Method Article
Akciğer Sağlığı ve Hastalığında Hava Yolu Bariyeri Bütünlüğünü Modellemek için iPSC'den Türetilmiş Epitelyal, Mezenkimal ve İmmün Hücre Ko-Kültürü
Bu Makalede
Özet
Bu makale, bir hava-sıvı arayüz kültüründe indüklenmiş pluripotent kök hücre (iPSC) türevi akciğer epiteli, mezenşim, endotel hücreleri ve makrofajlardan oluşan karmaşık, çok hücreli bir hava yolu bariyer modelinin oluşturulmasını açıklamaktadır.
Özet
İnsan akciğer dokusu, nazofarenksin üst solunum yolundan en küçük alveolar keseye kadar birbirine bağlı epitel, mezenşim, endotel ve bağışıklık hücreleri ağından oluşur. Bu hücreler arasındaki etkileşimler, akciğer gelişimi ve hastalığında çok önemlidir ve zararlı kimyasallara ve patojenlere karşı bir bariyer görevi görür. Mevcut in vitro ko-kültür modelleri, akciğerin hücresel ortamını veya etkileşimlerini doğru bir şekilde temsil etmeyebilen farklı biyolojik geçmişlere sahip ölümsüzleştirilmiş hücre dizilerini kullanır. İnsan iPSC'lerini 3D akciğer organoidleri (hem epitel hem de mezenşim içeren), endotel hücreleri ve makrofajlar olarak ayırdık. Bunlar, makrofajlar ve bir bazolateral endotel bariyeri (iAirway) ile yatırılan bir epitelyal / mezenkimal apikal bariyer oluşturmak için bir hava-sıvı arayüzü (ALI) formatında birlikte kültürlendi. iPSC'den türetilen iAirways, solunum yolu virüsleri ve sigara toksinleri ile enfeksiyona yanıt olarak bariyer bütünlüğünde bir azalma gösterdi. Bu çok soylu akciğer ko-kültür sistemi, akciğer gelişimi, homeostaz ve hastalığın ilerlemesinin altında yatan hücresel etkileşimleri, sinyal yollarını ve moleküler mekanizmaları incelemek için bir platform sağlar. iAirways, insan fizyolojisini ve hücresel etkileşimleri yakından taklit eder, hastadan türetilen iPSC'lerden üretilebilir ve hava yolunun farklı hücre tiplerini içerecek şekilde özelleştirilebilir. Genel olarak, iPSC'den türetilen iAirway modelleri, hastalık, patojen tepkisi, bağışıklık düzenlemesi ve in vitro ilaç keşfi veya yeniden kullanım için genetik itici güçleri daha iyi anlamak için bariyer bütünlüğünü incelemek için çok yönlü ve güçlü bir araç sunar ve hava yolu hastalıklarını anlamamızı ve tedavimizi ilerletme potansiyeline sahiptir.
Giriş
Büyük hava yollarındaki kan-hava bariyeri trakea, bronşlar ve bronşiyolleri içerir. Solunum sağlığının korunmasında çok önemli bir rol oynar ve hava yolu epiteli, bazal membran, kan damarları ve endotel hücreleri ve bağışıklık hücrelerinden oluşur. Hava yolundaki birincil epitel hücreleri, bazal hücreleri, kulüp hücrelerini, kirpikli hücreleri ve goblet hücrelerini kapsar. Hava yolu epitelinin kök hücreleri olarak görev yapan bazal hücreler, yüksek proliferatif ve kendini yenileme yeteneklerine sahip multipotent progenitörlerdir ve olgun hava yolu epitel hücrelerine yol açar1. Club hücreleri, koruyucu proteinler ve yüzey aktif maddeler salgılayarak hava yolu astarının korunmasına katkıda bulunan kirpikli olmayan, salgı hücreleridir2. Lümende ve submukozal bezlerde bulunan goblet hücreleri, döküntüleri yakalamak ve hava yolunu korumak için müsin salgılar3. Kirpikli hücreler, mukosiliyer yürüyen merdiven mekanizmasının ayrılmaz bir parçasıdır ve zararlı mikroorganizmaların birikmesini önler4. Bodrum membranı, yapısal destek sağlayan hücre dışı bir matristen oluşur5. Trakea ve hava yolunun geri kalanı, besin ve oksijen sağlayarak, atıkları uzaklaştırarak, iltihabı düzenleyerek ve doku onarımına ve anjiyogeneze katkıda bulunarak trakeal fonksiyonu desteklemede hayati bir rol oynayan endotel hücreleri ile kaplı zengin bir kan damarı ağı ile çevrilidir6. Son olarak, hava yolu makrofajları, solunum sistemini enfeksiyonlardan korumak, solunan partikülleri temizlemek ve dengeli bir bağışıklık tepkisini sürdürmek için gerekli olan dokuya özgü bağışıklık hücreleridir7.
Epitelyal, mezenkimal hücrelerin ve makrofaj hücrelerinin koordineli etkileri, hava yolundaki patojenlere karşı etkili bir bağışıklık tepkisi için kritik öneme sahiptir8. Epitel hücreleri, zararlı maddelerin geçişini kısıtlayan sıkı bağlantılarla fiziksel bir bariyer görevi görerek viral enfeksiyonlara karşı ilk savunma hattını oluşturur. Kirpikli hücrelerin ve goblet hücrelerinin koordineli etkisi, solunan partiküllerin, patojenlerin ve döküntülerin yakalanmasına ve uzaklaştırılmasınayardımcı olur 4. Ek olarak, hava yolu epitel hücreleri, bağışıklık hücrelerini işe almak için sitokinler ve kemokinler üretir9. Endotel hücreleri vasküler bütünlüğü korur, viral partiküllerin kan dolaşımı yoluyla yayılmasını önler, bağışıklık hücresi yapışmasını kolaylaştırmak için yapışma moleküllerini (VCAM-1) yukarı regüle eder ve bağışıklık hücrelerini kan dolaşımından enfeksiyon bölgesine toplamak için proinflamatuar sitokinler üretir10. Hava yolu makrofajları viral partikülleri, enfekte olmuş hücreleri ve kalıntıları yutar ve sindirir, T hücrelerine viral antijenler sunar ve viral replikasyonu inhibe etmek için tip I interferonlarla birlikte diğer bağışıklık hücrelerini aktive etmek ve işe almak için sitokinler üretir11. Epitelyal, mezenkimal ve makrofaj hücrelerinin koordineli etkileri, hava yolunu viral enfeksiyonlardan koruyan ve solunum sağlığını koruyan sağlam ve dinamik bir savunma sistemi oluşturur.
İnsan akciğerindeki çeşitli hücre tipleri arasındaki dinamik etkileşimleri anlamak, akciğerin viral enfeksiyonlara, enflamatuar hastalıklara ve ilaç dağıtımına verdiği yanıtı anlamak için çok önemlidir. İn vitro ko-kültürler, epitel, endotel hücreleri ve doğuştan gelen bağışıklık hücreleri arasındaki hücre-hücre sinyalizasyonunun incelenmesine izin verir12. Hastaya özgü hiPSC'lerden türetilen ilk otantik çok hücreli tip akciğer modelini geliştirdik13. Bu, 3 boyutlu bir oryantasyonda oluşturulan hem epitelyal hem de mezenkimal hücre popülasyonlarını içerir. Daha sonra, akciğer progenitör hücreleri bir "hava yolu organoidine" farklılaştırılabilir14, steril hücre kültürü ekleri üzerine kültürlenebilir ve insan hava yolunun koşullarını taklit eden bir hava-sıvı arayüzüne (ALI) maruz bırakılabilir 15,16,17. iPSC'den türetilmiş endotel hücreleri, bazal membrandaki epitelyal / mezenkimal tabakanın altında yer alan insan hava yolundaki yönelimlerini taklit ederek, zarın bazolateral tarafında kültürlenir. Son olarak, iPSC'den türetilmiş makrofajlar zarın apikal tarafına eklenir, epitel hücreleri ile etkileşime girer ve aktivasyon sinyallerini bekler (Şekil 1A). Bu model, hava yolunun biyolojisini ve işlevini doğru bir şekilde yeniden üretir. HiPSC'den türetilmiş, hastaya özgü, otantik çok hücreli tip iAirway kültürlerinin, viral enfeksiyonlar da dahil olmak üzere hava yolu bariyerinin ve patojenlerin içsel, akut yanıtını aydınlatmak için en uygun olduğunu varsayıyoruz. Örneğin, bu model (1) viral girişi ve replikasyonu incelemek, (2) epitelyal ve dokuya özgü bağışıklık hücrelerinin ilk bağışıklık tepkisini araştırmak, (3) bariyer bütünlüğünü ve işlevini incelemek, (4) terapötik ajanların etkinliğini test etmek ve (5) hastaya özgü bir modelde hücresel ve moleküler patogenez mekanizmalarını incelemek için kullanılabilir.
Bu makale, viral enfeksiyonlara hücresel yanıtları incelemek için çok hücreli akciğer ko-kültürlerinin hazırlanması için ayrıntılı bir protokolü açıklamaktadır.
Protokol
Bu çalışma protokolü, UCSD'nin İnsan Araştırmaları Koruma Programı (181180) Kurumsal İnceleme Kurulu tarafından onaylanmıştır. Bu protokol, pluripotent kök hücrelerin hava yolu hücrelerine, endotel hücrelerine ve makrofajlara farklılaşmasını yönlendirmek için küçük moleküller ve büyüme faktörleri kullanır. Bu hücreler daha sonra hücre kültürü ekleri üzerine birlikte kültürlenir ve bir hava-sıvı arayüzünde polarize edilir. Kullanılan reaktiflerin, sarf malzemelerinin ve ekipmanın ayrıntıları Malzeme Tablosunda listelenmiştir. Ortam ve tampon bileşimleri Ek Dosya 1'de verilmiştir.
1. iPSC'den türetilmiş hava yolu organoidlerinin üretimi (Gün 1 - 30)
NOT: Bu protokol, Leibel ve ark.13'te açıklanan metodolojiyi izleyerek iPSC'den türetilmiş hava yolu organoidleri oluşturmak için gereken adımları özetlemektedir (Şekil 1B). Süreç, kesin endodermin indüksiyonunu (1-3. günler), ön ön bağırsak endoderminin oluşumunu (4-6. günler) ve akciğer progenitörlerine farklılaşmayı (7-16. günler) içerir. Ayrıntılı metodoloji önceki yayındabulunabilir 13. Aşağıdaki adımlar, akciğer progenitörlerinden hava yolu organoidlerinin oluşumunu detaylandırmaktadır.
- ECM polimerinden akciğer progenitör sferoidlerinin çıkarılması ve ayrıştırılması (17. Gün)
- Hücre dışı matris (ECM) polimerini (8-9 mg / mL) buz üzerinde çözdürün.
- ECM'ye gömülü akciğer organoidlerinden vakum aspiratörü kullanarak harcanan ortamı aspire edin.
NOT: Sonraki aspirasyon adımları için, aksi belirtilmedikçe bir vakum aspiratörü kullanın. - Hücrelere 10 μM ROCK1 inhibitörü (ROCKi) ile takviye edilmiş 1 mL 2 U/mL dispas ekleyin ve ECM'deki akciğer progenitörlerini manuel olarak yeniden süspanse etmek için bir P1000 pipeti kullanın. 37 ° C'de 30 dakika inkübe edin, mekanik işleme yoluyla dispas ayrışma etkinliğini artırmak için karışımı her 15 dakikada bir yeniden süspanse edin.
- Kullanmadan 15 dakika önce, 45 mL oda sıcaklığındaki PBS'yi soğutmak için -20 °C'lik bir dondurucuya koyun. Sonraki adımlarda optimum ECM depolimerizasyonu için PBS'nin 4 °C'den daha soğuk olduğundan emin olun.
- 30 dakikalık dispas inkübasyonundan sonra, organoid ve dispase solüsyonunu 15 mL'lik konik bir tüpe aktarın.
- Plakadan kalan organoid ve ECM materyalini yıkamak ve toplamak için soğutulmuş PBS (1 mL proteaz başına 2 mL) ekleyin. Bir P1000 pipeti kullanarak organoidleri yeniden süspanse edin ve 5 dakika boyunca 400 x g'da santrifüjleyin.
NOT: Bu protokolde aksi belirtilmedikçe tüm santrifüj adımları oda sıcaklığında gerçekleştirilir. - Santrifüjlemeden sonra, organoidler içeren bulanık bir ECM peleti görünmelidir. ECM peletinden kaçınarak süpernatanı pipet ile dikkatlice aspire edin.
- Soğutulmuş PBS ile ikinci bir PBS yıkaması yapın, bir P1000 pipeti kullanarak yeniden süspanse edin ve 400 x g'da 5 dakika santrifüjleyin. Süpernatanı pipet ile aspire edin ve ~ 100 μL kalıntı çözelti bırakın.
- 15 mL konik tüpteki organoidlere 2 mL tripsin benzeri proteaz ekleyin. Bir P1000 pipeti kullanarak yeniden askıya alın. 37 ° C'de 10-12 dakika inkübe edin, karışımı inkübasyonun yarısında yeniden süspanse etmek için tüpü ters çevirin veya hafifçe vurun.
NOT: Organoidleri agrega olarak geçirmek için 10-12 dakika Tripsin benzeri proteaz ayrışması gerçekleştirin. - 12 dakika sonra, baz ortama 2 mL %2 FBS ekleyerek tripsin benzeri proteaz reaksiyonunu durdurun (Medyayı Durdurun, Ek Dosya 1'e bakın). Çözeltiyi bir P1000 pipeti ile tekrar süspanse edin ve 5 dakika boyunca 400 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve organoidleri 10 μM ROCKi ile desteklenmiş Stop Media'da yeniden süspanse edin. Bir hemositometre ve tripan mavisi kullanarak hücre sayımı için 10 μL'lik bir numune alın. Sayım sırasında organoidleri buz üzerinde tutun.
- Kuyu başına 100.000 hücre elde etmek için gereken hacmi hesaplayın. Aliquot hücresi 1.5 mL'lik bir mikrosantrifüj tüpüne toplanır ve 400 x g'da 5 dakika santrifüjlenir. 10 μL kalıntı ortam bırakarak fazla süpernatanı çıkarın.
- Hücre peletini 200 μL soğuk ECM polimeri içinde yeniden süspanse edin (kabarcıklardan kaçının ve erken polimerizasyonu önlemek için hızlı çalışın). 200 μL ECM ve hücre karışımını 12 oyuklu bir plakada her bir oyuğun dibine ekleyin. ECM'nin oda sıcaklığında biyogüvenlik kabininde 5 dakika boyunca kısmen polimerize olmasına izin verin.
- ECM polimerizasyonunu tamamlamak için plakayı 30-60 dakika boyunca 37 °C'lik bir inkübatöre aktarın. Ardından, 1.5 mL hava yolu organoid indüksiyon ortamı ekleyin (Ek Dosya 1).
- Ortamı 30. güne kadar 14 gün boyunca her gün değiştirin. Ortam 24 saat içinde sararırsa, hacmi 2 mL'ye yükseltin.
2. iPSC'den türetilmiş endotel hücrelerinin oluşturulması (Gün 1 - 14)
NOT: Aşağıdaki prosedür, Patsch ve ark.18'den uyarlanan iPSC'lerden (Şekil 1C) endotel hücrelerinin oluşumunu detaylandırmaktadır. Bu yöntem, plakaların hazırlanmasını, iPSC'lerin farklılaşmasını, endotel hücre indüksiyonunu, sıralamayı ve genişletmeyi içerir. Tablo 1, bu çalışmada kullanılan antikorları listeler.
- Endotel farklılaşması için iPSC'lerin kaplanması (Gün 0)
- HiPSC'ler %70-80 birleşime ulaştığında endotel hücre farklılaşmasına başlayın. Ayrışmadan bir saat önce her kuyucuğa 10 μM ROCKi Y-27632 ekleyin.
- Ortamı aspire edin, kuyucukları 1 mL PBS ile yıkayın, ardından 12 oyuklu bir plakanın oyuğuna 1 mL hücre ayırma çözeltisi ekleyerek iPSC'leri ayırın. 37 °C'de 20 dakika inkübe edin.
- Kuyucuklara 2 mL Stop Media ekleyerek hücre ayırma çözeltisini nötralize edin. Tek hücreli bir süspansiyon elde etmek için pipetleyin. Hücreleri 15 mL'lik bir konik tüpe aktarın ve 300 x g'da 5 dakika santrifüjleyin.
- Süpernatanı aspire edin, 10 μM ROCKi ile desteklenmiş iPSC kültür ortamında iPSC'leri yeniden süspanse edin ve bir hücre sayımı gerçekleştirin. 10 μM ROCKi ile 1 mL iPSC kültür ortamında ECM kaplı 12 oyuklu bir plakanın oyuklu başına 100.000 hiPSC plakası. Gece boyunca 37 °C'de inkübe edin.
NOT: iPSC-endotelyal farklılaşma için tohumlama yoğunluğu, hücre hattı başına optimizasyona ihtiyaç duyabilir. 6. Günde CD31 için akış sitometrisi kullanarak farklılaşma verimliliğini değerlendirin.
- Lateral mezoderm indüksiyonu (Gün 1-3)
- Kaplanmış iPSC'lerden iPSC kültür ortamını aspire edin ve oyuk başına 6 μM CHIR ve 25 ng/mL BMP4 ile desteklenmiş 3 mL N2B27 baz ortamı ekleyin (Ek Dosya 1). Ortamı hücrelere eklemeden önce ısıtın. Medyayı 3 gün boyunca değiştirmeyin.
- Endotel hücre indüksiyonu (Gün 4-5)
- 4. Günde, N2B27 ortamını aspire edin ve kuyucuk başına 200 ng / mL VEGF165 ve 2 μM forskolin ile desteklenmiş 2 mL endotelyal farklılaşma ortamı (EDM) ekleyin. 5. Günde medyayı değiştirin.
- Endotel hücresi sıralama ve yeniden kaplama (6. gün)
- 5. veya 6. günde, 100 μg / mL fibronektin çözeltisi yapmak için steril suda 1 mg fibronektini yeniden oluşturarak floresanla aktive edilen hücre sıralama (FACS) zenginleştirmesi için fibronektin kaplı bir T75 şişesi hazırlayın. T75 şişesini 6 mL fibronektin çözeltisi ile kaplayın ve oda sıcaklığında bir saat inkübe edin. Fibronektin solüsyonunu aspire edin ve steril su ile yıkayın. T75 şişesini oda sıcaklığında kurumaya bırakın. Yapılan ekstra şişeler 4 °C'de saklanabilir.
- Endotel bakım ortamını (EMM) hazırlayın18.
- 6. Günde, CD31 antikoru18 kullanarak iPSC'den türetilmiş endotel hücrelerini FACS yoluyla zenginleştirin.
- 37 ° C'de ayrışmadan bir saat önce her kuyucuğa 10 μM ROCKi Y-27632 ekleyin. Ortamı aspire edin ve PBS ile yıkayın. 12 oyuklu bir plakanın oyuğu başına 1 mL önceden ısıtılmış hücre ayırma çözeltisi ekleyin ve 37 ° C'de 8-10 dakika inkübe edin.
- Tek hücrenin ayrılmasını sağlamak için nazikçe pipetleyin. Hücreleri 15 mL'lik konik bir tüpe aktarın ve eşit hacimde Durdurma Ortamı ekleyin. 300 x g'da 5 dakika santrifüjleyin.
- Süpernatanı aspire edin ve endotel hücrelerini 10 μM ROCKi ile desteklenmiş 1 mL Stop Besinde yeniden süspanse edin. Filtreyi ıslatmak için önce 1 mL durdurma ortamı ekleyerek hücreleri 70μm filtreden geçirin, ardından hücreleri filtreden pipetleyin. Bir hemositometre ve tripan mavisi kullanarak hücre sayımı için 10 μL'lik bir numune alın. Sayım sırasında hücreleri buz üzerinde tutun.
- Hücre sayımı gerçekleştirin. Lekelenmemiş bir negatif kontrol olarak 200.000 hücreden oluşan bir alikot hazırlayın. Kalan hücreleri 1.5 mL'lik bir Eppendorf tüpüne aktarın ve 100 μL FACS tamponundaki her 1 milyon hücre için 10 μL CD31-APC ekleyin. 4 ° C'de bir döndürücü üzerinde 30 dakika inkübe edin.
- İnkübasyon tamamlandıktan sonra, Eppendorf tüpünü hücrelerle 300 x g'da 5 dakika santrifüjleyin, hücreleri 1 mL PBS ekleyerek yıkayın. Yıkama ve santrifüjleme adımını iki kez tekrarlayın. Süpernatanı yıkamalar arasında manuel olarak çıkarın.
- Hücre peletini, sıralamadan 5 dakika önce, canlılık boyama için 1 mL FACS tamponu ve 5 ug / mL DAPI çözeltisi içinde yeniden süspanse edin. Kurumsal yönergelere göre sıralayın.
- FACS'a göre sıralanmış hücreleri 2 mL EMM ile 15 mL'lik konik bir tüpte toplayın. 15 mL konik tüpü hücrelerle 300 x g'da 5 dakika santrifüjleyin. 10 μM ROCKi Y-27632 ve Penisilin Streptomisin (% 1) ile desteklenmiş 10 mL EMM'de süpernatanı aspire edin ve endotel hücrelerini yeniden askıya alın.
- Yeniden askıya alınmış FACS ile zenginleştirilmiş iPSC türevi endotel hücrelerini fibronektin kaplı şişeye aktarın. Hücreleri eşit olarak dağıtın ve gece boyunca 37 °C'lik bir inkübatöre yerleştirin.
NOT: T75 şişesi başına en az 500.000 hücre ve en fazla 2.000.000 hücre kullanın.
- Sıralanmış endotel hücrelerinin genişletilmesi ve dondurularak saklanması (7+ Gün)
- FACS zenginleştirmesinden sonra EMM ortamını her 2-3 günde bir değiştirin. T75 şişesi birleştiğinde (tohumlama yoğunluğuna bağlı olarak FACS'tan yaklaşık 7 gün sonra), iPSC'den türetilmiş endotel hücreleri ko-kültür için kullanılabilir veya gelecekteki uygulamalar için kriyoprezerve edilebilir.
- Hücre ayrışmasından önce 2x endotelyal dondurma solüsyonu hazırlayın (% 80 Endo-CM2,% 20 DMSO, 20 μM ROCKi).
- Kriyoviyal tüpleri etanol geçirmez bir kalemle ilgili bilgilerle etiketleyin. Hat kimliği, geçiş numarası, kültür ortamı, '6 kuyucuğuna çözdürün', donma tarihi.
- Sıralanmış iPSC'den türetilmiş endotel hücreleri birleştiğinde, ayrışmayı başlatın.
- T75 şişesini 5 ml PBS -/- ile yıkayın.
- iPSC'den türetilmiş endotel hücrelerini T75 başına 5 mL tripsin benzeri proteaz ile ayırın. Hücreleri 37 ° C'de 10 dakika inkübe edin, hücrelerin kalktığını doğrulamak için T75'i periyodik olarak kontrol edin.
- 5 mL Stop Media ekleyerek reaksiyonu nötralize edin. Çözelti içindeki 10 mL hücreyi 15 mL'lik tüpe aktarın. 300 x g'da 5 dakika santrifüjleyin.
- Süpernatanı aspire edin, E-CBM ortamında endotel hücrelerini yeniden askıya alın ve hematitometre ile sayım için 10 μL numune alın.
- Hücre sayımından sonra, 0.5 mL EGM2 ortamı başına 1 milyon hücre alikot.
NOT: Aşağıdaki adım zamana duyarlıdır. Hemen kullanılacak kriyoviyalleri ve dondurma kaplarını hazırlayın. - Endotel hücrelerine eşit hacimde 2x dondurma çözeltisi alikot. Nihai konsantrasyon %90 Endo-CM2, %10 DMO ve 10 μM ROCKi'dir (1 mL / 1 milyon hücre).
- Kapaklı şişeleri hemen bir dondurma odasına aktarın ve gece boyunca -80 °C'ye, ardından uzun süreli saklama için ertesi gün sıvı nitrojene (-180 °C) koyun.
3. iPSC'den türetilmiş makrofajların oluşumu (Gün 1 - 26)
NOT: Bu prosedür, van Wilgenburg ve ark.19 ve Pouyanfard et ark.20'den uyarlanan iPSC'lerden (Şekil 1D) makrofaj oluşturma adımlarını özetlemektedir. iPSC'lerin tek hücreli adaptasyonunu, embriyoid cisim farklılaşmasını, makrofaj progenitör oluşumunu ve makrofaj olgunlaşmasını kapsar.
- iPSC'lerin tek hücreli adaptasyonu
- iPSC'ler, görünür bir farklılaşma belirtisi olmadan ~% 70 -% 90 birleşmeye ulaştığında, tripsin benzeri proteaz ile tek hücreli geçişe başlayın.
- Kullanılmış ortamı aspire edin ve PBS ile durulayın. PBS'yi çıkarın ve tripsin benzeri proteaz ekleyin (6 oyuklu bir plakanın 1 mL/oyuğu, 12 oyuklu bir plakanın 500 μL/oyuğu). iPSC kolonileri plakadan ayrılana kadar 37 ° C'de 2-5 dakika inkübe edin.
- Tripsin benzeri proteazı eşit hacimde Stop Media (1 mL/6 oyuklu bir plaka, 500 μL/12 oyuklu bir plaka) ile nötralize edin. Hücreleri 5 dakika boyunca 200 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve hücreleri 10 μM ROCKi ile iPSC kültür ortamında nazikçe yeniden süspanse edin. Yeni ECM kaplamalı plakalara geçiş. Kriyoprezervasyon yapmadan veya tek hücreli uyarlanmış iPSC'leri kullanmadan önce 2-3 pasaj boyunca tekrarlayın.
NOT: Hücre sağlığına ve adaptasyonuna bağlı olarak geçiş oranını 1:2 ile 1:10 arasında ayarlayın. Ek olarak, en az üç tek hücreli geçişten geçmiş ve düşük geçişte olan iPSC'ler optimal makrofaj farklılaşmaları sağlar.
- Embriyoid vücut oluşumu (Gün 0-6)
- Tek hücreli uyarlanmış iPSC'ler ~% 75 birleşmeye ulaştığında, iPSC'leri adım 3.1-3.4'e göre tripsin benzeri proteaz ile geçiş.
- Hücreleri Durdurma Ortamında yeniden süspanse edin ve topakları çıkarmak için 70 μm'lik bir hücre süzgecinden 50 mL'lik yeni bir konik tüpe geçirin. Hücreleri yeniden askıya alın ve hematitometre ile hücre sayımı için 10 μL numune alın.
- Embriyoid cisimcik (EB) üretimi için, 96 oyuklu ultra düşük bağlanma (ULA) plakasının oyuğu başına 8.000-50.000 hücre kaplanır. 96 oyuklu bir ULA plakasının 60 kuyusunu tohumlamak için gereken toplam hücre sayısını hesaplayın.
NOT: iPSC'lerin tohumlama yoğunluğu, hücre hattı başına optimizasyon gerektirebilir. - iPSC'leri 15 mL konik olarak 200 x g'da 5 dakika santrifüjleyin. Süpernatanı aspire edin.
- 480.000 iPSC (60 kuyuda 8.000 hücre / kuyu) için, 6 mL (60 kuyuda 100 ul / kuyu) EB indüksiyon ortamında yeniden süspansiyon edin.
- Yuvarlak tabanlı 96 kuyulu bir ULA plakasının 36 dış kuyusuna 150 μL PBS ekleyin.
- EB ortamındaki iPSC'leri yeniden askıya alın ve bir ortam kanalına aktarın. Çok kanallı bir pipet kullanarak, 96 oyuklu ULA plakasının ortadaki 60 oyuğuna 100 μL/oyuklu hücre süspansiyonu ekleyin. Hücrelerin eşit dağılımını sağlamak için EB ortamındaki iPSC'leri aralıklı olarak yeniden askıya alın.
- 96 oyuklu plakayı 300 x g'da 4 ° C'de 5 dakika boyunca santrifüjleyin (varsa). Plakaları 37 °C'lik bir inkübatöre aktarın.
- 48-72 saat sonra, ortamın 50 μL'sini değiştirin (yarım ortam değişimi). 6 gün sonra kist oluşumunu kontrol edin.
NOT: Bazı iPSC hatları, EB'leri diğerlerinden daha erken veya daha kolay oluşturur. EB oluşumunu izleyin ve EB'lerin uygun zaman noktasında transfer edildiğinden emin olun (kist geliştiriyor olmalıdırlar).
- Makrofaj progenitör oluşumu için jelatin kaplama ve EB transferi (Gün 6-19)
- İki adet %0.1 jelatin kaplı 6 oyuklu plaka hazırlayın. Oyuk başına 1 mL %0.1 jelatin ekleyin ve oda sıcaklığında 20 dakika inkübe edin. Jelatin çözeltisini aspire edin ve plakaların davlumbazda 30-60 dakika kurumasını bekleyin.
- EB'leri 96 oyuklu plakadan 2 mL serolojik pipet kullanarak jelatin kaplı 6 oyuklu plakalara aktarın. 6 oyuklu jelatin kaplı bir plakanın oyuğu başına yaklaşık 8-10 EB dağıtın.
- Kullanılan artık EB ortamını aktarımdan dikkatlice çıkarın. Kuyucuk başına 2 mL makrofaj kültür ortamı 1 (Mac-CM1) ekleyin. EB'leri 37 ° C'de% 5 CO2 ile 5-7 gün boyunca rahatsız edilmeden inkübe edin.
NOT: İdeal olarak, 96 oyuklu bir embriyoid cisim plakası, iki adet 6 oyuklu plakaya bölünebilir. EB'ler zayıf bir şekilde geliştirilmişse, 6 oyuklu plaka başına aktarılan EB sayısı, iPSC'den embriyoid-vücut farklılaşma adımını optimize etmek için ayarlanabilir.
- Makrofaj progenitör üretimi
- Ortamın 2 / 3'ünü haftada iki kez değiştirin ve ortam rengi değişirse sesi 3 mL'ye çıkarın.
- Makrofaj progenitör hasadı için hazır olup olmadıklarını belirlemek için 8-19. günler arasındaki kültürleri kontrol edin. EB'ler ayrılırsa, EB'leri Mac-CM1 ile yeni kaplanmış bir plakaya aktarın ve 7 gün boyunca rahatsız edilmeden inkübe edin.
NOT: Makrofaj progenitör oluşturan kompleksin bakımı, makrofaj progenitörlerinin gelişimi ve sürekli üretimi için hayati önem taşır. Optimize edilmiş makrofaj progenitör oluşturan kompleksler, 2-6+ ay boyunca sürekli olarak miyeloid progenitörler üretecektir.
- Miyeloid progenitörlerin toplanması (19-26+ Gün)
- Süspansiyonda makrofaj progenitör hücreleri olduğunda, ortamı hücrelerle toplayın ve 50 mL'lik konik bir tüpe aktarın. 200 x g'da 5 dakika santrifüjleyin ve süpernatanı dikkatlice çıkarın.
- Makrofaj progenitörlerini Mac-CM2'de yeniden süspanse edin ve işlenmemiş bir steril kültür kabına/şişesine aktarın. 37 ° C'de% 5 CO2 ile 3-4 gün inkübe edin.
NOT: Hasat edilen hücre sayısına bağlı olarak, 10 cm'lik bir Petri kabına (6 oyuklu bir plakanın 3-4 oyuğu), T25 şişesine (6 oyuklu bir plakanın 1-2 oyuğu) veya T75 şişesine (tam 6 oyuklu plaka) uygun hacimde ortam ile. Bir T25 şişesi için 5-6 mL ortam, bir Petri kabında 10-12 mL ortam ve bir T75 şişesi için 12-15 mL ortam kullanın. Sonraki hasatlar için, miyeloid progenitörler ve makrofaj hücreleri, aynı hattan / miyeloid oluşturan komplekslerden iseler, önceki hasatlardan toplanabilir. Şişenin/şişelerdeki hücre sayısını korumak ve beslemek için yeterli olduğundan emin olun. Makrofajlar çoğalmaz; Makrofaj progenitörlerinden üretilirler. Makrofajlar, ekspresyon belirteçlerini kaybetmeden 2-6 hafta boyunca toplanabilir ve korunabilir.
- Makrofajların toplanması
NOT: Mac-CM2 ortamında 14 günlük makrofaj farklılaşmasından sonra, makrofaj kültürleri ko-kültür veya akış sitometrisi analizi için hazırdır.- Kullanılmış ortamı toplayın ve 50 mL'lik konik bir tüpe aktarın. Kalan ortamı ve hücreleri çıkarmak için şişeyi/plakayı PBS ile durulayın.
- Şişeye baz ortamı ekleyin (T25 için 3 mL ve T75 için 5 mL) ve şişenin/plakanın altından hücreleri ayırmak için steril bir hücre sıyırıcı kullanın. Hücreleri konik bir tüpe aktarın ve gerekirse kazıma işlemini tekrarlayın.
- Oda sıcaklığında 5 dakika boyunca 200 x g'da santrifüjleyin. Süpernatanı dikkatlice çıkarın ve daha fazla kullanım için hücreleri uygun ortamda veya tamponda yeniden süspanse edin.
4. Hava yolu hücrelerinin, endotel hücrelerinin ve makrofajların ko-kültürü
NOT: Bu prosedür, Costa ve ark.12'den uyarlanan hücre kültürü ekleri kullanılarak hava yolu hücrelerinin, endotel hücrelerinin ve makrofajların (Şekil 1A) ko-kültürü için adımları açıklar.
- Ko-kültür için hücre kültürü eklerinin ECM kaplaması (Ko-kültürün 0. günü)
- 3.0 μm gözenekli polyester (PET) hücre kültürü eklerini 4 mg/mL ECM çözeltisi ile kaplayın. Hücre kültürü eklerinin apikal tarafını plakanın içine 4 mg / mL ECM çözeltisi ile kısaca kaplayın. Artık ECM solüsyonunu pipetleyin. Plakayı 37 °C'de 1 saat inkübatöre yerleştirin.
- Büyük bir Petri kabı (100 mm x 20 mm veya 150 mm x 20 mm) edinin. Temiz cımbızla, hücre kültürü eklerini 12 oyuklu plakadan büyük Petri kabına steril bir şekilde aktarın. Uçları ters çevirin, böylece bazolateral taraf dik olur.
- Bazolateral tarafı 4 mg / mL ECM çözeltisi ile kaplayın. Artık ECM solüsyonunu pipetleyin. ECM kaplı hücre kültürü eklerine sahip Petri kabını, gece boyunca kuruması için 37 °C'lik bir inkübatöre yerleştirin.
- iPSC'den türetilmiş endotel hücrelerinin ayrışması ve kaplanması (ko-kültürün 1. günü)
- T75 şişesini PBS ve aspirat solüsyonu ile yıkayın. T75 şişesine 5 mL tripsin benzeri proteaz ekleyin ve 37 °C'de 8 dakika inkübe edin. Endotel hücrelerinin şişeden kalktığını görsel olarak değerlendirin.
NOT: iPSC'den türetilen endotel hücreleri şişeden kaldırılmamışsa, typsin benzeri proteaz ayrışma süresini artırın. - Endotel hücrelerinin ayrılmasını sağlamak ve hücreleri 15 mL'lik bir koni içine aktarmak için şişeye dokunun. Ayrışmayı durdurmak için 5 mL Stop Media ekleyin. Hücreleri 5 dakika boyunca 300 x g'da santrifüjleyin.
- Süpernatan aspirat edin ve hücre peletini 10 μM ROCKi ile 1 mL endotel kültür ortamında yeniden süspanse edin. Hücre sayımı için 10 μL yeniden süspanse çözelti elde edin ve sayım sırasında hücreleri buzun üzerine yerleştirin.
- 100 μL endotel kültürü ortamında 12 mm hücre kültürü eki başına 150.000 iPSC-endotel hücresi kullanın. Ekleme başına istenen hücre sayısına ulaşmak için ilgili ortam sesini ayarlayın.
- İnkübatörden ECM kaplı 3.0 μm hücre kültürü eklerine sahip bir Petri kabı alın (bkz. adım 4.1-4.3).
- iPSC-endotel hücrelerini yeniden askıya alın ve 150.000 hücreli 100 μL'yi ters hücre kültürü ekine (bazolateral taraf yukarı bakacak şekilde) pipetleyin. Hazırlanan hücre kültürü eklerinin her biri için pipetlemeyi tekrarlayın
- Hücreleri dikkatlice inkübatöre aktarın ve 3 saat boyunca rahatsız edilmeden bırakın.
- 12 oyuklu bir plakada, her oyuklu alana 1 mL endotel kültürü ortamı ekleyin (hazırlanan ilgili hücre kültürü eklerinin sayısı için).
- Endotel hücreli Petri kabını inkübatörden çıkarın. Temiz cımbız kullanarak, hücre kültürü eklerini endotel kültür ortamı ile plakaya dikkatlice aktarın (ek parçayı, alt kısmı şimdi ortama bakacak şekilde çevirin).
- Endotel hücrelerinin yapıştığını mikroskopta görsel olarak doğrulayın. Plakayı gece boyunca 37 °C'lik bir inkübatöre yerleştirin.
- T75 şişesini PBS ve aspirat solüsyonu ile yıkayın. T75 şişesine 5 mL tripsin benzeri proteaz ekleyin ve 37 °C'de 8 dakika inkübe edin. Endotel hücrelerinin şişeden kalktığını görsel olarak değerlendirin.
- iPSC'den türetilmiş hava yolu organoidlerinin ayrışması ve kaplanması (ko-kültürün 2. günü)
NOT: ECM polimerinden hava yolu organoidlerinin izolasyonu için 1.1.1-1.1.15 adımlarına bakın. Tek hücreli süspansiyon elde etmek için tripsin benzeri proteaz (adım 1.1.10) ayrışma süresini 15-20 dakika olarak değiştirin.- 15-20 dakika sonra, 3 mL Stop Media ekleyerek tripsin benzeri proteaz reaksiyonunu durdurun. Çözeltiyi bir P1000 pipeti ile tekrar süspanse edin ve 5 dakika boyunca 400 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve hava yolu organoidlerini 10 μM ROCKi ile 1 mL hava yolu genişletme ortamında yeniden süspanse edin. Bir hematitometre hücre sayımı için 10 μL'lik bir numune alın ve sayım sırasında hücreleri buzun üzerine yerleştirin.
- 12 mm hücre kültürü eki başına 500 μL hava yolu genişletme ortamında 300.000 iPSC-hava yolu hücresi tohumlayın. Hazırlanan ek parça başına istenen hücre sayısına ulaşmak için ilgili ortam sesini ayarlayın.
- 37 ° C inkübatörden endotel hücreli (bazolateral tarafa tohumlanmış) hücre kültürü ekleri olan plakayı çıkarın.
- iPSC-hava yolu hücrelerini yeniden askıya alın ve 300.000 hücreli 500 μL'yi her hücre kültürü ekinin apikal odasına pipetleyin. Plakayı, apikal hücreler sıvı-sıvı koşullarında olacak şekilde 48 saat boyunca 37 ° C'lik bir inkübatöre yerleştirin.
- Hava kaldırma ortak kültürü (Ortak kültürün 4. günü)
- Hücre kültürü ekinin apikal tarafından ortamı çıkarın. Bazolateral medyayı 1: 1 hava yolu farklılaşma medyası ve endotel kültür medyası olarak değiştirin. Plakayı inkübatöre geri koyun.
- iPSC'den türetilmiş makrofajların ayrışması ve kaplanması (ko-kültürün 5. günü)
- iPSC'den türetilen makrofajları bir hücre sıyırıcı kullanarak şişeden ayırın (bkz. adım 3.22-3.24). 5 dakika boyunca 300 x g'da santrifüjleyin ve süpernatanı aspire edin.
- iPSC-makrofajları 1 mL Mac-CM2'de yeniden süspanse edin. Hücre sayımı için 10 μL'lik bir numune alın ve sayım sırasında hücreleri buzun üzerine yerleştirin. Makrofajların sayısı, ekilen hava yolu hücrelerinin sayısını yansıtacaktır (makrofajların hava yolu hücrelerine oranı 1: 1).
- Hücre sayımından sonra, hazırlanan hücre kültürü oyuğu başına 35 μL ortamda 300.000 makrofaj alikot, 1.5 mL'lik bir mikrosantrifüj tüpüne yerleştirilir. 5 dakika boyunca 200 x g'da santrifüjleyin.
- Santrifüjlemeden sonra, süpernatanı pipetleyin. İlgili Mac-CM2'deki makrofajları hesaplamalardan yeniden askıya alın.
- Endotel ve hava yolu hücrelerinin ko-kültürlerini içeren ekleri inkübatörden çıkarın. 35 μL Mac-CM2'de 300.000 makrofajı hücre kültürü ekinin apikal tarafına tohumlayın. Plakayı 48 saat boyunca 37 ° C'lik bir inkübatöre yerleştirin.
NOT: iPSC-bağışıklık hücrelerinin hücre kültürü ekine yapıştığını doğrulamak için, hücreler bir floresan prob ile etiketlenebilir. Makrofaj kaplamasından 48 saat sonra floresan sinyali için mikroskopi ile yapışmayı onaylayın.
- Üçlü ko-kültür (Ko-kültürün 7. günü)
- Ko-kültürün enfeksiyon çalışmaları, transepitelyal elektrik direnci (TEER) ölçümleri ve bariyer bütünlüğü deneyleri gibi aşağı akış uygulamaları için hazır olduğundan emin olun.
Sonuçlar
iPSC'den türetilmiş hava yolu organoidlerinin, endotel hücrelerinin, bağışıklık hücrelerinin ve ko-kültürlerin farklılaşmasının başarıyla tamamlandığı olarak değerlendirilebileceği birden fazla aşama vardır. Farklılaşmalar farklı iPSC hatlarında gerçekleştirilebilir ve bu protokol en az beş farklı hatta test edilmiştir. Protokolün, özellikle tohumlama yoğunluğunu değiştirerek ve optimize ederek her yeni iPSC hattına uyarlanması gerekir.
iPSC'den türetilmiş hava yolu organoidlerinin başarılı verimi, parlak alan aracılığıyla değerlendirilebilir ve dört özelliğe sahip olacaktır: tanımlanmış sınırlar / kenarlar, yarı saydam / kistik morfoloji, çoğalma / genişleme yeteneği ve nekrotik hücrelerin eksikliği. Bulanık görünen hava yolu organoidleri, kültürün 2 haftası boyunca boyut olarak artmaz ve nekrozlu ko-kültür deneyleri için kullanılmamalıdır. Çevresinde kalın bir luminal tabaka bulunan organoidler vs. Yarı saydam / kistik organoidler sonraki deneyler için hala kullanılabilir. Bununla birlikte, yarı saydam/kistik hava yolu organoidleri ağırlıklı olarak bazal hücrelerden oluşurken, kalın çift zarlı organoidler ağırlıklı olarak kulüp hücrelerinden oluşur. Bazal hücreler kolayca çoğalıp genişlediğinden, hava-sıvı interfaz kültürü ve polarizasyon için daha uygundurlar. iPSC'den türetilmiş akciğer organoidlerinin başarılı verimini değerlendirmek için diğer yöntemler, başarılı bir farklılaşma verimi olan yüzey marker CPM (Tablo 1) için akciğer progenitör aşamasında (farklılaşmanın 16. günü) akış-sitometri analizidir >% 50 CPM + hücreleri.
Hava yolu organoid ayrışması ve hava-sıvı interfaz kültürü için, ECM polimerinin tamamının çıkarıldığından emin olun, aksi takdirde hücrelerin zar üzerinde genişlemesini önleyecektir. Hücreler, hava kaldırmadan önce kültürün 3. gününe kadar birleşmelidir. iAirways'deki hücre tiplerinin doğrulanması, ilgili hücre tipine özgü belirteçler için boyama ile değerlendirilebilir: bazal hücreler (p63+), kulüp hücreleri (SCGB1A1+), goblet hücreleri (MUC5AC+) ve kirpikli hücreler (AcTub+). Karakterizasyon ve ayırt edici akciğer hücresi tipine özgü belirteçler LungMAP21'de doğrulanmıştır. Mezenşim, vimentin veya düz kas aktinine karşı antikorlarla tespit edilebilir. Daha fazla kirpikli hücre oluşturmak için, kültürler daha uzun bir süre hava kaldırma veya DAPT ilavesi gerektirebilir.
iPSC'den türetilmiş endotel hücrelerinin başarılı verimi, parke taşı benzeri bir morfoloji gösteren parlak alan aracılığıyla değerlendirilebilir (iPSC'den türetilmiş endotel farklılaşmasının 6. günü). Başarılı bir iPSC'den türetilmiş endotel kültürü% >50 CD31 + hücre içerecektir ve sıralamadan sonra verim 500.000 hücreden fazla olacak şekilde yeterli hücre üretilmelidir. Hücreler pasajlı veya kriyoprezerve edilebilir ve CD31 markörü her pasaj veya yeni kültür ile akış yoluyla test edilmelidir. Hücreler P4'ün ötesine geçirilmemelidir. Referans için, CD31 sıralaması öncesi / sonrası iPSC'den türetilmiş endotel hücrelerine bakınız (Şekil 1C). Endotel hücreleri, uzun ve iğ şeklinde morfolojiye sahip büyük bir hücre gövdesi ile düz olacaktır.
Makrofaj farklılaşması için, embriyoid cisimleri ULA kuyusunun dibinde kalmalı ve her kuyucukta sadece bir EB bulunmalıdır. 5-7. güne kadar kistik değişiklikler göstermelidirler. Santrifüjlemeden sonra bir EB oluşturmazlarsa, iPSC'leri döndürmeden 96 oyuklu ULA plakasına tohumlayın. iPSC'lerin sayısının artırılması gerekli olabilir. iPSC'den türetilmiş bağışıklık hücrelerinin başarılı verimi, tamamen embriyoid cisimciklerinin (EB'ler) kistlere dönüşme yeteneğine bağlıdır (farklılaşmanın 7. günü). Kist geliştirmeyen iPSC'den türetilmiş immün EB'ler, jelatin üzerine kaplandığında stroma oluşturmayacak ve miyeloid progenitörler üretmeyecektir. Jelatin kaplı plakaya aktarıldıktan sonra, EB'ler plakanın dibine bağlı kalmalıdır. Plakanın hareketi, onları yerinden çıkarmamak için dikkatlice yapılmalıdır. Plakalar haftada iki kez manuel olarak değiştirilmeli ve askıya alınan hücreler Mac-CM2'ye geçirilmeli veya kriyoprezervasyonla saklanmalıdır. Ek olarak, askıya alınmış miyeloid progenitörleri hasat ettikten sonra, kaplanmamış plastik şişeye yapışmalı ve makrofajları gösteren vakuollerle parlak alan altında parlak hücreler oluşturmalıdırlar. Monositler için belirteç olan CD14+, askıda kalan hücrelerde %>90 olmalıdır. Makrofaj belirteci, CD68, zamanla artmalıdır ve makrofajların ~% 50'si 2 hafta sonra CD68 + eksprese eder (Şekil 1D). Her hücre hattı için yapışma verimliliği belirlenmelidir. Ortalama %20 yapışma verimliliği elde ediyoruz. Polarizasyon için, M0 makrofajları, farklı uyaranlarla desteklenen farklılaşma ortamı II'de 48 saat boyunca M1 (iPSC-M1) veya M2 (iPSC-M2) makrofajlarına polarize edilir: M1 polarizasyonu için 100 ng/mL LPS ve 20 ng/mL IFN-g veya M2 polarizasyonu için 50 ng/mL IL-4 ve 20 ng/mL IL-13. M1 polarizasyonu için belirteç CD80+'dır ve M2 polarizasyonu CD206+'dır.
Üçlü ko-kültürün başarılı bir şekilde oluşturulması, epitelyal sıkı bağlantı belirteçleri EPCAM, ECAD veya ZO-1 veya endotelyal sıkı bağlantı belirteci CD31 için immünofloresan yoluyla değerlendirilebilir (Şekil 2C, Tablo 1). Üçlü ko-kültürün işlevselliği, trans-elektriksel epitelyal / endotelyal direnç (TEER) ile de değerlendirilebilir. İyi monte edilmiş hava yolu organoid ve endotelyal ko-kültürleri, optimal hücre iletişimini ve bağlantısını gösteren daha büyük bir elektrik direncine sahip olacaktır. E-sigaralar veya viral meydan okuma gibi çevresel hakaretler, epitel ve endotel bariyerinin bütünlüğünü tehlikeye atacak ve ko-kültürün elektrik direncinin azalmasına (Şekil 3A,B) ve düzensiz sıkı bağlantılara (Şekil 3C) neden olacaktır.

Şekil 1: iPSC'den türetilmiş hava yolu epiteli, endotel ve immün kültürlerin farklılaşması ve karakterizasyonu. (A) iAirway'in montajı için iPSC'ye yönelik farklılaşmaların şeması. (B) EPCAM ve ECAD için parlak alan (solda) ve akış sitometrisi analizi (sağda) ile karakterize iPSC'den türetilmiş hava yolu epitel organoidleri. (C) CD31 için parlak alan (solda), immünofloresan ve akış sitometrisi analizi (sağda) ile karakterize iPSC'den türetilmiş hava yolu endotelyumu. CD31 sıralamasından sonraki ilgili parlak alan sağda gösterilmiştir. (D) iPSC'den türetilmiş makrofajlar, pan hematopoietik belirteç CD45, monosit yapıcı CD14 ve makrofaj belirteç CD68 için parlak alan (solda) ve akış sitometrisi analizi (sağda) ile karakterize edilir. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
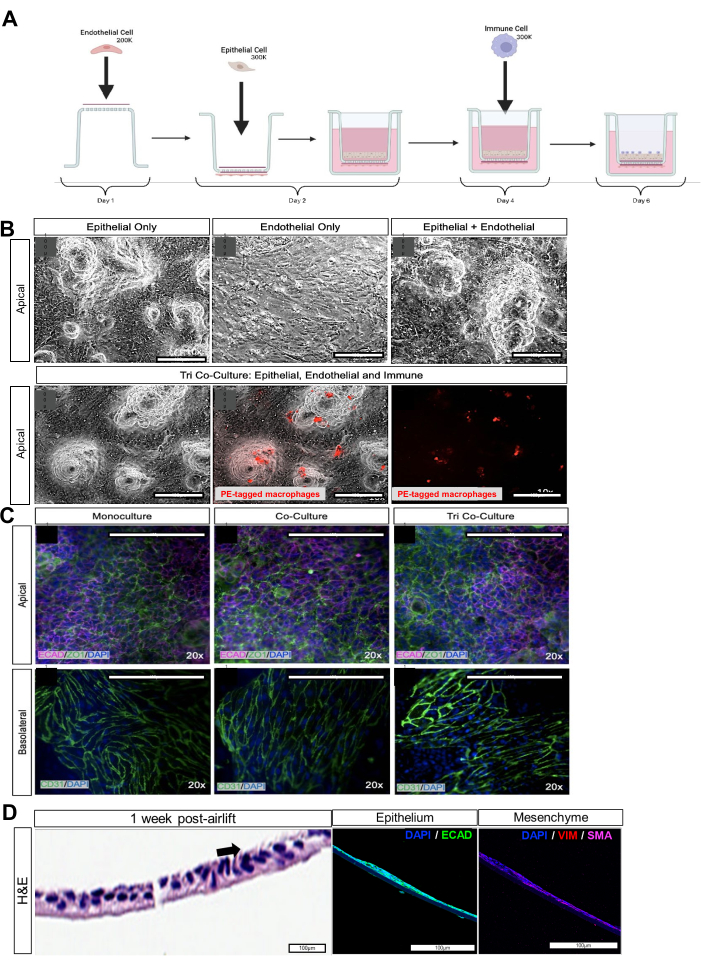
Şekil 2: iPSC'den türetilmiş epitelyal, mezenkimal ve makrofaj hücrelerinin ko-kültürü. (A) iAirway montajının şeması. (B) İlgili epitelyal ve endotelyal monokültürün, epitelyal ve endotelyal bi-kültürün ve epitelyal, endotelyal ve makrofaj ko-kültürünün parlak alan görüntüleri. Kırmızı sitotracker ile etiketlenmiş makrofajlar. Ölçek çubukları: 100 μm. (C) Hücre kültürü ekinin apikal tarafında sıkı bağlantı markörü ZO-1 ve bazolateral tarafta CD31 için immünofloresan boyama. Ölçek çubukları: 100 μm. (D) Apikal tarafta ayrışmış hava yolu organoidleri ile hücre kültürü ekinin kesiti, hava asansöründen 1 hafta sonra. Siyah okla H&E boyamalı sol panel, kirpikli hücreleri gösterir. İmmünofloresan görüntüleme ile orta panel, epitel belirteci E-kaderin'i (ECAD) gösterir. İmmünofloresan görüntüleme ile sağ panel, vimentin (VIM) ve düz kas aktini (SMA) gibi mezenkimal belirteçleri gösterir. Ölçek çubukları: 100 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
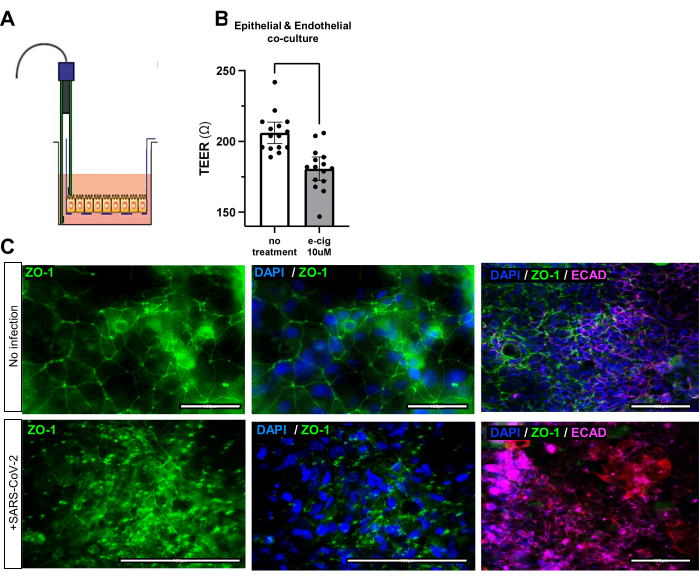
Şekil 3: E-sigara ve virüslere maruz kalan iAirways'in hava yolu bariyer fonksiyonundaki değişiklikler. (A) Trans-elektrik epitelyal/endotelyal direnç (TEER) ölçüm aracının şeması. (B) Ortama mentollü e-sigara ilavesinden 7 gün sonra TEER'in çubuk grafiği. Ortalama +/- %95 güven aralığı. N = 5 biyolojik kopya ve 3 teknik kopya; p değeri <0.001. (C) SARS-CoV-2 ile enfeksiyondan önce ve sonra sıkı bağlantı proteini ZO-1 için immünofloresan boyama. Enfeksiyon sonrası ZO-1'in düzensiz düzenine dikkat edin. Ölçek çubukları: 50 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Antikor | Uygulama | Seyreltme |
| CD 31 PECAM-1 (APC) | akış sitometrisi (FC) | 100 ul tamponda 10 μL |
| EPCAM/CD 326 (APC) | FC | 1:500 |
| E-CAD/CD 324 (APC) | FC | 100 ul tamponda 5 μL |
| BGBM | FC | 1:200 |
| CD 45 (PE) | FC | 100 ul tamponda 5 μL |
| CD 14 (FITC) | FC | 100 ul tamponda 5 μL |
| CD 68 (PE) | FC | 100 ul tamponda 5 μL |
| ZO-1 (İngilizce) | İmmünofloresan (IF) | 1:300 |
| Şaraplar | EĞER | 1:200 |
| SMA | EĞER | 1:100 |
Tablo 1: FACS ve İmmünofloresanda kullanılan antikorlar.
Ek Dosya 1: Ortam ve tampon bileşimleri. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Viral enfeksiyonları ve diğer toksinleri incelemek için büyük hava yollarında kan-hava bariyeri modelinin geliştirilmesi ve uygulanması, ilgili çeşitli hücre tiplerinin başarılı bir şekilde farklılaşmasını ve işlevini sağlamak için ayrıntılara titiz bir dikkat gerektirir. Bu tartışma, başarılı farklılaşma için temel faktörleri, potansiyel zorlukları, alternatif uygulamaları ve insan hastalıklarını incelemek için çıkarımları ele alacaktır.
Başarılı bir farklılaşma sağlamak için, hücre kültürü ekinin tipine ve gözenek boyutuna dikkat etmek önemlidir. ECM katmanları boyunca hücre-hücre iletişimini sağlamak için geniş gözenekler kullanılmalıdır. İndüklenmiş pluripotent kök hücre (iPSC) hatları için optimum tohumlama yoğunluğunun sağlanması kritik öneme sahiptir. Uygun yoğunluk, homojen farklılaşmayı kolaylaştırır ve istenmeyen hücre kümelerinin oluşumunu önleyerek daha homojen ve fonksiyonel bir epitel tabakasına yol açar. Sağlıklı ve fonksiyonel bir epitel tabakasını korumak için, herhangi bir bileşik, toksin veya virüs eklemeden önce apikal yüzeyi yıkamak önemlidir. Bu, biriken mukusun, ölü hücrelerin ve diğer kalıntıların uzaklaştırılmasına yardımcı olur, böylece stabil ve canlı bir kültür ortamını teşvik eder ve epitel hücrelerine erişime izin verir.
Endotel bileşeni için, hücrelerin uygun şekilde sıralandığından ve homojen olduğundan emin olmak esastır. Bu, yalnızca istenen endotel hücrelerinin kullanılmasını sağlayan, böylece tutarlılığı ve işlevi koruyan FACS gibi tekniklerle başarılabilir.
Makrofaj bileşeni için, plastiğe kolayca yapışmasına rağmen, makrofajlar apikal epitel hücrelerine iyi yapışmazlar. Makrofaj sayısını artırmak, iAirways'de büyük bir makrofaj popülasyonu sağlamak için faydalı olabilir. Yapışık makrofajlar, patojenler ve diğer bağışıklık hücreleri ile etkileşime girmek için daha iyi konumlandırılmıştır, böylece modelin alaka düzeyini arttırır. Endotelyal immün sinyalleme çalışması tercih edilirse, makrofajlar, dolaşımdaki monosit popülasyonunu taklit etmek için ortamdaki hücre kültürü eklerinin bazolateral tarafına tohumlanabilir22.
iAirway modelinin, hava yolunun akciğer gelişiminin incelenmesi de dahil olmak üzere başka önemli uygulamaları vardır. Model, farklı hücre popülasyonları arasında çok hücreli sinyalleşmeyi içeren, normal ve patolojik durumlar hakkında bilgi sağlayan akciğer gelişiminde yer alan karmaşık süreçleri incelemek için kullanılabilir. Alveolar gelişimi ve hastalığı incelemek için, hava yolu organoidleri distal akciğer organoidleri (DLO'lar) ile ikame edilebilir23,24 Bu, araştırmacıların alveolar gelişim ve fonksiyon dahil olmak üzere distal akciğeri incelemesine olanak tanır. Bu, özellikle akciğer bağışıklığında önemli bir rol oynayan alveolar makrofajların üretilmesi ve incelenmesi için yararlıdır.
Büyük hava yollarında kan-hava bariyerinin güvenilir ve tekrarlanabilir bir modelini geliştirmek çeşitli zorluklarla birlikte gelir. Akciğer progenitör hücreleri, başarılı bir farklılaşma için %50'den fazla NKX2-1 eksprese etmelidir. Verime ulaşılmazsa, ALI kültürleri daha fazla mezenşim barındırabilir veya akciğer dışı epitel hücreleri ile kontamine olabilir. Endotel hücrelerinin kaplanması sırasında sterilitenin korunması, hücre kültürü ekinin bazolateral tarafında kültürlendikleri için önemli bir zorluktur. Bu, plak kapağının steril ortamı kapatmasını önler, bu nedenle endotel hücrelerinin tohumlanması sırasında başka plakların kullanılması gerekir. Kirleticiler kültürü bozabilir ve modelin bütünlüğünü tehlikeye atabilir. Çoğu ALI kültürü, kirpikli hücreler de dahil olmak üzere hava yolu hücrelerinin çoğunu oluşturmak için en az 3 hafta inkübe edilir. Çoğu protokol bazal hücreleri tohumlar ve bu nedenle sinyal mekanizmalarının diğer hava yolu hücrelerini ayırt etmesi için zaman tanımalıdır. Mevcut protokol, olgun HBEC'den türetilmiş ALI'ye kıyasla daha düşük miktarlarda da olsa, halihazırda birçok hava yolu hücresini içeren hava yolu organoidlerini ayrıştırır. Epitelyal ve mezenkimal hücre tipleri ile birlikte az sayıda siliyer hücre görülür (Şekil 2D). Daha fazla kirpikli hücre oluşturmak için, DAPT hava yolu organoid kültürlerine ve / veya ALI ortamınaeklenebilir 25. Bu platform aynı zamanda, bazolateral medya 1: 1 epitel ve endotel ortamına değiştirildiğinde, hava asansöründen sonra apikal ve bazolateral hücrelerin kısa vadeli canlılığını test etmiştir. Canlılığı haftalar boyunca test etmek için daha fazla araştırma yapılması gerekiyor, bu da ALI'deki hücrelerin karmaşıklığını artırabilir.
Kan-hava bariyeri modeli, insan hastalıklarını incelemek ve terapötik müdahaleler geliştirmek için derin etkilere sahiptir. Model, özellikle hava yolu hücrelerinin havaya maruz kalmasıyla insan hava yollarını taklit eden fizyolojik olarak ilgili bir ortam sağlayarak, antiviral ilaçlar da dahil olmak üzere terapötik ajanları taramak ve optimize etmek için kullanılabilir. Gen nakavt teknikleri, bariyer disfonksiyonunun ve konakçı-patojen etkileşimlerinin spesifik mekanizmalarını incelemek için kullanılabilir. Model, viral enfeksiyonlardan astım ve KOAH gibi kronik durumlara kadar insan solunum yolu hastalıklarının çeşitli yönlerini incelemek için bir platform sunuyor. Bu anlayış, daha etkili ve hedefe yönelik tedavilerin geliştirilmesine yol açabilir.
Sonuç olarak, büyük hava yolunun (iAirway) kan-hava bariyeri modeli, viral enfeksiyonlar ve diğer solunum yolu hastalıklarına bağlı bariyer disfonksiyonunu incelemek için güçlü bir araçtır. Hücre tiplerinin başarılı bir şekilde farklılaşmasını sağlamak, gelişimsel zorlukları ele almak ve alternatif uygulamaları keşfetmek, bu modelin faydasını ve doğruluğunu artıracaktır. Terapötik hedefleme ve gen nakavt çalışmalarında uygulanması, insan solunum yolu hastalıklarını anlamamızı ve tedavimizi ilerletme potansiyelinin altını çizmektedir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
Bu araştırma CIRM (DISC2COVID19-12022) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12 well plates | Corning | 3512 | |
| 12-well inserts, 0.4 µm, translucent | VWR | 10769-208 | |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Accutase | Innovative Cell Tech | AT104 | |
| Activin A | R&D Systems | 338-AC | |
| All-trans retinoic acid (RA) | Sigma-Aldrich | R2625 | |
| ascorbic acid | Sigma | A4544 | |
| B27 without retinoic acid | ThermoFisher | 12587010 | |
| BMP4 | R&D Systems | 314-BP/CF | |
| Bovine serum albumin (BSA) Fraction V, 7.5% solution | Gibco | 15260-037 | |
| Br-cAMP | Sigma-Aldrich | B5386 | |
| CD 14 (FITC) | BioLegend | 982502 | |
| CD 31 PECAM-1(APC) | R&D System | FAB3567A | |
| CD 45 (PE) | BD Biosciences | 560975 | |
| CD 68 (PE) | BioLegend | 33808 | |
| CHIR99021 | Abcam | ab120890 | |
| CPM | Fujifilm | 014-27501 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dispase | StemCellTech | 7913 | |
| DMEM/F12 | Gibco | 10565042 | |
| Dorsomorphin | R&D Systems | 3093 | |
| E-CAD/CD 324 (APC) | BioLegend | 324107 | |
| EGF | R&D Systems | 236-EG | |
| EGM2 Medium | Lonza | CC-3162 | |
| EPCAM/CD 326 (APC) | BioLegend | 324212 | |
| FBS | Gibco | 10082139 | |
| FGF10 | R&D Systems | 345-FG/CF | |
| FGF7 | R&D Systems | 251-KG/CF | |
| Fibronectin | Fisher | 356008 | |
| Forskolin | Abcam | ab120058 | |
| Glutamax | Life Technologies | 35050061 | |
| Ham’s F12 | Invitrogen | 11765-054 | |
| HEPES | Gibco | 15630-080 | |
| IBMX (3-Isobtyl-1-methylxanthine) | Sigma-Aldrich | I5879 | |
| IL-3 | Peprotech | 200-03 | |
| Iscove’s Modified Dulbecco’s Medium (IMDM) + Glutamax | Invitrogen | 31980030 | |
| Knockout Serum Replacement (KSR) | Life Technologies | 10828028 | |
| Matrigel | Corning | 354230 | |
| M-CSF | Peprotech | 300-25 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR plus Kit (10/case) | Stem Cell Tech | 5825 | |
| N2 | ThermoFisher | 17502048 | |
| NEAA | Life Technologies | 11140050 | |
| PBS | Gibco | 10010023 | |
| Pen/strep | Lonza | 17-602F | |
| ReleSR | Stem Cell Tech | 5872 | |
| RPMI1640 + Glutamax | Life Technologies | 12633012 | |
| SB431542 | R&D Systems | 1614 | |
| SCF | PeproTech | 300-07 | |
| SMA | Invitrogen | 50-9760-80 | |
| STEMdiff APEL 2 Medium | STEMCELL Technologies | 5275 | |
| TrypLE Express | Gibco | 12605-028 | |
| VEGF165 | Preprotech | 100-20 | |
| Vimentin | Cell Signaling | 5741S | |
| Y-27632 (Rock Inhibitor) | R&D Systems | 1254/1 | |
| ZO-1 | Invitrogen | 339100 |
Referanslar
- Wu, M., Zhang, X., Lin, Y., Zeng, Y. Roles of airway basal stem cells in lung homeostasis and regenerative medicine. Respir Res. 23 (1), 122 (2022).
- Blackburn, J. B., Li, N. F., Bartlett, N. W., Richmond, B. W. An update in club cell biology and its potential relevance to chronic obstructive pulmonary disease. Am J Physiol Lung Cell Mol Physiol. 324 (5), L652-L665 (2023).
- Fahy, J. V., Dickey, B. F. Airway mucus function and dysfunction. N Engl J Med. 363 (23), 2233-2247 (2010).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Ann Am Thorac Soc. 15 (Suppl 3), S143-S148 (2018).
- Khalilgharibi, N., Mao, Y. To form and function: On the role of basement membrane mechanics in tissue development, homeostasis and disease. Open Biol. 11 (2), 200360 (2021).
- Mcdonald, D. M., Yao, L. C., Baluk, P. Dynamics of airway blood vessels and lymphatics: Lessons from development and inflammation. Proc Am Thorac Soc. 8 (6), 504-507 (2011).
- Parker, D., Prince, A. Innate immunity in the respiratory epithelium. Am J Respir Cell Mol Biol. 45 (2), 189-201 (2011).
- Davis, J. D., Wypych, T. P. Cellular and functional heterogeneity of the airway epithelium. Mucosal Immunol. 14 (5), 978-990 (2021).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clin Microbiol Rev. 24 (1), 210-229 (2011).
- Fosse, J. H., Haraldsen, G., Falk, K., Edelmann, R. Endothelial cells in emerging viral infections. Front Cardiovasc Med. 8, 619690 (2021).
- Wang, Y., Zheng, J., Wang, X., Yang, P., Zhao, D. Alveolar macrophages and airway hyperresponsiveness associated with respiratory syncytial virus infection. Front Immunol. 13, 1012048 (2022).
- Costa, A., De Souza Carvalho-Wodarz, C., Seabra, V., Sarmento, B., Lehr, C. M. Triple co-culture of human alveolar epithelium, endothelium and macrophages for studying the interaction of nanocarriers with the air-blood barrier. Acta Biomater. 91, 235-247 (2019).
- Leibel, S. L., Mcvicar, R. N., Winquist, A. M., Snyder, E. Y. Generation of 3D whole lung organoids from induced pluripotent stem cells for modeling lung developmental biology and disease. J Vis Exp. (170), e62456 (2021).
- Mccauley, K. B., Hawkins, F., Kotton, D. N. Derivation of epithelial-only airway organoids from human pluripotent stem cells. Curr Protoc Stem Cell Biol. 45 (1), e51 (2018).
- Choi, K. -. Y. G., Wu, B. C., Lee, A. H. -. Y., Baquir, B., Hancock, R. E. W. Utilizing organoid and air-liquid interface models as a screening method in the development of new host defense peptides. Front Cell Infect Microbiol. 10, 228 (2020).
- Fulcher, M. L., Randell, S. H. Human nasal and tracheo-bronchial respiratory epithelial cell culture. Methods Mol Biol. 945, 109-121 (2013).
- Hao, S., et al. Long-term modeling of SARS-COV-2 infection of in vitro cultured polarized human airway epithelium. mBio. 11 (6), e02852-e02920 (2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nat Cell Biol. 17 (8), 994-1003 (2015).
- Van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long-term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), e71098 (2013).
- Pouyanfard, S., et al. Human-induced pluripotent stem cell-derived macrophages ameliorate liver fibrosis. Stem Cells. 39 (12), 1701-1717 (2021).
- Ardini-Poleske, M. E., et al. Lungmap: The molecular atlas of lung development program. Am J Physiol Lung Cell Mol Physiol. 313 (5), L733-L740 (2017).
- Ronaghan, N. J., et al. M1-like, but not m0- or m2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), e0276013 (2022).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Rep. 3 (3), 394-403 (2014).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods. 14 (11), 1097-1106 (2017).
- Firth, A. L., et al. Generation of multiciliated cells in functional airway epithelia from human induced pluripotent stem cells. Proc Natl Acad Sci U S A. 111 (17), E1723-E1730 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır