Method Article
Co-cultura de células epiteliais, mesenquimais, endoteliais e imunes derivadas de iPSC para modelar a integridade da barreira das vias aéreas na saúde e doença pulmonar
Neste Artigo
Resumo
Este artigo descreve a geração de um modelo complexo de barreira das vias aéreas multicelular composto por epitélio pulmonar derivado de células-tronco pluripotentes induzidas (iPSC), mesênquima, células endoteliais e macrófagos em uma cultura de interface ar-líquido.
Resumo
O tecido pulmonar humano é composto por uma rede interconectada de epitélio, mesênquima, endotélio e células imunes desde as vias aéreas superiores da nasofaringe até o menor saco alveolar. As interações entre essas células são cruciais no desenvolvimento pulmonar e na doença, atuando como uma barreira contra produtos químicos e patógenos nocivos. Os modelos atuais de co-cultura in vitro utilizam linhagens celulares imortalizadas com diferentes origens biológicas, que podem não representar com precisão o meio celular ou as interações do pulmão. Diferenciamos iPSCs humanas em organoides pulmonares 3D (contendo epitélio e mesênquima), células endoteliais e macrófagos. Estes foram co-cultivados em um formato de interface ar-líquido (ALI) para formar uma barreira apical epitelial/mesenquimal revestida de macrófagos e uma barreira endotelial basolateral (iAirway). O iAirways derivado de iPSC mostrou uma redução na integridade da barreira em resposta à infecção por vírus respiratórios e toxinas do cigarro. Este sistema de co-cultura pulmonar de várias linhagens fornece uma plataforma para estudar interações celulares, vias de sinalização e mecanismos moleculares subjacentes ao desenvolvimento pulmonar, homeostase e progressão da doença. O iAirways imita de perto a fisiologia humana e as interações celulares, pode ser gerado a partir de iPSCs derivados do paciente e pode ser personalizado para incluir diferentes tipos de células das vias aéreas. No geral, os modelos iAirway derivados de iPSC oferecem uma ferramenta versátil e poderosa para estudar a integridade da barreira para entender melhor os fatores genéticos de doenças, resposta a patógenos, regulação imunológica e descoberta ou reaproveitamento de medicamentos in vitro, com o potencial de avançar nossa compreensão e tratamento de doenças das vias aéreas.
Introdução
A barreira sangue-ar nas grandes vias aéreas inclui a traqueia, brônquios e bronquíolos. Ele desempenha um papel crucial na manutenção da saúde respiratória e é composto pelo epitélio das vias aéreas, membrana basal, vasos sanguíneos e células endoteliais e células imunológicas. As células epiteliais primárias nas vias aéreas abrangem células basais, células club, células ciliadas e células caliciformes. As células basais, atuando como células-tronco do epitélio das vias aéreas, são progenitores multipotentes com alta capacidade proliferativa e de autorrenovação, dando origem a células epiteliais maduras das vias aéreas1. As células Club são células secretoras não ciliadas que contribuem para a manutenção do revestimento das vias aéreas secretando proteínas protetoras e surfactantes2. As células caliciformes, localizadas no lúmen e nas glândulas submucosas, secretam mucinas para reter os detritos e proteger as vias aéreas3. As células ciliadas são parte integrante do mecanismo de escada rolante mucociliar, evitando o acúmulo de microrganismos nocivos4. A membrana basal é constituída por uma matriz extracelular, que fornece suporte estrutural5. A traqueia e o resto das vias aéreas são circundados por uma rica rede de vasos sanguíneos, que são revestidos por células endoteliais que desempenham um papel vital no apoio à função traqueal, fornecendo nutrientes e oxigênio, removendo resíduos, regulando a inflamação e contribuindo para o reparo tecidual e angiogênese6. Finalmente, os macrófagos das vias aéreas são células imunes específicas do tecido, essenciais para proteger o sistema respiratório de infecções, limpar as partículas inaladas e manter uma resposta imune equilibrada7.
As ações coordenadas das células epiteliais, mesenquimais, endoteliais e células de macrófagos são críticas para uma resposta imune eficaz a patógenos nas vias aéreas8. As células epiteliais formam a primeira linha de defesa contra infecções virais, agindo como uma barreira física, com junções apertadas que restringem a passagem de substâncias nocivas. A ação coordenada das células ciliadas e das células caliciformes ajuda a reter e remover partículas inaladas, patógenos e detritos4. Além disso, as células epiteliais das vias aéreas produzem citocinas e quimiocinas para recrutar células imunes9. As células endoteliais mantêm a integridade vascular, impedindo a disseminação de partículas virais pela corrente sanguínea, regulam positivamente as moléculas de adesão (VCAM-1) para facilitar a adesão das células imunes e produzem citocinas pró-inflamatórias para recrutar células imunes da corrente sanguínea para o local da infecção10. Os macrófagos das vias aéreas engolfam e digerem partículas virais, células infectadas e detritos, apresentam antígenos virais às células T e produzem citocinas para ativar e recrutar outras células imunes, juntamente com interferons tipo I para inibir a replicação viral11. As ações coordenadas das células epiteliais, mesenquimais, endoteliais e macrófagos criam um sistema de defesa robusto e dinâmico que protege as vias aéreas de infecções virais e mantém a saúde respiratória.
Compreender as interações dinâmicas entre vários tipos de células no pulmão humano é crucial para compreender a resposta do pulmão a infecções virais, doenças inflamatórias e administração de medicamentos. As co-culturas in vitro permitem o estudo da sinalização célula-célula entre o epitélio, as células endoteliais e as células imunes inatas12. Desenvolvemos o primeiro modelo autêntico de pulmão do tipo multicelular derivado de hiPSCs específicos do paciente13. Isso incorpora populações de células epiteliais e mesenquimais, formadas em uma orientação 3D. Posteriormente, as células progenitoras do pulmão podem ser diferenciadas em um "organoide das vias aéreas"14, cultivadas em inserções de cultura de células estéreis e expostas a uma interface ar-líquido (LPA), replicando as condições das vias aéreashumanas15,16,17. As células endoteliais derivadas de iPSC são cultivadas no lado basolateral da membrana, imitando sua orientação nas vias aéreas humanas, situadas abaixo da camada epitelial/mesenquimal na membrana basal. Finalmente, macrófagos derivados de iPSC são adicionados ao lado apical da membrana, interagindo com as células epiteliais e aguardando sinais de ativação (Figura 1A). Este modelo reproduz com precisão a biologia e a função das vias aéreas. Postulamos que as culturas de vias aéreas multicelulares autênticas do tipo iAirway derivadas de hiPSC, específicas do paciente, são mais adequadas para elucidar a resposta intrínseca e aguda da barreira das vias aéreas e patógenos, incluindo infecções virais. Por exemplo, este modelo pode ser usado para (1) estudar a entrada e replicação viral, (2) investigar a resposta imune inicial por células imunes epiteliais e específicas do tecido, (3) examinar a integridade e função da barreira, (4) testar a eficácia de agentes terapêuticos e (5) estudar mecanismos celulares e moleculares de patogênese em um modelo específico do paciente.
Este artigo descreve um protocolo detalhado para a preparação de co-culturas pulmonares multicelulares para estudar as respostas celulares a infecções virais.
Protocolo
Este protocolo de estudo foi aprovado pelo Conselho de Revisão Institucional do Programa de Proteção à Pesquisa Humana da UCSD (181180). Este protocolo usa pequenas moléculas e fatores de crescimento para direcionar a diferenciação de células-tronco pluripotentes em células das vias aéreas, células endoteliais e macrófagos. Essas células são então co-cultivadas em inserções de cultura de células e polarizadas em uma interface ar-líquido. Os detalhes dos reagentes, consumíveis e equipamentos usados estão listados na Tabela de Materiais. As composições de mídia e buffer são fornecidas no Arquivo Suplementar 1.
1. Geração de organoides das vias aéreas derivados de iPSC (Dia 1 - 30)
NOTA: Este protocolo descreve as etapas necessárias para gerar organoides de vias aéreas derivados de iPSC (Figura 1B), seguindo a metodologia descrita em Leibel et al.13. O processo inclui indução de endoderma definitiva (dias 1-3), geração de endoderma anterior do intestino anterior (dias 4-6) e diferenciação em progenitores pulmonares (dias 7-16). A metodologia detalhada pode ser encontrada na publicação anterior13. As etapas a seguir detalham a geração de organoides das vias aéreas a partir de progenitores pulmonares.
- Extração e dissociação de esferoides progenitores pulmonares do polímero ECM (Dia 17)
- Descongele o polímero de matriz extracelular (MEC) (8-9 mg/mL) em gelo.
- Aspirar meios gastos, usando aspirador a vácuo, de organoides pulmonares embutidos em ECM.
NOTA: Para as etapas de aspiração subsequentes, use um aspirador a vácuo, salvo indicação em contrário. - Adicione 1 mL de 2 U/mL de dispase suplementada com 10 μM de inibidor de ROCK1 (ROCKi) às células e use uma pipeta P1000 para ressuspender manualmente os progenitores pulmonares na MEC. Incube por 30 min a 37 ° C, ressuspendendo a mistura a cada 15 min para aumentar a eficácia da dissociação da dispase por meio de processamento mecânico.
- 15 minutos antes do uso, coloque 45 mL de PBS em temperatura ambiente em um freezer a -20 ° C para esfriar. Certifique-se de que o PBS esteja mais frio que 4 °C para uma despolimerização ideal do ECM nas etapas subsequentes.
- Após 30 minutos de incubação de dispase, transfira o organoide e dispase a solução para um tubo cônico de 15 mL.
- Adicione PBS resfriado (2 mL por 1 mL de protease) para lavar e coletar organoide residual e material ECM da placa. Ressuspenda os organoides usando uma pipeta P1000 e centrifugue a 400 x g por 5 min.
NOTA: Todas as etapas de centrifugação são realizadas à temperatura ambiente, a menos que especificado de outra forma neste protocolo. - Após a centrifugação, um pellet de ECM turvo com organoides deve ser visível. Aspire cuidadosamente o sobrenadante via pipeta, evitando o pellet ECM.
- Realize uma segunda lavagem de PBS com PBS resfriado, ressuspenda usando uma pipeta P1000 e centrifugue a 400 x g por 5 min. Aspire o sobrenadante por meio de pipeta, deixando ~ 100 μL de solução residual.
- Adicione 2 mL de protease semelhante à tripsina aos organoides no tubo cônico de 15 mL. Ressuspenda usando uma pipeta P1000. Incubar durante 10-12 min a 37 °C, invertendo ou sacudindo o tubo para ressuspender a mistura a meio da incubação.
NOTA: Execute 10-12 min de dissociação de protease semelhante à tripsina para passar organoides como agregados. - Após 12 minutos, interrompa a reação de protease semelhante à tripsina adicionando 2 mL de FBS a 2% no meio base (Stop Media, consulte o Arquivo Suplementar 1). Ressuspenda a solução com uma pipeta P1000 e centrifugue a 400 x g por 5 min.
- Aspirar o sobrenadante e ressuspender organoides em Stop Media suplementado com 10 μM de ROCKi. Colher uma amostra de 10 μL para contagem de células utilizando um hemocitómetro e azul de tripano. Mantenha os organoides no gelo durante a contagem.
- Calcule o volume necessário para obter 100.000 células por poço. Alíquota agrega células em um tubo de microcentrífuga de 1,5 mL e centrifuga por 5 min a 400 x g. Remova o excesso de sobrenadante, deixando 10 μL de meio residual.
- Ressuspenda o pellet celular em 200 μL de polímero ECM frio (evite bolhas e trabalhe rapidamente para evitar a polimerização prematura). Adicione 200 μL da mistura de ECM e células ao fundo de cada poço em uma placa de 12 poços. Deixe o ECM polimerizar parcialmente à temperatura ambiente no gabinete de biossegurança por 5 min.
- Transfira a placa para uma incubadora a 37 °C por 30-60 min para completar a polimerização do ECM. Em seguida, adicione 1,5 mL de meio de indução organoide das vias aéreas (Arquivo Suplementar 1).
- Troque o meio a cada dois dias por 14 dias até o dia 30. Se o meio ficar amarelo em 24 h, aumente o volume para 2 mL.
2. Geração de células endoteliais derivadas de iPSC (Dia 1 - 14)
NOTA: O procedimento a seguir detalha a geração de células endoteliais a partir de iPSCs (Figura 1C), adaptado de Patsch et al.18. Este método inclui a preparação de placas, diferenciação de iPSCs, indução de células endoteliais, classificação e expansão. A Tabela 1 lista os anticorpos utilizados neste estudo.
- Plaqueamento de iPSCs para diferenciação endotelial (Dia 0)
- Inicie a diferenciação das células endoteliais quando as hiPSCs atingirem 70% -80% de confluência. Adicione 10 μM de ROCKi Y-27632 a cada poço uma hora antes da dissociação.
- Aspire o meio, lave os poços com 1 mL de PBS e, em seguida, dissocie as iPSCs adicionando 1 mL de solução de descolamento celular por poço de uma placa de 12 poços. Incubar durante 20 min a 37 °C.
- Neutralize a solução de desprendimento celular adicionando 2 mL de Stop Media aos poços. Pipeta para obter uma suspensão unicelular. Transfira as células para um tubo cônico de 15 mL e centrifugue por 5 min a 300 x g.
- Aspire o sobrenadante, ressuspenda as iPSCs em meios de cultura iPSC suplementados com 10 μM de ROCKi e faça uma contagem de células. Placa de 100.000 hiPSCs por poço de uma placa de 12 poços revestida com ECM em 1 mL de meio de cultura iPSC com 10 μM de ROCKi. Incubar durante a noite a 37 °C.
NOTA: A densidade de semeadura para diferenciação endotelial iPSC pode precisar de otimização por linha celular. Avalie a eficiência da diferenciação usando citometria de fluxo para CD31 no dia 6.
- Indução do mesoderma lateral (dia 1-3)
- Aspire os meios de cultura iPSC de iPSCs plaqueados e adicione 3 mL de meio de base N2B27 suplementado com 6 μM de CHIR e 25 ng/mL BMP4 por poço (Arquivo Suplementar 1). Aqueça a mídia antes de adicioná-la às células. Não troque a mídia por 3 dias.
- Indução de células endoteliais (dia 4-5)
- No dia 4, aspire o meio N2B27 e adicione 2 mL de meio de diferenciação endotelial (EDM) suplementado com 200 ng/mL VEGF165 e 2 μM de forscolina por poço. Mude a mídia no dia 5.
- Classificação e replaqueamento de células endoteliais (Dia 6)
- No dia 5 ou 6, prepare um frasco T75 revestido com fibronectina para enriquecimento de classificação de células ativadas por fluorescência (FACS) reconstituindo 1 mg de fibronectina em água estéril para fazer 100 μg / mL de solução de fibronectina. Cubra o frasco T75 com 6 ml da solução de fibronectina e incube à temperatura ambiente durante uma hora. Aspire a solução de fibronectina e lave com água estéril. Deixar o balão T75 secar à temperatura ambiente. Os frascos suplementares fabricados podem ser conservados a 4 °C.
- Prepare meios de manutenção endotelial (EMM)18.
- No dia 6, enriqueça as células endoteliais derivadas de iPSC via FACS usando o anticorpo CD3118.
- Adicione 10 μM de ROCKi Y-27632 a cada poço uma hora antes da dissociação a 37 ° C. Aspire o meio e lave com PBS. Adicione 1 mL de solução de descolamento de células pré-aquecida por poço de uma placa de 12 poços e incube por 8-10 min a 37 ° C.
- Pipete suavemente para garantir o descolamento de uma única célula. Transfira as células para um tubo cônico de 15 mL e adicione o mesmo volume de Stop Media. Centrifugue por 5 min a 300 x g.
- Aspire o sobrenadante e ressuspenda as células endoteliais em 1 mL de Stop Media suplementado com 10 μM de ROCKi. Passe as células pelo filtro de 70 μm adicionando primeiro 1 mL de meio de parada para molhar o filtro e, em seguida, pipetar as células através do filtro. Colher uma amostra de 10 μL para contagem de células utilizando um hemocitómetro e azul de tripano. Mantenha as células no gelo durante a contagem.
- Execute uma contagem de células. Preparar uma alíquota de 200.000 células como controlo negativo não corado. Transfira as células restantes para um tubo Eppendorf de 1,5 mL e adicione 10 μL de CD31-APC para cada 1 milhão de células em 100 μL de tampão FACS. Incubar durante 30 min num rotador a 4 °C.
- Uma vez concluída a incubação, centrifugue o tubo Eppendorf com células por 5 min a 300 x g, lave as células adicionando 1mL de PBS. Repita a etapa de lavagem e centrifugação duas vezes. Remova manualmente o sobrenadante entre as lavagens.
- Ressuspenda o pellet celular em 1mL de tampão FACS e 5 ug/mL de solução DAPI para coloração de viabilidade, 5 minutos antes da classificação. Classificar de acordo com as diretrizes institucionais.
- Colete células classificadas por FACS em um tubo cônico de 15 mL com 2 mL de EMM. Centrifugue o tubo cônico de 15 mL com células por 5 min a 300 x g. Aspirar o sobrenadante e ressuspender as células endoteliais em 10 mL de EMM suplementado com 10 μM de ROCKi Y-27632 e Penicilina Estreptomicina (1%).
- Transfira as células endoteliais derivadas de iPSC enriquecidas com FACS ressuspensas para o frasco revestido com fibronectina. Distribua uniformemente as células e coloque em uma incubadora a 37 ° C durante a noite.
NOTA: Use um mínimo de 500.000 células e um máximo de 2.000.000 células por frasco T75.
- Expansão e criopreservação de células endoteliais selecionadas (Dia 7+)
- Altere a mídia EMM a cada 2-3 dias após o enriquecimento do FACS. Uma vez que o frasco T75 se torna confluente (aproximadamente 7 dias após o FACS, dependendo da densidade de semeadura), as células endoteliais derivadas de iPSC podem ser usadas para cocultura ou criopreservadas para aplicações futuras.
- Prepare uma solução de congelamento endotelial 2x antes da dissociação celular (80% Endo-CM2, 20% DMSO, 20 μM de ROCKi).
- Rotule os tubos crioviais em uma caneta à prova de etanol com as respectivas informações. ID da linha, número da passagem, meio de cultura, 'descongelar em um poço 6', data do congelamento.
- Quando as células endoteliais derivadas de iPSC classificadas são confluentes, inicie a dissociação.
- Lavar o balão T75 com 5ml de PBS -/-.
- Dissocie as células endoteliais derivadas de iPSC com 5mL de protease semelhante à tripsina por T75. Incube as células a 37 °C DURANTE 10 min, verificando periodicamente o T75 para verificar se as células foram levantadas.
- Neutralize a reação adicionando 5 mL de Stop Media. Transfira 10 mL de células em solução para tubo de 15 mL. Centrifugue a 300 x g por 5 min.
- Aspire o sobrenadante, ressuspenda as células endoteliais em meio E-CBM e retire 10 μL de amostra para contagem via hemacitómetro.
- Após a contagem de células, alíquota de 1 milhão de células por 0,5 mL de meio EGM2.
NOTA: A etapa a seguir é sensível ao tempo. Prepare criogenials e recipientes de congelamento para serem usados imediatamente. - Alíquota de volume igual de solução de congelamento 2x para células endoteliais. A concentração final é de 90% de Endo-CM2, 10% de DMO e 10 μM de ROCKi (1 mL/1 milhão de células).
- Transfira os frascos tampados imediatamente para uma câmara de congelamento e coloque a -80 ° C durante a noite, depois em nitrogênio líquido (-180 ° C) no dia seguinte para armazenamento de longo prazo.
3. Geração de macrófagos derivados de iPSC (Dia 1 - 26)
NOTA: Este procedimento descreve as etapas para gerar macrófagos a partir de iPSCs (Figura 1D), adaptado de van Wilgenburg et al.19 e Pouyanfard et al.20. Abrange a adaptação unicelular de iPSCs, diferenciação do corpo embrióide, formação de progenitores de macrófagos e maturação de macrófagos.
- Adaptação de iPSCs de célula única
- Quando as iPSCs atingirem ~ 70% -90% de confluência sem sinais visíveis de diferenciação, inicie a passagem de célula única com protease semelhante à tripsina.
- Aspire o meio gasto e enxágue com PBS. Remova o PBS e adicione protease semelhante à tripsina (1 mL / poço de uma placa de 6 poços, 500 μL / poço de uma placa de 12 poços). Incubar a 37 °C durante 2-5 min até que as colónias de iPSC se dissociem da placa.
- Neutralize a protease semelhante à tripsina com um volume igual de Stop Media (1 mL / poço de uma placa de 6 poços, 500 μL / poço de uma placa de 12 poços). Centrifugue as células a 200 x g por 5 min.
- Aspire o sobrenadante e ressuspenda suavemente as células em meios de cultura iPSC com 10 μM de ROCKi. Passagem para novas placas revestidas com ECM. Repita por 2-3 passagens antes de criopreservar ou usar as iPSCs adaptadas de célula única.
NOTA: Ajuste a taxa de passagem de 1:2 para 1:10 com base na saúde e adaptação celular. Além disso, as iPSCs que sofreram pelo menos três passagens unicelulares e estão em baixa passagem produzem diferenciações ideais de macrófagos.
- Formação do corpo embrióide (Dia 0-6)
- Quando as iPSCs adaptadas a uma única célula atingem ~ 75% de confluência, as iPSCs de passagem com protease semelhante à tripsina de acordo com as etapas 3.1-3.4.
- Ressuspenda as células em Stop Media e passe por um filtro de células de 70 μm para um novo tubo cônico de 50 mL para remover aglomerados. Ressuspenda as células e colete uma amostra de 10 μL para contagem de células via hemacitômetro.
- Para a geração do corpo embrióide (EB), 8.000-50.000 células são plaqueadas por poço de uma placa de fixação ultrabaixa (ULA) de 96 poços. Calcule o número total de células necessárias para semear 60 poços de uma placa ULA de 96 poços.
NOTA: A densidade de semeadura de iPSCs pode exigir otimização por linha celular. - Centrifugue iPSCs em 15 mL cônicos a 200 x g por 5 min. Aspire o sobrenadante.
- Para 480.000 iPSCs (8.000 células/poço em 60 poços), ressuspenda em 6 mL (100 ul/poço em 60 poços) de meio de indução EB.
- Adicione 150 μL de PBS aos 36 poços externos de uma placa ULA de 96 poços de fundo redondo.
- Ressuspenda e transfira iPSCs em mídia EB para uma calha de mídia. Usando uma pipeta multicanal, adicione 100 μL / poço de suspensão celular nos 60 poços centrais da placa ULA de 96 poços. Ressuspenda as iPSCs em meio EB intermitentemente para garantir uma distribuição uniforme das células.
- Centrifugue a placa de 96 poços a 300 x g durante 5 min a 4 °C (se disponível). Transferir as placas para uma incubadora a 37 °C.
- Após 48-72 h, troque 50 μL do meio (troca de meio meio). Verifique a formação de cistos após 6 dias.
NOTA: Algumas linhas iPSC formam EBs mais cedo ou mais facilmente do que outras. Monitore a formação de EB e certifique-se de que os EBs sejam transferidos no momento apropriado (eles devem estar desenvolvendo cistos).
- Revestimento de gelatina e transferência de EB para formação de progenitores de macrófagos (Dia 6-19)
- Prepare duas placas de 6 poços revestidas com gelatina a 0,1%. Adicione 1 mL de gelatina a 0,1% por poço e incube em temperatura ambiente por 20 min. Aspire a solução de gelatina e deixe as placas secarem no exaustor por 30-60 min.
- Transfira EBs da placa de 96 poços para as placas de 6 poços revestidas com gelatina usando uma pipeta sorológica de 2 mL. Distribua aproximadamente 8-10 EBs por poço de uma placa revestida de gelatina de 6 poços.
- Remova cuidadosamente a mídia EB residual usada da transferência. Adicione 2 mL de meio de cultura de macrófagos 1 (Mac-CM1) por poço. Incubar EB's sem perturbações a 37 °C com 5% de CO2 por 5-7 dias.
NOTA: Idealmente, uma placa de 96 poços de corpos embrióides pode ser dividida em duas placas de 6 poços. Se os EBs forem pouco desenvolvidos, o número de EBs transferidos por placa de 6 poços pode ser ajustado para otimizar a etapa de diferenciação de iPSC para corpo embrióide.
- Geração de progenitores de macrófagos
- Substitua 2/3 da mídia duas vezes por semana, aumentando o volume para 3 mL se a cor da mídia mudar.
- Verifique as culturas entre os dias 8 e 19 para determinar se estão prontas para a colheita de progenitores de macrófagos. Se os EBs se soltarem, transfira os EBs para uma placa recém-revestida com Mac-CM1 e incube sem ser perturbado por 7 dias.
NOTA: A manutenção do complexo formador de progenitores de macrófagos é vital para o desenvolvimento e geração contínua de progenitores de macrófagos. Complexos formadores de progenitores de macrófagos otimizados gerarão continuamente progenitores mielóides por 2-6+ meses.
- Colheita de progenitores mielóides (Dia 19-26+)
- Quando houver células progenitoras de macrófagos em suspensão, colha o meio com células e transfira para um tubo cônico de 50 mL. Centrifugue a 200 x g por 5 min e remova cuidadosamente o sobrenadante.
- Ressuspenda os progenitores de macrófagos em Mac-CM2 e transfira para uma placa/balão de cultura estéril não tratado. Incubar a 37 °C com 5% de CO2 por 3-4 dias.
NOTA: Dependendo do número de células colhidas, transfira para uma placa de Petri de 10 cm (3-4 poços de uma placa de 6 poços), balão T25 (1-2 poços de uma placa de 6 poços) ou frasco T75 (placa cheia de 6 poços) com o volume apropriado de meio. Use 5-6 mL de meio para um frasco T25, 10-12 mL de meio em uma placa de Petri e 12-15 mL de meio para um frasco T75. Para colheitas subsequentes, progenitores mieloides e células de macrófagos podem ser agrupados de colheitas anteriores se forem da mesma linhagem/complexos formadores de mieloide. Apenas certifique-se de que o balão é suficiente para manter e alimentar o número de células no(s) frasco(s). Os macrófagos não proliferam; eles são gerados a partir de progenitores de macrófagos. Os macrófagos podem ser agrupados e mantidos por 2-6 semanas sem perder marcadores de expressão.
- Colheita de macrófagos
NOTA: Após 14 dias de diferenciação de macrófagos em meio Mac-CM2, as culturas de macrófagos estão prontas para co-cultura ou análise de citometria de fluxo.- Colete o meio gasto e transfira para um tubo cônico de 50 mL. Lave o balão / placa com PBS para remover os meios e células residuais.
- Adicione o meio de base ao frasco (3 ml para T25 e 5 ml para T75) e utilize um raspador de células esterilizado para separar as células do fundo do balão/placa. Transfira as células para um tubo cônico e repita a raspagem, se necessário.
- Centrifugue a 200 x g por 5 min em temperatura ambiente. Remova cuidadosamente o sobrenadante e ressuspenda as células em meio ou tampão apropriado para uso posterior.
4. Co-cultura de células das vias aéreas, células endoteliais e macrófagos
NOTA: Este procedimento descreve as etapas para a co-cultura de células das vias aéreas, células endoteliais e macrófagos (Figura 1A) usando insertos de cultura celular, adaptados de Costa et al.12.
- Revestimento ECM de insertos de cultura de células para co-cultura (Dia 0 de co-cultura)
- Cubra as inserções de cultura de células de poliéster (PET) de poros de 3,0 μm com solução de ECM de 4 mg/mL. Cubra brevemente o lado apical das inserções de cultura de células dentro da placa com 4 mg/mL de solução de MEC. Pipetar a solução residual de ECM. Coloque a placa na incubadora por 1 h a 37 °C.
- Obtenha uma placa de Petri grande (100 mm x 20 mm ou 150 mm x 20 mm). Com pinças limpas, transfira esterilizadamente as inserções de cultura de células da placa de 12 poços para a placa de Petri grande. Inverta as inserções para que o lado basolateral fique na vertical.
- Cubra o lado basolateral com 4 mg / mL de solução de ECM. Pipetar a solução residual de ECM. Coloque a placa de Petri com inserções de cultura de células revestidas com ECM em uma incubadora a 37 ° C para secar durante a noite.
- Dissociação e plaqueamento de células endoteliais derivadas de iPSC (Dia 1 de co-cultura)
- Lavar o balão T75 com PBS e aspirar a solução. Adicionar 5 ml de protease semelhante à tripsina ao balão T75 e incubar a 37 °C durante 8 min. Avalie visualmente se as células endoteliais foram retiradas do frasco.
NOTA: Aumente o tempo de dissociação da protease semelhante à tipsina se as células endoteliais derivadas de iPSC não tiverem saído do frasco. - Bata no frasco para garantir o descolamento das células endoteliais e transfira as células para um cônico de 15 mL. Adicione 5 mL de Stop Media para interromper a dissociação. Centrifugue as células a 300 x g por 5 min.
- Aspire o sobrenadante e ressuspenda o pellet celular em 1 mL de meio de cultura endotelial com 10 μM de ROCKi. Obtenha 10 μL de solução ressuspensa para contagem de células e coloque as células no gelo durante a contagem.
- Use 150.000 células endoteliais iPSC por inserção de cultura de células de 12 mm em 100 μL de meio de cultura endotelial. Ajuste o respectivo volume de mídia para atingir o número desejado de células por inserção.
- Obtenha uma placa de Petri com inserções de cultura de células de 3,0 μm revestidas com ECM da incubadora (consulte as etapas 4.1-4.3).
- Ressuspenda as células endoteliais iPSC e pipete 100 μL com 150.000 células no inserto de cultura de células invertido (lado basolateral voltado para cima). Repetir pipetagem para cada uma das pastilhas preparadas
- Transfira cuidadosamente as células para a incubadora e deixe-as intactas por 3 h.
- Em uma placa de 12 poços, adicione 1 mL de meio de cultura endotelial em cada poço (para o respectivo número de insertos de cultura de células preparados).
- Retire a placa de Petri com células endoteliais da incubadora. Usando uma pinça limpa, transfira cuidadosamente as inserções de cultura de células para a placa com meios de cultura endoteliais (virando a inserção para que o fundo fique voltado para baixo na mídia).
- Verifique visualmente em um microscópio se as células endoteliais aderiram. Colocar a placa numa incubadora a 37 °C durante a noite.
- Lavar o balão T75 com PBS e aspirar a solução. Adicionar 5 ml de protease semelhante à tripsina ao balão T75 e incubar a 37 °C durante 8 min. Avalie visualmente se as células endoteliais foram retiradas do frasco.
- Dissociação e plaqueamento de organoides das vias aéreas derivados de iPSC (Dia 2 de co-cultura)
NOTA: Consulte as etapas 1.1.1-1.1.15 para isolamento de organoides das vias aéreas do polímero ECM. Modifique a duração da dissociação da protease semelhante à tripsina (etapa 1.1.10) para 15-20 min para obter a suspensão de célula única.- Após 15-20 min, interrompa a reação de protease semelhante à tripsina adicionando 3 mL de Stop Media. Ressuspenda a solução com uma pipeta P1000 e centrifugue a 400 x g por 5 min.
- Aspire o sobrenadante e ressuspenda os organoides das vias aéreas em 1 mL de meio de expansão das vias aéreas com 10 μM de ROCKi. Pegue uma amostra de 10 μL para uma contagem de células do hemaciotômetro e coloque as células no gelo durante a contagem.
- Semeie 300.000 células iPSC das vias aéreas em 500 μL de meio de expansão das vias aéreas por inserto de cultura de células de 12 mm. Ajuste o respectivo volume de mídia para atingir o número desejado de células por inserto preparado.
- Remover a placa com inserções de cultura de células com células endoteliais (semeadas no lado basolateral) da incubadora a 37 °C.
- Ressuspenda as células das vias aéreas iPSC e pipete 500 μL com 300.000 células na câmara apical de cada inserto de cultura de células. Colocar a placa numa incubadora a 37 °C durante 48 h com as células apicais em condições líquido-líquido.
- Co-cultura de transporte aéreo (Dia 4 de co-cultura)
- Remova o meio do lado apical do inserto de cultura de células. Altere os meios basolaterais para meios de diferenciação das vias aéreas 1:1 e meios de cultura endotelial. Retorne a placa para a incubadora.
- Dissociação e plaqueamento de macrófagos derivados de iPSC (Dia 5 de co-cultura)
- Dissociar os macrófagos derivados de iPSC do balão utilizando um raspador de células (ver passos 3.22-3.24). Centrifugue a 300 x g por 5 min e aspire o sobrenadante.
- Ressuspenda macrófagos iPSC em 1 mL de Mac-CM2. Pegue uma amostra de 10 μL para contagem de células e coloque as células no gelo durante a contagem. O número de macrófagos espelhará o número de células das vias aéreas semeadas (proporção de 1:1 de macrófagos para células das vias aéreas).
- Após a contagem de células, alíquotas de 300.000 macrófagos em meio de 35 μL por poço de cultura de células preparada são inseridas em um tubo de microcentrífuga de 1,5 mL. Centrifugue a 200 x g por 5 min.
- Após centrifugação, pipetar o sobrenadante. Ressuspenda os macrófagos no respectivo Mac-CM2 dos cálculos.
- Remova as inserções com coculturas de células endoteliais e das vias aéreas da incubadora. Semeie 300.000 macrófagos em 35 μL de Mac-CM2 no lado apical da inserção da cultura de células. Colocar a placa numa incubadora a 37 °C durante 48 h.
NOTA: Para confirmar a adesão das células imunes ao iPSC ao inserto da cultura celular, as células podem ser marcadas com uma sonda fluorescente. Confirme a adesão por meio de microscopia para sinal fluorescente 48 h após o plaqueamento de macrófagos.
- Co-cultura tripla (7º dia de co-cultura)
- Certifique-se de que a cocultura esteja pronta para aplicações a jusante, como estudos de infecção, medições de resistência elétrica transepitelial (TEER) e ensaios de integridade de barreira.
Resultados
Existem vários estágios nos quais a diferenciação de organoides das vias aéreas derivadas de iPSC, células endoteliais, células imunes e co-culturas pode ser avaliada como concluída com sucesso. As diferenciações podem ser realizadas em diferentes linhagens de iPSC, e este protocolo foi testado em pelo menos cinco linhagens diferentes. O protocolo precisa ser adaptado a cada nova linha de iPSC, especificamente modificando e otimizando a densidade de semeadura.
O rendimento bem-sucedido de organoides das vias aéreas derivados de iPSC pode ser avaliado via campo claro e terá quatro características: limites/bordas definidos, morfologia translúcida/cística, capacidade de proliferar/expandir e falta de células necróticas. Os organoides das vias aéreas que parecem difusos não aumentam de tamanho ao longo das 2 semanas de cultura e têm necrose não devem ser usados para experimentos de cocultura. Organoides com uma camada luminal espessa na periferia vs. Os organoides translúcidos/císticos ainda podem ser usados para experimentos subsequentes. No entanto, os organoides translúcidos/císticos das vias aéreas são compostos predominantemente por células basais, enquanto os organoides de membrana dupla espessa são compostos predominantemente por células de clube. Como as células basais proliferam e se expandem facilmente, elas são mais adequadas para cultura e polarização de interfase ar-líquido. Outros métodos para avaliar o rendimento bem-sucedido de organoides pulmonares derivados de iPSC são a análise de citometria de fluxo no estágio de progenitor pulmonar (dia 16 da diferenciação) para o marcador de superfície CPM (Tabela 1), um rendimento de diferenciação bem-sucedido >50% de células CPM+.
Para a dissociação do organoide das vias aéreas e a cultura de interfase ar-líquido, certifique-se de que todo o polímero ECM foi removido, ou isso impedirá que as células se expandam na membrana. As células devem ser confluentes no dia 3 da cultura, antes do levantamento de ar. A confirmação dos tipos de células no iAirways pode ser avaliada pela coloração dos respectivos marcadores específicos do tipo de célula: células basais (p63+), células do clube (SCGB1A1+), células caliciformes (MUC5AC+) e células ciliadas (AcTub+). A caracterização e os marcadores específicos do tipo de células pulmonares são verificados no LungMAP21. O mesênquima pode ser detectado com anticorpos contra vimentina ou actina de músculo liso. Para gerar mais células ciliadas, as culturas podem exigir levantamento de ar por um longo período de tempo ou a adição de DAPT.
O rendimento bem-sucedido de células endoteliais derivadas de iPSC pode ser avaliado por meio de campo claro, mostrando uma morfologia semelhante a paralelepípedos (Dia 6 da diferenciação endotelial derivada de iPSC). Uma cultura endotelial derivada de iPSC bem-sucedida conterá >50% de células CD31 +, e células suficientes devem ser geradas para que, após a classificação, o rendimento seja superior a 500.000 células. As células podem ser passadas ou criopreservadas, e o marcador CD31 deve ser testado via fluxo a cada passagem ou nova cultura. As células não devem ser passadas além de P4. Para referência, consulte a classificação de células endoteliais derivadas de iPSC pré / pós CD31 (Figura 1C). As células endoteliais serão planas com um grande corpo celular com morfologia alongada e fusiforme.
Para a diferenciação de macrófagos, os corpos embrióides devem permanecer no fundo do poço ULA e apenas um EB deve estar em cada poço. Eles devem mostrar alterações císticas no dia 5-7. Se eles não formarem um EB após a centrifugação, semeie os iPSCs na placa ULA de 96 poços sem girar. Pode ser necessário aumentar o número de iPSCs. O rendimento bem-sucedido de células imunes derivadas de iPSC depende inteiramente da capacidade dos corpos embrióides (EBs) de se desenvolverem em cistos (Dia 7 de diferenciação). EBs imunes derivados de iPSC que não desenvolvem cistos não formarão estroma quando semeados na gelatina e não produzirão progenitores mieloides. Após a transferência para a placa revestida de gelatina, os EBs devem permanecer presos ao fundo da placa. O movimento da placa deve ser feito com cuidado para não desalojá-los. As placas devem ser trocadas duas vezes por semana manualmente e as células suspensas devem ser passadas para Mac-CM2 ou criopreservadas. Além disso, após a colheita dos progenitores mielóides suspensos, eles devem aderir ao frasco plástico não revestido e gerar células brilhantes sob campo claro com vacúolos, indicando macrófagos. O marcador para monócitos, CD14+, deve ser >90% nas células suspensas. O marcador de macrófagos, CD68, deve aumentar com o tempo, com ~ 50% dos macrófagos expressando CD68 + após 2 semanas (Figura 1D). A eficiência de adesão deve ser determinada para cada linha celular. Alcançamos uma média de 20% de eficiência de adesão. Para polarização, os macrófagos M0 são polarizados para macrófagos M1 (iPSC-M1) ou M2 (iPSC-M2) por 48 h em meio de diferenciação II suplementado com diferentes estímulos: 100 ng/mL LPS e 20 ng/mL IFN-g para polarização M1 ou 50 ng/mL IL-4 e 20 ng/mL IL-13 para polarização M2. O marcador para polarização M1 é CD80+ e a polarização M2 é CD206+.
A geração bem-sucedida da co-cultura tripla pode ser avaliada por imunofluorescência para marcadores de junção epitelial EPCAM, ECAD ou ZO-1, ou marcador de junção endotelial CD31 (Figura 2C, Tabela 1). A funcionalidade da co-cultura tripla também pode ser avaliada por meio da resistência epitelial/endotelial transelétrica (TEER). Coculturas organoides e endoteliais das vias aéreas bem montadas terão maior resistência elétrica, indicando comunicação e conexão celular ideais. Insultos ambientais, como cigarros eletrônicos ou desafio viral, comprometerão a integridade da barreira epitelial e endotelial, resultando em redução da resistência elétrica da co-cultura (Figura 3A, B) e junções apertadas desorganizadas ( Figura 3C ).

Figura 1: Diferenciação e caracterização do epitélio das vias aéreas derivado de iPSC, endotélio e culturas imunes. (A) Esquema de diferenciações direcionadas por iPSC para a montagem do iAirway. (B) Organoides do epitélio das vias aéreas derivados de iPSC caracterizados por campo claro (esquerda) e análise de citometria de fluxo (direita) para EPCAM e ECAD. (C) endotélio das vias aéreas derivado de iPSC caracterizado por campo claro (esquerda), imunofluorescência e análise de citometria de fluxo (direita) para CD31. O respectivo campo claro após a classificação CD31 é mostrado à direita. (D) Os macrófagos derivados de iPSC são caracterizados por análise de campo claro (esquerda) e citometria de fluxo (direita) para o marcador pan-hematopoiético CD45, fabricante de monócitos CD14 e marcador de macrófagos CD68. Barras de escala: 100 μm. Clique aqui para ver uma versão ampliada desta figura.
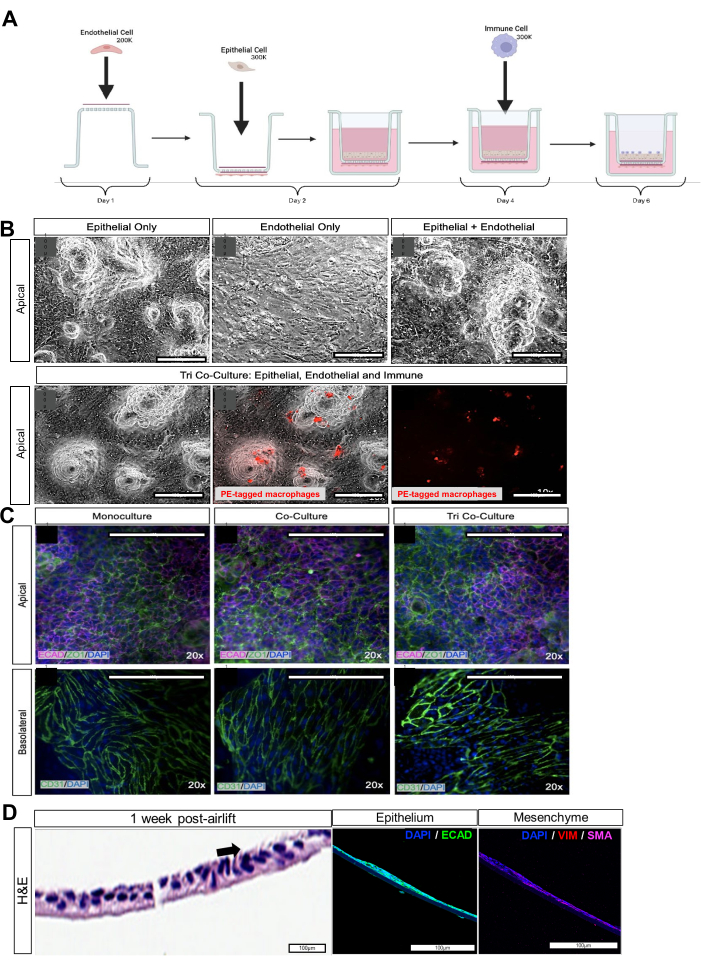
Figura 2: Co-cultura de células epiteliais, mesenquimais, endoteliais e macrófagos derivadas de iPSC. (A) Esquema da montagem do iAirway. (B) Imagens de campo claro da respectiva monocultura epitelial e endotelial, da bicultura epitelial e endotelial e da cocultura epitelial, endotelial e de macrófagos. Macrófagos marcados com citorastreador vermelho. Barras de escala: 100 μm. (C) Coloração imunofluorescente para marcador de junção apertada ZO-1 no lado apical do inserto de cultura de células e CD31 no lado basolateral. Barras de escala: 100 μm. (D) Seção transversal do inserto de cultura de células com organoides dissociados das vias aéreas no lado apical, 1 semana após o levantamento de ar. O painel esquerdo com coloração H & E com a seta preta mostra células ciliadas. O painel do meio, com imagem de imunofluorescência, mostra o marcador epitelial E-caderina (ECAD). O painel direito, com imagem de imunofluorescência, mostra marcadores mesenquimais como vimentina (VIM) e actina de músculo liso (AMS). Barras de escala: 100 μm. Clique aqui para ver uma versão ampliada desta figura.
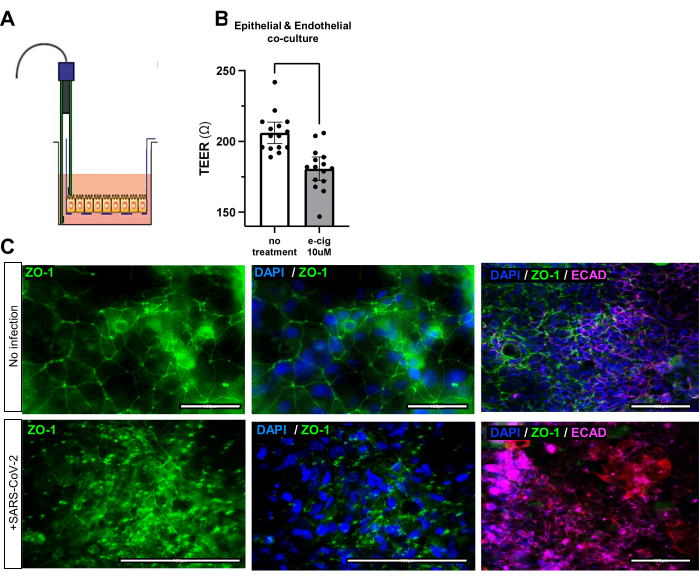
Figura 3: Alterações na função de barreira das vias aéreas dos iAirways expostos a cigarros eletrônicos e vírus. (A) Esquema da ferramenta de medição de resistência epitelial/endotelial transelétrica (TEER). (B) Gráfico de barras de TEER após 7 dias de adição de cigarro eletrônico mentolado à mídia. Intervalo de confiança médio de +/- 95%. N = 5 réplicas biológicas e 3 réplicas técnicas; Valor de p <0,001. (C) Coloração imunofluorescente para proteína de junção apertada ZO-1 antes e depois da infecção por SARS-CoV-2. Observe o layout desordenado do ZO-1 pós-infecção. Barras de escala: 50 μm. Clique aqui para ver uma versão maior desta figura.
| Anticorpo | Aplicação | Diluição |
| CD 31 PECAM-1 (APC) | citometria de fluxo (FC) | 10 μl em tampão de 100 ul |
| EPCAM/CD 326 (APC) | FC | 1:500 |
| E-CAD/CD 324 (APC) | FC | 5 μl em tampão de 100 ul |
| CPM | FC | 1:200 |
| CD 45 (PE) | FC | 5 μl em tampão de 100 ul |
| CD 14 (FITC) | FC | 5 μl em tampão de 100 ul |
| CD 68 (PE) | FC | 5 μl em tampão de 100 ul |
| ZO-1 | Imunofluorescência (IF) | 1:300 |
| Vimentina | SE | 1:200 |
| SMA | SE | 1:100 |
Tabela 1: Anticorpos usados em FACS e Imunofluorescência.
Arquivo Suplementar 1: Composições de mídia e buffer. Clique aqui para baixar este arquivo.
Discussão
O desenvolvimento e a implementação de um modelo da barreira sangue-ar nas grandes vias aéreas para estudar infecções virais e outras toxinas requerem atenção meticulosa aos detalhes para garantir a diferenciação e função bem-sucedidas dos vários tipos de células envolvidas. Esta discussão abordará os principais fatores para uma diferenciação bem-sucedida, desafios potenciais, aplicações alternativas e implicações para o estudo de doenças humanas.
Para garantir uma diferenciação bem-sucedida, é importante prestar atenção ao tipo de inserção da cultura celular e ao tamanho dos poros. Poros dilatados devem ser usados para garantir a comunicação célula-célula através das camadas de ECM. Garantir a densidade de semeadura ideal para linhagens de células-tronco pluripotentes induzidas (iPSC) é fundamental. A densidade adequada facilita a diferenciação uniforme e evita a formação de aglomerados celulares indesejados, levando a uma camada epitelial mais homogênea e funcional. Para manter uma camada epitelial saudável e funcional, é importante lavar a superfície apical antes de adicionar quaisquer compostos, toxinas ou vírus. Isso ajuda a remover muco acumulado, células mortas e outros detritos, promovendo assim um ambiente de cultura estável e viável e permitindo o acesso às células epiteliais.
Para o componente endotelial, é essencial garantir que as células estejam devidamente classificadas e homogêneas. Isso pode ser alcançado por meio de técnicas como o FACS, que garante que apenas as células endoteliais desejadas sejam usadas, mantendo assim a consistência e a função.
Para o componente macrófago, apesar de aderirem facilmente ao plástico, os macrófagos não aderem bem às células epiteliais apicais. Aumentar o número de macrófagos pode ser benéfico para garantir uma grande população de macrófagos no iAirways. Os macrófagos aderentes estão melhor posicionados para interagir com patógenos e outras células imunológicas, aumentando assim a relevância do modelo. Se o estudo da sinalização imune endotelial for preferido, os macrófagos podem ser semeados no lado basolateral das inserções de cultura de células no meio para mimetizar a população de monócitos circulantes22.
O modelo iAirway tem várias outras aplicações significativas, incluindo o estudo do desenvolvimento pulmonar das vias aéreas. O modelo pode ser usado para estudar os intrincados processos envolvidos no desenvolvimento pulmonar, que envolve sinalização multicelular entre diferentes populações de células, fornecendo informações sobre condições normais e patológicas. Para estudar o desenvolvimento e a doença alveolar, os organoides das vias aéreas podem ser substituídos por organoides pulmonares distais (DLOs)23,24 Isso permite que os pesquisadores estudem o pulmão distal, incluindo o desenvolvimento e a função alveolar. Isso é particularmente útil para gerar e estudar macrófagos alveolares, que desempenham um papel fundamental na imunidade pulmonar.
O desenvolvimento de um modelo confiável e reprodutível da barreira sangue-ar em grandes vias aéreas traz vários desafios. As células progenitoras pulmonares devem expressar mais de 50% de NKX2-1 para uma diferenciação bem-sucedida. Se o rendimento não for alcançado, as culturas de LPA podem abrigar mais mesênquima ou estar contaminadas com células epiteliais não pulmonares. Manter a esterilidade durante o plaqueamento das células endoteliais é um desafio significativo, uma vez que elas são cultivadas no lado basolateral do inserto de cultura de células. Isso evita que a tampa da placa feche o ambiente estéril, portanto, outras placas devem ser usadas durante a semeadura das células endoteliais. Os contaminantes podem interromper a cultura e comprometer a integridade do modelo. A maioria das culturas de LPA é incubada por um período mínimo de 3 semanas para gerar a maioria das células das vias aéreas, incluindo células ciliadas. A maioria dos protocolos semeia células basais e, portanto, deve dar tempo para que os mecanismos de sinalização diferenciem as outras células das vias aéreas. O protocolo atual dissocia os organoides das vias aéreas, que já contêm muitas das células das vias aéreas, embora em quantidades menores em comparação com a LPA derivada de HBEC madura. Poucas células ciliadas são vistas junto com os tipos de células epiteliais e mesenquimais (Figura 2D). Para gerar mais células ciliadas, a DAPT pode ser adicionada às culturas organoides das vias aéreas e/ou ao meio LPA25. Esta plataforma também testou apenas a viabilidade a curto prazo das células apicais e basolaterais após o levantamento de ar, quando o meio basolateral é alterado para meios epiteliais e endoteliais 1:1. Mais pesquisas precisam ser feitas para testar a viabilidade ao longo de semanas, o que pode aumentar a complexidade das células na LPA.
O modelo de barreira sangue-ar tem profundas implicações para o estudo de doenças humanas e o desenvolvimento de intervenções terapêuticas. O modelo pode ser usado para rastrear e otimizar agentes terapêuticos, incluindo medicamentos antivirais, fornecendo um ambiente fisiologicamente relevante que imita as vias aéreas humanas, especialmente com a exposição das células das vias aéreas ao ar. Técnicas de nocaute genético podem ser empregadas para estudar mecanismos específicos de disfunção de barreira e interações patógeno-hospedeiro. O modelo oferece uma plataforma para estudar vários aspectos das doenças respiratórias humanas, desde infecções virais até condições crônicas como asma e DPOC. Esse entendimento pode levar ao desenvolvimento de terapias mais eficazes e direcionadas.
Em conclusão, o modelo de barreira ar-sangue da grande via aérea (iAirway) representa uma ferramenta poderosa para estudar a disfunção da barreira devido a infecções virais e outras doenças respiratórias. Garantir a diferenciação bem-sucedida dos tipos de células, enfrentar os desafios de desenvolvimento e explorar aplicações alternativas aumentará a utilidade e a precisão desse modelo. Sua aplicação em estudos de direcionamento terapêutico e nocaute genético ressalta seu potencial no avanço de nossa compreensão e tratamento de doenças respiratórias humanas.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta pesquisa foi apoiada pela CIRM (DISC2COVID19-12022).
Materiais
| Name | Company | Catalog Number | Comments |
| 12 well plates | Corning | 3512 | |
| 12-well inserts, 0.4 µm, translucent | VWR | 10769-208 | |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Accutase | Innovative Cell Tech | AT104 | |
| Activin A | R&D Systems | 338-AC | |
| All-trans retinoic acid (RA) | Sigma-Aldrich | R2625 | |
| ascorbic acid | Sigma | A4544 | |
| B27 without retinoic acid | ThermoFisher | 12587010 | |
| BMP4 | R&D Systems | 314-BP/CF | |
| Bovine serum albumin (BSA) Fraction V, 7.5% solution | Gibco | 15260-037 | |
| Br-cAMP | Sigma-Aldrich | B5386 | |
| CD 14 (FITC) | BioLegend | 982502 | |
| CD 31 PECAM-1(APC) | R&D System | FAB3567A | |
| CD 45 (PE) | BD Biosciences | 560975 | |
| CD 68 (PE) | BioLegend | 33808 | |
| CHIR99021 | Abcam | ab120890 | |
| CPM | Fujifilm | 014-27501 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dispase | StemCellTech | 7913 | |
| DMEM/F12 | Gibco | 10565042 | |
| Dorsomorphin | R&D Systems | 3093 | |
| E-CAD/CD 324 (APC) | BioLegend | 324107 | |
| EGF | R&D Systems | 236-EG | |
| EGM2 Medium | Lonza | CC-3162 | |
| EPCAM/CD 326 (APC) | BioLegend | 324212 | |
| FBS | Gibco | 10082139 | |
| FGF10 | R&D Systems | 345-FG/CF | |
| FGF7 | R&D Systems | 251-KG/CF | |
| Fibronectin | Fisher | 356008 | |
| Forskolin | Abcam | ab120058 | |
| Glutamax | Life Technologies | 35050061 | |
| Ham’s F12 | Invitrogen | 11765-054 | |
| HEPES | Gibco | 15630-080 | |
| IBMX (3-Isobtyl-1-methylxanthine) | Sigma-Aldrich | I5879 | |
| IL-3 | Peprotech | 200-03 | |
| Iscove’s Modified Dulbecco’s Medium (IMDM) + Glutamax | Invitrogen | 31980030 | |
| Knockout Serum Replacement (KSR) | Life Technologies | 10828028 | |
| Matrigel | Corning | 354230 | |
| M-CSF | Peprotech | 300-25 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR plus Kit (10/case) | Stem Cell Tech | 5825 | |
| N2 | ThermoFisher | 17502048 | |
| NEAA | Life Technologies | 11140050 | |
| PBS | Gibco | 10010023 | |
| Pen/strep | Lonza | 17-602F | |
| ReleSR | Stem Cell Tech | 5872 | |
| RPMI1640 + Glutamax | Life Technologies | 12633012 | |
| SB431542 | R&D Systems | 1614 | |
| SCF | PeproTech | 300-07 | |
| SMA | Invitrogen | 50-9760-80 | |
| STEMdiff APEL 2 Medium | STEMCELL Technologies | 5275 | |
| TrypLE Express | Gibco | 12605-028 | |
| VEGF165 | Preprotech | 100-20 | |
| Vimentin | Cell Signaling | 5741S | |
| Y-27632 (Rock Inhibitor) | R&D Systems | 1254/1 | |
| ZO-1 | Invitrogen | 339100 |
Referências
- Wu, M., Zhang, X., Lin, Y., Zeng, Y. Roles of airway basal stem cells in lung homeostasis and regenerative medicine. Respir Res. 23 (1), 122 (2022).
- Blackburn, J. B., Li, N. F., Bartlett, N. W., Richmond, B. W. An update in club cell biology and its potential relevance to chronic obstructive pulmonary disease. Am J Physiol Lung Cell Mol Physiol. 324 (5), L652-L665 (2023).
- Fahy, J. V., Dickey, B. F. Airway mucus function and dysfunction. N Engl J Med. 363 (23), 2233-2247 (2010).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Ann Am Thorac Soc. 15 (Suppl 3), S143-S148 (2018).
- Khalilgharibi, N., Mao, Y. To form and function: On the role of basement membrane mechanics in tissue development, homeostasis and disease. Open Biol. 11 (2), 200360 (2021).
- Mcdonald, D. M., Yao, L. C., Baluk, P. Dynamics of airway blood vessels and lymphatics: Lessons from development and inflammation. Proc Am Thorac Soc. 8 (6), 504-507 (2011).
- Parker, D., Prince, A. Innate immunity in the respiratory epithelium. Am J Respir Cell Mol Biol. 45 (2), 189-201 (2011).
- Davis, J. D., Wypych, T. P. Cellular and functional heterogeneity of the airway epithelium. Mucosal Immunol. 14 (5), 978-990 (2021).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clin Microbiol Rev. 24 (1), 210-229 (2011).
- Fosse, J. H., Haraldsen, G., Falk, K., Edelmann, R. Endothelial cells in emerging viral infections. Front Cardiovasc Med. 8, 619690 (2021).
- Wang, Y., Zheng, J., Wang, X., Yang, P., Zhao, D. Alveolar macrophages and airway hyperresponsiveness associated with respiratory syncytial virus infection. Front Immunol. 13, 1012048 (2022).
- Costa, A., De Souza Carvalho-Wodarz, C., Seabra, V., Sarmento, B., Lehr, C. M. Triple co-culture of human alveolar epithelium, endothelium and macrophages for studying the interaction of nanocarriers with the air-blood barrier. Acta Biomater. 91, 235-247 (2019).
- Leibel, S. L., Mcvicar, R. N., Winquist, A. M., Snyder, E. Y. Generation of 3D whole lung organoids from induced pluripotent stem cells for modeling lung developmental biology and disease. J Vis Exp. (170), e62456 (2021).
- Mccauley, K. B., Hawkins, F., Kotton, D. N. Derivation of epithelial-only airway organoids from human pluripotent stem cells. Curr Protoc Stem Cell Biol. 45 (1), e51 (2018).
- Choi, K. -. Y. G., Wu, B. C., Lee, A. H. -. Y., Baquir, B., Hancock, R. E. W. Utilizing organoid and air-liquid interface models as a screening method in the development of new host defense peptides. Front Cell Infect Microbiol. 10, 228 (2020).
- Fulcher, M. L., Randell, S. H. Human nasal and tracheo-bronchial respiratory epithelial cell culture. Methods Mol Biol. 945, 109-121 (2013).
- Hao, S., et al. Long-term modeling of SARS-COV-2 infection of in vitro cultured polarized human airway epithelium. mBio. 11 (6), e02852-e02920 (2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nat Cell Biol. 17 (8), 994-1003 (2015).
- Van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long-term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), e71098 (2013).
- Pouyanfard, S., et al. Human-induced pluripotent stem cell-derived macrophages ameliorate liver fibrosis. Stem Cells. 39 (12), 1701-1717 (2021).
- Ardini-Poleske, M. E., et al. Lungmap: The molecular atlas of lung development program. Am J Physiol Lung Cell Mol Physiol. 313 (5), L733-L740 (2017).
- Ronaghan, N. J., et al. M1-like, but not m0- or m2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), e0276013 (2022).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Rep. 3 (3), 394-403 (2014).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods. 14 (11), 1097-1106 (2017).
- Firth, A. L., et al. Generation of multiciliated cells in functional airway epithelia from human induced pluripotent stem cells. Proc Natl Acad Sci U S A. 111 (17), E1723-E1730 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados