Method Article
iPSC 衍生的上皮细胞、间充质细胞、内皮细胞和免疫细胞共培养,以模拟肺部健康和疾病中的气道屏障完整性
摘要
本文描述了在气液界面培养物中由诱导多能干细胞 (iPSC) 衍生的肺上皮、间充质、内皮细胞和巨噬细胞组成的复杂多细胞气道屏障模型的生成。
摘要
人体肺组织由上皮、间充质、内皮和免疫细胞的互连网络组成,从鼻咽上气道到最小的肺泡囊。这些细胞之间的相互作用在肺部发育和疾病中至关重要,是抵御有害化学物质和病原体的屏障。目前的 体外 共培养模型利用具有不同生物学背景的永生化细胞系,这些细胞系可能无法准确代表肺的细胞环境或相互作用。我们将人类 iPSC 分化为 3D 肺类器官(包含上皮和间充质)、内皮细胞和巨噬细胞。这些以气液界面 (ALI) 形式共培养,以形成装有巨噬细胞和基底外侧内皮屏障 (iAirway) 的上皮/间充质顶端屏障。iPSC 衍生的 iAirways 显示,在呼吸道病毒和香烟毒素感染后,屏障完整性降低。这种多谱系肺共培养系统为研究细胞相互作用、信号通路以及肺发育、稳态和疾病进展的分子机制提供了一个平台。iAirways 密切模拟人类生理学和细胞相互作用,可以从患者来源的 iPSC 生成,并且可以定制以包括气道的不同细胞类型。总体而言,iPSC 衍生的 iAirway 模型为研究屏障完整性提供了一种多功能且强大的工具,以更好地了解疾病、病原体反应、免疫调节以及体外药物发现或再利用的遗传驱动 因素,并有可能促进我们对气道疾病的理解和治疗。
引言
大气道中的血气屏障包括气管、支气管和细支气管。它在维持呼吸系统健康方面起着至关重要的作用,由气道上皮、基底膜、血管和内皮细胞以及免疫细胞组成。气道中的原代上皮细胞包括基底细胞、俱乐部细胞、纤毛细胞和杯状细胞。基底细胞作为气道上皮细胞,是具有高增殖和自我更新能力的多能祖细胞,可产生成熟的气道上皮细胞1。俱乐部细胞是非纤毛的分泌细胞,通过分泌保护性蛋白和表面活性剂来帮助维持气道内壁2。杯状细胞位于管腔和粘膜下腺体中,分泌粘蛋白以捕获碎片并保护气道3。纤毛细胞是粘膜纤毛自动扶梯机制不可或缺的一部分,可防止有害微生物的积累4。基底膜由细胞外基质组成,细胞外基质提供结构支撑5。气管和气道的其余部分被丰富的血管网络包围,这些血管网络内衬着内皮细胞,这些细胞通过提供营养和氧气、清除废物、调节炎症以及促进组织修复和血管生成,在支持气管功能方面发挥着至关重要的作用6。最后,气道巨噬细胞是组织特异性免疫细胞,对于保护呼吸系统免受感染、清除吸入颗粒和维持平衡的免疫反应至关重要7。
上皮细胞、间充质细胞、内皮细胞和巨噬细胞的协调作用对于对气道中病原体的有效免疫反应至关重要8。上皮细胞通过充当物理屏障形成抵御病毒感染的第一道防线,紧密的连接限制有害物质的通过。纤毛细胞和杯状细胞的协调作用有助于捕获和清除吸入的颗粒、病原体和碎片4。此外,气道上皮细胞产生细胞因子和趋化因子来募集免疫细胞9。内皮细胞维持血管完整性,防止病毒颗粒通过血液传播,上调粘附分子 (VCAM-1) 以促进免疫细胞粘附,并产生促炎细胞因子以将免疫细胞从血液募集到感染部位10。气道巨噬细胞吞噬和消化病毒颗粒、感染细胞和碎片,将病毒抗原呈递给 T 细胞,并产生细胞因子来激活和募集其他免疫细胞,以及 I 型干扰素来抑制病毒复制11。上皮细胞、间充质细胞、内皮细胞和巨噬细胞的协调作用创造了一个强大而动态的防御系统,保护气道免受病毒感染并维持呼吸系统健康。
了解人肺中各种细胞类型之间的动态相互作用对于理解肺对病毒感染、炎症性疾病和药物输送的反应至关重要。体外共培养允许研究上皮细胞、内皮细胞和先天免疫细胞之间的细胞间信号传导12。我们开发了第一个源自患者特异性 hiPSCs 的真实多细胞型肺模型13。它包含上皮细胞群和间充质细胞群,以 3D 方向形成。随后,肺祖细胞可以分化为"气道类器官"14,培养到无菌细胞培养插入物上,并暴露于气液界面 (ALI),复制人类气道的条件 15,16,17。iPSC 衍生的内皮细胞在膜的基底外侧培养,模拟它们在人体气道中的定向,位于基底膜上皮/间充质层下方。最后,iPSC 衍生的巨噬细胞被添加到膜的顶端,与上皮细胞相互作用并等待激活信号(图 1A)。该模型准确地再现了气道的生物学和功能。我们假设 hiPSC 衍生的、患者特异性的、真实的多细胞型 iAirway 培养物最适合阐明气道屏障和病原体(包括病毒感染)的内在急性反应。例如,该模型可用于 (1) 研究病毒进入和复制,(2) 研究上皮和组织特异性免疫细胞的初始免疫反应,(3) 检查屏障完整性和功能,(4) 测试治疗剂的疗效,以及 (5) 在患者特异性模型中研究发病机制的细胞和分子机制。
本文描述了制备多细胞肺共培养物以研究细胞对病毒感染的反应的详细方案。
研究方案
该研究方案已获得 UCSD 人类研究保护计划 (181180) 机构审查委员会的批准。该方案使用小分子和生长因子来指导多能干细胞分化为气道细胞、内皮细胞和巨噬细胞。然后将这些细胞共培养到细胞培养小室上,并在气液界面中极化。材料 表中列出了所用试剂、耗材和设备的详细信息。培养基和缓冲液成分在 补充文件 1 中提供。
1. 生成 iPSC 来源的气道类器官(第 1 - 30 天)
注意:该协议概述了按照 Leibel 等人 13 中描述的方法生成 iPSC 衍生的气道类器官(图 1B)所需的步骤。该过程包括诱导最终内胚层(第 1-3 天)、前肠前肠内胚层的产生(第 4-6 天)和分化为肺祖细胞(第 7-16 天)。详细的方法可以在以前的出版物13 中找到。以下步骤详细介绍了从肺祖细胞产生气道类器官。
- 从 ECM 聚合物中提取和解离肺祖细胞球体(第 17 天)
- 在冰上解冻细胞外基质 (ECM) 聚合物 (8-9 mg/mL)。
- 使用真空抽吸器从嵌入 ECM 中的肺类器官中吸出用过的培养基。
注意:对于后续的吸液步骤,除非另有说明,否则请使用真空吸液器。 - 向细胞中加入 1 mL 补充有 10 μM ROCK1 抑制剂 (ROCKi) 的 2 U/mL 分散酶,并使用 P1000 移液器手动重悬 ECM 中的肺祖细胞。在 37 °C 下孵育 30 分钟,每 15 分钟重悬一次混合物,以通过机械处理提高分散酶解离效率。
- 使用前 15 分钟,将 45 mL 室温 PBS 放入 -20 °C 冰箱中冷却。确保 PBS 温度低于 4 °C,以便在后续步骤中实现最佳 ECM 解聚。
- 分散酶孵育 30 分钟后,将类器官和分散酶溶液转移到 15 mL 锥形管中。
- 加入冷冻的 PBS(每 1 mL 蛋白酶 2 mL)以洗涤并从板中收集残留的类器官和 ECM 材料。使用 P1000 移液器重悬类器官,并以 400 x g 离心 5 分钟。
注:除非本协议中另有规定,否则所有离心步骤均在室温下进行。 - 离心后,应该可以看到带有类器官的浑浊 ECM 沉淀。 通过 移液管小心吸出上清液,避免 ECM 沉淀。
- 用冷冻的 PBS 进行第二次 PBS 洗涤,使用 P1000 移液器重悬,并以 400 x g 离心 5 分钟。 通过 移液管吸出上清液,留下 ~100 μL 残留溶液。
- 将 2 mL 胰蛋白酶样蛋白酶添加到 15 mL 锥形管中的类器官中。使用 P1000 移液器重悬。在 37 °C 下孵育 10-12 分钟,倒置或轻弹试管以在孵育过程中重悬混合物。
注:进行 10-12 分钟的胰蛋白酶样蛋白酶解离,以将类器官作为聚集体传递。 - 12 分钟后,通过在基础培养基中加入 2 mL 2% FBS 来终止胰蛋白酶样蛋白酶反应(终止培养基,参见 补充文件 1)。用 P1000 移液器重悬溶液,并以 400 x g 离心 5 分钟。
- 吸出上清液,并在补充有 10 μM ROCKi 的终止培养基中重悬类器官。取 10 μL 样品,使用血球计数器和台盼蓝进行细胞计数。在计数过程中将类器官保持在冰上。
- 计算每孔获得 100,000 个细胞所需的体积。将细胞聚集体分装到 1.5 mL 微量离心管中,并以 400 x g 离心 5 分钟。去除多余的上清液,留下 10 μL 残留培养基。
- 将细胞沉淀重悬于 200 μL 冷 ECM 聚合物中(避免气泡并快速工作以防止过早聚合)。在 12 孔板的每个孔底部添加 200 μL ECM 和细胞混合物。让 ECM 在室温下在生物安全柜中部分聚合 5 分钟。
- 将板转移到 37 °C 培养箱中 30-60 分钟以完成 ECM 聚合。然后,加入 1.5 mL 气道类器官诱导培养基(补充文件 1)。
- 每隔一天更换培养基 14 天,直到第 30 天。如果培养基在 24 小时内变黄,则将体积增加到 2 mL。
2. iPSC 来源的内皮细胞的产生(第 1 - 14 天)
注意:以下程序详细介绍了从 iPSC 产生内皮细胞(图 1C),改编自 Patsch 等人 18。该方法包括板的制备、iPSC 的分化、内皮细胞诱导、分选和扩增。 表 1 列出了本研究中使用的抗体。
- 用于内皮分化的 iPSC 接种(第 0 天)
- 当 hiPSC 达到 70%-80% 汇合时,开始内皮细胞分化。解离前一小时向每个孔中加入 10 μM ROCKi Y-27632。
- 吸出培养基,用 1 mL PBS 洗涤孔,然后在 12 孔板的每孔中加入 1 mL 细胞分离溶液来解离 iPSC。在 37 °C 下孵育 20 分钟。
- 通过向孔中加入 2 mL 终止培养基来中和细胞分离溶液。移液以获得单细胞悬液。将细胞转移至 15 mL 锥形管中,并以 300 x g 的离心速度离心 5 分钟。
- 吸出上清液,在补充有 10 μM ROCKi 的 iPSC 培养基中重悬 iPSC,并进行细胞计数。在 1 mL 含 10 μM ROCKi 的 iPSC 培养基中,每孔接种 100,000 个 ECM 包被的 12 孔板。在 37 °C 下孵育过夜。
注:iPSC 内皮分化的接种密度可能需要优化每个细胞系。在第 6 天使用流式细胞术评估 CD31 的分化效率。
- 外侧中胚层诱导(第 1-3 天)
- 从铺板的 iPSC 中吸出 iPSC 培养基,每孔加入 3 mL N2B27 基础培养基,补充有 6 μM CHIR 和 25 ng/mL BMP4(补充文件 1)。在将培养基添加到细胞中之前加热培养基。3 天内不要更换介质。
- 内皮细胞诱导(第 4-5 天)
- 第 4 天,吸出 N2B27 培养基,每孔加入 2 mL 内皮分化培养基 (EDM),补充有 200 ng/mL VEGF165 和 2 μM 毛喉素。在第 5 天更换媒体。
- 内皮细胞分选和重新接种(第 6 天)
- 在第 5 天或第 6 天,通过在无菌水中重构 1 mg 纤连蛋白以制备 100 μg/mL 纤连蛋白溶液,制备用于荧光激活细胞分选 (FACS) 富集的纤连蛋白包被的 T75 培养瓶。用 6 mL 纤连蛋白溶液包被 T75 培养瓶,并在室温下孵育 1 小时。吸出纤连蛋白溶液并用无菌水洗涤。让 T75 培养瓶在室温下干燥。制作的额外烧瓶可以储存在 4 °C 下。
- 准备内皮维持培养基 (EMM)18。
- 第 6 天,使用 CD31 抗体 18 通过 FACS 富集 iPSC 衍生的内皮细胞。
- 在 37°C 解离前一小时向每个孔中加入 10 μM ROCKi Y-27632。 吸出培养基并用 PBS 洗涤。在 12 孔板的每孔中加入 1 mL 预热的细胞分离溶液,并在 37°C 下孵育 8-10 分钟。
- 轻轻移液以确保单细胞分离。将细胞转移至 15 mL 锥形管中,并加入等体积的终止培养基。以 300 x g 离心 5 分钟。
- 吸出上清液,将内皮细胞重悬于补充有 10 μM ROCKi 的 1 mL 终止培养基中。 首先加入 1 mL 终止培养基以润湿过滤器,然后将细胞移液通过过滤器,使细胞通过 70 μm 过滤器。取 10 μL 样品,使用血球计数器和台盼蓝进行细胞计数。在计数过程中将细胞保持在冰上。
- 进行细胞计数。准备 200,000 个细胞的等分试样作为未染色的阴性对照。将剩余的细胞转移到 1.5 mL Eppendorf 管中,并在 100 μL FACS 缓冲液中每 100 万个细胞添加 10 μL CD31-APC。在 4 °C 下在旋转器上孵育 30 分钟。
- 孵育完成后,将含有细胞的 Eppendorf 管以 300 x g 离心 5 分钟,加入 1 mL PBS 洗涤细胞。重复洗涤和离心步骤两次。在两次洗涤之间手动去除上清液。
- 分选前 5 分钟,将细胞沉淀重悬于 1 mL FACS 缓冲液和 5 ug/mL DAPI 溶液中进行活力染色。根据机构指南排序。
- 将 FACS 分选的细胞收集在装有 2 mL EMM 的 15 mL 锥形管中。将装有细胞的 15 mL 锥形管以 300 x g 离心 5 分钟。吸出上清液,将内皮细胞重悬于 10 mL 补充有 10 μM ROCKi Y-27632 和青霉素链霉素 (1%) 的 EMM 中。
- 将重悬的富含 FACS 的 iPSC 衍生的内皮细胞转移到纤连蛋白包被的培养瓶中。均匀分布细胞并置于 37 °C 培养箱中过夜。
注:每个 T75 培养瓶使用最少 500,000 个细胞,最多使用 2,000,000 个细胞。
- 分选内皮细胞的扩增和冷冻保存(第 7 天+)
- FACS 富集后每 2-3 天更换一次 EMM 培养基。一旦 T75 培养瓶汇合(FACS 后约 7 天,取决于接种密度),iPSC 衍生的内皮细胞可用于共培养或冻存以备将来使用。
- 在细胞解离之前准备 2x 内皮冷冻溶液(80% Endo-CM2、20% DMSO、20 μM ROCKi)。
- 在防乙醇笔中用相应的信息标记冷冻管。行 ID、传代号、培养基、"解冻至 6 孔"、冻结日期。
- 当分选的 iPSC 衍生的内皮细胞汇合时,开始解离。
- 用 5ml PBS -/- 洗涤 T75 烧瓶。
- 每 T75 用 5mL 胰蛋白酶解离 iPSC 衍生的内皮细胞。将细胞在 37 °C 下孵育 10 分钟,定期检查 T75 以验证细胞是否已提升。
- 通过添加 5 mL 终止培养基来中和反应。将 10 mL 溶液中的细胞转移到 15 mL 试管中。以 300 x g 离心 5 分钟。
- 吸出上清液,将内皮细胞重悬于 E-CBM 培养基中,然后取出 10 μL 样品 通过血细胞 计数器计数。
- 细胞计数后,每 0.5 mL EGM2 培养基分装 100 万个细胞。
注意:以下步骤对时间敏感。准备冻存管和冷冻容器以立即使用。 - 将等体积的 2x 冷冻溶液分装到内皮细胞中。终浓度为 90% Endo-CM2、10% DMO 和 10 μM ROCKi(1 mL/100 万个细胞)。
- 立即将加盖的样品瓶转移到冷冻室中,在 -80 °C 下放置过夜,然后在第二天放入液氮 (-180 °C) 中长期储存。
3. iPSC 衍生巨噬细胞的产生(第 1 - 26 天)
注:该程序概述了从 iPSC 生成巨噬细胞的步骤(图 1D),改编自 van Wilgenburg 等人 19 和 Pouyanfard 等人 20。它涵盖了 iPSC 的单细胞适应、胚状体分化、巨噬细胞祖细胞形成和巨噬细胞成熟。
- iPSC 的单细胞驯化
- 当 iPSC 达到 ~70%-90% 汇合且没有明显的分化迹象时,用胰蛋白酶样蛋白酶开始单细胞传代。
- 吸出用过的培养基并用 PBS 冲洗。去除 PBS 并添加胰蛋白酶样蛋白酶(6 孔板 1 mL/孔,12 孔板 500 μL/孔)。在 37 °C 下孵育 2-5 分钟,直到 iPSC 集落从板中解离。
- 用等体积的终止培养基(6 孔板 1 mL/孔,12 孔板 500 μL/孔)中和胰蛋白酶样蛋白酶。将细胞以 200 x g 离心 5 分钟。
- 吸出上清液,并在含有 10 μM ROCKi 的 iPSC 培养基中轻轻重悬细胞。传代到新的 ECM 包被板上。重复 2-3 代,然后冷冻保存或使用单细胞驯化的 iPSC。
注:根据细胞健康状况和适应性将传代比从 1:2 调整为 1:10。此外,经过至少 3 次单细胞传代且处于低传代状态的 iPSC 可产生最佳的巨噬细胞分化。
- 胚状体形成(第 0-6 天)
- 当单细胞驯化的 iPSC 达到 ~75% 汇合时,按照步骤 3.1-3.4 用胰蛋白酶传代 iPSC。
- 将细胞重悬于终止培养基中,并通过 70 μm 细胞过滤器进入新的 50 mL 锥形管中以去除团块。重悬细胞 并通过血细胞 计数器取 10 μL 样品进行细胞计数。
- 对于胚状体 (EB) 生成,在 96 孔超低附着 (ULA) 板的每孔中接种 8,000-50,000 个细胞。计算接种 96 孔 ULA 板的 60 个孔所需的细胞总数。
注:iPSC 的接种密度可能需要优化每个细胞系。 - 在 15 mL 锥形中以 200 x g 离心 iPSC 5 分钟。吸出上清液。
- 对于 480,000 个 iPSC(8,000 个细胞/孔,60 个孔),重悬于 6 mL(100 ul/孔,60 孔)EB 诱导培养基中。
- 将 150 μL PBS 添加到圆底 96 孔 ULA 板的 36 个外孔中。
- 重悬 EB 培养基中的 iPSC 并将其转移到培养基槽中。使用多通道移液器,将 100 μL/孔的细胞悬液添加到 96 孔 ULA 板的中心 60 个孔中。间歇性地将 iPSC 重悬于 EB 培养基中,以确保细胞分布均匀。
- 将 96 孔板在 4 °C 下以 300 x g 离心 5 分钟(如果可用)。将板转移到 37 °C 培养箱中。
- 48-72 小时后,更换 50 μL 培养基(更换一半培养基)。6 天后检查囊肿形成。
注意:一些 iPSC 细胞系比其他细胞系更早或更容易形成 EB。监测 EB 形成并确保 EB 在适当的时间点转移(它们应该正在形成囊肿)。
- 明胶涂层和 EB 转移用于巨噬细胞祖细胞形成(第 6-19 天)
- 准备两个 0.1% 明胶包被的 6 孔板。每孔加入 1 mL 0.1% 明胶,并在室温下孵育 20 分钟。吸出明胶溶液,让板在罩中干燥 30-60 分钟。
- 使用 2 mL 血清移液管将 EB 从 96 孔板转移到明胶包被的 6 孔板中。在 6 孔明胶包被板的每孔中分配大约 8-10 个 EB。
- 小心地去除转印过程中残留的 EB 培养基。每孔加入 2 mL 巨噬细胞培养基 1 (Mac-CM1)。将 EB 在 37 °C 和 5% CO2 下原封不动地孵育 5-7 天。
注:理想情况下,一个 96 孔的胚状体板可以分成两个 6 孔板。如果 EB 发育不良,可以调整每个 6 孔板转移的 EB 数量,以优化 iPSC 到胚状体的分化步骤。
- 巨噬细胞祖细胞生成
- 每周更换 2/3 的培养基 2 次,如果培养基颜色发生变化,将体积增加到 3 mL。
- 检查第 8-19 天之间的培养物,以确定它们是否准备好进行巨噬细胞祖细胞收获。如果 EB 分离,则将 EB 转移到含有 Mac-CM1 的新鲜涂层板中,并在原样下孵育 7 天。
注意:巨噬细胞祖细胞形成复合物的维持对于巨噬细胞祖细胞的发育和持续生成至关重要。优化的巨噬细胞祖细胞形成复合物将在 2-6+ 个月内持续产生髓系祖细胞。
- 收获髓系祖细胞(第 19-26 天+)
- 当存在悬浮的巨噬细胞祖细胞时,收获带有细胞的培养基并转移到 50 mL 锥形管中。以 200 x g 离心 5 分钟,然后小心去除上清液。
- 在 Mac-CM2 中重悬巨噬细胞祖细胞,并转移到未经处理的无菌培养皿/培养瓶中。在 37 °C 和 5% CO2 下孵育 3-4 天。
注:根据收获的细胞数量,转移至装有适当体积培养基的 10 cm 培养皿(6 孔板的 3-4 孔)、T25 培养瓶(6 孔板的 1-2 孔)或 T75 培养瓶(完整的 6 孔板)。T25 培养瓶使用 5-6 mL 培养基,培养皿中使用 10-12 mL 培养基,T75 培养瓶使用 12-15 mL 培养基。对于后续收获,如果髓系祖细胞和巨噬细胞来自同一系/髓系形成复合物,则可以从先前的收获中汇集它们。只需确保培养瓶足以维持和补料培养瓶中的细胞数量即可。巨噬细胞不增殖;它们由巨噬细胞祖细胞产生。巨噬细胞可以汇集并维持 2-6 周而不会丢失表达标志物。
- 收获巨噬细胞
注:在 Mac-CM2 培养基中分化巨噬细胞 14 天后,巨噬细胞培养物可直接进行共培养或流式细胞术分析。- 收集用过的培养基并转移到 50 mL 锥形管中。用 PBS 冲洗培养瓶/板以去除残留培养基和细胞。
- 向培养瓶中加入基础培养基(T25 为 3 mL,T75 为 5 mL),并使用无菌细胞刮刀将细胞从培养瓶/板底部分离。将细胞转移到锥形管中,必要时重复刮擦。
- 在室温下以 200 x g 离心 5 分钟。小心去除上清液,将细胞重悬于适当的培养基或缓冲液中以备进一步使用。
4. 气道细胞、内皮细胞和巨噬细胞的共培养
注:该程序描述了使用细胞培养插入物共培养气道细胞、内皮细胞和巨噬细胞(图 1A)的步骤,改编自 Costa 等人 12。
- 用于共培养的细胞培养小室的 ECM 涂层(共培养的第 0 天)
- 用 4 mg/mL ECM 溶液包被 3.0 μm 孔径聚酯 (PET) 细胞培养小室。用 4 mg/mL 的 ECM 溶液短暂包被板内细胞培养小室的顶端。吸出残留的 ECM 溶液。将板在37°C的培养箱中放置1小时。
- 获得一个大培养皿(100 毫米 x 20 毫米或 150 毫米 x 20 毫米)。使用干净的镊子,将细胞培养小室从 12 孔板无菌转移到大培养皿中。倒置插入物,使基底外侧直立。
- 用 4 mg/mL ECM 溶液涂覆基底外侧。吸出残留的 ECM 溶液。将带有 ECM 涂层细胞培养小室的培养皿放入 37 °C 培养箱中干燥过夜。
- iPSC 衍生的内皮细胞的解离和铺板(共培养的第 1 天)
- 用 PBS 洗涤 T75 培养瓶并吸出溶液。向 T75 培养瓶中加入 5 mL 胰蛋白酶样蛋白酶,并在 37 °C 下孵育 8 分钟。目视评估内皮细胞是否已从培养瓶中抬起。
注意:如果 iPSC 衍生的内皮细胞尚未从培养瓶中升起,则增加 typin 样蛋白酶解离的时间。 - 轻敲培养瓶以确保内皮细胞分离,并将细胞转移到 15 mL 锥形瓶中。加入 5 mL 终止培养基以停止解离。将细胞以 300 x g 离心 5 分钟。
- 吸出上清液,并将细胞沉淀重悬于 1 mL 含 10 μM ROCKi 的内皮培养基中。获取 10 μL 重悬溶液进行细胞计数,并在计数过程中将细胞置于冰上。
- 在 100 μL 内皮培养基中,每 12 mm 细胞培养小室使用 150,000 个 iPSC-内皮细胞。调整相应的培养基体积,以达到每个插入片段所需的细胞数。
- 从培养箱中获得带有 ECM 涂层的 3.0 μm 细胞培养插入物的培养皿(参见步骤 4.1-4.3)。
- 重悬 iPSC 内皮细胞,并将 100 μL 含 150,000 个细胞移液到倒置的细胞培养插入物上(基底外侧朝上)。对每个制备的细胞培养小室重复移液
- 小心地将细胞转移到培养箱中,并保持 3 小时不受干扰。
- 在 12 孔板中,在每个孔中加入 1 mL 内皮培养基(针对制备的相应数量的细胞培养插入物)。
- 从培养箱中取出装有内皮细胞的培养皿。使用干净的镊子,小心地将细胞培养小室转移到装有内皮培养基的板中(翻转小室,使底部现在朝下进入培养基)。
- 在显微镜上目视验证内皮细胞是否粘附。将板置于 37 °C 培养箱中过夜。
- 用 PBS 洗涤 T75 培养瓶并吸出溶液。向 T75 培养瓶中加入 5 mL 胰蛋白酶样蛋白酶,并在 37 °C 下孵育 8 分钟。目视评估内皮细胞是否已从培养瓶中抬起。
- iPSC 来源的气道类器官的解离和铺板(共培养的第 2 天)
注:请参阅步骤 1.1.1-1.1.15 从 ECM 聚合物中分离气道类器官。将胰蛋白酶样蛋白酶(步骤 1.1.10)解离的持续时间修改至 15-20 分钟,以获得单细胞悬液。- 15-20 分钟后,加入 3 mL 终止培养基,终止胰蛋白酶样蛋白酶反应。用 P1000 移液器重悬溶液,并以 400 x g 离心 5 分钟。
- 吸出上清液,并将气道类器官重悬于含有 10 μM ROCKi 的 1 mL 气道扩增培养基中。取 10 μL 样品进行血细胞计数器细胞计数,并在计数过程中将细胞置于冰上。
- 每 12 mm 细胞培养插入物在 500 μL 气道扩增培养基中接种 300,000 个 iPSC-气道细胞。调整相应的培养基体积,以达到每个准备好的插入片段所需的细胞数。
- 从37°C培养箱中取出带有内皮细胞(接种在基底外侧)的细胞培养插入物的板。
- 重悬 iPSC 气道细胞,并将 500 μL 和 300,000 个细胞移液到每个细胞培养插入室的顶腔中。将板置于 37 °C 培养箱中 48 小时,顶端细胞在液 - 液条件下。
- 气升共培养(共培养第 4 天)
- 从细胞培养小室的顶端侧去除培养基。将基底外侧培养基更换为 1:1 气道分化培养基和内皮培养基。将板放回培养箱中。
- iPSC 衍生的巨噬细胞的解离和铺板(共培养的第 5 天)
- 使用细胞刮刀从培养瓶中解离 iPSC 衍生的巨噬细胞(参见步骤 3.22-3.24)。以 300 x g 离心 5 分钟并吸出上清液。
- 将 iPSC 巨噬细胞重悬于 1 mL Mac-CM2 中。取 10 μL 样品进行细胞计数,并在计数过程中将细胞置于冰上。巨噬细胞的数量将反映接种的气道细胞数量(巨噬细胞与气道细胞的比例为 1:1)。
- 细胞计数后,将 300,000 个巨噬细胞分装在 35 μL 培养基中,将制备好的细胞培养小室放入 1.5 mL 微量离心管中。以 200 x g 离心 5 分钟。
- 离心后,吸出上清液。从计算中将巨噬细胞重悬于相应的 Mac-CM2 中。
- 从培养箱中取出与内皮细胞和气道细胞共培养物的插入片段。将 300,000 个巨噬细胞在 35 μL Mac-CM2 中接种到细胞培养插入物的顶端侧。将板置于 37 °C 培养箱中 48 小时。
注:为了确认 iPSC 免疫细胞对细胞培养小室的粘附性,可以用荧光探针标记细胞。 通过 显微镜确认巨噬细胞接种后 48 小时荧光信号的依从性。
- 三重共培养(共培养第 7 天)
- 确保共培养物已准备好用于下游应用,例如感染研究、跨上皮电阻 (TEER) 测量和屏障完整性测定。
结果
在多个阶段,iPSC 来源的气道类器官、内皮细胞、免疫细胞和共培养物的分化可以评估为成功完成。可以在不同的 iPSC 细胞系中进行分化,并且该方案已在至少五种不同的细胞系中进行了测试。该方案确实需要适应每个新的 iPSC 系,特别是通过修改和优化接种密度。
iPSC 来源的气道类器官的成功产量 可以通过明场 进行评估,并且具有四个特征:明确的边界/边缘、半透明/囊性形态、增殖/扩增能力以及缺乏坏死细胞。看起来模糊的气道类器官在培养 2 周后不会增加大小,并且有坏死,不应用于共培养实验。外围具有厚管腔层的类器官 vs.半透明/囊性类器官仍可用于后续实验。然而,半透明/囊性气道类器官主要由基底细胞组成,而厚的双膜类器官主要由俱乐部细胞组成。由于基底细胞易于增殖和扩增,因此它们更适合气液间期培养和极化。评估 iPSC 衍生的肺类器官成功产量的其他方法是在肺祖细胞阶段(分化的第 16 天)对表面标志物 CPM 进行流式细胞术分析(表 1),成功分化产生 >50% CPM + 细胞。
对于气道类器官解离和气液间期培养,确保所有 ECM 聚合物都已被去除,否则会阻止细胞在膜上扩增。细胞应在培养的第 3 天,即气升之前汇合。可以通过对相应的细胞类型特异性标志物进行染色来评估 iAirways 中细胞类型的确认:基底细胞 (p63+)、俱乐部细胞 (SCGB1A1+)、杯状细胞 (MUC5AC+) 和纤毛细胞 (AcTub+)。表征和标志肺细胞类型特异性标志物在 LungMAP21 上得到验证。间充质可以用抗波形蛋白或平滑肌肌动蛋白的抗体来检测。为了产生更多的纤毛细胞,培养物可能需要更长时间的空气提升或添加 DAPT。
可以通过 明场 评估 iPSC 衍生的内皮细胞的成功产量,显示鹅卵石状形态(iPSC 衍生的内皮分化的第 6 天)。成功的 iPSC 衍生内皮培养物将含有 >50% 的 CD31+ 细胞,并且应产生足够的细胞,以便在分选后,产量应超过 500,000 个细胞。细胞可以传代或冻存,每次传代或新培养物都应 通过 流式检测 CD31 标志物。细胞不应传代超过 P4。有关参考,请参阅 iPSC 衍生的 CD31 前/后内皮细胞排序(图 1C)。内皮细胞将是扁平的,具有细长和纺锤形形态的大细胞体。
对于巨噬细胞分化,胚状体应保持在 ULA 孔的底部,并且每个孔中应只有一个 EB。他们应该在第 5-7 天出现囊性变化。如果离心后没有形成 EB,则将 iPSC 接种到 96 孔 ULA 板中,无需旋转。可能需要增加 iPSC 的数量。iPSC 来源的免疫细胞的成功产量完全取决于拟胚体 (EB) 发育成包囊的能力(分化第 7 天)。不产生包囊的 iPSC 衍生免疫 EB 在接种到明胶上时不会形成基质,也不会产生髓系祖细胞。转移到明胶包被板后,EB 应保持附着在板的底部。板的移动应小心进行,以免它们脱落。应每周手动更换板两次,并将悬浮细胞传代到 Mac-CM2 中或冷冻保存。此外,收获悬浮的髓系祖细胞后,它们应粘附在未涂层的塑料瓶上,并在明场下产生带有液泡的明亮细胞,表明巨噬细胞。悬浮细胞中单核细胞的标志物 CD14 + 应为 >90%。巨噬细胞标志物 CD68 应随着时间的推移而增加,~50% 的巨噬细胞在 2 周后表达 CD68 +(图 1D)。应确定每个细胞系的粘附效率。我们实现了平均 20% 的粘合效率。对于极化,将 M0 巨噬细胞在补充有不同刺激的分化培养基 II 中极化为 M1 (iPSC-M1) 或 M2 (iPSC-M2) 巨噬细胞 48 小时:100 ng/mL LPS 和 20 ng/mL IFN-g 用于 M1 极化或 50 ng/mL IL-4 和 20 ng/mL IL-13用于 M2 极化。M1 极化的标志物是 CD80+,M2 极化是 CD206+。
可以通过免疫荧光评估上皮紧密连接标志物 EPCAM、ECAD 或 ZO-1 或内皮紧密连接标志物 CD31 的三重共培养的成功生成(图 2C,表 1)。三重共培养的功能也可以通过跨上皮/内皮电阻 (TEER) 进行评估。组装良好的气道类器官和内皮共培养物将具有更大的电阻,表明最佳的细胞通讯和连接。环境侮辱,如电子烟或病毒攻击,会损害上皮和内皮屏障的完整性,导致共培养物的电阻降低(图 3A、B)和杂乱无章的紧密连接(图 3C)。

图 1:iPSC 来源的气道上皮、内皮和免疫培养物的分化和表征。 (A) iAirway 组装的 iPSC 定向分化示意图。(B) iPSC 来源的气道上皮类器官,以 EPCAM 和 ECAD 的明场(左)和流式细胞术分析(右)为特征。(C) iPSC 来源的气道内皮,以 CD31 的明场(左)、免疫荧光和流式细胞术分析(右)为特征。CD31 排序后的相应明场显示在右侧。(D) 通过泛造血标志物 CD45、单核细胞制造者 CD14 和巨噬细胞标志物 CD68 的明场分析(左)和流式细胞术分析(右)来表征 iPSC 衍生的巨噬细胞。比例尺:100 μm。 请点击此处查看此图的较大版本。
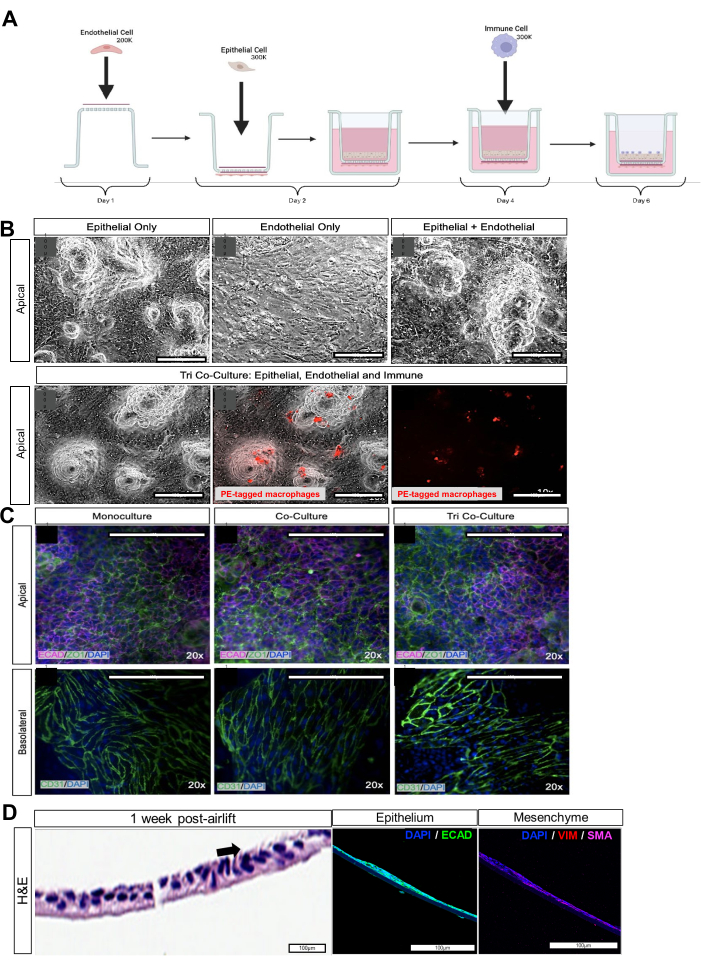
图 2:iPSC 来源的上皮细胞、间充质细胞、内皮细胞和巨噬细胞的共培养。 (A) iAirway 的组装示意图。(B) 各自的上皮和内皮单培养、上皮和内皮双培养以及上皮、内皮和巨噬细胞共培养的明场图像。用红色 cytotracker 标记的巨噬细胞。比例尺:100 μm。(C) 细胞培养小室顶端的紧密连接标志物 ZO-1 和基底外侧的 CD31 的免疫荧光染色。比例尺:100 μm。(D) 气升后 1 周,顶端带有解离气道类器官的细胞培养插入片段的横截面。带有黑色箭头的 H&E 染色的左面板显示了纤毛细胞。中间的面板,通过免疫荧光成像,显示了上皮标志物 E-钙粘蛋白 (ECAD)。右图通过免疫荧光成像显示间充质标志物,如波形蛋白 (VIM) 和平滑肌肌动蛋白 (SMA)。比例尺:100 μm。 请点击此处查看此图的较大版本。
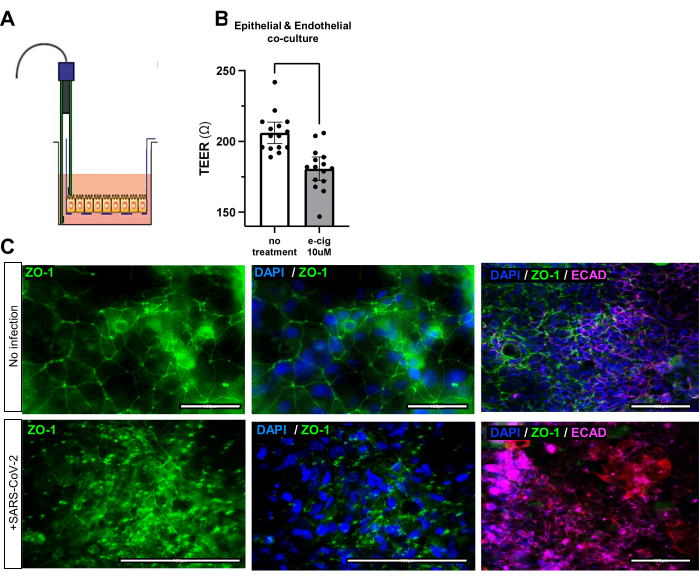
图 3:暴露于电子烟和病毒的 iAirways 气道屏障功能的变化。(A) 跨式电上皮/内皮阻力 (TEER) 测量工具示意图。(B) 将薄荷醇电子烟添加到培养基中 7 天后的 TEER 条形图。平均值 +/- 95% 置信区间。N = 5 个生物学重复和 3 个技术重复; p 值 <0.001。(C) 感染 SARS-CoV-2 前后紧密连接蛋白 ZO-1 的免疫荧光染色。注意感染后 ZO-1 的无序布局。比例尺:50 μm。 请点击此处查看此图的较大版本。
| 抗体 | 应用 | 稀释 |
| CD 31 PECAM-1(APC) | 流式细胞术 (FC) | 10 μl 在 100 ul 缓冲液中 |
| EPCAM/CD 326 (APC) | 燃料电池 | 1:500 |
| E-CAD/CD 324 (APC) | 燃料电池 | 5 μl 在 100 μL 缓冲液中 |
| 每千次展示费用 | 燃料电池 | 1:200 |
| CD 45 (PE) | 燃料电池 | 5 μl 在 100 μL 缓冲液中 |
| CD 14 (FITC) | 燃料电池 | 5 μl 在 100 μL 缓冲液中 |
| CD 68 (PE) | 燃料电池 | 5 μl 在 100 μL 缓冲液中 |
| 唑-1 | 免疫荧光 (IF) | 1:300 |
| 波形蛋白 | 如果 | 1:200 |
| SMA | 如果 | 1:100 |
表 1:FACS 和免疫荧光中使用的抗体。
补充文件 1:培养基和缓冲液成分。请点击此处下载此文件。
讨论
用于研究病毒感染和其他毒素的大气道血气屏障模型的开发和实施需要对细节一丝不苟,以确保所涉及的各种细胞类型的成功分化和功能。本讨论将讨论成功分化的关键因素、潜在挑战、替代应用以及对研究人类疾病的影响。
为确保成功分化,关注细胞培养小室的类型和孔径非常重要。应使用大孔来确保细胞间通过 ECM 层通讯。确保诱导多能干细胞 (iPSC) 系的最佳接种密度至关重要。适当的密度有助于均匀分化并防止形成不需要的细胞团块,从而形成更均匀和功能更强的上皮层。为了保持健康和功能性的上皮层,在添加任何化合物、毒素或病毒之前清洗根尖表面很重要。这有助于去除积聚的粘液、死细胞和其他碎片,从而促进稳定和可行的培养环境,并允许进入上皮细胞。
对于内皮成分,必须确保细胞正确分选且均匀。这可以通过 FACS 等技术来实现,该技术确保仅使用所需的内皮细胞,从而保持一致性和功能。
对于巨噬细胞成分,尽管巨噬细胞很容易粘附在塑料上,但不能很好地粘附在顶端上皮细胞上。增加巨噬细胞的数量可能有助于确保 iAirways 中有大量的巨噬细胞。贴壁巨噬细胞能够更好地与病原体和其他免疫细胞相互作用,从而提高模型的相关性。如果首选内皮免疫信号的研究,则可以将巨噬细胞接种在培养基中细胞培养插入物的基底外侧,以模拟循环单核细胞群22。
iAirway 模型还有其他几个重要的应用,包括研究气道的肺发育。该模型可用于研究肺部发育所涉及的复杂过程,其中涉及不同细胞群之间的多细胞信号传导,从而深入了解正常和病理状况。为了研究肺泡的发育和疾病,气道类器官可以替代远端肺类器官 (DLO)23,24 这使研究人员能够研究远端肺,包括肺泡的发育和功能。这对于生成和研究肺泡巨噬细胞特别有用,而肺泡巨噬细胞在肺免疫中起着关键作用。
在大气道中开发可靠且可重复的血气屏障模型面临一些挑战。肺祖细胞必须表达大于 50% 的 NKX2-1 才能成功分化。如果未达到产量,ALI 培养物可能含有更多的间充质或被非肺上皮细胞污染。在内皮细胞铺板过程中保持无菌是一项重大挑战,因为它们是在细胞培养插入片段的基底外侧培养的。这可以防止板盖关闭无菌环境,因此在接种内皮细胞期间必须使用其他板。污染物会破坏培养物并损害模型的完整性。大多数 ALI 培养物孵育至少 3 周,以产生大部分气道细胞,包括纤毛细胞。大多数方案接种基底细胞,因此必须为信号机制留出时间来区分其他气道细胞。目前的方案解离了气道类器官,它们已经包含许多气道细胞,尽管与成熟的 HBEC 衍生的 ALI 相比数量较少。很少看到纤毛细胞以及上皮和间充质细胞类型(图 2D)。为了产生更多的纤毛细胞,可以将 DAPT 添加到气道类器官培养物和/或 ALI 培养基中25。该平台也只测试了气举后顶端和基底外侧细胞的短期活力,当基底外侧介质变为 1:1 上皮和内皮介质时。需要做更多的研究来测试几周内的活力,这可能会增加 ALI 中细胞的复杂性。
血气屏障模型对研究人类疾病和开发治疗干预措施具有深远的影响。该模型可用于筛选和优化治疗剂,包括抗病毒药物,通过提供模拟人类气道的生理相关环境,尤其是当气道细胞暴露于空气中时。基因敲除技术可用于研究屏障功能障碍和宿主-病原体相互作用的特定机制。该模型提供了一个平台来研究人类呼吸系统疾病的各个方面,从病毒感染到哮喘和慢性阻塞性肺病等慢性病。这种理解可以导致开发更有效和有针对性的疗法。
总之,大气道的血气屏障模型 (iAirway) 代表了研究病毒感染和其他呼吸系统疾病引起的屏障功能障碍的有力工具。确保细胞类型的成功分化、解决开发挑战和探索替代应用将提高该模型的实用性和准确性。它在治疗靶向和基因敲除研究中的应用强调了它在促进我们对人类呼吸系统疾病的理解和治疗方面的潜力。
披露声明
作者没有什么可披露的。
致谢
这项研究得到了 CIRM (DISC2COVID19-12022) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 12 well plates | Corning | 3512 | |
| 12-well inserts, 0.4 µm, translucent | VWR | 10769-208 | |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Accutase | Innovative Cell Tech | AT104 | |
| Activin A | R&D Systems | 338-AC | |
| All-trans retinoic acid (RA) | Sigma-Aldrich | R2625 | |
| ascorbic acid | Sigma | A4544 | |
| B27 without retinoic acid | ThermoFisher | 12587010 | |
| BMP4 | R&D Systems | 314-BP/CF | |
| Bovine serum albumin (BSA) Fraction V, 7.5% solution | Gibco | 15260-037 | |
| Br-cAMP | Sigma-Aldrich | B5386 | |
| CD 14 (FITC) | BioLegend | 982502 | |
| CD 31 PECAM-1(APC) | R&D System | FAB3567A | |
| CD 45 (PE) | BD Biosciences | 560975 | |
| CD 68 (PE) | BioLegend | 33808 | |
| CHIR99021 | Abcam | ab120890 | |
| CPM | Fujifilm | 014-27501 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dispase | StemCellTech | 7913 | |
| DMEM/F12 | Gibco | 10565042 | |
| Dorsomorphin | R&D Systems | 3093 | |
| E-CAD/CD 324 (APC) | BioLegend | 324107 | |
| EGF | R&D Systems | 236-EG | |
| EGM2 Medium | Lonza | CC-3162 | |
| EPCAM/CD 326 (APC) | BioLegend | 324212 | |
| FBS | Gibco | 10082139 | |
| FGF10 | R&D Systems | 345-FG/CF | |
| FGF7 | R&D Systems | 251-KG/CF | |
| Fibronectin | Fisher | 356008 | |
| Forskolin | Abcam | ab120058 | |
| Glutamax | Life Technologies | 35050061 | |
| Ham’s F12 | Invitrogen | 11765-054 | |
| HEPES | Gibco | 15630-080 | |
| IBMX (3-Isobtyl-1-methylxanthine) | Sigma-Aldrich | I5879 | |
| IL-3 | Peprotech | 200-03 | |
| Iscove’s Modified Dulbecco’s Medium (IMDM) + Glutamax | Invitrogen | 31980030 | |
| Knockout Serum Replacement (KSR) | Life Technologies | 10828028 | |
| Matrigel | Corning | 354230 | |
| M-CSF | Peprotech | 300-25 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR plus Kit (10/case) | Stem Cell Tech | 5825 | |
| N2 | ThermoFisher | 17502048 | |
| NEAA | Life Technologies | 11140050 | |
| PBS | Gibco | 10010023 | |
| Pen/strep | Lonza | 17-602F | |
| ReleSR | Stem Cell Tech | 5872 | |
| RPMI1640 + Glutamax | Life Technologies | 12633012 | |
| SB431542 | R&D Systems | 1614 | |
| SCF | PeproTech | 300-07 | |
| SMA | Invitrogen | 50-9760-80 | |
| STEMdiff APEL 2 Medium | STEMCELL Technologies | 5275 | |
| TrypLE Express | Gibco | 12605-028 | |
| VEGF165 | Preprotech | 100-20 | |
| Vimentin | Cell Signaling | 5741S | |
| Y-27632 (Rock Inhibitor) | R&D Systems | 1254/1 | |
| ZO-1 | Invitrogen | 339100 |
参考文献
- Wu, M., Zhang, X., Lin, Y., Zeng, Y. Roles of airway basal stem cells in lung homeostasis and regenerative medicine. Respir Res. 23 (1), 122 (2022).
- Blackburn, J. B., Li, N. F., Bartlett, N. W., Richmond, B. W. An update in club cell biology and its potential relevance to chronic obstructive pulmonary disease. Am J Physiol Lung Cell Mol Physiol. 324 (5), L652-L665 (2023).
- Fahy, J. V., Dickey, B. F. Airway mucus function and dysfunction. N Engl J Med. 363 (23), 2233-2247 (2010).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Ann Am Thorac Soc. 15 (Suppl 3), S143-S148 (2018).
- Khalilgharibi, N., Mao, Y. To form and function: On the role of basement membrane mechanics in tissue development, homeostasis and disease. Open Biol. 11 (2), 200360 (2021).
- Mcdonald, D. M., Yao, L. C., Baluk, P. Dynamics of airway blood vessels and lymphatics: Lessons from development and inflammation. Proc Am Thorac Soc. 8 (6), 504-507 (2011).
- Parker, D., Prince, A. Innate immunity in the respiratory epithelium. Am J Respir Cell Mol Biol. 45 (2), 189-201 (2011).
- Davis, J. D., Wypych, T. P. Cellular and functional heterogeneity of the airway epithelium. Mucosal Immunol. 14 (5), 978-990 (2021).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clin Microbiol Rev. 24 (1), 210-229 (2011).
- Fosse, J. H., Haraldsen, G., Falk, K., Edelmann, R. Endothelial cells in emerging viral infections. Front Cardiovasc Med. 8, 619690 (2021).
- Wang, Y., Zheng, J., Wang, X., Yang, P., Zhao, D. Alveolar macrophages and airway hyperresponsiveness associated with respiratory syncytial virus infection. Front Immunol. 13, 1012048 (2022).
- Costa, A., De Souza Carvalho-Wodarz, C., Seabra, V., Sarmento, B., Lehr, C. M. Triple co-culture of human alveolar epithelium, endothelium and macrophages for studying the interaction of nanocarriers with the air-blood barrier. Acta Biomater. 91, 235-247 (2019).
- Leibel, S. L., Mcvicar, R. N., Winquist, A. M., Snyder, E. Y. Generation of 3D whole lung organoids from induced pluripotent stem cells for modeling lung developmental biology and disease. J Vis Exp. (170), e62456 (2021).
- Mccauley, K. B., Hawkins, F., Kotton, D. N. Derivation of epithelial-only airway organoids from human pluripotent stem cells. Curr Protoc Stem Cell Biol. 45 (1), e51 (2018).
- Choi, K. -. Y. G., Wu, B. C., Lee, A. H. -. Y., Baquir, B., Hancock, R. E. W. Utilizing organoid and air-liquid interface models as a screening method in the development of new host defense peptides. Front Cell Infect Microbiol. 10, 228 (2020).
- Fulcher, M. L., Randell, S. H. Human nasal and tracheo-bronchial respiratory epithelial cell culture. Methods Mol Biol. 945, 109-121 (2013).
- Hao, S., et al. Long-term modeling of SARS-COV-2 infection of in vitro cultured polarized human airway epithelium. mBio. 11 (6), e02852-e02920 (2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nat Cell Biol. 17 (8), 994-1003 (2015).
- Van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long-term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), e71098 (2013).
- Pouyanfard, S., et al. Human-induced pluripotent stem cell-derived macrophages ameliorate liver fibrosis. Stem Cells. 39 (12), 1701-1717 (2021).
- Ardini-Poleske, M. E., et al. Lungmap: The molecular atlas of lung development program. Am J Physiol Lung Cell Mol Physiol. 313 (5), L733-L740 (2017).
- Ronaghan, N. J., et al. M1-like, but not m0- or m2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), e0276013 (2022).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Rep. 3 (3), 394-403 (2014).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods. 14 (11), 1097-1106 (2017).
- Firth, A. L., et al. Generation of multiciliated cells in functional airway epithelia from human induced pluripotent stem cells. Proc Natl Acad Sci U S A. 111 (17), E1723-E1730 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。