Method Article
Cocultivo epitelial, mesenquimatal, endotelial e inmunitario derivado de iPSC para modelar la integridad de la barrera de las vías respiratorias en la salud y la enfermedad pulmonar
En este artículo
Resumen
Este artículo describe la generación de un modelo complejo de barrera multicelular de la vía aérea compuesto por epitelio pulmonar derivado de células madre pluripotentes inducidas (iPSC), mesénquima, células endoteliales y macrófagos en un cultivo de interfaz aire-líquido.
Resumen
El tejido pulmonar humano está compuesto por una red interconectada de epitelio, mesénquima, endotelio y células inmunitarias desde las vías respiratorias superiores de la nasofaringe hasta el saco alveolar más pequeño. Las interacciones entre estas células son cruciales en el desarrollo pulmonar y la enfermedad, ya que actúan como una barrera contra productos químicos y patógenos nocivos. Los modelos actuales de cocultivo in vitro utilizan líneas celulares inmortalizadas con diferentes antecedentes biológicos, que pueden no representar con precisión el entorno celular o las interacciones del pulmón. Diferenciamos las iPSC humanas en organoides pulmonares 3D (que contienen epitelio y mesénquima), células endoteliales y macrófagos. Estos se cocultivaron en un formato de interfaz aire-líquido (ALI) para formar una barrera apical epitelial/mesenquimal investida con macrófagos y una barrera endotelial basolateral (iAirway). Las iAirways derivadas de iPSC mostraron una reducción en la integridad de la barrera en respuesta a la infección por virus respiratorios y toxinas de cigarrillos. Este sistema de cocultivo pulmonar multilinaje proporciona una plataforma para estudiar las interacciones celulares, las vías de señalización y los mecanismos moleculares que subyacen al desarrollo pulmonar, la homeostasis y la progresión de la enfermedad. Las iAirways imitan de cerca la fisiología humana y las interacciones celulares, se pueden generar a partir de iPSC derivadas del paciente y se pueden personalizar para incluir diferentes tipos de células de las vías respiratorias. En general, los modelos de iAirway derivados de iPSC ofrecen una herramienta versátil y potente para estudiar la integridad de la barrera con el fin de comprender mejor los impulsores genéticos de la enfermedad, la respuesta a los patógenos, la regulación inmunitaria y el descubrimiento o reutilización de fármacos in vitro, con el potencial de avanzar en nuestra comprensión y tratamiento de las enfermedades de las vías respiratorias.
Introducción
La barrera sangre-aire en las vías respiratorias grandes incluye la tráquea, los bronquios y los bronquiolos. Desempeña un papel crucial en el mantenimiento de la salud respiratoria y está formado por el epitelio de las vías respiratorias, la membrana basal, los vasos sanguíneos y las células endoteliales, así como por las células inmunitarias. Las células epiteliales primarias de las vías respiratorias abarcan las células basales, las células club, las células ciliadas y las células caliciformes. Las células basales, que actúan como células madre del epitelio de la vía aérea, son progenitoras multipotentes con alta capacidad proliferativa y de autorrenovación, dando lugar a células epiteliales maduras de la vía aérea1. Las células club son células secretoras no ciliadas que contribuyen al mantenimiento del revestimiento de las vías respiratorias mediante la secreción de proteínas protectoras y tensioactivos2. Las células caliciformes, ubicadas en el lumen y en las glándulas submucosas, secretan mucinas para atrapar los desechos y proteger la vía aérea3. Las células ciliadas son parte integral del mecanismo de la escalera mecánica mucociliar, evitando la acumulación de microorganismos nocivos4. La membrana basal está constituida por una matriz extracelular, que proporciona soporte estructural5. La tráquea y el resto de las vías respiratorias están rodeadas por una rica red de vasos sanguíneos, que están revestidos de células endoteliales que desempeñan un papel vital en el apoyo a la función traqueal mediante el suministro de nutrientes y oxígeno, la eliminación de desechos, la regulación de la inflamación y la contribución a la reparación de tejidos y la angiogénesis. Por último, los macrófagos de las vías respiratorias son células inmunitarias específicas de tejidos, esenciales para proteger el sistema respiratorio de las infecciones, eliminar las partículas inhaladas y mantener una respuesta inmunitaria equilibrada7.
Las acciones coordinadas de las células epiteliales, mesenquimales, endoteliales y macrófagos son fundamentales para una respuesta inmunitaria eficaz a los patógenos enlas vías respiratorias. Las células epiteliales forman la primera línea de defensa contra las infecciones virales al actuar como una barrera física, con uniones estrechas que restringen el paso de sustancias nocivas. La acción coordinada de las células ciliadas y las células caliciformes ayuda a atrapar y eliminar las partículas inhaladas, los patógenos y los desechos4. Además, las células epiteliales de las vías respiratorias producen citocinas y quimiocinas para reclutar células inmunitarias9. Las células endoteliales mantienen la integridad vascular, evitando la propagación de partículas virales a través del torrente sanguíneo, regulan al alza las moléculas de adhesión (VCAM-1) para facilitar la adhesión de las células inmunitarias y producen citocinas proinflamatorias para reclutar células inmunitarias desde el torrente sanguíneo hasta el sitio de la infección10. Los macrófagos de las vías respiratorias engullen y digieren partículas virales, células infectadas y desechos, presentan antígenos virales a las células T y producen citocinas para activar y reclutar otras células inmunitarias, junto con interferones de tipo I para inhibir la replicación viral11. Las acciones coordinadas de las células epiteliales, mesenquimales, endoteliales y macrófagos crean un sistema de defensa robusto y dinámico que protege las vías respiratorias de las infecciones virales y mantiene la salud respiratoria.
Comprender las interacciones dinámicas entre varios tipos de células en el pulmón humano es crucial para comprender la respuesta del pulmón a las infecciones virales, las enfermedades inflamatorias y la administración de fármacos. Los cocultivos in vitro permiten el estudio de la señalización célula-célula entre el epitelio, las células endoteliales y las células inmunitarias innatas12. Desarrollamos el primer modelo auténtico de pulmón de tipo multicelular derivado de las hiPSC específicas del paciente13. Esto incorpora poblaciones de células epiteliales y mesenquimales, formadas en una orientación 3D. Posteriormente, las células progenitoras pulmonares pueden diferenciarse en un "organoide de la vía aérea"14, cultivarse en insertos de cultivo celular estériles y exponerse a una interfaz aire-líquido (ALI), replicando las condiciones de la vía aérea humana 15,16,17. Las células endoteliales derivadas de iPSC se cultivan en el lado basolateral de la membrana, imitando su orientación en la vía aérea humana, situada debajo de la capa epitelial/mesenquimal en la membrana basal. Por último, los macrófagos derivados de iPSC se añaden a la cara apical de la membrana, interactuando con las células epiteliales y esperando señales de activación (Figura 1A). Este modelo reproduce con precisión la biología y la función de la vía aérea. Postulamos que los cultivos de iAirway de tipo multicelular auténticos, específicos del paciente, derivados de hiPSC, son los más adecuados para dilucidar la respuesta intrínseca y aguda de la barrera de las vías respiratorias y los patógenos, incluidas las infecciones virales. Por ejemplo, este modelo se puede utilizar para (1) estudiar la entrada y replicación viral, (2) investigar la respuesta inmunitaria inicial de las células inmunitarias epiteliales y específicas de tejido, (3) examinar la integridad y la función de la barrera, (4) probar la eficacia de los agentes terapéuticos y (5) estudiar los mecanismos celulares y moleculares de la patogénesis en un modelo específico del paciente.
En este artículo se describe un protocolo detallado para la preparación de cocultivos pulmonares multicelulares para estudiar las respuestas celulares a las infecciones virales.
Protocolo
Este protocolo de estudio fue aprobado por la Junta de Revisión Institucional del Programa de Protección de la Investigación Humana de la UCSD (181180). Este protocolo utiliza moléculas pequeñas y factores de crecimiento para dirigir la diferenciación de las células madre pluripotentes en células de las vías respiratorias, células endoteliales y macrófagos. A continuación, estas células se cocultivan en insertos de cultivo celular y se polarizan en una interfaz aire-líquido. Los detalles de los reactivos, consumibles y equipos utilizados se enumeran en la Tabla de materiales. Las composiciones de medios y búferes se proporcionan en el Archivo Complementario 1.
1. Generación de organoides de las vías respiratorias derivados de iPSC (Día 1 - 30)
NOTA: Este protocolo describe los pasos necesarios para generar organoides de vía aérea derivados de iPSC (Figura 1B), siguiendo la metodología descrita en Leibel et al.13. El proceso incluye la inducción del endodermo definitivo (días 1-3), la generación del endodermo del intestino anterior anterior (días 4-6) y la diferenciación en progenitores pulmonares (días 7-16). La metodología detallada se puede encontrar en la publicación anterior13. Los siguientes pasos detallan la generación de organoides de las vías respiratorias a partir de progenitores pulmonares.
- Extracción y disociación de esferoides progenitores pulmonares a partir de polímeros ECM (Día 17)
- Descongele el polímero de matriz extracelular (ECM) (8-9 mg/mL) en hielo.
- Aspire los medios gastados, utilizando un aspirador de vacío, a partir de organoides pulmonares incrustados en la ECM.
NOTA: Para los pasos de aspiración posteriores, use un aspirador de vacío a menos que se indique lo contrario. - Añadir 1 mL de 2 U/mL de dispasa suplementada con 10 μM de inhibidor de ROCK1 (ROCKi) a las células y utilizar una pipeta P1000 para resuspender manualmente los progenitores pulmonares en la MEC. Incubar durante 30 min a 37 °C, resuspendiendo la mezcla cada 15 min para mejorar la eficacia de la disociación de la dispasa mediante el procesamiento mecánico.
- 15 minutos antes de usar, coloque 45 ml de PBS a temperatura ambiente en un congelador a -20 °C para que se enfríe. Asegúrese de que el PBS esté a menos de 4 °C para una despolimerización óptima del ECM en los pasos siguientes.
- Después de 30 minutos de incubación de la dispasa, transfiera el organoide y la solución de dispasa a un tubo cónico de 15 mL.
- Agregue PBS enfriado (2 mL por 1 mL de proteasa) para lavar y recolectar el organoide residual y el material de ECM de la placa. Vuelva a suspender los organoides con una pipeta P1000 y centrifugue a 400 x g durante 5 min.
NOTA: Todos los pasos de centrifugación se realizan a temperatura ambiente, a menos que se especifique lo contrario en este protocolo. - Después de la centrifugación, debe ser visible una bolita de ECM turbia con organoides. Aspire cuidadosamente el sobrenadante a través de una pipeta, evitando el pellet de ECM.
- Realice un segundo lavado de PBS con PBS refrigerado, vuelva a suspender con una pipeta P1000 y centrifugue a 400 x g durante 5 min. Aspirar el sobrenadante a través de una pipeta, dejando ~100 μL de solución residual.
- Agregue 2 mL de proteasa similar a la tripsina a los organoides en el tubo cónico de 15 mL. Vuelva a suspender con una pipeta P1000. Incubar durante 10-12 min a 37 °C, invirtiendo o moviendo el tubo para volver a suspender la mezcla a mitad de la incubación.
NOTA: Realice 10-12 minutos de disociación de proteasa similar a la tripsina para pasar los organoides como agregados. - Después de 12 min, detenga la reacción de la proteasa similar a la tripsina agregando 2 mL de FBS al 2% en el medio base (Stop Media, ver Archivo Suplementario 1). Vuelva a suspender la solución con una pipeta P1000 y centrífuga a 400 x g durante 5 min.
- Aspirar el sobrenadante y resuspender los organoides en Stop Media suplementado con 10 μM de ROCKi. Tome una muestra de 10 μL para el recuento de células utilizando un hemocitómetro y azul de tripán. Mantenga los organoides en hielo durante el conteo.
- Calcular el volumen necesario para obtener 100.000 celdas por pozo. La célula alícuota se agrega en un tubo de microcentrífuga de 1,5 mL y se centrifuga durante 5 min a 400 x g. Eliminar el exceso de sobrenadante, dejando 10 μL de medio residual.
- Vuelva a suspender el pellet de la célula en 200 μL de polímero ECM frío (evite las burbujas y trabaje rápidamente para evitar la polimerización prematura). Agregue 200 μL de ECM y mezcla de celdas al fondo de cada pocillo en una placa de 12 pocillos. Deje que el ECM se polimerice parcialmente a temperatura ambiente en la cabina de bioseguridad durante 5 minutos.
- Transfiera la placa a una incubadora a 37 °C durante 30-60 minutos para completar la polimerización de ECM. A continuación, añadir 1,5 mL de medio de inducción de organoides de las vías respiratorias (Ficha Suplementaria 1).
- Cambie el medio cada dos días durante 14 días hasta el día 30. Si el medio se vuelve amarillo dentro de las 24 horas, aumente el volumen a 2 ml.
2. Generación de células endoteliales derivadas de iPSC (Día 1 - 14)
NOTA: El siguiente procedimiento detalla la generación de células endoteliales a partir de iPSCs (Figura 1C), adaptado de Patsch et al.18. Este método incluye la preparación de placas, la diferenciación de iPSCs, la inducción de células endoteliales, la clasificación y la expansión. En la Tabla 1 se enumeran los anticuerpos utilizados en este estudio.
- Siembra de iPSCs para la diferenciación endotelial (Día 0)
- Comienza la diferenciación de las células endoteliales cuando las hiPSC alcanzan el 70%-80% de confluencia. Agregue 10 μM de ROCKi Y-27632 a cada pocillo una hora antes de la disociación.
- Aspire el medio, lave los pocillos con 1 mL de PBS y luego disocie las iPSC agregando 1 mL de solución de desprendimiento de celda por pocillo de una placa de 12 pocillos. Incubar durante 20 min a 37 °C.
- Neutralice la solución de desprendimiento de celda agregando 2 mL de Stop Media a los pocillos. Pipeta para obtener una suspensión unicelular. Transfiera las células a un tubo cónico de 15 mL y centrifugue durante 5 min a 300 x g.
- Aspirar el sobrenadante, resuspender las iPSC en un medio de cultivo de iPSC suplementado con 10 μM de ROCKi y realizar un recuento de células. Placa de 100.000 hiPSC por pocillo de una placa de 12 pocillos recubierta de ECM en 1 mL de medio de cultivo iPSC con 10 μM de ROCKi. Incubar durante la noche a 37 °C.
NOTA: La densidad de siembra para la diferenciación endotelial de iPSC puede necesitar optimización por línea celular. Evalúe la eficiencia de la diferenciación mediante citometría de flujo para CD31 en el día 6.
- Inducción del mesodermo lateral (Día 1-3)
- Aspire los medios de cultivo de iPSC de las iPSC plateadas y agregue 3 mL de medios de base N2B27 suplementados con 6 μM de CHIR y 25 ng/mL de BMP4 por pocillo (Archivo suplementario 1). Caliente el medio antes de agregarlo a las celdas. No cambie el medio durante 3 días.
- Inducción de células endoteliales (Día 4-5)
- En el día 4, aspire el medio N2B27 y agregue 2 mL de medio de diferenciación endotelial (EDM) suplementado con 200 ng/mL de VEGF165 y 2 μM de forskolina por pocillo. Cambia los medios el día 5.
- Clasificación y replateado de células endoteliales (Día 6)
- El día 5 o 6, prepare un matraz T75 recubierto de fibronectina para el enriquecimiento de la clasificación celular activada por fluorescencia (FACS) reconstituyendo 1 mg de fibronectina en agua estéril para hacer una solución de 100 μg/mL de fibronectina. Cubra el matraz T75 con 6 mL de la solución de fibronectina e incube a temperatura ambiente durante una hora. Aspirar la solución de fibronectina y lavar con agua estéril. Deje que el matraz T75 se seque a temperatura ambiente. Los matraces adicionales fabricados se pueden almacenar a 4 °C.
- Preparar los medios de mantenimiento endotelial (EMM)18.
- El día 6, enriquezca las células endoteliales derivadas de iPSC a través de FACS utilizando el anticuerpo CD3118.
- Agregue 10 μM de ROCKi Y-27632 a cada pocillo una hora antes de la disociación a 37 °C. Aspire el medio y lave con PBS. Añada 1 ml de solución de desprendimiento de células precalentada por pocillo de una placa de 12 pocillos e incube durante 8-10 min a 37 °C.
- Pipetear suavemente para asegurar el desprendimiento de una sola célula. Transfiera las células a un tubo cónico de 15 mL y agregue el mismo volumen de medios de parada. Centrífuga durante 5 min a 300 x g.
- Aspirar el sobrenadante y resuspender las células endoteliales en 1 mL de Stop Media suplementado con 10 μM de ROCKi. Pase las células a través del filtro de 70 μm añadiendo primero 1 ml de medio de parada para humedecer el filtro, luego pipetee las células a través del filtro. Tome una muestra de 10 μL para el recuento de células utilizando un hemocitómetro y azul de tripán. Mantenga las células en hielo durante el conteo.
- Realice un recuento de células. Prepare una alícuota de 200.000 células como un control negativo sin teñir. Transfiera las células restantes a un tubo Eppendorf de 1,5 ml y agregue 10 μl de CD31-APC por cada 1 millón de células en 100 μl de tampón FACS. Incubar durante 30 min en un rotador a 4 °C.
- Una vez completada la incubación, centrifugar el tubo Eppendorf con celdas durante 5 min a 300 x g, lavar las celdas agregando 1mL de PBS. Repita el paso de lavado y centrifugación dos veces. Retire manualmente el sobrenadante entre lavados.
- Vuelva a suspender el pellet de celda en 1 mL de tampón FACS y 5 ug/mL de solución DAPI para la tinción de viabilidad, 5 minutos antes de la clasificación. Ordenar según las pautas institucionales.
- Recoja las células clasificadas por FACS en un tubo cónico de 15 mL con 2 mL de EMM. Centrifugar el tubo cónico de 15 ml con celdas durante 5 minutos a 300 x g. Aspirar el sobrenadante y resuspender las células endoteliales en 10 mL de EMM suplementado con 10 μM de ROCKi Y-27632 y Penicilina Estreptomicina (1%).
- Transfiera las células endoteliales derivadas de iPSC enriquecidas con FACS resuspendidas al matraz recubierto de fibronectina. Distribuya uniformemente las células y colóquelas en una incubadora a 37 °C durante la noche.
NOTA: Utilice un mínimo de 500.000 células y un máximo de 2.000.000 de células por matraz T75.
- Expansión y criopreservación de células endoteliales clasificadas (Día 7+)
- Cambie los medios EMM cada 2-3 días después del enriquecimiento de FACS. Una vez que el matraz T75 se vuelve confluente (aproximadamente 7 días después de FACS, dependiendo de la densidad de siembra), las células endoteliales derivadas de iPSC se pueden utilizar para cocultivo o criopreservadas para aplicaciones futuras.
- Prepare una solución de congelación endotelial 2x antes de la disociación celular (80% de Endo-CM2, 20% de DMSO, 20 μM de ROCKi).
- Etiquete los tubos crioviales en una pluma a prueba de etanol con la información respectiva. Identificación de línea, número de paso, medio de cultivo, 'descongelar en un pozo de 6', fecha de congelación.
- Cuando las células endoteliales derivadas de iPSC ordenadas son confluentes, se inicia la disociación.
- Lave el matraz T75 con 5 ml de PBS -/-.
- Disocie las células endoteliales derivadas de iPSC con 5 ml de proteasa similar a la tripsina por T75. Incubar las células a 37 °C DURANTE 10 min, comprobando periódicamente el T75 para comprobar que las células se han levantado.
- Neutralice la reacción añadiendo 5 mL de Stop Media. Transfiera 10 mL de células en solución a un tubo de 15 mL. Centrifugar a 300 x g durante 5 min.
- Aspire el sobrenadante, resuspenda las células endoteliales en un medio E-CBM y extraiga una muestra de 10 μL para su recuento mediante hematiómetro.
- Después del recuento de células, alícuota 1 millón de células por 0,5 mL de medio EGM2.
NOTA: El siguiente paso es urgente. Prepare los crioviales y los recipientes de congelación para su uso inmediato. - Alícuota igual a volumen de 2x solución de congelación a las células endoteliales. La concentración final es 90% de Endo-CM2, 10% DMO y 10 μM de ROCKi (1 mL/1 millón de células).
- Transfiera los viales tapados inmediatamente a una cámara de congelación y colóquelos a -80 °C durante la noche, luego en nitrógeno líquido (-180 °C) al día siguiente para su almacenamiento a largo plazo.
3. Generación de macrófagos derivados de iPSC (Día 1 - 26)
NOTA: Este procedimiento describe los pasos para generar macrófagos a partir de iPSCs (Figura 1D), adaptado de van Wilgenburg et al.19 y Pouyanfard et al.20. Abarca la adaptación unicelular de las iPSC, la diferenciación de cuerpos embrioides, la formación de progenitores de macrófagos y la maduración de macrófagos.
- Adaptación de iPSCs a una sola célula
- Cuando las iPSC alcanzan una confluencia de ~70%-90% sin signos visibles de diferenciación, comienza el paso de una sola célula con proteasa similar a la tripsina.
- Aspire los medios gastados y enjuague con PBS. Retire el PBS y agregue la proteasa similar a la tripsina (1 mL/pocillo de una placa de 6 pocillos, 500 μL/pocillo de una placa de 12 pocillos). Incubar a 37 °C durante 2-5 min hasta que las colonias de iPSC se disocien de la placa.
- Neutralice la proteasa similar a la tripsina con un volumen igual de medios de parada (1 mL/pocillo de una placa de 6 pocillos, 500 μL/pocillo de una placa de 12 pocillos). Centrifugar las células a 200 x g durante 5 min.
- Aspirar el sobrenadante y resuspender suavemente las células en medios de cultivo iPSC con 10 μM de ROCKi. Paso a nuevas placas recubiertas de ECM. Repita durante 2-3 pasos antes de criopreservar o usar las iPSC adaptadas de una sola célula.
NOTA: Ajuste la relación de paso de 1:2 a 1:10 en función de la salud y la adaptación de la célula. Además, las iPSC que han pasado por al menos tres pasajes de una sola célula y tienen un paso bajo producen diferenciaciones óptimas de macrófagos.
- Formación del cuerpo embrioide (Día 0-6)
- Cuando las iPSC adaptadas a una sola célula alcanzan ~75% de confluencia, las iPSC pasan con proteasa similar a la tripsina según los pasos 3.1-3.4.
- Vuelva a suspender las células en el medio de parada y páselas a través de un filtro de células de 70 μm a un tubo cónico nuevo de 50 ml para eliminar los grumos. Vuelva a suspender las células y tome una muestra de 10 μL para el recuento de células a través de un hematitómetro.
- Para la generación de cuerpos embrioides (EB), se colocan entre 8.000 y 50.000 células por pocillo de una placa de fijación ultrabaja (ULA) de 96 pocillos. Calcule el número total de celdas necesarias para sembrar 60 pocillos de una placa ULA de 96 pocillos.
NOTA: La densidad de siembra de las iPSC puede requerir optimización por línea celular. - Centrífuga de iPSCs en cónica de 15 mL a 200 x g durante 5 min. Aspirar el sobrenadante.
- Para 480.000 iPSC (8.000 células/pocillo en 60 pocillos), resuspender en 6 mL (100 ul/pocillo en 60 pocillos) de medios de inducción EB.
- Agregue 150 μL de PBS a los 36 pocillos exteriores de una placa ULA de 96 pocillos de fondo redondo.
- Vuelva a suspender y transfiera las iPSC en medios EB a un canal de medios. Con una pipeta multicanal, agregue 100 μL/pocillo de suspensión celular en los 60 pocillos centrales de la placa ULA de 96 pocillos. Vuelva a suspender las iPSC en los medios EB de forma intermitente para garantizar una distribución uniforme de las células.
- Centrifugar la placa de 96 pocillos a 300 x g durante 5 min a 4 °C (si está disponible). Transfiera las placas a una incubadora a 37 °C.
- Después de 48-72 h, cambie 50 μL del medio (cambio de medio medio). Compruebe si hay formación de quistes después de 6 días.
NOTA: Algunas líneas iPSC forman EB antes o más fácilmente que otras. Monitoree la formación de EB y asegúrese de que las EB se transfieran en el momento adecuado (deben estar desarrollando quistes).
- Recubrimiento de gelatina y transferencia de EB para la formación de progenitores de macrófagos (Día 6-19)
- Prepare dos placas de 6 pocillos recubiertas de gelatina al 0,1%. Añadir 1 mL de gelatina al 0,1% por pocillo e incubar a temperatura ambiente durante 20 min. Aspire la solución de gelatina y deje que los platos se sequen en la campana durante 30-60 minutos.
- Transfiera los EB de la placa de 96 pocillos a las placas de 6 pocillos recubiertas de gelatina con una pipeta serológica de 2 ml. Distribuya aproximadamente 8-10 EB por pocillo de una placa recubierta de gelatina de 6 pocillos.
- Retire con cuidado los medios EB residuales utilizados de la transferencia. Añada 2 mL de medio de cultivo de macrófagos 1 (Mac-CM1) por pocillo. Incubar los EB sin perturbaciones a 37 °C con 5% de CO2 durante 5-7 días.
NOTA: Idealmente, una placa de 96 pocillos de cuerpos embrioides se puede dividir en dos placas de 6 pocillos. Si los EB están poco desarrollados, el número de EB transferidos por placa de 6 pocillos se puede ajustar para optimizar el paso de diferenciación de iPSC a cuerpo embrioide.
- Generación de progenitores de macrófagos
- Reemplace 2/3 del medio dos veces por semana, aumentando el volumen a 3 ml si el color del medio cambia.
- Revise los cultivos entre los días 8 y 19 para determinar si están listos para la recolección de progenitores de macrófagos. Si los EB se desprenden, transfiéralos a una placa recién recubierta con Mac-CM1 e incube sin perturbaciones durante 7 días.
NOTA: El mantenimiento del complejo formador de progenitores de macrófagos es vital para el desarrollo y la generación continua de progenitores de macrófagos. Los complejos optimizados formadores de progenitores de macrófagos generarán continuamente progenitores mieloides durante 2-6+ meses.
- Cosecha de progenitores mieloides (Día 19-26+)
- Cuando haya células progenitoras de macrófagos en suspensión, recoja el medio con células y transfiéralo a un tubo cónico de 50 mL. Centrifugar a 200 x g durante 5 min y retirar con cuidado el sobrenadante.
- Resuspenda los progenitores de macrófagos en Mac-CM2 y transfiéralos a una placa/matraz de cultivo estéril sin tratar. Incubar a 37 °C con 5% de CO2 durante 3-4 días.
NOTA: Dependiendo del número de células recolectadas, transfiéralo a una placa de Petri de 10 cm (3-4 pocillos de una placa de 6 pocillos), matraz T25 (1-2 pocillos de una placa de 6 pocillos) o matraz T75 (placa completa de 6 pocillos) con el volumen adecuado de medios. Utilice 5-6 mL de medio para un matraz T25, 10-12 mL de medio en una placa de Petri y 12-15 mL de medio para un matraz T75. Para las cosechas posteriores, los progenitores mieloides y las células de macrófagos se pueden agrupar de cosechas anteriores si pertenecen a la misma línea/complejos formadores de mieloides. Solo asegúrese de que el matraz sea suficiente para mantener y alimentar el número de células en el matraz (s). Los macrófagos no proliferan; Se generan a partir de progenitores de macrófagos. Los macrófagos pueden agruparse y mantenerse durante 2-6 semanas sin perder los marcadores de expresión.
- Recolección de macrófagos
NOTA: Después de 14 días de diferenciación de macrófagos en medios Mac-CM2, los cultivos de macrófagos están listos para el cocultivo o el análisis de citometría de flujo.- Recoja los medios gastados y transfiéralos a un tubo cónico de 50 ml. Enjuague el matraz/placa con PBS para eliminar los medios y las células residuales.
- Añada medios base al matraz (3 mL para T25 y 5 mL para T75) y utilice un raspador de células estéril para separar las células del fondo del matraz/placa. Transfiera las células a un tubo cónico y repita el raspado si es necesario.
- Centrifugar a 200 x g durante 5 min a temperatura ambiente. Retire con cuidado el sobrenadante y vuelva a suspender las células en un medio o tampón adecuado para su uso posterior.
4. Cocultivo de células de las vías respiratorias, células endoteliales y macrófagos
NOTA: Este procedimiento describe los pasos para el cocultivo de células de las vías respiratorias, células endoteliales y macrófagos (Figura 1A) utilizando insertos de cultivo celular, adaptados de Costa et al.12.
- Recubrimiento ECM de insertos de cultivo celular para cocultivo (Día 0 de cocultivo)
- Cubra los insertos de cultivo celular de poliéster (PET) de 3,0 μm de poro con una solución de ECM de 4 mg/mL. Cubra brevemente el lado apical de los insertos de cultivo celular dentro de la placa con 4 mg/mL de solución de ECM. Pipetear la solución de ECM residual. Coloque la placa en la incubadora durante 1 h a 37 °C.
- Consigue una placa de Petri grande (100 mm x 20 mm o 150 mm x 20 mm). Con pinzas limpias, transfiera estérilmente los insertos de cultivo celular de la placa de 12 pocillos a la placa de Petri grande. Invierta las inserciones para que el lado basolateral quede en posición vertical.
- Cubra el lado basolateral con 4 mg/mL de solución de ECM. Pipetear la solución de ECM residual. Coloque la placa de Petri con insertos de cultivo celular recubiertos de ECM en una incubadora a 37 °C para que se seque durante la noche.
- Disociación y siembra de células endoteliales derivadas de iPSC (Día 1 de cocultivo)
- Lave el matraz T75 con PBS y aspire la solución. Añadir 5 mL de proteasa similar a la tripsina al matraz T75 e incubar a 37 °C durante 8 min. Evaluar visualmente que las células endoteliales se han levantado del matraz.
NOTA: Aumente el tiempo de disociación de la proteasa tipo typsina si las células endoteliales derivadas de iPSC no se han levantado del matraz. - Golpee el matraz para asegurar el desprendimiento de las células endoteliales y transfiera las células a un recipiente cónico de 15 mL. Agregue 5 mL de Stop Media para detener la disociación. Centrifugar las celdas a 300 x g durante 5 min.
- Aspire el sobrenadante y resuspenda el pellet celular en 1 mL de medio de cultivo endotelial con 10 μM de ROCKi. Obtenga 10 μL de solución resuspendida para el recuento de células y coloque las células en hielo durante el recuento.
- Utilice 150.000 células endoteliales iPSC por inserto de cultivo celular de 12 mm en 100 μL de medio de cultivo endotelial. Ajuste el volumen del medio respectivo para alcanzar el número deseado de celdas por inserción.
- Obtenga una placa de Petri con insertos de cultivo celular de 3,0 μm recubiertos de ECM de la incubadora (consulte los pasos 4.1-4.3).
- Vuelva a suspender las células endoteliales iPSC y pipetee 100 μL con 150.000 células en el inserto de cultivo celular invertido (lado basolateral hacia arriba). Repita el pipeteo para cada uno de los insertos de cultivo celular preparados
- Transfiera con cuidado las células a la incubadora y déjelas sin tocar durante 3 h.
- En una placa de 12 pocillos, agregue 1 mL de medio de cultivo endotelial en cada pocillo (para el número respectivo de insertos de cultivo celular preparados).
- Saque la placa de Petri con células endoteliales de la incubadora. Con unas pinzas limpias, transfiera con cuidado los insertos de cultivo celular a la placa con medios de cultivo endotelial (volteando el inserto para que la parte inferior quede hacia abajo en el medio).
- Verificar visualmente en un microscopio que las células endoteliales se han adherido. Coloque la placa en una incubadora a 37 °C durante la noche.
- Lave el matraz T75 con PBS y aspire la solución. Añadir 5 mL de proteasa similar a la tripsina al matraz T75 e incubar a 37 °C durante 8 min. Evaluar visualmente que las células endoteliales se han levantado del matraz.
- Disociación y siembra de organoides de las vías respiratorias derivados de iPSC (Día 2 de cocultivo)
NOTA: Consulte los pasos 1.1.1-1.1.15 para el aislamiento de organoides de las vías respiratorias del polímero ECM. Modifique la duración de la disociación de la proteasa similar a la tripsina (paso 1.1.10) a 15-20 min para obtener una suspensión unicelular.- Después de 15-20 minutos, detenga la reacción de la proteasa similar a la tripsina agregando 3 mL de Stop Media. Vuelva a suspender la solución con una pipeta P1000 y centrífuga a 400 x g durante 5 min.
- Aspire el sobrenadante y resuspenda los organoides de las vías respiratorias en medios de expansión de las vías respiratorias de 1 mL con 10 μM de ROCKi. Tome una muestra de 10 μL para un recuento de células de hematómetro y coloque las células en hielo durante el recuento.
- Siembra 300.000 células iPSC de las vías respiratorias en 500 μL de medios de expansión de las vías respiratorias por inserto de cultivo celular de 12 mm. Ajuste el volumen de papel respectivo para alcanzar el número deseado de celdas por inserto preparado.
- Retire la placa con insertos de cultivo celular con células endoteliales (sembradas en el lado basolateral) de la incubadora a 37 °C.
- Vuelva a suspender las células de las vías respiratorias iPSC y pipetee 500 μL con 300.000 células en la cámara apical de cada inserto de cultivo celular. Colocar la placa en una incubadora a 37 °C durante 48 h con las células apicales en condiciones líquido-líquido.
- Co-cultivo con elevación aérea (Día 4 de co-cultivo)
- Retire el medio del lado apical del inserto de cultivo celular. Cambie los medios basolaterales por medios de diferenciación de las vías respiratorias 1:1 y medios de cultivo endotelial. Regrese la placa a la incubadora.
- Disociación y siembra de macrófagos derivados de iPSC (día 5 de cocultivo)
- Disocie los macrófagos derivados de iPSC del matraz utilizando un raspador de células (ver pasos 3.22-3.24). Centrifugar a 300 x g durante 5 min y aspirar el sobrenadante.
- Resuspenda los macrófagos iPSC en 1 mL de Mac-CM2. Tome una muestra de 10 μL para el recuento de células y colóquelas en hielo durante el recuento. El número de macrófagos reflejará el número de células de las vías respiratorias sembradas (proporción de 1:1 de macrófagos a células de las vías respiratorias).
- Después del recuento de células, se insertan 300.000 macrófagos en medios de 35 μL por pocillo de cultivo celular preparado en un tubo de microcentrífuga de 1,5 mL. Centrifugar a 200 x g durante 5 min.
- Después de la centrifugación, pipetear el sobrenadante. Vuelva a suspender los macrófagos en el Mac-CM2 respectivo de los cálculos.
- Retire de la incubadora los insertos con cocultivos de células endoteliales y de las vías respiratorias. Siembre 300.000 macrófagos en 35 μL de Mac-CM2 en el lado apical del inserto de cultivo celular. Coloque la placa en una incubadora a 37 °C durante 48 h.
NOTA: Para confirmar la adherencia de las células inmunitarias iPSC al inserto de cultivo celular, las células se pueden marcar con una sonda fluorescente. Confirmar la adherencia mediante microscopía para la señal fluorescente 48 h después de la siembra de macrófagos.
- Triple co-cultura (Día 7 de co-cultura)
- Asegúrese de que el cocultivo esté listo para aplicaciones posteriores, como estudios de infección, mediciones de resistencia eléctrica transepitelial (TEER) y ensayos de integridad de barrera.
Resultados
Existen múltiples etapas en las que se puede evaluar que la diferenciación de los organoides de las vías respiratorias, las células endoteliales, las células inmunitarias y los cocultivos derivados de iPSC se ha completado con éxito. Las diferenciaciones se pueden realizar en diferentes líneas de iPSC, y este protocolo se ha probado en al menos cinco líneas diferentes. El protocolo debe adaptarse a cada nueva línea de iPSC, específicamente modificando y optimizando la densidad de siembra.
El rendimiento exitoso de los organoides de las vías respiratorias derivados de iPSC se puede evaluar a través de campo claro y tendrá cuatro características: límites/bordes definidos, morfología translúcida/quística, capacidad de proliferar/expandirse y ausencia de células necróticas. Los organoides de las vías respiratorias que parecen borrosos no aumentan de tamaño durante las 2 semanas de cultivo y tienen necrosis no deben usarse para experimentos de cocultivo. Organoides con una gruesa capa luminal en la periferia vs. Los organoides translúcidos/quísticos aún se pueden utilizar para experimentos posteriores. Sin embargo, los organoides translúcidos/quísticos de las vías respiratorias están compuestos predominantemente por células basales, mientras que los organoides gruesos de doble membrana están compuestos predominantemente por células club. Debido a que las células basales proliferan y se expanden fácilmente, son más adecuadas para el cultivo y la polarización de la interfase aire-líquido. Otros métodos para evaluar el rendimiento exitoso de los organoides pulmonares derivados de iPSC son el análisis de citometría de flujo en la etapa progenitora pulmonar (día 16 de la diferenciación) para el marcador de superficie CPM (Tabla 1), un rendimiento de diferenciación exitoso >50% de células CPM+.
Para la disociación de organoides de las vías respiratorias y el cultivo de interfase aire-líquido, asegúrese de que se haya eliminado todo el polímero de ECM, o evitará que las células se expandan en la membrana. Las células deben estar confluentes para el día 3 de cultivo, antes del levantamiento aéreo. La confirmación de los tipos de células en las vías respiratorias se puede evaluar mediante la tinción de los respectivos marcadores específicos del tipo de célula: células basales (p63+), células club (SCGB1A1+), células caliciformes (MUC5AC+) y células ciliadas (AcTub+). La caracterización y los marcadores distintivos del tipo de células pulmonares se verifican en LungMAP21. El mesénquima se puede detectar con anticuerpos contra la vimentina o la actina del músculo liso. Para generar más células ciliadas, los cultivos pueden requerir transporte aéreo durante un período de tiempo más largo o la adición de DAPT.
El rendimiento exitoso de las células endoteliales derivadas de iPSC se puede evaluar a través de campo claro, mostrando una morfología similar a un adoquín (día 6 de la diferenciación endotelial derivada de iPSC). Un cultivo endotelial exitoso derivado de iPSC contendrá >50% de células CD31+, y se deben generar suficientes células para que, después de la clasificación, el rendimiento sea de más de 500.000 células. Las células pueden ser conducidas o criopreservadas, y el marcador CD31 debe probarse a través del flujo con cada paso o nuevo cultivo. Las celdas no deben pasar más allá de P4. Como referencia, ver Células endoteliales derivadas de iPSC antes y después de la clasificación de CD31 (Figura 1C). Las células endoteliales serán planas con un cuerpo celular grande con morfología alargada y en forma de huso.
Para la diferenciación de macrófagos, los cuerpos embrioides deben permanecer en el fondo del pocillo de ULA, y solo debe haber un EB en cada pocillo. Deberían mostrar cambios quísticos entre el día 5 y el 7. Si no forman un EB después de la centrifugación, siembre las iPSC en la placa ULA de 96 pocillos sin girar. Puede ser necesario aumentar el número de iPSC. El éxito de las células inmunitarias derivadas de iPSC depende totalmente de la capacidad de los cuerpos embrioides (EB) para convertirse en quistes (día 7 de diferenciación). Las EB inmunitarias derivadas de iPSC que no desarrollan quistes no formarán estroma cuando se coloquen en gelatina y no producirán progenitores mieloides. Después de la transferencia a la placa recubierta de gelatina, los EB deben permanecer unidos a la parte inferior de la placa. El movimiento de la placa debe hacerse con cuidado para no desalojarlos. Las placas deben cambiarse manualmente dos veces por semana y las células suspendidas deben pasar a Mac-CM2 o criopreservadas. Además, después de recolectar los progenitores mieloides suspendidos, deben adherirse al matraz de plástico no recubierto y generar células brillantes en campo claro con vacuolas, lo que indica macrófagos. El marcador de monocitos, CD14+, debe estar en un >90% en las células en suspensión. El marcador de macrófagos, CD68, debería aumentar con el tiempo, con ~50% de macrófagos expresando CD68+ después de 2 semanas (Figura 1D). La eficiencia de adhesión debe determinarse para cada línea celular. Logramos un promedio de 20% de eficiencia de adherencia. Para la polarización, los macrófagos M0 se polarizan a macrófagos M1 (iPSC-M1) o M2 (iPSC-M2) durante 48 h en medio de diferenciación II suplementado con diferentes estímulos: 100 ng/mL LPS y 20 ng/mL IFN-g para la polarización M1 o 50 ng/mL IL-4 y 20 ng/mL IL-13 para la polarización M2. El marcador de polarización M1 es CD80+ y la polarización M2 es CD206+.
El éxito de la generación del triple cocultivo puede evaluarse mediante inmunofluorescencia para los marcadores epiteliales de unión estrecha EPCAM, ECAD o ZO-1, o el marcador de unión estrecha endotelial CD31 (Figura 2C, Tabla 1). La funcionalidad del triple cocultivo también puede evaluarse mediante la resistencia epitelial/endotelial transeléctrica (TEER). Los cocultivos de organoides y endoteliales de las vías respiratorias bien ensamblados tendrán una mayor resistencia eléctrica, lo que indica una comunicación y conexión celular óptimas. Las agresiones ambientales, como los cigarrillos electrónicos o el desafío viral, comprometerán la integridad de la barrera epitelial y endotelial, lo que resultará en una reducción de la resistencia eléctrica del cocultivo (Figura 3A, B) y uniones estrechas desorganizadas (Figura 3C).

Figura 1: Diferenciación y caracterización de cultivos de epitelio, endotelio e inmunitarios de vías respiratorias derivados de iPSC. (A) Esquema de las diferenciaciones dirigidas por iPSC para el montaje de la iAirway. (B) Organoides de epitelio de las vías respiratorias derivados de iPSC caracterizados por campo claro (izquierda) y análisis de citometría de flujo (derecha) para EPCAM y ECAD. (C) Endotelio de las vías respiratorias derivado de iPSC caracterizado por campo claro (izquierda), inmunofluorescencia y análisis de citometría de flujo (derecha) para CD31. A la derecha se muestra el campo claro respectivo después de la clasificación CD31. (D) Los macrófagos derivados de iPSC se caracterizan mediante análisis de campo claro (izquierda) y citometría de flujo (derecha) para el marcador hematopoyético pan-CD45, el marcador de monocitos CD14 y el marcador de macrófagos CD68. Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
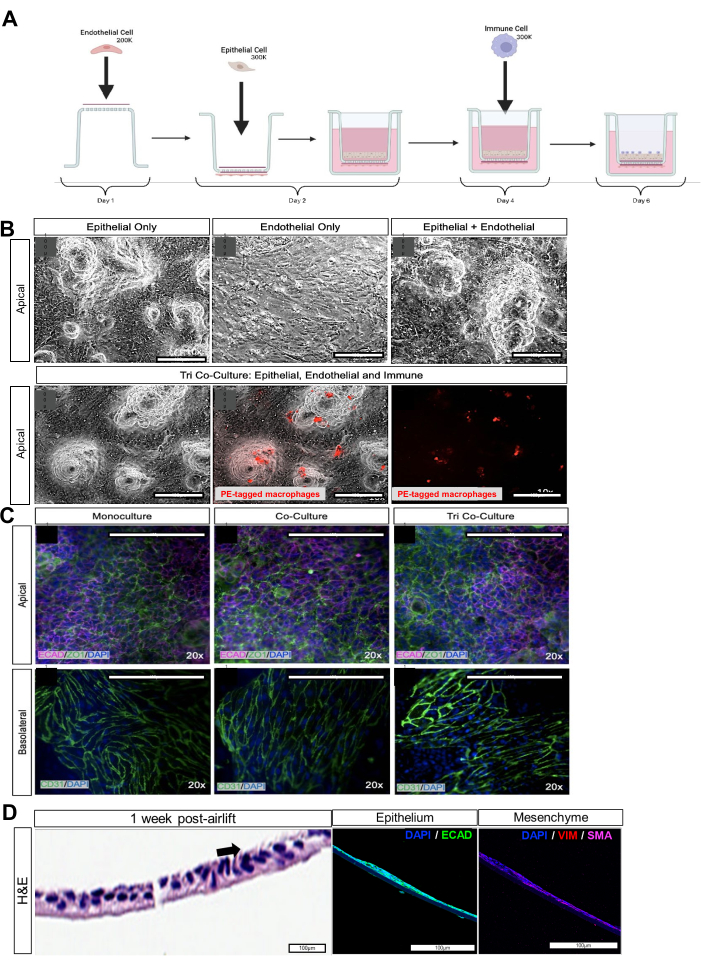
Figura 2: Cocultivo de células epiteliales, mesenquimales, endoteliales y macrófagos derivadas de iPSC. (A) Esquema del montaje de la vía aérea. (B) Imágenes de campo claro del respectivo monocultivo epitelial y endotelial, el bicultivo epitelial y endotelial, y el cocultivo epitelial, endotelial y macrófago. Macrófagos marcados con citotracker rojo. Barras de escala: 100 μm. (C) Tinción inmunofluorescente para el marcador de unión estrecha ZO-1 en el lado apical del inserto de cultivo celular y CD31 en el lado basolateral. Barras de escala: 100 μm. (D) Sección transversal del inserto de cultivo celular con organoides de vía aérea disociados en el lado apical, 1 semana después del levantamiento aéreo. El panel izquierdo con tinción de H&E con la flecha negra muestra las células ciliadas. El panel central, con imágenes de inmunofluorescencia, muestra el marcador epitelial E-cadherina (ECAD). El panel derecho, con imágenes de inmunofluorescencia, muestra marcadores mesenquimales como la vimentina (VIM) y la actina del músculo liso (SMA). Barras de escala: 100 μm. Haga clic aquí para ver una versión más grande de esta figura.
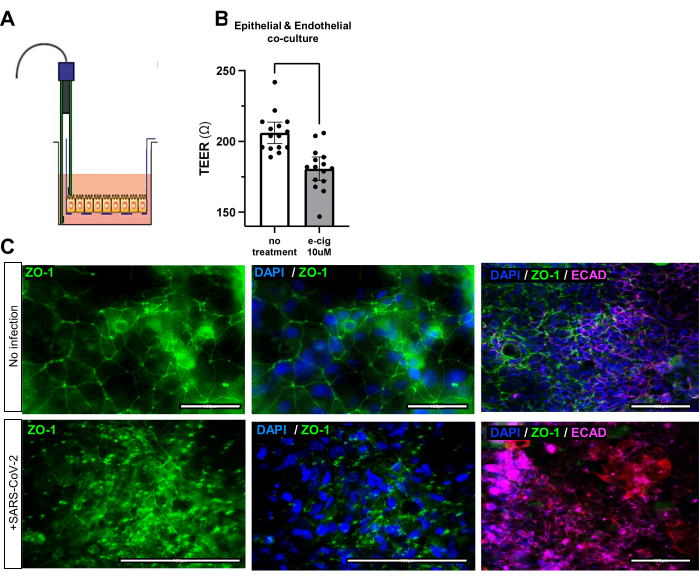
Figura 3: Cambios en la función de barrera de las vías respiratorias de las vías respiratorias expuestas a cigarrillos electrónicos y virus. (A) Esquema de la herramienta de medición de resistencia epitelial/endotelial transeléctrica (TEER). (B) Gráfico de barras de TEER después de 7 días de adición de cigarrillos electrónicos mentolados a los medios. Media +/- intervalo de confianza del 95%. N = 5 réplicas biológicas y 3 réplicas técnicas; Valor p <0,001. (C) Tinción inmunofluorescente para la proteína de unión estrecha ZO-1 antes y después de la infección por SARS-CoV-2. Obsérvese el diseño desordenado de ZO-1 después de la infección. Barras de escala: 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
| Anticuerpo | Aplicación | Dilución |
| CD 31 PECAM-1(APC) | citometría de flujo (FC) | 10 μl en tampón de 100 ul |
| EPCAM/CD 326 (APC) | FC | 1:500 |
| E-CAD/CD 324 (APC) | FC | 5 μl en tampón de 100 ul |
| CPM | FC | 1:200 |
| CD 45 (PE) | FC | 5 μl en tampón de 100 ul |
| CD 14 (FITC) | FC | 5 μl en tampón de 100 ul |
| CD 68 (PE) | FC | 5 μl en tampón de 100 ul |
| ZO-1 | Inmunofluorescencia (IF) | 1:300 |
| Vimentina | SI | 1:200 |
| SMA | SI | 1:100 |
Tabla 1: Anticuerpos utilizados en FACS e Inmunofluorescencia.
Archivo complementario 1: Composiciones de medios y búferes. Haga clic aquí para descargar este archivo.
Discusión
El desarrollo y la implementación de un modelo de barrera sangre-aire en las grandes vías respiratorias para el estudio de infecciones virales y otras toxinas requieren una atención meticulosa a los detalles para garantizar la diferenciación y función exitosas de los diversos tipos de células involucradas. Esta discusión abordará los factores clave para una diferenciación exitosa, los desafíos potenciales, las aplicaciones alternativas y las implicaciones para el estudio de las enfermedades humanas.
Para garantizar una diferenciación exitosa, es importante prestar atención al tipo de inserto de cultivo celular y al tamaño de los poros. Se deben utilizar poros grandes para garantizar la comunicación célula-célula a través de las capas de ECM. Es fundamental garantizar la densidad de siembra óptima para las líneas de células madre pluripotentes inducidas (iPSC). Una densidad adecuada facilita la diferenciación uniforme y evita la formación de grupos celulares no deseados, lo que conduce a una capa epitelial más homogénea y funcional. Para mantener una capa epitelial sana y funcional, es importante lavar la superficie apical antes de agregar cualquier compuesto, toxina o virus. Esto ayuda a eliminar la mucosidad acumulada, las células muertas y otros desechos, promoviendo así un entorno de cultivo estable y viable y permitiendo el acceso a las células epiteliales.
Para el componente endotelial, es esencial asegurarse de que las células estén correctamente clasificadas y sean homogéneas. Esto se puede lograr a través de técnicas como FACS, que garantiza que solo se utilicen las células endoteliales deseadas, manteniendo así la consistencia y la función.
Para el componente macrófago, a pesar de adherirse fácilmente al plástico, los macrófagos no se adhieren bien a las células epiteliales apicales. Aumentar el número de macrófagos puede ser beneficioso para garantizar una gran población de macrófagos en las vías respiratorias. Los macrófagos adherentes están mejor posicionados para interactuar con patógenos y otras células inmunitarias, lo que aumenta la relevancia del modelo. Si se prefiere el estudio de la señalización inmune endotelial, los macrófagos pueden sembrarse en el lado basolateral de los cultivos celulares insertados en el medio para imitar la población de monocitoscirculantes 22.
El modelo iAirway tiene varias otras aplicaciones importantes, incluido el estudio del desarrollo pulmonar de las vías respiratorias. El modelo se puede utilizar para estudiar los intrincados procesos involucrados en el desarrollo pulmonar, que implica la señalización multicelular entre diferentes poblaciones de células, lo que proporciona información sobre las condiciones normales y patológicas. Para estudiar el desarrollo alveolar y la enfermedad, los organoides de las vías respiratorias pueden sustituirse por organoides pulmonares distales (DLO)23,24 Esto permite a los investigadores estudiar el pulmón distal, incluido el desarrollo y la función alveolar. Esto es particularmente útil para generar y estudiar macrófagos alveolares, que juegan un papel clave en la inmunidad pulmonar.
El desarrollo de un modelo fiable y reproducible de la barrera sangre-aire en las vías respiratorias grandes conlleva varios desafíos. Las células progenitoras pulmonares deben expresar más del 50% de NKX2-1 para una diferenciación exitosa. Si no se alcanza el rendimiento, los cultivos de ALI pueden albergar más mesénquima o estar contaminados con células epiteliales no pulmonares. Mantener la esterilidad durante la siembra de las células endoteliales es un desafío importante, ya que se cultivan en el lado basolateral del inserto de cultivo celular. Esto evita que la tapa de la placa cierre el ambiente estéril, por lo que se deben utilizar otras placas durante la siembra de células endoteliales. Los contaminantes pueden alterar la cultura y comprometer la integridad del modelo. La mayoría de los cultivos de ALI se incuban durante un mínimo de 3 semanas para generar la mayoría de las células de las vías respiratorias, incluidas las células ciliadas. La mayoría de los protocolos siembran células basales y, por lo tanto, deben dar tiempo a los mecanismos de señalización para diferenciar las otras células de las vías respiratorias. El protocolo actual disocia los organoides de las vías respiratorias, que ya contienen muchas de las células de las vías respiratorias, aunque en cantidades más bajas en comparación con las ALIA maduras derivadas de HBEC. Se observan pocas células ciliadas junto con los tipos de células epiteliales y mesenquimales (Figura 2D). Para generar más células ciliadas, se puede añadir DAPT a los cultivos de organoides de las vías respiratorias y/o al medio ALI25. Además, esta plataforma solo ha probado la viabilidad a corto plazo de las células apicales y basolaterales después del levantamiento aéreo, cuando el medio basolateral se cambia a medios epiteliales y endoteliales 1:1. Es necesario realizar más investigaciones para probar la viabilidad durante un lapso de semanas, lo que puede aumentar la complejidad de las células en ALI.
El modelo de barrera sangre-aire tiene profundas implicaciones para el estudio de las enfermedades humanas y el desarrollo de intervenciones terapéuticas. El modelo se puede utilizar para seleccionar y optimizar agentes terapéuticos, incluidos los fármacos antivirales, proporcionando un entorno fisiológicamente relevante que imita las vías respiratorias humanas, especialmente con la exposición de las células de las vías respiratorias al aire. Las técnicas de knockout de genes se pueden emplear para estudiar mecanismos específicos de disfunción de la barrera y las interacciones huésped-patógeno. El modelo ofrece una plataforma para estudiar varios aspectos de las enfermedades respiratorias humanas, desde infecciones virales hasta afecciones crónicas como el asma y la EPOC. Esta comprensión puede conducir al desarrollo de terapias más efectivas y dirigidas.
En conclusión, el modelo de barrera hemato-aire de la vía aérea grande (iAirway) representa una poderosa herramienta para estudiar la disfunción de la barrera debida a infecciones virales y otras enfermedades respiratorias. Garantizar la diferenciación exitosa de los tipos de células, abordar los desafíos del desarrollo y explorar aplicaciones alternativas mejorará la utilidad y la precisión de este modelo. Su aplicación en estudios de orientación terapéutica y eliminación de genes subraya su potencial para avanzar en nuestra comprensión y tratamiento de las enfermedades respiratorias humanas.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue apoyada por el CIRM (DISC2COVID19-12022).
Materiales
| Name | Company | Catalog Number | Comments |
| 12 well plates | Corning | 3512 | |
| 12-well inserts, 0.4 µm, translucent | VWR | 10769-208 | |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Accutase | Innovative Cell Tech | AT104 | |
| Activin A | R&D Systems | 338-AC | |
| All-trans retinoic acid (RA) | Sigma-Aldrich | R2625 | |
| ascorbic acid | Sigma | A4544 | |
| B27 without retinoic acid | ThermoFisher | 12587010 | |
| BMP4 | R&D Systems | 314-BP/CF | |
| Bovine serum albumin (BSA) Fraction V, 7.5% solution | Gibco | 15260-037 | |
| Br-cAMP | Sigma-Aldrich | B5386 | |
| CD 14 (FITC) | BioLegend | 982502 | |
| CD 31 PECAM-1(APC) | R&D System | FAB3567A | |
| CD 45 (PE) | BD Biosciences | 560975 | |
| CD 68 (PE) | BioLegend | 33808 | |
| CHIR99021 | Abcam | ab120890 | |
| CPM | Fujifilm | 014-27501 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dispase | StemCellTech | 7913 | |
| DMEM/F12 | Gibco | 10565042 | |
| Dorsomorphin | R&D Systems | 3093 | |
| E-CAD/CD 324 (APC) | BioLegend | 324107 | |
| EGF | R&D Systems | 236-EG | |
| EGM2 Medium | Lonza | CC-3162 | |
| EPCAM/CD 326 (APC) | BioLegend | 324212 | |
| FBS | Gibco | 10082139 | |
| FGF10 | R&D Systems | 345-FG/CF | |
| FGF7 | R&D Systems | 251-KG/CF | |
| Fibronectin | Fisher | 356008 | |
| Forskolin | Abcam | ab120058 | |
| Glutamax | Life Technologies | 35050061 | |
| Ham’s F12 | Invitrogen | 11765-054 | |
| HEPES | Gibco | 15630-080 | |
| IBMX (3-Isobtyl-1-methylxanthine) | Sigma-Aldrich | I5879 | |
| IL-3 | Peprotech | 200-03 | |
| Iscove’s Modified Dulbecco’s Medium (IMDM) + Glutamax | Invitrogen | 31980030 | |
| Knockout Serum Replacement (KSR) | Life Technologies | 10828028 | |
| Matrigel | Corning | 354230 | |
| M-CSF | Peprotech | 300-25 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR plus Kit (10/case) | Stem Cell Tech | 5825 | |
| N2 | ThermoFisher | 17502048 | |
| NEAA | Life Technologies | 11140050 | |
| PBS | Gibco | 10010023 | |
| Pen/strep | Lonza | 17-602F | |
| ReleSR | Stem Cell Tech | 5872 | |
| RPMI1640 + Glutamax | Life Technologies | 12633012 | |
| SB431542 | R&D Systems | 1614 | |
| SCF | PeproTech | 300-07 | |
| SMA | Invitrogen | 50-9760-80 | |
| STEMdiff APEL 2 Medium | STEMCELL Technologies | 5275 | |
| TrypLE Express | Gibco | 12605-028 | |
| VEGF165 | Preprotech | 100-20 | |
| Vimentin | Cell Signaling | 5741S | |
| Y-27632 (Rock Inhibitor) | R&D Systems | 1254/1 | |
| ZO-1 | Invitrogen | 339100 |
Referencias
- Wu, M., Zhang, X., Lin, Y., Zeng, Y. Roles of airway basal stem cells in lung homeostasis and regenerative medicine. Respir Res. 23 (1), 122 (2022).
- Blackburn, J. B., Li, N. F., Bartlett, N. W., Richmond, B. W. An update in club cell biology and its potential relevance to chronic obstructive pulmonary disease. Am J Physiol Lung Cell Mol Physiol. 324 (5), L652-L665 (2023).
- Fahy, J. V., Dickey, B. F. Airway mucus function and dysfunction. N Engl J Med. 363 (23), 2233-2247 (2010).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Ann Am Thorac Soc. 15 (Suppl 3), S143-S148 (2018).
- Khalilgharibi, N., Mao, Y. To form and function: On the role of basement membrane mechanics in tissue development, homeostasis and disease. Open Biol. 11 (2), 200360 (2021).
- Mcdonald, D. M., Yao, L. C., Baluk, P. Dynamics of airway blood vessels and lymphatics: Lessons from development and inflammation. Proc Am Thorac Soc. 8 (6), 504-507 (2011).
- Parker, D., Prince, A. Innate immunity in the respiratory epithelium. Am J Respir Cell Mol Biol. 45 (2), 189-201 (2011).
- Davis, J. D., Wypych, T. P. Cellular and functional heterogeneity of the airway epithelium. Mucosal Immunol. 14 (5), 978-990 (2021).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clin Microbiol Rev. 24 (1), 210-229 (2011).
- Fosse, J. H., Haraldsen, G., Falk, K., Edelmann, R. Endothelial cells in emerging viral infections. Front Cardiovasc Med. 8, 619690 (2021).
- Wang, Y., Zheng, J., Wang, X., Yang, P., Zhao, D. Alveolar macrophages and airway hyperresponsiveness associated with respiratory syncytial virus infection. Front Immunol. 13, 1012048 (2022).
- Costa, A., De Souza Carvalho-Wodarz, C., Seabra, V., Sarmento, B., Lehr, C. M. Triple co-culture of human alveolar epithelium, endothelium and macrophages for studying the interaction of nanocarriers with the air-blood barrier. Acta Biomater. 91, 235-247 (2019).
- Leibel, S. L., Mcvicar, R. N., Winquist, A. M., Snyder, E. Y. Generation of 3D whole lung organoids from induced pluripotent stem cells for modeling lung developmental biology and disease. J Vis Exp. (170), e62456 (2021).
- Mccauley, K. B., Hawkins, F., Kotton, D. N. Derivation of epithelial-only airway organoids from human pluripotent stem cells. Curr Protoc Stem Cell Biol. 45 (1), e51 (2018).
- Choi, K. -. Y. G., Wu, B. C., Lee, A. H. -. Y., Baquir, B., Hancock, R. E. W. Utilizing organoid and air-liquid interface models as a screening method in the development of new host defense peptides. Front Cell Infect Microbiol. 10, 228 (2020).
- Fulcher, M. L., Randell, S. H. Human nasal and tracheo-bronchial respiratory epithelial cell culture. Methods Mol Biol. 945, 109-121 (2013).
- Hao, S., et al. Long-term modeling of SARS-COV-2 infection of in vitro cultured polarized human airway epithelium. mBio. 11 (6), e02852-e02920 (2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nat Cell Biol. 17 (8), 994-1003 (2015).
- Van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long-term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), e71098 (2013).
- Pouyanfard, S., et al. Human-induced pluripotent stem cell-derived macrophages ameliorate liver fibrosis. Stem Cells. 39 (12), 1701-1717 (2021).
- Ardini-Poleske, M. E., et al. Lungmap: The molecular atlas of lung development program. Am J Physiol Lung Cell Mol Physiol. 313 (5), L733-L740 (2017).
- Ronaghan, N. J., et al. M1-like, but not m0- or m2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), e0276013 (2022).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Rep. 3 (3), 394-403 (2014).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods. 14 (11), 1097-1106 (2017).
- Firth, A. L., et al. Generation of multiciliated cells in functional airway epithelia from human induced pluripotent stem cells. Proc Natl Acad Sci U S A. 111 (17), E1723-E1730 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados