Method Article
iPSC-abgeleitete Co-Kultur von Epithel-, mesenchymalen, endothelialen und Immunzellen zur Modellierung der Integrität der Atemwegsbarriere bei Lungengesundheit und -erkrankung
In diesem Artikel
Zusammenfassung
Dieser Artikel beschreibt die Generierung eines komplexen, mehrzelligen Atemwegsbarrieremodells, das aus induzierten pluripotenten Stammzellen (iPSC)-abgeleitetem Lungenepithel, Mesenchym, Endothelzellen und Makrophagen in einer Luft-Flüssigkeits-Grenzflächenkultur besteht.
Zusammenfassung
Menschliches Lungengewebe besteht aus einem miteinander verbundenen Netzwerk aus Epithel, Mesenchym, Endothel und Immunzellen von den oberen Atemwegen des Nasopharynx bis zum kleinsten Alveolarsack. Die Wechselwirkungen zwischen diesen Zellen sind entscheidend für die Entwicklung und Krankheit der Lunge und wirken als Barriere gegen schädliche Chemikalien und Krankheitserreger. Aktuelle in vitro Co-Kulturmodelle verwenden immortalisierte Zelllinien mit unterschiedlichem biologischem Hintergrund, die das zelluläre Milieu oder die Interaktionen der Lunge möglicherweise nicht genau repräsentieren. Wir differenzierten humane iPSCs in 3D-Lungenorganoide (die sowohl Epithel als auch Mesenchym enthalten), Endothelzellen und Makrophagen. Diese wurden in einem Luft-Flüssig-Grenzflächenformat (ALI) cokultiviert, um eine epitheliale/mesenchymale apikale Barriere zu bilden, die mit Makrophagen und einer basolateralen endothelialen Barriere (iAirway) besetzt war. iPSC-abgeleitete iAirways zeigten eine Verringerung der Barriereintegrität als Reaktion auf eine Infektion mit Atemwegsviren und Zigarettentoxinen. Dieses Lungen-Co-Kultursystem mit mehreren Linien bietet eine Plattform für die Untersuchung zellulärer Interaktionen, Signalwege und molekularer Mechanismen, die der Lungenentwicklung, der Homöostase und dem Fortschreiten der Krankheit zugrunde liegen. iAirways ahmen die menschliche Physiologie und zelluläre Interaktionen genau nach, können aus patienteneigenen iPSCs generiert werden und können so angepasst werden, dass sie verschiedene Zelltypen der Atemwege einbeziehen. Insgesamt bieten iPSC-abgeleitete iAirway-Modelle ein vielseitiges und leistungsstarkes Werkzeug für die Untersuchung der Barriereintegrität, um genetische Treiber für Krankheiten, Krankheitserregerreaktion, Immunregulation und Wirkstoffforschung oder -wiederverwendung in vitro besser zu verstehen, mit dem Potenzial, unser Verständnis und unsere Behandlung von Atemwegserkrankungen zu verbessern.
Einleitung
Die Blut-Luft-Schranke in den großen Atemwegen umfasst die Luftröhre, die Bronchien und die Bronchiolen. Es spielt eine entscheidende Rolle bei der Erhaltung der Gesundheit der Atemwege und besteht aus dem Epithel der Atemwege, der Basalmembran, den Blutgefäßen und Endothelzellen sowie den Immunzellen. Zu den primären Epithelzellen in den Atemwegen gehören Basalzellen, Keulenzellen, Flimmerzellen und Becherzellen. Basalzellen, die als Stammzellen des Epithels der Atemwege fungieren, sind multipotente Vorläuferzellen mit hohen proliferativen und Selbsterneuerungsfähigkeiten, aus denen reife Epithelzellen der Atemwege hervorgehen1. Keulzellen sind nicht-flimmernde, sekretorische Zellen, die zur Aufrechterhaltung der Atemwegsschleimhaut beitragen, indem sie schützende Proteine und Tenside sezernieren2. Becherzellen, die sich im Lumen und in den submukkösen Drüsen befinden, sezernieren Muzine, um Ablagerungen einzufangen und die Atemwege zu schützen3. Flimmerzellen sind integraler Bestandteil des mukoziliären Rollationsmechanismus und verhindern die Ansammlung schädlicher Mikroorganismen4. Die Basalmembran besteht aus einer extrazellulären Matrix, die die Struktur stützt5. Die Luftröhre und der Rest der Atemwege sind von einem reichhaltigen Netzwerk von Blutgefäßen umgeben, die mit Endothelzellen ausgekleidet sind, die eine wichtige Rolle bei der Unterstützung der Luftröhrenfunktion spielen, indem sie Nährstoffe und Sauerstoff liefern, Abfallstoffe entfernen, Entzündungen regulieren und zur Gewebereparatur und Angiogenese beitragen6. Schließlich sind Atemwegsmakrophagen gewebespezifische Immunzellen, die für den Schutz der Atemwege vor Infektionen, die Beseitigung eingeatmeter Partikel und die Aufrechterhaltung einer ausgewogenen Immunantwort unerlässlich sind7.
Die koordinierten Aktionen von Epithel-, Mesenchym-, Endothelzellen und Makrophagenzellen sind entscheidend für eine effektive Immunantwort auf Krankheitserreger in den Atemwegen8. Epithelzellen bilden die erste Verteidigungslinie gegen Virusinfektionen, indem sie als physikalische Barriere fungieren, wobei Tight Junctions den Durchgang von Schadstoffen einschränken. Die koordinierte Wirkung von Flimmerzellen und Becherzellen hilft, eingeatmete Partikel, Krankheitserreger und Ablagerungen einzufangen und zu entfernen4. Darüber hinaus produzieren Epithelzellen der Atemwege Zytokine und Chemokine, um Immunzellen zu rekrutieren9. Endothelzellen erhalten die vaskuläre Integrität, verhindern die Ausbreitung von Viruspartikeln durch den Blutkreislauf, regulieren Adhäsionsmoleküle (VCAM-1) hoch, um die Adhäsion von Immunzellen zu erleichtern, und produzieren entzündungsfördernde Zytokine, um Immunzellen aus dem Blutkreislauf an den Ort der Infektion zu rekrutieren10. Atemwegsmakrophagen verschlingen und verdauen Viruspartikel, infizierte Zellen und Trümmer, präsentieren T-Zellen virale Antigene und produzieren Zytokine, um andere Immunzellen zu aktivieren und zu rekrutieren, zusammen mit Typ-I-Interferonen, um die Virusreplikation zu hemmen11. Die koordinierten Aktionen von Epithel-, Mesenchym-, Endothel- und Makrophagenzellen schaffen ein robustes und dynamisches Abwehrsystem, das die Atemwege vor Virusinfektionen schützt und die Gesundheit der Atemwege erhält.
Das Verständnis der dynamischen Wechselwirkungen zwischen verschiedenen Zelltypen in der menschlichen Lunge ist entscheidend für das Verständnis der Reaktion der Lunge auf Virusinfektionen, entzündliche Erkrankungen und die Verabreichung von Medikamenten. In-vitro-Cokulturen ermöglichen die Untersuchung der Zell-Zell-Signalübertragung zwischen Epithel, Endothelzellen und angeborenen Immunzellen12. Wir haben das erste authentische Lungenmodell vom Mehrzelltyp entwickelt, das von patientenspezifischen hiPSCs abgeleitet wurde13. Dies umfasst sowohl epitheliale als auch mesenchymale Zellpopulationen, die in einer 3D-Orientierung gebildet werden. Anschließend können die Lungenvorläuferzellen zu einem "Atemwegsorganoid"14 differenziert, auf sterilen Zellkultureinsätzen kultiviert und einer Luft-Flüssigkeits-Grenzfläche (ALI) ausgesetzt werden, wodurch die Bedingungen der menschlichen Atemwege repliziertwerden 15,16,17. iPSC-abgeleitete Endothelzellen werden auf der basolateralen Seite der Membran kultiviert, wobei ihre Ausrichtung in den menschlichen Atemwegen unterhalb der epithelialen/mesenchymalen Schicht in der Basalmembran nachgeahmt wird. Schließlich werden iPSC-abgeleitete Makrophagen an die apikale Seite der Membran angehängt, die mit Epithelzellen interagieren und auf Aktivierungssignale warten (Abbildung 1A). Dieses Modell bildet die Biologie und Funktion der Atemwege genau nach. Wir gehen davon aus, dass aus hiPSC gewonnene, patientenspezifische, authentische iAirway-Kulturen vom Mehrzelltyp am besten geeignet sind, um die intrinsische, akute Reaktion der Atemwegsbarriere und von Krankheitserregern, einschließlich Virusinfektionen, aufzuklären. Zum Beispiel kann dieses Modell verwendet werden, um (1) den Eintritt und die Replikation von Viren zu untersuchen, (2) die anfängliche Immunantwort durch epitheliale und gewebespezifische Immunzellen zu untersuchen, (3) die Integrität und Funktion der Barriere zu untersuchen, (4) die Wirksamkeit von Therapeutika zu testen und (5) zelluläre und molekulare Mechanismen der Pathogenese in einem patientenspezifischen Modell zu untersuchen.
Dieser Artikel beschreibt ein detailliertes Protokoll zur Vorbereitung von mehrzelligen Lungen-Cokulturen zur Untersuchung zellulärer Reaktionen auf Virusinfektionen.
Protokoll
Dieses Studienprotokoll wurde vom Institutional Review Board des Human Research Protections Program der UCSD (181180) genehmigt. Dieses Protokoll verwendet kleine Moleküle und Wachstumsfaktoren, um die Differenzierung von pluripotenten Stammzellen in Atemwegszellen, Endothelzellen und Makrophagen zu steuern. Diese Zellen werden dann auf Zellkultureinsätzen co-kultiviert und in einer Luft-Flüssigkeits-Grenzfläche polarisiert. Die Details zu den verwendeten Reagenzien, Verbrauchsmaterialien und Geräten sind in der Materialtabelle aufgeführt. Die Medien- und Pufferzusammensetzungen sind in der Zusatzdatei 1 enthalten.
1. Erzeugung von iPSC-abgeleiteten Atemwegsorganoiden (Tag 1 - 30)
HINWEIS: Dieses Protokoll beschreibt die Schritte, die zur Erzeugung von iPSC-abgeleiteten Atemwegsorganoiden erforderlich sind (Abbildung 1B), gemäß der in Leibel et al.13 beschriebenen Methodik. Der Prozess umfasst die Induktion eines definitiven Endoderms (Tage 1-3), die Erzeugung eines vorderen Vorderdarm-Endoderms (Tage 4-6) und die Differenzierung in Lungenvorläuferzellen (Tage 7-16). Eine ausführliche Methodik ist der Vorveröffentlichung13 zu entnehmen. Die folgenden Schritte beschreiben die Erzeugung von Atemwegsorganoiden aus Lungenvorläuferzellen.
- Extraktion und Dissoziation von Lungenvorläufer-Sphäroiden aus EZM-Polymer (Tag 17)
- Polymer der extrazellulären Matrix (ECM) (8-9 mg/ml) auf Eis auftauen.
- Aspirieren Sie verbrauchte Medien mit einem Vakuumaspirator aus Lungenorganoiden, die in die ECM eingebettet sind.
HINWEIS: Verwenden Sie für nachfolgende Aspirationsschritte einen Vakuumsauger, sofern nicht anders angegeben. - Geben Sie 1 ml 2 U/ml-Dispase, ergänzt mit 10 μM ROCK1-Inhibitor (ROCKi), zu den Zellen und verwenden Sie eine P1000-Pipette, um die Lungenvorläuferzellen in der EZM manuell zu resuspendieren. 30 min bei 37 °C inkubieren und die Mischung alle 15 min resuspendieren, um die Wirksamkeit der Dissoziationsdissoziation durch mechanische Verarbeitung zu verbessern.
- 15 Minuten vor der Verwendung 45 ml PBS bei Raumtemperatur zum Abkühlen in einen Gefrierschrank bei -20 °C geben. Stellen Sie sicher, dass PBS kälter als 4 °C ist, um in den nachfolgenden Schritten eine optimale ECM-Depolymerisation zu gewährleisten.
- Nach 30 Minuten Dispase-Inkubation das Organoid und die Dispaselösung in ein konisches 15-ml-Röhrchen überführen.
- Fügen Sie gekühltes PBS (2 mL pro 1 mL Protease) hinzu, um das restliche Organoid- und ECM-Material von der Platte zu waschen und zu sammeln. Resuspendieren Sie die Organoide mit einer P1000-Pipette und zentrifugieren Sie sie 5 Minuten lang bei 400 x g .
HINWEIS: Alle Zentrifugationsschritte werden bei Raumtemperatur durchgeführt, sofern in diesem Protokoll nichts anderes angegeben ist. - Nach der Zentrifugation sollte ein trübes ECM-Pellet mit Organoiden sichtbar sein. Saugen Sie den Überstand vorsichtig mit einer Pipette an und vermeiden Sie dabei das ECM-Pellet.
- Führen Sie eine zweite PBS-Wäsche mit gekühltem PBS durch, resuspendieren Sie mit einer P1000-Pipette und zentrifugieren Sie sie 5 Minuten lang bei 400 x g . Aspirieren Sie den Überstand mit einer Pipette, wobei ~100 μl Restlösung übrig bleiben.
- Geben Sie 2 ml Trypsin-ähnliche Protease zu den Organoiden in dem konischen 15-ml-Röhrchen. Resuspendieren Sie mit einer P1000-Pipette. 10-12 Minuten bei 37 °C inkubieren, dabei das Röhrchen umdrehen oder schnippen, um die Mischung nach der Hälfte der Inkubation wieder zu resuspendieren.
HINWEIS: Führen Sie 10-12 Minuten Trypsin-ähnliche Proteasedissoziation durch, um Organoide als Aggregate zu passieren. - Nach 12 min stoppen Sie die Trypsin-ähnliche Proteasereaktion durch Zugabe von 2 mL 2% FBS in das Basismedium (Stop Media, siehe Zusatzdatei 1). Die Lösung mit einer P1000-Pipette resuspendieren und 5 Minuten lang bei 400 x g zentrifugieren.
- Aspirieren Sie den Überstand und resuspendieren Sie die Organoide in Stop Media, ergänzt mit 10 μM ROCKi. Entnehmen Sie eine 10-μl-Probe für die Zellzählung mit einem Hämozytometer und Trypanblau. Halten Sie die Organoide während der Zählung auf Eis.
- Berechnen Sie das Volumen, das benötigt wird, um 100.000 Zellen pro Vertiefung zu erhalten. Die Aliquot-Zelle aggregiert in ein 1,5-ml-Mikrozentrifugenröhrchen und zentrifugiert sie 5 Minuten lang bei 400 x g. Überschüssigen Überstand entfernen, wobei 10 μl Restmedium übrig bleiben.
- Resuspendieren Sie das Zellpellet in 200 μl kaltem ECM-Polymer (vermeiden Sie Blasen und arbeiten Sie schnell, um eine vorzeitige Polymerisation zu verhindern). Geben Sie 200 μl der EZM und der Zellmischung in einer 12-Well-Platte auf den Boden jeder Vertiefung. Lassen Sie die ECM bei Raumtemperatur in der Biosicherheitswerkbank 5 Minuten lang teilweise polymerisieren.
- Stellen Sie die Platte für 30-60 min in einen 37 °C-Inkubator, um die ECM-Polymerisation abzuschließen. Fügen Sie dann 1,5 ml organoides Induktionsmedium für die Atemwege hinzu (Ergänzende Datei 1).
- Wechseln Sie das Medium 14 Tage lang bis zum 30. Tag jeden zweiten Tag. Wenn das Medium innerhalb von 24 h gelb wird, erhöhen Sie das Volumen auf 2 ml.
2. Erzeugung von iPSC-abgeleiteten Endothelzellen (Tag 1 - 14)
HINWEIS: Das folgende Verfahren beschreibt die Erzeugung von Endothelzellen aus iPSCs (Abbildung 1C), adaptiert von Patsch et al.18. Diese Methode umfasst die Präparation von Platten, die Differenzierung von iPSCs, die Induktion, Sortierung und Expansion von Endothelzellen. Tabelle 1 listet die in dieser Studie verwendeten Antikörper auf.
- Platintierung von iPSCs für die endotheliale Differenzierung (Tag 0)
- Beginnen Sie mit der Differenzierung der Endothelzellen, wenn die hiPSCs eine Konfluenz von 70 % bis 80 % erreichen. Geben Sie eine Stunde vor der Dissoziation 10 μM ROCKi Y-27632 in jede Vertiefung.
- Aspirieren Sie das Medium, waschen Sie die Wells mit 1 mL PBS und dissoziieren Sie die iPSCs durch Zugabe von 1 mL Zellablösungslösung pro Well einer 12-Well-Platte. 20 min bei 37 °C inkubieren.
- Neutralisieren Sie die Zellablösung, indem Sie 2 mL Stop Media in die Vertiefungen geben. Pipettieren, um eine einzellige Suspension zu erhalten. Die Zellen werden in ein konisches 15-ml-Röhrchen überführt und 5 Minuten lang bei 300 x g zentrifugiert.
- Aspirieren Sie den Überstand, resuspendieren Sie iPS-Zellen in iPS-Kulturmedien, die mit 10 μM ROXI ergänzt sind, und führen Sie eine Zellzählung durch. Platte von 100.000 hiPSCs pro Well einer ECM-beschichteten 12-Well-Platte in 1 mL iPSC-Kulturmedium mit 10 μM ROCKi. Über Nacht bei 37 °C inkubieren.
HINWEIS: Die Seeding-Dichte für die iPSC-endotheliale Differenzierung muss möglicherweise pro Zelllinie optimiert werden. Beurteilen Sie die Differenzierungseffizienz mit Hilfe der Durchflusszytometrie für CD31 an Tag 6.
- Laterale Mesoderm-Induktion (Tag 1-3)
- Aspirieren Sie iPS-Kulturmedien aus plattierten iPS-Zellen und fügen Sie 3 mL N2B27-Basismedium hinzu, ergänzt mit 6 μM CHIR und 25 ng/ml BMP4 pro Vertiefung (Ergänzende Datei 1). Erwärmen Sie das Medium, bevor Sie es den Zellen hinzufügen. Wechseln Sie das Medium 3 Tage lang nicht.
- Induktion von Endothelzellen (Tag 4-5)
- An Tag 4 aspirieren Sie das N2B27-Medium und fügen Sie 2 ml endotheliales Differenzierungsmedium (EDM) hinzu, ergänzt mit 200 ng/mL VEGF165 und 2 μM Forskolin pro Well. Wechseln Sie die Medien an Tag 5.
- Sortierung und Neubeschichtung von Endothelzellen (Tag 6)
- Bereiten Sie an Tag 5 oder 6 einen mit Fibronektin beschichteten T75-Kolben für die Fluoreszenz-aktivierte Zellsortierung (FACS) vor, indem Sie 1 mg Fibronektin in sterilem Wasser rekonstituieren, um eine Fibronektinlösung von 100 μg/ml herzustellen. Der T75-Kolben wird mit 6 ml der Fibronektinlösung bestreicht und eine Stunde lang bei Raumtemperatur inkubiert. Aspirieren Sie die Fibronektinlösung und waschen Sie sie mit sterilem Wasser. Lassen Sie den T75-Kolben bei Raumtemperatur trocknen. Extra hergestellte Kolben können bei 4 °C gelagert werden.
- Bereiten Sie endotheliale Erhaltungsmedien (EMM) vor18.
- An Tag 6 reichern Sie iPSC-abgeleitete Endothelzellen über FACS mit dem CD31-Antikörper18 an.
- Geben Sie 10 μM ROCKi Y-27632 eine Stunde vor der Dissoziation bei 37 °C in jede Vertiefung. Saugen Sie das Medium an und waschen Sie es mit PBS. 1 ml vorgewärmte Zellablösungslösung pro Vertiefung einer 12-Well-Platte zugeben und 8-10 Minuten bei 37 °C inkubieren.
- Vorsichtig pipettieren, um eine einzellige Ablösung zu gewährleisten. Übertragen Sie die Zellen in ein konisches 15-ml-Röhrchen und fügen Sie das gleiche Volumen an Stoppmedium hinzu. 5 min bei 300 x g zentrifugieren.
- Aspirieren Sie den Überstand und resuspendieren Sie die Endothelzellen in 1 mL Stop Media, ergänzt mit 10 μM ROCKi. Führen Sie die Zellen durch den 70-μm-Filter, indem Sie zuerst 1 ml Stoppmedium hinzufügen, um den Filter zu benetzen, und pipettieren Sie die Zellen dann durch den Filter. Entnehmen Sie eine 10-μl-Probe für die Zellzählung mit einem Hämozytometer und Trypanblau. Halten Sie die Zellen während der Zählung auf Eis.
- Führen Sie eine Zellzählung durch. Bereiten Sie ein Aliquot von 200.000 Zellen als ungefärbte Negativkontrolle vor. Übertragen Sie die restlichen Zellen in ein 1,5-ml-Eppendorf-Röhrchen und fügen Sie 10 μl CD31-APC für jeweils 1 Million Zellen in 100 μl FACS-Puffer hinzu. 30 min auf einem Rotator bei 4 °C inkubieren.
- Sobald die Inkubation abgeschlossen ist, zentrifugieren Sie das Eppendorf-Röhrchen mit den Zellen für 5 Minuten bei 300 x g und waschen Sie die Zellen durch Zugabe von 1 ml PBS. Wiederholen Sie den Wasch- und Zentrifugationsschritt zweimal. Entfernen Sie den Überstand zwischen den Wäschen manuell.
- Resuspendieren Sie das Zellpellet 5 Minuten vor der Sortierung in 1 ml FACS-Puffer und 5 μg/ml DAPI-Lösung zur Viabilitätsfärbung. Sortieren Sie nach institutionellen Richtlinien.
- Sammeln Sie FACS-sortierte Zellen in einem konischen 15-ml-Röhrchen mit 2 mL EMM. Zentrifugieren Sie das konische 15-ml-Röhrchen mit den Zellen für 5 min bei 300 x g. Aspirieren Sie den Überstand und resuspendieren Sie Endothelzellen in 10 ml EMM, ergänzt mit 10 μM ROCKi Y-27632 und Penicillin Streptomycin (1%).
- Übertragen Sie die resuspendierten FACS-angereicherten iPSC-abgeleiteten Endothelzellen in den mit Fibronektin beschichteten Kolben. Die Zellen gleichmäßig verteilen und über Nacht in einen 37 °C heißen Inkubator stellen.
HINWEIS: Verwenden Sie mindestens 500.000 Zellen und maximal 2.000.000 Zellen pro T75-Kolben.
- Expansion und Kryokonservierung von sortierten Endothelzellen (Tag 7+)
- Wechseln Sie das EMM-Medium alle 2-3 Tage nach der FACS-Anreicherung. Sobald der T75-Kolben konfluent wird (ca. 7 Tage nach FACS, abhängig von der Aussaatdichte), können die iPSC-abgeleiteten Endothelzellen für Co-Kulturen verwendet oder für zukünftige Anwendungen kryokonserviert werden.
- Bereiten Sie vor der Zelldissoziation eine 2x endotheliale Gefrierlösung vor (80% Endo-CM2, 20% DMSO, 20 μM ROCKi).
- Beschriften Sie Kryoröhrchen in einem ethanolbeständigen Pen mit den entsprechenden Informationen. Linien-ID, Durchgangsnummer, Nährmedium, "Auftauen in eine 6-Vertiefung", Datum des Einfrierens.
- Wenn die sortierten iPSC-abgeleiteten Endothelzellen konfluent sind, wird die Dissoziation eingeleitet.
- Waschen Sie den T75-Kolben mit 5 ml PBS -/-.
- Dissoziieren Sie iPSC-abgeleitete Endothelzellen mit 5 ml Trypsin-ähnlicher Protease pro T75. Inkubieren Sie die Zellen 10 Minuten lang bei 37 °C und überprüfen Sie regelmäßig den T75-Wert, um sicherzustellen, dass sich die Zellen angehoben haben.
- Neutralisieren Sie die Reaktion, indem Sie 5 mL Stoppmedium hinzufügen. 10 ml Zellen in Lösung in ein 15-ml-Röhrchen überführen. Bei 300 x g 5 min zentrifugieren.
- Aspirieren Sie den Überstand, resuspendieren Sie die Endothelzellen in E-CBM-Medien und entnehmen Sie eine 10-μl-Probe zur Zählung mit einem Hämazytometer.
- Nach der Zellzählung aliquotieren Sie 1 Million Zellen pro 0,5 ml EGM2-Medium.
HINWEIS: Der folgende Schritt ist zeitkritisch. Bereiten Sie Kryoröhrchen und Gefriergefäße vor, die sofort verwendet werden können. - Aliquotieren Sie das gleiche Volumen von 2x Gefrierlösung mit Endothelzellen. Die Endkonzentration beträgt 90 % Endo-CM2, 10 % DMO und 10 μM ROCKi (1 ml/1 Million Zellen).
- Die verschlossenen Fläschchen sofort in eine Gefrierkammer geben und über Nacht bei -80 °C und am nächsten Tag zur Langzeitlagerung in flüssigen Stickstoff (-180 °C) stellen.
3. Erzeugung von iPSC-abgeleiteten Makrophagen (Tag 1 - 26)
HINWEIS: Dieses Verfahren beschreibt die Schritte zur Generierung von Makrophagen aus iPSCs (Abbildung 1D), adaptiert von van Wilgenburg et al.19 und Pouyanfard et al.20. Es umfasst die Einzelzelladaption von iPSCs, die Differenzierung des Embryoidkörpers, die Bildung von Makrophagen-Vorläuferzellen und die Reifung von Makrophagen.
- Einzelzelladaption von iPSCs
- Wenn iPSCs eine Konfluenz von ~70 % bis 90 % ohne sichtbare Anzeichen einer Differenzierung erreichen, beginnen Sie die Einzelzellpassage mit einer Trypsin-ähnlichen Protease.
- Verbrauchte Medien absaugen und mit PBS spülen. Entfernen Sie PBS und fügen Sie eine Trypsin-ähnliche Protease hinzu (1 ml/Vertiefung einer 6-Well-Platte, 500 μl/Vertiefung einer 12-Well-Platte). Inkubieren Sie bei 37 °C für 2-5 Minuten, bis sich die iPS-Kolonien von der Platte lösen.
- Neutralisieren Sie die Trypsin-ähnliche Protease mit einem gleichen Volumen Stop Media (1 ml/Vertiefung einer 6-Well-Platte, 500 μl/Vertiefung einer 12-Well-Platte). Zentrifugieren Sie die Zellen bei 200 x g für 5 min.
- Aspirieren Sie den Überstand und resuspendieren Sie die Zellen vorsichtig in iPS-Kulturmedien mit 10 μM ROCKi. Durchgang auf neue ECM-beschichtete Platten. Wiederholen Sie dies für 2-3 Passagen, bevor Sie kryokonservieren oder die einzelligen adaptierten iPSCs verwenden.
HINWEIS: Passen Sie das Durchgangsverhältnis von 1:2 bis 1:10 an, basierend auf der Zellgesundheit und -anpassung. Darüber hinaus liefern iPS-Zellen, die mindestens drei Einzelzellpassagen durchlaufen haben und sich in einer niedrigen Passage befinden, eine optimale Makrophagendifferenzierung.
- Bildung des Embryoidkörpers (Tag 0-6)
- Wenn einzellig adaptierte iPSCs eine Konfluenz von ~75 % erreichen, werden iPSCs mit Trypsin-ähnlicher Protease gemäß den Schritten 3.1-3.4 durchgeleitet.
- Resuspendieren Sie die Zellen in Stop Media und geben Sie sie durch ein 70-μm-Zellsieb in ein frisches konisches 50-ml-Röhrchen, um Klumpen zu entfernen. Resuspendieren Sie die Zellen und entnehmen Sie eine 10-μl-Probe für die Zellzählung mittels Hämazytometer.
- Für die Erzeugung von Embryoidkörpern (EB) werden 8.000 bis 50.000 Zellen pro Vertiefung einer 96-Well-Platte mit ultraniedriger Bindung (ULA) plattiert. Berechnen Sie die Gesamtzahl der Zellen, die benötigt werden, um 60 Wells einer 96-Well-ULA-Platte zu säen.
HINWEIS: Die Aussaatdichte von iPSCs kann pro Zelllinie optimiert werden. - Zentrifugieren Sie iPS-Zellen in 15 mL konisch bei 200 x g für 5 min. Aspirieren Sie den Überstand.
- Für 480.000 iPSCs (8.000 Zellen/Well in 60 Wells) resuspendieren Sie in 6 mL (100 μl/Well in 60 Wells) EB-Induktionsmedium.
- Geben Sie 150 μl PBS in die 36 äußeren Vertiefungen einer 96-Well-ULA-Platte mit rundem Boden.
- Resuspendieren und übertragen Sie iPSCs in EB-Medien in einen Medienrinnen. Geben Sie mit einer Mehrkanalpipette 100 μl/Vertiefung Zellsuspension in die mittleren 60 Vertiefungen der 96-Well-ULA-Platte. Resuspendieren Sie iPSCs in EB-Medien intermittierend, um eine gleichmäßige Verteilung der Zellen zu gewährleisten.
- Die 96-Well-Platte bei 300 x g für 5 min bei 4 °C zentrifugieren (falls verfügbar). Übertragen Sie die Platten in einen 37 °C heißen Inkubator.
- Nach 48-72 h 50 μL des Mediums wechseln (halber Medienwechsel). Überprüfen Sie nach 6 Tagen auf Zystenbildung.
HINWEIS: Einige iPS-Linien bilden EBs früher oder leichter als andere. Überwachen Sie die EB-Bildung und stellen Sie sicher, dass EBs zum richtigen Zeitpunkt übertragen werden (sie sollten Zysten entwickeln).
- Gelatinebeschichtung und EB-Transfer für die Bildung von Makrophagen-Vorläuferzellen (Tag 6-19)
- Bereiten Sie zwei mit 0,1 % Gelatine beschichtete 6-Well-Platten vor. 1 ml 0,1 % Gelatine pro Mulde hinzufügen und 20 Minuten bei Raumtemperatur inkubieren. Die Gelatinelösung ansaugen und die Platten 30-60 Minuten in der Haube trocknen lassen.
- Übertragen Sie EBs mit einer serologischen 2-ml-Pipette von der 96-Well-Platte auf die gelatinebeschichteten 6-Well-Platten. Verteilen Sie ca. 8-10 EBs pro Vertiefung einer mit Gelatine beschichteten 6-Well-Platte.
- Entfernen Sie vorsichtig die verwendeten EB-Medien aus dem Transfer. Fügen Sie 2 ml Makrophagen-Kulturmedium 1 (Mac-CM1) pro Vertiefung hinzu. EB's ungestört bei 37 °C mit 5% CO2 für 5-7 Tage inkubieren.
HINWEIS: Im Idealfall kann eine 96-Well-Platte mit Embryoidkörpern in zwei 6-Well-Platten aufgeteilt werden. Wenn die EBs schlecht entwickelt sind, kann die Anzahl der pro 6-Well-Platte übertragenen EBs angepasst werden, um den Schritt der Differenzierung von iPSC zu Embryoidkörper zu optimieren.
- Generierung von Makrophagen-Vorläuferzellen
- Tauschen Sie 2/3 des Mediums zweimal pro Woche aus und erhöhen Sie das Volumen auf 3 ml, wenn sich die Farbe des Mediums ändert.
- Überprüfen Sie die Kulturen zwischen den Tagen 8 und 19, um festzustellen, ob sie für die Ernte von Makrophagen-Vorläuferzellen bereit sind. Wenn sich EBs lösen, übertragen Sie die EBs auf eine frisch beschichtete Platte mit Mac-CM1 und inkubieren Sie 7 Tage lang ungestört.
HINWEIS: Die Aufrechterhaltung des Makrophagen-Vorläufer-bildenden Komplexes ist für die Entwicklung und kontinuierliche Generierung von Makrophagen-Vorläuferzellen von entscheidender Bedeutung. Optimierte Makrophagen-Vorläufer-bildende Komplexe erzeugen kontinuierlich myeloische Vorläuferzellen für 2-6+ Monate.
- Ernte myeloischer Vorläuferzellen (Tag 19-26+)
- Wenn sich Makrophagen-Vorläuferzellen in Suspension befinden, ernten Sie das Medium mit Zellen und geben Sie es in ein konisches 50-ml-Röhrchen. Bei 200 x g 5 min zentrifugieren und den Überstand vorsichtig entfernen.
- Resuspendieren Sie Makrophagen-Vorläuferzellen in Mac-CM2 und geben Sie sie in eine unbehandelte sterile Kulturschale/einen sterilen Kolben. Bei 37 °C mit 5 % CO2 3-4 Tage inkubieren.
HINWEIS: Abhängig von der Anzahl der geernteten Zellen in eine 10-cm-Petrischale (3-4 Vertiefungen einer 6-Well-Platte), einen T25-Kolben (1-2 Vertiefungen einer 6-Well-Platte) oder einen T75-Kolben (volle 6-Well-Platte) mit dem entsprechenden Medienvolumen umfüllen. Verwenden Sie 5-6 ml Medium für einen T25-Kolben, 10-12 mL Medium in einer Petrischale und 12-15 mL Medium für einen T75-Kolben. Für nachfolgende Ernten können myeloische Vorläuferzellen und Makrophagenzellen aus früheren Ernten gepoolt werden, wenn sie aus der gleichen Linie/myeloischen bildenden Komplexen stammen. Stellen Sie einfach sicher, dass der Kolben ausreicht, um die Anzahl der Zellen in den Kolben zu halten und zu füttern. Makrophagen vermehren sich nicht; Sie werden aus Makrophagen-Vorläuferzellen erzeugt. Makrophagen können gepoolt und für 2-6 Wochen aufbewahrt werden, ohne Expressionsmarker zu verlieren.
- Ernte von Makrophagen
HINWEIS: Nach 14-tägiger Makrophagendifferenzierung in Mac-CM2-Medien sind Makrophagenkulturen bereit für die Co-Kultur- oder Durchflusszytometrie-Analyse.- Sammeln Sie verbrauchte Medien und geben Sie sie in ein konisches 50-ml-Röhrchen. Spülen Sie den Kolben/die Platte mit PBS, um Medienreste und Zellen zu entfernen.
- Geben Sie Basismedien in den Kolben (3 mL für T25 und 5 mL für T75) und verwenden Sie einen sterilen Zellschaber, um die Zellen vom Boden des Kolbens/der Platte zu lösen. Übertragen Sie die Zellen in ein konisches Röhrchen und wiederholen Sie das Schaben bei Bedarf.
- Zentrifugieren Sie bei 200 x g für 5 min bei Raumtemperatur. Entfernen Sie vorsichtig den Überstand und resuspendieren Sie die Zellen in einem geeigneten Medium oder Puffer für die weitere Verwendung.
4. Co-Kultur von Atemwegszellen, Endothelzellen und Makrophagen
HINWEIS: Dieses Verfahren beschreibt die Schritte für die Co-Kultur von Atemwegszellen, Endothelzellen und Makrophagen (Abbildung 1A) unter Verwendung von Zellkultureinsätzen, adaptiert von Costa et al.12.
- ECM-Beschichtung von Zellkultureinsätzen für die Co-Kultur (Tag 0 der Co-Kultur)
- Beschichten Sie 3,0 μm poröse Polyester (PET)-Zellkultureinsätze mit 4 mg/ml ECM-Lösung. Die apikale Seite der Einsätze der Zellkultureinsätze in der Platte wird kurz mit 4 mg/ml ECM-Lösung bestreut. Pipettieren Sie die restliche ECM-Lösung ab. Stellen Sie die Platte für 1 h bei 37 °C in den Inkubator.
- Besorgen Sie sich eine große Petrischale (100 mm x 20 mm oder 150 mm x 20 mm). Mit einer sauberen Pinzette die Zellkultureinsätze von der 12-Well-Platte steril in die große Petrischale übertragen. Drehen Sie die Einsätze um, so dass die basolaterale Seite aufrecht steht.
- Die basolaterale Seite mit 4 mg/ml ECM-Lösung bestreichen. Pipettieren Sie die restliche ECM-Lösung ab. Stellen Sie die Petrischale mit den ECM-beschichteten Zellkultureinsätzen in einen 37 °C heißen Inkubator, um sie über Nacht zu trocknen.
- Dissoziation und Plattierung von iPSC-abgeleiteten Endothelzellen (Tag 1 der Co-Kultur)
- Der Kolben T75 wird mit PBS gewaschen und die Lösung aspiriert. 5 ml trypsinähnliche Protease in den T75-Kolben geben und 8 min bei 37 °C inkubieren. Beurteilen Sie visuell, ob sich die Endothelzellen aus dem Kolben gehoben haben.
HINWEIS: Verlängern Sie die Zeit der Typsin-ähnlichen Proteasedissoziation, wenn sich die iPSC-abgeleiteten Endothelzellen nicht aus dem Kolben gehoben haben. - Stichkolben zur Sicherstellung der Ablösung von Endothelzellen und zur Überführung der Zellen in einen konischen 15-ml-Kolben. Fügen Sie 5 ml Stoppmedium hinzu, um die Dissoziation zu stoppen. Zellen bei 300 x g für 5 min zentrifugieren.
- Das Überstand wird aspiriert und das Zellpellet in 1 ml Endothelkulturmedium mit 10 μM RROCKi resuspendiert. Besorgen Sie sich 10 μl resuspendierte Lösung für die Zellzählung und legen Sie die Zellen während der Zählung auf Eis.
- Verwenden Sie 150.000 iPSC-Endothelzellen pro 12-mm-Zellkultureinsatz in 100 μl Endothelkulturmedien. Passen Sie das jeweilige Medienvolumen an, um die gewünschte Anzahl von Zellen pro Einsatz zu erreichen.
- Entnehmen Sie eine Petrischale mit ECM-beschichteten 3,0 μm Zellkultureinsätzen aus dem Inkubator (siehe Schritte 4.1-4.3).
- Resuspendieren Sie iPSC-Endothelzellen und pipettieren Sie 100 μl mit 150.000 Zellen auf den invertierten Zellkultureinsatz (basolaterale Seite nach oben). Wiederholen Sie das Pipettieren für jeden der vorbereiteten Zellkultureinsätze
- Setzen Sie die Zellen vorsichtig in den Inkubator um und lassen Sie sie 3 h lang ungestört.
- Geben Sie in einer 12-Well-Platte 1 ml Endothelkulturmedium in jede Vertiefung (für die jeweilige Anzahl der vorbereiteten Zellkultureinsätze).
- Nehmen Sie die Petrischale mit den Endothelzellen aus dem Inkubator. Übertragen Sie die Zellkultureinsätze mit einer sauberen Pinzette vorsichtig mit dem Endothelkulturmedium in die Platte (drehen Sie den Einsatz so um, dass die Unterseite nun nach unten in das Medium zeigt).
- Überprüfen Sie visuell am Mikroskop, ob Endothelzellen anhaften. Stellen Sie die Platte über Nacht in einen 37 °C heißen Inkubator.
- Der Kolben T75 wird mit PBS gewaschen und die Lösung aspiriert. 5 ml trypsinähnliche Protease in den T75-Kolben geben und 8 min bei 37 °C inkubieren. Beurteilen Sie visuell, ob sich die Endothelzellen aus dem Kolben gehoben haben.
- Dissoziation und Plattierung von iPSC-abgeleiteten Organoiden der Atemwege (Tag 2 der Co-Kultur)
HINWEIS: In den Schritten 1.1.1-1.1.15 finden Sie Informationen zur Isolierung von Atemwegsorganoiden aus dem ECM-Polymer. Ändern Sie die Dauer der Dissoziation der Trypsin-ähnlichen Protease (Schritt 1.1.10) auf 15-20 Minuten, um eine einzellige Suspension zu erhalten.- Nach 15-20 Minuten stoppen Sie die Trypsin-ähnliche Proteasereaktion durch Zugabe von 3 ml Stop Media. Die Lösung mit einer P1000-Pipette resuspendieren und 5 Minuten lang bei 400 x g zentrifugieren.
- Aspirieren Sie den Überstand und resuspendieren Sie die Atemwegsorganoide in 1 mL Atemwegsexpansionsmedium mit 10 μM ROCKi. Entnehmen Sie eine 10-μl-Probe für eine Hämazytometer-Zellzählung und legen Sie die Zellen während der Zählung auf Eis.
- 300.000 iPSC-Atemwegszellen in 500 μl Atemwegsexpansionsmedium pro 12-mm-Zellkultureinsatz säen. Passen Sie das jeweilige Medienvolumen an, um die gewünschte Anzahl von Zellen pro vorbereitetem Einsatz zu erreichen.
- Entnehmen Sie die Platte mit Zellkultureinsätzen mit Endothelzellen (auf der basolateralen Seite ausgesät) aus dem 37 °C-Inkubator.
- Resuspendieren Sie iPSC-Atemwegszellen und pipettieren Sie 500 μl mit 300.000 Zellen in die apikale Kammer jedes Zellkultureinsatzes. Stellen Sie die Platte für 48 h in einen 37 °C Inkubator, wobei die apikalen Zellen unter Flüssig-Flüssig-Bedingungen gehalten werden.
- Co-Kultur mit Lufttransport (Tag 4 der Co-Kultur)
- Entfernen Sie das Medium von der apikalen Seite des Zellkultureinsatzes. Wechseln Sie das basolaterale Medium zu einem 1:1-Medium zur Differenzierung der Atemwege und einem Endothelkulturmedium. Stellen Sie die Platte wieder in den Inkubator.
- Dissoziation und Plattierung von iPSC-abgeleiteten Makrophagen (Tag 5 der Co-Kultur)
- Dissoziation von iPSC-abgeleiteten Makrophagen aus dem Kolben mit Hilfe eines Zellschabers (siehe Schritte 3.22-3.24). Bei 300 x g für 5 min zentrifugieren und den Überstand aspirieren.
- Resuspendieren Sie iPSC-Makrophagen in 1 ml Mac-CM2. Entnehmen Sie eine 10-μl-Probe für die Zellzählung und legen Sie die Zellen während der Zählung auf Eis. Die Anzahl der Makrophagen spiegelt die Anzahl der ausgesäten Atemwegszellen wider (Verhältnis von Makrophagen zu Atemwegszellen 1:1).
- Nach der Zellzählung aliquotieren Sie 300.000 Makrophagen in 35-μl-Medien pro Vertiefung mit vorbereiteten Zellkultureinsätzen in ein 1,5-ml-Mikrozentrifugenröhrchen. Bei 200 x g 5 min zentrifugieren.
- Nach der Zentrifugation den Überstand herauspipettieren. Resuspendieren Sie Makrophagen in entsprechenden Mac-CM2 aus Berechnungen.
- Entfernen Sie Einsätze mit Co-Kulturen von Endothel- und Atemwegszellen aus dem Inkubator. 300.000 Makrophagen in 35 μl Mac-CM2 auf die apikale Seite des Zellkultureinsatzes säen. Stellen Sie die Platte für 48 h in einen 37 °C heißen Inkubator.
HINWEIS: Um die Adhärenz von iPSC-Immunzellen an den Zellkultureinsatz zu bestätigen, können die Zellen mit einer Fluoreszenzsonde markiert werden. Bestätigung der Adhärenz durch Mikroskopie für das Fluoreszenzsignal 48 Stunden nach der Makrophagen-Platingierung.
- Dreifache Co-Kultur (Tag 7 der Co-Kultur)
- Stellen Sie sicher, dass die Co-Kultur für nachgelagerte Anwendungen wie Infektionsstudien, Messungen des transepithelialen elektrischen Widerstands (TEER) und Barriereintegritätstests bereit ist.
Ergebnisse
Es gibt mehrere Phasen, in denen die Differenzierung von iPSC-abgeleiteten Atemwegsorganoiden, Endothelzellen, Immunzellen und Co-Kulturen als erfolgreich abgeschlossen beurteilt werden kann. Differenzierungen können in verschiedenen iPS-Linien durchgeführt werden, und dieses Protokoll wurde in mindestens fünf verschiedenen Linien getestet. Das Protokoll muss an jede neue iPSC-Linie angepasst werden, insbesondere durch Modifikation und Optimierung der Seeding-Dichte.
Die erfolgreiche Ausbeute von iPSC-abgeleiteten Atemwegsorganoiden kann per Hellfeld beurteilt werden und weist vier Merkmale auf: definierte Grenzen/Kanten, transluzente/zystische Morphologie, Fähigkeit zur Proliferation/Expansion und Mangel an nekrotischen Zellen. Atemwegsorganoide, die unscharf erscheinen, nehmen im Laufe der 2 Wochen der Kultur nicht an Größe zu und sollten nicht für Co-Kulturexperimente verwendet werden. Organoide mit einer dicken luminalen Schicht an der Peripherie vs. Die transluzenten/zystischen Organoide können weiterhin für nachfolgende Experimente verwendet werden. Die transluzenten/zystischen Atemwegsorganoide bestehen jedoch überwiegend aus Basalzellen, während die dicken Dualmembran-Organoide überwiegend aus Keulenzellen bestehen. Da sich Basalzellen leicht vermehren und ausdehnen können, eignen sie sich besser für die Luft-Flüssig-Interphasenkultur und Polarisation. Weitere Methoden zur Beurteilung der erfolgreichen Ausbeute an iPSC-abgeleiteten Lungenorganoiden sind die Durchflusszytometrie-Analyse im Lungenvorläuferstadium (Tag 16 der Differenzierung) für Oberflächenmarker CPM (Tabelle 1), eine erfolgreiche Differenzierungsausbeute >50% CPM+ Zellen.
Stellen Sie bei der Dissoziation der Atemwegsorganoide und der Luft-Flüssig-Interphase-Kultur sicher, dass das gesamte EZM-Polymer entfernt wurde, da es sonst verhindert, dass sich die Zellen auf der Membran ausdehnen. Die Zellen sollten am 3. Tag der Kultur, vor dem Airlifting, konfluierend sein. Die Bestätigung der Zelltypen in den iAirways kann durch Färbung der jeweiligen zelltypspezifischen Marker beurteilt werden: Basalzellen (p63+), Clubzellen (SCGB1A1+), Becherzellen (MUC5AC+) und Flimmerzellen (AcTub+). Die Charakterisierung und die charakteristischen Lungenzelltyp-spezifischen Marker werden auf dem LungMAP21 verifiziert. Mesenchym kann mit Antikörpern gegen Vimentin oder Aktin der glatten Muskulatur nachgewiesen werden. Um mehr Flimmerzellen zu erzeugen, können die Kulturen über einen längeren Zeitraum ein Luftlifting oder die Zugabe von DAPT erfordern.
Die erfolgreiche Ausbeute an iPSC-abgeleiteten Endothelzellen kann mittels Hellfeld beurteilt werden, wobei eine kopfsteinpflasterartige Morphologie gezeigt wird (Tag 6 der iPSC-abgeleiteten Endotheldifferenzierung). Eine erfolgreiche iPSC-abgeleitete Endothelkultur enthält >50 % CD31+-Zellen, und es sollten genügend Zellen erzeugt werden, so dass die Ausbeute nach der Sortierung mehr als 500.000 Zellen betragen sollte. Zellen können passageiert oder kryokonserviert werden, und der CD31-Marker sollte bei jeder Passage oder neuen Kultur über den Fluss getestet werden. Zellen sollten nicht über P4 hinaus passaget werden. Als Referenz siehe iPSC-abgeleitete Endothelzellen vor/nach CD31-Sortierung (Abbildung 1C). Die Endothelzellen sind flach und haben einen großen Zellkörper mit länglicher und spindelförmiger Morphologie.
Für die Makrophagendifferenzierung sollten die Embryoidkörper am Boden der ULA-Vertiefung verbleiben, und nur ein EB sollte sich in jeder Vertiefung befinden. Sie sollten bis zum 5. bis 7. Tag zystische Veränderungen zeigen. Wenn sie nach der Zentrifugation kein EB bilden, säen Sie die iPSCs ohne Schleudern in die 96-Well-ULA-Platte. Möglicherweise ist es erforderlich, die Anzahl der iPSCs zu erhöhen. Die erfolgreiche Ausbeute von iPSC-abgeleiteten Immunzellen hängt vollständig von der Fähigkeit der Embryoidkörper (EBs) ab, sich zu Zysten zu entwickeln (Tag 7 der Differenzierung). iPSC-abgeleitete Immun-EBs, die keine Zysten entwickeln, bilden kein Stroma, wenn sie auf Gelatine plattiert werden, und produzieren keine myeloischen Vorläuferzellen. Nach dem Transfer auf die mit Gelatine beschichtete Platte sollten die EBs am Boden der Platte haften bleiben. Die Bewegung der Platte sollte vorsichtig erfolgen, um sie nicht zu verschieben. Die Platten sollten zweimal pro Woche manuell gewechselt werden, und die suspendierten Zellen sollten in Mac-CM2 eingeführt oder kryokonserviert werden. Darüber hinaus sollten sie nach der Ernte der suspendierten myeloischen Vorläuferzellen an dem unbeschichteten Kunststoffkolben haften und unter Hellfeld helle Zellen mit Vakuolen erzeugen, die auf Makrophagen hinweisen. Der Marker für Monozyten, CD14+, sollte in den suspendierten Zellen >90% betragen. Der Makrophagenmarker, CD68, sollte im Laufe der Zeit zunehmen, wobei ~50% der Makrophagen nach 2 Wochen CD68+ exprimieren (Abbildung 1D). Die Adhäsionseffizienz sollte für jede Zelllinie bestimmt werden. Wir erreichen einen durchschnittlichen Haftungsgrad von 20 %. Für die Polarisation werden M0-Makrophagen für 48 h entweder mit M1 (iPSC-M1) oder M2 (iPSC-M2) Makrophagen im Differenzierungsmedium II polarisiert, ergänzt mit verschiedenen Stimuli: 100 ng/mL LPS und 20 ng/mL IFN-g für die M1-Polarisation oder 50 ng/mL IL-4 und 20 ng/mL IL-13 für die M2-Polarisation. Der Marker für die M1-Polarisation ist CD80+ und die M2-Polarisation ist CD206+.
Die erfolgreiche Generierung der Triple-Co-Kultur kann durch Immunfluoreszenz für die epithelialen Tight Junction-Marker EPCAM, ECAD oder ZO-1 oder den endothelialen Tight Junction-Marker CD31 beurteilt werden (Abbildung 2C, Tabelle 1). Die Funktionalität der Triple-Co-Kultur kann auch über den transelektrischen Epithel-/Endothelwiderstand (TEER) beurteilt werden. Gut zusammengesetzte Organoid- und Endothel-Cokulturen der Atemwege weisen einen höheren elektrischen Widerstand auf, was auf eine optimale Zellkommunikation und -verbindung hinweist. Umwelteinflüsse wie E-Zigaretten oder virale Herausforderungen beeinträchtigen die Integrität der Epithel- und Endothelbarriere, was zu einem verringerten elektrischen Widerstand der Co-Kultur (Abbildung 3A,B) und unorganisierten Tight Junctions (Abbildung 3C) führt.

Abbildung 1: Differenzierung und Charakterisierung von iPSC-abgeleiteten Atemwegsepithel-, Endothel- und Immunkulturen. (A) Schematische Darstellung der iPSC-gerichteten Differenzierungen für den Aufbau des iAirways. (B) iPSC-abgeleitete Organoide des Atemwegsepithels, charakterisiert durch Hellfeld- (links) und Durchflusszytometrie-Analyse (rechts) für EPCAM und ECAD. (C) iPSC-abgeleitetes Atemwegsendothel, charakterisiert durch Hellfeld- (links), Immunfluoreszenz- und Durchflusszytometrie-Analyse (rechts) für CD31. Rechts ist das jeweilige Hellfeld nach der CD31-Sortierung dargestellt. (D) iPSC-abgeleitete Makrophagen werden durch Hellfeld- (links) und Durchflusszytometrie-Analyse (rechts) für den pan-hämatopoetischen Marker CD45, den Monozytenmacher CD14 und den Makrophagenmarker CD68 charakterisiert. Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
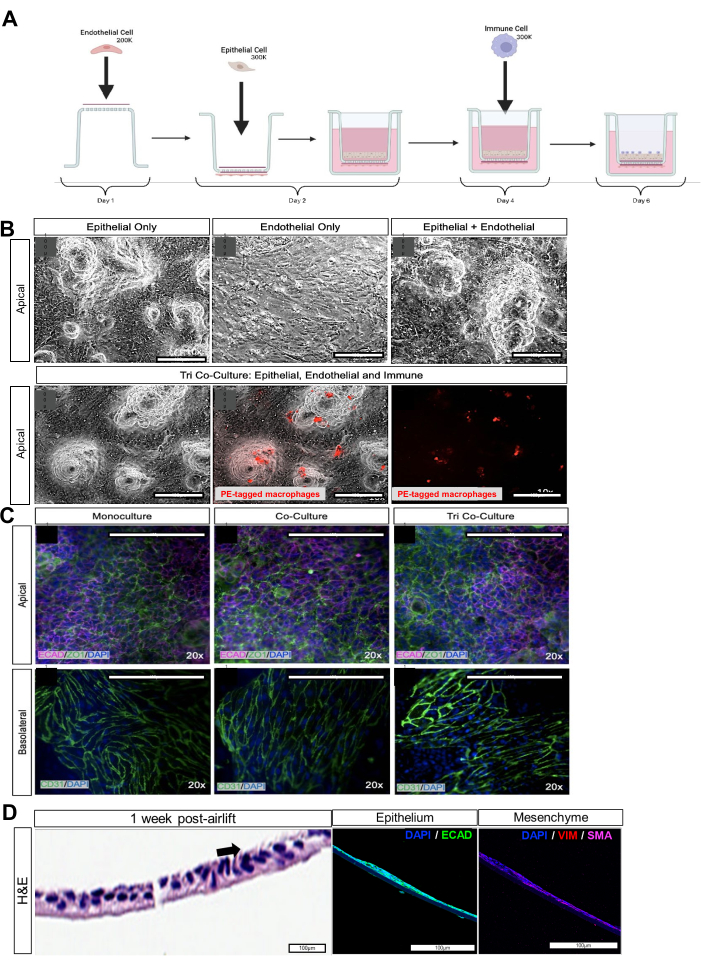
Abbildung 2: Co-Kultur von iPSC-abgeleiteten Epithel-, mesenchymalen, Endothel- und Makrophagenzellen. (A) Schematische Darstellung des Zusammenbaus des iAirways. (B) Hellfeldbilder der jeweiligen epithelialen und endothelialen Monokultur, der epithelialen und endothelialen Bikultur und der epithelialen, endothelialen und Makrophagen-Cokultur. Makrophagen, die mit rotem Cytotracker markiert sind. Maßstabsbalken: 100 μm. (C) Immunfluoreszenzfärbung für den Tight-Junction-Marker ZO-1 auf der apikalen Seite des Zellkultureinsatzes und CD31 auf der basolateralen Seite. Maßstabsbalken: 100 μm. (D) Querschnitt des Zellkultureinsatzes mit dissoziierten Atemwegsorganoiden auf der apikalen Seite, 1 Woche nach dem Luftlift. Das linke Feld mit H&E-Färbung mit dem schwarzen Pfeil zeigt Flimmerzellen. Das mittlere Bild mit Immunfluoreszenzbildgebung zeigt den epithelialen Marker E-Cadherin (ECAD). Das rechte Bild mit Immunfluoreszenzbildgebung zeigt mesenchymale Marker wie Vimentin (VIM) und Aktin der glatten Muskulatur (SMA). Maßstabsbalken: 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
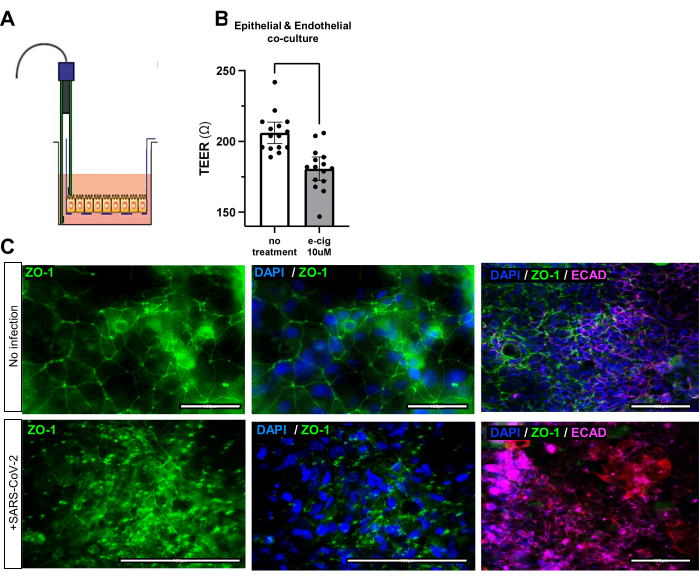
Abbildung 3: Veränderungen der Barrierefunktion der Atemwege von iAirways, die E-Zigaretten und Viren ausgesetzt waren. (A) Schematische Darstellung des Messwerkzeugs für den transelektrischen Epithel-/Endothelwiderstand (TEER). (B) Balkendiagramm des TEER nach 7 Tagen Zugabe von Menthol-E-Zigaretten zu den Medien. Mittleres Konfidenzintervall von +/- 95 %. N = 5 biologische und 3 technische Replikate; p-Wert <0,001. (C) Immunfluoreszenzfärbung des Tight-Junction-Proteins ZO-1 vor und nach einer Infektion mit SARS-CoV-2. Beachten Sie das ungeordnete Layout von ZO-1 nach der Infektion. Maßstabsstäbe: 50 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Antikörper | Anwendung | Verdünnung |
| CD 31 PECAM-1(APC) | Durchflusszytometrie (FC) | 10 μl in 100 ul Puffer |
| EPCAM/CD 326 (APC) | FC | 1:500 |
| E-CAD/CD 324 (APC) | FC | 5 μl in 100 ul Puffer |
| CPM | FC | 1:200 |
| CD 45 (PE) | FC | 5 μl in 100 ul Puffer |
| CD 14 (FITC) | FC | 5 μl in 100 ul Puffer |
| CD 68 (PE) | FC | 5 μl in 100 ul Puffer |
| ZO-1 | Immunfluoreszenz (IF) | 1:300 |
| Vimentin | WENN | 1:200 |
| SMA | WENN | 1:100 |
Tabelle 1: Antikörper, die bei FACS und Immunfluoreszenz verwendet werden.
Ergänzende Datei 1: Medien- und Pufferzusammensetzungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Die Entwicklung und Implementierung eines Modells der Blut-Luft-Schranke in den großen Atemwegen zur Untersuchung von Virusinfektionen und anderen Toxinen erfordert viel Liebe zum Detail, um die erfolgreiche Differenzierung und Funktion der verschiedenen beteiligten Zelltypen zu gewährleisten. In dieser Diskussion werden Schlüsselfaktoren für eine erfolgreiche Differenzierung, potenzielle Herausforderungen, alternative Anwendungen und Implikationen für die Erforschung menschlicher Krankheiten behandelt.
Um eine erfolgreiche Differenzierung zu gewährleisten, ist es wichtig, auf die Art des Zellkultureinsatzes und die Porengröße zu achten. Große Poren sollten verwendet werden, um die Zell-Zell-Kommunikation durch die Schichten der EZM zu gewährleisten. Die Sicherstellung der optimalen Aussaatdichte für induzierte pluripotente Stammzelllinien (iPSC) ist von entscheidender Bedeutung. Die richtige Dichte erleichtert die gleichmäßige Differenzierung und verhindert die Bildung unerwünschter Zellklumpen, was zu einer homogeneren und funktionelleren Epithelschicht führt. Um eine gesunde und funktionelle Epithelschicht zu erhalten, ist es wichtig, die apikale Oberfläche zu waschen, bevor Verbindungen, Toxine oder Viren hinzugefügt werden. Dies hilft, angesammelten Schleim, abgestorbene Zellen und andere Ablagerungen zu entfernen, wodurch eine stabile und lebensfähige Kulturumgebung gefördert und der Zugang zu den Epithelzellen ermöglicht wird.
Bei der endothelialen Komponente ist es wichtig, dass die Zellen richtig sortiert und homogen sind. Dies kann durch Techniken wie FACS erreicht werden, die sicherstellen, dass nur die gewünschten Endothelzellen verwendet werden, wodurch Konsistenz und Funktion erhalten bleiben.
Was die Makrophagenkomponente betrifft, so haften Makrophagen trotz ihres leichten Anhaftens an Kunststoff nicht gut an apikalen Epithelzellen. Eine Erhöhung der Anzahl der Makrophagen kann von Vorteil sein, um eine große Population von Makrophagen in den iAirways zu gewährleisten. Adhärente Makrophagen sind besser in der Lage, mit Krankheitserregern und anderen Immunzellen zu interagieren, was die Relevanz des Modells erhöht. Wenn die Untersuchung der endothelialen Immunsignalgebung bevorzugt wird, können die Makrophagen in die basolaterale Seite der Zellkulturinsertionen in den Medien ausgesät werden, um die zirkulierende Monozytenpopulationnachzuahmen 22.
Das iAirway-Modell hat mehrere andere wichtige Anwendungen, darunter die Untersuchung der Lungenentwicklung der Atemwege. Das Modell kann verwendet werden, um die komplizierten Prozesse zu untersuchen, die an der Lungenentwicklung beteiligt sind, die eine mehrzellige Signalübertragung zwischen verschiedenen Zellpopulationen beinhaltet, und gibt Einblicke in normale und pathologische Zustände. Um die Entwicklung und Erkrankung der Alveolen zu untersuchen, können Atemwegsorganoide durch distale Lungenorganoide (DLOs) ersetzt werden.23,24 Dies ermöglicht es Forschern, die distale Lunge zu untersuchen, einschließlich der Alveolarentwicklung und -funktion. Dies ist besonders nützlich für die Generierung und Untersuchung von Alveolarmakrophagen, die eine Schlüsselrolle bei der Immunität der Lunge spielen.
Die Entwicklung eines zuverlässigen und reproduzierbaren Modells der Blut-Luft-Schranke in großen Atemwegen ist mit mehreren Herausforderungen verbunden. Lungenvorläuferzellen müssen mehr als 50 % NKX2-1 exprimieren, um eine erfolgreiche Differenzierung zu gewährleisten. Wenn die Ausbeute nicht erreicht wird, können die ALI-Kulturen mehr Mesenchym beherbergen oder mit Nicht-Lungenepithelzellen kontaminiert sein. Die Aufrechterhaltung der Sterilität während der Beschichtung von Endothelzellen ist eine große Herausforderung, da sie auf der basolateralen Seite des Zellkultureinsatzes kultiviert werden. Dadurch wird verhindert, dass der Plattendeckel die sterile Umgebung verschließt, so dass während der Aussaat von Endothelzellen andere Platten verwendet werden müssen. Verunreinigungen können die Kultur stören und die Integrität des Modells beeinträchtigen. Die meisten ALI-Kulturen werden mindestens 3 Wochen lang inkubiert, um die meisten Atemwegszellen, einschließlich Flimmerzellen, zu erzeugen. Die meisten Protokolle säen Basalzellen aus und müssen daher Zeit für Signalmechanismen lassen, um die anderen Atemwegszellen zu differenzieren. Das derzeitige Protokoll dissoziiert Organoide der Atemwege, die bereits viele der Atemwegszellen enthalten, wenn auch in geringeren Mengen im Vergleich zu reifen HBEC-abgeleiteten ALI. Es sind nur wenige Flimmerzellen zusammen mit epithelialen und mesenchymalen Zelltypen zu sehen (Abbildung 2D). Um mehr Flimmerzellen zu erzeugen, kann DAPT zu den Organoidkulturen der Atemwege und/oder den ALI-Medien hinzugefügt werden25. Diese Plattform hat auch nur die kurzfristige Lebensfähigkeit der apikalen und basolateralen Zellen nach dem Lufttransport getestet, wenn das basolaterale Medium auf 1:1 epitheliale und endotheliale Medien umgestellt wird. Es muss noch mehr Forschung betrieben werden, um die Lebensfähigkeit über einen Zeitraum von Wochen zu testen, was die Komplexität der Zellen in ALI erhöhen könnte.
Das Blut-Luft-Schranken-Modell hat tiefgreifende Auswirkungen auf die Erforschung menschlicher Krankheiten und die Entwicklung therapeutischer Interventionen. Das Modell kann zum Screening und zur Optimierung von Therapeutika, einschließlich antiviraler Medikamente, verwendet werden, indem eine physiologisch relevante Umgebung bereitgestellt wird, die die menschlichen Atemwege nachahmt, insbesondere bei der Exposition der Atemwegszellen gegenüber der Luft. Gen-Knockout-Techniken können eingesetzt werden, um spezifische Mechanismen der Barrieredysfunktion und der Wirt-Pathogen-Interaktionen zu untersuchen. Das Modell bietet eine Plattform, um verschiedene Aspekte menschlicher Atemwegserkrankungen zu untersuchen, von Virusinfektionen bis hin zu chronischen Erkrankungen wie Asthma und COPD. Dieses Verständnis kann zur Entwicklung effektiverer und zielgerichteterer Therapien führen.
Zusammenfassend lässt sich sagen, dass das Blut-Luft-Barriere-Modell der großen Atemwege (iAirway) ein leistungsfähiges Werkzeug zur Untersuchung von Barrieredysfunktionen aufgrund von Virusinfektionen und anderen Atemwegserkrankungen darstellt. Die Sicherstellung einer erfolgreichen Differenzierung von Zelltypen, die Bewältigung von Entwicklungsherausforderungen und die Erforschung alternativer Anwendungen werden den Nutzen und die Genauigkeit dieses Modells verbessern. Seine Anwendung in therapeutischen Targeting- und Gen-Knockout-Studien unterstreicht sein Potenzial für das Verständnis und die Behandlung von Atemwegserkrankungen beim Menschen.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Forschung wurde vom CIRM (DISC2COVID19-12022) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| 12 well plates | Corning | 3512 | |
| 12-well inserts, 0.4 µm, translucent | VWR | 10769-208 | |
| 2-mercaptoethanol | Sigma-Aldrich | M3148 | |
| Accutase | Innovative Cell Tech | AT104 | |
| Activin A | R&D Systems | 338-AC | |
| All-trans retinoic acid (RA) | Sigma-Aldrich | R2625 | |
| ascorbic acid | Sigma | A4544 | |
| B27 without retinoic acid | ThermoFisher | 12587010 | |
| BMP4 | R&D Systems | 314-BP/CF | |
| Bovine serum albumin (BSA) Fraction V, 7.5% solution | Gibco | 15260-037 | |
| Br-cAMP | Sigma-Aldrich | B5386 | |
| CD 14 (FITC) | BioLegend | 982502 | |
| CD 31 PECAM-1(APC) | R&D System | FAB3567A | |
| CD 45 (PE) | BD Biosciences | 560975 | |
| CD 68 (PE) | BioLegend | 33808 | |
| CHIR99021 | Abcam | ab120890 | |
| CPM | Fujifilm | 014-27501 | |
| Dexamethasone | Sigma-Aldrich | D4902 | |
| Dispase | StemCellTech | 7913 | |
| DMEM/F12 | Gibco | 10565042 | |
| Dorsomorphin | R&D Systems | 3093 | |
| E-CAD/CD 324 (APC) | BioLegend | 324107 | |
| EGF | R&D Systems | 236-EG | |
| EGM2 Medium | Lonza | CC-3162 | |
| EPCAM/CD 326 (APC) | BioLegend | 324212 | |
| FBS | Gibco | 10082139 | |
| FGF10 | R&D Systems | 345-FG/CF | |
| FGF7 | R&D Systems | 251-KG/CF | |
| Fibronectin | Fisher | 356008 | |
| Forskolin | Abcam | ab120058 | |
| Glutamax | Life Technologies | 35050061 | |
| Ham’s F12 | Invitrogen | 11765-054 | |
| HEPES | Gibco | 15630-080 | |
| IBMX (3-Isobtyl-1-methylxanthine) | Sigma-Aldrich | I5879 | |
| IL-3 | Peprotech | 200-03 | |
| Iscove’s Modified Dulbecco’s Medium (IMDM) + Glutamax | Invitrogen | 31980030 | |
| Knockout Serum Replacement (KSR) | Life Technologies | 10828028 | |
| Matrigel | Corning | 354230 | |
| M-CSF | Peprotech | 300-25 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR plus Kit (10/case) | Stem Cell Tech | 5825 | |
| N2 | ThermoFisher | 17502048 | |
| NEAA | Life Technologies | 11140050 | |
| PBS | Gibco | 10010023 | |
| Pen/strep | Lonza | 17-602F | |
| ReleSR | Stem Cell Tech | 5872 | |
| RPMI1640 + Glutamax | Life Technologies | 12633012 | |
| SB431542 | R&D Systems | 1614 | |
| SCF | PeproTech | 300-07 | |
| SMA | Invitrogen | 50-9760-80 | |
| STEMdiff APEL 2 Medium | STEMCELL Technologies | 5275 | |
| TrypLE Express | Gibco | 12605-028 | |
| VEGF165 | Preprotech | 100-20 | |
| Vimentin | Cell Signaling | 5741S | |
| Y-27632 (Rock Inhibitor) | R&D Systems | 1254/1 | |
| ZO-1 | Invitrogen | 339100 |
Referenzen
- Wu, M., Zhang, X., Lin, Y., Zeng, Y. Roles of airway basal stem cells in lung homeostasis and regenerative medicine. Respir Res. 23 (1), 122 (2022).
- Blackburn, J. B., Li, N. F., Bartlett, N. W., Richmond, B. W. An update in club cell biology and its potential relevance to chronic obstructive pulmonary disease. Am J Physiol Lung Cell Mol Physiol. 324 (5), L652-L665 (2023).
- Fahy, J. V., Dickey, B. F. Airway mucus function and dysfunction. N Engl J Med. 363 (23), 2233-2247 (2010).
- Whitsett, J. A. Airway epithelial differentiation and mucociliary clearance. Ann Am Thorac Soc. 15 (Suppl 3), S143-S148 (2018).
- Khalilgharibi, N., Mao, Y. To form and function: On the role of basement membrane mechanics in tissue development, homeostasis and disease. Open Biol. 11 (2), 200360 (2021).
- Mcdonald, D. M., Yao, L. C., Baluk, P. Dynamics of airway blood vessels and lymphatics: Lessons from development and inflammation. Proc Am Thorac Soc. 8 (6), 504-507 (2011).
- Parker, D., Prince, A. Innate immunity in the respiratory epithelium. Am J Respir Cell Mol Biol. 45 (2), 189-201 (2011).
- Davis, J. D., Wypych, T. P. Cellular and functional heterogeneity of the airway epithelium. Mucosal Immunol. 14 (5), 978-990 (2021).
- Vareille, M., Kieninger, E., Edwards, M. R., Regamey, N. The airway epithelium: Soldier in the fight against respiratory viruses. Clin Microbiol Rev. 24 (1), 210-229 (2011).
- Fosse, J. H., Haraldsen, G., Falk, K., Edelmann, R. Endothelial cells in emerging viral infections. Front Cardiovasc Med. 8, 619690 (2021).
- Wang, Y., Zheng, J., Wang, X., Yang, P., Zhao, D. Alveolar macrophages and airway hyperresponsiveness associated with respiratory syncytial virus infection. Front Immunol. 13, 1012048 (2022).
- Costa, A., De Souza Carvalho-Wodarz, C., Seabra, V., Sarmento, B., Lehr, C. M. Triple co-culture of human alveolar epithelium, endothelium and macrophages for studying the interaction of nanocarriers with the air-blood barrier. Acta Biomater. 91, 235-247 (2019).
- Leibel, S. L., Mcvicar, R. N., Winquist, A. M., Snyder, E. Y. Generation of 3D whole lung organoids from induced pluripotent stem cells for modeling lung developmental biology and disease. J Vis Exp. (170), e62456 (2021).
- Mccauley, K. B., Hawkins, F., Kotton, D. N. Derivation of epithelial-only airway organoids from human pluripotent stem cells. Curr Protoc Stem Cell Biol. 45 (1), e51 (2018).
- Choi, K. -. Y. G., Wu, B. C., Lee, A. H. -. Y., Baquir, B., Hancock, R. E. W. Utilizing organoid and air-liquid interface models as a screening method in the development of new host defense peptides. Front Cell Infect Microbiol. 10, 228 (2020).
- Fulcher, M. L., Randell, S. H. Human nasal and tracheo-bronchial respiratory epithelial cell culture. Methods Mol Biol. 945, 109-121 (2013).
- Hao, S., et al. Long-term modeling of SARS-COV-2 infection of in vitro cultured polarized human airway epithelium. mBio. 11 (6), e02852-e02920 (2020).
- Patsch, C., et al. Generation of vascular endothelial and smooth muscle cells from human pluripotent stem cells. Nat Cell Biol. 17 (8), 994-1003 (2015).
- Van Wilgenburg, B., Browne, C., Vowles, J., Cowley, S. A. Efficient, long-term production of monocyte-derived macrophages from human pluripotent stem cells under partly-defined and fully-defined conditions. PLoS One. 8 (8), e71098 (2013).
- Pouyanfard, S., et al. Human-induced pluripotent stem cell-derived macrophages ameliorate liver fibrosis. Stem Cells. 39 (12), 1701-1717 (2021).
- Ardini-Poleske, M. E., et al. Lungmap: The molecular atlas of lung development program. Am J Physiol Lung Cell Mol Physiol. 313 (5), L733-L740 (2017).
- Ronaghan, N. J., et al. M1-like, but not m0- or m2-like, macrophages, reduce RSV infection of primary bronchial epithelial cells in a media-dependent fashion. PLoS One. 17 (10), e0276013 (2022).
- Gotoh, S., et al. Generation of alveolar epithelial spheroids via isolated progenitor cells from human pluripotent stem cells. Stem Cell Rep. 3 (3), 394-403 (2014).
- Yamamoto, Y., et al. Long-term expansion of alveolar stem cells derived from human iPS cells in organoids. Nat Methods. 14 (11), 1097-1106 (2017).
- Firth, A. L., et al. Generation of multiciliated cells in functional airway epithelia from human induced pluripotent stem cells. Proc Natl Acad Sci U S A. 111 (17), E1723-E1730 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten