Method Article
Bir koku bulutunda gezinen farelerin hipokampusunda kalsiyum sinyallerini kaydeden miniskop
Bu Makalede
Özet
Bu protokol, bir koku tüyünde gezinen farelerde hipokampal CA1'deki beyin-davranış ilişkisini araştırır. Hipokampusun görüntülenmesine erişmek için ameliyat, davranışsal eğitim, beynin miniskop GCaMP6f kaydı ve işlenmesi ve ROI nöral aktivitesinden fare pozisyonunun kodunu çözmek için davranışsal veriler dahil olmak üzere adım adım bir protokol sunuyoruz.
Özet
Fareler, koku maddelerinin kaynağını bulmak için karanlıkta karmaşık bir uzay-zamansal yapıya sahip bir koku bulutunda gezinir. Bu makale, 50 cm x 50 cm x 25 cm'lik bir koku alanında bir koku tüyünde gezinen farelerde hipokampustaki (dCA1) dorsal CA1stratum piramidal nöronlarında davranışı izlemek ve Ca 2+ geçici akımlarını kaydetmek için bir protokolü açıklamaktadır. Bir gradyan indeksi (GRIN) merceğinden odaklanan bir epifloresan minoskop, Thy2-GCaMP1f farelerinde kalsiyum sensörü GCaMP6f'yi eksprese eden dCA1 nöronlarındakiCa 6 + geçici akımları görüntüledi. Makale, fareleri otomatik bir koku alanında bu koku tüyü navigasyon görevini yerine getirmeleri için eğitmek için davranışsal protokolü açıklamaktadır. Yöntemler, GRIN lens implantasyonu için cerrahi için adım adım bir prosedür ve CA1'de GCaMP6f'yi görüntülemek için taban plakası yerleştirmeyi içerir. Makale, denemelerin başlamasını ve bir su ödülünün verilmesini otomatikleştirmek için fare konumunun gerçek zamanlı olarak izlenmesi hakkında bilgi sağlar. Ek olarak, protokol, koku navigasyon görevinin otomasyonunu ve miniskop için çerçeve sürelerini ve bir dijital kamera izleme fare konumunu açıklayan meta verileri senkronize etmek için bir arayüz kartının kullanılması hakkında bilgi içerir. Ayrıca, yöntemler, GCaMP6f floresan filmlerini işlemek için kullanılan boru hattını, NorMCorre algoritmasını kullanarak hareket düzeltmesi ve ardından EXTRACT ile ilgilenilen bölgelerin tanımlanması yoluyla tanımlar. Son olarak, makale, koku bulutunun fare navigasyonunu tahmin etmek için CA1 nöral topluluk aktivitesinden uzamsal yolların kodunu çözmek için bir yapay sinir ağı yaklaşımını açıklamaktadır.
Giriş
Kafası sabit farelerde 1,2,3 koku alma navigasyonunda yer alan nöral devrelerin ve serbestçe hareket eden farelerde 4,5,6,7,8 navigasyon stratejilerinin anlaşılmasında önemli ilerleme kaydedilmiş olmasına rağmen, türbülanslı koku bulutlarının etolojik olarak ilgili serbestçe hareket eden navigasyonunda nöral devrelerin rolü hala bilinmemektedir. Bu makale, hipokampustaki (dCA1) dorsal CA1 stratum piramidal nöronlarının sıralı nöral dinamiklerinin kokulu tüy navigasyonunda rol oynayıp oynamadığını incelemek için Thy1-GCaMP6f farelerinde9 genetik olarak kodlanmış kalsiyum sensörü GCaMP6f'yi eksprese eden hücrelerdeki Ca 2+ geçici durumlarını görüntüleyerek nöral aktivitenin izlenmesini açıklamaktadır. Yöntemler, dCA110,11,12 üzerinde bir GRIN merceğine odaklanan minyatür bir epifloresan mikroskobu aracılığıyla görüntülenen GCaMP6f floresansı hakkında bilgi sağlar. Yöntemler, musluğa ulaştıklarında bir su ödülü aldıkları bir koku tüyü navigasyon görevi gerçekleştiren farelerde uzamsal navigasyon ve dCA1 nöronu GCaMP6f kalsiyum geçici akımlarının aynı anda nasıl izleneceğini açıklar ve arka plan laminer hava akışı olan bir koku alanına bir koku verici madde verir13,14. Bu makale, gradyan indeksli (GRIN) lenslerin implantasyonu için stereotaksik cerrahi, serbestçe hareket eden bir farede miniskopu kafatasına sabitlemek için bir taban plakasının yerleştirilmesi, minyatür mikroskopla görüntüleme ve yüksek hızlı bir dijital kamera ile fare hareketinin izlenmesi, hareket artefaktlarının giderilmesi ve ilgilenilen bölgelerin (ROI'ler) bulunması için veri ön işleme, ve dCA1 ROI'lerindeki floresan değişikliklerinden farenin koku alanındaki X ve Y konumlarının kodunu çözmek için veri kümelerinin ve yapay sinir ağı eğitiminin ve tahminininhazırlanması 7.
Bir koku tüyünde gezinen farelerin hipokampusunun CA1 bölgesindeki kalsiyum sinyallerinin miniskop kaydı, koku tüyü navigasyonunun karmaşık davranış görevinde koku alma ve uzamsal bilgi ile ilgili nöral devrelerin hesaplanmasını anlamak için önemlidir 2,14,15,16. Hipokampusun CA1 bölgesi, uzamsal navigasyonda rol oynar ve verimli navigasyon için çevrenin bilişsel bir haritasını oluşturmak için çok önemlidir17,18. Kalsiyum sinyallerini bir miniskop ile kaydetmek, koku tüyü navigasyonu sırasında uzamsal bilgileri kodlayan CA1 nöronlarını araştırmanın değerli bir yoludur.
Bu teknik, nöral devrelerin karmaşık davranışları nasıl yönlendirdiğini daha iyi anlamak için GCaMP kalsiyum sinyallerini kaydetmek için miniskop teknolojisinin avantajlarını CA1 hipokampusunun uzamsal navigasyondaki köklü rolüyle birleştirir19. Alternatif olarak, 2-foton mikroskobu kullanan yaklaşımlar, CA1 nöronlarını 9,20 kaydedebilir, bu da kafaya sabitlenmiş bir fare gerektirir ve bir koku tüyünde21 gezinmek için serbestçe hareket etme olasılığını kısıtlar. CA1 nöronlarının yerel alan elektrofizyolojik kayıtları, koku bulutlarında gezinen serbestçe hareket eden farelerin araştırılmasına izin verir22. Yine de, yerel alan elektrik sinyalleri, tek birimli sinyalleri sivri uçlu sıralama teknikleriyle izole ederek hücre içi ateşlemeyi tahmin etmek için sınırlamalar getirir. Miniskop sinyalleri, tek hücre çözünürlüğünde nöral hesaplamaları tam olarak araştırmak için doğrudan hücre içi kalsiyum sinyalleriyle ilişkili ROI'lerin güvenilir bir şekilde10,11 tanımlanmasına izin verir. Miniskop teknolojisi, CA1 bölgesinin koku ipuçlarına dayalı olarak uzamsal bilgileri nasıl kodladığını daha iyi anlamak için eşsiz bir fırsat sunar.
Ayrıca, bu teknik, belirli nöronal popülasyonların navigasyon için koku bilgisini nasıl işlediğini ve koku tüyü takibi sırasında nöronal aktivite modelleri ile karar verme arasındaki ilişkiyi araştırır. Bu yöntem, beynin koku ve mekansal bilgileri nasıl işlediğinin daha iyi anlaşılmasına katkıda bulunabilir. Minoskoplar, serbestçe hareket eden bir farenin beynini kaydetmek için tek hücreli bir çözünürlük sunarken, özel cerrahi ve veri analizi uzmanlığı gerektirir. Bu yazıda, araştırmacıların koku tüyü navigasyonunun sinirsel mekanizmalarını araştırmak için her adımdan geçmelerine yardımcı olmak için kapsamlı bir protokol sunuyoruz.
Koku gezinme görevi, farelerde nöral kodlama ve uzamsal koku işareti hafızasını incelemek için umut verici bir çerçevedir. Makalenin bulguları, dCA1'deki nöronal topluluk kalsiyum sinyallerine dayalı olarak bir koku tüyünde gezinen farenin yörüngesini çözmenin mümkün olduğunu göstermektedir. Koku bulutu navigasyonunda dCA1 kalsiyum sinyallerinin rolünü anlamak, gerçekçi ortamlarda koku rehberli navigasyon için nöral devre temelini kırmak için çok önemli bir adımdır13,14.
Protokol
Çalışmalar 3-6 aylık erkek ve dişi Thy1-GCaMP6f transgenik farelerdegerçekleştirilmiştir 23. Tüm deneysel protokoller, Ulusal Sağlık Enstitüleri yönergelerine uygun olarak Colorado Üniversitesi Anschutz Tıp Kampüsü Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. GRIN lens implantasyonu (Bölüm 1) ve taban plakası yerleştirilmesi (Bölüm 2) için cerrahi prosedürlerönceki çalışmalardan uyarlanmıştır 9,24,25,26,27,28,29.
1. Hipokampusa GRIN lens implantasyonu için stereotaksik cerrahi
- Steril eldiven, baş örtüsü, cerrahi maske ve laboratuvar önlüğü giyin.
- Tüm sağkalım ameliyatları sırasında steril koşullar kullanın. Tüm cerrahi ekipmanı otoklavlama ile sterilize edin.
- Cerrahi alanın etrafına steril örtüler yerleştirin.
- Fareyi 10 dakika boyunca% 3 izofluran içeren indüksiyon odasına yerleştirerek uyuşturun. Anestezik indüksiyon sırasında deri altından 0.001 mg / g Polimerde Buprenorfin Baz enjekte edin.
- Farenin hareket etmeyi bırakıp bırakmadığını ve derin anestezi altında olup olmadığını kontrol edin, arka pençe refleksini test etmek için arka pençeyi sıkıştırarak onaylayın.
- İzofluran akışını burun konisine geçirin (Ek Dosya 1).
- Fareler için düşük akışlı izofluran anestezi sisteminin (Malzeme Tablosu) sıcaklık pedinin homeotermik ayarlara ayarlandığından emin olun ve buhar kaynağının harici olarak sıkıştırılmış olarak ayarlandığından emin olun.
- Anestezi uygulanmış fareyi dijital stereotaksik alete yerleştirin (Malzeme Tablosu). Farenin ön dişlerini ısırma çubuğuna yerleştirin ve izofluran akışını sağlamak ve kafayı yerine kilitlemek için burun konisini burnun önüne yerleştirin. Çimdikleme sonrası anestezi seviyesini pençe refleksine göre %2-%3 arasında ayarlayınız (Şekil 2A).
- Fare kulak çubuklarını kulaklara yerleştirin ve sıkın. Farenin kafasının yatay olduğundan ve yan yana veya yukarı aşağı hareket etmediğinden emin olun. Kafa güvenli olduğunda, kafatasına hafifçe aşağı doğru bastırmanın kafatasının kafa çubuklarının altından kaymasına neden olmadığından emin olun.
- Sıcaklık probunu rektuma yerleştirin ve hareketi önlemek için teli farenin kuyruğuna bantlayın. Rektal sıcaklığı 37 °C'de tutmak için pedin sıcaklığını ayarlayın.
- Zararlı hava kurumasını önlemek için gözlere oftalmik merhem ekleyin.
- Hareketi önlemek için kafa sabitken ve burun konisi tarafından sağlanan izofluran akışı altındayken saçları tıraş edin. Başın üstündeki saçları elektrikli bir tıraş makinesiyle tıraş edin, ardından kalan tüyleri tüy çıkarıcı ve steril pamuk uçlu ahşap aplikatörlerle temizleyin (Şekil 2B).
- Kafa derisini etanol ve betadin içeren steril bir pamuk uçlu ahşap aplikatör ile üçer kez sürünerek ameliyat alanını steril hale getirin.
- 0.1 mL lokal anestezik lidokaini deri altına (S.Q.) 29 G'lık bir iğne ile gözler ve kulaklar arasına enjekte edin. Bu bir balon yapacak. Cildi makasla kesmeden önce birkaç dakika bekleyin.
- Yalnızca uçlu bir teknik kullanarak, forseps kullanarak cildi dikkatlice yukarı çekin ve cildin dairesel bir kısmını çıkarmak için küçük bir makas kullanın. Steril bir pamuklu çubukla kanı emdirin.
- Kanama durduğunda, steril bir pamuklu çubuk kullanarak kafatasını hidrojen peroksit (% 5) ile temizleyin. Bu prosedürden sonra sagital sütür ve bregmayı işaretlemek için bregmatik sütür kesişimi dahil olmak üzere kemik işaretlerinin tanımlanmasının kolay olduğundan emin olun.
- Bregma ve lambda sütürlerinin tam olarak aynı Z koordinatında olduğundan emin olarak kafatasının stereotaksik cihaza göre düz olduğunu onaylayın. Bunu, manipülatörün koluna bir iğne yerleştirerek ve her iki dikişe dokunurken iğnenin ucunun aynı Z koordinatında olup olmadığını doğrulayarak gerçekleştirin. Aksi takdirde, ısırma çubuğunu Z plakasında hareket ettirerek ve beceri düz bir konuma gelene kadar prosedürü tekrarlayarak başın açısını ayarlayın.
- Dövme mürekkebi uygulamak için bir iğne tutan mikromanipülatöre bir pipet takın. Bregma'nın üstüne bir işaret yapın.
- Mikromanipülatör bregma üzerindeki koordinatları sıfırlayın ve sağ hipokampusta CA1'in üzerindeki koordinata hareket edin (bregmadan orta-lateral +1.8 mm, bregmadan ön-arka -2.4 mm)2. Bu, Radvansky ve Dombeck tarafından farelerde sanal koku gradyanı navigasyonunu incelemek için seçilen konumdur18,30. Hedef konumun üstünde kalıcı bir çukur oluşturmak için 1 dönüşte bir matkapla (Malzeme Tablosu) 10000 mm çapında küçük bir kalıcı göçüğü dikkatlice delin (Şekil 2C).
- 1.5 mm çapında ve 1 mm uzunluğunda bir GRIN merceğinin Beyne implantasyonuna izin vermek için 4 mm çapında dairesel bir delik açmak için diş matkabını kullanın (Malzeme Tablosu) (Şekil 2D).
- Deliğin ortasına 23 G'lik bir iğne sokarak ve iğneyi duranın 1,25 mm altındaki derinliğe ulaşana kadar yavaşça (~ 0,1 mm / dak) beyne hareket ettirerek dura ve korteksi delin. İğneyi beyinden yavaşça çıkarın (~ 0.1 mm / dak). Kanı temizlemek için steril pamuklu çubuklar ve tuzlu su kullanın.
- Birbirinin içine sığacak şekilde kesilmiş iki adet 1 mL mikropipet ucu ile yapılmış özel yapım bir UCLA'nın GRIN lens tutucusunu kullanın (GRIN lens tutucu, Malzeme Tablosu) (Şekil 2E, F).
- GRIN lens tutucuyu mikromanipülatöre bağlayın ve GRIN lensi tutmak için pipete bağlı aspiratörü açın. Hava emişi tarafından üretilen hava basıncı, GRIN lensini yerinde tutar.
- 4 mm uzunluğunda, 1 mm çapında GRIN lens kullanın. GRIN lensini, duranın -1,25 mm altında bir derinliğe ulaşana kadar kortekse yavaşça implante edin.
- Deliği kapatmak için dairesel kafatası perforasyonuna bir damla sıvı doku yapıştırıcısı (Malzeme Tablosu) yerleştirin. Kuruması için birkaç dakika bekleyin.
- Kafatası üzerinde kalıcı olarak kapatmak için GRIN lensin tabanına hızlı yapışkan çimento -biyouyumlu metakrilat reçinesi- (Malzeme Tablosu) hazırlayın. Birkaç dakika bekleyin ve kurumasını bekleyin.
- Bu noktada kafatasına kalıcı olarak bağlı olan GRIN lens tutucusunu serbest bırakmak için aspiratörü kapatın ve yavaşça çıkarın.
- Kafa çubuğunu kafatasının üst kısmına yerleştirin ve deliği GRIN lensi üzerinde ortalayın (Şekil 2G-I) (Ek Dosya 2 ve Ek Dosya 3).
- Kraniyal pencereyi kapatmak ve kafa çubuğunu kafatasına takmak için GRIN lensin tabanının etrafına çabuk kuruyan yapışkan çimentoyu (Malzeme Tablosu) dikkatlice yerleştirin. Kurutma yapışkan çimentoyu (Malzeme Tablosu) kafatasına sıkıca sabitlenmesini sağlamak için kafa çubuğunun ortasına ve yanlarına yerleştirin. Tamamen kuru olduğundan emin olun. GRIN lensin üzerine yapışkan çimento yerleştirilmediğinden emin olun; Aksi takdirde, optik yolu kalıcı olarak bozar ve görüntüyü engeller.
- Fiziksel hasardan korunmak için GRIN lensin üzerine bir damla düşük toksisiteli silikon yapıştırıcı (Malzeme Tablosu) yerleştirin.
- Isoflurane'i kapatın
- Hayvan anesteziden uyanana kadar ameliyat sonrası hemen bakım izlemesi yapın.
- Fareleri ağrı belirtileri açısından izleyerek ameliyattan tamamen iyileşene kadar ameliyat sonrası bakım yapın. Ameliyat geçiren hayvanı başka hayvanların şirketine iade etmeyin.
- Ağrı veya stres altında olmadıklarından emin olmak için kafesin etrafındaki hareketi, yeme ve içmeyi ve elleçlemeye verilen normal reaksiyonları kısaca gözlemleyin.
- Hayvanlar ciddi nörolojik veya doku hasarı belirtileri gösteriyorsa, derhal insancıl bir şekilde ötenazi yapın.
2. Minoskop için taban plakası yerleşimi
NOT: Farenin kafasını sabitleme prosedürleri, hayvan ameliyattan tamamen iyileştikten 2 hafta sonra başlar. dCA1 görüntüleme prosedürü, ameliyattan 3 hafta sonra, hayvan tamamen iyileştikten ve GCaMP6f sinyali güçlü bir şekilde görünür hale geldikten sonra başlar. dCA1 GCaMP6f floresansına bir minoskop kullanılarak GRIN merceğinden optik erişim için GRIN merceğinin üzerine bir taban plakası sabitlenmiştir. Bu protokol, miniskop sürüm 4 -V4'ü (Miniscope V4; Malzeme Tablosu).
- Ameliyattan 2 hafta sonra fareyi kafanın sabitlenmesine alıştırmak için kafa çubuğunu kıstırma kelepçeleriyle sabitleyerek fareyi 10 dakika boyunca kafayı sabitlemeye başlayın.
- Taban plakasının yerleştirilmesi için ameliyattan 3 hafta sonra farenin kafasını sabitleyin.
- Bir mikromanipülatöre bağlı bir mikromanipülatöre (Malzeme Tablosu) bağlı bir 3D baskılı tutucuya bir miniskop takın (Şekil 3A, B).
- İnce cımbız kullanarak lensin üst kısmındaki silikon yapıştırıcıyı (Malzeme Tablosu) dikkatlice çıkarın ve GRIN lensin yüzeyini bir lens mendili kullanarak temizleyin.
- Taban plakasının yan tarafındaki ayar vidasını sıkarak miniskopa takılı taban plakasını sabitleyin (Malzeme Tablosu) (Şekil 3C, D).
- Minoskopun ucunu GRIN merceğinin 100 μm üzerine ulaşana kadar hareket ettirin.
- 2.8 ila 2.10 arasındaki adımları izleyerek miniskop yazılımındaki (Malzeme Tablosu) miniskop ayarlarını yapılandırmak için kaydırıcıları kullanın.
- Gücü kontrol etmek ve %10 civarında tutmak için yazılımdaki Güç kaydırıcısına tıklayın.
- Edinme Oranı kaydırıcısına tıklayın ve 10 Hz civarında tutun.
- V4 miniskop, ince odaklama için kullanılabilecek bir elektro ıslatma merceğine sahiptir. Elektro ıslatma lensini odak aralığının ortasında tutmak için %50'ye ayarlamak üzere Odak kaydırıcısını tıklayın.
- GRIN lensin üst kısmını görüntülemek için yazılımı kullanın. GRIN lensin dairesel şeklini ekranda görmek mümkündür.
- Mikromanipülatör ile eksenel konumu ayarlayarak miniskopu GRIN lense yaklaştırın ve görüntüyü bilgisayarla izleyin.
- GRIN merceğinin üst kısmı göründüğünde, hücre flaşlarını görselleştirmek için en iyi odak düzlemine ulaşmak için mikromanipülatörde yukarı ve aşağı ince odaklama kullanın. Hücre flaşlarının kalitesini iki kez kontrol etmek için yazılımdaki sahte δF/F0 ayarını kullanın.
- Odağı, görüş alanında elde edilebilecek en yüksek floresan yoğunluğuna sahip maksimum hücre sayısına izin verecek şekilde ayarlayın. Bu noktada, kan damarlarının odakta olduğundan emin olun.
- Bir farenin geçici kalsiyum sinyalleri olmayabilir - yanıp söner. Bu durumda, sonraki adımlardan (14-16) kaçının ve geçici kalsiyum sinyallerinin oluşup oluşmadığını iki kez kontrol etmek için sonraki haftalarda fareyi tekrar doğrulayın.
NOT: Ameliyattan 2 ay sonra geçici kalsiyum sinyalleri hiç ortaya çıkmazsa, fareye ötenazi yapılması için bir karar verilebilir. - Odak optimize edildikten sonra, kafatası ile taban plakasının tabanı arasına dikkatlice hızlı yapışkan çimentodan bir duvar inşa edin. Minoskopu taban plakasına yapıştırmamaya dikkat edin ve GRIN lensin üstüne çimento bulaşmamasına çok dikkat edin.
- Çimento kuruduktan sonra, ayar vidasını çıkarın ve miniskopu mikromanipülatör ile taban plakasından dikkatlice çıkarın.
- GRIN lensini korumak için taban plakası kapağını kullanın.
3. Koku arenasının inşası
NOT: Bu yöntem, Connor ve ark.13 ve Gumaste ve ark.14'ün tasarımına dayalı olarak otomatik bir koku alanını tanımlar. Montajın tamamı, Malzeme Tablosunda (Ek Dosya 4) verilen bağlantıda bulunabilir.
- 50 cm (U) x 50 cm (G) x 25 cm (Y) boyutlarında 2 akrilik duvar, akrilik tavan, beyaz genişletilmiş polivinil klorür (PVC) zemin ve önde ve arkada hava akışını kolaylaştıran 2 benzersiz duvar içeren bir oda inşa edin (Şekil 4A).
- Arenanın arkasına, konik bir tasarıma ve odadan hava çekmek için bağlı bir bilgisayar fanına sahip bir hava emme ucu takın. Hava akış hızını düzenlemek için fan darbe genişlik modülasyonunu (PWM) ayarlamak için fiziksel bir düğme kullanın.
NOT: 3D baskılı petek yapısı, bir fareyi10'un içinde tutarken laminer hava akışını kolaylaştırmak için koku arenasının önü ve arkası için duvarlar içerir. Arenanın önündeki petek duvar, büyük hacimlerde havayı rahatsız edici olmayan bir şekilde almak için harici bir parlamaya sahiptir. - Bir şırıngaya bağlı bir Nema 17 step motora sahip basit mekanizmalar aracılığıyla su ödülü vermek için bir su dağıtım sistemi kurun. Bir A4988 mikro adımlama sürücüsü, dağıtılan hacmin hassas bir şekilde kontrol edilmesini sağlar (https://github.com/dougollerenshaw/syringe_pump, Şekil 4B).
- Hava giriş ucunu, bir hayvanın su ödülü için gezineceği 'şeritleri' tanımlamak için her set x ekseni boyunca 10 cm aralıklarla konumlandırılmış, su dağıtım ağızlarıyla eşleştirilmiş 4 set koku kaynağı ile ayarlayın (Şekil 4C, D).
- Tüplere ve koku verici şişelere bağlı solenoid valfler tarafından yönetilen bir koku dağıtım sistemi kurun (Şekil 4D).
NOT: Valfler, her zaman temiz havanın veya kokulu havanın aktığını ve herhangi bir zamanda tek bir şeridin veya sıfır şeridin kokulu havayı alabileceğini garanti eden bir düzenlemede bir röle kartı kullanılarak çalıştırılır. Beş adet 12 V solenoid valften oluşan bir set, 4 röle içeren bir röle kartı kullanılarak yönetilir. 4 rölenin tümü 'kapalı' olarak ayarlandığında, temiz hava valfi varsayılan olarak açıktır. Herhangi bir tek koku vanası açıldığında, temiz hava vanası otomatik olarak kapanır. Röle kartı durumu, birincil arduino denetleyicisinden gelen dijital çıkışlar kullanılarak yönetilir. Tüketici sınıfı bir akvaryum hava pompası, manuel bir hava akış regülatörü kullanarak 20 mL / dak ile sınırlandırılmış hava sağlar. Bir dizi 1/16 inç iç çaplı boru ve ayırıcı kullanan besleme hattı, solenoid valflerin her birine temiz hava sağlar. Koku maddesinden önceki ve sonraki çek valfler hava akış yönünü garanti eder. Temiz hava hattı, koku hatları kapatıldığında kokulu havanın dışarı atılmasını garanti etmek için arenaya girmeden önce koku hatları ile birleşir. - Hayvan davranışlarını izlemek için arenanın üzerine hızlı bir dijital kamera kurun (Malzeme Tablosu).
NOT: Hayvan davranışı, arenanın üzerine monte edilmiş tek bir hızlı dijital kamera kullanılarak 60 Hz'de izlenir (Malzeme Tablosu). 3,5 mm sabit odak uzaklığına sahip C Serisi lens, tüm alanı yakalayabilen bir C/CS montaj adaptörü ile monte edildi (Odak Lensi, Malzeme Tablosu). - Koku arenası donanımını yönetmek için özel bir python kodu kullanın (Malzeme Tablosu). Yazılım, deneysel parametrelerin ayarlanması ve deneysel verilerin elde edilmesi için gerekli kamera ve tüm donanımı entegre eder (Malzeme Tablosu).
- Bilgisayar aracılı koku ve su dağıtımı için araçlar sağlamak üzere Teensy 4.0 geliştirme kartına bağlı bir PC kurun (Odor Arena Donanım ve Yazılımı, Malzeme Tablosu).
- Dijital kamerayı, video kareleri kaydederken bir saat sinyalini dışa aktaracak şekilde ayarlayın. Sinyal, her iki sistemden gelen senkronizasyon sinyallerini kaydeden bir USB arabirim kartı (Malzeme Tablosu) kullanılarak miniskop ile post-hoc senkronizasyon için kullanılır.
NOT: Bir deney sırasında, özel edinme yazılımı, önemli deneysel olayları ve olayın meydana geldiği kamera çerçevesini içeren bir olay dosyası da oluşturur. Nadir bir olay olan bırakılan kareleri tanımlamak için bir zaman damgası dosyası da oluşturulur (Odor Arena Yazılımı, Malzeme Tablosu).
4. Bir fotoiyonizasyon dedektörü (PID) ile dumanın hava hızının ölçülmesi (Şekil 5)
NOT: Bu yöntem, gaz halindeki koku maddesini koku moleküllerini iyonize eden yüksek yoğunluklu bir ultraviyole ışığa maruz bırakan bir PID aracılığıyla koku bulutunun zaman seyrini tespit eder. Cihazın çıkışı, koku bulutundaki koku moleküllerini algılar. Bu teknik, PID kullanarak iki konumdan geçen koku maddelerinin varlığını tespit etmek için gecikmeyi karşılaştırarak koku alanındaki hava hızının tahmin edilmesini sağlar.
- İki farklı mesafeye hızlı yanıt veren minyatür bir PID yerleştirin. Koku kaynağından bir konum yakın, diğeri ise -10 cm uzakta- koku kaynağından uzaktır.
- PID kontrol cihazının ön panelindeki GAIN anahtarını x5 konumuna değiştirin.
- PID kontrol cihazının ön panelindeki POMPA anahtarını Yüksek konuma getirin.
- Koku verici olmadığında kontrolörün ön panelindeki sensör (voltaj) çıkışını gösteren ışık yayan diyot (LED) durum ışığını kontrol edin.
- Koku verici yokluğunda voltaj çıkışını sıfırlamak için potansiyometreyi OFFSET konumuna getirin.
- Koku alanındaki koku valfini açın.
- Vanayı açtıktan sonra her yerde PID ile koku bulutunun algılanmasındaki gecikmeyi ölçün. Bu prosedür, PID'nin çıkışı ile koku alanı tarafından kaydedilen valfin çıkışı (koku açık) bir arayüz kartı (Malzeme Tablosu) ile aynı anda kaydedilerek çevrimdışı olarak gerçekleştirilebilir.
- Dumanın hava hızını hesaplamak için her bir konumdaki gecikmelerdeki farkı iki PID arasındaki mesafedeki farka bölün.
5. Koku alanında davranışsal eğitim faresi (Şekil 6)
NOT: Bu bölüm, Findley ve ark.4'ten uyarlanan davranışsal bir görevi açıklamaktadır. Fare, bir su ödülü aramayı motive etmek için bir gün önce su kısıtlaması altındadır. Fare, su takviyesi elde etmek için koku salınımı kaynağında bulunan bir su musluğuna doğru koku tüyünü (Şekil 6B) yönlendirir (1 Hz'de verilen 3 damla 10 μL). Eğitim süresi boyunca, fare günde 2 mL'ye kadar erişime sahip olarak su kısıtlaması altında tutulur. Farenin vücut ağırlığı, su kısıtlaması süresi boyunca izlenir ve orijinal vücut ağırlığının %85'inin altında olmamalıdır. Fare, koku alanındaki eğitim sırasında günde yaklaşık 1 mL su alır ve eğitimden sonra kafeste günde 1 mL ek su ile desteklenir. Fare maksimum 72 saat su kısıtlaması altında kalır. Özel yazılım (Malzeme Tablosu), basit bir arka plan çıkarma ve blob yerelleştirme tekniği kullanarak farenin konumunu gerçek zamanlı (60 Hz) olarak algılar. Kullanıcı, şerit sınırlarını, ana sınırı (arenanın arkasındaki fare için başlangıç konumu) ve hedef sınırı (öndeki koku kaynağının yakınında) manuel olarak ayarlar. Ek olarak, kullanıcı yazılımın bu sınırları nasıl kullanacağına karar verebilir. Örneğin, kullanıcı yalnızca fare ev sınırının arkasındayken koku yayabilir. Farenin bir ödül alabilmesi için kullanıcı, hedefe (koku kaynağı) giderken farenin kokulandırılmış şerit içinde kalmasını isteyebilir. Fare hedef sınırı geçtiğinde bir ödül alabilir. Bununla birlikte, eğitim sırasında, bu gereksinimlerden herhangi biri, kendi kendini açıklayıcı ve kullanıcı dostu olacak şekilde tasarlanmış bir 'yaml' dosyasını düzenleyerek ayarlanır.
- İlk olarak, fareyi arenanın arkasına (arenanın havanın odaya aktığı taraftan 40 cm uzakta olan kısmı olarak tanımlanır) hareket ederek denemelere başlaması için eğitin. Fare arenanın arkasına gidene kadar bekleyin ve ardından koku ve suyu rastgele bir şeritte manuel olarak dağıtın. Farenin kaynağı bulmasına ve suyu içmesine izin verin.
- Koku ve su arasındaki ilişkiyi oluşturmak için prosedürü birçok kez tekrarlayın (Şekil 6A, B). Fare denemelere başlamayı öğrendikten sonra, kokuları iletmek için otomatik yazılımı kullanın.
- Otomatik özel yazılımı kullanarak iki şeritli koku gezinme görevini yapmak için fareyi eğitin. Bu görevde, kokuyu iletmek için iki koku portundan birini rastgele seçin ve koku maddesinin verildiği su musluğuna ulaştığında fareyi suyla güçlendirin. Bu protokol, mineral yağda %1 oranında seyreltilmiş koku verici izoamil asetat kullandı.
NOT: Fare, yaklaşık 40 dakikada yaklaşık 20 deneme koku tüyü navigasyonu oturumunu tamamlar. Fare günde bir seans gerçekleştirir. Eğitilen fare, oturumun sonunda rastgele seçimin üzerinde doğru gezinme yüzdesine ulaşır (%65 doğru seçimin >). Fare, 3 ila 5 seanslık eğitimden sonra iki şeritli koku navigasyon görevinde > %65 doğru seçim kriterini sağlamalıdır.
6. Koku alanında serbestçe hareket eden bir farenin epifloresan kaydı
NOT: Yöntem, Thy1 farelerinde6 eksprese edilen genetik olarak kodlanmış kalsiyum sensörü GCaMP9f'yi iki ağızlı koku tüyü navigasyon görevi sırasında geniş alan minoskop görüntüleme ile görüntüleyerek dorsal CA1'deki stratum piramidal (SP) hücrelerinin nöronal aktivitesinin kaydedilmesini açıklar (Ek Film 1 ve Ek Film 2). Tipik bir görüntüleme seansı 40 dakika sürer ve farenin yaklaşık 20 koku navigasyonu denemesini tamamlamasına olanak tanır. Bu teknik, bir fareyi birkaç ay boyunca kaydeder.
- Fareyi baş sabitleyin, mikromanipülatörü kullanarak miniskopu taban plakasının üstüne yerleştirin ve ayar vidasını sıkın.
- En yüksek floresan yoğunluğuna sahip en fazla sayıda hücreye sahip en uygun odak düzlemini bulmak için elektro ıslatma lensini ayarlayın.
- Doygunluk olmadan yüksek sinyal-gürültü oranıyla optimum dinamik aralığı elde etmek için miniskop gücünü ayarlayın. Bunu, 30 Hz'lik bir edinme hızında yaklaşık% 30 oranında ayarlanmış miniskop gücü ile Thy1-GCaMP6f farelerinde dorsal CA1'i görüntüleyerek elde edin.
- Minoskop taban plakasına takılıyken fareyi koku arenasının içine bırakın.
- Arenanın üst kısmında bulunan dijital kameranın transistör-transistör mantığı (TTL) çıkışını ve davranışsal ve GCaMP6f video kareleri arasında daha sonra senkronizasyon için miniskoptan gelen TTL sinyalini kaydetmek için arayüz kartıyla satın almaya başlayın. Dijital kamera 60 Hz'de kayıt yapar ve miniskop 30 Hz'de kayıt yapar.
- Minoskop ve davranışsal filmleri kaydetmeye başlayın ve iki musluk kokusu navigasyon görevi için otomatik yazılımı açın.
7. Veri ön işleme
Not: Bu yöntem, verileri işlemek için bir MATLAB işlem hattı kullanır. Kod GitHub'da mevcuttur (Senkronizasyon Yazılımı, Malzeme Tablosu). NoRMCorre31 , hareket düzeltme için kullanılır ve EXTRACT32 , kalsiyum geçişleri (δF/F0) arasındaki floresan ile normalize edilen floresan değişiklikleri olarak bildirilen zamanla değişen floresan sinyallerine sahip ROI'leri bulmak için kullanılır.
- GitHub'da bulunan MATLAB kodunu Synchronize_Files_JOVE.m'yi çalıştırarak arayüz kartı tarafından kaydedilen senkronizasyon sinyallerini kullanarak koku arenası meta verilerini, dijital kamera çerçevelerini ve miniskop çerçevelerini senkronize edin.
- NoRMCorre (Hareket Düzeltme Yazılımı, Malzeme Tablosu) kullanarak senkronize miniskop çerçevelerinin hareket düzeltmesini gerçekleştirin.
- EXTRACT (ROI Ekstraksiyon Yazılımı, Malzeme Tablosu) kullanarak zamanla değişen δF/F0 sinyallerine sahip ROI'leri bulun.
- Verileri denemelere ayırın (Senkronizasyon Yazılımı, Malzeme Tablosu).
- Her denemeyi, farenin doğru veya yanlış gezinme davranışına bağlı olarak sırasıyla bir isabet veya ıska olarak etiketleyin.
- Her bir ayrı denemenin davranışını ve yatırım getirilerini görselleştirmek için Behavior Ensemble ve Neural Trajectory Observatory (BENTO)33'ü kullanın (Şekil 7A, B ve Ek Film 3).
8. Veri analizi - Beyin sinyallerinden uzamsal konumun kodunun çözülmesi
NOT: Bu yöntem, dCA1 ROI'lerinden7'den farenin arenadaki X ve Y konumlarının kodunu çözmek için makine öğrenimini kullanır. MATLAB kodu (Beyin Sinyallerinin Kodunu Çözme Yazılımı, Malzeme Tablosu) https://github.com/restrepd/drgMiniscope'da mevcuttur.
- EXTRACT.mat çıktı dosyasını ve odor arena meta veri dosyasını drgDecodeOdorArenav2.m yazılımına girin. GitHub deposu bu iki dosyayı bir örnek için sağlar (Senkronizasyon Yazılımı, Malzeme Tablosu):
dFF_file='20220804_FCM22_withodor_miniscope_sync
_L1andL4_ncorre_ext. Mat';
arena_file='20220804_FCM22withodor_odorarena_L1
andL4_sync. Mat';
NOT: drgDecodeOdorArenav2.m, her deneme için ROI sinyallerini ve meta verileri (farenin X ve Y konumları, koku musluğu konumu, su dağıtımı vb.) içeren deneme içi verilere bölünmüş bir veri kümesi oluşturur. Kod ayrıca denemeler arasındaki veriler için kod çözmeyi de analiz eder. Kod, X ve Y pozisyonlarını tahmin etmek ve bir tane dışarıda bırakma prosedürü kullanarak dışarıda bırakılan denemenin konumunu tahmin etmek için biri hariç tüm denemeler için tüm ROI'ler için δF/F0 verileriyle bir yapay sinir ağını eğitmek için fitrnet'i kullanır. - Sinir ağı, X ve Y konumlarını çıktı olarak döndürür. Tahminlerde bulunmak için eğitilmiş sinir ağını kullanın. Girdi, ROI'lerden farenin arenadaki X ve Y konumlarının tahminlerini yapmak için ağı eğitmek için kullanılmayan denemeleri dışarıda bıraktı (Şekil 8A, B).
Sonuçlar
Bu prosedürün kullanılması, koku maddelerinin kaynağını bulmak için koku alanında gezinen farelerde dCA1 GCaMP6f floresan geçişlerinin görselleştirilmesine ve kaydedilmesine olanak tanır (Şekil 6A,B, Ek Film 1 ve Ek Film 2). Floresan görüntüleri NoRMCorre ile hareket düzeltmelidir ve ROI'leri çıkarmak için EXTRACT kullanılır. Ek olarak, bir arayüz kartı ile kayıt, ROI'lerden gelen δF/F0 sinyallerinin koku alanındaki koku ve su verme olaylarıyla (Şekil 7A) ve ayrıca farenin koku alanındaki hareketiyle (Şekil 7B ve Ek Film 3) senkronizasyonuna izin verir. Farenin koku bulutunda gezinmesinin temsili sonucu, görev sırasında çok sayıda kalsiyum geçişi içerir (Şekil 7A,B). Ek olarak, kalsiyum tepkilerinin koku ve su ödülünün varlığı ile nasıl hizalandığını incelemek mümkündür (Şekil 7A). BENTO ile tek denemelerin görselleştirilmesi, denemenin başlatılması, karar verme, gezinme, içme ve arenanın arkasına dönme dahil olmak üzere denemenin farklı aşamalarındaki kalsiyum yanıtları hakkında bilgi sağlar (Şekil 7B). Yöntem, koku odaklı bir navigasyon görevi sırasında CA1 kalsiyum tepkileri ile farelerin davranışı arasındaki bağlantıya ilişkin değerli bilgiler iletti.
PID kayıtları, koku tüyü ve dumanın hava hızı hakkında önemli bilgiler sağlayabilir. Temsili sonuç, koku arenası içindeki koku tüyünü serbest bırakmak için valfi açtıktan sonra PID yanıtında bir artış olduğunu gösterir (Şekil 5A). Ayrıca protokol, dCA1 ROI'lerinin δF/F0 sinyallerinden farenin X ve Y konumlarının kodunun çözülmesini sağlar (Şekil 8). Bu teknik, CA1 nöronlarının koku ve uzamsal bilgileri nasıl işlediğini daha iyi anlamakla ilgili olan CA1 yanıtlarına dayalı olarak koku tüyü gezinme görevi sırasında farenin uzamsal konumunu tahmin eder. dCA1'deki nöronal topluluk kalsiyum sinyallerinden farenin yörüngesinin kodunu çözmek önemlidir, çünkü dorsal CA1'deki nöronların, koku tüyü navigasyonunun karmaşık görevini yerine getirmek için koku ve mekansal bilginin bilişsel bir haritasını nasıl temsil ettiğini ortaya çıkarır. Yöntem, yalnızca yer hücreleri ve koku uyaranına yanıt veren diğer hücreler gibi davranan farklı ROI'lere genişletildi. Farenin yörüngesinin nöronal topluluk sinyallerinden başarılı bir şekilde çözülmesi, kod çözme tahmini ile farenin temel gerçek X ve Y konumları arasındaki güçlü korelasyon ile doğrulanabilir.
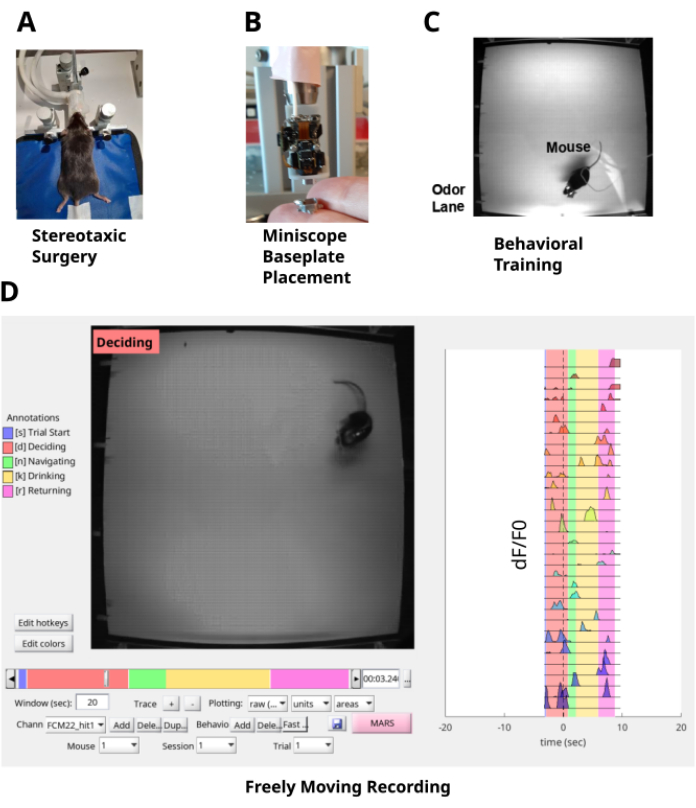
Şekil 1: Çalışma boru hattı. (A) Stereotaksik cerrahi, hipokampusun CA1 tabakasına bir GRIN lensi implante edilmesinden ve farenin kafasını sabitlemek için kafatasına bir kafa plakasından oluşur. (B) CA1 nöronlarının floresansına bir miniskop ile optik olarak erişim sağlamak için GRIN merceğinin üstüne bir taban plakası yerleştirilmiştir. (C) Fare, koku tüyü gezinme görevi konusunda eğitilmiştir. (D) Fare davranışının ve koku bulutunda gezinen CA1 nöronlarının serbestçe hareket eden kaydı. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Stereotaksik cerrahi. (A) Anestezi uygulanmış fareyi stereotaksik cihaza yerleştirin. Anestezi seviyesini, kıstırma pençe refleks tepkisine göre %2 ila %3 arasında ayarlayın (B) Başın üstündeki saçları tıraş edin. (C) Hedef konumun üst kısmında kalıcı bir çentik oluşturmak için bir matkapla dikkatlice küçük bir kalıcı göçük açın. (D) 1.5 mm çapında ve 1 mm uzunluğunda bir GRIN merceğinin Beyne implantasyonuna izin vermek için 4 mm çapında dairesel bir delik açmak için diş matkabını kullanın. (E) GRIN lens tutucusunu mikromanipülatöre bağlayın ve GRIN lensini tutmak için pipete bağlı aspiratörü açın. (F) GRIN lensini, dura maddesinin -1,25 mm altındaki derinliğe ulaşana kadar kortekse yavaşça implante edin. (G) İmplante edilmiş GRIN lensi ile kafatasına yapıştırılmış kafa plakasını ve taban plakasını gösteren açıklayıcı otopsi sonrası sabit kafa. (H) Kafatasının üst kısmındaki Baş Çubuğunu ve kafatasının içine implante edilen GRIN lensini gösteren başın ölüm sonrası BT taraması. (I) Farenin kafaya sabitlenmesini sağlamak için kafa plakasının tasarımı. Bu tasvirdeki hayvan, gelişmiş anatomik görselleştirmeyi kolaylaştırmak için çıplaktır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Miniskop taban plakasının yerleşimi. (A) Bir mikromanipülatöre bağlı 3D baskılı miniskop tutucu. (B) Sahibine bağlı miniskob. (C) Taban plakasını miniskopa takma. (D) Taban plakasını miniskopa sabitlemek için ayar vidasını sıkın. Taban plakasını fare kafatasına yapıştırdıktan sonra ayar vidası serbest bırakılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4. Koku arenasının inşası. (A) Koku arenası şeffaf Odası. Fare davranışını kaydetmek için üst düzey bir dijital kamera var. (B) Şırıngalara bağlı step motorlar, fareyi ödüllendirmek için su dağıtımını kontrol eder. (C) Koku alanının içinden görünüm, bir bal peteği yapısını gösteren, laminer bir akış ve dört koku dağıtım hattı elde etmek için kullanılır. (D) Koku alanının dışından görüntülenen tüpler, valfler ve koku şişeleri dahil olmak üzere koku dağıtım sistemi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 5: Koku tüyü kaydı. (A) Fotoiyonizasyon dedektörü (PID) ile kaydedilen koku tüyü. Koku alanında 4,23 cm/s'de yayılan bir koku tüyünün beş PID izinin Ortalama (koyu mavi)±Standart Sapması (açık mavi). Koku arena zemininden 2 cm uzakta bir koku kaynağı. PID'nin sensör kafası, koku bulutunun gaz konsantrasyonu için bir voltaj sinyali sağlar. (B) 20 cm/s'de sınırsız akışla koku bulutunun lazerle kaydedilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 6: Fare davranış eğitimi. (A) Fare, sağ şeritte salınan bir koku bulutuna doğru gezinmeyi öğreniyor. Fare, koku arenasının arkasına giderek bir deneme başlatmayı, koku bulutuna doğru gitmek için bir tarafa karar vermeyi ve bir su ödülü içmeyi öğrenir. (B) Fare, sol şeritte salınan bir koku bulutuna doğru gezinmeyi öğreniyor. Fare, doğru şeride giderse koku ile ödüllendirilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
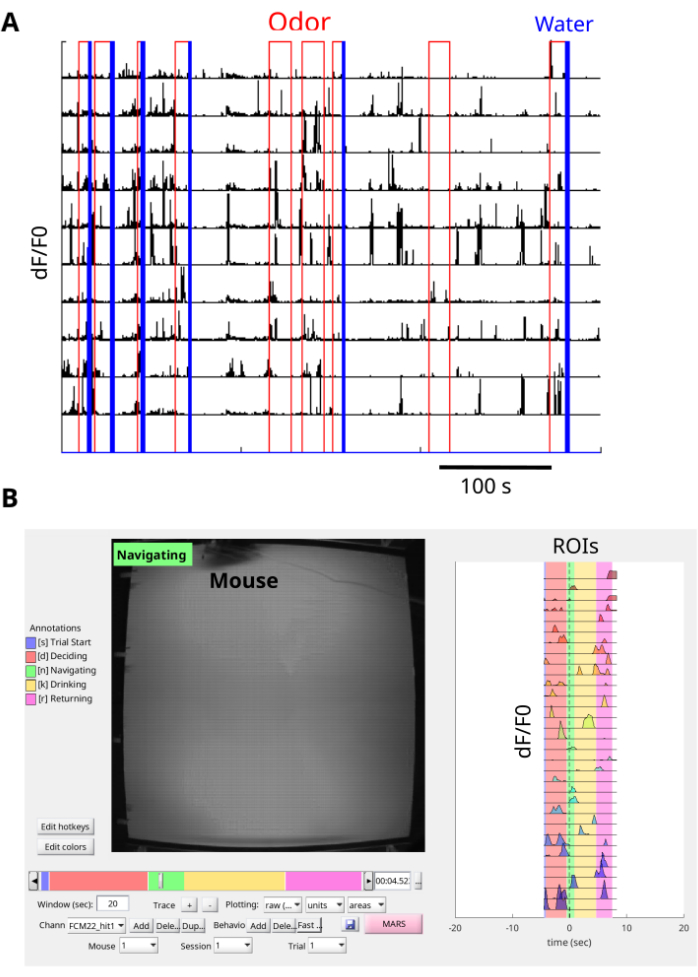
Şekil 7: Verilerin önceden işlenmesi. (A) Birçok deneme için koku arenası olaylarıyla senkronize edilmiş kalsiyum izleri. Her bir deneme, kırmızı renkte bir koku iletimi ile başlar ve ödüllü denemeler, mavi renkte bir su dağıtım darbesi ile sona erer. Her ROI için δF/F0 (birimsiz) kalsiyum izleri siyah renkle gösterilir. Her satır bir yatırım getirisini gösterir. Koku arenasındaki üst kameranın TTL çıkışlarını kaydetmek için bir arayüz kartı ve kareleri senkronize etmek için miniskop kamera kullanılır. NorMCorre, miniskop çerçevelerinden gelen hareket gürültüsünü düzeltmek için kullanılır ve EXTRACT, ROI'leri bulmak ve δF/F0 kalsiyum izlerini çıkarmak için kullanılır. (B) Bir tüyde gezinen bir farenin temsili tek denemesi. Tek bir denemenin her bir ROI'sinden senkronize davranışın (sol panel) ve δF/F0 kalsiyum izlerinin (sağ panel) eş zamanlı görselleştirilmesi BENTO ile gözlemlenir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 8. CA1 sinyallerinden farenin konumunun kodunun çözülmesi. CA1 ROI'lerinden farenin X ve Y konumunun kodunu çözme. Kod çözme tahmini mavi renkle gösterilir ve fare zemininin gerçek konumu kırmızı renkle gösterilir. Tahmin edilen izler, temel gerçekle güçlü bir şekilde ilişkilidir. (A) ROI'lerden X pozisyonlarının kodunun çözülmesi (Pearson Korelasyon Katsayısı = 0.88). (B) ROI'lerden Y pozisyonlarının kodunun çözülmesi (Pearson Korelasyon Katsayısı = 0.88). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Ek Film 1: Sol şeritte bir koku bulutuna doğru seyreden bir farenin senkronize davranışsal ve miniskop çerçevelerinin temsili örneği. (A) Minoskop takan ve koku arenasının içinde gezinen bir farenin davranışsal çerçeveleri. (B) GRIN lensi aracılığıyla kaydedilen ham kalsiyum geçişlerini gösteren farenin miniskop çerçeveleri. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Film 2: Sağ şeritte bir koku bulutuna doğru seyreden bir farenin senkronize davranışsal ve miniskop çerçevelerinin temsili örneği. (A) Minoskop takan ve koku arenasının içinde gezinen bir farenin davranışsal çerçeveleri. (B) GRIN lensi aracılığıyla kaydedilen ham kalsiyum geçişlerini gösteren farenin miniskop çerçeveleri. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Film 3: Fare davranışı ve beyin sinyallerinin işlenmiş verilerinin BENTO gösterimi. Sol panel: Fare arenada sağ şeride doğru ilerliyor. Davranış ek açıklamaları farklı renklerde gösterilir. Sağ panel: Gezinen farenin δF/F0 kalsiyum sinyalleri. Bu filmi indirmek için lütfen buraya tıklayın.
Ek Dosya 1: NoseconeRender.png. İzofluran anestezisi gerçekleştirmek için 3D baskılı burun konisi için dosya. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 2: HeadbarRender.png. Farenin kafasını sabitlemek için baş çubuğunu dosyalayın. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 3: HeadbarTechnicalDrawing.png. Farenin kafasını sabitlemek için baş çubuğunu dosyalayın. Bu dosyayı indirmek için lütfen buraya tıklayın.
Ek Dosya 4: ArenaFig_Draft2.tiff. Koku arenasının detaylı düzeni. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, bir koku bulutunda gezinen farelerin hipokampusunun dCA1 alanındaki yer hücrelerini ve kokuya duyarlı hücreleri kaydetme adımlarını titizlikle özetlemektedir. Protokoldeki kritik adımlar arasında stereotaksik cerrahi, miniskop taban plakasının yerleştirilmesi, koku alanının oluşturulması, koku alanındaki tüylerin kontrol edilmesi, davranış eğitimi, serbestçe hareket eden farenin minoskop kaydı, veri ön işleme ve veri analizi yer alıyor. Ek olarak, protokol, dCA1 kayıtlarından fare yörüngesinin kodunu çözme işlemini açıklar.
Stereotaksik cerrahide kritik bir adım, GRIN lensini doğru yere yerleştirmek için bregmaya göre koordinatları takip etmektir. Yöntemin bir sınırlaması, ameliyat ile GCaMP6f sinyallerini gözlemlemeye başlama süresi arasındaki gecikmedir ve bu süre 2-4 hafta sürebilir. Fare bu kritik dönemden sonra kullanıma hazır olmalıdır. Mevcut protokol ile önceki protokoller 24,25,26,27 arasındaki bir fark, hipokampusa AAV-GCaMP6f virüsü enjekte etmek yerine CA1'de GCaMP6f'yi zaten eksprese eden Thy1-GCaMP6f farelerinin kullanılmasıdır. Ameliyat sırasında zaman kazandırır ve AAV virüsünün beyinde ifade edilmesi için bekleme süresi gerektirmez. Ek olarak, bu protokol beyni aspire etmez ve aşırı dozları önlemek için dozun daha iyi kontrol edilmesini sağlayan ketamin / ksilazin yerine izofluran kullanır. Yöntemin bir sınırlaması, görüş alanını sınırlayan GRIN merceğinin optik sapmasıdır. Taban plakasının yerleştirilmesi için çok önemli bir adım, taban plakasını kafaya yapıştırdıktan sonra Z plakasının ayarlanmasında bir sınırlamayı önlemek için elektro ıslatma lensini merkezde tutmaktır. Koku arenasının inşasının bir sınırlaması, sistemin birkaç ay sürebilen ve bir mühendisin yardımını gerektirebilen karmaşıklığıdır. Davranışsal eğitimin bir sınırlaması, farelerin koku alanının bir tarafını diğerine karşı tercih edebilmesidir. Bu sorunun üstesinden gelmenin bir yolu, fareyi sol ve sağ şeritlere doğru seyrettiği için ödüllendiren alternatif denemeler yapmaktır.
Tüyü kontrol etmek için kritik bir adım, tüyün yolunu tespit etmek için PID iğnesini koku kaynağıyla aynı hizada tutmaktır. Serbestçe hareket eden bir fareyi miniskop kaydetmenin çok önemli bir adımı, mini koaksiyel telin görev sırasında dolaşmamasını sağlamaktır, bu da bir komütatörle önlenebilir. Mini koaksiyel telin farenin önüne gelmesini önlemek için helyum balonları kullanılabilir. Koku arenasının dijital üst kamerasının ve miniskop kameranın TTL darbelerini senkronize etmek için veri ön işleme için kritik öneme sahiptir. EXTRACT prosedürü için, ROI'leri ve δF/F0 sinyallerini daha iyi çıkarmak için negatif olmayan işlemenin kullanılması önerilir. EXTRACT, kötü olanları hariç tutmak için her bir ROI için izlerin görsel bir incelemesini sağlar. Yapay sinir ağını daha iyi eğitmek için yüzlerce dönem içeren büyük bir veri kümesine sahip olmak için farenin X ve Y konumlarının kodunu ROI'lerden çözmek çok önemlidir.
Bu serbestçe hareket eden kayıt yönteminin mevcut kafa sabitleme yöntemleriyle ilgili önemi, fare davranışını, karmaşık bir koku bulutunda gezinmek için uygun kafa hareketi ile etolojik olarak ilgili bir bağlamda incelemektir. Bu yöntem, karmaşık koku verici navigasyonunda dCA1 nöronlarının dinamik rolünü araştırmak için uygulanabilir. Ayrıca, prosedür hipokampus veya koku alma ile sınırlı değildir. Tekniğin diğer potansiyel uygulamaları arasında, ödüllü şeritleri belirtmek için LED'ler kullanarak görsel navigasyondaki olası uygulamalar da dahil olmak üzere, farklı beyin alanlarının ve duyusal modalitelerin rolünün incelenmesi yer almaktadır. Ek olarak, bu yöntem, popülasyondan nöral kalsiyumun kodunun çözülmesinin nörostimülasyonu veya duyusal geri bildirimi tetiklediği gerçek zamanlı kapalı döngü deneylerinde potansiyel olarak uygulanabilir 20,34,35,36.
Açıklamalar
Yazarlar herhangi bir çıkar çatışması beyan etmemektedir.
Teşekkürler
Bu araştırma ABD Ulusal Sağlık Enstitüleri (NIH UF1 NS116241 ve NIH R01 DC000566) ve Ulusal Bilim Vakfı (NSF BCS-1926676) tarafından desteklenmiştir. Yazarlar, Odor Arena odasının kurulmasına yardım ettiği için Andrew Scallon'a teşekkür ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Arduino Micro | Arduino | Micro | |
| Biocompatible Methacrylate Resin | Parkell | S380 | C&B-Metabond Adhesive Luting Cement |
| Decoding Brain Signals Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Dental Drill | Osada | LHP-6 | AZ210015 |
| Dental Drill Box | Osada | XL-230 | 30000 rotations per minute |
| Digital stereotaxic instrument | Stoelting | 51730D | Mouse Stereotaxic Instument, #51904 Digital Manipulator Arm, 3-Axes, Add-On, LEFT |
| Drill Bit | FST Fine Science Tools | 19007-05 | Tip diameter 0.5 mm |
| Fast Digital Camera | Edmund Optics | BFS-U3-63S4C | FLIR Blackfly S |
| Focal Lens | Edmund Optics | C-Series | 3.5 mm |
| GRIN lens | Inscopix | 1050-004595 | 1 mm diameter and 4 mm length |
| GRIN lens Holder | UCLA | http://miniscope.org/index.php/Surgery_Protocol | |
| Liquid Tissue Adhesive | 3M | 1469C | Vetbond Tissue Adhesive |
| Low-Flow Anesthesia System for Mice | Kent Scientific Corporation | SomnoSuite | https://www.kentscientific.com/products/somnosuite/ |
| Low Toxicity Silicone Adhesive | WPI – World Precision Instruments | Kwik-sil | |
| miniPID Controller | ASI – Aurora Scientific Inc. | Model 200B | Fast-Response Miniature Photo-Ionization Detector |
| Miniscope V4 Holder | UCLA | NA | https://github.com/Aharoni-Lab/Miniscope-v4/tree/master/Miniscope-v4-Holder |
| Miniscope V4 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4 |
| Miniscope Base Plate V2 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4-base-plates-variant-2-pack-of-10 |
| Miniscope DAQ-QT software | UCLA | https://github.com/Aharoni-Lab/Miniscope-DAQ-QT-Software/wiki | |
| Motion Correction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Odor Arena Hardware | Custom Made | 3D Model | https://www.dropbox.com/scl/fo/lwtpqysnpzis32mhrx3cd/ADomsxyhxu42sqDmTBl2O6k?rlkey=b3l4809eradundt5l3iz0gq74& dl=0 |
| Odor Arena Software | CUAnschutz | https://github.com/wryanw/odorarena | |
| Odorant Isoamyl Acetate | Aldrich Chemical Co | 06422AX | Diluted at 1% in odorless mineral oil |
| RHD USB Interface Board | Intan Technologies | C3100 | Product discontinued. Alternatively use another equivalent board. |
| ROI Extraction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Sutter Micromanipulator | Sutter Instrument Company | MP-285 | |
| Synchronization Software | CU Anschutz | https://github.com/fsimoesdesouza/Synchronization | |
| Thy1-GCaMP6f mice | Jackson Laboratory | IMSR_JAX 028281 | C57BL/6J-Tg(Thy1-GCaMP6f)GP5.12Dkim/J) |
Referanslar
- Adoff, M. D., Climer, J. R., Davoudi, H., Marvin, J. S., Looger, L. L., Dombeck, D. A. The functional organization of excitatory synaptic input to place cells. Nat Commun. 12 (1), 3558(2021).
- Radvansky, B. A., Oh, J. Y., Climer, J. R., Dombeck, D. A. Behavior determines the hippocampal spatial mapping of a multisensory environment. Cell Rep. 36 (5), 109444(2021).
- Lewis, S. M., et al. Plume dynamics structure the spatiotemporal activity of mitral/tufted cell networks in the mouse olfactory bulb. Front Cell Neurosci. 15, 633757(2021).
- Findley, T. M., et al. Sniff-synchronized, gradient-guided olfactory search by freely moving mice. ELife. 10, e58523(2021).
- Gire, D. H., Kapoor, V., Arrighi-Allisan, A., Seminara, A., Murthy, V. N. Mice develop efficient strategies for foraging and navigation using complex natural stimuli. Curr Biol. 26 (10), 1261-1273 (2016).
- Liu, A., Papale, A. E., Hengenius, J., Patel, K., Ermentrout, B., Urban, N. N. Mouse navigation strategies for odor source localization. Front Neurosci. 14, 218(2020).
- Tariq, M. F., et al. Using head-mounted ethanol sensors to monitor olfactory information and determine behavioral changes associated with ethanol-plume contact during mouse odor-guided navigation. eNeuro. 8 (1), (2021).
- Rigolli, N., Reddy, G., Seminara, A., Vergassola, M. Alternation emerges as a multi-modal strategy for turbulent odor navigation. ELife. (11), e76989(2022).
- Ma, M., et al. Sequential activity of CA1 hippocampal cells constitutes a temporal memory map for associative learning in mice. Curr Biol. 34 (4), 841-854 (2024).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nat Methods. 16 (1), 11-13 (2019).
- Aharoni, D., Hoogland, T. M. Circuit investigations with open-source miniaturized microscopes: Past, present and future. Front Cell Neurosci. 13, 141(2019).
- Flusberg, B. A., et al. High-speed, miniaturized fluorescence microscopy in freely moving mice. Nat Methods. 5 (11), 935-938 (2008).
- Connor, E. G., McHugh, M. K., Crimaldi, J. P. Quantification of airborne odor plumes using planar laser-induced fluorescence. Exp Fluids. 59 (9), 137(2018).
- Gumaste, A., et al. A Comparison between mouse, in silico, and robot odor plume navigation reveals advantages of mouse odor tracking. eNeuro. 7 (1), (2020).
- Gumaste, A., et al. Behavioral discrimination and olfactory bulb encoding of odor plume intermittency. ELife. 13, e85303(2024).
- Marin, A. C., Schaefer, A. T., Ackels, T. Spatial information from the odour environment in mammalian olfaction. Cell Tissue Res. 383 (1), 473-483 (2021).
- Eichenbaum, H. The role of the hippocampus in navigation is memory. J Neurophysiol. 117 (4), 1785-1796 (2017).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13 (11), 1433-1440 (2010).
- Wirtshafter, H. S., Disterhoft, J. F. In vivo multi-day calcium imaging of CA1 hippocampus in freely moving rats reveals a high preponderance of place cells with consistent place fields. J Neurosci. 42 (22), 4538-4554 (2022).
- Mizuta, K., Sato, M. Multiphoton imaging of hippocampal neural circuits: techniques and biological insights into region-, cell-type-, and pathway-specific functions. Neurophotonics. 11 (3), 033406(2024).
- Radvansky, B. A., Dombeck, D. A. An olfactory virtual reality system for mice. Nat Commun. 9 (1), 839(2018).
- Almeida-Santos, A. F., et al. Social isolation impairs the persistence of social recognition memory by disturbing the glutamatergic tonus and the olfactory bulb-dorsal hippocampus coupling. Sci Rep. 9 (1), 473(2019).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), e108697(2014).
- Thapa, R., Liang, B., Liu, R., Li, Y. Stereotaxic viral injection and gradient-index lens implantation for deep brain in vivo calcium imaging. J Vis Exp. (176), e63049(2021).
- Hsiao, Y. -T., Wang, A. Y. -C., Lee, T. -Y., Chang, C. -Y. Using baseplating and a miniscope preanchored with an objective lens for calcium transient research in mice. J Vis Exp. (172), e62611(2021).
- Zhang, L., et al. Miniscope GRIN lens system for calcium imaging of neuronal activity from deep brain structures in behaving animals. Curr Protoc Neurosci. 86 (1), e56(2019).
- Guo, D., Gürkan Özer, A., Uusisaari, M. Y. In vivo calcium imaging in mouse inferior olive. J Vis Exp. (172), e62222(2021).
- Yun, M., Shin, J., Jung, M. W. Protocol for calcium imaging of dorsal and ventral CA1 neurons in head-fixed mice. STAR Protoc. 4 (3), 102439(2023).
- Yun, M., Hwang, J. Y., Jung, M. W. Septotemporal variations in hippocampal value and outcome processing. Cell Rep. 42 (2), 112094(2023).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. J Neurosci Methods. 291, 83-94 (2017).
- Inan, H., et al. Fast and statistically robust cell extraction from large-scale neural calcium imaging datasets. bioRxiv. , (2021).
- Segalin, C., et al. The mouse action recognition system (MARS) software pipeline for automated analysis of social behaviors in mice. ELife. 10, e63720(2021).
- Chen, Z., et al. A hardware system for real-time decoding of in vivo calcium imaging data. ELife. (12), e78344(2023).
- Xue, F., et al. Multi-region calcium imaging in freely behaving mice with ultra-compact head-mounted fluorescence microscopes. Natl Sci Rev. 11 (1), nwad294(2024).
- Tabourin, L., Bretzner, F., Galstian, T. Towards a mini-endoscope design with spatially selective excitation and imaging. Biomed Opt Express. 15 (3), 1750-1760 (2024).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır