Method Article
Miniscope registrando sinais de cálcio no hipocampo de camundongos navegando em uma pluma de odor
Neste Artigo
Resumo
Este protocolo investiga a relação cérebro-comportamento no hipocampo CA1 em camundongos navegando em uma pluma de odor. Fornecemos um protocolo passo a passo, incluindo cirurgia para acessar imagens do hipocampo, treinamento comportamental, gravação e processamento do cérebro do miniscope GCaMP6f e dados comportamentais para decodificar a posição do mouse a partir da atividade neural do ROI.
Resumo
Os ratos navegam em uma pluma de odor com uma estrutura espaço-temporal complexa no escuro para encontrar a fonte de odores. Este artigo descreve um protocolo para monitorar o comportamento e registrar transientes de Ca2+ em neurônios piramidais do estrato dorsal CA1 no hipocampo (dCA1) em camundongos navegando em uma pluma de odor em uma arena de odor de 50 cm x 50 cm x 25 cm. Um miniscópio de epifluorescência focado através de uma lente de índice de gradiente (GRIN) imaginou transientes de Ca2+ em neurônios dCA1 expressando o sensor de cálcio GCaMP6f em camundongos Thy1-GCaMP6f. O artigo descreve o protocolo comportamental para treinar os camundongos para realizar essa tarefa de navegação de pluma de odor em uma arena de odor automatizada. Os métodos incluem um procedimento passo a passo para a cirurgia para implante de lente GRIN e colocação de placa de base para imagem GCaMP6f em CA1. O artigo fornece informações sobre o rastreamento em tempo real da posição do mouse para automatizar o início dos testes e a entrega de uma recompensa de água. Além disso, o protocolo inclui informações sobre o uso de uma placa de interface para sincronizar metadados que descrevem a automação da tarefa de navegação de odor e os tempos de quadro para o miniscópio e uma posição do mouse de rastreamento de câmera digital. Além disso, os métodos delineiam o pipeline usado para processar filmes de fluorescência GCaMP6f por correção de movimento usando o algoritmo NorMCorre seguido pela identificação de regiões de interesse com EXTRACT. Finalmente, o artigo descreve uma abordagem de rede neural artificial para decodificar caminhos espaciais da atividade do conjunto neural CA1 para prever a navegação do mouse na pluma de odor.
Introdução
Embora um progresso significativo tenha sido feito na compreensão dos circuitos neurais envolvidos na navegação olfativa em camundongos com a cabeça fixa 1,2,3 e estratégias de navegação em camundongos em movimento livre 4,5,6,7,8, o papel dos circuitos neurais na navegação em movimento livre etologicamente relevante de plumas de odor turbulentas ainda é desconhecido. Este artigo descreve o monitoramento da atividade neural por meio de imagens de transientes de Ca2+ em células que expressam o sensor de cálcio geneticamente codificado GCaMP6f em camundongos Thy1-GCaMP6f9 para estudar se a dinâmica neural sequencial de neurônios piramidais do estrato dorsal CA1 no hipocampo (dCA1) desempenha um papel na navegação da pluma de odor. Os métodos fornecem informações sobre a fluorescência GCaMP6f imageada por meio de um microscópio de epifluorescência em miniatura focado através de uma lente GRIN em dCA1 10,11,12. Os métodos explicam como monitorar simultaneamente a navegação espacial e os transientes de cálcio GCaMP6f do neurônio dCA1 em camundongos que executam uma tarefa de navegação de pluma de odor, onde receberam uma recompensa de água quando alcançaram o bico, entregando um odor em uma arena de odor com um fluxo de ar laminar de fundo13,14. Este artigo descreve os métodos necessários para realizar essa tarefa (Figura 1), incluindo a cirurgia estereotáxica para a implantação de lentes de índice de gradiente (GRIN), a colocação de uma placa de base para prender o miniscópio ao crânio em um mouse em movimento livre, imagens com o microscópio em miniatura e monitoramento do movimento do mouse com uma câmera digital de alta velocidade, pré-processamento de dados para remover artefatos de movimento e encontrar as regiões de interesse (ROIs), e preparação de conjuntos de dados e treinamento e previsão de redes neurais artificiais para decodificar as posições X e Y do camundongo na arena de odor a partir de mudanças na fluorescência em ROIs dCA17.
O registro miniscópio de sinais de cálcio na região CA1 do hipocampo de camundongos navegando em uma pluma de odor é relevante para a compreensão do cálculo de circuitos neurais envolvidos com olfato e informações espaciais na complexa tarefa comportamental de navegação de pluma de odor 2,14,15,16. A região CA1 do hipocampo desempenha um papel na navegação espacial e é crucial para a criação de um mapa cognitivo do ambiente para uma navegação eficiente17,18. Registrar sinais de cálcio com um miniscópio é uma maneira valiosa de investigar os neurônios CA1 que codificam informações espaciais durante a navegação da pluma de odor.
Essa técnica combina as vantagens da tecnologia miniscope para registrar sinais de cálcio GCaMP com o papel bem estabelecido do hipocampo CA1 na navegação espacial para entender melhor como os circuitos neurais conduzem comportamentos complexos19. Alternativamente, abordagens usando microscopia de 2 fótons podem registrar neurônios CA1 9,20, o que requer um mouse com a cabeça fixa e restringe a possibilidade de se mover livremente para navegar em uma pluma de odor21. Registros eletrofisiológicos de campo local de neurônios CA1 permitem a investigação de camundongos que se movem livremente navegando em plumas de odor22. Ainda assim, os sinais elétricos de campo local impõem limitações à estimativa do disparo intracelular, isolando sinais de unidade única por meio de técnicas de classificação de pico. Os sinais do Miniscope permitem a identificação de ROIs associadas diretamente aos sinais de cálcio intracelular de maneira confiável10,11 para investigar cálculos neurais com resolução de célula única com precisão. A tecnologia Miniscope oferece uma oportunidade única de entender melhor como a região CA1 codifica informações espaciais com base em pistas de odor.
Além disso, esta técnica investiga como populações neuronais específicas processam informações de odor para navegação e a relação entre os padrões de atividade neuronal e a tomada de decisão durante o rastreamento da pluma de odor. Este método pode contribuir para uma melhor compreensão de como o cérebro processa o odor e as informações espaciais. Embora os miniscópios ofereçam uma resolução de célula única para registrar o cérebro de um camundongo em movimento livre, eles exigem cirurgia especializada e experiência em análise de dados. Neste artigo, fornecemos um protocolo abrangente para ajudar os pesquisadores a passar por cada etapa para investigar os mecanismos neurais da navegação da pluma de odor.
A tarefa de navegação de odores é uma estrutura promissora para estudar a codificação neural e a memória espacial de sinais de odor em camundongos. As descobertas do artigo indicam que é possível decodificar a trajetória do camundongo navegando em uma pluma de odor com base nos sinais de cálcio do conjunto neuronal em dCA1. Compreender o papel dos sinais de cálcio dCA1 na navegação da pluma de odor é um passo crucial para quebrar a base do circuito neural para a navegação guiada por odor em ambientes realistas13,14.
Protocolo
Os estudos foram realizados em camundongos transgênicos Thy1-GCaMP6f machos e fêmeas de 3-6 mesesde idade 23. Todos os protocolos experimentais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais do Campus Médico Anschutz da Universidade do Colorado, de acordo com as diretrizes do National Institutes of Health. Os procedimentos cirúrgicos para implante da lente GRIN (Seção 1) e colocação da placa de base (Seção 2) foram adaptados de trabalhos anteriores 9,24,25,26,27,28,29.
1. Cirurgia estereotáxica para implante de lente GRIN no hipocampo
- Use luvas estéreis, uma cobertura para a cabeça, uma máscara cirúrgica e um jaleco.
- Use condições estéreis durante todas as cirurgias de sobrevivência. Esterilize todos os equipamentos cirúrgicos em autoclavagem.
- Coloque campos estéreis ao redor da área cirúrgica.
- Anestesiar o camundongo colocando-o na câmara de indução com isoflurano a 3% por 10 min. Injetar Base de Buprenorfina em Polímero a 0,001 mg/g por via subcutânea no momento da indução anestésica.
- Verifique se o mouse para de se mover e está sob anestesia profunda, confirmada beliscando a pata traseira para testar o reflexo da pata traseira.
- Mude o fluxo de isoflurano para o cone nasal (Suplementar File 1).
- Certifique-se de que o sistema de anestesia com isoflurano de baixo fluxo para camundongos (Tabela de Materiais) tenha a almofada de temperatura configurada para as configurações homeotérmicas e certifique-se de que a fonte de vapor esteja configurada para compressão externa.
- Coloque o mouse anestesiado no instrumento estereotáxico digital (Tabela de Materiais). Coloque os dentes da frente do mouse na barra de mordida e coloque o cone do nariz na frente do nariz para garantir o fluxo de isoflurano e travar a cabeça no lugar. Ajuste o nível de anestesia entre 2% e 3% de acordo com o reflexo da pata após beliscar (Figura 2A).
- Coloque as barras de orelha do mouse nas orelhas e aperte-as. Certifique-se de que a cabeça do mouse esteja na horizontal e não se mova de um lado para o outro ou para cima e para baixo. Quando a cabeça estiver segura, certifique-se de que pressionar levemente o crânio para baixo não faça com que o crânio escorregue por baixo das barras de cabeça.
- Coloque a sonda de temperatura no reto e prenda o fio na cauda do mouse para evitar movimentos. Defina a temperatura da almofada para manter a temperatura retal em 37 °C.
- Adicione pomada oftálmica aos olhos para evitar o ressecamento prejudicial do ar.
- Raspe o cabelo quando a cabeça estiver fixa e sob o fluxo de isoflurano fornecido pelo cone do nariz para evitar movimentos. Raspe o cabelo acima da cabeça com um barbeador elétrico e, em seguida, limpe os pelos restantes com removedor de pelos e aplicadores de madeira com ponta de algodão estéril (Figura 2B).
- Torne o campo cirúrgico estéril esfregando o couro cabeludo com um aplicador de madeira estéril com ponta de algodão com etanol e betadine três vezes cada.
- Injete 0,1 mL do anestésico local lidocaína por via subcutânea (S.Q.) sob a pele entre os olhos e as orelhas com uma agulha de 29 G. Isso fará uma bolha. Aguarde alguns minutos antes de cortar a pele com uma tesoura.
- Usando uma técnica apenas de pontas, puxe a pele para cima com cuidado usando uma pinça e use uma tesoura pequena para remover uma parte circular da pele. Absorva qualquer sangue com um cotonete estéril.
- Assim que o sangramento parar, limpe o crânio com peróxido de hidrogênio (5%) usando um cotonete estéril. Certifique-se de que os pontos de referência ósseos, incluindo a sutura sagital e a interseção da sutura bregmática para marcar o bregma, sejam fáceis de identificar após este procedimento.
- Confirme se o crânio é plano em relação ao aparelho estereotáxico, certificando-se de que as suturas bregma e lambda estejam exatamente na mesma coordenada Z. Faça isso colocando uma agulha no braço do manipulador e verificando se a ponta de uma agulha está na mesma coordenada Z ao tocar em ambas as suturas. Caso contrário, ajuste o ângulo da cabeça movendo a barra de mordida na placa Z e repetindo o procedimento até que a habilidade esteja em uma posição plana.
- Conecte uma pipeta ao micromanipulador segurando uma agulha para aplicar a tinta da tatuagem. Faça uma marca no topo do bregma.
- Zere as coordenadas do micromanipulador no bregma e mova para a coordenada acima CA1 no hipocampo direito (médio-lateral +1,8 mm do bregma, ântero-posterior -2,4 mm do bregma)2. Este é o local escolhido por Radvansky e Dombeck para estudar a navegação virtual do gradiente de odor em camundongos 18,30. Perfure cuidadosamente um pequeno amassado permanente de 1 mm de diâmetro com uma broca (Tabela de Materiais) a 10000 rotações para fazer um amassado permanente na parte superior do local alvo (Figura 2C).
- Use a broca odontológica para abrir uma perfuração circular de 1,5 mm de diâmetro para permitir a implantação de uma lente GRIN de 1 mm de diâmetro e 4 mm de comprimento no cérebro (Tabela de Materiais) (Figura 2D).
- Perfure a dura-máter e o córtex inserindo uma agulha 23 G no meio do orifício e movendo a agulha para o cérebro lentamente (~ 0,1 mm / min) até atingir a profundidade de 1,25 mm abaixo da dura-máter. Remova a agulha lentamente do cérebro (~ 0,1 mm / min). Use cotonetes estéreis e soro fisiológico para limpar o sangue.
- Use um suporte de lente GRIN da UCLA feito sob medida, construído com duas pontas de micropipeta de 1 mL cortadas para caber uma dentro da outra (suporte de lente GRIN, Tabela de Materiais) (Figura 2E, F).
- Conecte o suporte da lente GRIN ao micromanipulador e ligue o aspirador conectado à pipeta para segurar a lente GRIN. A pressão do ar produzida pela sucção de ar mantém a lente GRIN no lugar.
- Use uma lente GRIN de 4 mm de comprimento e 1 mm de diâmetro. Implante a lente GRIN lentamente no córtex até atingir uma profundidade de -1,25 mm abaixo da dura-máter.
- Coloque uma gota de adesivo de tecido líquido (Tabela de Materiais) na perfuração circular do crânio para selar o orifício. Aguarde alguns minutos para secar.
- Prepare cimento adesivo rápido -resina de metacrilato biocompatível- (Tabela de Materiais) na base da lente GRIN para selá-la permanentemente no crânio. Aguarde alguns minutos e deixe secar.
- Desligue o aspirador para liberar e remova lentamente o suporte da lente GRIN da parte superior da lente GRIN que neste momento está permanentemente presa ao crânio.
- Coloque a barra de cabeça na parte superior do crânio, centralizando o orifício na lente GRIN (Figura 2G-I) (Arquivo Suplementar 2 e Arquivo Suplementar 3).
- Coloque cuidadosamente cimento adesivo de secagem rápida (Tabela de Materiais) ao redor da base da lente GRIN para selar a janela craniana e prender a barra da cabeça ao crânio. Coloque o cimento adesivo de secagem (Tabela de Materiais) no meio da barra da cabeça e nas laterais para mantê-lo bem fixado no crânio. Certifique-se de que está completamente seco. Certifique-se de que nenhum cimento adesivo seja colocado em cima da lente GRIN; caso contrário, degradará permanentemente o caminho óptico e bloqueará a imagem.
- Coloque uma gota de adesivo de silicone de baixa toxicidade (Tabela de Materiais) em cima da lente GRIN para proteção contra danos físicos.
- Desligue o isoflurano
- Faça monitoramento imediato de cuidados pós-operatórios até que o animal acorde da anestesia.
- Tome cuidados pós-operatórios até a recuperação total da cirurgia, monitorando os camundongos quanto a sinais de dor. Não devolva o animal que foi submetido à cirurgia à companhia de outros animais.
- Observe brevemente o movimento ao redor da gaiola, comer e beber e as reações normais ao manuseio para garantir que não estejam sob dor ou estresse.
- Se os animais mostrarem sinais de danos neurológicos ou teciduais graves, eutanasia-os humanamente imediatamente.
2. Posicionamento da placa de base para o miniscópio
NOTA: Os procedimentos para fixar a cabeça do camundongo começam 2 semanas após o animal se recuperar totalmente da cirurgia. O procedimento para a imagem dCA1 começa 3 semanas após a cirurgia, após o animal se recuperar totalmente e o sinal GCaMP6f se tornar fortemente visível. Uma placa de base é fixada na parte superior da lente GRIN para acesso óptico da fluorescência dCA1 GCaMP6f através da lente GRIN usando um miniscópio. Este protocolo utilizou o miniscope versão 4 -V4 (Miniscope V4; Tabela de Materiais).
- Comece a fixar a cabeça do mouse por 10 minutos, prendendo a barra da cabeça com grampos de aperto para aclimatar o mouse à fixação da cabeça 2 semanas após a cirurgia.
- Fixe a cabeça do mouse 3 semanas após a cirurgia para a colocação da placa de base.
- Anexe um miniscópio a um suporte impresso em 3D preso a um micromanipulador (Tabela de Materiais) conectado a um micromanipulador (Figura 3A, B).
- Remova cuidadosamente o adesivo de silicone (Tabela de Materiais) da parte superior da lente usando uma pinça fina e limpe a superfície da lente GRIN usando um pano de lente.
- Prenda a placa de base presa ao miniscópio apertando o parafuso de fixação na lateral da placa de base (Tabela de Materiais) (Figura 3C, D).
- Mova a extremidade do miniscópio até atingir 100 μm acima da lente GRIN.
- Use os controles deslizantes para definir as configurações do miniscope no software miniscope (Tabela de materiais) seguindo as etapas 2.8 a 2.10.
- Clique no controle deslizante Power no software para controlar a potência e mantê-la em torno de 10%.
- Clique no controle deslizante Taxa de aquisição e mantenha-o em torno de 10 Hz.
- O miniscópio v4 possui uma lente eletroumectante que pode ser usada para foco fino. Clique no controle deslizante Foco para defini-lo em 50% para manter a lente eletroumectante no meio da faixa focal.
- Use o software para view a parte superior da lente GRIN. É possível ver a forma circular da lente GRIN na tela.
- Aproxime o miniscópio da lente GRIN ajustando a posição axial com o micromanipulador e monitore a imagem com o computador.
- Quando a parte superior da lente GRIN estiver visível, use o foco fino para cima e para baixo no micromanipulador para alcançar o melhor plano focal para visualizar os flashes das células. Use a configuração pseudo δF/F0 no software para verificar novamente a qualidade dos flashes da célula.
- Defina o foco para permitir o número máximo de células no campo de view com a maior intensidade de fluorescência atingível. Neste ponto, certifique-se de que os vasos sanguíneos estejam em foco.
- Pode acontecer que um camundongo não tenha sinais transitórios de cálcio - flashes. Nesse caso, evite as próximas etapas (14-16) e verifique o mouse novamente nas próximas semanas para verificar novamente se os sinais transitórios de cálcio ocorrem.
NOTA: Pode-se tomar a decisão de sacrificar o camundongo se os sinais transitórios de cálcio nunca ocorrerem 2 meses após a cirurgia. - Uma vez que o foco esteja otimizado, construa cuidadosamente uma parede de cimento adesivo rápido entre o crânio e a parte inferior da placa de base. Tome cuidado para não cimentar o miniscópio na placa de base e tenha muito cuidado para não deixar nenhum cimento na parte superior da lente GRIN.
- Quando o cimento estiver seco, remova o parafuso de fixação e remova cuidadosamente o miniscópio da placa de base com o micromanipulador.
- Use a tampa da placa de base para proteger a lente GRIN.
3. Construção da arena de odor
NOTA: Este método delineia uma arena de odor automatizada com base no projeto de Connor et al.13 e Gumaste et al.14. A montagem completa pode ser encontrada no link fornecido na Tabela de Materiais (Arquivo Suplementar 4).
- Construa uma câmara com dimensões de 50 cm (L) x 50 cm (L) x 25 cm (A) com 2 paredes de acrílico, um teto de acrílico, um piso de cloreto de polivinila expandido branco (PVC) e 2 paredes exclusivas na frente e atrás que facilitam o fluxo de ar (Figura 4A).
- Instale uma extremidade de sucção de ar na parte traseira da arena com um design cônico e um ventilador de computador conectado para retirar o ar da câmara. Use um botão físico para definir a modulação da largura de pulso do ventilador (PWM) para regular a taxa de fluxo de ar.
NOTA: Uma estrutura de favo de mel impressa em 3D compreende paredes para a frente e para trás da arena de odor para facilitar o fluxo laminar de ar, mantendo um mouse dentro de10. A parede alveolar na frente da arena possui um alargamento externo para receber grandes volumes de ar de maneira não perturbadora. - Configure um sistema de fornecimento de água para fornecer recompensa de água por meio de engenhocas simples com um motor de passo Nema 17 acoplado a uma seringa. Um driver de micropasso A4988 permite o controle preciso do volume dispensado (https://github.com/dougollerenshaw/syringe_pump, Figura 4B).
- Configure a extremidade de entrada de ar com 4 conjuntos de fontes de odor emparelhadas com bicos de fornecimento de água, com cada conjunto posicionado a 10 cm de distância ao longo do eixo x para definir as 'pistas' ao longo das quais um animal navegará para uma recompensa de água (Figura 4C, D).
- Instale um sistema de fornecimento de odor gerenciado por válvulas solenóides conectadas a tubos e frascos de odor (Figura 4D).
NOTA: As válvulas são alimentadas por uma placa de relé em um arranjo que garante que o ar limpo ou o ar odorizado flua o tempo todo e que uma pista única ou zero pista possa receber ar odorizado a qualquer momento. Um conjunto de cinco válvulas solenoides de 12 V é gerenciado usando uma placa de relé contendo 4 relés. Quando todos os 4 relés estão definidos como 'desligados', a válvula de ar limpo está aberta por padrão. Quando qualquer válvula de odor único é aberta, a válvula de ar limpo é fechada automaticamente. O estado da placa de relé é gerenciado usando saídas digitais do controlador arduino primário. Uma bomba de ar de aquário de nível de consumidor fornece ar restrito a 20 mL / min usando um regulador de fluxo de ar manual. Usando uma série de tubos e divisores de diâmetro interno de 1/16 de polegada, a linha de abastecimento fornece ar limpo em cada uma das válvulas solenóides. As válvulas de retenção antes e depois do odor garantem a direção do fluxo de ar. A linha de ar limpo se funde com as linhas de odor antes de entrar na arena para garantir que o ar odorizado seja purgado quando as linhas de odor são fechadas. - Instale uma câmera digital rápida acima da arena para monitorar o comportamento animal (Tabela de Materiais).
NOTA: O comportamento animal é monitorado a 60 Hz usando uma única câmera digital rápida montada acima da arena (Tabela de Materiais). Uma lente C-Series de distância focal fixa de 3,5 mm foi montada por meio de um adaptador de montagem C/CS, capaz de capturar toda a arena (Lente Focal, Tabela de Materiais). - Use um código python personalizado para gerenciar o hardware da arena de odor (Tabela de Materiais). O software integra a câmera e todo o hardware necessário para configurar parâmetros experimentais e adquirir dados experimentais (Tabela de Materiais).
- Configure um PC conectado a uma placa de desenvolvimento Teensy 4.0 para fornecer os meios para o fornecimento de odor e água mediado por computador (Odor Arena Hardware and Software, Table of Materials).
- Configure a câmera digital para exportar um sinal de relógio ao gravar quadros de vídeo. O sinal é usado para sincronização post-hoc com o miniscópio usando uma placa de interface USB (Tabela de Materiais), que registra os sinais de sincronização de ambos os sistemas.
NOTA: Durante um experimento, o software de aquisição personalizado também cria um arquivo de eventos que contém os eventos experimentais importantes e o quadro da câmera no qual o evento ocorreu. Um arquivo de carimbos de data/hora também é criado para identificar quaisquer quadros descartados, um evento raro (Odor Arena Software, Table of Materials).
4. Medição da velocidade do ar da pluma com um detector de fotoionização (PID) (Figura 5)
NOTA: Este método detecta o curso do tempo da pluma de odor através de um PID que expõe o odor gasoso a uma luz ultravioleta de alta intensidade que ioniza as moléculas de odor. A saída do dispositivo detecta moléculas de odor na pluma de odor. Essa técnica permite estimar a velocidade do ar na arena de odores, comparando o atraso para detectar a presença de odores viajando por dois locais usando o PID.
- Coloque um PID em miniatura de resposta rápida em duas distâncias diferentes. Um local é próximo e outro local distante - 10 cm de distância - da fonte de odor.
- Troque a chave GAIN no painel frontal do controlador PID para a posição x5.
- Troque a chave PUMP no painel frontal do controlador PID para a posição Alta.
- Verifique a luz de status do diodo emissor de luz (LED) mostrando a saída do sensor (voltage) no painel frontal do controlador na ausência de odores.
- Alterne o potenciômetro OFFSET para zerar o voltage saída na ausência de odores.
- Ligue a válvula de odor na arena de odor.
- Meça o atraso na detecção da pluma de odor com o PID em cada local após a abertura da válvula. Este procedimento pode ser realizado off-line gravando simultaneamente a saída do PID e a saída da válvula registrada pela arena de odor (odor on) com uma placa de interface (Tabela de Materiais).
- Divida a diferença nos atrasos em cada local pela diferença na distância entre os dois PIDs para calcular a velocidade do ar da pluma.
5. Camundongo de treinamento comportamental na arena de odor (Figura 6)
NOTA: Esta seção descreve uma tarefa comportamental adaptada de Findley et al.4. O rato tem restrição de água no dia anterior para motivar a busca de uma recompensa de água. O camundongo navega pela pluma de odor (Figura 6B) em direção a uma bica de água localizada na fonte de liberação de odor para obter reforço de água (3 gotas de 10 μL fornecidas a 1 Hz). Durante o período de treinamento, o camundongo é mantido sob restrição hídrica por ter acesso a até 2 mL por dia. O peso corporal do camundongo é monitorado durante o período de restrição de água e não deve ser inferior a 85% do peso corporal original. O camundongo recebe aproximadamente 1 mL de água por dia durante o treinamento na arena de odor e é suplementado com 1 mL adicional de água por dia na gaiola após o treinamento. O rato permanece sob restrição de água por um período máximo de 72 h. O software personalizado (Tabela de Materiais) detecta a localização do mouse em tempo real (60 Hz) usando uma técnica simples de subtração de fundo e localização de blob. O usuário define manualmente os limites da pista, o limite inicial (o local inicial do mouse na parte de trás da arena) e o limite de destino (próximo à fonte de odor na frente). Além disso, o usuário pode decidir como o software utiliza esses limites. Por exemplo, o usuário pode fornecer odores somente quando o mouse estiver atrás do limite inicial. Para que o mouse receba uma recompensa, o usuário pode exigir que ele permaneça dentro da pista odorizada enquanto navega até o alvo (a fonte de odor). Assim que o mouse cruzar o limite do alvo, ele poderá receber uma recompensa. Durante o treinamento, no entanto, qualquer um desses requisitos é ajustado simplesmente editando um arquivo 'yaml' projetado para ser autoexplicativo e fácil de usar.
- Primeiro, treine o mouse para iniciar os testes movendo-se para a parte de trás da arena (definida como a parte da arena que está a 40 cm de distância do lado onde o ar flui para a câmara). Espere até que o mouse vá para a parte de trás da arena e, em seguida, entregue manualmente o odor e a água em uma pista aleatória. Deixe o rato encontrar a fonte e beber a água.
- Repita o procedimento várias vezes para criar a associação entre odor e água (Figura 6A, B). Depois que o mouse aprender a iniciar testes, use o software automatizado para fornecer odores.
- Treine o mouse para fazer a tarefa de navegação de odor de duas pistas usando o software personalizado automatizado. Nesta tarefa, escolha aleatoriamente uma das duas portas de odor para fornecer odor e reforce o mouse com água quando ele chegar à bica de água onde o odor é entregue. Este protocolo utilizou o odorante acetato de isoamila diluído a 1% em óleo mineral.
NOTA: O mouse completa uma sessão de cerca de 20 tentativas de navegação de pluma de odor em cerca de 40 minutos. O mouse executa uma sessão por dia. O mouse treinado atinge uma porcentagem de navegação correta acima da escolha aleatória no final da sessão (> 65% de escolhas corretas). O mouse deve atingir o critério de > 65% de acertos na tarefa de navegação de odores de duas pistas após 3 a 5 sessões de treinamento.
6. Registro de epifluorescência de um camundongo em movimento livre na arena do odor
NOTA: O método descreve o registro da atividade neuronal das células do estrato piramidal (SP) no CA1 dorsal por meio de imagens do sensor de cálcio geneticamente codificado GCaMP6f expresso em camundongos Thy19 por imagens de miniscópio de campo amplo durante a tarefa de navegação da pluma de odor de dois bicos (Filme Suplementar 1 e Filme Suplementar 2). Uma sessão típica de imagem leva 40 minutos, permitindo que o mouse conclua aproximadamente 20 tentativas de navegação de odor. Esta técnica registra um camundongo por vários meses.
- Cabeça fixe o mouse, coloque o miniscópio na parte superior da placa de base usando o micromanipulador e aperte o parafuso de fixação.
- Ajuste a lente eletroumectante para encontrar o plano focal ideal com o maior número de células com a maior intensidade de fluorescência.
- Ajuste a potência do miniscópio para obter a faixa dinâmica ideal com uma alta relação sinal-ruído sem saturação. Consiga isso por meio de imagens de CA1 dorsal em camundongos Thy1-GCaMP6f com potência de miniscópio definida em torno de 30% a uma taxa de aquisição de 30 Hz.
- Solte o mouse dentro da arena de odor com o miniscópio preso à placa de base.
- Inicie a aquisição com a placa de interface para gravar a saída lógica transistor-transistor (TTL) da câmera digital localizada na parte superior da arena e o sinal TTL do miniscópio para sincronização posterior entre quadros de vídeo comportamentais e GCaMP6f. A câmera digital grava a 60 Hz e o miniscópio grava a 30 Hz.
- Comece a gravar o miniscópio e os filmes comportamentais e ligue o software automatizado para duas tarefas de navegação de odor de bico.
7. Pré-processamento de dados
NOTA: Este método usa um pipeline MATLAB para processar os dados. O código está disponível no GitHub (Software de Sincronização, Tabela de Materiais). O NoRMCorre31 é usado para correção de movimento e o EXTRACT32 é usado para encontrar as ROIs com sinais de fluorescência variáveis no tempo relatados como mudanças na fluorescência normalizadas pela fluorescência entre transientes de cálcio (δF / F0).
- Sincronize os metadados da arena de odor, os quadros da câmera digital e os quadros do miniscópio usando os sinais de sincronização registrados pela placa de interface executando o código MATLAB Synchronize_Files_JOVE.m, disponível no GitHub.
- Execute a correção de movimento dos quadros do miniscópio sincronizados usando o NoRMCorre (Software de Correção de Movimento, Tabela de Materiais).
- Encontre os ROIs com sinais δF/F0 variáveis no tempo usando o EXTRACT (ROI Extraction Software, Table of Materials).
- Separe os dados em testes (Software de Sincronização, Tabela de Materiais).
- Rotule cada tentativa como um acerto ou um erro com base, respectivamente, no comportamento de navegação correto ou errado do mouse.
- Use o Behavior Ensemble and Neural Trajectory Observatory (BENTO)33 para visualizar o comportamento e os ROIs de cada tentativa separada (Figura 7A, B e Filme Suplementar 3).
8. Análise de dados - Decodificando a posição espacial dos sinais cerebrais
NOTA: Este método usa aprendizado de máquina para decodificar as posições X e Y do mouse na arena a partir dos ROIs dCA17. O código MATLAB está disponível (Software de Decodificação de Sinais Cerebrais, Tabela de Materiais) em https://github.com/restrepd/drgMiniscope.
- Insira o arquivo de saída EXTRACT.mat e o arquivo de metadados da arena de odor no software drgDecodeOdorArenav2.m. O repositório GitHub fornece esses dois arquivos para um exemplo (Software de Sincronização, Tabela de Materiais):
dFF_file='20220804_FCM22_withodor_miniscope_sync
_L1andL4_ncorre_ext.mat';
arena_file='20220804_FCM22withodor_odorarena_L1
andL4_sync.mat';
NOTA: drgDecodeOdorArenav2.m cria um conjunto de dados dividido por dados dentro do estudo contendo os sinais e metadados de ROI (posições X e Y do mouse, localização do bico de odor, fornecimento de água, etc.) para cada teste. O código também analisa a decodificação de dados entre as tentativas. O código usa fitrnet para treinar uma rede neural artificial com os dados δF / F0 para todos os ROIs para todos os ensaios, exceto um, para prever as posições X e Y e prever a posição do ensaio deixado de fora usando um procedimento de deixar um de fora. - A rede neural retorna as posições X e Y como saída. Use a rede neural treinada para fazer previsões. A entrada deixou de fora os testes não usados para treinar a rede para fazer previsões das posições X e Y do mouse na arena a partir dos ROIs (Figura 8A, B).
Resultados
O uso deste procedimento permite visualizar e registrar transientes de fluorescência dCA1 GCaMP6f em camundongos que navegam na arena de odor para encontrar a fonte de odores (Figura 6A, B, Filme Suplementar 1 e Filme Suplementar 2). As imagens de fluorescência são corrigidas por movimento com NoRMCorre, e EXTRACT é usado para extrair as ROIs. Além disso, a gravação com uma placa de interface permite a sincronização dos sinais δF / F0 das ROIs com eventos de odor e entrega de água na arena de odor (Figura 7A), bem como com o movimento do mouse na arena de odor (Figura 7B e Filme Suplementar 3). O resultado representativo do camundongo navegando na pluma de odor inclui um grande número de transientes de cálcio durante a tarefa (Figura 7A, B). Além disso, é possível inspecionar como as respostas de cálcio estão alinhadas com a presença de odor e recompensa de água (Figura 7A). A visualização de ensaios únicos com BENTO fornece informações sobre as respostas de cálcio em diferentes estágios do ensaio, incluindo início do ensaio, decisão, navegação, consumo e retorno ao fundo da arena (Figura 7B). O método comunicou informações valiosas sobre a ligação entre as respostas de cálcio CA1 e o comportamento dos camundongos durante uma tarefa de navegação orientada para o odor.
As gravações PID podem fornecer informações cruciais sobre a pluma de odor e a velocidade do ar da pluma. O resultado representativo mostra um aumento na resposta da PID após a abertura da válvula para liberar a pluma de odor dentro da arena de odor (Figura 5A). Além disso, o protocolo produz a decodificação das posições X e Y do camundongo a partir dos sinais δF / F0 das ROIs dCA1 (Figura 8). Essa técnica prevê a localização espacial do camundongo durante a tarefa de navegação da pluma de odor com base nas respostas CA1, o que é relevante para entender melhor como os neurônios CA1 processam o odor e as informações espaciais. Decodificar a trajetória do camundongo a partir de sinais de cálcio do conjunto neuronal em dCA1 é significativo porque revela como os neurônios em CA1 dorsal representam um mapa cognitivo de odor e informações espaciais para realizar a complexa tarefa de navegação de pluma de odor. O método foi expandido para diferentes ROIs que se comportam exclusivamente como células de lugar e outras células que respondem ao estímulo de odor. A decodificação bem-sucedida da trajetória do camundongo a partir de sinais de conjuntos neuronais pode ser confirmada pela forte correlação entre a previsão de decodificação e as posições X e Y verdadeiras do camundongo.
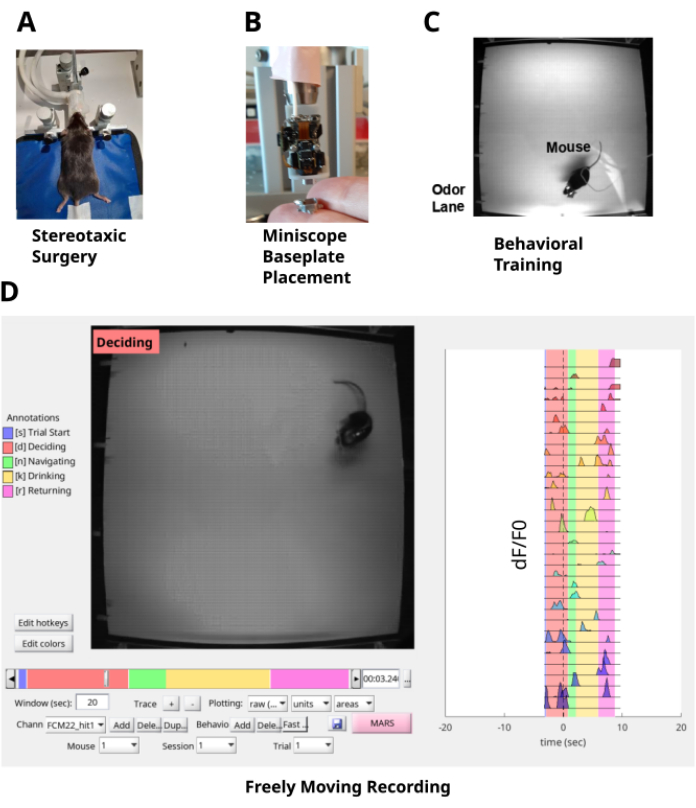
Figura 1: Pipeline de estudo. (A) A cirurgia estereotáxica consiste em implantar uma lente GRIN na camada CA1 do hipocampo e uma placa de cabeça no crânio para fixação da cabeça do camundongo. (B) Uma placa de base é colocada na parte superior da lente GRIN para permitir o acesso óptico à fluorescência dos neurônios CA1 com um miniscópio. (C) O mouse é treinado na tarefa de navegação da pluma de odor. (D) Registro em movimento livre do comportamento do camundongo e dos neurônios CA1 navegando na pluma de odor. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cirurgia estereotáxica. (A) Coloque o camundongo anestesiado no aparelho estereotáxico. Ajuste o nível de anestesia entre 2 a 3% de acordo com a resposta reflexa da pata de beliscar (B) Raspe o cabelo acima da cabeça. (C) Faça um pequeno amassado permanente com uma broca com uma broca para fazer um amassado permanente na parte superior do local alvo. (D) Use a broca odontológica para abrir uma perfuração circular de 1,5 mm de diâmetro para permitir a implantação de uma lente GRIN de 1 mm de diâmetro e 4 mm de comprimento no cérebro. (E) Conecte o suporte da lente GRIN ao micromanipulador e ligue o aspirador conectado à pipeta para segurar a lente GRIN. (F) Implante a lente GRIN lentamente no córtex até atingir a profundidade de -1,25 mm abaixo da dura-máter. (G) Cabeça fixa post-mortem ilustrativa mostrando a placa de cabeça e a placa de base cimentadas no crânio com a lente GRIN implantada. (H) Tomografia computadorizada post-mortem da cabeça ilustrando a barra da cabeça na parte superior do crânio e a lente GRIN implantada dentro do crânio. (I) Projeto da placa de cabeça para permitir a fixação da cabeça do mouse. O animal nesta representação não é drapeado para facilitar uma melhor visualização anatômica. Clique aqui para ver uma versão maior desta figura.

Figura 3: Colocação da placa de base do miniscópio. (A) Suporte de miniscópio impresso em 3D acoplado a um micromanipulador. (B) Miniscope anexado ao suporte. (C) Fixação da placa de base ao miniscópio. (D) Apertar o parafuso de fixação para fixar a placa de base ao miniscópio. O parafuso de fixação é liberado após cimentar a placa de base no crânio do camundongo. Clique aqui para ver uma versão maior desta figura.

Figura 4. Construção da arena de odores. (A) Câmara transparente da arena do odor. Há uma câmera digital superior para gravar o comportamento do mouse. (B) Motores de passo acoplados a seringas controlam o fornecimento de água para recompensar o mouse. (C) Vista de dentro da arena de odor mostrando uma estrutura de favo de mel é usada para produzir um fluxo laminar e quatro linhas de entrega de odor. (D) Sistema de entrega de odor, incluindo tubos, válvulas e garrafas de odor vistas do lado de fora da arena de odor. Clique aqui para ver uma versão maior desta figura.

Figura 5: Registro de pluma de odor . (A) Pluma de odor registrada com o detector de fotoionização (PID). Média (azul negrito) ± Desvio padrão (azul claro) de cinco traços PID de uma pluma de odor se propagando a 4,23 cm / s na arena de odor. Uma fonte de odor a 2 cm do piso da arena de odor. A cabeça do sensor do PID fornece um sinal de tensão para a concentração de gás da pluma de odor. (B) Gravação a laser da pluma de odor com fluxo ilimitado a 20 cm / s. Clique aqui para ver uma versão maior desta figura.

Figura 6: Treinamento comportamental do camundongo. (A) Rato aprendendo a navegar em direção a uma pluma de odor liberada na faixa da direita. O rato aprende a iniciar um teste indo para a parte de trás da arena de odores, decide um lado para navegar em direção à pluma de odores e bebe uma recompensa de água. (B) Rato aprendendo a navegar em direção a uma pluma de odor liberada na faixa da esquerda. O rato é recompensado com odor se navegar para a pista correta. Clique aqui para ver uma versão maior desta figura.
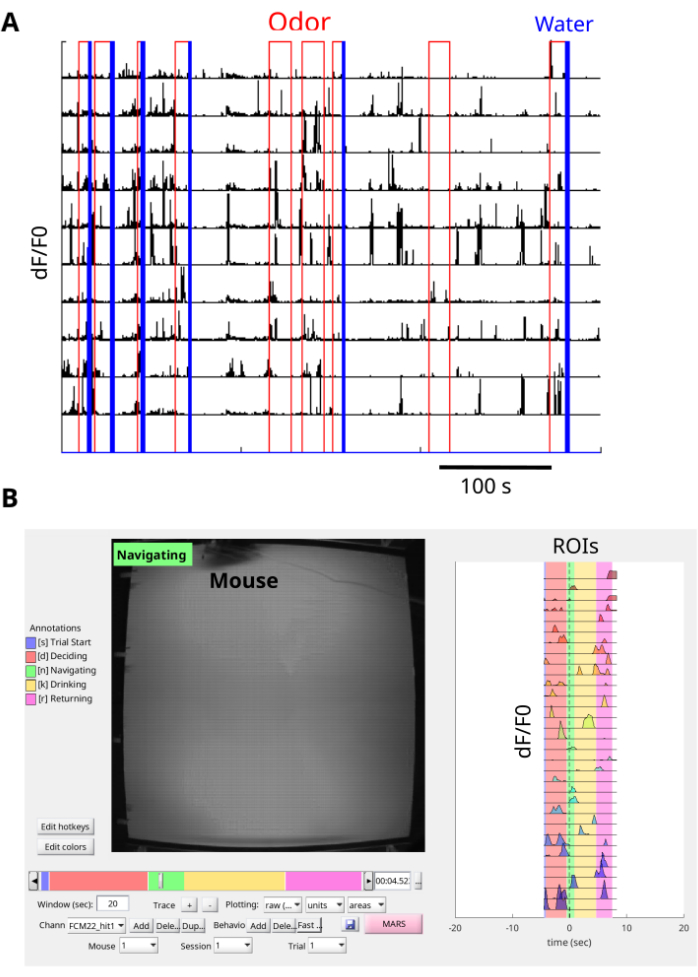
Figura 7: Pré-processamento dos dados. (A) Traços de cálcio sincronizados com os eventos da arena de odor para muitos ensaios. Cada teste começa com a entrega de odor em vermelho, e os testes recompensados terminam com um pulso de entrega de água em azul. Os traços de cálcio δF/F0 (sem unidade) para cada ROI são mostrados em preto. Cada linha indica um ROI. Uma placa de interface é usada para gravar as saídas TTL da câmera superior na arena de odor e a câmera miniscope para sincronizar os quadros. NorMCorre é usado para corrigir o ruído de movimento dos quadros do miniscópio e EXTRACT é usado para encontrar as ROIs e extrair os traços de cálcio δF/F0. (B) Ensaio único representativo de um rato navegando em uma pluma. A visualização simultânea do comportamento sincronizado (painel esquerdo) e traços de cálcio δF/F0 (painel direito) de cada ROI de um único ensaio é observada com o BENTO. Clique aqui para ver uma versão maior desta figura.

Figura 8. Decodificando a posição do mouse a partir dos sinais CA1. Decodificando a posição X e Y do mouse a partir das ROIs CA1. A previsão de decodificação é mostrada em azul e a posição verdadeira do solo do mouse é mostrada em vermelho. Os traços previstos estão fortemente correlacionados com a verdade fundamental. (A) Decodificando as posições X das ROIs (Coeficiente de Correlação de Pearson = 0,88). (B) Decodificando as posições Y das ROIs (Coeficiente de Correlação de Pearson = 0,88). Clique aqui para ver uma versão maior desta figura.
Filme Suplementar 1: Exemplo representativo de quadros comportamentais e de miniscópio sincronizados de um mouse navegando em direção a uma pluma de odor na faixa da esquerda. (A) Quadros comportamentais de um camundongo usando um miniscópio e navegando dentro da arena de odor. (B) Quadros de miniscópio do camundongo mostrando os transientes de cálcio bruto registrados através da lente GRIN. Por favor, clique aqui para baixar este filme.
Filme Suplementar 2: Exemplo representativo de quadros comportamentais e de miniscópio sincronizados de um rato navegando em direção a uma pluma de odor na faixa da direita. (A) Quadros comportamentais de um camundongo usando um miniscópio e navegando dentro da arena de odor. (B) Quadros de miniscópio do camundongo mostrando os transientes de cálcio bruto registrados através da lente GRIN. Por favor, clique aqui para baixar este filme.
Filme Suplementar 3: Exibição BENTO dos dados processados do comportamento do rato e sinais cerebrais. Painel esquerdo: o mouse está navegando em direção à faixa da direita na arena. As anotações de comportamento são mostradas em cores diferentes. Painel direito: sinais de cálcio δF / F0 do mouse navegando. Por favor, clique aqui para baixar este filme.
Arquivo Suplementar 1: NoseconeRender.png. Arquivo para o cone do nariz impresso em 3D para realizar anestesia com isoflurano. Clique aqui para baixar este arquivo.
Arquivo Suplementar 2: HeadbarRender.png. Arquivo para a barra de cabeça para fixar a cabeça do mouse. Clique aqui para baixar este arquivo.
Arquivo Suplementar 3: HeadbarTechnicalDrawing.png. Arquivo para a barra de cabeça para fixar a cabeça do mouse. Clique aqui para baixar este arquivo.
Arquivo Suplementar 4: ArenaFig_Draft2.tiff. Layout detalhado da arena de odor. Clique aqui para baixar este arquivo.
Discussão
Este protocolo descreve meticulosamente as etapas para registrar células de lugar e células responsivas a odores na área dCA1 do hipocampo de camundongos navegando em uma pluma de odor. As etapas críticas do protocolo incluem cirurgia estereotáxica, colocação da placa de base do miniscópio, construção da área de odor, verificação da pluma na arena de odor, treinamento comportamental, gravação do miniscópio do mouse em movimento livre, pré-processamento de dados e análise de dados. Além disso, o protocolo explica o processo de decodificação da trajetória do camundongo a partir das gravações do dCA1.
Um passo crítico na cirurgia estereotáxica é seguir as coordenadas relativas ao bregma para colocar a lente GRIN no local correto. Uma limitação do método é o atraso entre a cirurgia e o tempo para começar a observar os sinais GCaMP6f, que pode levar de 2 a 4 semanas. O mouse deve estar pronto para uso após esse período crítico. Uma diferença entre o protocolo atual e os protocolos anteriores 24,25,26,27 é usar camundongos Thy1-GCaMP6f que já expressam GCaMP6f em CA1 em vez de injetar o vírus AAV-GCaMP6f no hipocampo. Economiza tempo durante a cirurgia e não requer tempo de espera para a expressão do vírus AAV no cérebro. Além disso, esse protocolo não aspira o cérebro e utiliza isoflurano em vez de cetamina/xilazina, o que proporciona um melhor controle da dose para evitar overdoses. Uma limitação do método é a aberração óptica da lente GRIN, que limita o campo de visão. Um passo crucial para a colocação da placa de base é manter a lente eletroumectante no centro para evitar uma limitação no ajuste da placa Z após cimentar a placa de base na cabeça. Uma limitação da construção da arena de odores é a complexidade do sistema, que pode levar vários meses e pode exigir a assistência de um engenheiro. Uma limitação do treinamento comportamental é que os ratos podem preferir um lado da arena de odor contra o outro. Uma maneira de superar esse problema é alternar os testes recompensando o mouse por navegar em direção às pistas esquerda e direita.
Uma etapa crítica para verificar a pluma é manter a agulha PID alinhada com a fonte de odor para detectar o caminho da pluma. Uma etapa crucial na gravação de um mouse em movimento livre é garantir que o fio mini-coaxial não se emaranha durante a tarefa, o que pode ser evitado com um comutador. Balões de hélio podem ser usados para evitar que o fio mini-coaxial fique na frente do mouse. É fundamental para o pré-processamento de dados sincronizar os pulsos TTL da câmera digital superior da arena de odor e da câmera miniscópio. Para o procedimento EXTRACT, recomenda-se o uso de processamento não negativo para extrair melhor os sinais ROIs e δF/F0. EXTRACT produz uma inspeção visual dos traços de cada ROI para excluir os ruins. É fundamental decodificar as posições X e Y do mouse a partir das ROIs para ter um grande conjunto de dados com centenas de épocas para melhor treinar a rede neural artificial.
A importância deste método de gravação em movimento livre em relação aos métodos de fixação de cabeça existentes é estudar o comportamento do camundongo em um contexto etologicamente relevante com o movimento adequado da cabeça para navegar em uma pluma de odor complexa. Este método é aplicável para investigar o papel dinâmico dos neurônios dCA1 na navegação complexa de odores. Além disso, o procedimento não se restringe ao hipocampo ou ao olfato. Outras aplicações potenciais da técnica incluem o estudo do papel de diferentes áreas cerebrais e modalidades sensoriais, incluindo possíveis aplicações na navegação visual usando LEDs para indicar as faixas recompensadas. Além disso, esse método pode ser potencialmente aplicado em experimentos de circuito fechado em tempo real, nos quais a decodificação do cálcio neural da população desencadeia neuroestimulação ou feedback sensorial 20,34,35,36.
Divulgações
Os autores declaram não haver conflito de interesses.
Agradecimentos
Esta pesquisa foi apoiada pelos Institutos Nacionais de Saúde dos EUA (NIH UF1 NS116241 e NIH R01 DC000566) e pela National Science Foundation (NSF BCS-1926676). Os autores agradecem a Andrew Scallon por ajudar a montar a câmara Odor Arena.
Materiais
| Name | Company | Catalog Number | Comments |
| Arduino Micro | Arduino | Micro | |
| Biocompatible Methacrylate Resin | Parkell | S380 | C&B-Metabond Adhesive Luting Cement |
| Decoding Brain Signals Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Dental Drill | Osada | LHP-6 | AZ210015 |
| Dental Drill Box | Osada | XL-230 | 30000 rotations per minute |
| Digital stereotaxic instrument | Stoelting | 51730D | Mouse Stereotaxic Instument, #51904 Digital Manipulator Arm, 3-Axes, Add-On, LEFT |
| Drill Bit | FST Fine Science Tools | 19007-05 | Tip diameter 0.5 mm |
| Fast Digital Camera | Edmund Optics | BFS-U3-63S4C | FLIR Blackfly S |
| Focal Lens | Edmund Optics | C-Series | 3.5 mm |
| GRIN lens | Inscopix | 1050-004595 | 1 mm diameter and 4 mm length |
| GRIN lens Holder | UCLA | http://miniscope.org/index.php/Surgery_Protocol | |
| Liquid Tissue Adhesive | 3M | 1469C | Vetbond Tissue Adhesive |
| Low-Flow Anesthesia System for Mice | Kent Scientific Corporation | SomnoSuite | https://www.kentscientific.com/products/somnosuite/ |
| Low Toxicity Silicone Adhesive | WPI – World Precision Instruments | Kwik-sil | |
| miniPID Controller | ASI – Aurora Scientific Inc. | Model 200B | Fast-Response Miniature Photo-Ionization Detector |
| Miniscope V4 Holder | UCLA | NA | https://github.com/Aharoni-Lab/Miniscope-v4/tree/master/Miniscope-v4-Holder |
| Miniscope V4 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4 |
| Miniscope Base Plate V2 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4-base-plates-variant-2-pack-of-10 |
| Miniscope DAQ-QT software | UCLA | https://github.com/Aharoni-Lab/Miniscope-DAQ-QT-Software/wiki | |
| Motion Correction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Odor Arena Hardware | Custom Made | 3D Model | https://www.dropbox.com/scl/fo/lwtpqysnpzis32mhrx3cd/ADomsxyhxu42sqDmTBl2O6k?rlkey=b3l4809eradundt5l3iz0gq74& dl=0 |
| Odor Arena Software | CUAnschutz | https://github.com/wryanw/odorarena | |
| Odorant Isoamyl Acetate | Aldrich Chemical Co | 06422AX | Diluted at 1% in odorless mineral oil |
| RHD USB Interface Board | Intan Technologies | C3100 | Product discontinued. Alternatively use another equivalent board. |
| ROI Extraction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Sutter Micromanipulator | Sutter Instrument Company | MP-285 | |
| Synchronization Software | CU Anschutz | https://github.com/fsimoesdesouza/Synchronization | |
| Thy1-GCaMP6f mice | Jackson Laboratory | IMSR_JAX 028281 | C57BL/6J-Tg(Thy1-GCaMP6f)GP5.12Dkim/J) |
Referências
- Adoff, M. D., Climer, J. R., Davoudi, H., Marvin, J. S., Looger, L. L., Dombeck, D. A. The functional organization of excitatory synaptic input to place cells. Nat Commun. 12 (1), 3558(2021).
- Radvansky, B. A., Oh, J. Y., Climer, J. R., Dombeck, D. A. Behavior determines the hippocampal spatial mapping of a multisensory environment. Cell Rep. 36 (5), 109444(2021).
- Lewis, S. M., et al. Plume dynamics structure the spatiotemporal activity of mitral/tufted cell networks in the mouse olfactory bulb. Front Cell Neurosci. 15, 633757(2021).
- Findley, T. M., et al. Sniff-synchronized, gradient-guided olfactory search by freely moving mice. ELife. 10, e58523(2021).
- Gire, D. H., Kapoor, V., Arrighi-Allisan, A., Seminara, A., Murthy, V. N. Mice develop efficient strategies for foraging and navigation using complex natural stimuli. Curr Biol. 26 (10), 1261-1273 (2016).
- Liu, A., Papale, A. E., Hengenius, J., Patel, K., Ermentrout, B., Urban, N. N. Mouse navigation strategies for odor source localization. Front Neurosci. 14, 218(2020).
- Tariq, M. F., et al. Using head-mounted ethanol sensors to monitor olfactory information and determine behavioral changes associated with ethanol-plume contact during mouse odor-guided navigation. eNeuro. 8 (1), (2021).
- Rigolli, N., Reddy, G., Seminara, A., Vergassola, M. Alternation emerges as a multi-modal strategy for turbulent odor navigation. ELife. (11), e76989(2022).
- Ma, M., et al. Sequential activity of CA1 hippocampal cells constitutes a temporal memory map for associative learning in mice. Curr Biol. 34 (4), 841-854 (2024).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nat Methods. 16 (1), 11-13 (2019).
- Aharoni, D., Hoogland, T. M. Circuit investigations with open-source miniaturized microscopes: Past, present and future. Front Cell Neurosci. 13, 141(2019).
- Flusberg, B. A., et al. High-speed, miniaturized fluorescence microscopy in freely moving mice. Nat Methods. 5 (11), 935-938 (2008).
- Connor, E. G., McHugh, M. K., Crimaldi, J. P. Quantification of airborne odor plumes using planar laser-induced fluorescence. Exp Fluids. 59 (9), 137(2018).
- Gumaste, A., et al. A Comparison between mouse, in silico, and robot odor plume navigation reveals advantages of mouse odor tracking. eNeuro. 7 (1), (2020).
- Gumaste, A., et al. Behavioral discrimination and olfactory bulb encoding of odor plume intermittency. ELife. 13, e85303(2024).
- Marin, A. C., Schaefer, A. T., Ackels, T. Spatial information from the odour environment in mammalian olfaction. Cell Tissue Res. 383 (1), 473-483 (2021).
- Eichenbaum, H. The role of the hippocampus in navigation is memory. J Neurophysiol. 117 (4), 1785-1796 (2017).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13 (11), 1433-1440 (2010).
- Wirtshafter, H. S., Disterhoft, J. F. In vivo multi-day calcium imaging of CA1 hippocampus in freely moving rats reveals a high preponderance of place cells with consistent place fields. J Neurosci. 42 (22), 4538-4554 (2022).
- Mizuta, K., Sato, M. Multiphoton imaging of hippocampal neural circuits: techniques and biological insights into region-, cell-type-, and pathway-specific functions. Neurophotonics. 11 (3), 033406(2024).
- Radvansky, B. A., Dombeck, D. A. An olfactory virtual reality system for mice. Nat Commun. 9 (1), 839(2018).
- Almeida-Santos, A. F., et al. Social isolation impairs the persistence of social recognition memory by disturbing the glutamatergic tonus and the olfactory bulb-dorsal hippocampus coupling. Sci Rep. 9 (1), 473(2019).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), e108697(2014).
- Thapa, R., Liang, B., Liu, R., Li, Y. Stereotaxic viral injection and gradient-index lens implantation for deep brain in vivo calcium imaging. J Vis Exp. (176), e63049(2021).
- Hsiao, Y. -T., Wang, A. Y. -C., Lee, T. -Y., Chang, C. -Y. Using baseplating and a miniscope preanchored with an objective lens for calcium transient research in mice. J Vis Exp. (172), e62611(2021).
- Zhang, L., et al. Miniscope GRIN lens system for calcium imaging of neuronal activity from deep brain structures in behaving animals. Curr Protoc Neurosci. 86 (1), e56(2019).
- Guo, D., Gürkan Özer, A., Uusisaari, M. Y. In vivo calcium imaging in mouse inferior olive. J Vis Exp. (172), e62222(2021).
- Yun, M., Shin, J., Jung, M. W. Protocol for calcium imaging of dorsal and ventral CA1 neurons in head-fixed mice. STAR Protoc. 4 (3), 102439(2023).
- Yun, M., Hwang, J. Y., Jung, M. W. Septotemporal variations in hippocampal value and outcome processing. Cell Rep. 42 (2), 112094(2023).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. J Neurosci Methods. 291, 83-94 (2017).
- Inan, H., et al. Fast and statistically robust cell extraction from large-scale neural calcium imaging datasets. bioRxiv. , (2021).
- Segalin, C., et al. The mouse action recognition system (MARS) software pipeline for automated analysis of social behaviors in mice. ELife. 10, e63720(2021).
- Chen, Z., et al. A hardware system for real-time decoding of in vivo calcium imaging data. ELife. (12), e78344(2023).
- Xue, F., et al. Multi-region calcium imaging in freely behaving mice with ultra-compact head-mounted fluorescence microscopes. Natl Sci Rev. 11 (1), nwad294(2024).
- Tabourin, L., Bretzner, F., Galstian, T. Towards a mini-endoscope design with spatially selective excitation and imaging. Biomed Opt Express. 15 (3), 1750-1760 (2024).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados