Method Article
Miniscopio che registra i segnali di calcio nell'ippocampo dei topi che navigano in un pennacchio di odori
In questo articolo
Riepilogo
Questo protocollo studia la relazione cervello-comportamento nel CA1 ippocampale nei topi che navigano in un pennacchio di odore. Forniamo un protocollo passo-passo, che include la chirurgia per accedere all'imaging dell'ippocampo, l'allenamento comportamentale, la registrazione e l'elaborazione del cervello con miniscopio GCaMP6f e i dati comportamentali per decodificare la posizione del mouse dall'attività neurale ROI.
Abstract
I topi navigano in un pennacchio di odori con una complessa struttura spazio-temporale al buio per trovare la fonte degli odori. Questo articolo descrive un protocollo per monitorare il comportamento e registrare i transitori di Ca2+ nei neuroni piramidali dello strato dorsale CA1 nell'ippocampo (dCA1) nei topi che navigano in un pennacchio di odori in un'arena di odori di 50 cm x 50 cm x 25 cm. Un miniscopio per epifluorescenza focalizzato attraverso una lente con indice di gradiente (GRIN) ha ripreso i transienti Ca2+ nei neuroni dCA1 che esprimono il sensore di calcio GCaMP6f nei topi Thy1-GCaMP6f. Il documento descrive il protocollo comportamentale per addestrare i topi a eseguire questo compito di navigazione del pennacchio di odori in un'arena automatizzata per gli odori. I metodi includono una procedura passo-passo per l'intervento chirurgico per l'impianto di lenti GRIN e il posizionamento della piastra di base per l'imaging GCaMP6f in CA1. L'articolo fornisce informazioni sul tracciamento in tempo reale della posizione del mouse per automatizzare l'inizio delle prove e la consegna di una ricompensa in acqua. Inoltre, il protocollo include informazioni sull'utilizzo di una scheda di interfaccia per sincronizzare i metadati che descrivono l'automazione dell'attività di navigazione degli odori e i tempi di fotogramma per il miniscopio e la posizione del mouse di tracciamento della fotocamera digitale. Inoltre, i metodi delineano la pipeline utilizzata per elaborare i film di fluorescenza GCaMP6f mediante correzione del movimento utilizzando l'algoritmo NorMCorre seguito dall'identificazione delle regioni di interesse con EXTRACT. Infine, l'articolo descrive un approccio di rete neurale artificiale per decodificare i percorsi spaziali dall'attività dell'insieme neurale CA1 per prevedere la navigazione del mouse del pennacchio di odore.
Introduzione
Sebbene siano stati compiuti progressi significativi nella comprensione dei circuiti neurali coinvolti nella navigazione olfattiva nei topi con testa fissa 1,2,3 e nelle strategie di navigazione nei topi in movimento libero 4,5,6,7,8, il ruolo dei circuiti neurali nella navigazione in movimento libero etologicamente rilevante di pennacchi di odori turbolenti è ancora sconosciuto. Questo articolo descrive il monitoraggio dell'attività neurale mediante l'imaging di transitori di Ca2+ in cellule che esprimono il sensore di calcio geneticamente codificato GCaMP6f nei topi Thy1-GCaMP6f9 per studiare se la dinamica neurale sequenziale dei neuroni piramidali dello strato dorsale CA1 nell'ippocampo (dCA1) svolge un ruolo nella navigazione del pennacchio odoroso. I metodi forniscono informazioni sulla fluorescenza GCaMP6f attraverso un microscopio a epifluorescenza in miniatura focalizzato attraverso una lente GRIN su dCA1 10,11,12. I metodi spiegano come monitorare simultaneamente la navigazione spaziale e i transienti di calcio GCaMP6f del neurone dCA1 nei topi che eseguono un compito di navigazione del pennacchio di odori in cui hanno ricevuto una ricompensa in acqua quando hanno raggiunto il beccuccio erogando un odorante in un'arena di odori con un flusso d'aria laminare di fondo13,14. Questo articolo descrive i metodi necessari per raggiungere questo obiettivo (Figura 1), tra cui la chirurgia stereotassica per l'impianto di lenti con indice di gradiente (GRIN), il posizionamento di una piastra di base per fissare il miniscopio al cranio in un topo che si muove liberamente, l'imaging con il microscopio in miniatura e il monitoraggio del movimento del mouse con una fotocamera digitale ad alta velocità, la pre-elaborazione dei dati per la rimozione di artefatti di movimento e la ricerca delle regioni di interesse (ROI), e preparazione di set di dati e addestramento e previsione di reti neurali artificiali per la decodifica delle posizioni X e Y del topo nell'arena degli odori dai cambiamenti nella fluorescenza nelle ROI dCA17.
La registrazione con miniscopio dei segnali di calcio nella regione CA1 dell'ippocampo di topi che navigano in un pennacchio di odori è rilevante per comprendere il calcolo dei circuiti neurali coinvolti con l'olfatto e le informazioni spaziali nel complesso compito comportamentale della navigazione odore-pennacchio 2,14,15,16. La regione CA1 dell'ippocampo svolge un ruolo nella navigazione spaziale ed è fondamentale per creare una mappa cognitiva dell'ambiente per una navigazione efficiente 17,18. La registrazione dei segnali di calcio con un miniscopio è un modo prezioso per studiare i neuroni CA1 che codificano le informazioni spaziali durante la navigazione del pennacchio di odore.
Questa tecnica combina i vantaggi della tecnologia miniscope per la registrazione dei segnali di calcio GCaMP con il ruolo ben consolidato dell'ippocampo CA1 nella navigazione spaziale per comprendere meglio come i circuiti neurali guidano comportamenti complessi19. In alternativa, gli approcci che utilizzano la microscopia a 2 fotoni possono registrare i neuroni CA1 9,20, che richiede un topo fissato alla testa e limita la possibilità di muoversi liberamente per navigare in un pennacchio di odore21. Le registrazioni elettrofisiologiche a campo locale dei neuroni CA1 consentono l'indagine di topi che si muovono liberamente navigando nei pennacchi di odore22. Tuttavia, i segnali elettrici di campo locale impongono limitazioni alla stima dell'attivazione intracellulare isolando i segnali di singole unità attraverso tecniche di ordinamento degli spike. I segnali miniscope consentono l'identificazione delle ROI associate direttamente ai segnali intracellulari del calcio in modo affidabile10,11 per studiare con precisione i calcoli neurali alla risoluzione di una singola cellula. La tecnologia Miniscope offre un'opportunità unica per comprendere meglio come la regione CA1 codifica le informazioni spaziali in base ai segnali olfattivi.
Inoltre, questa tecnica studia il modo in cui specifiche popolazioni neuronali elaborano le informazioni sugli odori per la navigazione e la relazione tra i modelli di attività neuronale e il processo decisionale durante il tracciamento del pennacchio di odore. Questo metodo può contribuire a una migliore comprensione di come il cervello elabora gli odori e le informazioni spaziali. Sebbene i miniscopi offrano una risoluzione a singola cellula per registrare il cervello di un topo che si muove liberamente, richiedono competenze chirurgiche specializzate e di analisi dei dati. In questo articolo, forniamo un protocollo completo per aiutare i ricercatori a passare attraverso ogni fase per studiare i meccanismi neurali della navigazione del pennacchio di odore.
L'attività di navigazione degli odori è un quadro promettente per lo studio della codifica neurale e della memoria spaziale dei segnali olfattivi nei topi. I risultati dell'articolo indicano che è possibile decodificare la traiettoria del topo che naviga in un pennacchio di odori sulla base dei segnali di calcio dell'ensemble neuronale in dCA1. Comprendere il ruolo dei segnali di calcio dCA1 nella navigazione dei pennacchi di odori è un passo cruciale per decifrare le basi del circuito neurale per la navigazione guidata dagli odori in ambienti realistici13,14.
Protocollo
Gli studi sono stati condotti su topi transgenici maschi e femmine di 3-6 mesi di Thy1-GCaMP6f23. Tutti i protocolli sperimentali sono stati approvati dall'Institutional Animal Care and Use Committee dell'Università del Colorado Anschutz Medical Campus in conformità con le linee guida del National Institutes of Health. Le procedure chirurgiche per l'impianto della lente GRIN (Sezione 1) e il posizionamento della piastra di base (Sezione 2) sono state adattate dai lavori precedenti 9,24,25,26,27,28,29.
1. Chirurgia stereotassica per l'impianto di una lente GRIN nell'ippocampo
- Indossare guanti sterili, un copricapo, una maschera chirurgica e un camice da laboratorio.
- Utilizzare condizioni sterili durante tutti gli interventi chirurgici di sopravvivenza. Sterilizzare tutte le apparecchiature chirurgiche in autoclave.
- Posizionare teli sterili intorno all'area chirurgica.
- Anestetizzare il topo posizionandolo nella camera di induzione con isoflurano al 3% per 10 minuti. Iniettare la base di buprenorfina in polimero a 0,001 mg/g per via sottocutanea al momento dell'induzione dell'anestetico.
- Controlla se il topo smette di muoversi ed è in anestesia profonda, confermato pizzicando la zampa posteriore per testare il riflesso della zampa posteriore.
- Commutare il flusso di isoflurano al cono del naso (File supplementare 1).
- Assicurarsi che il sistema di anestesia con isoflurano a basso flusso per topi (Tabella dei materiali) abbia il pad della temperatura impostato sulle impostazioni omeotermiche e assicurarsi che la fonte di vapore sia impostata su compressa esternamente.
- Posizionare il topo anestetizzato nello strumento stereotassico digitale (Tabella dei materiali). Posizionare i denti anteriori del topo nella barra del morso e posizionare il cono del naso davanti al naso per garantire il flusso di isoflurano e bloccare la testa in posizione. Regolare il livello di anestesia tra il 2% e il 3% in base al riflesso della zampa dopo aver pizzicato (Figura 2A).
- Posiziona le barre auricolari del mouse nelle orecchie e stringile. Assicurati che la testa del mouse sia orizzontale e non si muova da un lato all'altro o su e giù. Quando la testa è fissata, assicurarsi che una leggera pressione verso il basso sul cranio non provochi lo scivolamento sotto le sbarre.
- Posizionare la sonda di temperatura nel retto e fissare il filo sulla coda del topo per evitare movimenti. Impostare la temperatura dell'elettrodo per mantenere la temperatura rettale a 37 °C.
- Aggiungi un unguento oftalmico agli occhi per prevenire la dannosa secchezza dell'aria.
- Radere i peli quando la testa è fissa e sotto il flusso di isoflurano fornito dal cono del naso per impedirne il movimento. Radere i peli sopra la testa con un rasoio elettrico, quindi rimuovere i peli rimanenti con un depilatore e applicatori sterili in legno con punta in cotone (Figura 2B).
- Rendere sterile il campo operatorio tamponando il cuoio capelluto con un applicatore sterile in legno con punta in cotone con etanolo e betadina tre volte ciascuno.
- Iniettare 0,1 ml di lidocaina anestetico locale per via sottocutanea (S.Q.) sotto la pelle tra gli occhi e le orecchie con un ago da 29 G. Questo creerà una bolla. Attendere qualche minuto prima di tagliare la pelle con le forbici.
- Usando una tecnica di sole punte, tira la pelle verso l'alto con cautela usando una pinza e usa un paio di piccole forbici per rimuovere una parte circolare della pelle. Assorbire il sangue con un batuffolo di cotone sterile.
- Una volta che l'emorragia si ferma, pulire il cranio con perossido di idrogeno (5%) utilizzando un batuffolo di cotone sterile. Assicurarsi che i punti di riferimento ossei, compresa la sutura sagittale e l'intersezione della sutura bregmatica per contrassegnare il bregma, siano facili da identificare dopo questa procedura.
- Confermare che il cranio sia piatto rispetto all'apparato stereotassico assicurandosi che le suture bregma e lambda siano esattamente alla stessa coordinata Z. A tale scopo, posizionare un ago nel braccio del manipolatore e verificare se la punta di un ago si trova alla stessa coordinata Z quando si toccano entrambe le suture. In caso contrario, regolare l'angolazione della testa spostando la barra del morso nella piastra Z e ripetendo la procedura fino a quando l'abilità non è in posizione piatta.
- Collegare una pipetta al micromanipolatore tenendo un ago per applicare l'inchiostro del tatuaggio. Fai un segno sulla parte superiore del bregma.
- Azzerare le coordinate del micromanipolatore su bregma e spostarsi alla coordinata sopra CA1 nell'ippocampo destro (medio-laterale +1,8 mm da bregma, antero-posteriore -2,4 mm da bregma)2. Questo è il luogo scelto da Radvansky e Dombeck per studiare la navigazione virtuale del gradiente di odore nei topi18,30. Praticare con cautela una piccola ammaccatura permanente di 1 mm di diametro con un trapano (Tabella dei materiali) a 10000 rotazioni per fare un'ammaccatura permanente sulla parte superiore della posizione target (Figura 2C).
- Utilizzare il trapano dentale per aprire una perforazione circolare di 1,5 mm di diametro per consentire l'impianto di una lente GRIN di 1 mm di diametro e 4 mm di lunghezza nel cervello (Tabella dei materiali) (Figura 2D).
- Perforare la dura madre e la corteccia inserendo un ago da 23 G al centro del foro e spostando l'ago nel cervello lentamente (~0,1 mm/min) fino a raggiungere la profondità di 1,25 mm al di sotto della dura dura. Rimuovere lentamente l'ago dal cervello (~0,1 mm/min). Utilizzare tamponi di cotone sterili e soluzione salina per pulire il sangue.
- Utilizzare un supporto per lenti GRIN UCLA su misura costruito con due puntali per micropipette da 1 ml tagliati per adattarsi l'uno all'altro (supporto per lenti GRIN, Tabella dei materiali) (Figura 2E, F).
- Collegare il supporto della lente GRIN al micromanipolatore e accendere l'aspiratore collegato alla pipetta per tenere la lente GRIN. La pressione dell'aria prodotta dall'aspirazione dell'aria mantiene la lente GRIN in posizione.
- Utilizzare una lente GRIN di 4 mm di lunghezza e 1 mm di diametro. Impiantare lentamente la lente GRIN nella corteccia fino a raggiungere una profondità di -1,25 mm al di sotto della dura dura.
- Posizionare una goccia di adesivo in tessuto liquido (Tabella dei materiali) nella perforazione circolare del cranio per sigillare il foro. Attendere qualche minuto per asciugare.
- Preparare il cemento adesivo rapido -resina metacrilata biocompatibile- (Tabella dei Materiali) sulla base della lente GRIN per sigillarla definitivamente sul cranio. Aspettate qualche minuto e lasciate asciugare.
- Spegnere l'aspiratore per sganciarlo e rimuovere lentamente il portalenti GRIN dalla parte superiore della lente GRIN che a questo punto è fissata in modo permanente al cranio.
- Posizionare la barra per la testa sulla parte superiore del cranio, centrando il foro sulla lente GRIN (Figura 2G-I) (File supplementare 2 e File supplementare 3).
- Posizionare con cura il cemento adesivo ad asciugatura rapida (Tabella dei materiali) attorno alla base della lente GRIN per sigillare la finestra cranica e fissare la barra della testa al cranio. Posizionare il cemento adesivo essiccante (Tabella dei materiali) al centro della barra della testa e sui lati per tenerlo saldamente fissato al cranio. Assicurati che sia completamente asciutto. Assicurarsi che non sia posizionato cemento adesivo sopra la lente GRIN; In caso contrario, degraderà in modo permanente il percorso ottico e bloccherà l'immagine.
- Posizionare una goccia di adesivo siliconico a bassa tossicità (Tabella dei materiali) sopra la lente GRIN per proteggerla da danni fisici.
- Disattivare l'isoflurano
- Effettuare un monitoraggio post-operatorio immediato fino a quando l'animale non si sveglia dall'anestesia.
- Prenditi cura post-operatoria fino al completo recupero dall'intervento chirurgico monitorando i topi per segni di dolore. Non restituire l'animale che ha subito un intervento chirurgico in compagnia di altri animali.
- Osservare brevemente il movimento intorno alla gabbia, mangiare e bere e le normali reazioni alla manipolazione per assicurarsi che non siano sotto dolore o stress.
- Se gli animali mostrano segni di gravi danni neurologici o tissutali, sopprimerli immediatamente con mezzi umani.
2. Posizionamento della piastra di base per il miniscopio
NOTA: Le procedure per il fissaggio della testa del topo iniziano 2 settimane dopo che l'animale si è completamente ripreso dall'intervento chirurgico. La procedura per l'imaging dCA1 inizia 3 settimane dopo l'intervento chirurgico, dopo che l'animale si è completamente ripreso e il segnale GCaMP6f diventa fortemente visibile. Una piastra di base è fissata sulla parte superiore della lente GRIN per l'accesso ottico della fluorescenza dCA1 GCaMP6f attraverso la lente GRIN utilizzando un miniscopio. Questo protocollo utilizzava il miniscopio versione 4 -V4 (Miniscope V4; Tabella dei materiali).
- Iniziare a fissare la testa del mouse per 10 minuti fissando la barra della testa con morsetti a pinza per acclimatare il mouse a essere fissato alla testa 2 settimane dopo l'intervento chirurgico.
- Fissare la testa del mouse 3 settimane dopo l'intervento chirurgico per il posizionamento della piastra di base.
- Collegare un miniscopio a un supporto stampato in 3D collegato a un micromanipolatore (tabella dei materiali) collegato a un micromanipolatore (Figura 3A, B).
- Rimuovere con cautela l'adesivo siliconico (Tabella dei materiali) dalla parte superiore della lente utilizzando una pinzetta fine e pulire la superficie della lente GRIN utilizzando un panno per lenti.
- Fissare la piastra di base fissata al miniscopio serrando la vite di fermo sul lato della piastra di base (Tabella dei materiali) (Figura 3C, D).
- Spostare l'estremità del miniscopio fino a raggiungere 100 μm sopra la lente GRIN.
- Utilizzare i cursori per configurare le impostazioni del miniscopio nel software del miniscopio (Tabella dei materiali) seguendo i passaggi da 2.8 a 2.10.
- Fare clic sul dispositivo di scorrimento Potenza nel software per controllare la potenza e mantenerla intorno al 10%.
- Fare clic sul cursore Velocità di acquisizione e mantenerlo intorno ai 10 Hz.
- Il miniscopio v4 è dotato di una lente per elettrobagnatura che può essere utilizzata per la messa a fuoco fine. Fare clic sul cursore Messa a fuoco per impostarlo al 50% per mantenere la lente di elettrobagnatura al centro della gamma focale.
- Utilizzare il software per visualizzare la parte superiore della lente GRIN. È possibile vedere la forma circolare della lente GRIN sullo schermo.
- Avvicinare il miniscopio alla lente GRIN regolando la posizione assiale con il micromanipolatore e monitorare l'immagine con il computer.
- Una volta che la parte superiore della lente GRIN è visibile, utilizzare la messa a fuoco fine su e giù sul micromanipolatore per raggiungere il miglior piano focale per visualizzare i lampi delle cellule. Utilizzare l'impostazione pseudo δF/F0 nel software per ricontrollare la qualità dei lampeggi della cella.
- Impostare la messa a fuoco in modo da consentire il numero massimo di cellule nel campo visivo con la massima intensità di fluorescenza raggiungibile. A questo punto, assicurati che i vasi sanguigni siano a fuoco.
- Può succedere che un topo non abbia segnali transitori di calcio. In questo caso, evitare i passaggi successivi (14-16) e verificare nuovamente il mouse nelle settimane successive per ricontrollare se si verificano i segnali transitori del calcio.
NOTA: Si può decidere di sopprimere il topo se i segnali transitori del calcio non si verificano mai 2 mesi dopo l'intervento chirurgico. - Una volta ottimizzata la messa a fuoco, costruisci con cura un muro di cemento adesivo rapido tra il cranio e la parte inferiore della piastra di base. Fare attenzione a non cementare il miniscopio sulla piastra di base e fare molta attenzione a non far cadere del cemento sulla parte superiore della lente GRIN.
- Una volta che il cemento è asciutto, rimuovere la vite di fermo e rimuovere con cautela il miniscopio dalla piastra di base con il micromanipolatore.
- Utilizzare il coperchio della piastra di base per proteggere la lente GRIN.
3. Costruzione dell'arena degli odori
NOTA: Questo metodo delinea un'arena automatizzata degli odori basata sul design di Connor et al.13 e Gumaste et al.14. L'assemblaggio completo può essere trovato nel link fornito nella Tabella dei materiali (File supplementare 4).
- Costruire una camera di dimensioni 50 cm (L) x 50 cm (L) x 25 cm (A) con 2 pareti in acrilico, un soffitto in acrilico, un pavimento in cloruro di polivinile espanso bianco (PVC) e 2 pareti uniche nella parte anteriore e posteriore che facilitano il flusso d'aria (Figura 4A).
- Installa un'estremità di aspirazione dell'aria nella parte posteriore dell'arena con un design affusolato e una ventola del computer collegata per aspirare l'aria dalla camera. Utilizzare una manopola fisica per impostare la modulazione dell'ampiezza dell'impulso della ventola (PWM) per regolare la velocità del flusso d'aria.
NOTA: Una struttura a nido d'ape stampata in 3D comprende pareti per la parte anteriore e posteriore dell'arena degli odori per facilitare il flusso laminare dell'aria mantenendo un topo all'interno10. La parete a nido d'ape nella parte anteriore dell'arena ha una svasatura esterna per ricevere grandi volumi d'aria in modo non disturbante. - Imposta un sistema di erogazione dell'acqua per erogare la ricompensa dell'acqua tramite semplici aggeggi con un motore passo-passo Nema 17 accoppiato a una siringa. Un driver a micropassi A4988 consente un controllo preciso del volume erogato (https://github.com/dougollerenshaw/syringe_pump, Figura 4B).
- Imposta l'estremità di aspirazione dell'aria con 4 serie di fonti di odori abbinate a beccucci di erogazione dell'acqua, con ogni set posizionato a 10 cm di distanza lungo l'asse x per definire le "corsie" lungo le quali un animale navigherà per una ricompensa in acqua (Figura 4C, D).
- Installare un sistema di erogazione degli odori gestito da elettrovalvole collegate a tubi e flaconi di odorizzante (Figura 4D).
NOTA: Le valvole sono alimentate tramite una scheda relè in una disposizione che garantisce che l'aria pulita o l'aria odorizzata fluiscano sempre e che una singola corsia o zero corsie possano ricevere aria odorizzata in un dato momento. Un set di cinque elettrovalvole a 12 V è gestito tramite una scheda relè contenente 4 relè. Quando tutti e 4 i relè sono impostati su "off", la valvola dell'aria pulita è aperta per impostazione predefinita. Quando viene aperta una singola valvola degli odori, la valvola dell'aria pulita si chiude automaticamente. Lo stato della scheda relè è gestito utilizzando le uscite digitali dal controller arduino primario. Una pompa d'aria per acquari di livello consumer fornisce aria limitata a 20 mL/min utilizzando un regolatore manuale del flusso d'aria. Utilizzando una serie di tubi e splitter di diametro interno da 1/16 di pollice, la linea di alimentazione fornisce aria pulita a ciascuna delle elettrovalvole. Le valvole di ritegno prima e dopo l'odorizzante garantiscono la direzione del flusso d'aria. La linea dell'aria pulita si fonde con le linee degli odori prima di entrare nell'arena per garantire che l'aria odorizzata venga spurgata quando le linee degli odori sono chiuse. - Installa una telecamera digitale veloce sopra l'arena per monitorare il comportamento degli animali (Tabella dei materiali).
NOTA: Il comportamento degli animali viene monitorato a 60 Hz utilizzando un'unica telecamera digitale veloce montata sopra l'arena (Tabella dei materiali). Un obiettivo della serie C a lunghezza focale fissa di 3,5 mm è stato montato tramite un adattatore C/CS, in grado di catturare l'intera arena (obiettivo focale, tabella dei materiali). - Usa un codice python personalizzato per gestire l'hardware dell'arena degli odori (Tabella dei materiali). Il software integra la telecamera e tutto l'hardware necessario per l'impostazione dei parametri sperimentali e l'acquisizione dei dati sperimentali (Tabella dei Materiali).
- Configura un PC collegato a una scheda di sviluppo Teensy 4.0 per fornire i mezzi per l'erogazione di odori e acqua mediata dal computer (Odor Arena Hardware and Software, Table of Materials).
- Impostare la fotocamera digitale per esportare un segnale di clock durante la registrazione di fotogrammi video. Il segnale viene utilizzato per la sincronizzazione post-hoc con il miniscopio utilizzando una scheda di interfaccia USB (Table of Materials), che registra i segnali di sincronizzazione da entrambi i sistemi.
NOTA: Durante un esperimento, il software di acquisizione personalizzato crea anche un file di eventi che contiene gli eventi sperimentali importanti e il fotogramma della fotocamera in cui si è verificato l'evento. Viene inoltre creato un file di timestamp per identificare eventuali fotogrammi caduti, un evento raro (Odor Arena Software, Table of Materials).
4. Misurazione della velocità dell'aria del pennacchio con un rivelatore a fotoionizzazione (PID) (Figura 5)
NOTA: Questo metodo rileva l'andamento temporale del pennacchio di odore attraverso un PID che espone l'odorizzante gassoso a una luce ultravioletta ad alta intensità che ionizza le molecole odorizzanti. L'output del dispositivo rileva le molecole odorose nel pennacchio di odore. Questa tecnica consente di stimare la velocità dell'aria nell'arena degli odori confrontando il ritardo per rilevare la presenza di odorizzanti che viaggiano attraverso due posizioni utilizzando il PID.
- Posiziona un PID miniaturizzato a risposta rapida a due diverse distanze. Una posizione è vicina e un'altra posizione lontana -10 cm di distanza dalla fonte dell'odore.
- Portare l'interruttore GAIN sul pannello frontale del controller PID in posizione x5.
- Portare l'interruttore PUMP sul pannello frontale del controller PID in posizione Alta.
- Controllare la spia di stato del diodo a emissione luminosa (LED) che mostra l'uscita del sensore (tensione) nel pannello frontale del controller in assenza di odoranti.
- Commutare il potenziometro OFFSET per azzerare la tensione in uscita in assenza di odorizzanti.
- Accendi la valvola degli odori nell'arena degli odori.
- Misurare il ritardo nel rilevamento del pennacchio di odore con il PID in ogni posizione dopo aver aperto la valvola. Questa procedura può essere eseguita offline registrando contemporaneamente l'uscita del PID e l'uscita della valvola registrata dall'arena odori (odor on) con una scheda di interfaccia (Table of Materials).
- Dividi la differenza nei ritardi in ciascuna posizione per la differenza nella distanza tra i due PID per calcolare la velocità dell'aria del pennacchio.
5. Topo di addestramento comportamentale nell'arena degli odori (Figura 6)
NOTA: Questa sezione descrive un compito comportamentale adattato da Findley et al.4. Il topo è limitato all'acqua il giorno prima per motivare la ricerca di una ricompensa in acqua. Il topo naviga il pennacchio di odore (Figura 6B) verso un beccuccio d'acqua situato alla fonte di rilascio dell'odore per ottenere il rinforzo dell'acqua (3 gocce da 10 μl erogate a 1 Hz). Durante il periodo di addestramento, il topo viene mantenuto sotto la restrizione dell'acqua avendo accesso a un massimo di 2 ml al giorno. Il peso corporeo del topo viene monitorato durante il periodo di restrizione idrica e non deve essere inferiore all'85% del peso corporeo originale. Il topo riceve circa 1 ml di acqua al giorno durante l'allenamento nell'arena degli odori e viene integrato con un ulteriore 1 ml di acqua al giorno nella gabbia dopo l'allenamento. Il topo rimane sotto restrizione d'acqua per un periodo massimo di 72 ore. Il software personalizzato (Table of Materials) rileva la posizione del mouse in tempo reale (60 Hz) utilizzando una semplice tecnica di sottrazione dello sfondo e localizzazione di blob. L'utente imposta manualmente i confini della corsia, il confine di casa (la posizione di partenza per il mouse sul retro dell'arena) e il confine di destinazione (vicino alla fonte dell'odore nella parte anteriore). Inoltre, l'utente può decidere in che modo il software utilizza questi limiti. Ad esempio, l'utente può emettere odori solo quando il mouse si trova dietro il confine della casa. Affinché il mouse riceva una ricompensa, l'utente potrebbe richiedere che rimanga all'interno della corsia odorizzata mentre naviga verso la destinazione (la fonte dell'odore). Una volta che il topo attraversa il confine del bersaglio, può ricevere una ricompensa. Durante la formazione, tuttavia, tutti questi requisiti vengono regolati semplicemente modificando un file "yaml" progettato per essere autoesplicativo e facile da usare.
- Per prima cosa, addestra il topo a iniziare le prove spostandosi sul retro dell'arena (definita come la porzione dell'arena che si trova a 40 cm di distanza dal lato in cui l'aria fluisce nella camera). Attendi che il mouse vada in fondo all'arena, quindi eroga manualmente odore e acqua in una corsia casuale. Lascia che il topo trovi la fonte e beva l'acqua.
- Ripetere la procedura più volte per creare l'associazione tra odore e acqua (Figura 6A, B). Una volta che il mouse impara ad avviare le prove, utilizza il software automatizzato per erogare gli odori.
- Addestra il mouse a eseguire l'attività di navigazione degli odori a due corsie utilizzando il software personalizzato automatizzato. In questa attività, scegli casualmente una delle due porte per gli odori per erogare l'odore e rinforza il mouse con acqua quando arriva al beccuccio dell'acqua in cui viene erogato l'odore. Questo protocollo utilizzava l'odorante acetato di isoamile diluito all'1% in olio minerale.
NOTA: Il mouse completa una sessione di circa 20 prove di navigazione del pennacchio di odori in circa 40 minuti. Il mouse esegue una sessione al giorno. Il mouse addestrato raggiunge una percentuale di navigazione corretta rispetto alla scelta casuale alla fine della sessione (> il 65% di scelte corrette). Il mouse dovrebbe soddisfare il criterio di > il 65% di scelte corrette nell'attività di navigazione degli odori a due corsie dopo 3-5 sessioni di formazione.
6. Registrazione dell'epifluorescenza di un topo che si muove liberamente nell'arena degli odori
NOTA: Il metodo descrive la registrazione dell'attività neuronale delle cellule dello strato piramidale (SP) nel CA1 dorsale mediante l'imaging del sensore di calcio geneticamente codificato GCaMP6f espresso nei topi Thy19 mediante imaging miniscopico ad ampio campo durante l'attività di navigazione del pennacchio di odore a due beccucci (Filmato supplementare 1 e Filmato supplementare 2). Una tipica sessione di imaging dura 40 minuti, consentendo al mouse di completare circa 20 prove di navigazione degli odori. Questa tecnica registra un topo per diversi mesi.
- Fissare il mouse, posizionare il miniscopio sulla parte superiore della piastra di base utilizzando il micromanipolatore e serrare la vite di fermo.
- Regolare la lente di elettrobagnatura per trovare il piano focale ottimale con il maggior numero di celle con la massima intensità di fluorescenza.
- Regolare la potenza del miniscopio per ottenere la gamma dinamica ottimale con un elevato rapporto segnale/rumore senza saturazione. Per ottenere questo risultato, è possibile ottenere l'imaging del CA1 dorsale nei topi Thy1-GCaMP6f con potenza del miniscopio impostata intorno al 30% a una velocità di acquisizione di 30 Hz.
- Rilascia il mouse all'interno dell'arena degli odori con il miniscopio attaccato alla piastra di base.
- Avviare l'acquisizione con la scheda di interfaccia per registrare l'uscita logica transistor-transistor (TTL) della fotocamera digitale situata nella parte superiore dell'arena e il segnale TTL dal miniscopio per la successiva sincronizzazione tra i fotogrammi video comportamentali e GCaMP6f. La fotocamera digitale registra a 60 Hz e il miniscopio a 30 Hz.
- Inizia a registrare il miniscopio e i filmati comportamentali e attiva il software automatizzato per due attività di navigazione degli odori con beccuccio.
7. Pre-elaborazione dei dati
NOTA: Questo metodo utilizza una pipeline MATLAB per elaborare i dati. Il codice è disponibile su GitHub (Software di sincronizzazione, Tabella dei materiali). NoRMCorre31 viene utilizzato per la correzione del movimento e EXTRACT32 viene utilizzato per trovare le ROI con segnali di fluorescenza variabili nel tempo riportati come variazioni della fluorescenza normalizzate dalla fluorescenza tra transitori di calcio (δF/F0).
- Sincronizza i metadati dell'arena degli odori, i fotogrammi della fotocamera digitale e i fotogrammi del miniscopio utilizzando i segnali di sincronizzazione registrati dalla scheda di interfaccia eseguendo il codice MATLAB Synchronize_Files_JOVE.m, disponibile su GitHub.
- Esegui la correzione del movimento dei fotogrammi sincronizzati del miniscopio utilizzando NoRMCorre (Motion Correction Software, Table of Materials).
- Trova le ROI con segnali δF/F0 variabili nel tempo utilizzando EXTRACT (ROI Extraction Software, Table of Materials).
- Separare i dati in prove (software di sincronizzazione, tabella dei materiali).
- Etichettare ogni prova come hit o miss in base rispettivamente al comportamento di navigazione corretto o sbagliato del mouse.
- Utilizzare il Behavior Ensemble and Neural Trajectory Observatory (BENTO)33 per visualizzare il comportamento e le ROI di ogni studio separato (Figura 7A, B e Filmato supplementare 3).
8. Analisi dei dati - Decodifica della posizione spaziale dai segnali cerebrali
NOTA: questo metodo utilizza l'apprendimento automatico per decodificare le posizioni X e Y del mouse nell'arena dai ROI dCA17. Il codice MATLAB è disponibile (Decoding Brain Signals Software, Table of Materials) all'indirizzo https://github.com/restrepd/drgMiniscope.
- Inserisci il file di output EXTRACT.mat e il file di metadati dell'arena degli odori nel software drgDecodeOdorArenav2.m. Il repository GitHub fornisce questi due file per un esempio (Software di sincronizzazione, Tabella dei materiali):
dFF_file='20220804_FCM22_withodor_miniscope_sync
_L1andL4_ncorre_ext.mat';
arena_file='20220804_FCM22withodor_odorarena_L1
andL4_sync.mat';
NOTA: drgDecodeOdorArenav2.m crea un set di dati diviso per i dati all'interno dello studio contenente i segnali ROI e i metadati (posizioni X e Y del topo, posizione del beccuccio dell'odore, erogazione dell'acqua, ecc.) per ogni prova. Il codice analizza anche la decodifica dei dati tra le prove. Il codice utilizza fitrnet per addestrare una rete neurale artificiale con i dati δF/F0 per tutte le ROI per tutte le prove tranne una per prevedere le posizioni X e Y e prevedere la posizione della prova esclusa utilizzando una procedura di esclusione di una. - La rete neurale restituisce le posizioni X e Y come output. Utilizza la rete neurale addestrata per fare previsioni. L'input ha lasciato fuori le prove non utilizzate per addestrare la rete a fare previsioni delle posizioni X e Y del mouse nell'arena dalle ROI (Figura 8A, B).
Risultati
L'utilizzo di questa procedura consente di visualizzare e registrare i transienti di fluorescenza dCA1 GCaMP6f nei topi che navigano nell'arena degli odori per trovare la fonte degli odori (Figura 6A, B, Filmato supplementare 1 e Filmato supplementare 2). Le immagini a fluorescenza vengono corrette con NoRMCorre e EXTRACT viene utilizzato per estrarre le ROI. Inoltre, la registrazione con una scheda di interfaccia consente la sincronizzazione dei segnali δF/F0 dalle ROI con gli eventi di erogazione di odori e acqua nell'arena degli odori (Figura 7A), nonché con il movimento del mouse nell'arena degli odori (Figura 7B e filmato supplementare 3). Il risultato rappresentativo del mouse che naviga nel pennacchio di odori include un gran numero di transitori di calcio durante l'attività (Figura 7A, B). Inoltre, è possibile ispezionare come le risposte del calcio sono allineate con la presenza di odore e la ricompensa dell'acqua (Figura 7A). La visualizzazione di singole prove con BENTO fornisce informazioni sulle risposte al calcio nelle diverse fasi della prova, tra cui l'inizio della prova, la decisione, la navigazione, il consumo di alcol e il ritorno in fondo all'arena (Figura 7B). Il metodo ha comunicato preziose informazioni sul legame tra le risposte del calcio CA1 e il comportamento dei topi durante un'attività di navigazione orientata agli odori.
Le registrazioni PID possono fornire informazioni cruciali sul pennacchio di odori e sulla velocità dell'aria del pennacchio. Il risultato rappresentativo mostra un aumento della risposta PID dopo l'apertura della valvola per rilasciare il pennacchio di odore all'interno dell'arena degli odori (Figura 5A). Inoltre, il protocollo consente di decodificare le posizioni X e Y del mouse dai segnali δF/F0 delle ROI dCA1 (Figura 8). Questa tecnica prevede la posizione spaziale del topo durante l'attività di navigazione del pennacchio di odore in base alle risposte CA1, il che è rilevante per comprendere meglio come i neuroni CA1 elaborano l'odore e le informazioni spaziali. La decodifica della traiettoria del topo dai segnali di calcio dell'ensemble neuronale in dCA1 è significativa perché rivela come i neuroni nel CA1 dorsale rappresentino una mappa cognitiva di informazioni odorose e spaziali per svolgere il complesso compito di navigazione del pennacchio di odore. Il metodo è stato esteso a diversi ROI che si comportano esclusivamente come cellule di posizione e altre cellule che rispondono allo stimolo dell'odore. Il successo della decodifica della traiettoria del topo dai segnali dell'insieme neuronale può essere confermato dalla forte correlazione tra la previsione di decodifica e le posizioni X e Y reali a terra del topo.
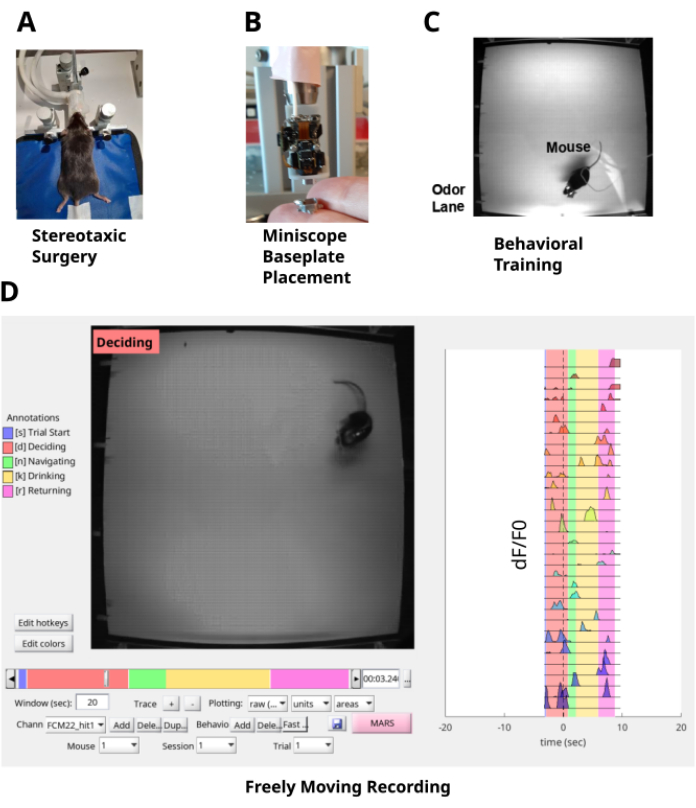
Figura 1: Pipeline di studio. (A) La chirurgia stereotassica consiste nell'impianto di una lente GRIN nello strato CA1 dell'ippocampo e di una piastra sulla testa per il fissaggio della testa del topo. (B) Una piastra di base è posizionata sulla parte superiore della lente GRIN per consentire l'accesso ottico alla fluorescenza dei neuroni CA1 con un miniscopio. (C) Il topo viene addestrato sull'attività di navigazione del pennacchio di odore. (D) Registrazione in movimento libero del comportamento del topo e dei neuroni CA1 che navigano nel pennacchio di odore. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Chirurgia stereotassica. (A) Posizionare il topo anestetizzato nell'apparato stereotassico. Regolare il livello di anestesia tra il 2 e il 3% di conseguenza con la risposta riflessa della zampa pizzicante (B) Radere i capelli sopra la testa. (C) Praticare con cura una piccola ammaccatura permanente con un trapano per fare un'ammaccatura permanente sulla parte superiore della posizione target. (D) Utilizzare il trapano dentale per aprire una perforazione circolare di 1,5 mm di diametro per consentire l'impianto di una lente GRIN di 1 mm di diametro e 4 mm di lunghezza nel cervello. (E) Collegare il supporto della lente GRIN al micromanipolatore e accendere l'aspiratore collegato alla pipetta per tenere la lente GRIN. (F) Impiantare lentamente la lente GRIN nella corteccia fino a raggiungere la profondità di -1,25 mm al di sotto della dura materia. (G) Testa fissa post-mortem illustrativa che mostra la piastra della testa e la piastra di base cementate sul cranio con la lente GRIN impiantata. (H) TAC post-mortem della testa che illustra la barra per la testa sulla parte superiore del cranio e la lente GRIN impiantata all'interno del cranio. (I) Progettazione della piastra della testa per consentire il fissaggio della testa del topo. L'animale in questa rappresentazione non è drappeggiato per facilitare una migliore visualizzazione anatomica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Posizionamento della piastra di base del miniscopio. (A) Porta miniscopio stampato in 3D accoppiato a un micromanipolatore. (B) Miniscopio attaccato al supporto. (C) Fissaggio della piastra di base al miniscopio. (D) Serraggio della vite di fermo per il fissaggio della piastra di base al miniscopio. La vite di fermo viene rilasciata dopo aver cementato la piastra di base al cranio del topo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4. Costruzione dell'arena degli odori. (A) Camera trasparente dell'arena degli odori. C'è una fotocamera digitale superiore per registrare il comportamento del mouse. (B) I motori passo-passo accoppiati a siringhe controllano l'erogazione dell'acqua per premiare il topo. (C) La vista dall'interno dell'arena degli odori che mostra una struttura a nido d'ape viene utilizzata per produrre un flusso laminare e quattro linee di erogazione degli odori. (D) Sistema di erogazione degli odori, inclusi tubi, valvole e bottiglie di odori visti dall'esterno dell'arena degli odori. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Registrazione del pennacchio di odore. (A) Pennacchio di odore registrato con il rivelatore a fotoionizzazione (PID). Media (blu grassetto)±Deviazione standard (azzurro) di cinque tracce PID di un pennacchio di odore che si propaga a 4,23 cm/s nell'arena degli odori. Una fonte di odori a 2 cm dal pavimento dell'arena degli odori. La testa del sensore del PID fornisce un segnale di tensione per la concentrazione di gas del pennacchio di odore. (B) Registrazione laser del pennacchio di odore con flusso illimitato a 20 cm/s. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: Formazione comportamentale del topo. (A) Il mouse impara a navigare verso un pennacchio di odore rilasciato sulla corsia di destra. Il topo impara a iniziare una prova andando in fondo all'arena degli odori, decide un lato per navigare verso il pennacchio di odori e beve una ricompensa in acqua. (B) Il mouse impara a navigare verso un pennacchio di odore rilasciato sulla corsia di sinistra. Il mouse viene ricompensato con l'odore se naviga verso la corsia corretta. Clicca qui per visualizzare una versione più grande di questa figura.
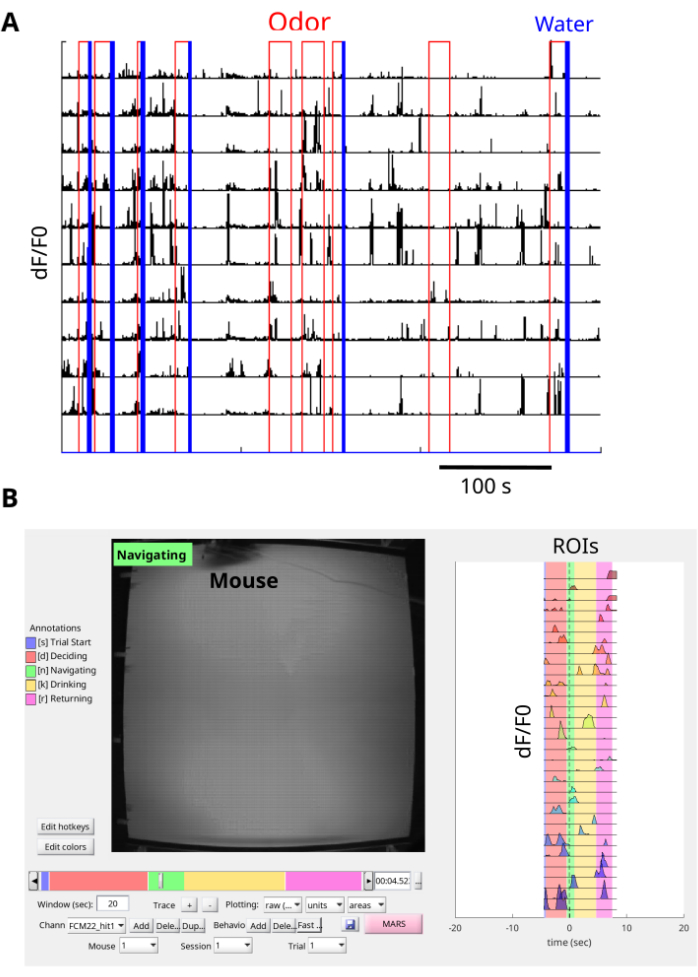
Figura 7: Pre-elaborazione dei dati. (A) Tracce di calcio sincronizzate con gli eventi dell'arena degli odori per molte prove. Ogni singola prova inizia con l'erogazione dell'odore in rosso e le prove premiate terminano con un impulso di erogazione dell'acqua in blu. Le tracce di calcio δF/F0 (senza unità) per ogni ROI sono mostrate in nero. Ogni riga indica un ROI. Una scheda di interfaccia viene utilizzata per registrare le uscite TTL della telecamera superiore sull'arena degli odori e della telecamera miniscope per la sincronizzazione dei fotogrammi. NorMCorre viene utilizzato per correggere il rumore di movimento dai fotogrammi del miniscopio e EXTRACT viene utilizzato per trovare le ROI ed estrarre le tracce di calcio δF/F0. (B) Prova singola rappresentativa di un topo che naviga in un pennacchio. La visualizzazione simultanea del comportamento sincronizzato (pannello di sinistra) e delle tracce di calcio δF/F0 (pannello di destra) da ciascun ROI di un singolo studio è osservata con BENTO. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 8. Decodifica della posizione del mouse dai segnali CA1. Decodifica della posizione X e Y del mouse dalle ROI CA1. La previsione di decodifica è mostrata in blu e la posizione reale del terreno del mouse è mostrata in rosso. Le tracce previste sono fortemente correlate con la verità di base. (A) Decodificare le posizioni X dalle ROI (coefficiente di correlazione di Pearson = 0,88). (B) Decodifica delle posizioni Y dalle ROI (coefficiente di correlazione di Pearson = 0,88). Clicca qui per visualizzare una versione più grande di questa figura.
Filmato supplementare 1: Esempio rappresentativo di fotogrammi comportamentali e miniscopici sincronizzati di un mouse che naviga verso un pennacchio di odore nella corsia di sinistra. (A) Fotogrammi comportamentali di un topo che indossa un miniscopio e naviga all'interno dell'arena degli odori. (B) Fotogrammi del topo in miniatura che mostrano i transitori di calcio grezzo registrati attraverso la lente GRIN. Clicca qui per scaricare questo filmato.
Filmato supplementare 2: Esempio rappresentativo di fotogrammi comportamentali e miniscopici sincronizzati di un topo che naviga verso un pennacchio di odore nella corsia di destra. (A) Fotogrammi comportamentali di un topo che indossa un miniscopio e naviga all'interno dell'arena degli odori. (B) Fotogrammi del topo in miniatura che mostrano i transitori di calcio grezzo registrati attraverso la lente GRIN. Clicca qui per scaricare questo filmato.
Filmato supplementare 3: Visualizzazione BENTO dei dati elaborati del comportamento del mouse e dei segnali cerebrali. Pannello di sinistra: il mouse sta navigando verso la corsia di destra nell'arena. Le annotazioni del comportamento vengono visualizzate in colori diversi. Pannello di destra: segnali di calcio δF/F0 della navigazione del mouse. Clicca qui per scaricare questo filmato.
Fascicolo supplementare 1: NoseconeRender.png. File per il cono nasale stampato in 3D per eseguire l'anestesia con isoflurano. Clicca qui per scaricare questo file.
Fascicolo supplementare 2: HeadbarRender.png. Lima per la barra della testa per il fissaggio della testa del mouse. Clicca qui per scaricare questo file.
Fascicolo supplementare 3: HeadbarTechnicalDrawing.png. Lima per la barra della testa per il fissaggio della testa del mouse. Clicca qui per scaricare questo file.
Fascicolo supplementare 4: ArenaFig_Draft2.tiff. Layout dettagliato dell'arena degli odori. Clicca qui per scaricare questo file.
Discussione
Questo protocollo delinea meticolosamente i passaggi per registrare le cellule di posizione e le cellule sensibili agli odori nell'area dCA1 dell'ippocampo dei topi che navigano in un pennacchio di odori. Le fasi critiche del protocollo includono la chirurgia stereotassica, il posizionamento della piastra di base del miniscopio, la costruzione dell'area dell'odore, il controllo del pennacchio nell'arena dell'odore, l'allenamento comportamentale, la registrazione del miniscopio del mouse che si muove liberamente, la pre-elaborazione dei dati e l'analisi dei dati. Inoltre, il protocollo spiega il processo di decodifica della traiettoria del topo dalle registrazioni dCA1.
Un passaggio fondamentale nella chirurgia stereotassica consiste nel seguire le coordinate relative al bregma per posizionare la lente GRIN nella posizione corretta. Una limitazione del metodo è il ritardo tra l'intervento chirurgico e il momento di iniziare a osservare i segnali GCaMP6f, che può richiedere 2-4 settimane. Il mouse dovrebbe essere pronto per l'uso dopo questo periodo critico. Una differenza tra il protocollo attuale e i protocolli precedenti 24,25,26,27 consiste nell'utilizzo di topi Thy1-GCaMP6f che già esprimono GCaMP6f in CA1 invece di iniettare il virus AAV-GCaMP6f nell'ippocampo. Risparmia tempo durante l'intervento chirurgico e non richiede un tempo di attesa per l'espressione del virus AAV nel cervello. Inoltre, questo protocollo non aspira il cervello e utilizza l'isoflurano al posto della ketamina/xilazina, che fornisce un migliore controllo della dose per prevenire il sovradosaggio. Una limitazione del metodo è l'aberrazione ottica della lente GRIN, che limita il campo visivo. Un passaggio cruciale per il posizionamento della piastra di base è quello di mantenere la lente di elettrobagnatura al centro per evitare una limitazione nella regolazione della piastra Z dopo aver cementato la piastra di base sulla testa. Un limite della costruzione dell'arena degli odori è la complessità del sistema, che può richiedere diversi mesi e può richiedere l'assistenza di un ingegnere. Una limitazione dell'addestramento comportamentale è che i topi possono preferire un lato dell'arena degli odori rispetto all'altro. Un modo per superare questo problema è quello di alternare le prove premiando il mouse per la navigazione verso le corsie di sinistra e destra.
Un passaggio fondamentale per il controllo del pennacchio è mantenere l'ago PID allineato con la fonte dell'odore per rilevare il percorso del pennacchio. Un passaggio cruciale nella registrazione del miniscopio di un mouse che si muove liberamente è garantire che il filo mini-coassiale non si aggrovigli durante l'attività, cosa che può essere evitata con un commutatore. I palloncini ad elio possono essere utilizzati per evitare che il filo mini-coassiale arrivi davanti al mouse. È fondamentale per la pre-elaborazione dei dati sincronizzare gli impulsi TTL della fotocamera digitale superiore dell'arena degli odori e della telecamera del miniscopio. Per la procedura EXTRACT, si consiglia di utilizzare l'elaborazione non negativa per estrarre meglio i segnali ROI e δF/F0. EXTRACT produce un'ispezione visiva delle tracce per ogni ROI per escludere quelle errate. È fondamentale decodificare le posizioni X e Y del mouse dalle ROI per avere un ampio set di dati con centinaia di epoche per un migliore addestramento della rete neurale artificiale.
L'importanza di questo metodo di registrazione a movimento libero rispetto ai metodi esistenti fissati con la testa è lo studio del comportamento del topo in un contesto etologicamente rilevante con il movimento corretto della testa per navigare in un pennacchio di odori complesso. Questo metodo è applicabile per studiare il ruolo dinamico dei neuroni dCA1 nella navigazione olfattiva complessa. Inoltre, la procedura non è limitata all'ippocampo o all'olfatto. Altre potenziali applicazioni della tecnica includono lo studio del ruolo di diverse aree cerebrali e modalità sensoriali, comprese le possibili applicazioni nella navigazione visiva utilizzando i LED per indicare le corsie premiate. Inoltre, questo metodo può essere potenzialmente applicato in esperimenti a circuito chiuso in tempo reale in cui la decodifica del calcio neurale dalla popolazione innesca la neurostimolazione o il feedback sensoriale 20,34,35,36.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questa ricerca è stata supportata dal National Institutes of Health degli Stati Uniti (NIH UF1 NS116241 e NIH R01 DC000566) e dalla National Science Foundation (NSF BCS-1926676). Gli autori ringraziano Andrew Scallon per aver aiutato a creare la camera dell'Odor Arena.
Materiali
| Name | Company | Catalog Number | Comments |
| Arduino Micro | Arduino | Micro | |
| Biocompatible Methacrylate Resin | Parkell | S380 | C&B-Metabond Adhesive Luting Cement |
| Decoding Brain Signals Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Dental Drill | Osada | LHP-6 | AZ210015 |
| Dental Drill Box | Osada | XL-230 | 30000 rotations per minute |
| Digital stereotaxic instrument | Stoelting | 51730D | Mouse Stereotaxic Instument, #51904 Digital Manipulator Arm, 3-Axes, Add-On, LEFT |
| Drill Bit | FST Fine Science Tools | 19007-05 | Tip diameter 0.5 mm |
| Fast Digital Camera | Edmund Optics | BFS-U3-63S4C | FLIR Blackfly S |
| Focal Lens | Edmund Optics | C-Series | 3.5 mm |
| GRIN lens | Inscopix | 1050-004595 | 1 mm diameter and 4 mm length |
| GRIN lens Holder | UCLA | http://miniscope.org/index.php/Surgery_Protocol | |
| Liquid Tissue Adhesive | 3M | 1469C | Vetbond Tissue Adhesive |
| Low-Flow Anesthesia System for Mice | Kent Scientific Corporation | SomnoSuite | https://www.kentscientific.com/products/somnosuite/ |
| Low Toxicity Silicone Adhesive | WPI – World Precision Instruments | Kwik-sil | |
| miniPID Controller | ASI – Aurora Scientific Inc. | Model 200B | Fast-Response Miniature Photo-Ionization Detector |
| Miniscope V4 Holder | UCLA | NA | https://github.com/Aharoni-Lab/Miniscope-v4/tree/master/Miniscope-v4-Holder |
| Miniscope V4 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4 |
| Miniscope Base Plate V2 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4-base-plates-variant-2-pack-of-10 |
| Miniscope DAQ-QT software | UCLA | https://github.com/Aharoni-Lab/Miniscope-DAQ-QT-Software/wiki | |
| Motion Correction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Odor Arena Hardware | Custom Made | 3D Model | https://www.dropbox.com/scl/fo/lwtpqysnpzis32mhrx3cd/ADomsxyhxu42sqDmTBl2O6k?rlkey=b3l4809eradundt5l3iz0gq74& dl=0 |
| Odor Arena Software | CUAnschutz | https://github.com/wryanw/odorarena | |
| Odorant Isoamyl Acetate | Aldrich Chemical Co | 06422AX | Diluted at 1% in odorless mineral oil |
| RHD USB Interface Board | Intan Technologies | C3100 | Product discontinued. Alternatively use another equivalent board. |
| ROI Extraction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Sutter Micromanipulator | Sutter Instrument Company | MP-285 | |
| Synchronization Software | CU Anschutz | https://github.com/fsimoesdesouza/Synchronization | |
| Thy1-GCaMP6f mice | Jackson Laboratory | IMSR_JAX 028281 | C57BL/6J-Tg(Thy1-GCaMP6f)GP5.12Dkim/J) |
Riferimenti
- Adoff, M. D., Climer, J. R., Davoudi, H., Marvin, J. S., Looger, L. L., Dombeck, D. A. The functional organization of excitatory synaptic input to place cells. Nat Commun. 12 (1), 3558(2021).
- Radvansky, B. A., Oh, J. Y., Climer, J. R., Dombeck, D. A. Behavior determines the hippocampal spatial mapping of a multisensory environment. Cell Rep. 36 (5), 109444(2021).
- Lewis, S. M., et al. Plume dynamics structure the spatiotemporal activity of mitral/tufted cell networks in the mouse olfactory bulb. Front Cell Neurosci. 15, 633757(2021).
- Findley, T. M., et al. Sniff-synchronized, gradient-guided olfactory search by freely moving mice. ELife. 10, e58523(2021).
- Gire, D. H., Kapoor, V., Arrighi-Allisan, A., Seminara, A., Murthy, V. N. Mice develop efficient strategies for foraging and navigation using complex natural stimuli. Curr Biol. 26 (10), 1261-1273 (2016).
- Liu, A., Papale, A. E., Hengenius, J., Patel, K., Ermentrout, B., Urban, N. N. Mouse navigation strategies for odor source localization. Front Neurosci. 14, 218(2020).
- Tariq, M. F., et al. Using head-mounted ethanol sensors to monitor olfactory information and determine behavioral changes associated with ethanol-plume contact during mouse odor-guided navigation. eNeuro. 8 (1), (2021).
- Rigolli, N., Reddy, G., Seminara, A., Vergassola, M. Alternation emerges as a multi-modal strategy for turbulent odor navigation. ELife. (11), e76989(2022).
- Ma, M., et al. Sequential activity of CA1 hippocampal cells constitutes a temporal memory map for associative learning in mice. Curr Biol. 34 (4), 841-854 (2024).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nat Methods. 16 (1), 11-13 (2019).
- Aharoni, D., Hoogland, T. M. Circuit investigations with open-source miniaturized microscopes: Past, present and future. Front Cell Neurosci. 13, 141(2019).
- Flusberg, B. A., et al. High-speed, miniaturized fluorescence microscopy in freely moving mice. Nat Methods. 5 (11), 935-938 (2008).
- Connor, E. G., McHugh, M. K., Crimaldi, J. P. Quantification of airborne odor plumes using planar laser-induced fluorescence. Exp Fluids. 59 (9), 137(2018).
- Gumaste, A., et al. A Comparison between mouse, in silico, and robot odor plume navigation reveals advantages of mouse odor tracking. eNeuro. 7 (1), (2020).
- Gumaste, A., et al. Behavioral discrimination and olfactory bulb encoding of odor plume intermittency. ELife. 13, e85303(2024).
- Marin, A. C., Schaefer, A. T., Ackels, T. Spatial information from the odour environment in mammalian olfaction. Cell Tissue Res. 383 (1), 473-483 (2021).
- Eichenbaum, H. The role of the hippocampus in navigation is memory. J Neurophysiol. 117 (4), 1785-1796 (2017).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13 (11), 1433-1440 (2010).
- Wirtshafter, H. S., Disterhoft, J. F. In vivo multi-day calcium imaging of CA1 hippocampus in freely moving rats reveals a high preponderance of place cells with consistent place fields. J Neurosci. 42 (22), 4538-4554 (2022).
- Mizuta, K., Sato, M. Multiphoton imaging of hippocampal neural circuits: techniques and biological insights into region-, cell-type-, and pathway-specific functions. Neurophotonics. 11 (3), 033406(2024).
- Radvansky, B. A., Dombeck, D. A. An olfactory virtual reality system for mice. Nat Commun. 9 (1), 839(2018).
- Almeida-Santos, A. F., et al. Social isolation impairs the persistence of social recognition memory by disturbing the glutamatergic tonus and the olfactory bulb-dorsal hippocampus coupling. Sci Rep. 9 (1), 473(2019).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), e108697(2014).
- Thapa, R., Liang, B., Liu, R., Li, Y. Stereotaxic viral injection and gradient-index lens implantation for deep brain in vivo calcium imaging. J Vis Exp. (176), e63049(2021).
- Hsiao, Y. -T., Wang, A. Y. -C., Lee, T. -Y., Chang, C. -Y. Using baseplating and a miniscope preanchored with an objective lens for calcium transient research in mice. J Vis Exp. (172), e62611(2021).
- Zhang, L., et al. Miniscope GRIN lens system for calcium imaging of neuronal activity from deep brain structures in behaving animals. Curr Protoc Neurosci. 86 (1), e56(2019).
- Guo, D., Gürkan Özer, A., Uusisaari, M. Y. In vivo calcium imaging in mouse inferior olive. J Vis Exp. (172), e62222(2021).
- Yun, M., Shin, J., Jung, M. W. Protocol for calcium imaging of dorsal and ventral CA1 neurons in head-fixed mice. STAR Protoc. 4 (3), 102439(2023).
- Yun, M., Hwang, J. Y., Jung, M. W. Septotemporal variations in hippocampal value and outcome processing. Cell Rep. 42 (2), 112094(2023).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. J Neurosci Methods. 291, 83-94 (2017).
- Inan, H., et al. Fast and statistically robust cell extraction from large-scale neural calcium imaging datasets. bioRxiv. , (2021).
- Segalin, C., et al. The mouse action recognition system (MARS) software pipeline for automated analysis of social behaviors in mice. ELife. 10, e63720(2021).
- Chen, Z., et al. A hardware system for real-time decoding of in vivo calcium imaging data. ELife. (12), e78344(2023).
- Xue, F., et al. Multi-region calcium imaging in freely behaving mice with ultra-compact head-mounted fluorescence microscopes. Natl Sci Rev. 11 (1), nwad294(2024).
- Tabourin, L., Bretzner, F., Galstian, T. Towards a mini-endoscope design with spatially selective excitation and imaging. Biomed Opt Express. 15 (3), 1750-1760 (2024).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon