Method Article
匂いプルームをナビゲートするマウスの海馬でのカルシウム信号を記録するミニスコープ
要約
このプロトコルは、匂いプルームをナビゲートするマウスの海馬CA1の脳と行動の関係を調査します。海馬のイメージングにアクセスするための手術、行動トレーニング、脳のミニスコープGCaMP6fの記録と処理、ROI神経活動からマウスの位置を解読するための行動データなど、段階的なプロトコルを提供します。
要約
マウスは、複雑な時空間構造を持つ匂いプルームを暗闇の中でナビゲートし、匂い物質の発生源を見つけます。この記事では、50 cm x 50 cm x 25 cmの匂いアリーナで匂いプルームをナビゲートするマウスの海馬(dCA1)の背側CA1錐体層ニューロンの行動を監視し、Ca2+ 過渡現象を記録するプロトコルについて説明します。グラジエントインデックス(GRIN)レンズを通して焦点を合わせた落射蛍光ミニスコープは、Thy1-GCaMP6fマウスのカルシウムセンサーGCaMP6fを発現するdCA1ニューロンのCa2+ 過渡現象を画像化しました。この論文では、自動化された匂いの領域でこの臭気プルームナビゲーションタスクを実行するようにマウスを訓練するための行動プロトコルについて説明しています。この方法には、GRINレンズ移植のための手術のための段階的な手順と、CA1でGCaMP6fをイメージングするためのベースプレート留置が含まれます。この記事では、マウスの位置をリアルタイムで追跡して、試験の開始と水の報酬の配信を自動化する方法について説明します。さらに、このプロトコルには、ミニスコープとデジタルカメラトラッキングマウスの位置の臭気ナビゲーションタスクとフレーム時間の自動化を説明するメタデータを同期するためのインターフェースボードの使用に関する情報が含まれています。さらに、この手法では、NorMCorreアルゴリズムを使用したモーション補正によりGCaMP6f蛍光映画の処理に使用されるパイプラインを描写し、その後、EXTRACTで関心領域を同定します。最後に、この論文では、CA1ニューラルアンサンブル活動から空間パスを解読して、マウスが匂いプルームのナビゲーションを予測する人工ニューラルネットワークアプローチについて説明します。
概要
頭部固定マウス1,2,3の嗅覚ナビゲーションに関与する神経回路の理解や、自由に動くマウス4,5,6,7,8のナビゲーション戦略の理解には大きな進歩が見られましたが、乱流の匂いプルームの動物倫理学的に関連性のある自由に動くナビゲーションにおける神経回路の役割はまだわかっていません。この記事では、Thy1-GCaMP6fマウス9で遺伝的にコードされたカルシウムセンサーGCaMP6fを発現する細胞のCa2+過渡現象をイメージングすることにより神経活動をモニタリングし、海馬の背側CA1錐体層ニューロン(dCA1)の連続的な神経ダイナミクスが匂いプルームナビゲーションに関与しているかどうかを研究する方法について説明します。この手法は、dCA1 10,11,12上のGRINレンズを通して焦点を合わせた小型落射蛍光顕微鏡を通じて、画像化されたGCaMP6f蛍光に関する情報を提供します。これらの方法は、マウスが匂いプルームナビゲーションタスクを実行し、注ぎ口に到達したときに水報酬を受け取り、背景の層流13,14を持つ匂いアリーナに匂い物質を供給するマウスの空間ナビゲーションとdCA1ニューロンGCaMP6fカルシウム過渡現象を同時に監視する方法を説明しています。この記事では、グラディエントインデックス(GRIN)レンズを埋め込むための脳定位固定術、自由に動くマウスの頭蓋骨にミニスコープを固定するためのベースプレートの配置、小型顕微鏡によるイメージングと高速デジタルカメラによるマウスの動きの監視、モーションアーチファクトの除去と関心領域(ROI)の発見のためのデータ前処理など、このタスクを達成するために必要な方法(図1)について説明します。 dCA1 ROIの蛍光の変化から匂い領域でのマウスのX位置とY位置を解読するためのデータセットと人工ニューラルネットワークのトレーニングと予測の準備7。
匂いプルームをナビゲートするマウスの海馬のCA1領域におけるカルシウム信号のミニスコープ記録は、匂いプルームナビゲーションの複雑な行動課題における嗅覚および空間情報に関与する神経回路の計算を理解するのに関連します2,14,15,16。海馬のCA1領域は、空間ナビゲーションにおいて役割を果たし、効率的なナビゲーション17,18のための環境の認知マップを作成するために重要である。ミニスコープでカルシウム信号を記録することは、臭気プルームナビゲーション中に空間情報をコードするCA1ニューロンを調査するための貴重な方法です。
この技術は、GCaMPカルシウム信号を記録するためのミニスコープ技術の利点と、空間ナビゲーションにおけるCA1海馬の確立された役割を組み合わせて、神経回路が複雑な行動をどのように駆動するかをよりよく理解します19。あるいは、2光子顕微鏡を用いたアプローチでは、CA1ニューロン9,20を記録することができるが、これには頭部固定マウスが必要であり、匂いプルーム21をナビゲートするために自由に動く可能性を抑制する。CA1ニューロンの局所場電気生理学的記録により、匂いプルームをナビゲートする自由に動くマウスの調査が可能になります22。それでも、局所的な電界電気信号は、スパイクソーティング技術を通じて単一ユニットの信号を分離することにより、細胞内発火を推定することに限界を課します。Miniscopeの信号は、信頼性の高い方法で細胞内カルシウムシグナル10,11に直接関連するROIの同定を可能にし、シングルセル分解能で神経計算を正確に調査する。Miniscopeテクノロジーは、CA1領域が臭気の手がかりに基づいて空間情報をどのようにエンコードするかをよりよく理解するユニークな機会を提供します。
さらに、この手法では、特定のニューロン集団がナビゲーションのために匂い情報をどのように処理するか、および匂いプルーム追跡中のニューロン活動パターンと意思決定との関係を調査します。この方法は、脳が匂いや空間情報をどのように処理しているかをよりよく理解するのに役立ちます。ミニスコープは、自由に動くマウスの脳を記録するためのシングルセル分解能を提供しますが、専門的な手術とデータ解析の専門知識が必要です。この論文では、研究者が匂いとプルームのナビゲーションの神経メカニズムを調査するための各ステップを経るのを支援するための包括的なプロトコルを提供します。
匂いナビゲートタスクは、マウスの神経コーディングと空間的な匂いの手がかり記憶を研究するための有望なフレームワークです。この論文の知見は、dCA1のニューロン集団カルシウムシグナルに基づいて、マウスが匂いプルームをナビゲートする軌跡を解読することが可能であることを示しています。臭気プルームナビゲーションにおけるdCA1カルシウム信号の役割を理解することは、現実的な環境における臭気誘導ナビゲーションの神経回路基盤を解明するための重要なステップである13,14。
プロトコル
研究は、生後3-6ヶ月齢の雄と雌のThy1-GCaMP6fトランスジェニックマウス23で行われました。すべての実験プロトコルは、国立衛生研究所のガイドラインに従って、コロラド大学アンシュッツメディカルキャンパスの動物管理および使用委員会によって承認されました。GRINレンズ移植術(セクション1)とベースプレート留置術(セクション2)の外科的処置は、以前の作品9,24,25,26,27,28,29から採用されました。
1. 海馬にGRINレンズを埋め込む脳定位固定術
- 滅菌手袋、ヘッドカバー、サージカルマスク、白衣を着用してください。
- すべてのサバイバル手術では、無菌状態を使用してください。すべての手術器具をオートクレーブ滅菌します。
- 手術部位の周囲に滅菌ドレープを配置します。
- マウスを3%イソフルランで誘導チャンバーに10分間入れて麻酔をかけます。 麻酔導入時に0.001 mg / gのポリマーにブプレノルフィンベースを皮下注射します。
- マウスが動きを止めて深い麻酔下にあるかどうかを確認し、後足をつまんで後足の反射をテストします。
- イソフルランの流れをノーズコーンに切り替えます(補足ファイル1)。
- マウス用の低流量イソフルラン麻酔システム(材料の表)の温度パッドが恒温設定に設定されていることを確認し、蒸気源が外部圧縮に設定されていることを確認してください。
- 麻酔をかけたマウスをデジタル定位固定装置(Table of Materials)に入れます。マウスの前歯をバイトバーに置き、ノーズコーンを鼻の前に置き、イソフルランの流れを確保し、頭を所定の位置に固定します。つまんだ後の足の反射に応じて、麻酔のレベルを2%〜3%に調整します(図2A)。
- マウスのイヤーバーを耳に当てて締めます。マウスのヘッドが水平で、左右または上下に動かないことを確認します。頭が固定されているときは、頭蓋骨を軽く下に押して頭蓋骨がヘッドバーの下に滑り落ちないようにしてください。
- 温度プローブを直腸に置き、マウスの尻尾にワイヤーをテープで固定して動かないようにします。直腸温を37°Cに維持するようにパッドの温度を設定します。
- 有害な空気乾燥を防ぐために、眼科用軟膏を目に加えます。.
- 頭が固定され、ノーズコーンによって提供されるイソフルランの流れの下にある場合は、動きを防ぐために髪を剃ります。電気シェーバーで頭の上の髪を剃り、その後、毛髪除去剤と滅菌綿先端の木製アプリケーターで残りの毛を取り除きます(図2B)。
- 滅菌綿の先端が付いた木製アプリケーターで頭皮を拭き、エタノールとベタジンをそれぞれ3回ずつ拭いて、手術野を滅菌にします。
- 0.1 mLの局所麻酔薬リドカインを、29 Gの針で目と耳の間の皮膚下に皮下(S.Q.)注射します。.これにより泡ができます。ハサミで皮膚を切る前に、数分待ちます。
- 先端のみの技術を使用して、鉗子を使用して皮膚を慎重に引き上げ、小さなはさみを使用して皮膚の円形部分を取り除きます。滅菌綿棒で血液を吸収します。
- 出血が止まったら、滅菌綿棒を使用して過酸化水素(5%)で頭蓋骨を洗浄します。この手順の後、矢状縫合糸やブレグマをマークするためのブレグマティック縫合糸の交差点を含む骨のランドマークが簡単に識別できることを確認してください。
- 頭蓋骨が脳定位固定装置に対して平らであることを確認するには、ブレグマ縫合糸とラムダ縫合糸が正確に同じZ座標にあることを確認します。これを行うには、マニピュレーターの腕に針を置き、両方の縫合糸に触れたときに針の先端が同じZ座標にあるかどうかを確認します。それ以外の場合は、Zプレートのバイトバーを動かし、スキルがフラットな位置になるまで手順を繰り返すことで、ヘッドの角度を調整します。
- 針を持ったマイクロマニピュレーターにピペットを取り付けて、タトゥーインクを塗ります。ブレグマの上部に印をつけます。
- マイクロマニピュレータの座標をブレグマ上でゼロにし、右海馬のCA1上の座標に移動します(ブレグマから中外側+1.8 mm、ブレグマから前後-2.4 mm)2。これは、マウス18,30の仮想臭気勾配ナビゲーションを研究するためにRadvanskyとDombeckによって選択された場所です。ドリル(材料表)で直径1mmの小さな永久的なへこみを慎重にドリルで開けます(材料表)10000回転で、ターゲット位置の上部に恒久的なへこみを作ります(図2C)。
- デンタルドリルを使用して直径1.5mmの円形のミシン目を開き、直径1mm、長さ4mmのGRINレンズを脳に埋め込みます(材料表)(図2D)。
- 硬膜と皮質を穿刺するには、穴の中央に 23G の針を挿入し、硬膜から 1.25 mm の深さに達するまでゆっくりと (~0.1 mm/分) 脳に針を動かします。針を脳からゆっくりと取り外します(~0.1 mm/分)。滅菌綿棒と生理食塩水を使用して血液をきれいにします。
- 2つの1 mLマイクロピペットチップを互いに収まるようにカットしたカスタムメイドのUCLAのGRINレンズホルダーを使用します(GRINレンズホルダー、 材料表)(図2E、F)。
- GRINレンズホルダーをマイクロマニピュレーターに接続し、ピペットに接続されたアスピレーターの電源を入れてGRINレンズを保持します。空気吸引によって生成される空気圧がGRINレンズを所定の位置に保持します。
- 長さ4mm、直径1mmのGRINレンズを使用してください。GRINレンズを皮質にゆっくりと埋め込み、硬膜から-1.25mmの深さに達するまで埋め込みます。
- 円形の頭蓋骨穿孔に液体組織接着剤(材料の表)を一滴垂らして穴を塞ぎます。乾くまで数分待ちます。
- GRINレンズのベースに速接着性セメント-生体適合性メタクリレート樹脂-(材料表)を調製し、頭蓋骨に永久に密封します。数分待ってから乾かします。
- アスピレーターの電源を切って解放し、この時点で頭蓋骨に恒久的に取り付けられているGRINレンズの上部からGRINレンズホルダーをゆっくりと取り外します。
- ヘッドバーを頭蓋骨の上部に置き、GRINレンズの穴の中央に置きます(図2G-I)(補足 File 2および補足 File 3)。
- GRINレンズの基部の周りに速乾性のある接着セメント(Table of Materials)を慎重に置き、頭蓋窓を密閉し、ヘッドバーを頭蓋骨に取り付けます。乾燥性接着剤セメント(Table of Materials)をヘッドバーの中央と側面に配置して、頭蓋骨にしっかりと固定します。完全に乾いていることを確認してください。GRINレンズの上に接着セメントが置かれていないことを確認してください。そうしないと、光路が永久に劣化し、画像がブロックされます。
- GRINレンズの上に低毒性のシリコーン接着剤(Table of Materials)を一滴垂らして、物理的損傷から保護します。
- イソフルランの電源を切ります。
- 動物が麻酔から目覚めるまで、術後すぐにケアモニタリングを受けてください。
- 手術から完全に回復するまで、マウスに痛みの兆候がないか監視することにより、術後ケアを受けてください。手術を受けた動物を他の動物と一緒に戻さないでください。
- ケージの周りの動き、飲食、取り扱いに対する正常な反応を簡単に観察して、痛みやストレスを受けていないことを確認します。
- 動物が深刻な神経学的または組織的損傷の兆候を示した場合は、すぐに人道的に安楽死させてください。
2.ミニスコープのベースプレートの配置
注:マウスの頭部固定の手順は、動物が手術から完全に回復してから2週間後に開始されます。dCA1のイメージング手順は、動物が完全に回復し、GCaMP6fシグナルが強く見えるようになった後、手術の3週間後に開始されます。GRINレンズの上部にはベースプレートが固定されており、ミニスコープを使用してGRINレンズを通じてdCA1 GCaMP6f蛍光を光学的にアクセスすることができます。このプロトコルは、ミニスコープバージョン4-V4(Miniscope V4; 資料の表)。
- 手術の2週間後にマウスをヘッド固定に慣れさせるために、ヘッドバーをピンチクランプで固定することにより、マウスのヘッド固定を10分間開始します。
- 手術の3週間後にマウスを頭に固定し、ベースプレートを留置します。
- マイクロマニピュレータに取り付けられたマイクロマニピュレータ(Table of Materials)に取り付けられた3Dプリントされたホルダーにミニスコープを取り付けます(図3A、B)。
- 細いピンセットを使用してレンズの上部からシリコーン接着剤(Table of Materials)を慎重に取り除き、レンズワイプを使用してGRINレンズの表面を清掃します。
- ミニスコープに取り付けられたベースプレートを固定し、ベースプレートの側面にある止めネジを締めます(材料表)(図3C、D)。
- ミニスコープの端をGRINレンズの100μm上に達するまで動かします。
- スライダーを使用して、手順2.8から2.10に従って、ミニスコープソフトウェア(資料の表)でミニスコープ設定を構成します。
- ソフトウェアの [電力 ]スライダーをクリックして電力を制御し、約10%に保ちます。
- [Acquisition Rate] スライダをクリックし、約 10 Hz に保ちます。
- v4ミニスコープには、ファインフォーカスに使用できるエレクトロウェッティングレンズがあります。 フォーカス スライダーをクリックして50%に設定し、エレクトロウェッティングレンズを焦点範囲の中央に保ちます。
- ソフトウェアを使用して view GRINレンズの上部。GRINレンズの円形を画面上で確認することができます。
- マイクロマニピュレーターで軸方向の位置を調整してミニスコープをGRINレンズに近づけ、コンピューターで画像を監視します。
- GRINレンズの上部が見えたら、マイクロマニピュレーターで上下にファインフォーカスを使用して、セルフラッシュを視覚化するのに最適な焦点面に到達します。ソフトウェアの擬似δF/F0設定を使用して、セルのフラッシュの品質を再確認してください。
- 視野内に最大数の細胞を許容し、達成可能な最高の蛍光強度が得られるようにフォーカスを設定します。この時点で、血管に焦点が合っていることを確認します。
- マウスには一時的なカルシウム信号がないことがあります-点滅します。この場合、次の手順(14-16)を避け、次の数週間でマウスを再度確認して、一時的なカルシウム信号が発生するかどうかを再確認してください。
注:手術後2か月で一過性のカルシウム信号が発生しない場合、マウスを安楽死させる決定を下すことができます。 - ピントが合ったら、頭蓋骨とベースプレートの底部の間に素早く接着するセメントの壁を慎重に作ります。ミニスコープをベースプレートにセメントで固定しないように注意し、GRINレンズの上部にセメントが付着しないように十分注意してください。
- セメントが乾いたら、止めネジを取り外し、マイクロマニピュレーターでミニスコープをベースプレートから慎重に取り外します。
- ベースプレートカバーを使用してGRINレンズを保護します。
3.臭気アリーナの建設
注:この方法は、Connorら13 およびGumasteら14の設計に基づいて、自動化された臭気アリーナを描写します。完全なアセンブリは、 資料の表(補足ファイル4)に記載されているリンクにあります。
- 50 cm(L)x 50 cm(W)x 25 cm(H)の寸法で、2つのアクリル壁、アクリル天井、白い発泡ポリ塩化ビニル(PVC)床、および空気の流れを促進する前面と背面の2つのユニークな壁を備えたチャンバーを構築します(図4A)。
- アリーナの後部にエアサクションエンドを取り付け、テーパードデザインとコンピューターファンを取り付けてチャンバーから空気を引き出します。物理ノブを使用して、ファンのパルス幅変調(PWM)を設定し、空気の流れの速度を調整します。
注:3Dプリントされたハニカム構造は、臭気アリーナの前面と背面の壁で構成されており、マウスを内部に保持しながら空気の層流を促進します10。アリーナの正面にあるハニカム壁には、大量の空気を無秩序に受け取るための外部フレアがあります。 - Nema 17ステッピングモーターをシリンジに結合した単純な仕掛けを介して水報酬を配信するための水供給システムを設定します。A4988 マイクロステッピング ドライバーにより、ディスペンス量を正確に制御できます (https://github.com/dougollerenshaw/syringe_pump、図 4B)。
- 吸気口には、4セットの臭気源と水供給口を組み合わせて設置し、各セットをx軸に沿って10 cm離して配置し、動物が水の報酬のためにナビゲートする「レーン」を定義します(図4C、D)。
- チューブと臭気ボトルに接続された電磁弁によって管理される臭気供給システムを取り付けます(図4D)。
注:バルブは、クリーンな空気または臭気のある空気が常に流れていること、および1つのシングルレーンまたはゼロレーンのいずれかがいつでも臭気のある空気を受け取ることができることを保証する配置のリレーボードを使用して電力を供給されます。5つの12Vソレノイドバルブのセットは、4つのリレーを含むリレーボードを使用して管理されます。4つのリレーすべてが「オフ」に設定されている場合、クリーンエアバルブはデフォルトで開いています。臭気バルブが1つでも開くと、クリーンエアバルブは自動的に閉じます。リレーボードの状態は、プライマリArduinoコントローラからのデジタル出力を使用して管理されます。民生用アクアリウムエアポンプは、手動のエアフローレギュレーターを使用して20mL/minに制限された空気を供給します。1/16インチの内径チューブとスプリッターを連ねて、各ソレノイドバルブに清浄な空気を供給します。臭気物質の前後の逆止弁は、空気の流れの方向を保証します。クリーンエアラインは、アリーナに入る前に臭気ラインと合流し、臭気ラインが閉じたときに臭気のある空気がパージされることを保証します。 - アリーナの上に高速デジタルカメラを設置して、動物の行動を監視します(資料の表)。
注:動物の行動は、アリーナの上に取り付けられた単一の高速デジタルカメラを使用して60Hzで監視されます(資料表)。3.5mmの固定焦点レンズCシリーズレンズは、C/CSマウントアダプターを介して取り付けられ、アリーナ全体をキャプチャできます(フォーカルレンズ、 マテリアルテーブル)。 - カスタムPythonコードを使用して、臭気アリーナハードウェアを管理します(材料の表)。このソフトウェアは、実験パラメータの設定と実験データの取得に必要なすべてのカメラとすべてのハードウェアを統合しています(材料表)。
- Teensy 4.0開発ボードに接続されたPCをセットアップして、コンピューターを介した臭気と水の配信の手段を提供します(Odor Arenaハードウェアおよびソフトウェア、 資料表)。
- ビデオフレームの録画時にクロック信号をエクスポートするようにデジタルカメラを設定します。この信号は、USBインターフェースボード(Table of Materials)を使用してミニスコープとの事後同期に使用され、両方のシステムからの同期信号を記録します。
注:実験中、カスタム集録ソフトウェアは、重要な実験イベントとイベントが発生したカメラフレームを含むイベントファイルも作成します。また、まれなイベントであるドロップされたフレームを識別するために、タイムスタンプファイルも作成されます(Odor Arena Software、 Table of Materials)。
4. 光イオン化検出器(PID)によるプルームの風速測定(図5)
注:この方法は、臭気分子をイオン化する高強度の紫外線にガス状の臭気物質をさらすPIDを通じて、臭気プルームの時間経過を検出します。デバイスの出力は、臭気プルーム内の臭気分子を検出します。この手法では、遅延を比較して、PIDを使用して2つの場所を移動する臭気物質の存在を検出することにより、臭気アリーナの対気速度を推定できます。
- 高速応答のミニチュアPIDを2つの異なる距離に配置します。1つの場所は近く、別の場所は臭気源から遠く離れています-10cm離れています。
- PIDコントローラーのフロントパネルにある GAIN スイッチを x5の位置に変更します。
- PIDコントローラーのフロントパネルにある PUMP スイッチを Highの位置に変更します。
- コントローラーのフロントパネルに臭気物質がない場合、コントローラーのフロントパネルにセンサー(vol)出力を示す発光ダイオード(LED)ステータスライトを確認してください。
- ポテンショメータ OFFSET を切り替えて、臭気物質がない場合に電圧出力をゼロにします。
- 臭気アリーナの臭気バルブをオンにします。
- バルブを開いた後、各位置のPIDで臭気プルームを検出する遅延を測定します。この手順は、PIDの出力と臭気アリーナで記録されたバルブの出力(臭気オン)をインターフェースボード(材料表)で同時に記録することにより、オフラインで実行できます。
- 各ロケーションの遅延の差を 2 つの PID 間の距離の差で割って、プルームの対気速度を計算します。
5. 匂いの領域での行動訓練用マウス(図6)
注:このセクションでは、Findley et al.4から適応した行動課題について説明します。ネズミは、水の報酬を求める動機付けのために、前日に水に制限されています。マウスは、臭気プルーム(図6B)を臭気放出源にある水注ぎ口に向かって移動し、水の強化(10μLを3滴1Hzで送液)します。トレーニング期間中、マウスは1日あたり最大2mLにアクセスすることにより、水分制限の下で維持されます。マウスの体重は、水制限期間中に監視され、元の体重の85%を下回ってはなりません。マウスは、匂いアリーナでのトレーニング中に1日あたり約1mLの水を受け取り、トレーニング後にケージ内で1日あたり1mLの水を追加で補給します。マウスは、最大72時間、水制限下に置かれます。カスタムソフトウェア(Table of Materials)は、単純な背景減算とブロブローカリゼーション技術を使用して、マウスの位置をリアルタイム(60Hz)で検出します。ユーザーは、レーン境界、ホーム境界 (アリーナの背面にあるマウスの開始位置)、およびターゲット境界 (前面の臭気源の近く) を手動で設定します。さらに、ユーザーは、ソフトウェアがこれらの境界をどのように利用するかを決定できます。例えば、ユーザは、マウスがホーム境界の後ろにいる場合にのみ臭気を配信してもよい。マウスが報酬を受け取るために、ユーザーは、ターゲット(臭気源)に移動するときに、マウスが臭気のあるレーン内に留まるように要求する場合があります。マウスがターゲットの境界を越えると、報酬を受け取ることができます。ただし、トレーニング中、これらの要件はいずれも、一目瞭然でユーザーフレンドリーに設計された「yaml」ファイルを編集するだけで調整されます。
- まず、アリーナの背面(アリーナの空気がチャンバーに流れ込む側から40cm離れた部分と定義)に移動して、マウスをトレーニングしてトライアルを開始します。マウスがアリーナの後ろに移動するまで待ってから、1つのランダムなレーンに手動で臭いと水を配信します。マウスにソースを見つけて水を飲ませます。
- 手順を何度も繰り返して、臭いと水の関連付けを作成します(図6A、B)。マウスが試験の開始を学習したら、自動化されたソフトウェアを使用して臭いを配信します。
- 自動化されたカスタムソフトウェアを使用して、2レーンの臭気ナビゲーションタスクを実行するようにマウスをトレーニングします。このタスクでは、2つの匂いポートのうち1つをランダムに選択して臭気を配信し、匂い物質が配信される水口に到着したときにマウスを水で補強します。このプロトコルでは、鉱物油で1%に希釈した臭気物質である酢酸イソアミルを使用しました。
注:マウスは、約20回の臭気プルームナビゲーションの試行セッションを約40分で完了します。マウスは1日1回のセッションを実行します。学習済みのマウスは、セッションの終了時にランダムな選択を上回る正しいナビゲーションの割合を達成します (> 65% の正しい選択)。マウスは、3〜5回のトレーニングセッションの後、2レーンの臭気ナビゲーションタスクで65%の正しい選択を>するという基準を達成する必要があります。
6. 匂い領域で自由に動くマウスの落射蛍光記録
注:この方法は、2つの注ぎ口の臭気プルームナビゲーションタスク(補足動画1、および補足動画2)中に、Thy1マウス9で発現された遺伝的にコードされたカルシウムセンサーGCaMP6fを広視野ミニスコープイメージングによりイメージングすることにより、背側CA1のピラミッド層(SP)細胞のニューロン活動を記録することを説明しています。一般的なイメージングセッションには40分かかり、マウスは約20回の匂いナビゲーションの試行を完了することができます。この手法は、マウスを数か月間記録します。
- マウスをヘッド固定し、マイクロマニピュレーターを使用してミニスコープをベースプレートの上部に置き、止めネジを締めます。
- エレクトロウェッティングレンズを調整して、蛍光強度が最も高い細胞の数が最も多い最適な焦点面を見つけます。
- ミニスコープの電力を調整して、飽和することなく高い信号対雑音比で最適なダイナミックレンジを取得します。これを達成するには、Thy1-GCaMP6fマウスの背側CA1をイメージングし、ミニスコープの倍率を30Hzの捕捉率で約30%に設定します。
- ミニスコープをベースプレートに取り付けた状態で、マウスを臭気アリーナ内で放します。
- インターフェースボードで集録を開始し、アリーナの上部にあるデジタルカメラのトランジスタトランジスタロジック(TTL)出力とミニスコープからのTTL信号を記録し、後でビヘイビアビデオフレームとGCaMP6fビデオフレームを同期します。デジタルカメラは60Hzで記録し、ミニスコープは30Hzで記録します。
- ミニスコープと行動動画の録画を開始し、2つの注ぎ口臭ナビゲーションタスクの自動ソフトウェアをオンにします。
7. データの前処理
注: この方法では、MATLAB パイプラインを使用してデータを処理します。コードは GitHub (同期ソフトウェア、 資料表) で入手できます。NoRMCorre31 はモーション補正に使用され、EXTRACT32 はカルシウム過渡現象(δF/F0)間の蛍光によって正規化された蛍光の変化として報告される時間変動蛍光シグナルを持つROIを見つけるために使用されます。
- MATLAB コード (GitHub) で入手可能な Synchronize_Files_JOVE.m を実行して、インターフェイス ボードによって記録された同期信号を使用して、臭気アリーナのメタデータ、デジタル カメラ フレーム、およびミニスコープ フレームを同期します。
- NoRMCorre(Motion Correction Software, Table of Materials)を使用して、同期したミニスコープフレームのモーション補正を行います。
- EXTRACT (ROI Extraction Software, Table of Materials) を使用して、時間的に変化する δF/F0 信号の ROI を求めます。
- データを試行に分けます(同期ソフトウェア、 材料表)。
- 各試行に、マウスの正しいナビゲーション動作または間違ったナビゲーション動作に基づいて、ヒットまたはミスとしてラベルを付けます。
- Behavior Ensemble and Neural Trajectory Observatory (BENTO)33 を使用して、各個別の試行の行動と ROI を視覚化します (図 7A、B、および 補足ムービー 3)。
8. データ解析 - 脳信号から空間位置を解読する
注:この方法では、機械学習を使用して、アリーナ内のマウスのX位置とY位置をdCA1ROI7からデコードします。MATLAB コードは https://github.com/restrepd/drgMiniscope から入手できます (Decoding Brain Signals Software, Table of Materials)。
- EXTRACT.mat出力ファイルと臭気アリーナメタデータファイルをdrgDecodeOdorArenav2.mに入力します。GitHub リポジトリには、例として次の 2 つのファイルが用意されています (同期ソフトウェア、資料表)。
dFF_file='20220804_FCM22_withodor_miniscope_sync
_L1andL4_ncorre_ext.mat';
arena_file='20220804_FCM22withodor_odorarena_L1
andL4_sync.mat';
注:drgDecodeOdorArenav2.mは、各試行のROI信号とメタデータ(マウスのX位置とY位置、臭気注ぎの位置、水の供給など)を含む試行内データで分割されたデータセットを作成します。このコードでは、試行間のデータのデコードも分析されます。このコードでは、fitrnet を使用して、X と Y の位置を予測し、leave one out 手順を使用して 1 つの試行のすべての ROI の δF/F0 データを使用して人工ニューラル ネットワークをトレーニングします。 - ニューラル ネットワークは、X と Y の位置を出力として返します。トレーニング済みのニューラル ネットワークを使用して予測を行います。入力では、ROI からアリーナ内のマウスの X 位置と Y 位置を予測するようにネットワークに学習させるために使用されなかった試行が除外されました (図 8A、B)。
結果
この手順により、匂い物質の発生源を見つけるために匂い領域をナビゲートするマウスのdCA1 GCaMP6f蛍光過渡現象を可視化および記録することができます(図6A、B、 補足動画1、 補足動画2)。蛍光画像はNoRMCorreでモーション補正され、EXTRACTを使用してROIが抽出されます。さらに、インターフェースボードで記録することで、ROIからのδF/F0信号を、臭気アリーナでの臭気および水の供給イベント(図7A)や、臭気アリーナでのマウスの動き(図7B、 補足動画3)と同期させることができます。マウスが臭気プルームをナビゲートする代表的な結果には、タスク中の多数のカルシウム過渡現象が含まれます(図7A、B)。さらに、カルシウム応答が臭気や水分報酬の存在とどのように一致しているかを調べることができます(図7A)。BENTOによる単一試験の可視化は、試験の開始、決定、ナビゲート、飲酒、アリーナの後方への復帰など、試験のさまざまな段階でのカルシウム反応に関する情報を提供します(図7B)。この手法は、匂い指向のナビゲーションタスクにおけるCA1カルシウム応答とマウスの行動との関連に関する貴重な洞察を伝えました。
PID記録は、臭気プルームとプルームの対気速度に関する重要な情報を提供できます。代表的な結果は、バルブを開いて臭気アリーナ内の臭気プルームを放出した後のPID応答の増加を示しています(図5A)。さらに、このプロトコルは、dCA1 ROIのδF/F0信号からマウスのX位置とY位置をデコードします(図8)。この手法は、CA1応答に基づいて匂いプルームナビゲーションタスク中のマウスの空間位置を予測するもので、CA1ニューロンが匂いと空間情報をどのように処理するかをより深く理解する上で重要です。dCA1のニューロン集団カルシウムシグナルからマウスの軌跡を解読することは、背側CA1のニューロンが匂いプルームナビゲーションの複雑なタスクを実行するための匂い物質と空間情報の認知マップをどのように表しているかを明らかにするため、重要です。この方法は、場所細胞および臭気刺激に応答する他の細胞としてのみ振る舞うさまざまなROIに拡張されました。ニューロンのアンサンブル信号からマウスの軌跡をうまくデコードすることは、デコード予測とマウスの接地された真のXおよびY位置との間に強い相関関係があることで確認できます。
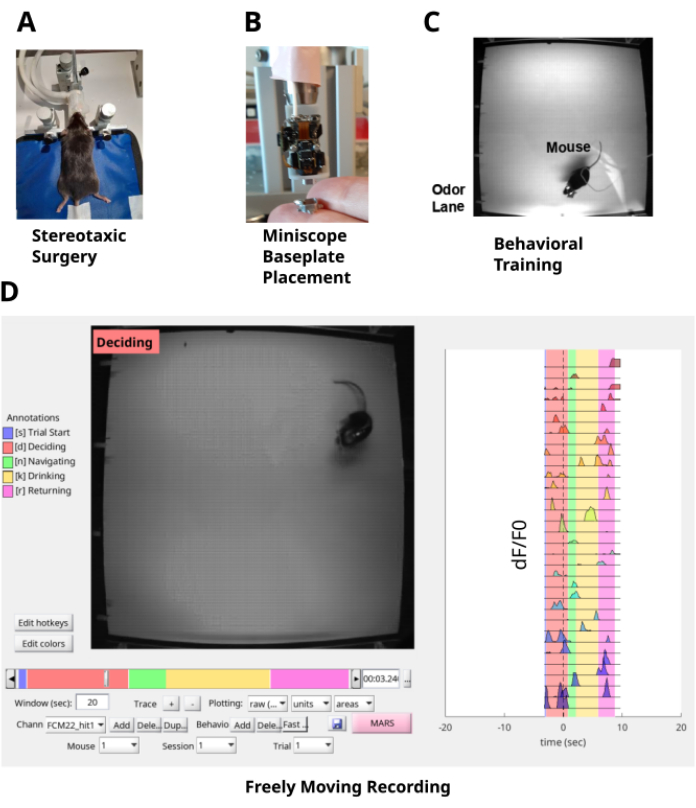
図1:研究パイプライン (A)脳定位固定術は、海馬のCA1層にGRINレンズを埋め込み、マウスを頭部固定するためのヘッドプレートを頭蓋骨に埋め込むことからなる。(B)ベースプレートはGRINレンズの上部に配置されており、ミニスコープでCA1ニューロンの蛍光に光学的にアクセスできます。(C)マウスは、臭気プルームナビゲーションタスクについて訓練されています。(D)マウスの行動と匂いプルームをナビゲートするCA1ニューロンの自由に動く記録。 この図の拡大版を表示するには、ここをクリックしてください。

図2:脳定位固定装置 手術 (A) 麻酔をかけたマウスを脳定位固定装置に入れます。つまむ足の反射反応に応じて、麻酔のレベルを2〜3%に調整します(B)頭の上の髪を剃ります。(C)ドリルで小さな永久的なへこみを慎重にドリルで開けて、ターゲットの場所の上部に恒久的なへこみを作ります。(D)デンタルドリルを使用して直径1.5mmの円形の穿孔を開き、直径1mm、長さ4mmのGRINレンズを脳に移植できるようにします。(E)GRINレンズホルダーをマイクロマニピュレーターに接続し、ピペットに接続されたアスピレーターをオンにしてGRINレンズを保持します。(F)GRINレンズを皮質にゆっくりと埋め込み、硬膜物質から-1.25mmの深さに達するまで埋め込みます。(G)埋め込まれたGRINレンズで頭蓋骨にセメントで固定されたヘッドプレートとベースプレートを示す、実例となる死後固定ヘッド。(H) 頭蓋骨上部のヘッドバーと頭蓋骨の内側に埋め込まれたGRINレンズを示す頭部の死後CTスキャン。(I)マウスのヘッド固定を可能にするためのヘッドプレートの設計。この描写の動物は、解剖学的視覚化を改善するためにドレープを外しています。 この図の拡大版を表示するには、ここをクリックしてください。

図3:ミニスコープベースプレートの配置。 (A)マイクロマニピュレーターに結合された3Dプリントされたミニスコープホルダー。(B)ホルダーに取り付けられたミニスコープ。(C)ベースプレートをミニスコープに取り付けます。(D)ベースプレートをミニスコープに固定するための止めネジを締めます。止めネジは、ベースプレートをマウスの頭蓋骨に接着した後に解放されます。 この図の拡大版を表示するには、ここをクリックしてください。

図 4.臭気アリーナの建設。 (A)臭気アリーナ透明チャンバー。マウスの動作を記録するためのトップデジタルカメラがあります。(B)シリンジに結合されたステップモーターは、マウスに報酬を与えるために水の供給を制御します。(C)臭気アリーナの内側からの眺めは、ハニカム構造を示し、層流と4つの臭気供給ラインを生成するために使用されます。(D)臭気アリーナの外側から見たチューブ、バルブ、および臭気ボトルを含む臭気供給システム。 この図の拡大版を表示するには、ここをクリックしてください。

図5:臭気プルームの記録 (A)光イオン化検出器(PID)で記録された臭気プルーム。平均(太字の青)±臭気領域で4.23 cm/sで伝播する臭気プルームの5つのPIDトレースの標準偏差(水色)。ニオイアリーナフロアから2cmのところにニオイ物質源。PIDのセンサーヘッドは、臭気プルームのガス濃度の電圧信号を提供します。(B)20 cm / sで無制限の流れを持つ臭気プルームのレーザー記録この 図の拡大版を表示するには、ここをクリックしてください。

図6:マウスの行動訓練。 (A)マウスは、右車線で放出された臭気プルームに向かってナビゲートすることを学習しています。ネズミは、匂いアリーナの後ろに移動して試行を開始し、匂いプルームに向かって移動する側を決定し、水を飲むことを学びます。(B)マウスは、左車線で放出された臭気プルームに向かってナビゲートすることを学習しています。マウスは、正しいレーンに移動すると臭いがします。 この図の拡大版を表示するには、ここをクリックしてください。
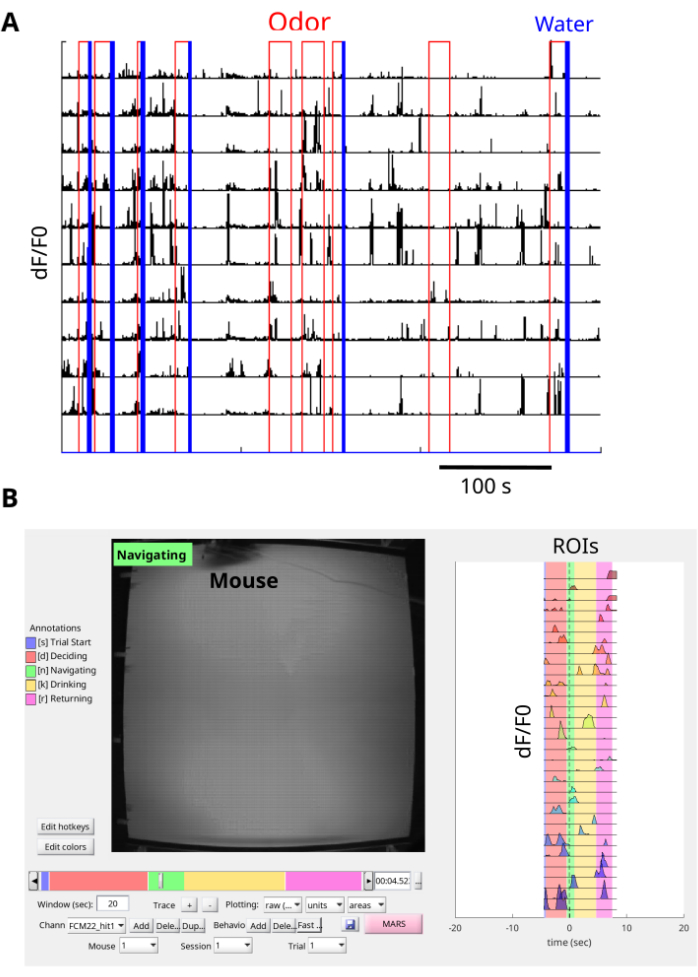
図7:データの前処理 (A) 多くの試験で臭気アリーナイベントと同期したカルシウムの痕跡。各 1 回の試行は、赤の臭気の配信で始まり、報酬の試行は青の水の配信パルスで終了します。各ROIのδF/F0(単位なし)カルシウムトレースは黒で示しています。各線はROIを示します。インターフェースボードは、臭気アリーナのトップカメラのTTL出力を記録するために使用され、ミニスコープカメラはフレームを同期するために使用されます。NorMCorreはミニスコープフレームからの移動ノイズを補正するために使用され、EXTRACTはROIを見つけてδF / F0カルシウムトレースを抽出するために使用されます。(B)プルームをナビゲートするマウスの代表的な単一試行。BENTO では、1 回の試行の各 ROI からの同期挙動 (左パネル) と δF/F0 カルシウム痕跡 (右パネル) の同時可視化が観察されます。 この図の拡大版を表示するには、ここをクリックしてください。

図 8.CA1信号からマウスの位置をデコードします。 CA1 ROI からのマウスの X 位置と Y 位置のデコード。デコード予測は青で、マウスの接地真位置は赤で示されます。予測されたトレースは、グラウンドトゥルースと強く相関しています。(A) ROIからX位置をデコードします(ピアソン相関係数= 0.88)。(B)ROIからY位置をデコードします(ピアソン相関係数= 0.88)。 この図の拡大版を表示するには、ここをクリックしてください。
補足ムービー 1: 左レーンの臭気プルームに向かって移動するマウスの同期動作フレームとミニスコープ フレームの代表的な例。 (A)ミニスコープを装着し、匂いの領域内を移動するマウスの行動フレーム。(B)GRINレンズを通して記録された生のカルシウム過渡現象を示すマウスのミニスコープフレーム。 この映画をダウンロードするには、ここをクリックしてください。
補足ムービー2:右車線の臭気プルームに向かって移動するマウスの同期動作フレームとミニスコープフレームの代表的な例。 (A)ミニスコープを装着し、匂いの領域内を移動するマウスの行動フレーム。(B)GRINレンズを通して記録された生のカルシウム過渡現象を示すマウスのミニスコープフレーム。 この映画をダウンロードするには、ここをクリックしてください。
補足動画3:マウスの行動と脳信号の処理済みデータをBENTOで表示します。 左パネル:マウスはアリーナの右レーンに向かって移動しています。ビヘイビアの注釈は、異なる色で表示されます。右パネル:マウスのナビゲートのδF/F0カルシウム信号。 この映画をダウンロードするには、ここをクリックしてください。
補足ファイル1:NoseconeRender.png。 3Dプリントされたノーズコーンがイソフルラン麻酔を行うためのヤスリがけ。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル2:HeadbarRender.png。 マウスのヘッド固定用のヘッドバー用のファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル3:HeadbarTechnicalDrawing.png。 マウスのヘッド固定用のヘッドバー用のファイル。 このファイルをダウンロードするには、ここをクリックしてください。
補足ファイル4:ArenaFig_Draft2.tiff。 臭気アリーナの詳細なレイアウト。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
このプロトコルは、臭気プルームをナビゲートするマウスの海馬のdCA1領域に場所細胞および臭気応答性細胞を記録する手順を細心の注意を払って概説しています。プロトコルの重要なステップには、定位固定装置手術、ミニスコープベースプレートの配置、臭気領域の構築、臭気アリーナのプルームのチェック、行動トレーニング、自由に動くマウスのミニスコープ記録、データの前処理、およびデータ分析が含まれます。さらに、このプロトコルは、dCA1記録からマウスの軌跡を解読するプロセスを説明しています。
脳定位固定術の重要なステップは、ブレグマに対する相対的な座標をたどって、GRINレンズを正しい位置に配置することです。この方法の限界は、手術とGCaMP6f信号の観察開始までの時間との間の遅延であり、これには2〜4週間かかる場合があります。マウスは、この重要な期間を過ぎると使用できるようになります。現在のプロトコルと以前のプロトコル24、25、26、27 との間の違いは、海馬にAAV-GCaMP6fウイルスを注入する代わりに、CA1で既にGCaMP6fを発現しているThy1-GCaMP6fマウスを使用していることである。手術中の時間を節約し、脳内でAAVウイルスが発現するまでの待ち時間を必要としません。さらに、このプロトコルは脳を吸引せず、ケタミン/キシラジンの代わりにイソフルランを使用するため、過剰摂取を防ぐための用量をより適切に制御できます。この方法の限界は、GRINレンズの光学収差により視野が制限されることです。ベースプレートの配置には、エレクトロウェッティングレンズを中央に置いて、ベースプレートをヘッドに接着した後のZプレートの調整が制限されないようにすることが重要です。臭気アリーナの建設の限界は、システムの複雑さであり、これには数か月かかることがあり、エンジニアの支援が必要になる場合があります。行動訓練の制限は、マウスが匂いの領域の一方の側を他方の側よりも好む可能性があることです。この問題を克服する 1 つの方法は、マウスが左右のレーンに向かって移動したことに対して報酬を与える代替試行を行うことです。
プルームをチェックするための重要なステップは、PID針を臭気源と位置合わせしてプルームの経路を検出することです。自由に動くマウスをミニスコープで記録する際の重要なステップは、タスク中にミニ同軸ワイヤーが絡まないようにすることですが、これは整流子で防ぐことができます。ヘリウムバルーンを使用して、ミニ同軸線がマウスの前に来るのを防ぐことができます。データの前処理では、臭気アリーナのデジタルトップカメラとミニスコープカメラのTTLパルスを同期させることが重要です。EXTRACTプロシージャでは、ROIとδF/F0信号をより適切に抽出するために、非負の処理を使用することをお勧めします。EXTRACTは、各ROIのトレースを視覚的に検査して、不良なものを除外します。人工ニューラルネットワークの学習を向上させるためには、マウスのX位置とY位置をROIからデコードして、数百のエポックを持つ大規模なデータセットを作成することが重要です。
この自由に動く記録法が既存の頭部固定法に比べて重要であるのは、複雑な臭気プルームをナビゲートするための適切な頭部の動きを伴う、動物学的に関連性のある文脈でのマウスの行動を研究することです。この方法は、複雑な匂い物質ナビゲーションにおけるdCA1ニューロンの動的役割を調査するために適用できます。さらに、この手順は海馬や嗅覚に限定されません。この技術の他の潜在的な応用には、LEDを使用して報酬レーンを示すことによる視覚ナビゲーションへの応用の可能性を含む、さまざまな脳領域と感覚モダリティの役割の研究が含まれます。さらに、この方法は、集団からの神経カルシウムの解読が神経刺激または感覚フィードバック20,34,35,36をトリガーするリアルタイムの閉ループ実験に適用できる可能性がある。
開示事項
著者は、利益相反を宣言しません。
謝辞
本研究は、米国国立衛生研究所(NIH UF1 NS116241およびNIH R01 DC000566)および米国国立科学財団(NSF BCS-1926676)の支援を受けた。著者は、Odor Arenaチャンバーの設立を支援してくれたAndrew Scallonに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| Arduino Micro | Arduino | Micro | |
| Biocompatible Methacrylate Resin | Parkell | S380 | C&B-Metabond Adhesive Luting Cement |
| Decoding Brain Signals Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Dental Drill | Osada | LHP-6 | AZ210015 |
| Dental Drill Box | Osada | XL-230 | 30000 rotations per minute |
| Digital stereotaxic instrument | Stoelting | 51730D | Mouse Stereotaxic Instument, #51904 Digital Manipulator Arm, 3-Axes, Add-On, LEFT |
| Drill Bit | FST Fine Science Tools | 19007-05 | Tip diameter 0.5 mm |
| Fast Digital Camera | Edmund Optics | BFS-U3-63S4C | FLIR Blackfly S |
| Focal Lens | Edmund Optics | C-Series | 3.5 mm |
| GRIN lens | Inscopix | 1050-004595 | 1 mm diameter and 4 mm length |
| GRIN lens Holder | UCLA | http://miniscope.org/index.php/Surgery_Protocol | |
| Liquid Tissue Adhesive | 3M | 1469C | Vetbond Tissue Adhesive |
| Low-Flow Anesthesia System for Mice | Kent Scientific Corporation | SomnoSuite | https://www.kentscientific.com/products/somnosuite/ |
| Low Toxicity Silicone Adhesive | WPI – World Precision Instruments | Kwik-sil | |
| miniPID Controller | ASI – Aurora Scientific Inc. | Model 200B | Fast-Response Miniature Photo-Ionization Detector |
| Miniscope V4 Holder | UCLA | NA | https://github.com/Aharoni-Lab/Miniscope-v4/tree/master/Miniscope-v4-Holder |
| Miniscope V4 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4 |
| Miniscope Base Plate V2 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4-base-plates-variant-2-pack-of-10 |
| Miniscope DAQ-QT software | UCLA | https://github.com/Aharoni-Lab/Miniscope-DAQ-QT-Software/wiki | |
| Motion Correction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Odor Arena Hardware | Custom Made | 3D Model | https://www.dropbox.com/scl/fo/lwtpqysnpzis32mhrx3cd/ADomsxyhxu42sqDmTBl2O6k?rlkey=b3l4809eradundt5l3iz0gq74& dl=0 |
| Odor Arena Software | CUAnschutz | https://github.com/wryanw/odorarena | |
| Odorant Isoamyl Acetate | Aldrich Chemical Co | 06422AX | Diluted at 1% in odorless mineral oil |
| RHD USB Interface Board | Intan Technologies | C3100 | Product discontinued. Alternatively use another equivalent board. |
| ROI Extraction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Sutter Micromanipulator | Sutter Instrument Company | MP-285 | |
| Synchronization Software | CU Anschutz | https://github.com/fsimoesdesouza/Synchronization | |
| Thy1-GCaMP6f mice | Jackson Laboratory | IMSR_JAX 028281 | C57BL/6J-Tg(Thy1-GCaMP6f)GP5.12Dkim/J) |
参考文献
- Adoff, M. D., Climer, J. R., Davoudi, H., Marvin, J. S., Looger, L. L., Dombeck, D. A. The functional organization of excitatory synaptic input to place cells. Nat Commun. 12 (1), 3558(2021).
- Radvansky, B. A., Oh, J. Y., Climer, J. R., Dombeck, D. A. Behavior determines the hippocampal spatial mapping of a multisensory environment. Cell Rep. 36 (5), 109444(2021).
- Lewis, S. M., et al. Plume dynamics structure the spatiotemporal activity of mitral/tufted cell networks in the mouse olfactory bulb. Front Cell Neurosci. 15, 633757(2021).
- Findley, T. M., et al. Sniff-synchronized, gradient-guided olfactory search by freely moving mice. ELife. 10, e58523(2021).
- Gire, D. H., Kapoor, V., Arrighi-Allisan, A., Seminara, A., Murthy, V. N. Mice develop efficient strategies for foraging and navigation using complex natural stimuli. Curr Biol. 26 (10), 1261-1273 (2016).
- Liu, A., Papale, A. E., Hengenius, J., Patel, K., Ermentrout, B., Urban, N. N. Mouse navigation strategies for odor source localization. Front Neurosci. 14, 218(2020).
- Tariq, M. F., et al. Using head-mounted ethanol sensors to monitor olfactory information and determine behavioral changes associated with ethanol-plume contact during mouse odor-guided navigation. eNeuro. 8 (1), (2021).
- Rigolli, N., Reddy, G., Seminara, A., Vergassola, M. Alternation emerges as a multi-modal strategy for turbulent odor navigation. ELife. (11), e76989(2022).
- Ma, M., et al. Sequential activity of CA1 hippocampal cells constitutes a temporal memory map for associative learning in mice. Curr Biol. 34 (4), 841-854 (2024).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nat Methods. 16 (1), 11-13 (2019).
- Aharoni, D., Hoogland, T. M. Circuit investigations with open-source miniaturized microscopes: Past, present and future. Front Cell Neurosci. 13, 141(2019).
- Flusberg, B. A., et al. High-speed, miniaturized fluorescence microscopy in freely moving mice. Nat Methods. 5 (11), 935-938 (2008).
- Connor, E. G., McHugh, M. K., Crimaldi, J. P. Quantification of airborne odor plumes using planar laser-induced fluorescence. Exp Fluids. 59 (9), 137(2018).
- Gumaste, A., et al. A Comparison between mouse, in silico, and robot odor plume navigation reveals advantages of mouse odor tracking. eNeuro. 7 (1), (2020).
- Gumaste, A., et al. Behavioral discrimination and olfactory bulb encoding of odor plume intermittency. ELife. 13, e85303(2024).
- Marin, A. C., Schaefer, A. T., Ackels, T. Spatial information from the odour environment in mammalian olfaction. Cell Tissue Res. 383 (1), 473-483 (2021).
- Eichenbaum, H. The role of the hippocampus in navigation is memory. J Neurophysiol. 117 (4), 1785-1796 (2017).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13 (11), 1433-1440 (2010).
- Wirtshafter, H. S., Disterhoft, J. F. In vivo multi-day calcium imaging of CA1 hippocampus in freely moving rats reveals a high preponderance of place cells with consistent place fields. J Neurosci. 42 (22), 4538-4554 (2022).
- Mizuta, K., Sato, M. Multiphoton imaging of hippocampal neural circuits: techniques and biological insights into region-, cell-type-, and pathway-specific functions. Neurophotonics. 11 (3), 033406(2024).
- Radvansky, B. A., Dombeck, D. A. An olfactory virtual reality system for mice. Nat Commun. 9 (1), 839(2018).
- Almeida-Santos, A. F., et al. Social isolation impairs the persistence of social recognition memory by disturbing the glutamatergic tonus and the olfactory bulb-dorsal hippocampus coupling. Sci Rep. 9 (1), 473(2019).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), e108697(2014).
- Thapa, R., Liang, B., Liu, R., Li, Y. Stereotaxic viral injection and gradient-index lens implantation for deep brain in vivo calcium imaging. J Vis Exp. (176), e63049(2021).
- Hsiao, Y. -T., Wang, A. Y. -C., Lee, T. -Y., Chang, C. -Y. Using baseplating and a miniscope preanchored with an objective lens for calcium transient research in mice. J Vis Exp. (172), e62611(2021).
- Zhang, L., et al. Miniscope GRIN lens system for calcium imaging of neuronal activity from deep brain structures in behaving animals. Curr Protoc Neurosci. 86 (1), e56(2019).
- Guo, D., Gürkan Özer, A., Uusisaari, M. Y. In vivo calcium imaging in mouse inferior olive. J Vis Exp. (172), e62222(2021).
- Yun, M., Shin, J., Jung, M. W. Protocol for calcium imaging of dorsal and ventral CA1 neurons in head-fixed mice. STAR Protoc. 4 (3), 102439(2023).
- Yun, M., Hwang, J. Y., Jung, M. W. Septotemporal variations in hippocampal value and outcome processing. Cell Rep. 42 (2), 112094(2023).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. J Neurosci Methods. 291, 83-94 (2017).
- Inan, H., et al. Fast and statistically robust cell extraction from large-scale neural calcium imaging datasets. bioRxiv. , (2021).
- Segalin, C., et al. The mouse action recognition system (MARS) software pipeline for automated analysis of social behaviors in mice. ELife. 10, e63720(2021).
- Chen, Z., et al. A hardware system for real-time decoding of in vivo calcium imaging data. ELife. (12), e78344(2023).
- Xue, F., et al. Multi-region calcium imaging in freely behaving mice with ultra-compact head-mounted fluorescence microscopes. Natl Sci Rev. 11 (1), nwad294(2024).
- Tabourin, L., Bretzner, F., Galstian, T. Towards a mini-endoscope design with spatially selective excitation and imaging. Biomed Opt Express. 15 (3), 1750-1760 (2024).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved