Method Article
Минископ регистрирует сигналы кальция в гиппокампе мышей, ориентирующихся по шлейфу запаха
В этой статье
Резюме
Этот протокол исследует взаимосвязь между мозгом и поведением в гиппокампе CA1 у мышей, ориентирующихся по шлейфу запаха. Мы предоставляем пошаговый протокол, включающий хирургическое вмешательство для доступа к визуализации гиппокампа, поведенческую тренировку, запись и обработку мозга с помощью минископа GCaMP6f, а также поведенческие данные для декодирования положения мыши по нейронной активности ROI.
Аннотация
Мыши ориентируются в шлейфе запаха со сложной пространственно-временной структурой в темноте, чтобы найти источник пахучих веществ. В данной статье описан протокол мониторинга поведения и регистрации переходных процессов Ca2+ в дорсальных нейронах пирамидального слоя CA1 в гиппокампе (dCA1) у мышей, перемещающихся по шлейфу запаха на арене запаха размером 50 см x 50 см x 25 см. Эпифлуоресцентный минископ, сфокусированный через линзу с градиентным индексом (GRIN), визуализировал транзиентыCa2+ в нейронах dCA1, экспрессирующих кальциевый сенсор GCaMP6f у мышей Thy1-GCaMP6f. В статье описан поведенческий протокол для обучения мышей выполнению этой задачи навигации по запаховому шлейфу на автоматизированной арене запахов. Методы включают в себя пошаговую процедуру операции по имплантации линзы GRIN и установку опорной пластины для визуализации GCaMP6f в CA1. В статье представлена информация об отслеживании положения мыши в режиме реального времени для автоматизации начала испытаний и выдачи водного вознаграждения. Кроме того, протокол включает информацию об использовании интерфейсной платы для синхронизации метаданных, описывающую автоматизацию задачи навигации по запахам и время кадра для минископа и цифровой камеры, отслеживающей положение мыши. Кроме того, эти методы очерчивают конвейер, используемый для обработки флуоресцентных фильмов GCaMP6f, путем коррекции движения с использованием алгоритма NorMCorre с последующей идентификацией интересующих областей с помощью EXTRACT. Наконец, в статье описывается подход искусственной нейронной сети к декодированию пространственных путей из активности нейронного ансамбля CA1 для прогнозирования навигации мыши по шлейфу запаха.
Введение
Несмотря на значительный прогресс, достигнутый в понимании нейронных цепей, участвующих в обонятельной навигации у мышей с фиксированной головой 1,2,3 и стратегий навигации у свободно движущихся мышей 4,5,6,7,8, роль нейронных цепей в этологически значимой свободно движущейся навигации турбулентных запаховых шлейфов до сих пор неизвестна. В данной статье описывается мониторинг нейронной активности путем визуализации транзиентовCa2+ в клетках, экспрессирующих генетически кодируемый кальциевый сенсор GCaMP6f у мышей Thy1-GCaMP6f9 с целью изучения того, играет ли роль последовательная нейронная динамика дорсальных нейронов пирамидального слоя CA1 в гиппокампе (dCA1) в навигации по шлейфу запаха. Методы позволяют получить информацию о флуоресценции, полученной с помощью миниатюрного эпифлуоресцентного микроскопа, сфокусированного через линзу GRIN на dCA1 10,11,12. Методы объясняют, как одновременно контролировать пространственную навигацию и переходные процессы кальция dCA1-нейрона GCaMP6f у мышей, выполняющих навигационную задачу по запаху-шлейфу, где они получали водное вознаграждение, когда достигали носика, доставляя одорант на пахотную арену с фоновым ламинарным потоком воздуха13,14. В данной статье описаны методы, необходимые для решения этой задачи (рис. 1), включая стереотаксическую хирургию для имплантации линз с градиентным индексом (GRIN), размещение опорной пластины для крепления минископа к черепу в свободно движущейся мыши, визуализацию с помощью миниатюрного микроскопа и мониторинг движения мыши с помощью высокоскоростной цифровой камеры, предварительную обработку данных для удаления артефактов движения и поиска областей интереса (ROIs). а также подготовка наборов данных и обучение и прогнозирование искусственных нейронных сетей для декодирования положений мыши по X и Y на арене запаха по изменениям флуоресценции в ROI dCA17.
Запись сигналов кальция в области CA1 гиппокампа мышей, ориентирующихся по запаховому шлейфу, имеет отношение к пониманию вычислений нейронных цепей, связанных с обонянием и пространственной информацией в сложной поведенческой задаче навигации по запаху-шлейфу 2,14,15,16. Область CA1 гиппокампа играет роль в пространственной навигации и имеет решающее значение для создания когнитивной карты окружающей среды для эффективной навигации17,18. Запись сигналов кальция с помощью минископа является ценным способом исследования нейронов CA1, которые кодируют пространственную информацию во время навигации по запаховому шлейфу.
Этот метод сочетает в себе преимущества технологии минископа для регистрации кальциевых сигналов GCaMP с хорошо известной ролью гиппокампа CA1 в пространственной навигации для лучшего понимания того, как нейронные цепи управляют сложным поведением. В качестве альтернативы, подходы с использованием двухфотонной микроскопии могут регистрировать нейроны CA1 9,20, что требует фиксации головы мыши и ограничивает возможность свободного перемещения для навигации по пахучему шлейфу21. Электрофизиологические записи нейронов CA1 в локальном поле позволяют исследовать свободно движущихся мышей, ориентирующихся по запаховым шлейфам22. Тем не менее, локальные полевые электрические сигналы накладывают ограничения на оценку внутриклеточного возбуждения путем выделения единичных сигналов с помощью методов сортировки спайков. Сигналы минископа позволяют надежно идентифицировать ROI, непосредственно связанные с внутриклеточными сигналами кальция10,11 для точного исследования нейронных вычислений с разрешением одной клетки. Технология минископа предоставляет уникальную возможность лучше понять, как область CA1 кодирует пространственную информацию на основе сигналов запаха.
Кроме того, этот метод исследует, как конкретные нейронные популяции обрабатывают информацию о запахе для навигации, а также взаимосвязь между паттернами активности нейронов и принятием решений во время отслеживания запахового шлейфа. Этот метод может способствовать лучшему пониманию того, как мозг обрабатывает запах и пространственную информацию. Несмотря на то, что минископы обеспечивают одноклеточное разрешение для записи свободно движущегося мозга мыши, они требуют специализированной хирургии и опыта анализа данных. В этой статье мы предоставляем всеобъемлющий протокол, который помогает исследователям пройти через каждый шаг для изучения нейронных механизмов навигации по запаху и шлейфу.
Задача навигации по запахам является многообещающей основой для изучения нейронного кодирования и пространственной памяти сигналов обоняния у мышей. Результаты работы указывают на то, что можно расшифровать траекторию движения мыши по пахучему шлейфу на основе сигналов кальция нейронного ансамбля в dCA1. Понимание роли сигналов кальция dCA1 в навигации по запаховому шлейфу является важным шагом на пути к разрушению нейронной сети для навигации по запахам в реалистичных условиях13,14.
протокол
Исследования проводились на 3-6-месячных самцах и самках трансгенных мышей Thy1-GCaMP6f23. Все экспериментальные протоколы были одобрены Комитетом по уходу за животными и их использованию Медицинского кампуса Аншутц Университета Колорадо в соответствии с рекомендациями Национальных институтов здравоохранения. Хирургические процедуры по имплантации линзы GRIN (раздел 1) и установке опорной пластины (раздел 2) были адаптированы из предыдущих работ 9,24,25,26,27,28,29.
1. Стереотаксическая хирургия по имплантации линзы GRIN в гиппокамп
- Наденьте стерильные перчатки, головной убор, хирургическую маску и лабораторный халат.
- Используйте стерильные условия во время всех операций по выживанию. Стерилизуйте все хирургическое оборудование методом автоклавирования.
- Наложите стерильные простыни вокруг операционной области.
- Обезболите мышь, поместив ее в индукционную камеру с 3% изофлураном на 10 мин. Введите подкожно основание бупренорфина в полимере в дозе 0,001 мг/г во время индукции анестетика.
- Проверьте, не перестает ли мышь двигаться и находится ли она под глубоким наркозом, подтверждается щипком задней лапы, чтобы проверить рефлекс задней лапы.
- Переключите поток изофлурана на носовой конус (Дополнительный файл 1).
- Убедитесь, что в системе анестезии с низким потоком изофлурана для мышей (Таблица материалов) температурная площадка настроена на гомеотермические настройки, а источник пара настроен на внешнее сжатие.
- Поместите мышь под наркозом в цифровой стереотаксический инструмент (Таблица материалов). Поместите передние зубы мыши в прикусочную планку и поместите носовой конус перед носом, чтобы обеспечить поток изофлурана и зафиксировать голову на месте. Отрегулируйте уровень анестезии до 2%-3% в зависимости от рефлекса лапы после защемления (Рисунок 2A).
- Поместите ушные планки мыши в уши и затяните их. Убедитесь, что головка мыши расположена горизонтально и не перемещается из стороны в сторону или вверх и вниз. Когда голова надежно закреплена, убедитесь, что легкое нажатие на череп не приведет к тому, что череп выскользнет из-под перекладины.
- Поместите температурный зонд в прямую кишку и примотайте провод к хвосту мыши, чтобы избежать движения. Установите температуру прокладки так, чтобы ректальная температура поддерживалась на уровне 37 °C.
- Добавляйте офтальмологическую мазь в глаза, чтобы предотвратить вредное пересыхание воздуха.
- Брейте волосы, когда голова зафиксирована и находится под потоком изофлурана, обеспечиваемым носовым конусом, чтобы предотвратить движение. Сбрейте волосы над головой с помощью электробритвы, затем удалите оставшиеся волосы с помощью средства для удаления волос и стерильных аппликаторов с хлопчатобумажным наконечником (Рисунок 2B).
- Сделайте операционное поле стерильным, протерев кожу головы стерильным аппликатором из дерева с ватным наконечником этанол и бетадин по три раза каждый.
- Введите 0,1 мл местного анестетика лидокаина подкожно (S.Q.) под кожу между глазами и ушами с помощью иглы 29 G. В результате образуется пузырь. Подождите несколько минут, прежде чем срезать кожу ножницами.
- Используя технику «только кончики», осторожно подтяните кожу вверх с помощью щипцов и с помощью маленьких ножниц удалите круглую часть кожи. Всасьте любую кровь стерильным ватным тампоном.
- Как только кровотечение остановится, очистите череп перекисью водорода (5%) с помощью стерильного ватного тампона. Убедитесь, что костные ориентиры, включая сагиттальный шов и пересечение брегматических швов для обозначения брегмы, легко идентифицируются после этой процедуры.
- Убедитесь, что череп плоский относительно стереотаксического аппарата, убедившись, что брегма и лямбда находятся точно в одной и той же координате Z. Выполните это, поместив иглу в руку манипулятора и проверив, находится ли кончик иглы в одной и той же координате Z при прикосновении к обоим швам. В противном случае отрегулируйте угол наклона головки, переместив планку прикуса в Z-пластине и повторяя процедуру до тех пор, пока навык не окажется в плоском положении.
- Приложите пипетку к микроманипулятору, держа иглу, для нанесения чернил на татуировку. Сделайте отметку на верхней части брегмы.
- Обнулите координаты микроманипулятора на брегме и переместитесь к координате выше CA1 в правом гиппокампе (средне-латеральный +1,8 мм от брегмы, передне-задний -2,4 мм от брегмы)2. Именно это место выбрали Радванский и Домбек для изучения виртуальной навигации по градиенту запахов у мышей18,30. Осторожно просверлите небольшую постоянную вмятину диаметром 1 мм с помощью сверла (Таблица материалов) на 10000 оборотов, чтобы сделать постоянную вмятину в верхней части целевого места (Рисунок 2C).
- С помощью бормашины откройте круглую перфорацию диаметром 1,5 мм, чтобы можно было вживить линзу GRIN диаметром 1 мм и длиной 4 мм в мозг (Таблица материалов) (Рисунок 2D).
- Проколите твердую мозговую оболочку и кору головного мозга, вставив иглу 23 G в середину отверстия и медленно перемещая иглу в мозг (~0,1 мм/мин), пока она не достигнет глубины 1,25 мм ниже твердой мозговой оболочки. Медленно извлеките иглу из мозга (~0,1 мм/мин). Используйте стерильные ватные палочки и физраствор для очистки крови.
- Используйте изготовленный по индивидуальному заказу держатель линз GRIN от Калифорнийского университета в Лос-Анджелесе, состоящий из двух наконечников микропипеток объемом 1 мл, обрезанных по размеру друг в друга (держатель линз GRIN, Таблица материалов) (рис. 2E, F).
- Подключите держатель линзы GRIN к микроманипулятору и включите аспиратор, подключенный к пипетке, чтобы удерживать линзу GRIN. Давление воздуха, создаваемое всасыванием воздуха, удерживает линзу GRIN на месте.
- Используйте линзу GRIN длиной 4 мм и диаметром 1 мм. Медленно имплантируйте линзу GRIN в кору головного мозга, пока она не достигнет глубины -1,25 мм ниже твердой мозговой оболочки.
- Поместите каплю жидкого тканевого клея (Таблица материалов) в круглую перфорацию черепа, чтобы запечатать отверстие. Подождите несколько минут, чтобы высохнуть.
- Приготовьте быстродействующий адгезивный цемент - биосовместимую метакрилатную смолу - (Таблица материалов) на основании линзы GRIN, чтобы навсегда запечатать ее на черепе. Подождите несколько минут и дайте ему высохнуть.
- Выключите аспиратор, чтобы отпустить, и медленно снимите держатель линзы GRIN с верхней части линзы GRIN, которая в этот момент постоянно прикреплена к черепу.
- Поместите перекладину для головы на верхнюю часть черепа, центрируя отверстие на линзе GRIN (Рисунок 2G-I) (Дополнительный файл 2 и Дополнительный файл 3).
- Осторожно нанесите быстросохнущий клейкий цемент (Таблица материалов) вокруг основания линзы GRIN, чтобы закрыть черепное окно и прикрепить перекладину для головы к черепу. Поместите высыхающий клейкий цемент (Таблица материалов) в середину перекладины для головы и по бокам, чтобы он плотно фиксировался на черепе. Убедитесь, что он полностью высох. Убедитесь, что на верхнюю часть линзы GRIN не нанесен клейкий цемент; В противном случае это приведет к необратимому ухудшению оптического пути и блокировке изображения.
- Нанесите каплю низкотоксичного силиконового клея (Таблица материалов) на верхнюю часть линзы GRIN для защиты от физических повреждений.
- Выключите прием изофлурана
- Осуществляйте немедленное послеоперационное наблюдение до тех пор, пока животное не придет в себя после анестезии.
- Принимайте послеоперационный уход до полного восстановления после операции, наблюдая за мышами на предмет признаков боли. Не стоит возвращать животное, перенесшее операцию, в компанию других животных.
- Кратковременно наблюдайте за передвижением по клетке, едой и питьем, а также за нормальными реакциями на обращение, чтобы убедиться, что они не испытывают боли или стресса.
- Если у животных проявляются признаки серьезного неврологического или тканевого повреждения, немедленно гуманно усыпьте их.
2. Размещение опорной пластины для минископа
ПРИМЕЧАНИЕ: Процедуры по фиксации головы мыши начинаются через 2 недели после того, как животное полностью восстановится после операции. Процедура визуализации dCA1 начинается через 3 недели после операции после того, как животное полностью выздоровеет и сигнал GCaMP6f станет хорошо различимым. В верхней части линзы GRIN закреплена опорная пластина для оптического доступа флуоресценции dCA1 GCaMP6f через линзу GRIN с помощью минископа. В этом протоколе использовался miniscope версии 4 -V4 (Miniscope V4; Таблица материалов).
- Начните фиксировать голову мыши в течение 10 минут, закрепив головную планку зажимами, чтобы приспособить мышь к фиксации головы через 2 недели после операции.
- Головка мыши фиксируется через 3 недели после операции для установки опорной пластины.
- Прикрепите минископ к напечатанному на 3D-принтере держателю, прикрепленному к микроманипулятору (Таблица материалов), прикрепленному к микроманипулятору (рис. 3A, B).
- Осторожно удалите силиконовый клей (Таблица материалов) с верхней части линзы с помощью тонкого пинцета и очистите поверхность линзы GRIN салфеткой для линз.
- Закрепите опорную пластину, прикрепленную к минископу, затянув установочный винт сбоку от опорной пластины (Таблица материалов) (Рисунок 3C, D).
- Переместите конец минископа до тех пор, пока он не достигнет 100 μм над линзой GRIN.
- Используйте ползунки для настройки параметров минископа в программном обеспечении минископа (Таблица материалов), следуя шагам с 2.8 по 2.10.
- Нажмите на ползунок « Мощность» в программном обеспечении, чтобы контролировать мощность и поддерживать ее на уровне около 10%.
- Нажмите на ползунок «Скорость захвата » и удерживайте его в районе 10 Гц.
- Минископ v4 имеет линзу с электросмачиванием, которую можно использовать для точной фокусировки. Нажмите на ползунок «Фокус», чтобы установить его на 50%, чтобы электросмачивающий объектив оставался в середине диапазона фокусных расстояний.
- Используйте программное обеспечение для просмотра верхней части линзы GRIN. На экране можно увидеть круглую форму линзы GRIN.
- Приблизьте минископ к объективу ГРИН, отрегулировав осевое положение с помощью микроманипулятора, и контролируйте изображение с помощью компьютера.
- Как только верхняя часть линзы GRIN станет видимой, используйте тонкую фокусировку вверх и вниз на микроманипуляторе, чтобы достичь наилучшей фокальной плоскости для визуализации ячеечных вспышек. Используйте настройку псевдо δF/F0 в программном обеспечении, чтобы перепроверить качество мигания ячеек.
- Установите фокус таким образом, чтобы в поле зрения оставалось максимальное количество ячеек с максимально достижимой интенсивностью флуоресценции. На этом этапе убедитесь, что кровеносные сосуды находятся в фокусе.
- Может случиться так, что у мыши отсутствуют переходные кальциевые сигналы-вспышки. В этом случае избегайте следующих шагов (14-16) и проверьте мышь снова в течение следующих недель, чтобы перепроверить, возникают ли переходные сигналы кальция.
Примечание: Решение об эвтаназии мыши может быть принято, если транзиторные кальциевые сигналы никогда не проявляются в течение 2 месяцев после операции. - После того, как фокус будет оптимизирован, осторожно соорудите стену из быстродействующего клеевого цемента между черепом и нижней частью опорной пластины. Будьте осторожны, чтобы не закрепить минископ на опорной пластине, и будьте очень осторожны, чтобы цемент не попал на верхнюю часть линзы GRIN.
- Как только цемент высохнет, снимите установочный винт и осторожно снимите минископ с опорной плиты с помощью микроманипулятора.
- Используйте крышку опорной пластины для защиты линзы GRIN.
3. Строительство пахучей арены
ПРИМЕЧАНИЕ: Этот метод очерчивает автоматизированную арену запаха, основанную на проектах Connor et al.13 и Gumaste et al.14. Полную сборку можно найти по ссылке в Таблице материалов (Дополнительный файл 4).
- Постройте камеру размером 50 см (Д) x 50 см (Ш) x 25 см (В) с 2 акриловыми стенами, акриловым потолком, белым полом из пенополивинилхлорида (ПВХ) и 2 уникальными стенами спереди и сзади, которые способствуют потоку воздуха (Рисунок 4A).
- Установите всасывающий узел в задней части арены с конической конструкцией и прикрепленным компьютерным вентилятором для вытягивания воздуха из камеры. Используйте физическую ручку для установки широтно-импульсной модуляции вентилятора (ШИМ) для регулирования скорости потока воздуха.
ПРИМЕЧАНИЕ: Напечатанная на 3D-принтере сотовая структура включает в себя стенки спереди и сзади зоны для защиты от запаха, чтобы облегчить ламинарный поток воздуха, сохраняя при этом мышь внутри10. Сотовая стена в передней части арены имеет внешний расширитель для приема больших объемов воздуха без прерывания работы. - Настройте систему подачи воды для доставки воды с помощью простых приспособлений с шаговым двигателем Nema 17, соединенным со шприцем. Микрошаговый драйвер A4988 позволяет точно контролировать выдаваемый объем (https://github.com/dougollerenshaw/syringe_pump, Рисунок 4B).
- Установите воздухозаборник с 4 комплектами источников запаха в паре с водоотводными трубами, каждый из которых расположен на расстоянии 10 см друг от друга по оси X, чтобы определить «дорожки», по которым животное будет перемещаться в поисках водного вознаграждения (рис. 4C, D).
- Установите систему доставки запаха, управляемую электромагнитными клапанами, подключенными к трубкам и бутылкам с запахом (рис. 4D).
ПРИМЕЧАНИЕ: Клапаны питаются от релейной платы в компоновке, которая гарантирует, что чистый воздух или одорированный воздух поступает постоянно, и что либо одна, либо нулевая полоса могут получать одорированный воздух в любой момент времени. Комплект из пяти электромагнитных клапанов 12 В управляется с помощью релейной платы, содержащей 4 реле. Когда все 4 реле установлены в положение «выключено», клапан чистого воздуха по умолчанию открыт. Когда открывается любой клапан с одним запахом, клапан чистого воздуха автоматически закрывается. Управление состоянием релейной платы осуществляется с помощью цифровых выходов от основного контроллера Arduino. Аквариумный воздушный насос потребительского класса подает воздух, который ограничен до 20 мл/мин с помощью ручного регулятора расхода воздуха. Используя ряд трубок и сплиттеров внутреннего диаметра 1/16 дюйма, подающая линия подает чистый воздух на каждый из электромагнитных клапанов. Обратные клапаны до и после одоранта гарантируют направление потока воздуха. Линия чистого воздуха сливается с линиями одоранта перед подачей на арену, чтобы гарантировать продувку одорированного воздуха при закрытии линий запаха. - Установите над ареной быструю цифровую камеру для наблюдения за поведением животных (Таблица материалов).
ПРИМЕЧАНИЕ: Поведение животных контролируется с частотой 60 Гц с помощью одной быстрой цифровой камеры, установленной над ареной (Таблица материалов). Объектив с фиксированным фокусным расстоянием 3,5 мм серии C был установлен с помощью адаптера крепления C/CS, способного захватывать всю арену (Focal Lens, Table of Materials). - Используйте пользовательский код Python для управления оборудованием арены с запахом (Таблица материалов). Программное обеспечение объединяет камеру и все оборудование, необходимое для настройки экспериментальных параметров и получения экспериментальных данных (Таблица материалов).
- Настройте ПК, подключенный к плате разработки Teensy 4.0, чтобы обеспечить средства для компьютерной доставки запахов и воды (Odor Arena Hardware and Software, Table of Materials).
- Настройте цифровую камеру для экспорта тактового сигнала при записи видеокадров. Сигнал используется для последующей синхронизации с минископом с помощью интерфейсной платы USB (Table of Materials), которая записывает сигналы синхронизации от обеих систем.
ПРИМЕЧАНИЕ: Во время эксперимента программное обеспечение для сбора данных также создает файл событий, содержащий важные события эксперимента и кадр камеры, на котором произошло событие. Файл временных меток также создается для идентификации любых пропущенных кадров, что является редким событием (Odor Arena Software, Table of Materials).
4. Измерение скорости воздуха шлейфа с помощью фотоионизационного детектора (ПИД) ( Рисунок 5)
ПРИМЕЧАНИЕ: Этот метод определяет временной ход шлейфа запаха с помощью ПИД, который подвергает газообразный одорант воздействию ультрафиолетового света высокой интенсивности, ионизирующего молекулы одоранта. На выходе устройства обнаруживаются молекулы одоранта в шлейфе запаха. Этот метод позволяет оценить скорость воздуха в области запаха путем сравнения задержки для обнаружения присутствия одорантов, проходящих через два места, с помощью PID.
- Разместите быстродействующий миниатюрный ПИД на двух разных расстояниях. Одно место находится близко, а другое - далеко -10 см друг от друга- от источника запаха.
- Переведите переключатель GAIN на передней панели ПИД-регулятора в положение x5.
- Переведите переключатель PUMP на передней панели ПИД-регулятора в положение Высоко.
- Проверьте индикатор состояния светодиодов (LED), показывающий выход датчика (напряжения) на передней панели контроллера при отсутствии одорантов.
- Переключите потенциометр OFFSET для обнуления выходного напряжения при отсутствии одорантов.
- Откройте клапан запаха на арене запаха.
- Измерьте задержку в обнаружении шлейфа запаха с помощью ПИД в каждом месте после открытия клапана. Эта процедура может быть выполнена в автономном режиме путем одновременной записи выходного сигнала ПИД и выхода клапана, зарегистрированного на арене запаха (запах включен) с помощью интерфейсной платы (Table of Materials).
- Разделите разницу в задержках в каждом месте на разницу в расстоянии между двумя PID, чтобы рассчитать воздушную скорость шлейфа.
5. Поведенческая тренировка мыши в области запаха ( Рисунок 6)
ПРИМЕЧАНИЕ: В этом разделе описывается поведенческая задача, адаптированная из Findley et al.4. Мышь ограничивают в воде накануне, чтобы мотивировать ее к поиску водной награды. Мышь направляет шлейф запаха (рис. 6B) к водяному носику, расположенному в источнике выделения запаха, для получения водного подкрепления (3 капли по 10 мкл с частотой 1 Гц). В период обучения мышь находится под ограничением воды, имея доступ к 2 мл в день. Масса тела мыши контролируется в период ограничения потребления воды и не должна быть ниже 85% от исходной массы тела. Мышь получает примерно 1 мл воды в день во время тренировки на арене запаха и дополняется дополнительным 1 мл воды в день в клетке после тренировки. Мышь остается под водой в течение максимум 72 часов. Специальное программное обеспечение (Table of Materials) определяет местоположение мыши в режиме реального времени (60 Гц) с помощью простого метода вычитания фона и локализации блобов. Пользователь вручную задает границы полосы движения, домашнюю границу (начальное местоположение для мыши в задней части арены) и целевую границу (рядом с источником запаха спереди). Кроме того, пользователь может решить, как программное обеспечение использует эти границы. Например, пользователь может издавать запахи только тогда, когда мышь находится за границей дома. Чтобы мышь получила награду, пользователь может потребовать, чтобы она оставалась в пределах одорированной полосы, пока она движется к цели (источнику запаха). Как только мышь пересечет целевую границу, она может получить награду. Однако во время обучения любое из этих требований корректируется путем простого редактирования файла 'yaml', разработанного так, чтобы он был понятен и удобен для пользователя.
- Во-первых, научите мышь начинать испытания, перемещаясь в заднюю часть арены (определяемую как часть арены, которая находится на расстоянии 40 см от стороны, где воздух поступает в камеру). Подождите, пока мышь уйдет в заднюю часть арены, а затем вручную доставляйте запах и воду по одной случайной полосе. Дайте мышке найти источник и выпить воды.
- Повторите эту процедуру много раз, чтобы создать ассоциацию между запахом и водой (рис. 6А, В). Как только мышь научится начинать пробные испытания, используйте автоматизированное программное обеспечение для доставки запахов.
- Обучите мышь выполнять задачу навигации по двум полосам запаха с помощью автоматизированного пользовательского программного обеспечения. В этой задаче случайным образом выберите один из двух отверстий для подачи запаха и укрепления мыши водой, когда она достигнет носика, куда подается одорант. В этом протоколе использовался одорант изоамилацетат, разведенный в дозе 1% в минеральном масле.
ПРИМЕЧАНИЕ: Мышь завершает сеанс из примерно 20 попыток навигации по запаховому шлейфу примерно за 40 минут. Мышь выполняет один сеанс в день. Обученная мышь достигает процента правильной навигации выше случайного выбора в конце сеанса (> 65% правильных выборов). Мышь должна достичь критерия > 65% правильных выборов в задаче двухполосной навигации по запаху после 3-5 сеансов обучения.
6. Эпифлуоресцентная запись свободно движущейся мыши на арене запаха
ПРИМЕЧАНИЕ: Метод описывает регистрацию нейронной активности клеток пирамидального слоя (SP) в дорсальном CA1 путем визуализации генетически кодируемого кальциевого сенсора GCaMP6f, экспрессируемого у мышей Thy19 , с помощью широкопольной визуализации в минископе во время задачи навигации по шлейфу запаха с двумя носиками (дополнительный фильм 1 и дополнительный фильм 2). Типичный сеанс визуализации занимает 40 минут, что позволяет мыши выполнить около 20 попыток навигации по запахам. Эта методика записывает мышь в течение нескольких месяцев.
- Головкой закрепите мышку, поместите минископ на верхнюю часть опорной пластины с помощью микроманипулятора и закрутите установочный винт.
- Отрегулируйте линзу для электросмачивания для поиска оптимальной фокальной плоскости с наибольшим количеством ячеек с наибольшей интенсивностью флуоресценции.
- Отрегулируйте мощность минископа для получения оптимального динамического диапазона с высоким соотношением сигнал/шум без насыщения. Это можно сделать с помощью визуализации дорсального CA1 у мышей Thy1-GCaMP6f с мощностью минископа, установленной на уровне около 30% при частоте регистрации 30 Гц.
- Отпустите мышь внутрь арены запаха, а минископ прикреплен к опорной пластине.
- Начните сбор данных с интерфейсной платы для записи транзисторно-транзисторного логического выхода (TTL) цифровой камеры, расположенной в верхней части арены, и сигнала TTL с минископа для последующей синхронизации между поведенческими кадрами и видеокадрами GCaMP6f. Цифровая камера записывает с частотой 60 Гц, а минископ — с частотой 30 Гц.
- Начните запись минископа и поведенческих фильмов и включите автоматизированное программное обеспечение для двух задач навигации по запаху носика.
7. Предварительная обработка данных
ПРИМЕЧАНИЕ: Этот метод использует конвейер MATLAB для обработки данных. Код доступен на GitHub (Synchronization Software, Table of Materials). NoRMCorre31 используется для коррекции движения, а EXTRACT32 используется для поиска ROI с изменяющимися во времени флуоресцентными сигналами, сообщаемыми как изменения флуоресценции, нормализованные флуоресценцией между кальциевыми переходными процессами (δF/F0).
- Синхронизируйте метаданные арены запахов, кадры цифровых камер и кадры минископа с помощью сигналов синхронизации, записанных интерфейсной платой, выполнив код MATLAB Synchronize_Files_JOVE.m, доступный на GitHub.
- Выполняйте коррекцию движения синхронизированных рамок минископа с помощью NoRMCorre (Motion Correction Software, Table of Materials).
- Найдите ROI с изменяющимися во времени сигналами δF/F0 с помощью EXTRACT (ROI Extraction Software, Table of Materials).
- Разделите данные на испытания (программное обеспечение для синхронизации, таблица материалов).
- Помечайте каждую попытку как попадание или промах в зависимости от правильного или неправильного навигационного поведения мыши.
- Используйте Behavior Ensemble и Neural Trajectory Observatory (BENTO)33 для визуализации поведения и ROI каждого отдельного испытания (рис. 7A, B и дополнительный фильм 3).
8. Анализ данных - Расшифровка пространственного положения по сигналам мозга
ПРИМЕЧАНИЕ: Этот метод использует машинное обучение для декодирования положений мыши по осям X и Y на арене из ROI dCA17. Код MATLAB (Decoding Brain Signals Software, Table of Materials) доступен по адресу https://github.com/restrepd/drgMiniscope.
- Введите выходной файл EXTRACT.mat и файл метаданных odor arena в программное обеспечение drgDecodeOdorArenav2.m. Репозиторий GitHub предоставляет эти два файла для примера (Synchronization Software, Table of Materials):
dFF_file='20220804_FCM22_withodor_miniscope_sync
_L1andL4_ncorre_ext.mat';
arena_file='20220804_FCM22withodor_odorarena_L1
andL4_sync.mat';
ПРИМЕЧАНИЕ: drgDecodeOdorArenav2.m создает набор данных, разделенный на данные внутри испытания, содержащий сигналы ROI и метаданные (положения мыши по осям X и Y, расположение носика запаха, подача воды и т. д.) для каждого испытания. Код также анализирует декодирование данных между испытаниями. Код использует fitrnet для обучения искусственной нейронной сети с данными δF/F0 для всех ROI для всех испытаний, кроме одного, для прогнозирования позиций X и Y и прогнозирования положения пропущенного испытания с помощью процедуры leave one out. - Нейронная сеть возвращает позиции X и Y в качестве выходных данных. Используйте обученную нейронную сеть для составления прогнозов. Входные данные не учитывали испытания, которые не использовались для обучения сети прогнозированию положений мыши по осям X и Y на арене на основе ROI (рис. 8A, B).
Результаты
Использование этой процедуры позволяет визуализировать и регистрировать переходные процессы флуоресценции dCA1 GCaMP6f у мышей, перемещающихся по области запахов для поиска источника запахов (Рисунок 6A, B, Дополнительный фильм 1 и Дополнительный фильм 2). Флуоресцентные изображения корректируются с помощью NoRMCorre, а для извлечения ROI используется EXTRACT. Кроме того, запись с помощью интерфейсной платы позволяет синхронизировать сигналы δF/F0 от ROI с событиями запаха и доставки воды на арене запаха (рисунок 7A), а также с движением мыши на арене запаха (рисунок 7B и дополнительный фильм 3). Репрезентативный результат навигации мыши по шлейфу запаха включает в себя большое количество переходных процессов кальция во время выполнения задачи (рис. 7A, B). Кроме того, можно проверить, как реакции кальция согласуются с присутствием запаха и вознаграждением за воду (рисунок 7A). Визуализация отдельных испытаний с использованием BENTO предоставляет информацию о реакциях кальция на разных этапах исследования, включая начало исследования, принятие решения, навигацию, питье и возвращение в конец арены (Рисунок 7B). Этот метод позволил получить ценную информацию о связи между реакцией кальция CA1 и поведением мышей во время задачи навигации, ориентированной на запахи.
Записи ПИД могут предоставить важную информацию о шлейфе запаха и скорости воздуха в шлейфе. Репрезентативный результат показывает увеличение отклика ПИД после открытия клапана для выпуска шлейфа запаха внутрь обонятельной арены (рис. 5A). Кроме того, протокол обеспечивает декодирование положений мыши по осям X и Y по сигналам δF/F0 ROI dCA1 (рис. 8). Этот метод предсказывает пространственное положение мыши во время задачи навигации по запаху-шлейфу на основе реакций CA1, что важно для лучшего понимания того, как нейроны CA1 обрабатывают запах и пространственную информацию. Расшифровка траектории движения мыши по сигналам кальция нейронного ансамбля в dCA1 имеет большое значение, поскольку она показывает, как нейроны в дорсальном CA1 представляют собой когнитивную карту одоранта и пространственной информации для выполнения сложной задачи навигации по запаховому шлейфу. Метод был расширен до различных ROI, которые ведут себя исключительно как клетки места и другие клетки, реагирующие на раздражитель запаха. Успешное декодирование траектории движения мыши по сигналам нейронного ансамбля может быть подтверждено сильной корреляцией между предсказанием декодирования и истинными позициями мыши по осям X и Y.
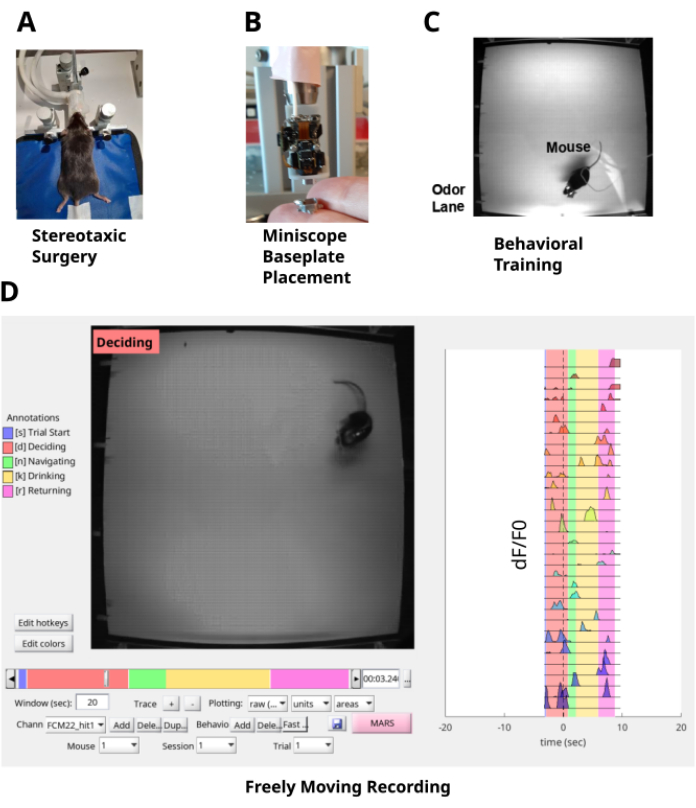
(А) Стереотаксическая хирургия заключается в имплантации линзы GRIN в слой CA1 гиппокампа и головной пластины на черепе для фиксации головы мыши. (B) Опорная пластина помещается в верхнюю часть линзы GRIN для обеспечения оптического доступа к флуоресценции нейронов CA1 с помощью минископа. (C) Мышь обучена выполнению задачи навигации по запаховому шлейфу. (D) Свободно движущаяся запись поведения мыши и нейронов CA1, перемещающихся по шлейфу запаха. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Стереотаксическая хирургия. (А) Поместите мышь, находящуюся под наркозом, в стереотаксический аппарат. Отрегулируйте уровень анестезии от 2 до 3% в соответствии с реакцией рефлекса щипковой лапы (B) Сбрейте шерсть над головой. (C) Осторожно просверлите небольшую постоянную вмятину с помощью дрели, чтобы сделать постоянную вмятину в верхней части целевого места. (D) С помощью бормашины откройте круглую перфорацию диаметром 1,5 мм, чтобы можно было вживить в мозг линзу GRIN диаметром 1 мм и длиной 4 мм. (E) Подсоедините держатель линзы GRIN к микроманипулятору и включите аспиратор, подключенный к пипетке, чтобы удерживать линзу GRIN. (F) Медленно имплантируйте линзу GRIN в кору головного мозга, пока она не достигнет глубины -1,25 мм ниже твердой мозговой оболочки. (G) Иллюстративная посмертная фиксированная голова с изображением головной пластины и опорной пластины, прикрепленных к черепу с помощью имплантированной линзы GRIN. (H) Посмертная компьютерная томография головы, иллюстрирующая головную планку в верхней части черепа и линзу ГРИН, имплантированную внутрь черепа. (I) Конструкция накладки на голову таким образом, чтобы можно было закрепить голову мыши. Животное на этом изображении без драпировки, чтобы облегчить улучшенную анатомическую визуализацию. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Размещение опорной плиты минископа. (A) Напечатанный на 3D-принтере держатель минископа, соединенный с микроманипулятором. (B) Минископ прикреплен к держателю. (C) Прикрепление опорной пластины к минископу. (D) Закручивание установочного винта для крепления опорной плиты к минископу. Установочный винт освобождается после приклеивания опорной пластины к черепу мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4. Строительство пахнущей арены. (А) Пахнущая арена прозрачной камерой. Есть топовая цифровая камера для записи поведения мыши. (B) Шаговые двигатели, соединенные со шприцами, контролируют подачу воды, чтобы вознаградить мышь. (C) Вид изнутри арены запаха, показывающий сотовую структуру, используется для создания ламинарного потока и четырех линий подачи запаха. (D) Система доставки запаха, включая трубки, клапаны и бутылки с запахом, видимые снаружи области запаха. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 5: Регистрация шлейфа запаха. (A) Шлейф запаха, зарегистрированный с помощью фотоионизационного детектора (PID). Среднее (жирный синий)±Стандартное отклонение (светло-голубой) пяти ПИД-следов запахового шлейфа, распространяющегося со скоростью 4,23 см/с в области запаха. Источник запаха на расстоянии 2 см от пола арены. Сенсорная головка ПИД подает сигнал напряжения на концентрацию газа в шлейфе запаха. (B) Лазерная регистрация запахового шлейфа с неограниченным потоком со скоростью 20 см/с. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Поведенческая тренировка мыши. (А) Мышь учится ориентироваться в направлении запахового шлейфа, выпущенного на правой полосе. Мышь учится начинать испытание, поднимаясь в заднюю часть арены запаха, выбирает сторону, с которой можно двигаться к шлейфу запаха, и пьет воду в награду. (B) Мышь учится ориентироваться в направлении запахового шлейфа, выпущенного на левую полосу. Мышь вознаграждается запахом, если она движется по правильной полосе. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
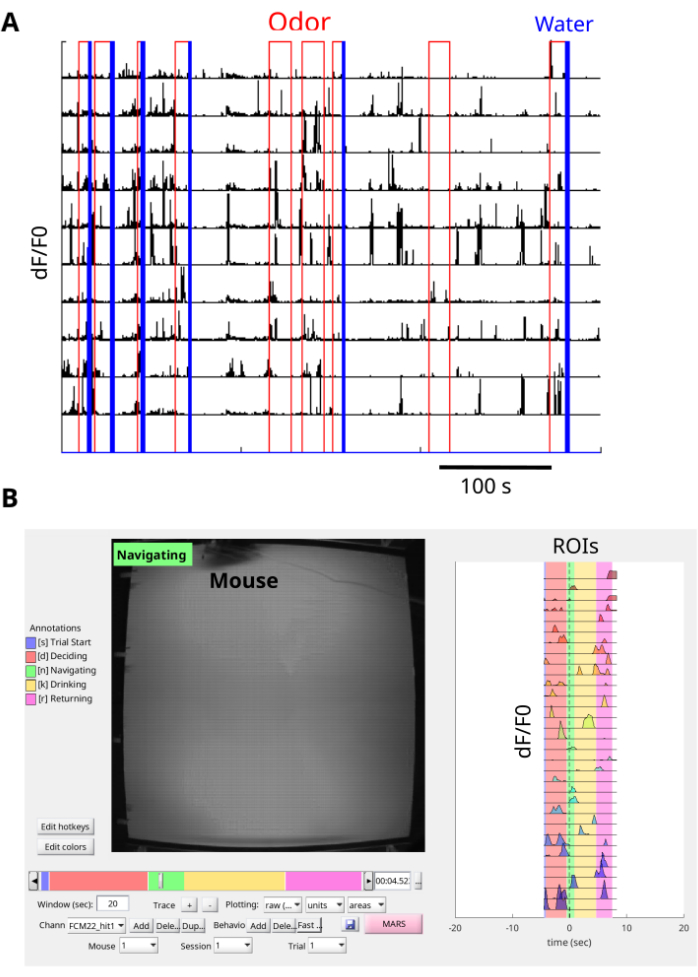
Рисунок 7: Предварительная обработка данных. (A) Кальциевые следы синхронизированы с событиями на арене запаха для многих испытаний. Каждое испытание начинается с подачи запаха красным цветом, а вознаграждаемые испытания заканчиваются импульсом подачи воды синим цветом. Кривые кальция δF/F0 (безразмерные) для каждого ROI показаны черным цветом. Каждая строка указывает на ROI. Интерфейсная плата используется для записи выходов TTL верхней камеры на арене запаха, а камера минископа — для синхронизации кадров. NorMCorre используется для коррекции шума движения от рамок минископа, а EXTRACT используется для поиска ROI и извлечения следов кальция δF/F0. (B) Репрезентативное однократное испытание мыши, перемещающейся по шлейфу. С помощью BENTO наблюдается одновременная визуализация синхронизированного поведения (левая панель) и следов кальция δF/F0 (правая панель) из каждого ROI одного исследования. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 8. Расшифровка положения мыши по сигналам CA1. Декодирование положения мыши по осям X и Y из ROI CA1. Прогноз декодирования отображается синим цветом, а истинное положение мыши на земле — красным. Прогнозируемые следы сильно коррелируют с наземной правдой. (A) Расшифровка позиций X из ROI (коэффициент корреляции Пирсона = 0,88). (B) Расшифровка позиций по оси Y из ROI (коэффициент корреляции Пирсона = 0,88). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительный фильм 1: Репрезентативный пример синхронизированных поведенческих кадров и кадров минископа, на которых мышь движется к запаховому шлейфу в левой полосе. (А) Поведенческие рамки мыши, носящей минископ и перемещающейся внутри области запахов. (B) Рамки минископа мыши, показывающие необработанные переходные процессы кальция, зарегистрированные через линзу GRIN. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный фильм 2: Репрезентативный пример синхронизированных поведенческих кадров и кадров минископа, на которых мышь движется к шлейфу запаха в правой полосе. (А) Поведенческие рамки мыши, носящей минископ и перемещающейся внутри области запахов. (B) Рамки минископа мыши, показывающие необработанные переходные процессы кальция, зарегистрированные через линзу GRIN. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный фильм 3: BENTO отображение обработанных данных о поведении мыши и сигналах мозга. Левая панель: мышь перемещается по правой полосе на арене. Аннотации поведения отображаются разными цветами. Правая панель: δF/F0 кальциевые сигналы навигации мыши. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный файл 1: NoseconeRender.png. Файл для напечатанного на 3D-принтере носового конуса для проведения изофлурановой анестезии. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 2: HeadbarRender.png. Напильник для головной планки для фиксации головы мыши. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 3: HeadbarTechnicalDrawing.png. Напильник для головной планки для фиксации головы мыши. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный файл 4: ArenaFig_Draft2.tiff. Подробный макет пахнущей арены. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Обсуждение
В этом протоколе подробно описаны шаги по регистрации клеток места и чувствительных к запаху клеток в области dCA1 гиппокампа мышей, ориентирующихся по шлейфу запаха. Важнейшие этапы протокола включают стереотаксическую хирургию, установку опорной пластины минископа, построение области запаха, проверку шлейфа в области запаха, поведенческую тренировку, запись свободно движущейся мыши с помощью минископа, предварительную обработку данных и анализ данных. Кроме того, протокол объясняет процесс декодирования траектории мыши по записям dCA1.
Важным этапом стереотаксической хирургии является следование координатам относительно брегмы, чтобы разместить линзу GRIN в правильном месте. Ограничением метода является задержка между операцией и временем начала наблюдения за сигналами GCaMP6f, которое может занять 2-4 недели. Мышь должна быть готова к использованию после этого критического периода. Разница между текущим протоколом и предыдущими протоколами 24,25,26,27 заключается в использовании мышей Thy1-GCaMP6f, уже экспрессирующих GCaMP6f в CA1, вместо инъекции вируса AAV-GCaMP6f в гиппокамп. Это экономит время во время операции и не требует времени ожидания экспрессии вируса AAV в мозге. Кроме того, этот протокол не аспирирует мозг и использует изофлуран вместо кетамина/ксилазина, что обеспечивает лучший контроль дозы для предотвращения передозировок. Ограничением метода является оптическая аберрация линзы GRIN, которая ограничивает поле зрения. Важным шагом при размещении опорной плиты является удержание электросмачивающей линзы в центре, чтобы предотвратить ограничение регулировки Z-пластины после цементирования опорной пластины на головке. Ограничением строительства пахучей арены является сложность системы, которая может занять несколько месяцев и потребовать помощи инженера. Ограничением поведенческой дрессировки является то, что мыши могут предпочитать одну сторону области запаха другой. Один из способов решить эту проблему — чередовать испытания, вознаграждая мышь за переход к левой и правой полосе.
Важным шагом для проверки шлейфа является то, что игла PID должна быть выровнена с источником запаха, чтобы определить траекторию шлейфа. Важным шагом при записи свободно движущейся мыши в минископе является обеспечение того, чтобы провод мини-коаксиального кабеля не запутывался во время выполнения задачи, что можно предотвратить с помощью коммутатора. Гелиевые шары можно использовать для предотвращения попадания мини-коаксиального провода перед мышью. Для предварительной обработки данных критически важно синхронизировать TTL-импульсы цифровой верхней камеры области запахов и камеры минископа. Для процедуры EXTRACT рекомендуется использовать неотрицательную обработку, чтобы лучше извлечь ROI и сигналы δF/F0. EXTRACT обеспечивает визуальный контроль трассировок для каждого ROI, чтобы исключить плохие. Крайне важно декодировать позиции мыши по осям X и Y из ROI, чтобы иметь большой набор данных с сотнями эпох для лучшего обучения искусственной нейронной сети.
Значение этого свободно движущегося метода записи по сравнению с существующими методами фиксации головы заключается в изучении поведения мыши в этологически релевантном контексте с правильным движением головы для навигации по сложному шлейфу запаха. Этот метод применим для исследования динамической роли нейронов dCA1 в навигации по сложным одорантам. Кроме того, процедура не ограничивается гиппокампом или обонянием. Другие потенциальные применения метода включают изучение роли различных областей мозга и сенсорных модальностей, включая возможные применения в визуальной навигации с использованием светодиодов для обозначения вознаграждаемых полос. Кроме того, этот метод потенциально может быть применен в экспериментах с замкнутым контуром в реальном времени, в которых расшифровка нейронного кальция из популяции запускает нейростимуляцию или сенсорную обратную связь 20,34,35,36.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано Национальными институтами здравоохранения США (NIH UF1 NS116241 и NIH R01 DC000566) и Национальным научным фондом (NSF BCS-1926676). Авторы благодарят Эндрю Скаллона за помощь в создании камеры Odor Arena.
Материалы
| Name | Company | Catalog Number | Comments |
| Arduino Micro | Arduino | Micro | |
| Biocompatible Methacrylate Resin | Parkell | S380 | C&B-Metabond Adhesive Luting Cement |
| Decoding Brain Signals Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Dental Drill | Osada | LHP-6 | AZ210015 |
| Dental Drill Box | Osada | XL-230 | 30000 rotations per minute |
| Digital stereotaxic instrument | Stoelting | 51730D | Mouse Stereotaxic Instument, #51904 Digital Manipulator Arm, 3-Axes, Add-On, LEFT |
| Drill Bit | FST Fine Science Tools | 19007-05 | Tip diameter 0.5 mm |
| Fast Digital Camera | Edmund Optics | BFS-U3-63S4C | FLIR Blackfly S |
| Focal Lens | Edmund Optics | C-Series | 3.5 mm |
| GRIN lens | Inscopix | 1050-004595 | 1 mm diameter and 4 mm length |
| GRIN lens Holder | UCLA | http://miniscope.org/index.php/Surgery_Protocol | |
| Liquid Tissue Adhesive | 3M | 1469C | Vetbond Tissue Adhesive |
| Low-Flow Anesthesia System for Mice | Kent Scientific Corporation | SomnoSuite | https://www.kentscientific.com/products/somnosuite/ |
| Low Toxicity Silicone Adhesive | WPI – World Precision Instruments | Kwik-sil | |
| miniPID Controller | ASI – Aurora Scientific Inc. | Model 200B | Fast-Response Miniature Photo-Ionization Detector |
| Miniscope V4 Holder | UCLA | NA | https://github.com/Aharoni-Lab/Miniscope-v4/tree/master/Miniscope-v4-Holder |
| Miniscope V4 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4 |
| Miniscope Base Plate V2 | Labmaker | NA | https://www.labmaker.org/products/miniscope-v4-base-plates-variant-2-pack-of-10 |
| Miniscope DAQ-QT software | UCLA | https://github.com/Aharoni-Lab/Miniscope-DAQ-QT-Software/wiki | |
| Motion Correction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Odor Arena Hardware | Custom Made | 3D Model | https://www.dropbox.com/scl/fo/lwtpqysnpzis32mhrx3cd/ADomsxyhxu42sqDmTBl2O6k?rlkey=b3l4809eradundt5l3iz0gq74& dl=0 |
| Odor Arena Software | CUAnschutz | https://github.com/wryanw/odorarena | |
| Odorant Isoamyl Acetate | Aldrich Chemical Co | 06422AX | Diluted at 1% in odorless mineral oil |
| RHD USB Interface Board | Intan Technologies | C3100 | Product discontinued. Alternatively use another equivalent board. |
| ROI Extraction Software | CU Anschutz | https://github.com/restrepd/drgMiniscope | |
| Sutter Micromanipulator | Sutter Instrument Company | MP-285 | |
| Synchronization Software | CU Anschutz | https://github.com/fsimoesdesouza/Synchronization | |
| Thy1-GCaMP6f mice | Jackson Laboratory | IMSR_JAX 028281 | C57BL/6J-Tg(Thy1-GCaMP6f)GP5.12Dkim/J) |
Ссылки
- Adoff, M. D., Climer, J. R., Davoudi, H., Marvin, J. S., Looger, L. L., Dombeck, D. A. The functional organization of excitatory synaptic input to place cells. Nat Commun. 12 (1), 3558(2021).
- Radvansky, B. A., Oh, J. Y., Climer, J. R., Dombeck, D. A. Behavior determines the hippocampal spatial mapping of a multisensory environment. Cell Rep. 36 (5), 109444(2021).
- Lewis, S. M., et al. Plume dynamics structure the spatiotemporal activity of mitral/tufted cell networks in the mouse olfactory bulb. Front Cell Neurosci. 15, 633757(2021).
- Findley, T. M., et al. Sniff-synchronized, gradient-guided olfactory search by freely moving mice. ELife. 10, e58523(2021).
- Gire, D. H., Kapoor, V., Arrighi-Allisan, A., Seminara, A., Murthy, V. N. Mice develop efficient strategies for foraging and navigation using complex natural stimuli. Curr Biol. 26 (10), 1261-1273 (2016).
- Liu, A., Papale, A. E., Hengenius, J., Patel, K., Ermentrout, B., Urban, N. N. Mouse navigation strategies for odor source localization. Front Neurosci. 14, 218(2020).
- Tariq, M. F., et al. Using head-mounted ethanol sensors to monitor olfactory information and determine behavioral changes associated with ethanol-plume contact during mouse odor-guided navigation. eNeuro. 8 (1), (2021).
- Rigolli, N., Reddy, G., Seminara, A., Vergassola, M. Alternation emerges as a multi-modal strategy for turbulent odor navigation. ELife. (11), e76989(2022).
- Ma, M., et al. Sequential activity of CA1 hippocampal cells constitutes a temporal memory map for associative learning in mice. Curr Biol. 34 (4), 841-854 (2024).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nat Methods. 16 (1), 11-13 (2019).
- Aharoni, D., Hoogland, T. M. Circuit investigations with open-source miniaturized microscopes: Past, present and future. Front Cell Neurosci. 13, 141(2019).
- Flusberg, B. A., et al. High-speed, miniaturized fluorescence microscopy in freely moving mice. Nat Methods. 5 (11), 935-938 (2008).
- Connor, E. G., McHugh, M. K., Crimaldi, J. P. Quantification of airborne odor plumes using planar laser-induced fluorescence. Exp Fluids. 59 (9), 137(2018).
- Gumaste, A., et al. A Comparison between mouse, in silico, and robot odor plume navigation reveals advantages of mouse odor tracking. eNeuro. 7 (1), (2020).
- Gumaste, A., et al. Behavioral discrimination and olfactory bulb encoding of odor plume intermittency. ELife. 13, e85303(2024).
- Marin, A. C., Schaefer, A. T., Ackels, T. Spatial information from the odour environment in mammalian olfaction. Cell Tissue Res. 383 (1), 473-483 (2021).
- Eichenbaum, H. The role of the hippocampus in navigation is memory. J Neurophysiol. 117 (4), 1785-1796 (2017).
- Dombeck, D. A., Harvey, C. D., Tian, L., Looger, L. L., Tank, D. W. Functional imaging of hippocampal place cells at cellular resolution during virtual navigation. Nat Neurosci. 13 (11), 1433-1440 (2010).
- Wirtshafter, H. S., Disterhoft, J. F. In vivo multi-day calcium imaging of CA1 hippocampus in freely moving rats reveals a high preponderance of place cells with consistent place fields. J Neurosci. 42 (22), 4538-4554 (2022).
- Mizuta, K., Sato, M. Multiphoton imaging of hippocampal neural circuits: techniques and biological insights into region-, cell-type-, and pathway-specific functions. Neurophotonics. 11 (3), 033406(2024).
- Radvansky, B. A., Dombeck, D. A. An olfactory virtual reality system for mice. Nat Commun. 9 (1), 839(2018).
- Almeida-Santos, A. F., et al. Social isolation impairs the persistence of social recognition memory by disturbing the glutamatergic tonus and the olfactory bulb-dorsal hippocampus coupling. Sci Rep. 9 (1), 473(2019).
- Dana, H., et al. Thy1-GCaMP6 transgenic mice for neuronal population imaging in vivo. PLoS One. 9 (9), e108697(2014).
- Thapa, R., Liang, B., Liu, R., Li, Y. Stereotaxic viral injection and gradient-index lens implantation for deep brain in vivo calcium imaging. J Vis Exp. (176), e63049(2021).
- Hsiao, Y. -T., Wang, A. Y. -C., Lee, T. -Y., Chang, C. -Y. Using baseplating and a miniscope preanchored with an objective lens for calcium transient research in mice. J Vis Exp. (172), e62611(2021).
- Zhang, L., et al. Miniscope GRIN lens system for calcium imaging of neuronal activity from deep brain structures in behaving animals. Curr Protoc Neurosci. 86 (1), e56(2019).
- Guo, D., Gürkan Özer, A., Uusisaari, M. Y. In vivo calcium imaging in mouse inferior olive. J Vis Exp. (172), e62222(2021).
- Yun, M., Shin, J., Jung, M. W. Protocol for calcium imaging of dorsal and ventral CA1 neurons in head-fixed mice. STAR Protoc. 4 (3), 102439(2023).
- Yun, M., Hwang, J. Y., Jung, M. W. Septotemporal variations in hippocampal value and outcome processing. Cell Rep. 42 (2), 112094(2023).
- Sheffield, M. E. J., Dombeck, D. A. Calcium transient prevalence across the dendritic arbour predicts place field properties. Nature. 517 (7533), 200-204 (2015).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. J Neurosci Methods. 291, 83-94 (2017).
- Inan, H., et al. Fast and statistically robust cell extraction from large-scale neural calcium imaging datasets. bioRxiv. , (2021).
- Segalin, C., et al. The mouse action recognition system (MARS) software pipeline for automated analysis of social behaviors in mice. ELife. 10, e63720(2021).
- Chen, Z., et al. A hardware system for real-time decoding of in vivo calcium imaging data. ELife. (12), e78344(2023).
- Xue, F., et al. Multi-region calcium imaging in freely behaving mice with ultra-compact head-mounted fluorescence microscopes. Natl Sci Rev. 11 (1), nwad294(2024).
- Tabourin, L., Bretzner, F., Galstian, T. Towards a mini-endoscope design with spatially selective excitation and imaging. Biomed Opt Express. 15 (3), 1750-1760 (2024).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены