Method Article
Multipleks Siklik Floresan İmmünohistokimya
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Multipleks siklik immünohistokimya, tekrarlanan antijen-antikor inkübasyonu, görüntü taraması ve görüntü hizalama ve entegrasyonu kullanılarak aynı anda birden fazla belirtecin in situ tespitine izin verir. Burada, akciğer kanseri ve eşleştirilmiş beyin metastazı örneklerinde bu teknoloji ile immün hücre substratlarının tanımlanması için çalışma protokolünü sunuyoruz.
Özet
Tümör mikroçevresi, konakçı hücreler, tümör hücreleri, bağışıklık hücreleri, stromal hücreler ve vaskülatür arasındaki etkileşimleri içerir. İmmün hücre alt kümelerinin ve hedef proteinlerin karakterize edilmesi ve uzamsal olarak düzenlenmesi prognostik ve terapötik amaçlar için çok önemlidir. Bu durum çoğullanmış immünohistokimya boyama yöntemlerinin geliştirilmesine yol açmıştır. Multipleks floresan immünohistokimyası, hücre fonksiyonunun ve hücreler arası etkileşimlerin kapsamlı bir şekilde anlaşılmasını kolaylaştırarak çoklu belirteçlerin aynı anda saptanmasına izin verir. Bu yazıda, multipleks siklik floresan immünohistokimya testi için bir iş akışı ve lenfosit alt kümelerinin kantitifikasyon analizinde uygulanması açıklanmaktadır. Multipleks siklik floresan immünohistokimya boyama, antijen alımı, siklik antikor inkübasyonu ve formalinle sabitlenmiş parafine gömülü (FFPE) bir doku lamı üzerinde boyamayı içeren standart immünohistokimya ile benzer adımları ve reaktifleri takip eder. Antijen-antikor reaksiyonu sırasında, farklı türlerden bir antikor karışımı hazırlanır. Antijen alma süresi ve antikor konsantrasyonu gibi koşullar, sinyal-gürültü oranını artırmak için optimize edilir ve doğrulanır. Bu teknik tekrarlanabilir ve immünoterapi araştırmaları ve klinik uygulamalar için değerli bir araç olarak hizmet eder.
Giriş
Beyin metastazları (BM), küçük hücreli dışı akciğer kanseri vakalarının (KHDAK) yaklaşık yarısında meydana gelen ve kötü prognozlu en yaygın merkezi sinir sistemi (MSS) tümörlerini temsil eder1. KHDAK hastalarının tahminen %10-20'si ilk tanı sırasında zaten BM'ye sahiptir ve KHDAK vakalarının yaklaşık %40'ında tedavi sırasında KHDAK gelişecektir2. Tümör mikroçevresi (TME), kan damarları, fibroblastlar, makrofajlar, hücre dışı matriks (ECM), lenfoid, kemik iliği kaynaklı bağışıklık hücreleri ve sinyal molekülleri gibi çeşitli bileşenler dahil olmak üzere NSCLC oluşumu ve BM ile yakından ilişkilidir 3,4. Mikroçevresel bağışıklık hücreleri, kanser hücresi büyümesini ve gelişimini etkilemede çok önemli bir rol oynar. Beyin metastazları, karmaşık immünolojik mikroortamlar ve sinyalizasyon süreçleri ile karakterize çok sayıda potansiyel tedavi hedefi sunar. Örneğin, PD-1 inhibitörleri, bir bağışıklık kontrol noktası inhibitörü (ICI) olarak akciğer kanseri beyin metastazı (LCBM) olan hastalar için klinik etkinlik göstermiştir. Bununla birlikte, PD-1 tedavisine yanıtların sıklığı primer KHDAK ve LCBM5 arasında değişir, bu da tümör immün mikroçevresinin kritik bir ICI düzenleyici görevi gördüğünü düşündürür.
İmmünohistokimya (IHC) biyoloji, temel tıp ve patoloji alanlarında paha biçilmez bir araçtır6. Bu tespit yöntemi, bir doku lamı7 üzerindeki antijen-antikorun etkileşimi yoluyla antijen ekspresyonunu görselleştirir. IHC, prediktif belirteçleri teşhis etmek, prognostik belirteçleri değerlendirmek, hedefe yönelik tedavileri yönlendirmek ve tümör hücrelerinin biyolojik işlevlerini araştırmak için kullanılır8. Bununla birlikte, geleneksel IHC yöntemi bir seferde yalnızca bir biyobelirteç tespit edebilir. Bu sınırlamayı ele almak için, immünohistokimyasal teknolojinin yeniliği, hem parlak alanda hem de floresan alanda aynı doku lamı üzerinde birden fazla protein belirtecinin aynı anda tanımlanmasına izin veren multipleks floresan immünohistokimyasının (mfIHC) geliştirilmesine yol açmıştır9. Bu ilerleme, TME içindeki stromal hücreler, bağışıklık hücreleri ve kanser hücreleri arasındaki hücre bileşiminin ve moleküler etkileşimlerin doğru analizini sağlar.
Bu çalışmada, immün hücrelerin mekansal dağılımını analiz etmek için multipleks siklik immünohistokimya için bir protokol sunuyoruz. Tavşan ve sıçan gibi farklı türlerin iki birincil antikoru aynı anda inkübasyon için seçilir, ardından floresan etiketli ikincil antikorlar gelir. Antijen alımı, her antijen-antikor reaksiyonu turundan sonra gerçekleştirilir. Otofloresan bloke edilir ve çekirdekleri boyamak için 4', 6-diamidino-2-fenilindol (DAPI) kullanılır. Panel, CD3, CD8, CD20 ve CK'nin sıralı tespitini içerir, hücreler belirteçlere göre kategorize edilir: tümör hücreleri (CK +), olgun T hücreleri (CD3 +), sitotoksik T hücreleri (CD3 + CD8 +), B hücreleri (CD20 +) 10,11.
Protokol
Araştırma, Yunnan Kanser Hastanesi / Kunming Tıp Üniversitesi Üçüncü Bağlı Hastanesi tıbbi etik komitesi tarafından onaylandı. Tüm denekler/yasal vasiler bilgilendirilmiş onam imzaladı.
1. Slayt hazırlama
- Primer akciğer tümörü veya akciğer kanseri beyin metastazı hücrelerini içeren eşleştirilmiş parafin bloklarının bölümlerini bir mikrotom kullanarak 4 μm kalınlığında kesin. Bölümleri suya çıkarın ve cımbızla ayırın, en iyisini seçin ve polilisin kaplı slayta yapıştırın.
- Doku yapışmasını artırmak için doku slaytlarını 65 °C'de 30 dakika fırına koyun.
- Slaytları, her biri 10 dakika süren üç değişiklikle ksilene daldırın.
- Alkol konsantrasyonunu kademeli olarak azaltın ve slaytları 5 dakika boyunca %100 etanol, 5 dakika boyunca %90 etanol, 5 dakika boyunca %75 etanol ve 3 dakika boyunca deiyonize suda inkübe edin.
2. Isı kaynaklı epitop alımı (HIER)
- 100x sodyum sitrat tampon çözeltisini (pH 6.0) deiyonize suda 1x (10 mM) ile seyreltin ve slaytları tamamen daldırmak için yeterli tampon çözeltisi hazırlayın.
- Slaytları düdüklü tencereye yerleştirin, 100 dakika boyunca yüksek ısıya (30 °C) ve basınca (~2 psi) maruz bırakın. Isıttıktan sonra, slaytları damıtılmış suda 3 dakika oda sıcaklığına soğumaya bırakın.
- PBS tampon çözeltisi (pH 7.0) hazırlamak için bir paket 52 g fosfat tamponlu salin (PBS; toz) 5 L deiyonize suda çözün. Slaytları 3 değişiklikle 5 dakika boyunca PBS tampon çözeltisine yerleştirin.
3. Peroksidaz blokajı
- Bölümleri% 3 hidrojen peroksit ile kaplayın ve oda sıcaklığında 10 dakika inkübe edin. Slaytları PBS'de 3x, her biri 5 dakika durulayın.
- Fazla suyu dokunun çevresinden emmek için filtre kağıdı kullanın. Bu arada, dokunun nemli olduğundan emin olun.
4. İlk tur için primer antikor inkübasyonu
- CD8 (Tavşan monoklonal antikoru, klon SP16) ve CD20 (fare monoklonal antikoru, klon L26) için birincil antikorların çalışan bir karışımını hazırlayın, Bond birincil antikor seyrelticisinde 1:50 oranında seyreltin.
- Antikor kompleksini bölümlere ekleyin ve oda sıcaklığında 1 saat inkübe edin.
- % 0.1 Tween / fosfat tamponlu salin çözeltisi hazırlayın: 1 L PBS tampon çözeltisinde 1 mL Tween.
- Bölümleri %0,1 Tween/fosfat tamponlu tuzlu su ile 3 kez 5 dakika yıkayın. Fazla suyu dokunun çevresinden uzaklaştırmak için filtre kağıdı kullanın, bu arada dokunun nemli olduğundan emin olun.
5. İlk tur için ikincil antikor inkübasyonu
- Fosfat tampon salin içinde 1:50 oranında seyreltilmiş, floresan etiketli keçi anti-tavşan antikoru (Uyarma (Ex): 495 nm) ve keçi anti-fare antikoru (Ex: 578 nm) karışımı hazırlayın. Keçi anti-tavşan antikoru, CD8'in primer antikoruna bağlanır ve keçi anti-fare antikoru, CD20'nin primer antikoruna bağlanır.
- İkincil antikor karışımını damla damla ekleyin ve oda sıcaklığında 1 saat inkübe edin.
6. Isı kaynaklı epitop alımı ve peroksidaz blokajı
- 100x sodyum sitrat (pH 6.0) ila 1x (10 mM) deiyonize suda seyreltin ve slaytları tamamen daldırmak için yeterli tampon çözelti hazırlayın.
- Slaytları bir düdüklü tencereye koyun ve 1 dakika boyunca yüksek ısıya (100 °C) ve basınca (~30 psi) maruz bırakın. Isıttıktan sonra, slaytları 3 dakika oda sıcaklığına soğuması için damıtılmış suya koyun.
- 3. adımda açıklandığı gibi peroksidaz blokajı gerçekleştirin.
7. İkinci tur için primer antikor inkübasyonu
- Birincil antikor seyrelticisinde 1:50 oranında seyreltilmiş CD3 (Tavşan monoklonal antikoru, klon SP7) ve CK (fare monoklonal antikoru, MX005) için birincil antikorların çalışma bir karışımını hazırlayın.
- Antikor kompleksini bölümlere ekleyin ve oda sıcaklığında 1 saat inkübe edin.
- %0,1 Tween/fosfat tamponlu tuzlu su ile 3 kez 5 dakika yıkayın. Fazla suyu dokunun çevresinden uzaklaştırmak için filtre kağıdı kullanın, bu arada dokunun nemli olduğundan emin olun.
8. İkinci tur için ikincil antikor inkübasyonu
- Keçi anti-tavşan (Örn: 652 nm) ve keçi anti-fare antikoru (Örn: 590 nm) karışımını hazırlayın, fosfat tampon salin içinde 1:50 seyreltin. Keçi anti-tavşan antikoru, CD3'ün primer antikoruna bağlanır ve keçi anti-fare antikoru, CK'nin primer antikoruna bağlanır.
- İkincil antikor karışımını damla damla ekleyin, oda sıcaklığında 1 saat inkübe edin. %0,1 Tween/fosfat tamponlu tuzlu su ile 3 kez 5 dakika yıkayın.
9. Otofloresan söndürme ve DAPI boyama
- Doku bölümüne 1 dakika boyunca reaktif (0.15 M / L KMnO4) ekleyin. 5 dakika akan su ile durulayın.
DİKKAT: KMnO4 toksiktir ve cilde zarar verir. Slaytları tutarken eldiven giydiğinizden emin olun. Sıvı cilde damlarsa, temiz peçetelerle hızlıca silin ve akan suyla yıkayın. - Slaytı artan alkol konsantrasyonlarıyla (%70, %90, %100) her konsantrasyonda 3 dakika kurutun.
- Multispektral görüntüleme için DAPI ve lamel ekleyin. DAPI miktarı doku büyüklüğüne bağlıdır. Lamel eklendikten sonra dokunun tamamen DAPI ile kaplandığından emin olun.
10. Slayt taraması
- Slaytları bir tepsiye yerleştirin ve daha fazla itilemeyecek duruma gelene kadar itin.
- Programı başlatmak için masaüstündeki Program Simgesine çift tıklayın. Başlatma sırasında mod seçim penceresi görüntülenir. Seçim penceresinde iki parlak alan ve floresan modu görüntülenir: otomatik mod ve manuel mod. Floresan tarama modunda, Otomatik Mod'u tıklatın.
- Fare imlecini üzerine getirin ? Ayarlarla ilgili bilgileri görüntülemek için düğmesine basın. Kanal Numarası'nı > Sahte Renk'i seçmek için Filtre Ayarı > Filtre Kanalı'nı tıklatın. Rengi tanımlayın ve kaydedin.
- Tarama Modu > Tam Otomatik > Rutin Çalışma'ya tıklayın. Çıktı için slayt adını tanımlamak için Rutin Çalışma > Slayt Adı'nı tıklatın. Filtreleri seçmek için Kanal Ayarları> Rutin İş'e tıklayın.
- Sanal slaytın elde edilen kalitesini ve depolama konumunu belirlemek için Tarama Seçenekleri'ni > Rutin Çalışma'yı tıklatın.
- Eşik ayarı ve taranacak aralığın seçimi için Önizleme'ye tıklayın.
- Donanım > Filtreleri'ni > Canlı > Otomatik Odaklama > Otomatik Pozlama > Dijital Kazanç > Manuel pozlama süresini kullan seçeneğini işaretleyin > Aralığı sınırlamayı işaretleyin > Akımı Ayarla'yı tıklayın.
- Taramayı Başlat> Rutin İş'e tıklayın. Büyütme seviyesini 20x veya 40x olarak seçin. Uygun dosya boyutları için 20x'i seçin. MRXS uzantısı 3D Pannoramic MIDI tarayıcı tarafından tanımlanır. Resim uzantısı da TIFF resmi olarak değiştirilebilir.
- Confocal için görüntüyü seçmek için Slayt Görüntüleyici > Çoklu Görünüm Araç Kutusu'nu tıklatın, ardından görüntüyü hizalayın ve bütünleştirin.
11. Hücre yoğunluklarının kantitatif değerlendirilmesi
- Halo 10 tarayıcı yazılımı ile tümör ve stroma bölgelerindeki pozitif bağışıklık hücrelerinin (CD3+, CD3+CD8+, CD20+) yüzdelerini ölçün. Tümör dokusunu tanımlamak için CK boyamayı doğrulayın.
Sonuçlar
Tek bir slayt üzerinde 5 renkli multipleks floresan kullanarak döngüsel antijen tespiti için bir protokol sunuyoruz. Tahlili optimize ederek, farklı türlerden iki antikorun inkübasyonunu sağlıyoruz (Şekil 1). Deney prosedürü için gerekli cihazlar arasında bir düdüklü tencere ve immün boyama kutusu bulunur (Şekil 2A).
Testi tamamladıktan sonra, slaytları taramadan önce dört işaretleyicinin sahte rengini tanımlarız. CD3, CD8, CD20 ve CK'nin sözde renkleri sırasıyla sarı, kırmızı, yeşil ve camgöbeği'dir. Çekirdekler DAPI ile etiketlenmiştir. Analiz için tümör ve stromanın temsili bölgeleri seçilir. 495 nm, 578 nm, 652 nm ve 590 nm'deki floresan spektrum, 3D otomatik dijital slayt tarayıcı kullanılarak yakalanır. Akciğer kanseri beyin metastazı dokusunda temsili bir yığın görüntüsü ve tek etiketli görüntüler Şekil 2B'de gösterilmiştir. Tarayıcı yazılımı, tek işaretleyici floresan sinyali içeren görüntülere dayanarak, sözde renge dayalı hücre fenotip özelliklerini çıkardı. Karşılık gelen pozitif bağışıklık hücresi sayısı ve toplam bağışıklık hücresi sayısı da sayıldı. Boyanan her protein seviyesi, tespit edilen dokularda H-skoru12 hesaplanarak ölçülür. Bu işlemlerden sonra, her bir tümöre sızan lenfosit tipinin sayısı ve her bir hücre tipinin toplam hedef hücre sayısı içindeki oranı sayılır ve analiz edilir. Her bir bağışıklık hücresi tipinin oranı, tümöre sızan lenfositlerin etkili yüzdesini sunar. Akciğer kanseri beyin metastazlarında CD3+, CD3+CD8+ T hücreleri ve CD20+ B hücrelerinin yüzdesi primer akciğer kanseri kesitlerine göre analiz edildi. Temsili sonuçlar Şekil 3'te gösterilmektedir. Akciğer kanseri beyin metastazlarında immün hücrelerin yoğunluğu (CD3+ T hücreleri, CD3+ CD8+ T hücreleri) primer akciğer kanserine göre daha düşüktür. CD20+ B hücreleri, beyin metastazı grubunda primer akciğer kanseri grubuna göre daha yüksektir. Bununla birlikte, sınırlı örneklemler için sonuçlar bu iki grup arasında önemli ölçüde farklı değildir.

Şekil 1: Multipleks siklik floresan immünohistokimya boyamanın iş akışı. 4 μm'lik bölümler kesilir ve yapışkan lam üzerine yapıştırılır. Aşağıdaki çalışma adımları gerçekleştirilir: deparafinizasyon ve rehidrasyon, antijen alımı, antijen alımı, antijen blokajı, primer antikor karışımı inkübasyonu, sekonder antikor inkübasyonu, daha sonra antijen alımı, antijen blokajı, primer antikor karışımı inkübasyonu ve sekonder antikor inkübasyonu adımlarının tekrarlanması, ardından otofloresansın azaltılması, slayt taraması için uygun filtrenin seçilmesi ve sonuçların analiz edilmesi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
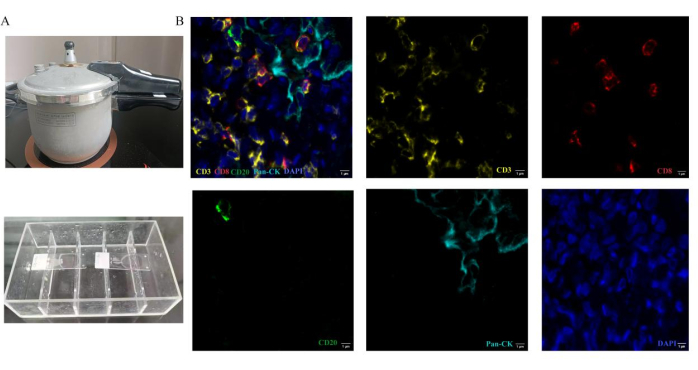
Şekil 2: Multipleks floresan immünohistokimya boyamanın çalışma yöntemleri. Antijen tedavisi, bölümlerin düdüklü tencerede ısıtılmasıyla gerçekleştirilir. (A) Düdüklü tencere, Isı kaynaklı epitop alımı için kullanılır. Antikor inkübasyonu sürecinde, slaytlar immün boyama kutusuna yerleştirilir. (B) Akciğer kanseri beyin metastaz dokusunda kullanılan panel için temsili kompozit ve tek boyalı görüntüler. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Primer akciğer kanseri ve akciğer kanseri beyin metastazları içindeki bağışıklık hücrelerinin oranı. Dört akciğer kanseri beyin metastazı dokusunda CD3+, CD3+CD8+, CD20+ immün hücre oranı, eşleştirilmiş primer akciğer kanseri dokularından daha düşüktür (hata çubukları: Standart sapma). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Multipleks siklik floresan immünohistokimya boyama sürecini tanımladık. Primer antikor seçimi, floresan immünohistokimya testinin çok önemli bir yönüdür ve daha iyi özgüllük ve tekrarlanabilirlik için monoklonal antikorlar önerilir. Primer antikorun çalışma konsantrasyonunu optimize etmek için, immünohistokimya deneyleri yoluyla bir dizi seyreltme test edilmiştir. Hem pozitif kontroller (hedef antijen ekspresyonunu değerlendirmek için) hem de negatif kontroller (primer antikor inkübasyonu yok) esastır ve kurulmalıdır.
Bu protokolde, birincil antikorlar seyreltilir ve farklı türlerden bir karışım için hazırlanır. Floresan etiketli ikincil antikorlar da farklı türlerden türetilerek aynı şekilde toplanır ve inkübe edilir. Bu nedenle, kritik adım, antijenlere dayalı olarak farklı primer antikorlar için türlerin seçilmesidir ve poliklonal antikora kıyasla monoklonal antikor tercih edilir. Bunlar, birincil antikor ve ikincil antikor arasındaki kombinasyonun spesifik olmasını sağlayabilir. Karıştırılan sıvı, her iki primer antikor için çalışma konsantrasyonuna ulaşmalı ve iki antikor arasında aynı anda çapraz reaktivite bulunmamalıdır. Birincil antikorlar aynı türden ise, önce bir ikincil antikor, sonra ikincisi inkübe edilir. Bir panelde primer antikor inkübasyon sekansını belirlerken, antijen-antikor reaksiyonuna duyarlı antikorlara öncelik verilmelidir, düşük ekspresyonlu antijenler için yoğunluk ikinci epitop alımı sırasında güçlenecektir. Antikor inkübasyonunun ikinci turundan önce, antijen alımının tekrarlanması, ilk operasyona (2 dakika) kıyasla daha az zaman alır (1 dakika). Önceki döngüsel boyamadan kaynaklanan floresan yoğunluğu, bölümler iki kez ısı kaynaklı geri alıma tabi tutulsa bile azalmayacaktır. Spesifik olmayan immünoreaktiviteden kaçınmak için, antikor çalışma konsantrasyonu, inkübasyon süresi ve çevre sıcaklığı dahil olmak üzere inkübasyon koşullarının optimize edilmesi gerekir.
Son yıllarda, esas olarak ısı kaynaklı epitop alımı (HIER) ve proteaz kaynaklı epitop alımı (PIER) olarak ikiye ayrılan çeşitli epitop alma yöntemleri geliştirilmiştir. Isıtma, antijen epitoplarını açığa çıkaran ve antikorlar tarafından daha etkili bir şekilde tespit edilmesini sağlayan etkili bir antijen alma yöntemidir13. Antijen alımı için iki ana seçenek, sitrat tamponu ve yüksek pH'lı EDTA tamponu14'e dayanmaktadır. Optimize edilmiş geri alma durumu, hedef antijene göre tanımlanır.
Otofloresan, doku işlemede kullanılan endojen floroforların ve reaktiflerin neden olduğu kesitlerde floresan görüntülemeye müdahale edebilir15. Elüsyon için ilişkili bir reaktifin kullanılması gereklidir. Floroforlar, otofloresan tepe noktalarından (yaklaşık 490 nm)16,17 kaçınarak emisyon tepe noktaları ile seçilir. Sudan Black B ve NaBH4'ün doku otofloresansını söndürmek için rapor edilmiştir18,19. Sudan Black B ve NaBH4 kombinasyonu, hedeflenen renal formalinle sabitlenmiş parafine gömülü dokuda floresan arka planını azalttı20. Bu protokolde, KMnO4'ün 0.15 M / L konsantrasyonda doku tedavisi 1 dakika boyunca zaman kazandırır. KMnO4, spontan floresansı korumak için doku üzerinde bir tabakayı kaplar ve arka plan floresansını azaltır, tespit edilen proteinin spesifik boyanması daha fazla görselleştirilir.
Tüm slaytlar dört farklı filtre kanalında taranır, görüntü hizalama analizi gereklidir, tek hücreli ve hücre altı yapıların lokalizasyonunu hizalamak büyük bir zorluktur. Bu teknikten elde edilen multispektral görüntüler için, spektral karışmayı önlemek için profesyonel ışık görüntüleme ekipmanı ve kantitatif analiz yazılımına ihtiyaç vardır. Cihazın pahalı maliyeti, uygulamasını sınırlar. İki antikorun birlikte inkübasyonu, özellikle 3 döngü inkübasyon gerektiren 6 işaretli bir panel ile uğraşırken zaman kazandırır. Bu teknik, tümör immün mikro ortamlarında immün hücrelerin daha ayrıntılı karakterizasyonunu görselleştirmek için kullanılır. Gelecekte, yöntem tümörle ilişkili üçüncül lenfoid yapıların kantitatif analizi için uygulanacaktır.
Özetle, multipleks siklik floresan immünohistokimyası, tek bir slayt üzerinde ayrı ayrı etiketlenmiş floroforlar tarafından birden fazla hedefin boyanmasını sağlar. Bu tahlil, tümör immün mikroçevresindeki hücrelerin mekansal dağılımının daha iyi anlaşılmasını sağlar ve tümör-immün hücrelerin mekansal yakınlığı, immünoterapiden fayda görecek hastaların taranmasına katkıda bulunur.
Açıklamalar
Yazarlar, bu yazıda bildirilen çalışmayı etkilemiş gibi görünebilecek bilinen hiçbir rakip mali çıkarları veya kişisel ilişkileri olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Çin Ulusal Doğa Bilimleri Vakfı (NO.81860413, 81960455), Yunnan Bilim ve Teknoloji Departmanı Fonu (202001AY070001-080), Yunnan Eyaleti Eğitim Departmanı Bilimsel Araştırma Vakfı (2019J1274) tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.15 mol/L KmnO4 | Maixin Biotechnology Co. Ltd. | MST-8005 | |
| 100x sodium citrate | Maixin Biotechnology Co., Ltd | MVS-0100 | |
| 3% hydrogen peroxide | Maixin Biotechnology Co., Ltd | SP KIT-A1 | |
| 3D Pannoramic MIDI | 3D histech Ltd | Pannoramic MIDI 1.18 | |
| Alexa Fluor 488 | Abcam | ab150113 | |
| Alexa Fluor 568 | Abcam | ab175701 | |
| Alexa Fluor 594 | Abcam | ab150116 | |
| Alexa Fluor 647 | Abcam | ab150079 | |
| Bond primary antibody diluent | Lecia | AR9352 | |
| CD20 | Maixin Biotechnology Co., Ltd | kit-0001 | |
| CD3 | Maixin Biotechnology Co., Ltd. | kit-0003 | |
| CD8 | Maixin Biotechnology Co., Ltd | RMA-0514 | |
| CK | Maixin Biotechnology Co. Ltd. | MAB-0671, | |
| DAPI | sig-ma | D8417 | |
| ethanol | Sinopharm Group Chemical reagent Co., LTD | 10009218 | |
| Histocore Multicut | lecia | 2245 | |
| PBS(powder) | Maixin Biotechnology Co., Ltd | PBS-0061 | |
| slide viwer | 3D histech Ltd | ||
| xylene | Sinopharm Group Chemical reagent Co., LTD | 10023418 |
Referanslar
- Wanleenuwat, P., Iwanowski, P. Metastases to the central nervous system: Molecular basis and clinical considerations. J Neurol Sci. 412, 116755(2020).
- Schoenmaekers, J., Dingemans, A. C., Hendriks, L. E. L. Brain imaging in early stage non-small cell lung cancer: still a controversial topic. J Thorac Dis. 10, S2168-S2171 (2018).
- Vilariño, N., Bruna, J., Bosch-Barrera, J., Valiente, M., Nadal, E. Immunotherapy in NSCLC patients with brain metastases. Understanding brain tumor microenvironment and dissecting outcomes from immune checkpoint blockade in the clinic. Cancer Treat Rev. 89, 102067(2020).
- Babar, Q., Saeed, A., Tabish, T. A., Sarwar, M., Thorat, N. D. Targeting the tumor microenvironment: Potential strategy for cancer therapeutics. Biochim Biophys Acta Mol Basis Dis. 1869 (6), 166746(2023).
- Goldberg, S. B., et al. Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial. Lancet Oncol. 21 (5), 655-663 (2020).
- Sukswai, N., Khoury, J. D. Immunohistochemistry Innovations for Diagnosis and Tissue-Based Biomarker Detection. Curr Hematol Malig Rep. 14 (5), 368-375 (2019).
- Janardhan, K. S., Jensen, H., Clayton, N. P., Herbert, R. A. Immunohistochemistry in Investigative and Toxicologic Pathology. Toxicol Pathol. 46 (5), 488-510 (2018).
- Torlakovic, E. E., Nielsen, S., Vyberg, M., Taylor, C. R. Getting controls under control: the time is now for immunohistochemistry. J Clin Pathol. 68 (11), 879-882 (2015).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Commun (Lond). 40 (4), 135-153 (2020).
- Wong, P. F., et al. Multiplex quantitative analysis of tumor-infiltrating lymphocytes and immunotherapy outcome in metastatic melanoma. Clin Cancer Res. 25 (8), 2442-2449 (2019).
- Sanchez, K., et al. Multiplex immunofluorescence to measure dynamic changes in tumor-infiltrating lymphocytes and PD-L1 in early-stage breast cancer. Breast Cancer Res. 23 (1), 2(2021).
- Zhang, W., et al. Multiplex immunohistochemistry indicates biomarkers in colorectal cancer. Neoplasma. 68 (6), 1272-1282 (2021).
- Salameh, S., Nouel, D., Flores, C., Hoops, D. An optimized immunohistochemistry protocol for detecting the guidance cue Netrin-1 in neural tissue. MethodsX. 5, 1-7 (2018).
- McClellan, P., Jacquet, R., Yu, Q., Landis, W. J. A Method for the immunohistochemical identification and localization of Osterix in periosteum-wrapped constructs for tissue engineering of bone. J Histochem Cytochem. 65 (7), 407-420 (2017).
- Sun, Y., et al. Sudan black B reduces autofluorescence in murine renal tissue. Arch Pathol Lab Med. 135 (10), 1335-1342 (2011).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. J Immunother Cancer. 8 (1), 000155(2020).
- Clarke, G. M., et al. A novel, automated technology for multiplex biomarker imaging and application to breast cancer. Histopathology. 64 (2), 242-255 (2014).
- Oliveira, V. C., et al. Sudan Black B treatment reduces autofluorescence and improves resolution of in situ hybridization specific fluorescent signals of brain sections. Histol Histopathol. 25 (8), 1017-1024 (2010).
- Ahrens, M. J., Dudley, A. T. Chemical pretreatment of growth plate cartilage increases immunofluorescence sensitivity. J Histochem Cytochem. 59 (4), 408-418 (2011).
- Zhang, Y., et al. Spectral characteristics of autofluorescence in renal tissue and methods for reducing fluorescence background in confocal laser scanning microscopy. J Fluoresc. 28 (2), 561-572 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır