Method Article
Immunohistochimie par fluorescence cyclique multiplex
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
L’immunohistochimie cyclique multiplex permet la détection in situ de plusieurs marqueurs simultanément en utilisant l’incubation répétée d’antigène-anticorps, le balayage d’images et l’alignement et l’intégration d’images. Nous présentons ici le protocole opératoire pour identifier les substrats des cellules immunitaires avec cette technologie dans des échantillons de cancer du poumon et de métastases cérébrales appariées.
Résumé
Le microenvironnement tumoral implique des interactions entre les cellules hôtes, les cellules tumorales, les cellules immunitaires, les cellules stromales et le système vasculaire. La caractérisation et l’organisation spatiale des sous-ensembles de cellules immunitaires et des protéines cibles sont cruciales à des fins pronostiques et thérapeutiques. Cela a conduit au développement de méthodes de coloration immunohistochimique multiplexées. L’immunohistochimie par fluorescence multiplex permet la détection simultanée de plusieurs marqueurs, facilitant une compréhension complète de la fonction cellulaire et des interactions intercellulaires. Dans cet article, nous décrivons un flux de travail pour le test d’immunohistochimie par fluorescence cyclique multiplex et son application dans l’analyse de quantification de sous-ensembles de lymphocytes. La coloration multiplex par immunohistochimie par fluorescence cyclique suit des étapes et des réactifs similaires à ceux de l’immunohistochimie standard, impliquant la récupération d’antigènes, l’incubation d’anticorps cycliques et la coloration sur une lame de tissu fixée au formol et enrobée de paraffine (FFPE). Au cours de la réaction antigène-anticorps, un mélange d’anticorps de différentes espèces est préparé. Les conditions, telles que le temps de récupération de l’antigène et la concentration d’anticorps, sont optimisées et validées pour augmenter le rapport signal/bruit. Cette technique est reproductible et constitue un outil précieux pour la recherche en immunothérapie et les applications cliniques.
Introduction
Les métastases cérébrales représentent les tumeurs du système nerveux central (SNC) les plus courantes, survenant dans près de la moitié des cas de cancer du poumon non à petites cellules (CPNPC), avec un mauvais pronostic1. On estime que 10 à 20 % des patients atteints de CPNPC sont déjà atteints de BM au moment du diagnostic initial, et qu’environ 40 % des cas de CPNPC développeront une BM au cours du traitement2. Le microenvironnement tumoral (TME) est étroitement associé à l’apparition du CPNPC et de la BM, y compris divers composants, tels que les vaisseaux sanguins, les fibroblastes, les macrophages, la matrice extracellulaire (ECM), les lymphoïdes, les cellules immunitaires dérivées de la moelle osseuse et les molécules de signalisation 3,4. Les cellules immunitaires microenvironnementales jouent un rôle crucial dans la croissance et le développement des cellules cancéreuses. Les métastases cérébrales présentent de nombreuses cibles thérapeutiques potentielles caractérisées par des microenvironnements immunologiques et des processus de signalisation complexes. Par exemple, les inhibiteurs de-1 ont montré une efficacité clinique pour les patients atteints de métastases cérébrales cancéreuses du poumon (LCBM) en tant qu’inhibiteur du point de contrôle immunitaire (ICI). Cependant, la fréquence des réponses au traitement par-1 varie entre le CPNPC primaire et le LCBM5, ce qui suggère que le microenvironnement immunitaire tumoral agit comme un régulateur essentiel des ICI.
L’immunohistochimie (IHC) est un outil inestimable dans les domaines de la biologie, de la médecine fondamentale et de la pathologie6. Cette méthode de détection visualise l’expression de l’antigène par l’interaction antigène-anticorps sur une lame de tissu7. L’IHC est utilisée pour diagnostiquer les marqueurs prédictifs, évaluer les marqueurs pronostiques, guider les thérapies ciblées et explorer les fonctions biologiques des cellules tumorales8. Cependant, la méthode IHC traditionnelle ne peut détecter qu’un seul biomarqueur à la fois. Pour remédier à cette limitation, l’innovation de la technologie immunohistochimique a conduit au développement de l’immunohistochimie par fluorescence multiplex (mfIHC), qui permet l’identification simultanée de plusieurs marqueurs protéiques sur la même lame de tissu, à la fois en fond clair et en champ fluorescent9. Cette avancée fournit une analyse précise de la composition cellulaire et des interactions moléculaires entre les cellules stromales, les cellules immunitaires et les cellules cancéreuses au sein du TME.
Dans cette étude, nous présentons un protocole d’immunohistochimie cyclique multiplex pour analyser la distribution spatiale des cellules immunitaires. Deux anticorps primaires d’espèces différentes, comme le lapin et le rat, sont choisis pour l’incubation simultanée, suivis d’anticorps secondaires marqués par fluorescence. La récupération de l’antigène est effectuée après chaque série de réactions antigène-anticorps. L’autofluorescence est bloquée et le 4', 6-diamidino-2-phénylindole (DAPI) est utilisé pour colorer les noyaux. Le panel comprend la détection séquentielle des CD3, CD8, CD20 et CK, les cellules sont classées en fonction des marqueurs : cellules tumorales (CK+), cellules T matures (CD3+), cellules T cytotoxiques (CD3+CD8+), cellules B (CD20+)10,11.
Protocole
La recherche a été approuvée par le comité d’éthique médicale de l’hôpital du cancer du Yunnan / le troisième hôpital affilié de l’Université médicale de Kunming. Tous les sujets/tuteurs légaux ont signé un consentement éclairé.
1. Préparation des diapositives
- Coupez des coupes de blocs de paraffine appariés contenant des cellules de métastases cérébrales de tumeur pulmonaire primitive ou de cancer du poumon d’une épaisseur de 4 μm à l’aide d’un microtome. Retirez les sections à l’eau et séparez-les avec une pince à épiler, choisissez la meilleure et collez-la sur la lame recouverte de polylysine.
- Placez les lames de tissus dans un four à 65 °C pendant 30 min pour améliorer l’adhérence des tissus.
- Immergez les lames dans le xylène en trois changements d’une durée de 10 minutes chacun.
- Réduire graduellement la concentration d’alcool et incuber les lames dans de l’éthanol à 100 % pendant 5 min, de l’éthanol à 90 % pendant 5 min, de l’éthanol à 75 % pendant 5 min et dans de l’eau déminéralisée pendant 3 min.
2. Récupération d’épitopes induite par la chaleur (HIER)
- Diluer 100x solution tampon de citrate de sodium (pH 6,0) à 1x (10 mM) dans de l’eau désionisée, en préparant suffisamment de solution tampon pour immerger complètement les lames.
- Placez les lames dans une cocotte-minute en les soumettant à une chaleur élevée (100 °C) et à une pression (~30 psi) pendant 2 min. Après chauffage, laissez les lames refroidir à température ambiante dans de l’eau distillée pendant 3 min.
- Dissoudre un sachet de 52 g de solution saline tamponnée au phosphate (PBS ; en poudre) dans 5 L d’eau désionisée pour préparer une solution tampon de PBS (pH 7,0). Placez les lames dans la solution tampon PBS pendant 5 minutes, avec 3 changements.
3. Blocage de la peroxydase
- Couvrir les sections avec du peroxyde d’hydrogène à 3 % et incuber pendant 10 min à température ambiante. Rincer les lames au PBS, 3x pendant 5 min chacune.
- Utilisez du papier filtre pour absorber l’excès d’eau loin du périmètre du tissu. Pendant ce temps, assurez-vous que le tissu est humide.
4. Incubation primaire des anticorps pour le premier tour
- Préparez un mélange fonctionnel des anticorps primaires pour CD8 (anticorps monoclonal de lapin, clone SP16) et CD20 (anticorps monoclonal de souris, clone L26), dilués 1:50 dans un diluant d’anticorps primaire de Bond.
- Ajouter le complexe d’anticorps sur les sections et incuber pendant 1 h à température ambiante.
- Préparer une solution saline tamponnée à 0,1 % de Tween/phosphate : 1 mL de Tween dans 1 L de solution tampon PBS.
- Lavez les sections avec 0,1 % de solution saline tamponnée au phosphate, 3 fois pendant 5 minutes chacune. Utilisez du papier filtre pour éloigner l’excès d’eau du périmètre du tissu, pendant ce temps, assurez-vous que le tissu est humide.
5. Incubation secondaire des anticorps pour le premier tour
- Préparez un mélange d’anticorps anti-lapin de chèvre marqué par fluorescence (Excitation (Ex) : 495 nm) et d’anticorps anti-souris de chèvre (Ex : 578 nm), dilué 1:50 dans une solution saline tampon phosphate. L’anticorps anti-lapin de chèvre se fixe à l’anticorps primaire de CD8, et l’anticorps anti-souris de chèvre se fixe à l’anticorps primaire de CD20.
- Ajouter le mélange d’anticorps secondaires goutte à goutte et incuber à température ambiante pendant 1 h.
6. Récupération d’épitopes induite par la chaleur et blocage de la peroxydase
- Diluer 100x citrate de sodium (pH 6,0) à 1x (10 mM) dans de l’eau désionisée, en préparant suffisamment de solution tampon pour immerger complètement les lames.
- Placez les lames dans un autocuiseur et soumettez-les à une chaleur élevée (100 °C) et à une pression (~30 psi) pendant 1 min. Après chauffage, placez les lames dans de l’eau distillée pour qu’elles refroidissent à température ambiante pendant 3 minutes.
- Effectuez le blocage de la peroxydase comme décrit à l’étape 3.
7. Incubation primaire des anticorps pour le deuxième tour
- Préparez un mélange fonctionnel des anticorps primaires pour CD3 (anticorps monoclonal de lapin, clone SP7) et CK (anticorps monoclonal de souris, MX005), dilués 1:50 dans un diluant d’anticorps primaire.
- Ajouter le complexe d’anticorps sur les sections et incuber pendant 1 h à température ambiante.
- Laver avec 0,1 % de solution saline tamponnée au phosphate, 3x pendant 5 min chacune. Utilisez du papier filtre pour éloigner l’excès d’eau du périmètre du tissu, pendant ce temps, assurez-vous que le tissu est humide.
8. Incubation secondaire des anticorps pour le deuxième tour
- Préparer un mélange d’anticorps anti-lapin (Ex : 652 nm) et d’anticorps anti-souris (Ex : 590 nm), dilution 1:50 dans une solution saline tampon phosphate. L’anticorps anti-lapin de chèvre se fixe à l’anticorps primaire de CD3, et l’anticorps anti-souris de chèvre se fixe à l’anticorps primaire de CK.
- Ajouter le mélange d’anticorps secondaires goutte à goutte, incuber à température ambiante pendant 1 h. Laver avec 0,1 % de solution saline tamponnée au phosphate, 3x pendant 5 min chacune.
9. Trempe par autofluorescence et coloration DAPI
- Ajouter le réactif (0,15 M/L KMnO4) à la coupe de tissu pendant 1 min. Rincer à l’eau courante pendant 5 min.
ATTENTION : KMnO4 est toxique et endommage la peau. Assurez-vous de porter des gants lorsque vous manipulez les diapositives. Si le liquide coule sur la peau, essuyez-le rapidement avec des serviettes propres et rincez à l’eau courante. - Séchez la lame avec des concentrations croissantes d’alcool (70 %, 90 %, 100 %), pendant 3 minutes à chaque concentration.
- Ajoutez DAPI et lamelle pour l’imagerie multispectrale. La quantité de DAPI dépend de la taille du tissu. Assurez-vous que le tissu est complètement recouvert de DAPI après l’ajout de la lamelle.
10. Numérisation des lames
- Placez les lames sur un plateau et poussez jusqu’à ce qu’elles ne puissent plus être poussées.
- Pour démarrer le programme, double-cliquez sur l’icône du programme sur le bureau. Au démarrage, la fenêtre de sélection du mode s’affiche. La fenêtre de sélection affiche deux modes fond clair et fluorescent : mode automatique et mode manuel. En mode de balayage fluorescent, cliquez sur Mode automatique.
- Déplacez le curseur de la souris sur ? pour afficher les informations sur les paramètres. Cliquez sur Paramètre de filtre > Filtrer le canal pour choisir le numéro de canal > la pseudo-couleur. Définissez la couleur et enregistrez.
- Cliquez sur Travail de routine > mode de numérisation > Entièrement automatique. Cliquez sur Travail de routine > nom de la diapositive pour définir le nom de la diapositive pour la sortie. Cliquez sur Travail de routine > Paramètres de canal pour choisir des filtres.
- Cliquez sur Options de travail > de numérisation de routine pour déterminer la qualité et l’emplacement de stockage de la diapositive virtuelle.
- Cliquez sur Aperçu pour définir le seuil et sélectionner la plage à analyser.
- Cliquez sur Matériel > Filtres > Live > Mise au point automatique > Exposition automatique > Gain numérique > Cochez la case Utiliser le temps d’exposition manuelle > Cochez la case limitant la plage > Régler le courant.
- Cliquez sur Travail de routine > Démarrer l’analyse. Sélectionnez le niveau de grossissement 20x ou 40x. Choisissez 20x pour les tailles de fichiers appropriées. L’extension MRXS est définie par un scanner MIDI Pannoramic 3D. L’extension d’image peut également être modifiée en image TIFF.
- Cliquez sur Visionneuse de diapositives > Boîte à outils multivue pour choisir l’image à confocaliser, puis alignez et intégrez l’image.
11. Évaluation quantitative des densités cellulaires
- Quantifiez les pourcentages de cellules immunitaires positives (CD3+, CD3+CD8+, CD20+) dans les zones tumorales et stromales avec le logiciel de scanner Halo 10. Valider la coloration CK pour définir le tissu tumoral.
Résultats
Nous présentons un protocole de détection d’antigènes cycliques utilisant la fluorescence multiplex à 5 couleurs sur une seule lame. Grâce à notre optimisation du test, nous permettons l’incubation de deux anticorps d’espèces différentes (Figure 1). Les dispositifs nécessaires à la procédure d’expérience comprennent un autocuiseur et une boîte d’immunocoloration (Figure 2A).
Après avoir terminé le test, nous définissons la pseudo couleur des quatre marqueurs avant de numériser les lames. Les pseudo-couleurs de CD3, CD8, CD20 et CK sont respectivement jaune, rouge, vert et cyan. Les noyaux sont marqués avec DAPI. Des régions représentatives de la tumeur et du stroma sont sélectionnées pour l’analyse. Le spectre fluorescent à 495 nm, 578 nm, 652 nm et 590 nm est capturé à l’aide d’un scanner numérique automatique 3D. Une image empilée représentative et des images marquées dans le tissu des métastases cérébrales du cancer du poumon sont présentées à la figure 2B. Sur la base d’images contenant un signal de fluorescence à marqueur unique, le logiciel du scanner a extrait les caractéristiques phénotypiques des cellules en fonction de la pseudo couleur. Le nombre correspondant de cellules immunitaires positives et de cellules immunitaires totales a également été compté. Les niveaux de chaque protéine colorée sont quantifiés dans les tissus détectés en calculant le score H12. Après ces procédures, le nombre de chaque type de lymphocytes infiltrant la tumeur et la proportion de chaque type de cellule dans le nombre total de cellules cibles sont comptés et analysés. La proportion de chaque type de cellule immunitaire présente le pourcentage effectif de lymphocytes infiltrant la tumeur. Le pourcentage de lymphocytes T CD3+, CD3+CD8+ et CD20+ a été analysé dans les métastases cérébrales du cancer du poumon par rapport aux coupes de cancer du poumon primitif. Des résultats représentatifs sont présentés à la figure 3. La densité des cellules immunitaires (lymphocytes T CD3+, lymphocytes T CD3+ CD8+) est plus faible dans les métastases cérébrales du cancer du poumon que dans le cancer primitif du poumon. Les lymphocytes B CD20+ sont plus élevés dans le groupe des métastases cérébrales que dans le groupe des cancers du poumon primitifs. Cependant, les résultats ne sont pas significativement différents entre ces deux groupes pour les échantillons limités.

Figure 1 : Flux de travail de coloration multiplex par immunohistochimie par fluorescence cyclique. Les sections de 4 μm sont coupées et collées sur une lame adhésive. Les étapes opératoires suivantes sont effectuées : déparaffinisation et réhydratation, récupération d’antigènes, récupération d’antigènes, blocage d’antigènes, incubation primaire du mélange d’anticorps, incubation secondaire des anticorps, puis répétition des étapes de récupération de l’antigène, blocage de l’antigène, incubation du mélange d’anticorps primaires et incubation secondaire des anticorps, suivie de la réduction de l’autofluorescence, de la sélection du filtre approprié pour le balayage des lames et de l’analyse des résultats. Veuillez cliquer ici pour voir une version agrandie de cette figure.
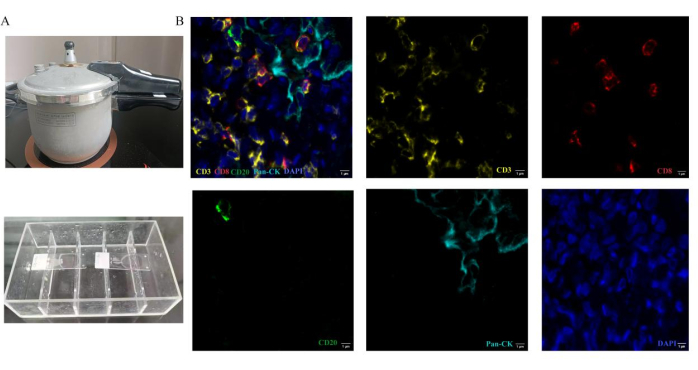
Figure 2 : Méthodes opératoires de coloration immunohistochimique par fluorescence multiplex. Le traitement antigénique est effectué en chauffant des sections dans un autocuiseur. (A) L’autocuiseur est utilisé pour la récupération d’épitopes induite par la chaleur. Dans le processus d’incubation des anticorps, les lames sont placées dans la boîte d’immunocoloration. (B) Images composites et monocolorées représentatives pour le panel utilisé dans le tissu des métastases cérébrales du cancer du poumon. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Proportion de cellules immunitaires dans le cancer du poumon primitif et les métastases cérébrales du cancer du poumon. La proportion de cellules immunitaires CD3+, CD3+CD8+, CD20+ dans quatre tissus de métastases cérébrales du cancer du poumon est inférieure à celle des tissus primitifs appariés du cancer du poumon (barres d’erreur : écart-type). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous avons décrit le processus de coloration par immunohistochimie par fluorescence cyclique multiplexe. La sélection des anticorps primaires est un aspect crucial du test d’immunohistochimie de fluorescence, et les anticorps monoclonaux sont recommandés pour une meilleure spécificité et répétabilité. Pour optimiser la concentration de travail de l’anticorps primaire, une série de dilutions a été testée par des expériences d’immunohistochimie. Les contrôles positifs (pour évaluer l’expression de l’antigène cible) et négatifs (pas d’incubation primaire d’anticorps) sont essentiels et doivent être mis en place.
Dans ce protocole, les anticorps primaires sont dilués et préparés pour un mélange de différentes espèces. Les anticorps secondaires marqués par fluorescence sont également regroupés et incubés de la même manière, dérivés d’espèces différentes. Ainsi, l’étape critique consiste à choisir l’espèce pour différents anticorps primaires en fonction des antigènes, et l’anticorps monoclonal est préféré à l’anticorps polyclonal. Ceux-ci peuvent garantir que la combinaison entre l’anticorps primaire et l’anticorps secondaire est spécifique. Le liquide mélangé doit atteindre la concentration de travail pour les deux anticorps primaires et la réactivité croisée ne doit pas exister simultanément entre les deux anticorps. Si les anticorps primaires sont de la même espèce, un anticorps secondaire est incubé en premier, puis le second. Lors de la détermination de la séquence d’incubation des anticorps primaires dans un panel, la priorité doit être donnée aux anticorps sensibles à la réaction antigène-anticorps, pour les antigènes à faible expression, l’intensité augmenterait lors de la récupération du deuxième épitope. Avant le deuxième cycle d’incubation des anticorps, la répétition du prélèvement d’antigène prend moins de temps (1 min) que la première opération (2 min). L’intensité de fluorescence de la coloration cyclique précédente ne diminuera pas même si les coupes subissent deux fois une récupération induite par la chaleur. Pour éviter l’immunoréactivité non spécifique, les conditions d’incubation doivent être optimisées, y compris la concentration de travail des anticorps, le temps d’incubation et la température ambiante.
Diverses méthodes de récupération d’épitopes ont été développées au cours des dernières décennies, principalement divisées en récupération d’épitopes induite par la chaleur (HIER) et récupération d’épitopes induite par la protéase (PIER). Le chauffage est une méthode efficace de récupération des antigènes qui expose les épitopes de l’antigène, ce qui les rend plus efficacement détectés par les anticorps13. Les deux principales options de récupération de l’antigène sont basées sur le tampon citrate et le tampon EDTA14 à pH élevé. La condition de récupération optimisée est identifiée en fonction de l’antigène cible.
L’autofluorescence peut interférer avec l’imagerie fluorescente sur les coupes causées par des fluorophores endogènes et des réactifs utilisés dans le traitement des tissus15. L’utilisation d’un réactif associé est nécessaire pour l’élution. Les fluorophores sont sélectionnés avec des pics d’émission évitant les pics d’autofluorescence (environ 490 nm)16,17. Sudan Black B et NaBH4 ont été signalés pour l’extinction de l’autofluorescence tissulaire18,19. La combinaison de Sudan Black B et de NaBH4 a réduit le fond de fluorescence dans un tissu rénal ciblé fixé au formol et inclus dans la paraffine20. Dans ce protocole, le traitement tissulaire de KMnO4 à une concentration de 0,15 M/L permet de gagner du temps pendant 1 min. KMnO4 recouvre une couche sur le tissu pour protéger la fluorescence spontanée et réduit la fluorescence de fond, la coloration spécifique de la protéine détectée est plus visualisée.
L’ensemble des lames est scanné dans quatre canaux de filtres différents, l’analyse de l’alignement des images est nécessaire, c’est un grand défi d’aligner la localisation des structures unicellulaires et subcellulaires. Pour les images multispectrales de cette technique, un équipement professionnel d’imagerie optique et un logiciel d’analyse quantitative sont nécessaires pour éviter la diaphonie spectrale. Le coût élevé de l’instrument limite son application. La co-incubation de deux anticorps permet de gagner du temps, surtout lorsqu’il s’agit d’un panel à 6 marqueurs, qui nécessite 3 cycles d’incubation. Cette technique est utilisée pour visualiser une caractérisation plus détaillée des cellules immunitaires dans les microenvironnements immunitaires tumoraux. À l’avenir, la méthode sera appliquée à l’analyse quantitative des structures lymphoïdes tertiaires associées aux tumeurs.
En résumé, l’immunohistochimie par fluorescence cyclique multiplex permet de colorer plusieurs cibles par des fluorophores marqués individuellement sur une seule lame. Ce test permet de mieux comprendre la distribution spatiale des cellules dans le microenvironnement immunitaire tumoral, et la proximité spatiale des cellules immunitaires tumorales contribue au dépistage des patients qui bénéficieront de l’immunothérapie.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont pas d’intérêts financiers concurrents connus ou de relations personnelles qui auraient pu sembler influencer le travail rapporté dans cet article.
Remerciements
Ce travail a été soutenu par la Fondation nationale des sciences naturelles de Chine (NO.81860413, 81960455), le Fonds du Département des sciences et de la technologie du Yunnan (202001AY070001-080), la Fondation de la recherche scientifique du Département de l’éducation de la province du Yunnan (2019J1274).
matériels
| Name | Company | Catalog Number | Comments |
| 0.15 mol/L KmnO4 | Maixin Biotechnology Co. Ltd. | MST-8005 | |
| 100x sodium citrate | Maixin Biotechnology Co., Ltd | MVS-0100 | |
| 3% hydrogen peroxide | Maixin Biotechnology Co., Ltd | SP KIT-A1 | |
| 3D Pannoramic MIDI | 3D histech Ltd | Pannoramic MIDI 1.18 | |
| Alexa Fluor 488 | Abcam | ab150113 | |
| Alexa Fluor 568 | Abcam | ab175701 | |
| Alexa Fluor 594 | Abcam | ab150116 | |
| Alexa Fluor 647 | Abcam | ab150079 | |
| Bond primary antibody diluent | Lecia | AR9352 | |
| CD20 | Maixin Biotechnology Co., Ltd | kit-0001 | |
| CD3 | Maixin Biotechnology Co., Ltd. | kit-0003 | |
| CD8 | Maixin Biotechnology Co., Ltd | RMA-0514 | |
| CK | Maixin Biotechnology Co. Ltd. | MAB-0671, | |
| DAPI | sig-ma | D8417 | |
| ethanol | Sinopharm Group Chemical reagent Co., LTD | 10009218 | |
| Histocore Multicut | lecia | 2245 | |
| PBS(powder) | Maixin Biotechnology Co., Ltd | PBS-0061 | |
| slide viwer | 3D histech Ltd | ||
| xylene | Sinopharm Group Chemical reagent Co., LTD | 10023418 |
Références
- Wanleenuwat, P., Iwanowski, P. Metastases to the central nervous system: Molecular basis and clinical considerations. J Neurol Sci. 412, 116755(2020).
- Schoenmaekers, J., Dingemans, A. C., Hendriks, L. E. L. Brain imaging in early stage non-small cell lung cancer: still a controversial topic. J Thorac Dis. 10, S2168-S2171 (2018).
- Vilariño, N., Bruna, J., Bosch-Barrera, J., Valiente, M., Nadal, E. Immunotherapy in NSCLC patients with brain metastases. Understanding brain tumor microenvironment and dissecting outcomes from immune checkpoint blockade in the clinic. Cancer Treat Rev. 89, 102067(2020).
- Babar, Q., Saeed, A., Tabish, T. A., Sarwar, M., Thorat, N. D. Targeting the tumor microenvironment: Potential strategy for cancer therapeutics. Biochim Biophys Acta Mol Basis Dis. 1869 (6), 166746(2023).
- Goldberg, S. B., et al. Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial. Lancet Oncol. 21 (5), 655-663 (2020).
- Sukswai, N., Khoury, J. D. Immunohistochemistry Innovations for Diagnosis and Tissue-Based Biomarker Detection. Curr Hematol Malig Rep. 14 (5), 368-375 (2019).
- Janardhan, K. S., Jensen, H., Clayton, N. P., Herbert, R. A. Immunohistochemistry in Investigative and Toxicologic Pathology. Toxicol Pathol. 46 (5), 488-510 (2018).
- Torlakovic, E. E., Nielsen, S., Vyberg, M., Taylor, C. R. Getting controls under control: the time is now for immunohistochemistry. J Clin Pathol. 68 (11), 879-882 (2015).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Commun (Lond). 40 (4), 135-153 (2020).
- Wong, P. F., et al. Multiplex quantitative analysis of tumor-infiltrating lymphocytes and immunotherapy outcome in metastatic melanoma. Clin Cancer Res. 25 (8), 2442-2449 (2019).
- Sanchez, K., et al. Multiplex immunofluorescence to measure dynamic changes in tumor-infiltrating lymphocytes and PD-L1 in early-stage breast cancer. Breast Cancer Res. 23 (1), 2(2021).
- Zhang, W., et al. Multiplex immunohistochemistry indicates biomarkers in colorectal cancer. Neoplasma. 68 (6), 1272-1282 (2021).
- Salameh, S., Nouel, D., Flores, C., Hoops, D. An optimized immunohistochemistry protocol for detecting the guidance cue Netrin-1 in neural tissue. MethodsX. 5, 1-7 (2018).
- McClellan, P., Jacquet, R., Yu, Q., Landis, W. J. A Method for the immunohistochemical identification and localization of Osterix in periosteum-wrapped constructs for tissue engineering of bone. J Histochem Cytochem. 65 (7), 407-420 (2017).
- Sun, Y., et al. Sudan black B reduces autofluorescence in murine renal tissue. Arch Pathol Lab Med. 135 (10), 1335-1342 (2011).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. J Immunother Cancer. 8 (1), 000155(2020).
- Clarke, G. M., et al. A novel, automated technology for multiplex biomarker imaging and application to breast cancer. Histopathology. 64 (2), 242-255 (2014).
- Oliveira, V. C., et al. Sudan Black B treatment reduces autofluorescence and improves resolution of in situ hybridization specific fluorescent signals of brain sections. Histol Histopathol. 25 (8), 1017-1024 (2010).
- Ahrens, M. J., Dudley, A. T. Chemical pretreatment of growth plate cartilage increases immunofluorescence sensitivity. J Histochem Cytochem. 59 (4), 408-418 (2011).
- Zhang, Y., et al. Spectral characteristics of autofluorescence in renal tissue and methods for reducing fluorescence background in confocal laser scanning microscopy. J Fluoresc. 28 (2), 561-572 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon