Method Article
Zyklische Multiplex-Fluoreszenz-Immunhistochemie
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Die zyklische Multiplex-Immunhistochemie ermöglicht den gleichzeitigen In-situ-Nachweis mehrerer Marker durch wiederholte Antigen-Antikörper-Inkubation, Bildscannen sowie Bildausrichtung und -integration. Hier stellen wir das Operationsprotokoll zur Identifizierung von Immunzellsubstraten mit dieser Technologie in Lungenkrebs- und gepaarten Hirnmetastasenproben vor.
Zusammenfassung
Die Tumormikroumgebung beinhaltet Wechselwirkungen zwischen Wirtszellen, Tumorzellen, Immunzellen, Stromazellen und Gefäßen. Die Charakterisierung und räumliche Organisation von Immunzelluntergruppen und Zielproteinen ist für prognostische und therapeutische Zwecke von entscheidender Bedeutung. Dies hat zur Entwicklung von Multiplex-Immunhistochemie-Färbemethoden geführt. Die Multiplex-Fluoreszenz-Immunhistochemie ermöglicht den gleichzeitigen Nachweis mehrerer Marker und ermöglicht so ein umfassendes Verständnis der Zellfunktion und der interzellulären Interaktionen. In diesem Artikel beschreiben wir einen Arbeitsablauf für den zyklischen Multiplex-Fluoreszenz-Immunhistochemie-Assay und seine Anwendung in der Quantifizierungsanalyse von Lymphozyten-Untergruppen. Die zyklische Multiplex-Fluoreszenz-Immunhistochemie-Färbung folgt ähnlichen Schritten und Reagenzien wie die Standard-Immunhistochemie, einschließlich Antigengewinnung, zyklischer Antikörperinkubation und Färbung auf einem formalinfixierten paraffineingebetteten (FFPE) Gewebeobjektträger. Während der Antigen-Antikörper-Reaktion wird eine Mischung aus Antikörpern verschiedener Spezies hergestellt. Bedingungen, wie z. B. die Antigen-Retrieval-Zeit und die Antikörperkonzentration, werden optimiert und validiert, um das Signal-Rausch-Verhältnis zu erhöhen. Diese Technik ist reproduzierbar und dient als wertvolles Werkzeug für die Immuntherapieforschung und klinische Anwendungen.
Einleitung
Hirnmetastasen (BM) stellen die häufigsten Tumoren des zentralen Nervensystems (ZNS) dar, die bei fast der Hälfte der Fälle von nicht-kleinzelligem Lungenkrebs (NSCLC) auftreten und eine schlechte Prognosehaben 1. Schätzungsweise 10 % bis 20 % der NSCLC-Patienten haben zum Zeitpunkt der Erstdiagnose bereits eine BM, und etwa 40 % der NSCLC-Fälle entwickeln im Verlauf der Behandlung eine BM2. Die Tumormikroumgebung (TME) ist eng mit dem Auftreten und der BM von NSCLC verbunden, einschließlich verschiedener Komponenten wie Blutgefäße, Fibroblasten, Makrophagen, extrazelluläre Matrix (EZM), lymphoide, aus dem Knochenmark stammende Immunzellen und Signalmoleküle 3,4. Mikroumgebungs-Immunzellen spielen eine entscheidende Rolle bei der Beeinflussung des Wachstums und der Entwicklung von Krebszellen. Hirnmetastasen stellen zahlreiche potenzielle Behandlungsziele dar, die durch komplexe immunologische Mikroumgebungen und Signalprozesse gekennzeichnet sind. Beispielsweise haben PD-1-Inhibitoren klinische Wirksamkeit bei Patienten mit Lungenkrebs-Hirnmetastasen (LCBM) als Immun-Checkpoint-Inhibitor (ICI) gezeigt. Die Häufigkeit des Ansprechens auf die PD-1-Therapie variiert jedoch zwischen primärem NSCLC und LCBM5, was darauf hindeutet, dass die Tumorimmunmikroumgebung als kritischer ICI-Regulator fungiert.
Die Immunhistochemie (IHC) ist ein unschätzbares Werkzeug in den Bereichen Biologie, Grundlagenmedizin und Pathologie6. Diese Nachweismethode visualisiert die Antigenexpression durch die Interaktion von Antigen-Antikörper auf einem Gewebeobjektträger7. IHC wird zur Diagnose prädiktiver Marker, zur Bewertung prognostischer Marker, zur Steuerung gezielter Therapien und zur Erforschung der biologischen Funktionen von Tumorzellen verwendet8. Die traditionelle IHC-Methode kann jedoch jeweils nur einen Biomarker nachweisen. Um diese Einschränkung zu beheben, hat die Innovation der immunhistochemischen Technologie zur Entwicklung der Multiplex-Fluoreszenz-Immunhistochemie (mfIHC) geführt, die die gleichzeitige Identifizierung mehrerer Proteinmarker auf demselben Gewebeobjektträger ermöglicht, sowohl im Hellfeld als auch im Fluoreszenzfeld9. Dieser Fortschritt ermöglicht eine genaue Analyse der Zellzusammensetzung und der molekularen Wechselwirkungen zwischen Stromazellen, Immunzellen und Krebszellen innerhalb der TME.
In dieser Studie stellen wir ein Protokoll für zyklische Multiplex-Immunhistochemie vor, um die räumliche Verteilung von Immunzellen zu analysieren. Zwei Primärantikörper verschiedener Spezies, wie Kaninchen und Ratte, werden gleichzeitig für die Inkubation ausgewählt, gefolgt von fluoreszenzmarkierten Sekundärantikörpern. Die Antigen-Retrieval wird nach jeder Runde der Antigen-Antikörper-Reaktion durchgeführt. Die Autofluoreszenz wird blockiert und 4', 6-Diamidino-2-phenylindol (DAPI) wird zur Färbung der Zellkerne verwendet. Das Panel umfasst den sequentiellen Nachweis von CD3, CD8, CD20 und CK, die Zellen werden nach den Markern kategorisiert: Tumorzellen (CK+), reife T-Zellen (CD3+), zytotoxische T-Zellen (CD3+CD8+), B-Zellen (CD20+)10,11.
Protokoll
Die Forschung wurde von der medizinischen Ethikkommission des Yunnan Cancer Hospital/des Third Affiliated Hospital der Kunming Medical University genehmigt. Alle Probanden/Erziehungsberechtigten haben eine Einverständniserklärung unterschrieben.
1. Vorbereitung der Objektträger
- Schneiden Sie Abschnitte von gepaarten Paraffinblöcken, die primäre Lungentumor- oder Lungenkrebs-Hirnmetastasen enthalten, mit einer Dicke von 4 μm mit einem Mikrotom. Entfernen Sie die Abschnitte zum Wasser und trennen Sie sie mit einer Pinzette, wählen Sie die beste aus und kleben Sie sie auf den polylysinbeschichteten Objektträger.
- Legen Sie die Gewebeobjektträger 30 Minuten lang bei 65 °C in einen Ofen, um die Gewebehaftung zu verbessern.
- Tauchen Sie die Objektträger durch drei Wechsel, die jeweils 10 Minuten dauern, in Xylol.
- Reduzieren Sie allmählich die Alkoholkonzentration und inkubieren Sie die Objektträger 5 Minuten lang in 100 % Ethanol, 5 Minuten lang 90 % Ethanol, 5 Minuten lang 75 % Ethanol und 3 Minuten lang in entionisiertem Wasser.
2. Wärmeinduzierte Epitopgewinnung (HIER)
- Verdünnen Sie 100x Natriumcitrat-Pufferlösung (pH 6,0) auf 1x (10 mM) in deionisiertem Wasser und bereiten Sie genügend Pufferlösung vor, um die Objektträger vollständig einzutauchen.
- Legen Sie die Objektträger in einen Schnellkochtopf und setzen Sie sie 2 Minuten lang hoher Hitze (100 °C) und Druck (~30 psi) aus. Lassen Sie die Objektträger nach dem Erhitzen 3 Minuten lang in destilliertem Wasser auf Raumtemperatur abkühlen.
- Eine Packung mit 52 g phosphatgepufferter Kochsalzlösung (PBS; pulverisiert) in 5 l deionisiertem Wasser zur Herstellung einer PBS-Pufferlösung (pH 7,0) auflösen. Legen Sie die Objektträger 5 Minuten lang mit 3 Wechseln in die PBS-Pufferlösung.
3. Peroxidase-Blockierung
- Die Schnitte mit 3% Wasserstoffperoxid bedecken und 10 min bei Raumtemperatur inkubieren. Spülen Sie die Objektträger in PBS aus, 3x für jeweils 5 Minuten.
- Verwenden Sie Filterpapier, um überschüssiges Wasser vom Umfang des Gewebes wegzunehmen. Achten Sie in der Zwischenzeit darauf, dass das Gewebe feucht ist.
4. Primärantikörper-Inkubation für die erste Runde
- Bereiten Sie eine Arbeitsmischung der Primärantikörper für CD8 (monoklonaler Kaninchen-Antikörper, Klon SP16) und CD20 (monoklonaler Maus-Antikörper, Klon L26) her, verdünnt 1:50 in Bond-Primärantikörper-Verdünnungsmittel.
- Den Antikörperkomplex auf die Schnitte geben und 1 h bei Raumtemperatur inkubieren.
- Bereiten Sie eine Lösung aus 0,1% Tween/phosphatgepufferter Kochsalzlösung vor: 1 ml Tween in 1 l PBS-Pufferlösung.
- Waschen Sie die Abschnitte mit 0,1% Tween/phosphatgepufferter Kochsalzlösung, 3x für jeweils 5 min. Verwenden Sie Filterpapier, um überschüssiges Wasser vom Umfang des Gewebes abzuleiten, während Sie sicherstellen, dass das Gewebe feucht ist.
5. Inkubation von Sekundärantikörpern für die erste Runde
- Bereiten Sie eine Mischung aus fluoreszenzmarkiertem Ziegen-Anti-Kaninchen-Antikörper (Anregung (Ex): 495 nm) und Ziegen-Anti-Maus-Antikörper (Ex: 578 nm) her, verdünnt 1:50 in Phosphatpuffer-Kochsalzlösung. Der Ziegen-Anti-Kaninchen-Antikörper bindet an den primären Antikörper von CD8 und der Ziegen-Anti-Maus-Antikörper an den primären Antikörper von CD20.
- Die sekundäre Antikörpermischung tropfenweise zugeben und 1 h bei Raumtemperatur inkubieren.
6. Wärmeinduzierte Epitopgewinnung und Peroxidase-Blockierung
- Verdünnen Sie 100x Natriumcitrat (pH 6,0) auf 1x (10 mM) in deionisiertem Wasser und bereiten Sie genügend Pufferlösung vor, um die Objektträger vollständig einzutauchen.
- Legen Sie die Objektträger in einen Schnellkochtopf und setzen Sie sie 1 Minute lang hoher Hitze (100 °C) und Druck (~30 psi) aus. Legen Sie die Objektträger nach dem Erhitzen 3 Minuten lang in destilliertes Wasser, um sie auf Raumtemperatur abzukühlen.
- Führen Sie die Peroxidase-Blockierung wie in Schritt 3 beschrieben durch.
7. Inkubation von Primärantikörpern für die zweite Runde
- Bereiten Sie eine Arbeitsmischung der primären Antikörper für CD3 (monoklonaler Kaninchen-Antikörper, Klon SP7) und CK (monoklonaler Maus-Antikörper, MX005) vor, verdünnt 1:50 in primärem Antikörperverdünnungsmittel.
- Den Antikörperkomplex auf die Schnitte geben und 1 h bei Raumtemperatur inkubieren.
- Mit 0,1% Tween/phosphatgepufferter Kochsalzlösung waschen, 3x für jeweils 5 min. Verwenden Sie Filterpapier, um überschüssiges Wasser vom Umfang des Gewebes abzuleiten, während Sie sicherstellen, dass das Gewebe feucht ist.
8. Sekundäre Antikörperinkubation für die zweite Runde
- Ziegen-Anti-Kaninchen-Antikörper (z. B. 652 nm) und Ziegen-Anti-Maus-Antikörper (z. B. 590 nm) herstellen, Verdünnung 1:50 in Phosphatpuffer-Kochsalzlösung. Der Ziegen-Anti-Kaninchen-Antikörper bindet an den primären Antikörper von CD3 und der Ziegen-Anti-Maus-Antikörper an den primären Antikörper von CK.
- Sekundäre Antikörpermischung tropfenweise zugeben, 1 h bei Raumtemperatur inkubieren. Mit 0,1% Tween/phosphatgepufferter Kochsalzlösung waschen, 3x für jeweils 5 min.
9. Autofluoreszenzlöschung und DAPI-Färbung
- Reagenz (0,15 M/L KMnO4) 1 Minute lang in den Gewebeschnitt geben. 5 Min. mit fließendem Wasser abspülen.
ACHTUNG: KMnO4 ist giftig und schädigt die Haut. Achten Sie darauf, beim Umgang mit den Objektträgern Handschuhe zu tragen. Wenn die Flüssigkeit auf die Haut tropft, wischen Sie sie schnell mit sauberen Servietten ab und spülen Sie sie mit fließendem Wasser ab. - Trocknen Sie den Objektträger mit steigenden Alkoholkonzentrationen (70 %, 90 %, 100 %) für 3 Minuten in jeder Konzentration.
- Fügen Sie DAPI und Deckglas für multispektrale Bildgebung hinzu. Die Menge an DAPI hängt von der Gewebegröße ab. Stellen Sie sicher, dass das Gewebe nach dem Hinzufügen des Deckglases vollständig von DAPI bedeckt ist.
10. Scannen von Objektträgern
- Legen Sie die Objektträger auf ein Tablett und drücken Sie, bis es nicht mehr weiter geschoben werden kann.
- Um das Programm zu starten, doppelklicken Sie auf das Programmsymbol auf dem Desktop. Während des Startvorgangs wird das Modusauswahlfenster angezeigt. Das Auswahlfenster zeigt zwei Hellfeld- und Fluoreszenzmodi an: den automatischen Modus und den manuellen Modus. Klicken Sie im Fluoreszenz-Scan-Modus auf Automatischer Modus.
- Bewegen Sie den Mauszeiger über ? , um die Informationen zu den Einstellungen anzuzeigen. Klicken Sie auf Filtereinstellung > Filterkanal , um die Kanalnummer > Pseudofarbe auszuwählen. Definieren Sie die Farbe und speichern Sie.
- Klicken Sie auf Routinearbeiten > Scanmodus > Vollautomatisch. Klicken Sie auf Routinearbeit > Folienname , um den Foliennamen für die Ausgabe zu definieren. Klicken Sie > Kanaleinstellungen auf Routinearbeit , um Filter auszuwählen.
- Klicken Sie auf Routinearbeit > Scanoptionen , um die resultierende Qualität und den Speicherort des virtuellen Objektträgers zu bestimmen.
- Klicken Sie auf Vorschau , um den Schwellenwert festzulegen und den zu scannenden Bereich auszuwählen.
- Klicken Sie auf Hardware > Filter > Live > Autofokus > Automatische Belichtung > Digitale Verstärkung > Häkchen Manuelle Belichtungszeit verwenden > Häkchen, um den Bereich > Strom einstellen einzuschränken.
- Klicken Sie auf Routinearbeiten > Scan starten. Wählen Sie die Vergrößerungsstufe als 20x oder 40x. Wählen Sie 20x für geeignete Dateigrößen. MRXS wird durch den 3D Pannoramic MIDI Scanner definiert. Die Bilderweiterung kann auch in ein TIFF-Bild geändert werden.
- Klicken Sie auf Dia-Viewer > Multiview-Toolbox , um das Bild für die Konfiguration auszuwählen und dann auszurichten und zu integrieren.
11. Quantitative Bewertung von Zelldichten
- Quantifizieren Sie den Prozentsatz positiver Immunzellen (CD3+, CD3+CD8+, CD20+) in Tumor- und Stromabereichen mit der Halo 10 Scanner-Software. Validieren Sie die CK-Färbung zur Definition von Tumorgewebe.
Ergebnisse
Wir präsentieren ein Protokoll für den zyklischen Antigennachweis mit 5-Farben-Multiplex-Fluoreszenz auf einem einzigen Objektträger. Durch unsere Optimierung des Assays ermöglichen wir die Inkubation von zwei Antikörpern aus verschiedenen Spezies (Abbildung 1). Zu den notwendigen Geräten für den Versuchsablauf gehören ein Schnellkochtopf und eine Immunfärbebox (Abbildung 2A).
Nach Abschluss des Assays definieren wir die Pseudofarbe der vier Marker, bevor wir die Objektträger scannen. Die Pseudofarben von CD3, CD8, CD20 und CK sind Gelb, Rot, Grün bzw. Cyan. Die Kerne sind mit DAPI markiert. Repräsentative Regionen von Tumor und Stroma werden für die Analyse ausgewählt. Das Fluoreszenzspektrum bei 495 nm, 578 nm, 652 nm und 590 nm wird mit einem automatischen digitalen 3D-Diascanner erfasst. Ein repräsentatives Stapelbild und einfach markierte Bilder in Lungenkrebs-Hirnmetastasengewebe sind in Abbildung 2B dargestellt. Basierend auf Bildern, die ein einzelnes Marker-Fluoreszenzsignal enthielten, extrahierte die Scanner-Software Zellphänotypmerkmale basierend auf Pseudofarben. Es wurden auch die entsprechende Anzahl positiver Immunzellen und die Gesamtzahl der Immunzellen gezählt. Jeder gefärbte Proteingehalt wird in den detektierten Geweben durch Berechnung des H-Scores12 quantifiziert. Nach diesen Verfahren werden die Anzahl der einzelnen tumorinfiltrierenden Lymphozytentypen und der Anteil jedes Zelltyps an der Gesamtzahl der Zielzellen gezählt und analysiert. Der Anteil jedes Immunzelltyps stellt den effektiven Prozentsatz der tumorinfiltrierenden Lymphozyten dar. Der Prozentsatz von CD3+, CD3+CD8+ T-Zellen und CD20+ B-Zellen wurde in Lungenkrebs-Hirnmetastasen im Vergleich zu primären Lungenkrebsabschnitten analysiert. Repräsentative Ergebnisse sind in Abbildung 3 dargestellt. Die Dichte der Immunzellen (CD3+ T-Zellen, CD3+ CD8+ T-Zellen) ist bei Lungenkrebs-Hirnmetastasen geringer als bei primärem Lungenkrebs. CD20+ B-Zellen sind in der Hirnmetastasengruppe höher als in der primären Lungenkrebsgruppe. Die Ergebnisse unterscheiden sich jedoch nicht signifikant zwischen diesen beiden Gruppen für die begrenzten Stichproben.

Abbildung 1: Arbeitsablauf der zyklischen Multiplex-Fluoreszenz-Immunhistochemie-Färbung. Die 4 μm langen Abschnitte werden geschnitten und auf Klebeobjektträger geklebt. Die folgenden Arbeitsschritte werden durchgeführt: Entparaffinisierung und Rehydration, Antigengewinnung, Antigenrückgewinnung, Antigenblockierung, Inkubation der Primärantikörpermischung, Inkubation der Sekundärantikörperinkubation, dann Wiederholung der Schritte der Antigengewinnung, Antigenblockierung, Inkubation der Primärantikörpermischung und der Inkubation der Sekundärantikörper, gefolgt von der Reduzierung der Autofluoreszenz, der Auswahl des geeigneten Filters für das Scannen von Objektträgern und der Analyse der Ergebnisse. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
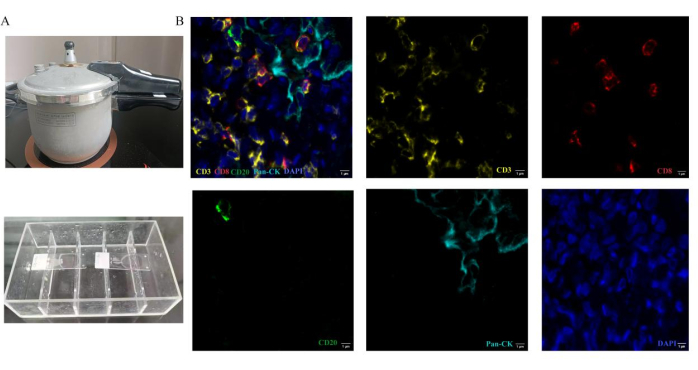
Abbildung 2: Operationsmethoden der Multiplex-Fluoreszenz-Immunhistochemie-Färbung. Die Antigenbehandlung wird durch Erhitzen von Abschnitten in einem Schnellkochtopf durchgeführt. (A) Der Schnellkochtopf wird für die hitzeinduzierte Epitopgewinnung verwendet. Bei der Antikörperinkubation werden die Objektträger in die Immunfärbebox gelegt. (B) Repräsentative zusammengesetzte und einfach gefärbte Bilder für das Panel, das in Lungenkrebs-Hirnmetastasengewebe verwendet wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Anteil der Immunzellen an primären Lungenkrebs- und Lungenkrebs-Hirnmetastasen. Der Anteil der CD3+-, CD3+CD8+- und CD20+-Immunzellen in vier Lungenkrebs-Hirnmetastasengeweben ist niedriger als der Anteil gepaarter primärer Lungenkrebsgewebe (Fehlerbalken: Standardabweichung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Wir haben den Prozess für die zyklische Multiplex-Fluoreszenz-Immunhistochemie-Färbung beschrieben. Die Auswahl der primären Antikörper ist ein entscheidender Aspekt des Fluoreszenz-Immunhistochemie-Assays, und monoklonale Antikörper werden für eine bessere Spezifität und Wiederholbarkeit empfohlen. Um die Arbeitskonzentration des primären Antikörpers zu optimieren, wurde eine Reihe von Verdünnungen durch immunhistochemische Experimente getestet. Sowohl Positivkontrollen (zur Beurteilung der Zielantigenexpression) als auch Negativkontrollen (keine primäre Antikörperinkubation) sind unerlässlich und sollten eingerichtet werden.
In diesem Protokoll werden die Primärantikörper verdünnt und für eine Mischung aus verschiedenen Spezies vorbereitet. Die fluoreszenzmarkierten Sekundärantikörper werden ebenfalls auf die gleiche Weise gepoolt und inkubiert, die von verschiedenen Spezies stammen. Der entscheidende Schritt ist also die Auswahl der Spezies für verschiedene primäre Antikörper auf der Grundlage der Antigene, und der monoklonale Antikörper wird im Vergleich zu polyklonalen Antikörpern bevorzugt. Diese können sicherstellen, dass die Kombination zwischen Primärantikörper und Sekundärantikörper spezifisch ist. Die gemischte Flüssigkeit sollte die Arbeitskonzentration für beide Primärantikörper erreichen, und es sollte keine Kreuzreaktivität zwischen den beiden Antikörpern gleichzeitig bestehen. Wenn die primären Antikörper von derselben Spezies sind, wird zuerst ein sekundärer Antikörper inkubiert, dann der zweite. Bei der Bestimmung der Sequenz der primären Antikörperinkubation in einem Panel sollte Antikörpern Vorrang eingeräumt werden, die empfindlich auf die Antigen-Antikörper-Reaktion reagieren, bei den Antigenen mit niedriger Expression würde die Intensität während der zweiten Epitopentnahme zunehmen. Vor der zweiten Runde der Antikörperinkubation nimmt die wiederholte Antigenentnahme im Vergleich zur ersten Operation (2 Minuten) weniger Zeit (1 Minute) in Anspruch. Die Fluoreszenzintensität der vorherigen zyklischen Färbung nimmt nicht ab, obwohl die Schnitte zweimal hitzeinduziert entnommen werden. Um unspezifische Immunreaktivität zu vermeiden, müssen die Inkubationsbedingungen optimiert werden, einschließlich der Arbeitskonzentration der Antikörper, der Inkubationszeit und der Umgebungstemperatur.
In den letzten Jahrzehnten wurden verschiedene Methoden der Epitopgewinnung entwickelt, die sich vor allem in die hitzeinduzierte Epitopgewinnung (HIER) und die proteaseinduzierte Epitopgewinnung (PIER) unterteilen. Das Erhitzen ist eine effiziente Methode zur Antigengewinnung, die Antigenepitope freilegt und sie durch Antikörper effektiver detektiert13. Die beiden Hauptoptionen für die Antigengewinnung basieren auf Citratpuffer und EDTA-Puffer mit hohem pH-Wert14. Die optimierte Retrievalbedingung wird anhand des Zielantigens identifiziert.
Autofluoreszenz kann die Fluoreszenzbildgebung an Schnitten stören, die durch endogene Fluorophore und Reagenzien verursacht werden, die in der Gewebeverarbeitung verwendet werden15. Für die Elution ist die Verwendung eines zugehörigen Reagenzes erforderlich. Fluorophore werden mit Emissionspeaks ausgewählt, die Autofluoreszenzpeaks vermeiden (um 490 nm)16,17. Sudan Black B und NaBH4 wurden für das Abschrecken der Gewebeautofluoreszenz berichtet18,19. Die Kombination von Sudan Black B und NaBH4 reduzierte den Fluoreszenzhintergrund in gezieltem Nierenformalin-fixiertem, paraffineingebettetem Gewebe20. In diesem Protokoll ist die Gewebebehandlung von KMnO4 in einer Konzentration von 0,15 M/L für 1 Minute zeitsparend. KMnO4 bedeckt eine Schicht auf dem Gewebe zur Abschirmung der spontanen Fluoreszenz und reduziert die Hintergrundfluoreszenz, die spezifische Färbung des detektierten Proteins wird besser visualisiert.
Die gesamten Objektträger werden in vier verschiedenen Filterkanälen gescannt, eine Bildausrichtungsanalyse ist notwendig, es ist eine große Herausforderung, die Lokalisierung von einzelligen und subzellulären Strukturen auszurichten. Für multispektrale Bilder mit dieser Technik sind professionelle Lichtbildgebungsgeräte und quantitative Analysesoftware erforderlich, um spektrales Übersprechen zu vermeiden. Die teuren Kosten des Instruments schränken seine Anwendung ein. Die Co-Inkubation von zwei Antikörpern spart Zeit, insbesondere bei einem 6-Marker-Panel, das 3 Inkubationszyklen erfordert. Diese Technik wird verwendet, um eine detailliertere Charakterisierung von Immunzellen in Tumorimmunmikroumgebungen zu visualisieren. In Zukunft soll die Methode zur quantitativen Analyse tumorassoziierter tertiärer lymphatischer Strukturen eingesetzt werden.
Zusammenfassend lässt sich sagen, dass die zyklische Multiplex-Fluoreszenz-Immunhistochemie die Färbung mehrerer Targets durch einzeln markierte Fluorophore auf einem einzigen Objektträger ermöglicht. Dieser Assay bietet ein verbessertes Verständnis der räumlichen Verteilung von Zellen in der Mikroumgebung des Tumorimmuns, und die räumliche Nähe von Tumor-Immunzellen trägt zum Screening von Patienten bei, die von einer Immuntherapie profitieren.
Offenlegungen
Die Autoren erklären, dass ihnen keine konkurrierenden finanziellen Interessen oder persönlichen Beziehungen bekannt sind, die die in diesem Artikel berichtete Arbeit beeinflusst haben könnten.
Danksagungen
Diese Arbeit wurde unterstützt von der National Natural Science Foundation of China (NO.81860413, 81960455), dem Yunnan Science and Technology Department Fund (202001AY070001-080), der Scientific Research Foundation of Education Department der Provinz Yunnan (2019J1274).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.15 mol/L KmnO4 | Maixin Biotechnology Co. Ltd. | MST-8005 | |
| 100x sodium citrate | Maixin Biotechnology Co., Ltd | MVS-0100 | |
| 3% hydrogen peroxide | Maixin Biotechnology Co., Ltd | SP KIT-A1 | |
| 3D Pannoramic MIDI | 3D histech Ltd | Pannoramic MIDI 1.18 | |
| Alexa Fluor 488 | Abcam | ab150113 | |
| Alexa Fluor 568 | Abcam | ab175701 | |
| Alexa Fluor 594 | Abcam | ab150116 | |
| Alexa Fluor 647 | Abcam | ab150079 | |
| Bond primary antibody diluent | Lecia | AR9352 | |
| CD20 | Maixin Biotechnology Co., Ltd | kit-0001 | |
| CD3 | Maixin Biotechnology Co., Ltd. | kit-0003 | |
| CD8 | Maixin Biotechnology Co., Ltd | RMA-0514 | |
| CK | Maixin Biotechnology Co. Ltd. | MAB-0671, | |
| DAPI | sig-ma | D8417 | |
| ethanol | Sinopharm Group Chemical reagent Co., LTD | 10009218 | |
| Histocore Multicut | lecia | 2245 | |
| PBS(powder) | Maixin Biotechnology Co., Ltd | PBS-0061 | |
| slide viwer | 3D histech Ltd | ||
| xylene | Sinopharm Group Chemical reagent Co., LTD | 10023418 |
Referenzen
- Wanleenuwat, P., Iwanowski, P. Metastases to the central nervous system: Molecular basis and clinical considerations. J Neurol Sci. 412, 116755(2020).
- Schoenmaekers, J., Dingemans, A. C., Hendriks, L. E. L. Brain imaging in early stage non-small cell lung cancer: still a controversial topic. J Thorac Dis. 10, S2168-S2171 (2018).
- Vilariño, N., Bruna, J., Bosch-Barrera, J., Valiente, M., Nadal, E. Immunotherapy in NSCLC patients with brain metastases. Understanding brain tumor microenvironment and dissecting outcomes from immune checkpoint blockade in the clinic. Cancer Treat Rev. 89, 102067(2020).
- Babar, Q., Saeed, A., Tabish, T. A., Sarwar, M., Thorat, N. D. Targeting the tumor microenvironment: Potential strategy for cancer therapeutics. Biochim Biophys Acta Mol Basis Dis. 1869 (6), 166746(2023).
- Goldberg, S. B., et al. Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial. Lancet Oncol. 21 (5), 655-663 (2020).
- Sukswai, N., Khoury, J. D. Immunohistochemistry Innovations for Diagnosis and Tissue-Based Biomarker Detection. Curr Hematol Malig Rep. 14 (5), 368-375 (2019).
- Janardhan, K. S., Jensen, H., Clayton, N. P., Herbert, R. A. Immunohistochemistry in Investigative and Toxicologic Pathology. Toxicol Pathol. 46 (5), 488-510 (2018).
- Torlakovic, E. E., Nielsen, S., Vyberg, M., Taylor, C. R. Getting controls under control: the time is now for immunohistochemistry. J Clin Pathol. 68 (11), 879-882 (2015).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Commun (Lond). 40 (4), 135-153 (2020).
- Wong, P. F., et al. Multiplex quantitative analysis of tumor-infiltrating lymphocytes and immunotherapy outcome in metastatic melanoma. Clin Cancer Res. 25 (8), 2442-2449 (2019).
- Sanchez, K., et al. Multiplex immunofluorescence to measure dynamic changes in tumor-infiltrating lymphocytes and PD-L1 in early-stage breast cancer. Breast Cancer Res. 23 (1), 2(2021).
- Zhang, W., et al. Multiplex immunohistochemistry indicates biomarkers in colorectal cancer. Neoplasma. 68 (6), 1272-1282 (2021).
- Salameh, S., Nouel, D., Flores, C., Hoops, D. An optimized immunohistochemistry protocol for detecting the guidance cue Netrin-1 in neural tissue. MethodsX. 5, 1-7 (2018).
- McClellan, P., Jacquet, R., Yu, Q., Landis, W. J. A Method for the immunohistochemical identification and localization of Osterix in periosteum-wrapped constructs for tissue engineering of bone. J Histochem Cytochem. 65 (7), 407-420 (2017).
- Sun, Y., et al. Sudan black B reduces autofluorescence in murine renal tissue. Arch Pathol Lab Med. 135 (10), 1335-1342 (2011).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. J Immunother Cancer. 8 (1), 000155(2020).
- Clarke, G. M., et al. A novel, automated technology for multiplex biomarker imaging and application to breast cancer. Histopathology. 64 (2), 242-255 (2014).
- Oliveira, V. C., et al. Sudan Black B treatment reduces autofluorescence and improves resolution of in situ hybridization specific fluorescent signals of brain sections. Histol Histopathol. 25 (8), 1017-1024 (2010).
- Ahrens, M. J., Dudley, A. T. Chemical pretreatment of growth plate cartilage increases immunofluorescence sensitivity. J Histochem Cytochem. 59 (4), 408-418 (2011).
- Zhang, Y., et al. Spectral characteristics of autofluorescence in renal tissue and methods for reducing fluorescence background in confocal laser scanning microscopy. J Fluoresc. 28 (2), 561-572 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten