Method Article
Мультиплексная циклическая флуоресцентная иммуногистохимия
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мультиплексная циклическая иммуногистохимия позволяет in situ обнаруживать несколько маркеров одновременно с помощью повторной инкубации антиген-антитело, сканирования изображений, выравнивания и интеграции изображений. Здесь мы представляем операционный протокол идентификации субстратов иммунных клеток с помощью этой технологии в образцах рака легких и парных метастазов в головном мозге.
Аннотация
Микроокружение опухоли включает в себя взаимодействие между клетками хозяина, опухолевыми клетками, иммунными клетками, стромальными клетками и сосудистой сетью. Характеристика и пространственная организация субпопуляций иммунных клеток и белков-мишеней имеют решающее значение для прогностических и терапевтических целей. Это привело к разработке мультиплексных иммуногистохимических методов окрашивания. Мультиплексная флуоресцентная иммуногистохимия позволяет одновременно обнаруживать несколько маркеров, способствуя всестороннему пониманию функции клеток и межклеточных взаимодействий. В данной работе описывается рабочий процесс мультиплексного циклического флуоресцентного иммуногистохимического анализа и его применение в количественном анализе субпопуляций лимфоцитов. Мультиплексное циклическое флуоресцентное иммуногистохимическое окрашивание проходит те же этапы и реагенты, что и стандартная иммуногистохимия, включая извлечение антигена, циклическую инкубацию антител и окрашивание на предметном стекле ткани, закрепленном формалином и парафином (FFPE). Во время реакции антиген-антитело готовится смесь антител разных видов. Такие условия, как время извлечения антигена и концентрация антител, оптимизируются и проверяются для увеличения отношения сигнал/шум. Этот метод воспроизводим и служит ценным инструментом для исследований в области иммунотерапии и клинического применения.
Введение
Метастазы в головной мозг (БМ) представляют собой наиболее распространенные опухоли центральной нервной системы (ЦНС), встречающиеся почти в половине случаев немелкоклеточного рака легкого (НМРЛ) с неблагоприятным прогнозом1. По оценкам, 10–20% пациентов с НМРЛ уже имеют БМ на момент постановки первоначального диагноза, и примерно у 40% пациентов с НМРЛ БМ развивается в течение курса лечения2. Микроокружение опухоли (ТМЭ) тесно связано с возникновением НМРЛ и БМ, включая различные компоненты, такие как кровеносные сосуды, фибробласты, макрофаги, внеклеточный матрикс (ВКМ), лимфоидные иммунные клетки, иммунные клетки костного мозга и сигнальные молекулы 3,4. Иммунные клетки микроокружения играют решающую роль во влиянии на рост и развитие раковых клеток. Метастазы в головном мозге представляют собой многочисленные потенциальные мишени для лечения, характеризующиеся сложным иммунологическим микроокружением и сигнальными процессами. Например, ингибиторы PD-1 показали клиническую эффективность у пациентов с метастазами рака легких в головной мозг (ЛКМ) в качестве ингибитора контрольных точек иммунного ответа (ИКТИ). Тем не менее, частота ответов на терапию PD-1 варьируется между первичным НМРЛ и LCBM5, что позволяет предположить, что опухолевое иммунное микроокружение действует как важнейший регулятор ICI.
Иммуногистохимия (ИГХ) является бесценным инструментом в области биологии, фундаментальной медицины и патологии6. Этот метод детекции визуализирует экспрессию антигена через взаимодействие антиген-антитело на предметном стеклеткани 7. ВПХ используется для диагностики прогностических маркеров, оценки прогностических маркеров, назначения таргетной терапии и изучения биологических функций опухолевых клеток8. Однако традиционный метод ВПХ может обнаружить только один биомаркер за раз. Чтобы устранить это ограничение, инновация иммуногистохимической технологии привела к разработке мультиплексной флуоресцентной иммуногистохимии (mfIHC), которая позволяет одновременно идентифицировать несколько белковых маркеров на одном и том же предметном стекле ткани, как в светлом, так и во флуоресцентном поле9. Это достижение обеспечивает точный анализ клеточного состава и молекулярных взаимодействий между стромальными клетками, иммунными клетками и раковыми клетками в пределах TME.
В данном исследовании представлен протокол мультиплексной циклической иммуногистохимии для анализа пространственного распределения иммунных клеток. Для инкубации одновременно выбираются два первичных антитела разных видов, таких как кролик и крыса, за которыми следуют флуоресцентно меченные вторичные антитела. Забор антигена проводится после каждого раунда реакции антиген-антитело. Аутофлуоресценция блокируется, и для окрашивания ядер используется 4', 6-диамидино-2-фенилиндол (DAPI). Панель включает последовательное определение CD3, CD8, CD20 и КФК, клетки классифицируются по маркерам: опухолевые клетки (CK+), зрелые Т-клетки (CD3+), цитотоксические Т-клетки (CD3+CD8+), В-клетки (CD20+)10,11.
протокол
Исследование было одобрено комитетом по медицинской этике Юньнаньской онкологической больницы/Третьей филиальной больницы Куньминского медицинского университета. Все субъекты/законные опекуны подписали информированное согласие.
1. Подготовка слайдов
- С помощью микротома вырезать срезы парных парафиновых блоков, содержащих клетки первичной опухоли легкого или рака легкого с метастазами в головной мозг, толщиной 4 мкм. Срезы опустите в воду и отделите пинцетом, выберите лучший и приклейте его на предметное стекло с полилизиновым покрытием.
- Поместите предметные стекла тканей в духовку при температуре 65 °C на 30 минут, чтобы усилить адгезию тканей.
- Погрузите слайды в ксилол в три смены, каждая из которых длится 10 минут.
- Постепенно снижайте концентрацию спирта и инкубируйте предметные стекла в 100% этаноле в течение 5 мин, 90% этаноле в течение 5 мин, 75% этаноле в течение 5 мин и в деионизированной воде в течение 3 мин.
2. Извлечение эпитопов, индуцированных теплом (HIER)
- Разбавьте 100-кратный буферный раствор цитрата натрия (pH 6,0) до 1x (10 мМ) в деионизированной воде, приготовив достаточное количество буферного раствора для полного погружения предметных стекол.
- Поместите слайды в скороварку, подвергая их сильному нагреву (100 °C) и давлению (~30 фунтов на квадратный дюйм) в течение 2 минут. После нагрева дайте предметным стеклам остыть до комнатной температуры в дистиллированной воде в течение 3 минут.
- Растворите один пакетик 52 г фосфатно-солевого буфера (ФБС; порошкообразный) в 5 л деионизированной воды для приготовления буферного раствора ПБС (рН 7,0). Поместите предметные стекла в буферный раствор PBS на 5 минут с 3 заменами.
3. Блокирование пероксидазы
- Накройте срезы 3%-ной перекисью водорода и выдержите 10 мин при комнатной температуре. Промойте предметные стекла в PBS 3 раза по 5 минут каждый.
- Используйте фильтровальную бумагу, чтобы впитать лишнюю воду по периметру ткани. Тем временем следите за тем, чтобы ткань была влажной.
4. Инкубация первичных антител для первого раунда
- Готовят рабочую смесь первичных антител к CD8 (моноклональное антитело кролика, клон SP16) и CD20 (моноклональное антитело мыши, клон L26), разбавленную 1:50 в разбавителе первичных антител Бонда.
- Добавьте комплекс антител на срезы и инкубируйте в течение 1 ч при комнатной температуре.
- Приготовьте раствор из 0,1% твин/фосфатно-буферного солевого раствора: 1 мл твина в 1 л буферного раствора PBS.
- Промойте участки 0,1% солевым раствором, буферизованным от Tween/фосфатов, 3 раза по 5 минут каждая. Используйте фильтровальную бумагу, чтобы отвести лишнюю воду от периметра салфетки, при этом убедитесь, что ткань влажная.
5. Инкубация вторичных антител для первого раунда
- Приготовьте смесь флуоресцентно-меченых козьих антител против кроликов (возбуждение (Ex): 495 нм) и козьих антител против мышей (Ex: 578 нм), разбавленных 1:50 в фосфатном буферном растворе. Козье антикроличье антитело присоединяется к первичному антителу CD8, а козье антитело к мыши присоединяется к первичному антителу CD20.
- Добавьте смесь вторичных антител по каплям и инкубируйте при комнатной температуре в течение 1 ч.
6. Теплоиндуцированный забор эпитопов и блокирование пероксидазы
- Разбавьте 100-кратный цитрат натрия (pH 6,0) до 1x (10 мМ) в деионизированной воде, приготовив достаточное количество буферного раствора для полного погружения предметных стекол.
- Поместите слайды в скороварку и подвергните их сильному нагреву (100 °C) и давлению (~30 фунтов на квадратный дюйм) в течение 1 минуты. После нагревания поместите предметные стекла в дистиллированную воду, чтобы они остыли до комнатной температуры в течение 3 минут.
- Выполните блокирование пероксидазы, как описано в шаге 3.
7. Инкубация первичных антител для второго раунда
- Готовят рабочую смесь первичных антител к CD3 (моноклональное антитело кролика, клон SP7) и КФК (моноклональное антитело мыши, MX005), разбавленную 1:50 в разбавителе первичных антител.
- Добавьте комплекс антител на срезы и инкубируйте в течение 1 ч при комнатной температуре.
- Промывайте 0,1% солевым буфером Tween/фосфатным раствором, 3 раза по 5 минут каждый. Используйте фильтровальную бумагу, чтобы отвести лишнюю воду от периметра салфетки, при этом убедитесь, что ткань влажная.
8. Инкубация вторичных антител для второго раунда
- Приготовьте смесь козьих антикроличьих (Ex: 652 нм) и козьих антител против мышей (Ex: 590 нм), разведение 1:50 в фосфатном буферном растворе. Козье антикроличье антитело присоединяется к первичному антителу CD3, а козье антитело к мыши присоединяется к первичному антителу КФК.
- Добавить смесь вторичных антител по каплям, инкубировать при комнатной температуре в течение 1 ч. Промывайте 0,1% солевым буфером Tween/фосфатным раствором, 3 раза по 5 минут каждый.
9. Аутофлюоресцентная тушка и окрашивание DAPI
- Добавьте реагент (0,15 м/л KMnO4) в срез ткани на 1 мин. Смойте проточной водой в течение 5 мин.
ВНИМАНИЕ: KMnO4 токсичен и повреждает кожу. Обязательно надевайте перчатки при работе с горками. Если жидкость попала на кожу, быстро вытрите ее чистыми салфетками и промойте проточной водой. - Высушите предметное стекло с возрастающей концентрацией спирта (70%, 90%, 100%) в течение 3 мин в каждой концентрации.
- Добавьте DAPI и coverslip для мультиспектральной съемки. Количество DAPI зависит от размера ткани. Убедитесь, что ткань полностью покрыта DAPI после добавления покровного стекла.
10. Сканирование слайдов
- Поместите слайды на поднос и нажимайте до тех пор, пока его нельзя будет толкнуть дальше.
- Чтобы запустить программу, дважды щелкните значок программы на рабочем столе. Во время запуска отображается окно выбора режима. В окне выбора отображаются два режима светлого поля и флуоресцентного режима: автоматический и ручной. В режиме флуоресцентного сканирования нажмите кнопку Автоматический режим.
- Наведите курсор мыши на ? , чтобы отобразить информацию о настройках. Нажмите кнопку «Настройка фильтра» > «Фильтр канала », чтобы выбрать «Номер канала» > «Псевдоцвет». Определите цвет и сохраните.
- Щелкните Рутинная работа > режиме сканирования > Полностью автоматический. Щелкните Рутинная работа > Имя слайда , чтобы определить имя слайда для вывода. Нажмите «Рутинная работа» > «Настройки канала », чтобы выбрать фильтры.
- Нажмите кнопку «Рутинная работа» > «Параметры сканирования», чтобы определить итоговое качество и место хранения виртуального слайда.
- Нажмите кнопку Предварительный просмотр, чтобы установить пороговое значение и выбрать диапазон для сканирования.
- Нажмите «Аппаратные > фильтры» > Live > Auto Focus > Auto Exposure > Digital Gain > Tick (Цифровое усиление Tick) используйте ручное время экспозиции > Tick, ограничивая диапазон > Set Current.
- Нажмите кнопку Рутинная работа > начать сканирование. Выберите уровень увеличения 20x или 40x. Выберите 20x для соответствующих размеров файлов. Расширение MRXS определяется 3D Pannoramic MIDI сканером. Расширение изображения также может быть изменено на изображение TIFF.
- Нажмите «Просмотр слайдов» > панели инструментов Multiview, чтобы выбрать изображение для конфокального, а затем выровняйте и интегрируйте изображение.
11. Количественная оценка плотности клеток
- Количественная оценка процентного содержания положительных иммунных клеток (CD3+, CD3+CD8+, CD20+) в области опухоли и стромы с помощью программного обеспечения сканера Halo 10. Валидация окрашивания КФК для определения опухолевой ткани.
Результаты
Представлен протокол циклической детекции антигена с использованием 5-цветной мультиплексной флуоресценции на одном предметном стекле. Благодаря оптимизации анализа мы обеспечиваем инкубацию двух антител разных видов (рис. 1). К необходимым приспособлениям для проведения эксперимента относятся скороварка и ящик для иммуноокрашивания (рис. 2А).
После завершения анализа мы определяем псевдоцвет четырех маркеров перед сканированием слайдов. Псевдоцветами CD3, CD8, CD20 и CK являются желтый, красный, зеленый и голубой соответственно. Ядра помечены DAPI. Для анализа выбираются репрезентативные участки опухоли и стромы. Флуоресцентный спектр с длиной волны 495 нм, 578 нм, 652 нм и 590 нм захватывается с помощью автоматического цифрового сканера 3D-слайдов. На рисунке 2Б показано репрезентативное стековое изображение и одномеченые изображения в ткани метастазов рака легких в головном мозге. На основе изображений, содержащих флуоресцентный сигнал одного маркера, программное обеспечение сканера выделило характеристики фенотипа клеток на основе псевдоцвета. Также подсчитывалось соответствующее количество положительных иммунных клеток и общее количество иммунных клеток. Уровни каждого окрашенного белка количественно определяются в обнаруженных тканях путем вычисления H-критерия12. После этих процедур подсчитывают и анализируют количество каждого типа инфильтрирующих опухоль лимфоцитов и долю каждого типа клеток в общем количестве клеток-мишеней. Доля каждого типа иммунных клеток представляет собой эффективный процент инфильтрирующих опухоль лимфоцитов. Проанализировано процентное содержание CD3+, CD3+CD8+ Т-клеток и CD20+ В-клеток в метастазах рака легкого в сравнении с первичными срезами рака легкого. Репрезентативные результаты показаны на рисунке 3. Плотность иммунных клеток (CD3+ Т-клеток, CD3+ CD8+ Т-клеток) ниже при метастазах рака легкого в головном мозге, чем при первичном раке легких. Уровень CD20+ В-клеток выше в группе метастазов в головном мозге, чем в группе первичного рака легких. Тем не менее, результаты не имеют существенных различий между этими двумя группами для ограниченных выборок.

Рисунок 1: Рабочий процесс мультиплексного циклического флуоресцентного иммуногистохимического окрашивания. Секции размером 4 мкм вырезаются и приклеиваются на клейкое предметное стекло. Выполняются следующие операционные этапы: депарафинизация и регидратация, извлечение антигена, извлечение антигена, блокирование антигена, инкубация смеси первичных антител, инкубация вторичных антител, затем повторение этапов извлечения антигена, блокирование антигена, инкубация первичной смеси антител и инкубация вторичных антител с последующим снижением аутофлюоресценции, выбором соответствующего фильтра для сканирования предметных стекол и анализом результатов. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
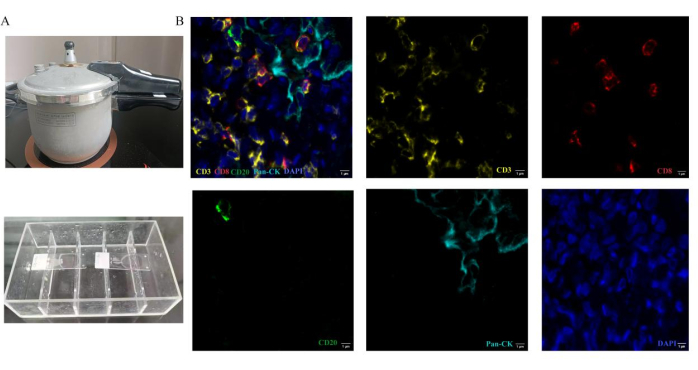
Рисунок 2: Методы работы мультиплексного флуоресцентного иммуногистохимического окрашивания. Обработка антигеном осуществляется путем нагрева секций в скороварке. (A) Скороварка используется для получения эпитопов, вызванных теплом. В процессе инкубации антител предметные стекла помещают в бокс для иммуноокрашивания. (B) Репрезентативные составные и одиночные изображения для панели, используемой в ткани с метастазами в мозг при раке легких. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.

Рисунок 3: Соотношение иммунных клеток при первичном раке легкого и метастазах рака легкого в головном мозге. Доля CD3+, CD3+CD8+, CD20+ иммунных клеток в четырех тканях метастазов рака легкого ниже, чем в парных тканях первичного рака легких (погрешность: стандартное отклонение). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Обсуждение
Описан процесс мультиплексного циклического флуоресцентного иммуногистохимического окрашивания. Первичный выбор антител является решающим аспектом флуоресцентного иммуногистохимического анализа, и моноклональные антитела рекомендуются для лучшей специфичности и воспроизводимости. Чтобы оптимизировать рабочую концентрацию первичного антитела, с помощью иммуногистохимических экспериментов была протестирована серия разведений. Как положительный контроль (для оценки экспрессии целевого антигена), так и отрицательный контроль (отсутствие первичной инкубации антител) имеют важное значение и должны быть установлены.
В этом протоколе первичные антитела разводят и готовят для смеси из разных видов. Меченные флуоресценцией вторичные антитела также объединяются и инкубируются таким же образом, полученными от разных видов. Таким образом, критическим этапом является выбор вида для различных первичных антител на основе антигенов, причем моноклональное антитело предпочтительнее поликлонального антитела. Они могут гарантировать, что комбинация между первичными и вторичными антителами является специфичной. Смешанная жидкость должна достигать рабочей концентрации как для первичных антител, так и перекрестная реактивность не должна существовать между двумя антителами одновременно. Если первичные антитела одного вида, сначала инкубируют одно вторичное антитело, затем второе. При определении последовательности инкубации первичных антител в панели приоритет следует отдавать антителам, чувствительным к реакции антиген-антитело, для антигенов с низкой экспрессией интенсивность будет усиливаться при заборе второго эпитопа. Перед вторым раундом инкубации антител повторный забор антигена занимает меньше времени (1 мин) по сравнению с первой операцией (2 мин). Интенсивность флуоресценции от предыдущего циклического окрашивания не уменьшится, даже если срезы будут дважды подвергнуты тепловому извлечению. Чтобы избежать неспецифической иммунореактивности, необходимо оптимизировать условия инкубации, включая рабочую концентрацию антител, время инкубации и температуру окружающей среды.
В последние десятилетия были разработаны различные методы извлечения эпитопов, в основном разделенные на извлечение эпитопов, индуцированное теплом (HIER) и извлечение эпитопов, индуцированное протеазой (PIER). Нагревание является эффективным методом извлечения антигенов, который обнажает антигенные эпитопы, что делает их более эффективными антителами13. Два основных варианта получения антигена основаны на цитратном буфере и буфере ЭДТА14 с высоким pH. Оптимальное условие извлечения определяется в соответствии с антигеном-мишенью.
Автофлуоресценция может препятствовать флуоресцентной визуализации на срезах, вызванных эндогенными флуорофорами и реагентами, используемыми при обработке тканей15. Для элюирования требуется использование сопутствующего реагента. Флуорофоры подбираются с пиками излучения, избегая пиков автофлуоресценции (около 490 нм)16,17. Сообщалось о том, что Sudan Black B и NaBH4 гасят аутофлуоресценцию тканей18,19. Комбинация Sudan Black B и NaBH4 снижала флуоресцентный фон в таргетной почечной ткани, зафиксированной формалином и парафином20. В этом протоколе обработка тканей KMnO4 в концентрации 0,15 М/л экономит время в течение 1 мин. KMnO4 покрывает слой на ткани для экранирования спонтанной флуоресценции и уменьшает фоновую флуоресценцию, специфическое окрашивание обнаруженного белка более визуализируется.
Целые слайды сканируются в четырех различных каналах фильтров, необходим анализ выравнивания изображения, это большая задача для выравнивания локализации одноклеточных и субклеточных структур. Для получения мультиспектральных изображений, полученных с помощью этого метода, необходимо профессиональное оборудование для визуализации света и программное обеспечение для количественного анализа, чтобы избежать перекрестных спектральных помех. Дороговизна инструмента ограничивает его применение. Совместная инкубация двух антител экономит время, особенно при работе с 6-маркерной панелью, которая требует 3 циклов инкубации. Этот метод используется для визуализации более детальной характеристики иммунных клеток в опухолевом иммунном микроокружении. В дальнейшем метод будет применяться для количественного анализа опухоль-ассоциированных третичных лимфоидных структур.
Таким образом, мультиплексная циклическая флуоресцентная иммуногистохимия позволяет окрашивать несколько мишеней индивидуально мечеными флуорофорами на одном предметном стекле. Этот анализ обеспечивает лучшее понимание пространственного распределения клеток в опухолевом иммунном микроокружении, а пространственная близость опухолевых иммунных клеток способствует скринингу пациентов, которым будет полезна иммунотерапия.
Раскрытие информации
Авторы заявляют, что у них нет известных конкурирующих финансовых интересов или личных отношений, которые могли бы повлиять на работу, представленную в этой статье.
Благодарности
Эта работа была поддержана Национальным фондом естественных наук Китая (NO.81860413, 81960455), Фондом Юньнаньского департамента науки и технологий (202001AY070001-080), Научно-исследовательским фондом Департамента образования провинции Юньнань (2019J1274).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.15 mol/L KmnO4 | Maixin Biotechnology Co. Ltd. | MST-8005 | |
| 100x sodium citrate | Maixin Biotechnology Co., Ltd | MVS-0100 | |
| 3% hydrogen peroxide | Maixin Biotechnology Co., Ltd | SP KIT-A1 | |
| 3D Pannoramic MIDI | 3D histech Ltd | Pannoramic MIDI 1.18 | |
| Alexa Fluor 488 | Abcam | ab150113 | |
| Alexa Fluor 568 | Abcam | ab175701 | |
| Alexa Fluor 594 | Abcam | ab150116 | |
| Alexa Fluor 647 | Abcam | ab150079 | |
| Bond primary antibody diluent | Lecia | AR9352 | |
| CD20 | Maixin Biotechnology Co., Ltd | kit-0001 | |
| CD3 | Maixin Biotechnology Co., Ltd. | kit-0003 | |
| CD8 | Maixin Biotechnology Co., Ltd | RMA-0514 | |
| CK | Maixin Biotechnology Co. Ltd. | MAB-0671, | |
| DAPI | sig-ma | D8417 | |
| ethanol | Sinopharm Group Chemical reagent Co., LTD | 10009218 | |
| Histocore Multicut | lecia | 2245 | |
| PBS(powder) | Maixin Biotechnology Co., Ltd | PBS-0061 | |
| slide viwer | 3D histech Ltd | ||
| xylene | Sinopharm Group Chemical reagent Co., LTD | 10023418 |
Ссылки
- Wanleenuwat, P., Iwanowski, P. Metastases to the central nervous system: Molecular basis and clinical considerations. J Neurol Sci. 412, 116755(2020).
- Schoenmaekers, J., Dingemans, A. C., Hendriks, L. E. L. Brain imaging in early stage non-small cell lung cancer: still a controversial topic. J Thorac Dis. 10, S2168-S2171 (2018).
- Vilariño, N., Bruna, J., Bosch-Barrera, J., Valiente, M., Nadal, E. Immunotherapy in NSCLC patients with brain metastases. Understanding brain tumor microenvironment and dissecting outcomes from immune checkpoint blockade in the clinic. Cancer Treat Rev. 89, 102067(2020).
- Babar, Q., Saeed, A., Tabish, T. A., Sarwar, M., Thorat, N. D. Targeting the tumor microenvironment: Potential strategy for cancer therapeutics. Biochim Biophys Acta Mol Basis Dis. 1869 (6), 166746(2023).
- Goldberg, S. B., et al. Pembrolizumab for management of patients with NSCLC and brain metastases: long-term results and biomarker analysis from a non-randomised, open-label, phase 2 trial. Lancet Oncol. 21 (5), 655-663 (2020).
- Sukswai, N., Khoury, J. D. Immunohistochemistry Innovations for Diagnosis and Tissue-Based Biomarker Detection. Curr Hematol Malig Rep. 14 (5), 368-375 (2019).
- Janardhan, K. S., Jensen, H., Clayton, N. P., Herbert, R. A. Immunohistochemistry in Investigative and Toxicologic Pathology. Toxicol Pathol. 46 (5), 488-510 (2018).
- Torlakovic, E. E., Nielsen, S., Vyberg, M., Taylor, C. R. Getting controls under control: the time is now for immunohistochemistry. J Clin Pathol. 68 (11), 879-882 (2015).
- Tan, W. C. C., et al. Overview of multiplex immunohistochemistry/immunofluorescence techniques in the era of cancer immunotherapy. Cancer Commun (Lond). 40 (4), 135-153 (2020).
- Wong, P. F., et al. Multiplex quantitative analysis of tumor-infiltrating lymphocytes and immunotherapy outcome in metastatic melanoma. Clin Cancer Res. 25 (8), 2442-2449 (2019).
- Sanchez, K., et al. Multiplex immunofluorescence to measure dynamic changes in tumor-infiltrating lymphocytes and PD-L1 in early-stage breast cancer. Breast Cancer Res. 23 (1), 2(2021).
- Zhang, W., et al. Multiplex immunohistochemistry indicates biomarkers in colorectal cancer. Neoplasma. 68 (6), 1272-1282 (2021).
- Salameh, S., Nouel, D., Flores, C., Hoops, D. An optimized immunohistochemistry protocol for detecting the guidance cue Netrin-1 in neural tissue. MethodsX. 5, 1-7 (2018).
- McClellan, P., Jacquet, R., Yu, Q., Landis, W. J. A Method for the immunohistochemical identification and localization of Osterix in periosteum-wrapped constructs for tissue engineering of bone. J Histochem Cytochem. 65 (7), 407-420 (2017).
- Sun, Y., et al. Sudan black B reduces autofluorescence in murine renal tissue. Arch Pathol Lab Med. 135 (10), 1335-1342 (2011).
- Taube, J. M., et al. The Society for Immunotherapy of Cancer statement on best practices for multiplex immunohistochemistry (IHC) and immunofluorescence (IF) staining and validation. J Immunother Cancer. 8 (1), 000155(2020).
- Clarke, G. M., et al. A novel, automated technology for multiplex biomarker imaging and application to breast cancer. Histopathology. 64 (2), 242-255 (2014).
- Oliveira, V. C., et al. Sudan Black B treatment reduces autofluorescence and improves resolution of in situ hybridization specific fluorescent signals of brain sections. Histol Histopathol. 25 (8), 1017-1024 (2010).
- Ahrens, M. J., Dudley, A. T. Chemical pretreatment of growth plate cartilage increases immunofluorescence sensitivity. J Histochem Cytochem. 59 (4), 408-418 (2011).
- Zhang, Y., et al. Spectral characteristics of autofluorescence in renal tissue and methods for reducing fluorescence background in confocal laser scanning microscopy. J Fluoresc. 28 (2), 561-572 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены