Method Article
Miyelodisplastik Sendrom ve Akut Miyeloid Lösemide Kemik İliği Mikroçevresel Popülasyonlarının Belirlenmesi
Bu Makalede
Özet
Burada, miyelodisplastik sendromlar ve akut miyeloid löseminin murin modellerinden kemik iliği mikroçevre popülasyonlarını izole etmek ve karakterize etmek için ayrıntılı bir protokol sunulmaktadır. Bu teknik, endotelyal ve mezenkimal stromal hücreler dahil olmak üzere hematopoietik olmayan kemik iliği nişindeki değişiklikleri hastalık ilerlemesi ile tanımlar.
Özet
Kemik iliği mikroçevresi, hematopoietik kök hücreler (HSC'ler) için destek sağlayan mezenkimal stromal hücreler, endotel hücreleri, osteolineage hücreleri ve fibroblastlar gibi farklı hücre popülasyonlarından oluşur. Normal HSC'leri desteklemenin yanı sıra, kemik iliği mikroçevresi, miyelodisplastik sendromlar (MDS) ve akut miyeloid lösemi (AML) gibi hematopoietik kök hücre bozukluklarının gelişiminde de rol oynar. HSC'lerde MDS ile ilişkili mutasyonlar, özellikle yaşlılarda farklılaşmada bir bloğa ve ilerleyici kemik iliği yetmezliğine yol açar. MDS sıklıkla tedaviye dirençli AML'ye ilerleyebilir, bu hastalık hızlı bir şekilde olgunlaşmamış miyeloid patlamaların birikmesi ile karakterize bir hastalıktır. Bu miyeloid neoplazmları olan hastalarda kemik iliği mikroçevresinin değiştiği bilinmektedir. Burada, miyelodisplastik sendrom ve akut miyeloid löseminin murin modellerinden kemik iliği mikroçevresel hücrelerini izole etmek ve fenotipik olarak karakterize etmek için kapsamlı bir protokol açıklanmaktadır. Kemik iliği niş popülasyonlarındaki değişikliklerin izole edilmesi ve karakterize edilmesi, hastalığın başlaması ve ilerlemesindeki rollerinin belirlenmesine yardımcı olabilir ve kemik iliği stromal popülasyonlarında kanseri teşvik eden değişiklikleri hedefleyen yeni terapötiklerin geliştirilmesine yol açabilir.
Giriş
Kemik iliği mikroçevresi hematopoietik hücrelerden, hematopoietik olmayan stromal hücrelerden ve hücre dışı matriks 1,2'den oluşur. Bu mikro çevre, hematopoietik kök hücrenin kendi kendini yenilemesini teşvik edebilir, soy farklılaşmasını düzenleyebilir ve kemik dokusuna yapısal ve mekanik desteksağlayabilir 1,2,3,4,5. Stromal niş, osteosoy hücrelerini, fibroblastları, sinir hücrelerini ve endotel hücrelerini6 içerirken, hematopoietik niş, lenfoid ve miyeloid popülasyonlardanoluşur 1,2,3. Normal HSC'leri desteklemenin yanı sıra, kemik iliği mikroçevresi de MDS ve AML 7,8,9,10,11 gibi hematopoietik kök hücre bozukluklarının gelişiminde rol oynayabilir. Osteolineage hücrelerindeki mutasyonların MDS, AML ve diğer miyeloproliferatif neoplazmların gelişimini desteklediği gösterilmiştir 10,12,13,14.
Miyelodisplastik sendromlar, hematopoetik kök hücrelerdeki mutasyonlardan kaynaklanan bir grup pre-lösemik bozukluktur. MDS sıklıkla HSC farklılaşmasında bir blok ve sıklıkla kemik iliği yetmezliğine yol açabilen displastik hücrelerin üretimi ile ilişkilidir. MDS, Amerika Birleşik Devletleri'nde en sık teşhis edilen miyeloid neoplazmdır ve 3 yıllık sağkalım oranı %35-45 arasındadır15. MDS genellikle akut miyeloid lösemiye dönüşüm riski ile ilişkilidir. MDS'den türetilen AML çoğu tedaviye dirençli olduğundan ve nüks etme olasılığı yüksek olduğundan, bu ölümcül bir komplikasyon olabilir. Hematopoietik kök ve progenitörlerdeki translokasyonlar veya mutasyonlar nedeniyle ortaya çıkan AML, genellikle standart kemoterapiye dirençlidir16,17. MDS ve AML esas olarak yaşlıların hastalıkları olduğundan, çoğunluğu 60 yaşın üzerinde teşhis edildiğinden, çoğu hasta küratif kemik iliği nakli için uygun değildir. Bu nedenle, hastalığın ilerlemesinin yeni düzenleyicilerini tanımlamak için önemli bir ihtiyaç vardır. Kemik iliği mikroçevresi malign hücreler için destek sağlayabildiğinden14, kemik iliği nişindeki değişikliklerin hastalık ilerlemesi ile tanımlanması, tümör nişinin yeniden şekillenmesini inhibe etmeyi amaçlayan yeni terapötiklerin tanımlanmasına yol açabilir. Bu nedenle, hastalığın ilerlemesinin yeni düzenleyicilerini tanımlamak için önemli bir ihtiyaç vardır. Bu amaçla, malign hücrelere destek sağlayabilecek kemik iliği stromal hücre popülasyonlarındaki değişiklikleri tanımlamak ve karakterize etmek çok önemlidir.
AML ve MDS'nin birkaç fare modeli oluşturulmuştur ve hastalığın başlaması ve ilerlemesi sırasında kemik iliği mikro ortamındaki değişiklikleri incelemek için kullanılabilir 6,1,19,20,21,22. Burada, retroviral olarak indüklenen AML 6,20'nin murin modellerini ve ayrıca ticari olarak temin edilebilen Nup98-HoxD13 (NHD13) yüksek riskli MDS'den AML'ye dönüşüm19 modelini kullanarak kemik iliği stromal hücre popülasyonlarındaki değişiklikleri tanımlamak için protokoller açıklanmaktadır. De novo AML hücreleri ile nakledilen fareler 20-30 gün içinde hastalığa yenik düşer6. NHD13 fareleri, 15-20 hafta civarında sitopeni ve kemik iliği displazisi geliştirir, bu da sonunda AML'ye dönüşür ve farelerin yaklaşık% 75'i 32 hafta civarında hastalığa yenik düşer. Fare modeli kemik iliği mikroçevre popülasyonlarını analiz etmek için kemikler hasat edilir, kemik iliği ve kemik spikülleri enzimatik sindirim kullanılarak sindirilir ve hücreler daha sonra manyetik sıralama ile CD45-/Ter119-hematopoietik olmayan popülasyonlar için zenginleştirilir. Benzer analizler daha önce 11,13,22,23,24,25 olarak tanımlanmış olsa da, genellikle kemik iliğine veya kemiğe odaklanırlar ve analizlerinde her iki kaynaktan gelen hücreleri içermezler. Bu popülasyonların birleşik karakterizasyonu, gen ekspresyon analizleri ile birlikte, hücresel hematopoietik mikroçevrenin hastalığın başlaması ve ilerlemesi için nasıl destek sağladığının kapsamlı bir şekilde anlaşılmasını sağlayabilir (Şekil 1). Aşağıda açıklanan protokol retroviral olarak indüklenen AML modeline ve genetik bir MDS modeline odaklanırken, bu stratejiler ilgilenilen herhangi bir murin modelinin kemik iliği nişindeki değişiklikleri incelemek için kolayca uyarlanabilir.
Protokol
Tüm hayvan deneyleri, Rochester Üniversitesi Hayvan Kaynakları Komitesi tarafından onaylanan protokollere uygun olarak gerçekleştirildi. Fareler, Rochester Üniversitesi'ndeki hayvan bakım tesislerinde yetiştirildi ve bakımı yapıldı. Yüksek riskli MDS'yi modellemek için, ticari olarak temin edilebilen NHD13 fare modeli19 kullanılır. Bu modelde, kemik iliği stromal hücreleri, hastalık başlamadan önce 8 haftalıkken dişi NHD13 farelerinde analiz edilir. De novo AML, daha önce açıklandığı gibiüretilir 6,11,20. MLL-AF9 ve NRas gibi AML'yi indüklemek için kullanılan onkogenler, akış sitometrisi kullanılarak lösemik olmayan GFP-kemik iliği popülasyonlarının analizine izin veren GFP veya YFP ile etiketlenir. Kısaca, 10 haftalık dişi C57BL / 6J farelere murin GFP / YFP + AML hücreleri nakledilir ve kemik iliği nakilden 2 hafta sonra toplanır. Bu çalışmada dişi fareler gösteri amaçlı kullanılırken, bu protokol hem erkek hem de dişi farelerle gerçekleştirilebilir. Ayrıca bir femur veya tüm uzun kemikler kullanılarak da gerçekleştirilebilir.
1. Kemik iliği hasadı
NOT: Hayvan diseksiyon protokolü ile ilgili ayrıntılar için lütfen Amend et al.26'ya bakın.
- Harcı ve tokmağı %70 etanol ile temizleyin, soğutulmuş FACS tamponu ile durulayın (Tablo 1) ve hasada başlamadan önce soğuması için buzun üzerine koyun. Ayrıca, oda sıcaklığına ulaşmasını sağlamak için MAC tamponunu (Tablo 1) tezgahın üzerine yerleştirin.
- Kurumsal hayvan bakımını takip ederek hayvana ötenazi yapın ve kılavuz ve protokolleri kullanın.
- Tezgahta, kürkü ıslanana kadar fareye iyice %70 etanol püskürtün. Forseps ve kavisli makas kullanarak, karın üzerindeki cildi kaldırın ve farenin her iki tarafında, karından yanal olarak yaklaşık 0,5 mm uzunluğunda iki kesi yapın. Ardından, karından distalde 0,5 mm'lik bir kesi yapın. Farenin bacaklarındaki deriyi ve kürkü çıkarmak için aşağı çekin.
- Makası pelvise dik olarak yerleştirin, forseps ile femuru yukarı çekerken aşağı doğru bastırın. Femur başı pelvisten ayrılmalıdır. Patellofemoral eklemde femur ve tibiayı ayırın. Kemikleri buz üzerinde 6 oyuklu bir plakada FACS tamponuna yerleştirin.
- Laboratuvar sınıfı doku kullanarak kemiklerden doku çıkarın ve temizlenmiş kemikleri buz üzerinde taze FACS tamponu ile 6 oyuklu yeni bir plakaya yerleştirin.
- Tüm kemikleri 2-5 mL FACS tamponu ile harca yerleştirin, böylece tüm kemikler tampona daldırılır (tampon hacmini kaç kemik işlediğinize göre ayarlayın). Kemik iliği dokusu serbest kalana kadar havaneli kullanarak kemikleri dairesel hareketlerle ezin ve öğütün.
- 3 mL'lik bir şırınga kullanarak, sıvıyı harçtan yukarı çekip aşağı akıtarak kemik iliğini homojenize edin.
- 3 mL'lik bir şırınga kullanarak, sıvıyı harçtan yukarı çekin ve 70 μm'lik bir hücre süzgecinden buz üzerinde 50 mL'lik bir tüpe süzün. Filtredeki kemik/doku parçalarını FACS tamponu ile tekrar harca durulayın ve ikinci kez homojenize etmek ve süzmek için adım 1.7'ye dönün. Bu kemik iliği fraksiyonunu oluşturur.
- Kalan kemik parçalarını (spikülleri) FACS tamponu ile harcın içine geri durulayın ve maksimum hücre verimini sağlamak için FACS tamponu kullanarak 15 mL'lik bir tüpe yıkayın. Bu kemik spikülleri fraksiyonudur.
2. Kemik iliğinin sindirimi
- Kemik iliğini 300 x g'da 4 °C'de 5 dakika santrifüjleyin. Süpernatanı boşaltın ve atın.
- Kemik iliğini 2 mL kemik iliği sindirim karışımında (Tablo 1) tekrar süspanse edin ve 15 mL'lik bir tüpe aktarın. Bir döndürücü üzerinde 37 °C'de 45 dakika inkübe edin.
- Enzimatik sindirimi durdurmak için 10 mL FACS tamponu ekleyin. Karışımı 70 μm'lik bir hücre süzgecinden 50 mL'lik yeni bir tüpe süzün.
- Karışımı 400 x g'da 4 °C'de 7 dakika boyunca peletleyin.
- Kemik iliği peletini 1 mL RBC lizis tamponunda yeniden süspanse edin (bkz. Buz üzerinde 4 dakika inkübe edin.
- Lizizi durdurmak için 10 mL FACS tamponu ekleyin. Karışımı 70 μm'lik bir hücre süzgecinden 50 mL'lik yeni bir tüpe süzün.
- Karışımı 300 x g'da 4 °C'de 5 dakika boyunca peletleyin. Süpernatanı çıkarın ve peleti 100 μL FACS tamponunda yeniden süspanse edin.
3. Kemik spiküllerinin sindirimi
- Kemik spiküllerini adım 1.9'dan itibaren girdap haline getirin ve yerleşmelerine izin verin. Süpernatanı boşaltın ve kemiği altta tutun.
- Kemik spiküllerini 1 mL kemik spikülü sindirim karışımında tekrar süspanse edin (Tablo 1).
- Tüpleri 37 °C'de 60 dakika boyunca bir tüp döndürücüye yerleştirin.
- Enzimatik sindirimi durdurmak için 10 mL FACS tamponu ekleyin. Karışımı 70 μm'lik bir hücre süzgecinden geçirerek RBC ile parçalanmış ve sindirilmiş kemik iliği içeren 50 mL'lik tüpe süzün.
4. Boyama
- Kemik spiküllerini ve kemik iliği hücresi süspansiyonunu nazikçe karıştırın.
- Yayınlanmış protokoller27'de açıklandığı gibi,% 0.4 Tripan mavisi bazlı boyama kullanarak bir hemositometredeki canlı hücre sayısını saymak için 10 μL hücre süspansiyonu kullanın. Hücre süspansiyonundan lekesiz bir kontrol için 50.000 hücre toplayın.
- Kalan hücreleri 300 x g'da 4 °C'de 5 dakika santrifüjleyin. Süpernatanı çıkarın ve 100 μL FACS tamponunda yeniden süspanse edin.
NOT: İdeal seyreltmeyi belirlemek için antikorlar titre edilebilir. Antikor seçimi (epitoplar ve florokromlar) özelleştirilebilir. - Manyetik tükenme için antikorlarla boyama için, FC Blok (25 x 106 hücre başına 1 μL), CD45-APC (25 x 106 hücre başına 10 μL) ve Ter119-APC (25 x 106 hücre başına 4 μL) ekleyin (bkz.
- 20 dakika buz üzerinde inkübe edin. FACS tamponu ile yıkayın, APC lekeli kontrol için 50.000 hücreyi (~ 50 μL) çıkarın, 4 ° C'de 5 dakika boyunca 300 x g'de santrifüjleyin ve 100 μL FACS tamponunda yeniden süspanse edin.
- Manyetik tükenme için hücre süspansiyonunun mikro boncuklarla boyanması için, mIgG (25 x 106 hücre başına 8 μL) ve Anti-APC mikro boncuklar (25 x 106 hücre başına 20 μL) ekleyin (bkz.
- 20 dakika buz üzerinde inkübe edin. 10 mL FACS tamponu ile yıkayın, 300 x g'da 4 °C'de 5 dakika santrifüjleyin.
5. Manyetik ayırma ile numunenin tükenmesi
NOT: Bu adım, üreticinin talimatlarına göre piyasada bulunan bir manuel manyetik ayırıcı kullanılarak gerçekleştirilir. Bu adım, otomatik bir ayırıcı ile de gerçekleştirilebilir (bkz.
- LD kolonunu 2 mL MAC tamponu ile yıkayarak hazırlayın (Tablo 1). Atık suyu atın ve toplama tüpünü değiştirin.
- MAC tamponunda 1 x 108 hücreye kadar yeniden süspanse edin ve bunları 35 μm hücre süzgeci kapağına sahip 5 mL'lik bir test tüpünden süzün.
- LD sütununu manyetik ayırıcı standına yerleştirin. Elüatı toplamak için kolonun altına 5 mL'lik bir test tüpü yerleştirin.
- Hücre süspansiyonunu hazırlanan LD sütununa ekleyin. Negatif fraksiyonun toplama tüpüne akmasına izin verin. Kolonu 1 mL MAC tamponu ile iki kez yıkayın ve elüatı aynı tüpte toplayın. Bu, aşağıdaki adım 5.6'da kullanılan negatif kesirdir.
- LD kolonunu manyetik ayırıcı standından çıkarın ve yeni bir 5 mL test tüpüne yerleştirin. Kolon pistonunu kullanarak pozitif olarak etiketlenmiş hücreleri temizlemek için kolona 3 mL tampon dağıtmak için bir pipet kullanın.
- Negatif ve pozitif fraksiyonları 300 x g'da 4 °C'de 5 dakika santrifüjleyin. Bunları 100 μL FACS tamponunda yeniden süspanse edin.
- % 0.4 Tripan mavisi ile negatif ve pozitif fraksiyonların 10 μL'sini sayın. Aşağıdaki osteo-analiz/endotel paneli boyama hacimleri bu hücre sayısına dayanacaktır.
- Akış sitometrisi geçit kontrolleri için pozitif fraksiyondan 50.000 canlı hücre kullanın.
6. Osteo-analiz / endotelyal panel boyası
NOT: Kompanzasyon, tüm uygun boyama ve geçit kontrolleri dahil olmak üzere standart akış sitometri protokolleri izlenerek yapılmalıdır.
- CD45 / Ter119 negatif fraksiyonunun boyanması için (1 x 106 hücre başına her antikorun 1 μL'si), CD31-PE-Cy7, Sca-1-BV421, CD51-PE ve CD140a-PE-Cy5 ekleyin (bkz.
- 20 dakika buz üzerinde inkübe edin. 2 mL FACS tamponu ile yıkayın, ardından 300 x g'da 4 °C'de 5 dakika santrifüjleyin.
- Canlı/ölü boyama için 1 mL FACS tamponu ve 1:1000 PI seyreltmesi ekleyin, ardından numuneyi 35 μm hücre süzgeci kapağına sahip 5 mL'lik bir test tüpünden süzün.
- Hücreleri çok renkli bir akış sitometresinde analiz edin.
Sonuçlar
Bu makale, MDS ve lösemi murin modellerinden endotelyal ve mezenkimal stromal hücreler gibi kemik iliği mikroçevre popülasyonlarını analiz etmek için akış sitometrisine dayalı bir yöntemi açıklamaktadır (Şekil 1). Şekil 2 , sindirilmiş ve CD45/Ter119 tükenmiş fraksiyondaki hücrelerin (P1) seçiminden başlayarak, ileri ve yan saçılma profili boyunca ilgilenilen popülasyonların tespiti için geçit stratejisini göstermektedir. Bir lösemi örneğindeki hücrelerin örnek geçitlenmesi P1'de gösterilmiştir (Şekil 2A). Tekliler seçilir ve çiftler bu analizden çıkarılır, P2 (Şekil 2B). Şekil 2C , propidyum iyot negatif canlı hücreleri, P3'ü seçmek için kapıları göstermektedir. Hematopoetik olmayan stromal popülasyonlara odaklanmak için, CD45-/Ter119-, P4 (APC, Y-ekseni) vs. SSC-A seçilir (Şekil 2D). Bu ilk geçit stratejisi, analiz edilecek tüm numuneler için ortaktır.
Lösemi murin modeli, Şekil 2E-G'de endotel hücreleri için geçitleri göstermek için kullanılır. Şekil 2E, CD31 pozitifini (Pe-Cy7, Y ekseni) vs. Kanser olmayan bir kontrol faresinde ve lösemik bir farede SSC-A hücreleri, P4 ile geçitlidir. CD31 ile pozitif olarak etiketlenmiş hücreler endotel hücreleri, P5'tir. Şekil 2F'de, P5 ile kapılı, arteriolar endotel hücreleri CD45-Ter119-CD31+Sca1+, P6 olarak tanımlanır ve sinüzoidal endotel hücreleri CD45-Ter119-CD31+Sca1-, P7 (BV421, Y ekseni) olarak tanımlanır. SSC-A'yı seçin.
Bu analiz, lösemik olmayan kemik iliği mikroçevresel hücrelerine odaklansa da, tümör yükünün belirlenmesine de yardımcı olur. Bu, deneyi başlatmadan önce sindirilmemiş/tükenmemiş numunenin küçük bir kısmı ile yapılabilir. Bu deneysel kontrolde (kesikli çizgiler) Şekil 2G, P8 numunedeki tümör yükünü temsil eder ve P9 kanserli olmayan hücreleri temsil eder.
MDS murin modeli, Şekil 2H-J'deki mezenkimal stromal hücrelerin analizini göstermek için kullanılmıştır. Şekil 2H, CD31 negatifini (Pe-Cy7, Y ekseni) vs. SSC-A hücreleri, P4 üzerinden geçitli. Yabani tip bir kontrol faresi ve MDS faresindeki mezenkimal stromal hücre popülasyonları Şekil 2I'de gösterilmektedir. P10 ile kapılı mezenkimal stromal hücreler CD45-Ter119-CD31-CD51+CD140a+, P113 (Pe, Y-ekseni; Pe-Cy5, X ekseni). Deneysel kontrol (kesikli çizgiler), Şekil 2J, Şekil 2I'deki deney örneklerinde gösterilen MSC'leri geçmek için kullanılan tek renkli geçit kontrolleri, CD51 tek boyama ve CD140a tek boyama örneklerini göstermektedir.
Bu veriler, arteriolar endotel hücrelerinin, immün yetmezliği olan farelerde hasta kaynaklı ksenogreftleri kullanan daha önceki çalışmalarla tutarlı olarak, sinüzoidal endotel popülasyonlarında eşzamanlı bir kayıpla birlikte AML mikroçevresinde önemli ölçüde genişlediğini göstermektedir(Şekil 2F). NHD13 farelerinde 8 haftalıkken görülen mezenkimal stromal hücrelerdeki küçük genişlemenin (Şekil 2I), bu fareler MDS25'in özelliklerini göstermeye başladığında 16-20 haftada artması muhtemeldir. Endotel hücre popülasyonunu göstermek için sadece lösemi modeli ve mezenkimal stromal hücre popülasyonlarını göstermek için MDS murin modeli kullanılsa da, bu modellerden herhangi birinde farklı mikroçevresel popülasyonları analiz etmek için benzer boyama ve geçit stratejileri kullanılabilir.
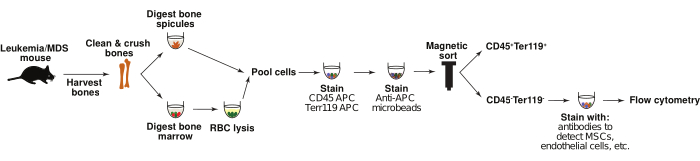
Şekil 1: Kemik iliği stromal hücrelerinin izolasyonu. Şematik, hematopoietik olmayan kemik iliği stromal hücrelerinin kontrol ve lösemik farelerden izole edilmesi sürecini gösterir. Kısaca kemik spikülleri ve kemik iliği ayrı ayrı sindirilir ve daha sonra havuzlanır. CD45-Ter119- popülasyonu manyetik sıralama ile zenginleştirilir ve mezenkimal stromal hücreler ve endotel hücreleri gibi ilgilenilen popülasyonlara karşı antikor panelleri ile boyanır. Hücreler daha sonra akış sitometrisi ile analiz edilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
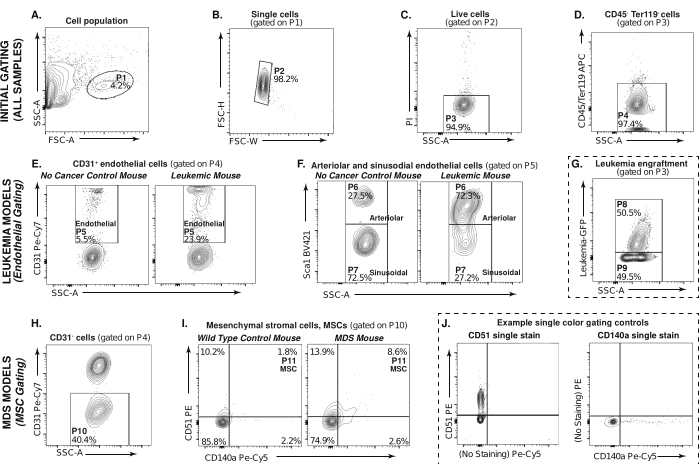
Şekil 2: Hematopoietik olmayan kemik iliği ve stromal hücreler için geçit stratejisi. (AD) Hem lösemi hem de MDS murin modelinde sindirilmiş, CD45- / Ter119-, hematopoetik olmayan popülasyonları (P4) seçmek için kullanılan akış sitometrisi geçit stratejisi. (E) Lösemi kemik iliği endotel hücreleri (P5, CD31+) (F) Sca1+ arteriolar (P6) veya Sca1- sinüzoidal endotel hücreleri (P7) olarak alt gruplara ayrılabilir. (G) P8'in aşılamayı temsil ettiği, P9'un kanser olmayan hücreleri temsil ettiği bir AML örneğinde lösemi aşılaması. Noktalı çizgiler bu grafiğin deneysel bir kontrol olduğunu gösterir. (H) P4, MDS kemik iliği CD31 hücreleri, P10 (I) Mezenkimal stromal hücreler (CD51 + / CD140a +, P11) ile kapılı. (J) Örnek tek renkli geçit kontrolleri, CD51 (solda) ve CD140a (sağda) (I)'deki mezenkimal stromal hücrelerin kapılarını belirlemek için kullanılır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Çözüm | Reaktif | Konsantrasyon | Eklenecek tutar |
| FACS arabelleği | HBSS (HBSS) | 10 katı | 100 mL |
| EDTA | 0,5 milyon | 4 mL | |
| Fetal Sığır Serumu | - | 50 mL | |
| Su | - | 848 mL | |
| Kemik iliği sindirim karışımı | HBSS (HBSS) | 1 adet | 2 mL |
| DNaz 1 | 1x DPBS'de 1 μg/mL | 20 μL | |
| Dispase II Tozu | - | 4 mg | |
| Kollajenaz Tip IV | - | 2 mg | |
| Kemik spikülü sindirim karışımı | DPBS (DPBS) | 1 adet | 320 mL |
| Kollajenaz Tip 1 | - | 1 gr | |
| Fetal Sığır Serumu | - | 80 mL | |
| MAC arabelleği | BSA | 66 g/mol | 5 gr |
| DPBS (DPBS) | 10 katı | 100 mL | |
| EDTA | 0,5 milyon | 4 mL | |
| Su | - | 896 Lt |
Tablo 1: Bu çalışmada kullanılan çözelti ve tamponların bileşimi.
Tartışmalar
Murin lösemi modelleri, agresif miyeloid lösemi ilerlemesini destekleyen hücre içsel ve niş odaklı sinyalleri tanımlamak için yaygın olarak kullanılmıştır 6,19,21. Burada, MDS ve AML'nin murin modellerinde kemik iliği mikroçevresinin hücresel bileşimini tanımlamak için kapsamlı bir akış sitometrisi tabanlı protokol sunulmaktadır.
Deneysel numunelerden akış sitometrik verilerini elde etmeden önce, floresan örtüşmesini dikkatli bir şekilde telafi etmek önemlidir. Tüm uygun boyama ve geçit kontrollerinin dahil edilmesi de önemlidir. Bu adımlar, deneycinin, pozitif veya negatif antikor boyamasının, ilgilenilen hücre belirteçlerinin doğru ifadesini temsil ettiğini ve floresan spektral örtüşmesi veya otofloresan eseri olmadığını doğrulamasını sağlayacaktır. Bu protokol seçilen hücre yüzeyi belirteçlerini tanımlasa da, antikor panelleri deneysel ihtiyaca göre genişletilebilir. Örneğin, CD144 (Ve-Cadherin) fareler hasat edilmeden önce in vivo olarak uygulanabilir ve endotel hücrelerinin 5,29 ek bir spesifik belirteci olarak hizmet edebilir. Burada belirtilen floroforlar ve antikor klonları değiştirilebilirken, ideal seyreltmelerini belirlemek için titrasyonlar yapılmalıdır. Kemik iliği nişindeki tüm hücre popülasyonlarını kategorik olarak tanımlamak için, MDS/AML başlangıcı ve ilerlemesi sırasında kemik iliği niş manzarasını oluşturmak için tek hücreli RNA dizilimi kullanılabilir 23,24,30.
Numunenin bu protokolde açıklanan adımlara göre dikkatli bir şekilde hazırlanması çok önemlidir. Kemikler homojenize edilirken, havan ve tokmağın soğutulması ve hücre ölümünü önlemek ve yüksek hücre geri kazanımı sağlamak için tüm adımların buz üzerinde gerçekleştirilmesi çok önemlidir. Diğer istenmeyen hücre tiplerinin kontaminasyonunu önlemek için homojenizasyondan önce kemikleri çevreleyen tüm dokuların çıkarılması çok önemlidir. RBC lizisi ve sindirimi sırasında, enzimatik reaksiyonu uygun miktarda FACS Tamponu ile durdurmak ve taze tamponda iyice yeniden süspanse etmek önemlidir, aksi takdirde hücreler sindirilmeye devam edecek ve sonunda ölecektir.
Kemik ve kemik iliği fraksiyonlarının ayrılması çok önemlidir, çünkü kemik spikülleri sindirim tamponu için farklı bir enzim karışımı gerektirir ve sindirim için daha uzun zamana ihtiyaç duyar. Kemik sindiriminde, kollajenaz tip 1, hücre dışı matriks ve kollajen liflerinde yaygın olarak bulunan kollajenaz fibrillerini sindirmek için faydalıdır31. Ek olarak, endosteuma yakın bulunan bazı kemik iliği hücreleri, homojenizasyondan sonra kemiğe bağlı kalır ve sadece enzimatik sindirim ile salınır. Kemik iliğini sindirirken, kollajenaz tip IV, kemik iliği32 içindeki epitel ve endotel hücrelerinin bazal membranını sindirmek için kullanılırken, dispas esas olarak fibronektin31'i parçalar. Hücreler ve matris arasındaki ilişkiler daha zayıf olduğu için kemik iliğinin sindirimi daha az zaman gerektirir. Kemik iliği fraksiyonunun benzer koşullarda inkübe edilmesi, ilgilenilen popülasyonlara zarar verebilir. İki farklı sindirim tamponu kullanmak, tespit edilebilen stomal popülasyonların sayısını önemli ölçüde artırır ve böylece analiz etmek için daha büyük bir veri seti sağlar.
Fare kemik iliği mikroçevresel popülasyonlarını analiz etmek için mevcut protokollerin çoğu, kemik iliğini yalnızca uzun kemiklerden temizlemek için bir şırınga kullanır13,24. Mevcut kemik kırma yöntemi, pelvis gibi diğer kemiklerden veri elde etme yeteneği sağlar, numune hazırlama süresini önemli ölçüde azaltır ve keskin iğnelerle yaralanma olasılığını azaltır. Kemiğin olgun osteoblastlardan ve normal ve malign hematopoietik hücrelere destek sağlayabilen diğer hücre popülasyonlarından oluştuğu göz önüne alındığında, kemik spiküllerinden hücrelerin dahil edilmesine yönelik bu yöntem, numunedeki kemik iliği mikro çevresinin daha doğru bir şekilde temsil edilmesini sağlar. Önceki bir çalışmada kemik iliği ve kemik spikülleriayrı ayrı sindirilirken, aynı örnekte osteolineage ve endotel hücrelerinin boyanması gösterilmemiştir. İkinci bir çalışma, kemik iliği ve kemik spiküllerini sindirmek için ticari olarak temin edilebilen tescilli enzim karışımlarınıkullandı 23 ve önemli ölçüde daha pahalı olan tek hücreli RNA dizileme teknolojisini kullanarak verileri analiz etti. CD45- / Ter119- hücreleri için bu zenginleştirme yöntemi, ilgilenilen hücreleri seçer ve akış sitometresinde veri elde etmek için gereken süreyi önemli ölçüde azaltır. Bu nedenle, tek hücreli RNA dizilimi gibi diğer son teknoloji yöntemlerle karşılaştırıldığında, bu akış sitometrisi tabanlı yöntem daha erişilebilir, uygun maliyetlidir ve eğitimli biyoinformatikçiler tarafından karmaşık analizler gerektirmez 23,24,30.
Bu protokolün, yalnızca MDS ve AML'nin mevcut murin modellerinden herhangi birinin değil, herhangi bir genetik fare modelinin kemik iliği mikro ortamını karakterize etmek için kullanılabileceğini belirtmek önemlidir. Benzer yöntemler, hasta kaynaklı ksenogreft (PDX) modellerinin murin kemik iliği nişindeki değişikliklerin analizinde de etkili olabilir. Bu yöntemler, MDS/AML'nin kemik iliği nişlerini etkilediği mekanizmaları belirlemeyi amaçlayan çalışmalar için yararlı olabilir. İnsan hastalardan büyük miktarlarda kemik iliği örneklemesi ile ilgili teknik zorluklar göz önüne alındığında, murin modellerinin bu analizleri, malign kemik iliği mikroçevresinin daha iyi anlaşılmasını sağlamak ve hastalığın ilerlemesindeki rolünü tanımlamak için etkili bir araçtır.
Açıklamalar
Herhangi bir çıkar çatışması beyan edilmedi.
Teşekkürler
URMC Flow Sitometri Çekirdeğine teşekkür ederiz. Bu çalışma, Amerikan Hematoloji Derneği Akademik Ödülü, Lösemi Araştırma Vakfı ödülü ve NIH hibeleri R01DK133131 ve JB'ye verilen R01CA266617 tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL pipette Tips | Genesee Scientific | 24-165RL | |
| 1.7 mL Microcentrifuge Tubes | AVANT | L211511-CS | |
| 10 µL pipette Tips | Genesee Scientific | 24-140RL | |
| 10 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1760 | |
| 1000 mL Vacuum Filtration Flask | NEST | 344021 | |
| 15 mL Centrifuge Tube | VWR | 10026-076 | |
| 2 mL Aspirating Pipette | NEST | 325011 | |
| 200 µL pipette Tips | Genesee Scientific | 24-150-RL | |
| 25 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1780 | |
| 5 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1740 | |
| 5 mL Polystyrene Round-Bottom Tube 12 x 75 mm style | Falcon | 352054 | |
| 5 mL Polystyrene Round-Bottom Tube with Cell Strainer Cap 12 x 75 mm style | Falcon | 352235 | |
| 50 mL Centrifuge Tube | NEST | 602052 | |
| 6 Well, Flat Bottom with Low Evaporation Lid | Falcon | 353046 | |
| Absorbent Underpads with Waterproof Moisture Barrier | VWR | 56616-031 | |
| APC MicroBeads | Miltenyi | 130-090-855 | |
| autoMACS Pro Separator | Miltenyi Biotec GmBH | 4425745 | |
| BD Pharmingen Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | 0.5 mg/mL |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | 66.000 g/mol |
| Brilliant Violet 421 anti-mouse Ly-6A/E (Sca-1) Antibody (D7) | Invitrogen | 404-5981 | 0.2 mg/mL |
| C57BL/6J Mice | Jackson Laboratory | 664 | |
| Carbon Dioxide Gas Tank | Airgas | CD50 | |
| CD31 (PECAM-1) Monoclonal Antibody (390), PE-Cyanine7 | Invitrogen | 25-0311-82 | 0.2 mg/mL |
| CD45 Monoclonal Antibody (30-F11), APC | Invitrogen | 17-0451-82 | 0.2 mg/mL |
| Cell Strainer 70 µm Nylon | Falcon | 352350 | |
| Cole-Parmer Essentials Mortar and Pestle; Agate, 125 mL | Cole-Parmer | EW-63100-62 | |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C5138-500MG | |
| Collagenase Type I | STEMCELL | 7415 | |
| Corning Mini Centrifuge | CORNING | 6770 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 4099 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D4513 | |
| Dispase II, powder | Gibco | 117105041 | |
| DPBS 10x | gibco | 14200-075 | |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 00-4333-57 | |
| Ethanol absolute, KOPTEC, meets analytical specification of BP, Ph. Eur., USP (200 Proof) | VWR | 89125-174 | |
| Fine scissors - sharp | Fine Science Tools | 14061-10 | |
| Foundation B Fetal Bovine Serum | GeminiBio | 900-208 | |
| Gilson PIPETMAN L Pipette Starter Kits | FisherScientific | F167370G | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Hank's Balanced Salt Solution (HBSS) 10x | gibco | 14185-052 | |
| Hemocytometer | Fisher | 02-671-10 | |
| Incubator | BINDER | C150-UL | |
| Kimwipes | KIMTECH | K222101 | |
| LABGARD Class II, Type A2 Biological Safety Cabinet | Nuaire | NU-425-400 | |
| LD Columns | Miltenyi Biotec GmBH | 130-042-901 | |
| LSE Vortex Mixer | CORNING | 6775 | |
| LSRII/Fortessa/Symphony A1 | Becton, Dickinson and Company | 647800L6 | |
| MACS MULTI STAND | Miltenyi Biotec GmBH | 130-042-303 | |
| MACsmix Tube Rotator | Miltenyi Biotec GmBH | 130-090-753 | |
| mIgG | Millipore-Sigma | 18765-10mg | 2 mg/mL |
| Nup98-HoxD13 (NHD13) Mice | Jackson Laboratory | 010505 | |
| PE anti-mouse CD51 Antibody (RMV-7) | Biolegend | 104106 | 0.2 mg/mL |
| PE/Cyanine5 anti-mouse CD140a Antibody (RUO) | Biolegend | 135920 | 0.2 mg/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 10,000 U/mL |
| Plastipak 3 mL Syringe | Becton, Dickinson and Company | 309657 | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| QuadroMACS Separator | Miltenyi Biotec GmBH | 130-090-976 | |
| Sorvall X Pro / ST Plus Series Centrifuge | Thermo Scientific | 75009521 | |
| TER-119 Monoclonal Antibody (TER-119), APC | Invitrogen | 17-5921-82 | 0.2 mg/mL |
| Trypan Blue Solution 0.4% | Gibco | 15-250-061 | |
| Ultrapure 0.5 M EDTA, pH 8.0 | Invitrogen | 15575-038 |
Referanslar
- Morrison, S. J., Scadden, D. T. The bone marrow niche for haematopoietic stem cells. Nature. 505 (7483), 327-334 (2014).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Pinho, S., Frenette, P. S. Haematopoietic stem cell activity and interactions with the niche. Nat Rev Mol Cell Biol. 20 (5), 303-320 (2019).
- Kfoury, Y., Scadden, D. T. Mesenchymal cell contributions to the stem cell niche. Cell Stem Cell. 16 (3), 239-253 (2015).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Bajaj, J., et al. Cd98-mediated adhesive signaling enables the establishment and propagation of acute myelogenous leukemia. Cancer Cell. 30 (5), 792-805 (2016).
- Konopleva, M. Y., Jordan, C. T. Leukemia stem cells and microenvironment: Biology and therapeutic targeting. J Clin Oncol. 29 (5), 591-599 (2011).
- Kim, Y. W., et al. Defective notch activation in microenvironment leads to myeloproliferative disease. Blood. 112 (12), 4628-4638 (2008).
- Walkley, C. R., et al. A microenvironment-induced myeloproliferative syndrome caused by retinoic acid receptor gamma deficiency. Cell. 129 (6), 1097-1110 (2007).
- Kode, A., et al. Leukaemogenesis induced by an activating β-catenin mutation in osteoblasts. Nature. 506 (7487), 240-244 (2014).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Raaijmakers, M. H., et al. Bone progenitor dysfunction induces myelodysplasia and secondary leukaemia. Nature. 464 (7290), 852-857 (2010).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Bajaj, J., Diaz, E., Reya, T. Stem cells in cancer initiation and progression. J Cell Biol. 219 (1), e201911053(2020).
- Sekeres, M. A., Taylor, J. Diagnosis and treatment of myelodysplastic syndromes: A review. Jama. 328 (9), 872-880 (2022).
- Zeisig, B. B., Kulasekararaj, A. G., Mufti, G. J., So, C. W. Snapshot: Acute myeloid leukemia. Cancer Cell. 22 (5), 698-698.e1 (2012).
- Krivtsov, A. V., Armstrong, S. A. Mll translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer. 7 (11), 823-833 (2007).
- Yoshimi, A., et al. Coordinated alterations in rna splicing and epigenetic regulation drive leukaemogenesis. Nature. 574 (7777), 273-277 (2019).
- Lin, Y. W., Slape, C., Zhang, Z., Aplan, P. D. Nup98-hoxd13 transgenic mice develop a highly penetrant, severe myelodysplastic syndrome that progresses to acute leukemia. Blood. 106 (1), 287-295 (2005).
- Kwon, H. Y., et al. Tetraspanin 3 is required for the development and propagation of acute myelogenous leukemia. Cell Stem Cell. 17 (2), 152-164 (2015).
- Bajaj, J., et al. An in vivo genome-wide crispr screen identifies the rna-binding protein staufen2 as a key regulator of myeloid leukemia. Nat Cancer. 1 (4), 410-422 (2020).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by mll-af9. Nature. 442 (7104), 818-822 (2006).
- Baryawno, N., et al. A cellular taxonomy of the bone marrow stroma in homeostasis and leukemia. Cell. 177 (7), 1915-1932.e16 (2019).
- Tikhonova, A. N., et al. The bone marrow microenvironment at single-cell resolution. Nature. 569 (7755), 222-228 (2019).
- Balderman, S. R., et al. Targeting of the bone marrow microenvironment improves outcome in a murine model of myelodysplastic syndrome. Blood. 127 (5), 616-625 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. JoVE. 110, e53936(2016).
- JoVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. , JoVE. (2023).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to acute myeloid leukemia progression and drug response. Blood. 128 (22), 2662(2016).
- Xu, C., et al. Stem cell factor is selectively secreted by arterial endothelial cells in bone marrow. Nat Commun. 9 (1), 2449(2018).
- Baccin, C., et al. Combined single-cell and spatial transcriptomics reveal the molecular, cellular and spatial bone marrow niche organization. Nat Cell Biol. 22 (1), 38-48 (2020).
- Ebrahimi Dastgurdi, M., Ejeian, F., Nematollahi, M., Motaghi, A., Nasr-Esfahani, M. H. Comparison of two digestion strategies on characteristics and differentiation potential of human dental pulp stem cells. Arch Oral Biol. 93, 74-79 (2018).
- Abreu-Velez, A. M., Howard, M. S. Collagen IV in normal skin and in pathological processes. N Am J Med Sci. 4 (1), 1-8 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır
Sitemizdeki deneyiminizi iyileştirmek için çerezleri kullanıyoruz
Sitemizi kullanmaya devam ederek ya da "Devam et" butonuna tıklayarak, çerezleri kabul edebilirsiniz.