Method Article
تحديد مجموعات البيئة الدقيقة لنخاع العظم في متلازمة خلل التنسج النقوي وسرطان الدم النخاعي الحاد
In This Article
Summary
هنا يتم تقديم بروتوكول مفصل لعزل وتوصيف مجموعات البيئة الدقيقة لنخاع العظم من نماذج الفئران لمتلازمات خلل التنسج النقوي وسرطان الدم النخاعي الحاد. تحدد هذه التقنية التغيرات في مكانة نخاع العظم غير المكونة للدم ، بما في ذلك الخلايا اللحمية البطانية واللحمة المتوسطة ، مع تطور المرض.
Abstract
تتكون البيئة المكروية لنخاع العظم من مجموعات خلايا متميزة ، مثل الخلايا اللحمية المتوسطة ، والخلايا البطانية ، وخلايا النسب العظمي ، والخلايا الليفية ، والتي توفر الدعم للخلايا الجذعية المكونة للدم (HSCs). بالإضافة إلى دعم HSCs الطبيعية ، تلعب البيئة المكروية لنخاع العظم أيضا دورا في تطوير اضطرابات الخلايا الجذعية المكونة للدم ، مثل متلازمات خلل التنسج النقوي (MDS) وسرطان الدم النخاعي الحاد (AML). تؤدي الطفرات المرتبطة ب MDS في HSCs إلى كتلة في التمايز وفشل نخاع العظم التدريجي ، خاصة عند كبار السن. يمكن أن تتطور متلازمات خلل التنسج النقي في كثير من الأحيان إلى ابيضاض الدم النقوي الحاد المقاوم للعلاج، وهو مرض يتميز بالتراكم السريع للأرومات النخاعية غير الناضجة. من المعروف أن البيئة المكروية لنخاع العظم تتغير في المرضى الذين يعانون من هذه الأورام النخاعية. هنا ، يتم وصف بروتوكول شامل لعزل وتوصيف الخلايا البيئية الدقيقة لنخاع العظم من نماذج الفئران لمتلازمة خلل التنسج النقوي وسرطان الدم النخاعي الحاد. يمكن أن يساعد عزل وتوصيف التغيرات في مجموعات نخاع العظم المتخصصة في تحديد دورها في بدء المرض وتطوره وقد يؤدي إلى تطوير علاجات جديدة تستهدف التغيرات المعززة للسرطان في مجموعات انسجة نخاع العظم.
Introduction
تتكون البيئة المكروية لنخاع العظم من خلايا مكونة للدم ، وخلايا انسجة غير مكونة للدم ، ومصفوفة خارج الخلية 1,2. يمكن لهذه البيئة المكروية أن تعزز التجديد الذاتي للخلايا الجذعية المكونة للدم ، وتنظيم تمايز النسب ، وتوفير الدعم الهيكلي والميكانيكي للأنسجة العظمية1،2،3،4،5. يشمل مكانة اللحمية خلايا النسب العظمي والخلايا الليفية والخلايا العصبية والخلايا البطانية6 ، بينما يتكون مكان المكونة للدم من السكان اللمفاويين والنخاعيين1،2،3. بالإضافة إلى دعم HSCs الطبيعية ، يمكن أن تلعب البيئة المكروية لنخاع العظم أيضا دورا في تطوير اضطرابات الخلايا الجذعية المكونة للدم مثل MDS و AML7،8،9،10،11. وقد تبين أن الطفرات في خلايا السلالة العظمية تعزز تطور متلازمات خلل التنسج النقي وابيضاض الدم النقوي وغيرها من الأورام التكاثريةالنقوية 10،12،13،14.
متلازمات خلل التنسج النقوي هي مجموعة من اضطرابات ما قبل اللوكيميا التي تنشأ من طفرات في الخلايا الجذعية المكونة للدم. كثيرا ما يرتبط متلازمات خلل التنسج النقي بكتلة في تمايز HSC وإنتاج خلايا خلل التنسج، والتي يمكن أن تؤدي غالبا إلى فشل نخاع العظم. متلازمات خلل التنسج النقي هي أكثر الأورام النخاعية التي يتم تشخيصها شيوعا في الولايات المتحدة وترتبط بمعدل بقاء لمدة 3 سنوات من 35٪ -45٪ 15. غالبا ما يرتبط متلازمات خلل التنسج النقي بارتفاع خطر التحول إلى ابيضاض الدم النخاعي الحاد. يمكن أن يكون هذا من المضاعفات القاتلة ، حيث أن ابيضاض الدم النقوي الحاد المشتق من متلازمات خلل التنسج النقي مقاوم لمعظم العلاجات ومن المحتمل أن ينتكس. ابيضاض الدم النقوي الحاد (AML) الذي ينشأ من جديد بسبب عمليات النقل أو الطفرات في الجذع والأسلاف المكونة للدم غالبا ما يكون مقاوما للعلاج الكيميائي القياسي16,17. نظرا لأن MDS و AML هما في المقام الأول أمراض كبار السن ، حيث يتم تشخيص الغالبية فوق سن 60 عاما ، فإن معظم المرضى غير مؤهلين لعمليات زرع نخاع العظم العلاجية. وبالتالي ، هناك حاجة كبيرة لتحديد المنظمين الجدد لتطور المرض. نظرا لأن البيئة المكروية لنخاع العظم يمكن أن توفر الدعم للخلايا الخبيثة14 ، فإن تحديد التغييرات في مكانة نخاع العظم مع تطور المرض قد يؤدي إلى تحديد علاجات جديدة تهدف إلى تثبيط إعادة تشكيل مكانة الورم. لذلك ، هناك حاجة كبيرة لتحديد منظمات جديدة لتطور المرض. تحقيقا لهذه الغاية ، من الأهمية بمكان تحديد وتوصيف التغيرات في مجموعات الخلايا اللحمية في نخاع العظم التي قد توفر الدعم للخلايا الخبيثة.
تم إنشاء العديد من نماذج الفئران من AML و MDS ويمكن استخدامها لدراسة التغيرات في البيئة المكروية لنخاع العظم أثناء بدء المرض وتطوره6،1،19،20،21،22. هنا ، يتم وصف بروتوكولات لتحديد التغيرات في مجموعات الخلايا اللحمية في نخاع العظم باستخدام نماذج الفئران من AML 6,20 المستحث بالفيروسات القهقرية ، بالإضافة إلى نموذج Nup98-HoxD13 (NHD13) المتاح تجاريا من MDS عالية الخطورة لتحويلAML 19. الفئران المزروعة بخلايا دي نوفو AML تستسلم للمرض في 20-30 يوما6. تصاب الفئران NHD13 بنقص الخلايا وخلل التنسج في نخاع العظم حوالي 15-20 أسبوعا ، والذي يتحول في النهاية إلى AML ، ويستسلم ما يقرب من 75٪ من الفئران للمرض حوالي 32 أسبوعا. لتحليل مجموعات البيئة المكروية لنخاع العظم النموذجية للفئران ، يتم حصاد العظام ، ويتم هضم نخاع العظم والشويكات العظمية باستخدام الهضم الأنزيمي ، ثم يتم إثراء الخلايا ل CD45- / Ter119- المجموعات غير المكونة للدم عن طريق الفرز المغناطيسي. في حين تم وصف تحليلات مماثلة سابقا11،13،22،23،24،25 ، فإنها غالبا ما تركز على نخاع العظم أو العظم ولا تدمج خلايا من كلا المصدرين في تحليلاتها. يمكن أن يوفر التوصيف المشترك لهذه المجموعات ، جنبا إلى جنب مع تحليلات التعبير الجيني ، فهما شاملا لكيفية توفير البيئة المكروية المكونة للدم الخلوية الدعم لبدء المرض وتطوره (الشكل 1). بينما يركز البروتوكول الموضح أدناه على نموذج AML المستحث بالفيروسات القهقرية ونموذج MDS الوراثي ، يمكن تكييف هذه الاستراتيجيات بسهولة لدراسة التغيرات في مكانة نخاع العظم لأي نموذج فأر مهم.
Protocol
أجريت جميع التجارب على وفقا للبروتوكولات المعتمدة من قبل لجنة جامعة روتشستر للثروة الحيوانية. تم تربية الفئران والحفاظ عليها في مرافق رعاية في جامعة روتشستر. لنمذجة متلازمات خلل التنسج النقي عالية الخطورة ، يتم استخدام نموذج الفئران NHD13 المتاح تجاريا19 . في هذا النموذج ، يتم تحليل الخلايا اللحمية لنخاع العظم في إناث الفئران NHD13 في عمر 8 أسابيع ، قبل ظهور المرض. دي نوفو يتم إنشاء AML كما هو موضح سابقا6،11،20. يتم تمييز الجينات المسرطنة المستخدمة للحث على ابيضاض الدم النقوي الحاد ، مثل MLL-AF9 و NRas ، ب GFP أو YFP ، مما يسمح بتحليل مجموعات نخاع العظم GFP غير اللوكيمية باستخدام قياس التدفق الخلوي. باختصار ، يتم زرع إناث الفئران C57BL / 6J البالغة من العمر 10 أسابيع بخلايا الفئران GFP / YFP + AML ، ويتم حصاد نخاع العظم بعد أسبوعين من الزرع. بينما يتم استخدام إناث الفئران في هذه الدراسة لأغراض العرض التوضيحي ، يمكن إجراء هذا البروتوكول مع ذكور أو إناث الفئران. يمكن أيضا إجراؤه باستخدام عظم الفخذ أو جميع العظام الطويلة.
1. حصاد نخاع العظم
ملاحظة: للحصول على تفاصيل حول بروتوكول تشريح ، يرجى الرجوع إلى تعديل وآخرون 26.
- نظف الهاون والمدقة بنسبة 70٪ من الإيثانول ، واشطفها بمحلول FACS المبرد (الجدول 1) ، وضعها على الثلج لتبرد قبل بدء الحصاد. أيضا ، ضع المخزن المؤقت MACs (الجدول 1) على المقعد للسماح له بالوصول إلى درجة حرارة الغرفة.
- القتل الرحيم للحيوان باتباع إرشادات وبروتوكولات رعاية واستخدام المؤسسية.
- على سطح الطاولة ، قم برش الماوس جيدا بنسبة 70٪ من الإيثانول حتى يصبح الفراء مبللا. باستخدام ملقط ومقص منحني ، ارفع الجلد على البطن وقم بعمل شقين بطول 0.5 مم تقريبا على جانبي الفأر ، جانبيا من البطن. بعد ذلك ، قم بعمل شق 0.5 مم بعيدا عن البطن. اسحب لأسفل لإزالة الجلد والفراء من أرجل الماوس.
- ضع المقص عموديا على الحوض ، واضغط لأسفل أثناء سحب عظم الفخذ بالملقط. يجب أن ينفصل رأس الفخذ عن الحوض. افصل عظم الفخذ والساق عند المفصل الرضفي الفخذي. ضع العظام في مخزن FACS المؤقت في طبق من 6 آبار على الجليد.
- قم بإزالة الأنسجة من العظام باستخدام الأنسجة المختبرية وضع العظام النظيفة في طبق جديد مكون من 6 آبار مع مخزن مؤقت جديد من FACS على الجليد.
- ضع جميع العظام في الهاون باستخدام 2-5 مل من المخزن المؤقت FACS بحيث يتم غمر جميع العظام في المخزن المؤقت (اضبط حجم المخزن المؤقت بناء على عدد العظام التي تقوم بمعالجتها). سحق وطحن العظام باستخدام المدقة في حركة دائرية حتى يتم تحرير أنسجة نخاع العظم.
- باستخدام حقنة سعة 3 مل ، قم بتجانس نخاع العظم عن طريق سحب السائل لأعلى وغسله من الهاون.
- باستخدام حقنة سعة 3 مل ، اسحب السائل من الهاون وقم بترشيحه من خلال مصفاة خلية 70 ميكرومتر في أنبوب سعة 50 مل على الجليد. اشطف قطع العظم / الأنسجة من المرشح مرة أخرى إلى الهاون باستخدام مخزن FACS المؤقت وارجع إلى الخطوة 1.7 للتجانس والتصفية مرة أخرى. هذا يشكل جزء نخاع العظم.
- اشطف قطع العظام المتبقية (الشويكات) مرة أخرى في الهاون باستخدام مخزن FACS المؤقت واغسلها في أنبوب سعة 15 مل باستخدام محلول FACS لضمان أقصى إنتاجية للخلايا. هذا هو جزء الشويكات العظمية.
2. هضم نخاع العظم
- جهاز طرد مركزي نخاع العظم عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. صب وتجاهل طاف.
- أعد تعليق نخاع العظم في 2 مل من خليط هضم نخاع العظم (الجدول 1) وانقله إلى أنبوب سعة 15 مل. احتضان في 37 درجة مئوية لمدة 45 دقيقة على المدور.
- أضف 10 مل من محلول FACS المؤقت لوقف الهضم الأنزيمي. قم بتصفية الخليط من خلال مصفاة خلية 70 ميكرومتر في أنبوب جديد سعة 50 مل.
- يخفق المزيج على حرارة 400 × جم لمدة 7 دقائق على حرارة 4 درجات مئوية.
- أعد تعليق حبيبات نخاع العظم في 1 مل من محلول تحلل كرات الدم الحمراء (انظر جدول المواد). احتضان لمدة 4 دقائق على الجليد.
- أضف 10 مل من المخزن المؤقت FACS لإيقاف التحلل. قم بتصفية الخليط من خلال مصفاة خلية 70 ميكرومتر في أنبوب جديد سعة 50 مل.
- يخفق المزيج على حرارة 300 × جم لمدة 5 دقائق على حرارة 4 درجات مئوية. قم بإزالة المادة الطافية وأعد تعليق الحبيبات في 100 ميكرولتر من المخزن المؤقت FACS.
3. هضم الشويكات العظمية
- دوامة الشويكات العظمية من الخطوة 1.9 والسماح لها بالاستقرار. صب الطافع والاحتفاظ بالعظم في الأسفل.
- إعادة تعليق الشويكات العظمية في 1 مل من خليط هضم شبيكة العظام (الجدول 1).
- ضع الأنابيب على أنبوب دوار لمدة 60 دقيقة عند 37 درجة مئوية.
- أضف 10 مل من محلول FACS المؤقت لوقف الهضم الأنزيمي. قم بتصفية الخليط من خلال مصفاة خلية 70 ميكرومتر في أنبوب سعة 50 مل يحتوي على نخاع عظمي محلل ومهضوم من كرات الدم الحمراء.
4. تلطيخ
- امزج بلطف الشويكات العظمية وتعليق خلايا نخاع العظم.
- استخدم 10 ميكرولتر من معلق الخلية لحساب عدد الخلايا الحية على مقياس الدم باستخدام 0.4٪ تلطيخ أزرق تريبان ، كما هو موضح في البروتوكولات المنشورة27. اجمع 50000 خلية للتحكم غير الملوث من تعليق الخلية.
- أجهزة الطرد المركزي الخلايا المتبقية عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. قم بإزالة المادة الطافية وإعادة تعليقها في 100 ميكرولتر من المخزن المؤقت FACS.
ملاحظة: يمكن معايرة الأجسام المضادة لتحديد التخفيف المثالي. يمكن تخصيص اختيار الأجسام المضادة (الحواتم والفلوروكرومات). - للتلطيخ بالأجسام المضادة للنضوب المغناطيسي ، أضف FC Block (1 ميكرولتر لكل 25 × 106 خلايا) ، CD45-APC (10 ميكرولتر لكل 25 × 106 خلايا) ، و Ter119-APC (4 ميكرولتر لكل 25 × 106 خلايا) (انظر جدول المواد).
- احتضان على الجليد لمدة 20 دقيقة. اغسل باستخدام المخزن المؤقت FACS ، وقم بإزالة 50000 خلية (~ 50 ميكرولتر) للتحكم الملون ب APC ، وأجهزة الطرد المركزي عند 300 × g لمدة 5 دقائق عند 4 درجات مئوية ، وأعد التعليق في 100 ميكرولتر من المخزن المؤقت FACS.
- لتلطيخ معلق الخلية بالميكروبيدات للنضوب المغناطيسي ، أضف mIgG (8 ميكرولتر لكل 25 × 106 خلايا) والميكروبيدات المضادة ل APC (20 ميكرولتر لكل 25 × 106 خلايا) (انظر جدول المواد).
- احتضان على الجليد لمدة 20 دقيقة. يغسل بمخزن مؤقت FACS سعة 10 مل ، جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
5. استنزاف العينة عن طريق الفرز المغناطيسي
ملاحظة: يتم تنفيذ هذه الخطوة باستخدام فاصل مغناطيسي يدوي متوفر تجاريا وفقا لتعليمات الشركة المصنعة. يمكن أيضا تنفيذ هذه الخطوة باستخدام فاصل آلي (انظر جدول المواد).
- قم بإعداد عمود LD عن طريق غسله ب 2 مل من المخزن المؤقت MACs (الجدول 1). تخلص من النفايات السائلة وقم بتغيير أنبوب التجميع.
- أعد تعليق ما يصل إلى 1 × 108 خلايا في المخزن المؤقت MACs وقم بتصفيتها من خلال أنبوب اختبار سعة 5 مل مع غطاء مصفاة خلية 35 ميكرومتر.
- ضع عمود LD على حامل الفاصل المغناطيسي. ضع أنبوب اختبار سعة 5 مل أسفل العمود لجمع الشحم.
- أضف تعليق الخلية إلى عمود LD المعد. اترك الكسر السالب يتدفق إلى أنبوب التجميع. اغسل العمود مرتين باستخدام 1 مل من المخزن المؤقت MACs ، مع جمع الشطف في نفس الأنبوب. هذا هو الكسر السالب المستخدم في الخطوة 5.6 أدناه.
- قم بإزالة عمود LD من حامل الفاصل المغناطيسي وضعه على أنبوب اختبار جديد سعة 5 مل. استخدم ماصة لتوزيع 3 مل من المخزن المؤقت في العمود لطرد الخلايا التي تم تصنيفها بشكل إيجابي ، باستخدام مكبس العمود.
- أجهزة الطرد المركزي الكسور السالبة والموجبة عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليقها في 100 ميكرولتر من المخزن المؤقت FACS.
- عد 10 ميكرولتر من الكسور السالبة والموجبة مع 0.4٪ تريبان الأزرق. ستعتمد أحجام تلطيخ اللوحة البطانية / تحليل العظام أدناه على عدد الخلايا هذا.
- استخدم 50000 خلية حية من الكسر الموجب للتحكم في بوابة قياس التدفق الخلوي.
6. تحليل العظام / وصمة عار لوحة البطانة
ملاحظة: يجب إجراء التعويض باتباع بروتوكولات قياس التدفق الخلوي القياسية ، بما في ذلك جميع أدوات التحكم المناسبة في التلوين والبوابات.
- لتلطيخ الجزء السلبي CD45 / Ter119 (1 ميكرولتر من كل جسم مضاد لكل 1 × 106 خلايا) ، أضف CD31-PE-Cy7 و Sca-1-BV421 و CD51-PE و CD140a-PE-Cy5 (انظر جدول المواد).
- احتضان على الجليد لمدة 20 دقيقة. يغسل ب 2 مل من محلول FACS ، ثم جهاز طرد مركزي عند 300 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- أضف 1 مل من المخزن المؤقت FACS وتخفيف 1: 1000 من PI للتلطيخ الحي / الميت ، ثم قم بتصفية العينة من خلال أنبوب اختبار 5 مل مع غطاء مصفاة خلية 35 ميكرومتر.
- تحليل الخلايا على مقياس التدفق الخلوي متعدد الألوان.
النتائج
توضح هذه المقالة طريقة قائمة على قياس التدفق الخلوي لتحليل مجموعات البيئة الدقيقة لنخاع العظم ، مثل الخلايا اللحمية البطانية والوسيطة ، من نماذج MDS و Leukemia murine (الشكل 1). يصور الشكل 2 استراتيجية البوابات للكشف عن المجموعات السكانية ذات الأهمية ، بدءا من اختيار الخلايا (P1) في الجزء المهضوم والمستنفد CD45 / Ter119 من خلال ملف التشتت الأمامي والجانبي. يتم عرض أمثلة على بوابات الخلايا في عينة سرطان الدم في P1 (الشكل 2A). يتم اختيار المفردات ويتم استبعاد الثنائيات من هذا التحليل ، P2 (الشكل 2B). يوضح الشكل 2C بوابات لاختيار الخلايا الحية سالبة اليود البروبيديوم ، P3. للتركيز على مجموعات اللحمة غير المكونة للدم ، الخلايا التي هي CD45- / Ter119- ، P4 (APC ، المحور Y) مقابل. يتم اختيار SSC-A (الشكل 2D). استراتيجية البوابات الأولية هذه شائعة لتحليل جميع العينات.
يستخدم نموذج فأر ابيضاض الدم لتوضيح بوابات الخلايا البطانية في الأشكال 2E-G. يصور الشكل 2E CD31 الإيجابي (Pe-Cy7 ، المحور Y) مقابل. خلايا SSC-A في فأر التحكم غير السرطاني وكذلك فأر اللوكيميا ، بوابات من خلال P4. الخلايا التي تحمل علامة CD31 هي الخلايا البطانية ، P5. في الشكل 2F ، المسور من خلال P5 ، يتم تحديد الخلايا البطانية الشريانية على أنها CD45-Ter119-CD31 + Sca1 + ، P6 ، ويتم تحديد الخلايا البطانية الجيبية على أنها CD45-Ter119-CD31 + Sca1- ، P7 (BV421 ، المحور Y) مقابل. SSC-A.
على الرغم من أن هذا التحليل يركز على الخلايا البيئية الدقيقة لنخاع العظم غير اللوكيميا ، إلا أنه من المفيد أيضا تحديد عبء الورم. يمكن القيام بذلك باستخدام جزء صغير من العينة غير المهضومة / غير المستنفدة قبل بدء التجربة. في هذا التحكم التجريبي (الخطوط المتقطعة) الشكل 2G ، يمثل P8 عبء الورم في العينة ويمثل P9 الخلايا غير السرطانية.
يستخدم نموذج الفئران متلازمات خلل التنسج التنسجي النقي لتوضيح تحليل خلايا اللحمة المتوسطة في الشكل 2H-J. يصور الشكل 2H CD31 السلبي (Pe-Cy7 ، المحور Y) مقابل. خلايا SSC-A ، بوابات من خلال P4. يوضح الشكل 2I تجمعات خلايا اللحمة المتوسطة في فأر تحكم من النوع البري وفأر متلازم خلل التنسج النقي. من خلال P10 ، يتم تحديد الخلايا اللحمية المتوسطة على أنها CD45-Ter119-CD31-CD51 + CD140a + ، P113 (Pe ، المحور Y; Pe-Cy5 ، المحور السيني). الضوابط التجريبية (الخطوط المتقطعة) ، يوضح الشكل 2J أمثلة على عناصر التحكم في البوابات أحادية اللون ، وبقعة CD51 المفردة و CD140a المفردة المستخدمة لبوابة MSCs الموضحة في العينات التجريبية في الشكل 2I.
تشير هذه البيانات إلى أن الخلايا البطانية الشريانية تتوسع بشكل كبير في البيئة المكروية ل AML ، مع فقدان مصاحب في مجموعات البطانة الجيبية (الشكل 2F) ، بما يتفق مع الدراسات السابقة باستخدام الطعوم الخارجية المشتقة من المريض في الفئران التي تعاني من نقص المناعة28. من المحتمل أن التوسع الصغير في خلايا اللحمة المتوسطة التي شوهدت في الفئران NHD13 في عمر 8 أسابيع (الشكل 2I) قد يزداد في 16-20 أسبوعا ، عندما تبدأ هذه الفئران في عرض خصائص MDS25. على الرغم من استخدام نموذج ابيضاض الدم فقط لتوضيح عدد الخلايا البطانية واستخدام نموذج الفئران MDS لتوضيح مجموعات خلايا اللحمة المتوسطة ، يمكن استخدام استراتيجيات تلطيخ وبوابات مماثلة لتحليل مجموعات البيئة الدقيقة المختلفة في أي من هذه النماذج ، أو في الواقع ، في أي نموذج فأر معدل وراثيا مهم.
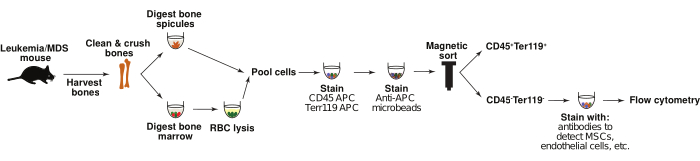
الشكل 1: عزل خلايا انسجة نخاع العظم. يوضح التخطيطي عملية عزل الخلايا اللحمية لنخاع العظم غير المكونة للدم من الفئران الضابطة واللوكيميا. باختصار ، يتم هضم الشويكات العظمية ونخاع العظم بشكل منفصل ثم تجميعها. يتم إثراء مجموعة CD45-Ter119- عن طريق الفرز المغناطيسي ، وملطخة بألواح الأجسام المضادة ضد المجموعات ذات الأهمية ، مثل خلايا اللحمة المتوسطة والخلايا البطانية. ثم يتم تحليل الخلايا عن طريق قياس التدفق الخلوي. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
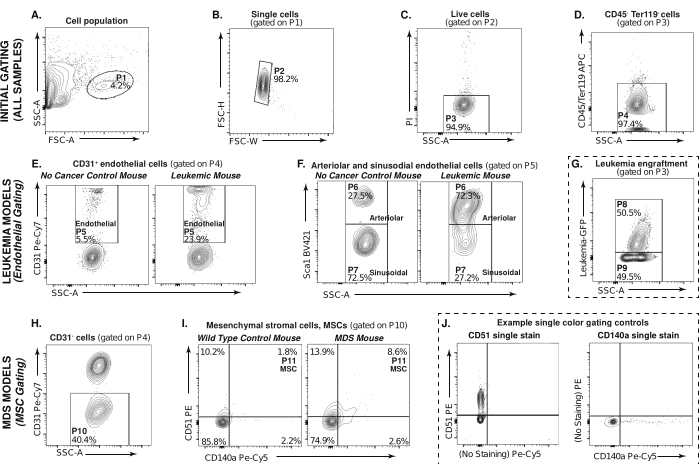
الشكل 2: استراتيجية البوابات لنخاع العظم غير المكونة للدم والخلايا اللحمية. (A-D) استراتيجية بوابة قياس التدفق الخلوي المستخدمة لاختيار السكان المهضومين ، CD45- / Ter119- ، غير المكونة للدم (P4) في كل من سرطان الدم ونموذج الفئران MDS. (ه) يمكن تقسيم الخلايا البطانية لنخاع العظم ابيضاض الدم (P5 ، CD31 +) على النحو التالي: (F) Sca1+ الشرياني (P6) أو الخلايا البطانية الجيبية Sca1 (P7). (ز) تطعيم اللوكيميا في عينة AML حيث يمثل P8 التطعيم بينما يمثل P9 الخلايا غير السرطانية. تشير الخطوط المنقطة إلى أن هذه المؤامرة هي عنصر تحكم تجريبي. (H) بوابات من خلال P4 ، نخاع العظم MDS خلايا CD31 ، P10 (I) خلايا انسجة اللحمة المتوسطة (CD51 + / CD140a + ، P11). (J) مثال على عناصر التحكم في البوابات أحادية اللون ، CD51 (يسار) و CD140a (يمين) المستخدمة لتحديد بوابات خلايا اللحمة المتوسطة في (I). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| حل | الكاشف | تركيز | المبلغ المراد إضافته |
| المخزن المؤقت FACS | هبس | 10 أضعاف | 100 مل |
| EDTA | 0.5 م | 4 مل | |
| مصل الجنين البقري | - | 50 مل | |
| الماء | - | 848 مل | |
| خليط هضم نخاع العظم | هبس | 1x | 2 مل |
| دناز 1 | 1 ميكروغرام / مل في 1x DPBS | 20 ميكرولتر | |
| مسحوق ديسباز II | - | 4 ملغ | |
| كولاجيناز النوع الرابع | - | 2 ملغ | |
| خليط هضم العظم الشائك | دب ب س | 1x | 320 مل |
| كولاجيناز نوع 1 | - | 1 غرام | |
| مصل الجنين البقري | - | 80 مل | |
| المخزن المؤقت ل MACs | جيش صرب البوسنه | 66 غ/مول | 5 غرام |
| دب ب س | 10 أضعاف | 100 مل | |
| EDTA | 0.5 م | 4 مل | |
| الماء | - | 896 لتر |
الجدول 1: تكوين المحاليل والمخازن المؤقتة المستخدمة في هذه الدراسة.
Discussion
تم استخدام نماذج سرطان الدم الفئران على نطاق واسع لتحديد الإشارات الجوهرية للخلايا والمتخصصة التي تعزز تطور سرطان الدم النخاعي العدواني6،19،21. هنا ، يتم تقديم بروتوكول شامل قائم على قياس التدفق الخلوي لتحديد التركيب الخلوي للبيئة الدقيقة لنخاع العظم في نماذج الفئران من MDS و AML.
قبل الحصول على بيانات قياس التدفق الخلوي من العينات التجريبية ، من المهم التعويض بعناية عن تداخل التألق. من الضروري أيضا تضمين جميع أدوات التحكم المناسبة في التلوين والبوابات. ستسمح هذه الخطوات للمجرب بتأكيد أن تلطيخ الأجسام المضادة الإيجابي أو السلبي يمثل تعبيرا دقيقا عن علامات الخلايا ذات الأهمية وليس قطعة أثرية للتداخل الطيفي الفلوري أو التألق الذاتي. على الرغم من أن هذا البروتوكول يصف علامات سطح الخلية المحددة ، إلا أنه يمكن توسيع ألواح الأجسام المضادة بناء على الحاجة التجريبية. على سبيل المثال ، يمكن إعطاء CD144 (Ve-Cadherin) في الجسم الحي قبل حصاد الفئران ويمكن أن يكون بمثابة علامة محددة إضافية للخلايا البطانية 5,29. بينما يمكن تغيير الفلوروفورات واستنساخ الأجسام المضادة المشار إليها هنا، يجب إجراء المعايرات لتحديد تخفيفها المثالي. لتحديد جميع مجموعات الخلايا بشكل قاطع في مكانة نخاع العظم ، يمكن استخدام تسلسل الحمض النووي الريبي أحادي الخلية لإنشاء المشهد المتخصص لنخاع العظم أثناء بدء MDS / AML وتقدمه23،24،30.
من الأهمية بمكان تحضير العينة بعناية وفقا للخطوات الموضحة في هذا البروتوكول. عند تجانس العظام ، من الأهمية بمكان أن يتم تبريد الهاون والمدقة ، ويتم تنفيذ جميع الخطوات على الجليد لمنع موت الخلايا ولضمان استعادة الخلايا العالية. من المهم جدا إزالة جميع الأنسجة المحيطة بالعظام قبل التجانس لمنع تلوث أنواع الخلايا الأخرى غير المرغوب فيها. أثناء تحلل كرات الدم الحمراء والهضم ، من المهم إيقاف التفاعل الأنزيمي بكمية مناسبة من FACS Buffer وإعادة تعليقه جيدا في محلول مؤقت جديد ، أو ستستمر الخلايا في الهضم وتموت في النهاية.
يعد فصل كسور العظام ونخاع العظم أمرا ضروريا لأن الشويكات العظمية تتطلب مزيجا مختلفا من الإنزيمات لمخزن الهضم وتحتاج إلى وقت أطول للهضم. في هضم العظام ، يكون نوع الكولاجين 1 مفيدا لهضم ألياف كولاجيناز التي توجد عادة في المصفوفة خارج الخلية وألياف الكولاجين31. بالإضافة إلى ذلك، تظل بعض خلايا نخاع العظم الموجودة بالقرب من البطانة مرتبطة بالعظم بعد التجانس، ولا تفرز إلا عن طريق الهضم الأنزيمي. عند هضم نخاع العظم ، يستخدم كولاجيناز من النوع الرابع لهضم الغشاء القاعدي للخلايا الظهارية والبطانية داخل نخاع العظم32 ، بينما يشق الفاصل بشكل أساسي الفبرونيكتين31. يتطلب نخاع العظم وقتا أقل للهضم لأن الارتباطات بين الخلايا والمصفوفة أضعف. يمكن أن يؤدي احتضان جزء نخاع العظم في ظروف مماثلة إلى إتلاف السكان المعنيين. يؤدي استخدام اثنين من مخازن الهضم المختلفة إلى زيادة كبيرة في عدد مجموعات الفم التي يمكن اكتشافها ، وبالتالي يوفر مجموعة بيانات أكبر لتحليلها.
تستخدم معظم البروتوكولات المتاحة لتحليل مجموعات البيئة الدقيقة لنخاع عظم الفئران حقنة لطرد نخاع العظم من العظام الطويلة فقط13,24. توفر الطريقة الحالية لسحق العظام القدرة على الحصول على بيانات من عظام أخرى مثل الحوض ، وتقلل بشكل كبير من وقت تحضير العينة ، وتخفف من احتمال حدوث إصابات بإبر حادة. بالنظر إلى أن العظم يتكون من بانيات عظمية ناضجة ومجموعات خلايا أخرى يمكن أن توفر الدعم للخلايا المكونة للدم الطبيعية والخبيثة ، فإن هذه الطريقة لتضمين خلايا من الشويكات العظمية تتيح تمثيلا أكثر دقة للبيئة الدقيقة لنخاع العظم في العينة. في حين أن إحدى الدراسات السابقة هضمت نخاع العظم والشبيكات العظمية بشكل منفصل11 ، إلا أنها لم تثبت تلطيخ الخلايا العظمية والبطانية في نفس العينة. استخدمت دراسة ثانية خلطات الإنزيمات المسجلة الملكية المتاحة تجاريا لهضم نخاع العظم والشويكاتالعظمية 23 ، وحللت البيانات باستخدام تقنية تسلسل الحمض النووي الريبي أحادية الخلية الأكثر تكلفة بكثير. تختار طريقة التخصيب هذه لخلايا CD45- / Ter119- الخلايا ذات الأهمية ، وتقلل بشكل كبير من الوقت اللازم للحصول على البيانات على مقياس التدفق الخلوي. وبالتالي ، بالمقارنة مع أحدث الطرق الأخرى مثل تسلسل الحمض النووي الريبي أحادي الخلية ، فإن هذه الطريقة القائمة على قياس التدفق الخلوي يمكن الوصول إليها بشكل أكبر وفعالة من حيث التكلفة ولا تتطلب تحليلا متطورا من قبل علماء المعلوماتية الحيوية المدربين23،24،30.
من المهم ملاحظة أنه يمكن استخدام هذا البروتوكول لتوصيف البيئة المكروية لنخاع العظم ليس فقط لأي من نماذج الفئران المتاحة من MDS و AML ولكن أي نموذج فأر وراثي. يمكن أن تكون الطرق المماثلة فعالة أيضا في تحليل التغيرات في مكانة نخاع عظم الفئران لنماذج xenograft المشتقة من المريض (PDX). يمكن أن تكون هذه الطرق مفيدة للدراسات التي تهدف إلى تحديد الآليات التي تؤثر بها MDS / AML على مكانة نخاع العظم. نظرا للتحديات التقنية المرتبطة بأخذ عينات كميات كبيرة من نخاع العظام من المرضى من البشر ، فإن هذه التحليلات لنماذج الفئران هي أداة فعالة لتعزيز فهم البيئة المكروية لنخاع العظم الخبيث وتحديد دورها في تطور المرض.
Disclosures
لم يتم الإعلان عن أي تضارب في المصالح.
Acknowledgements
نود أن نشكر نواة قياس التدفق الخلوي URMC. تم دعم هذا العمل من قبل جائزة الجمعية الأمريكية لعلماء أمراض الدم ، وجائزة مؤسسة أبحاث اللوكيميا ومنح المعاهد الوطنية للصحة R01DK133131 R01CA266617 منح ل JB
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL pipette Tips | Genesee Scientific | 24-165RL | |
| 1.7 mL Microcentrifuge Tubes | AVANT | L211511-CS | |
| 10 µL pipette Tips | Genesee Scientific | 24-140RL | |
| 10 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1760 | |
| 1000 mL Vacuum Filtration Flask | NEST | 344021 | |
| 15 mL Centrifuge Tube | VWR | 10026-076 | |
| 2 mL Aspirating Pipette | NEST | 325011 | |
| 200 µL pipette Tips | Genesee Scientific | 24-150-RL | |
| 25 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1780 | |
| 5 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1740 | |
| 5 mL Polystyrene Round-Bottom Tube 12 x 75 mm style | Falcon | 352054 | |
| 5 mL Polystyrene Round-Bottom Tube with Cell Strainer Cap 12 x 75 mm style | Falcon | 352235 | |
| 50 mL Centrifuge Tube | NEST | 602052 | |
| 6 Well, Flat Bottom with Low Evaporation Lid | Falcon | 353046 | |
| Absorbent Underpads with Waterproof Moisture Barrier | VWR | 56616-031 | |
| APC MicroBeads | Miltenyi | 130-090-855 | |
| autoMACS Pro Separator | Miltenyi Biotec GmBH | 4425745 | |
| BD Pharmingen Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | 0.5 mg/mL |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | 66.000 g/mol |
| Brilliant Violet 421 anti-mouse Ly-6A/E (Sca-1) Antibody (D7) | Invitrogen | 404-5981 | 0.2 mg/mL |
| C57BL/6J Mice | Jackson Laboratory | 664 | |
| Carbon Dioxide Gas Tank | Airgas | CD50 | |
| CD31 (PECAM-1) Monoclonal Antibody (390), PE-Cyanine7 | Invitrogen | 25-0311-82 | 0.2 mg/mL |
| CD45 Monoclonal Antibody (30-F11), APC | Invitrogen | 17-0451-82 | 0.2 mg/mL |
| Cell Strainer 70 µm Nylon | Falcon | 352350 | |
| Cole-Parmer Essentials Mortar and Pestle; Agate, 125 mL | Cole-Parmer | EW-63100-62 | |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C5138-500MG | |
| Collagenase Type I | STEMCELL | 7415 | |
| Corning Mini Centrifuge | CORNING | 6770 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 4099 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D4513 | |
| Dispase II, powder | Gibco | 117105041 | |
| DPBS 10x | gibco | 14200-075 | |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 00-4333-57 | |
| Ethanol absolute, KOPTEC, meets analytical specification of BP, Ph. Eur., USP (200 Proof) | VWR | 89125-174 | |
| Fine scissors - sharp | Fine Science Tools | 14061-10 | |
| Foundation B Fetal Bovine Serum | GeminiBio | 900-208 | |
| Gilson PIPETMAN L Pipette Starter Kits | FisherScientific | F167370G | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Hank's Balanced Salt Solution (HBSS) 10x | gibco | 14185-052 | |
| Hemocytometer | Fisher | 02-671-10 | |
| Incubator | BINDER | C150-UL | |
| Kimwipes | KIMTECH | K222101 | |
| LABGARD Class II, Type A2 Biological Safety Cabinet | Nuaire | NU-425-400 | |
| LD Columns | Miltenyi Biotec GmBH | 130-042-901 | |
| LSE Vortex Mixer | CORNING | 6775 | |
| LSRII/Fortessa/Symphony A1 | Becton, Dickinson and Company | 647800L6 | |
| MACS MULTI STAND | Miltenyi Biotec GmBH | 130-042-303 | |
| MACsmix Tube Rotator | Miltenyi Biotec GmBH | 130-090-753 | |
| mIgG | Millipore-Sigma | 18765-10mg | 2 mg/mL |
| Nup98-HoxD13 (NHD13) Mice | Jackson Laboratory | 010505 | |
| PE anti-mouse CD51 Antibody (RMV-7) | Biolegend | 104106 | 0.2 mg/mL |
| PE/Cyanine5 anti-mouse CD140a Antibody (RUO) | Biolegend | 135920 | 0.2 mg/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 10,000 U/mL |
| Plastipak 3 mL Syringe | Becton, Dickinson and Company | 309657 | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| QuadroMACS Separator | Miltenyi Biotec GmBH | 130-090-976 | |
| Sorvall X Pro / ST Plus Series Centrifuge | Thermo Scientific | 75009521 | |
| TER-119 Monoclonal Antibody (TER-119), APC | Invitrogen | 17-5921-82 | 0.2 mg/mL |
| Trypan Blue Solution 0.4% | Gibco | 15-250-061 | |
| Ultrapure 0.5 M EDTA, pH 8.0 | Invitrogen | 15575-038 |
References
- Morrison, S. J., Scadden, D. T. The bone marrow niche for haematopoietic stem cells. Nature. 505 (7483), 327-334 (2014).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Pinho, S., Frenette, P. S. Haematopoietic stem cell activity and interactions with the niche. Nat Rev Mol Cell Biol. 20 (5), 303-320 (2019).
- Kfoury, Y., Scadden, D. T. Mesenchymal cell contributions to the stem cell niche. Cell Stem Cell. 16 (3), 239-253 (2015).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Bajaj, J., et al. Cd98-mediated adhesive signaling enables the establishment and propagation of acute myelogenous leukemia. Cancer Cell. 30 (5), 792-805 (2016).
- Konopleva, M. Y., Jordan, C. T. Leukemia stem cells and microenvironment: Biology and therapeutic targeting. J Clin Oncol. 29 (5), 591-599 (2011).
- Kim, Y. W., et al. Defective notch activation in microenvironment leads to myeloproliferative disease. Blood. 112 (12), 4628-4638 (2008).
- Walkley, C. R., et al. A microenvironment-induced myeloproliferative syndrome caused by retinoic acid receptor gamma deficiency. Cell. 129 (6), 1097-1110 (2007).
- Kode, A., et al. Leukaemogenesis induced by an activating β-catenin mutation in osteoblasts. Nature. 506 (7487), 240-244 (2014).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Raaijmakers, M. H., et al. Bone progenitor dysfunction induces myelodysplasia and secondary leukaemia. Nature. 464 (7290), 852-857 (2010).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Bajaj, J., Diaz, E., Reya, T. Stem cells in cancer initiation and progression. J Cell Biol. 219 (1), e201911053(2020).
- Sekeres, M. A., Taylor, J. Diagnosis and treatment of myelodysplastic syndromes: A review. Jama. 328 (9), 872-880 (2022).
- Zeisig, B. B., Kulasekararaj, A. G., Mufti, G. J., So, C. W. Snapshot: Acute myeloid leukemia. Cancer Cell. 22 (5), 698-698.e1 (2012).
- Krivtsov, A. V., Armstrong, S. A. Mll translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer. 7 (11), 823-833 (2007).
- Yoshimi, A., et al. Coordinated alterations in rna splicing and epigenetic regulation drive leukaemogenesis. Nature. 574 (7777), 273-277 (2019).
- Lin, Y. W., Slape, C., Zhang, Z., Aplan, P. D. Nup98-hoxd13 transgenic mice develop a highly penetrant, severe myelodysplastic syndrome that progresses to acute leukemia. Blood. 106 (1), 287-295 (2005).
- Kwon, H. Y., et al. Tetraspanin 3 is required for the development and propagation of acute myelogenous leukemia. Cell Stem Cell. 17 (2), 152-164 (2015).
- Bajaj, J., et al. An in vivo genome-wide crispr screen identifies the rna-binding protein staufen2 as a key regulator of myeloid leukemia. Nat Cancer. 1 (4), 410-422 (2020).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by mll-af9. Nature. 442 (7104), 818-822 (2006).
- Baryawno, N., et al. A cellular taxonomy of the bone marrow stroma in homeostasis and leukemia. Cell. 177 (7), 1915-1932.e16 (2019).
- Tikhonova, A. N., et al. The bone marrow microenvironment at single-cell resolution. Nature. 569 (7755), 222-228 (2019).
- Balderman, S. R., et al. Targeting of the bone marrow microenvironment improves outcome in a murine model of myelodysplastic syndrome. Blood. 127 (5), 616-625 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. JoVE. 110, e53936(2016).
- JoVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. , JoVE. (2023).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to acute myeloid leukemia progression and drug response. Blood. 128 (22), 2662(2016).
- Xu, C., et al. Stem cell factor is selectively secreted by arterial endothelial cells in bone marrow. Nat Commun. 9 (1), 2449(2018).
- Baccin, C., et al. Combined single-cell and spatial transcriptomics reveal the molecular, cellular and spatial bone marrow niche organization. Nat Cell Biol. 22 (1), 38-48 (2020).
- Ebrahimi Dastgurdi, M., Ejeian, F., Nematollahi, M., Motaghi, A., Nasr-Esfahani, M. H. Comparison of two digestion strategies on characteristics and differentiation potential of human dental pulp stem cells. Arch Oral Biol. 93, 74-79 (2018).
- Abreu-Velez, A. M., Howard, M. S. Collagen IV in normal skin and in pathological processes. N Am J Med Sci. 4 (1), 1-8 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved