Method Article
Identificazione delle popolazioni microambientali del midollo osseo nella sindrome mielodisplastica e nella leucemia mieloide acuta
In questo articolo
Riepilogo
Qui viene presentato un protocollo dettagliato per isolare e caratterizzare le popolazioni microambientali del midollo osseo da modelli murini di sindromi mielodisplastiche e leucemia mieloide acuta. Questa tecnica identifica i cambiamenti nella nicchia del midollo osseo non ematopoietico, comprese le cellule stromali endoteliali e mesenchimali, con progressione della malattia.
Abstract
Il microambiente del midollo osseo è costituito da popolazioni cellulari distinte, come le cellule stromali mesenchimali, le cellule endoteliali, le cellule osteolignaggio e i fibroblasti, che forniscono supporto alle cellule staminali ematopoietiche (HSC). Oltre a supportare le normali HSC, il microambiente del midollo osseo svolge anche un ruolo nello sviluppo di malattie delle cellule staminali ematopoietiche, come le sindromi mielodisplastiche (MDS) e la leucemia mieloide acuta (LMA). Le mutazioni associate alle MDS nelle HSC portano a un blocco della differenziazione e a una progressiva insufficienza del midollo osseo, soprattutto negli anziani. Le MDS possono spesso progredire verso la LMA resistente alla terapia, una malattia caratterizzata da un rapido accumulo di blasti mieloidi immaturi. È noto che il microambiente del midollo osseo è alterato nei pazienti con queste neoplasie mieloidi. Qui viene descritto un protocollo completo per isolare e caratterizzare fenotipicamente le cellule microambientali del midollo osseo da modelli murini di sindrome mielodisplastica e leucemia mieloide acuta. L'isolamento e la caratterizzazione dei cambiamenti nelle popolazioni di nicchia del midollo osseo può aiutare a determinare il loro ruolo nell'inizio e nella progressione della malattia e può portare allo sviluppo di nuove terapie mirate alle alterazioni che promuovono il cancro nelle popolazioni stromali del midollo osseo.
Introduzione
Il microambiente del midollo osseo è costituito da cellule ematopoietiche, cellule stromali non ematopoietiche e dalla matrice extracellulare 1,2. Questo microambiente può promuovere l'autorinnovamento delle cellule staminali ematopoietiche, regolare la differenziazione del lignaggio e fornire supporto strutturale e meccanico al tessuto osseo 1,2,3,4,5. La nicchia stromale comprende le cellule dell'osteolignaggio, i fibroblasti, le cellule nervose e le cellule endoteliali6, mentre la nicchia ematopoietica è costituita dalle popolazioni linfoidi e mieloidi 1,2,3. Oltre a supportare le normali HSC, il microambiente del midollo osseo può anche svolgere un ruolo nello sviluppo di malattie delle cellule staminali ematopoietiche come MDS e LMA 7,8,9,10,11. È stato dimostrato che le mutazioni nelle cellule osteolignaggi promuovono lo sviluppo di MDS, LMA e altre neoplasie mieloproliferative 10,12,13,14.
Le sindromi mielodisplastiche sono un gruppo di malattie preleucemiche che derivano da mutazioni nelle cellule staminali ematopoietiche. La MDS è spesso associata a un blocco della differenziazione delle HSC e alla produzione di cellule displastiche, che spesso possono portare a insufficienza del midollo osseo. La MDS è la neoplasia mieloide più comunemente diagnosticata negli Stati Uniti ed è associata a un tasso di sopravvivenza a 3 anni del 35%-45%15. La MDS è spesso associata a un alto rischio di trasformazione in leucemia mieloide acuta. Questa può essere una complicanza fatale, poiché la LMA derivata da MDS è resistente alla maggior parte delle terapie e può recidiva. Anche la LMA che insorge de novo a causa di traslocazioni o mutazioni nel tronco ematopoietico e nei progenitori è spesso resistente alla chemioterapia standard16,17. Poiché le MDS e la LMA sono principalmente malattie degli anziani, con la maggior parte diagnosticate oltre i 60 anni, la maggior parte dei pazienti non è idonea per i trapianti curativi di midollo osseo. C'è, quindi, una significativa necessità di identificare nuovi regolatori della progressione della malattia. Poiché il microambiente del midollo osseo può fornire supporto alle cellule maligne14, la definizione dei cambiamenti nella nicchia del midollo osseo con progressione della malattia può portare all'identificazione di nuove terapie volte a inibire il rimodellamento della nicchia tumorale. C'è, quindi, una significativa necessità di identificare nuovi regolatori della progressione della malattia. A tal fine, è fondamentale identificare e caratterizzare i cambiamenti nelle popolazioni di cellule stromali del midollo osseo che possono fornire supporto alle cellule maligne.
Sono stati generati diversi modelli murini di LMA e MDS che possono essere utilizzati per studiare i cambiamenti nel microambiente del midollo osseo durante l'inizio e la progressione della malattia 6,1,19,20,21,22. Qui, vengono descritti i protocolli per identificare i cambiamenti nelle popolazioni di cellule stromali del midollo osseo utilizzando modelli murini di LMA 6,20 indotta da retrovirale, nonché il modello Nup98-HoxD13 (NHD13) disponibile in commercio di MDS ad alto rischio in trasformazioneAML 19. I topi trapiantati con cellule di LMA de novo soccombono alla malattia in 20-30 giorni6. I topi NHD13 sviluppano citopenie e displasia del midollo osseo intorno alle 15-20 settimane, che alla fine si trasformano in LMA, e quasi il 75% dei topi soccombe alla malattia intorno alle 32 settimane. Per analizzare le popolazioni del microambiente del midollo osseo modello murino, le ossa vengono prelevate, il midollo osseo e le spicole ossee vengono digeriti utilizzando la digestione enzimatica e le cellule vengono quindi arricchite per le popolazioni non ematopoietiche CD45-/Ter119- mediante ordinamento magnetico. Sebbene analisi simili siano state descritte in precedenza 11,13,22,23,24,25, spesso si concentrano sul midollo osseo o sull'osso e non incorporano cellule provenienti da entrambe le fonti nelle loro analisi. La caratterizzazione combinata di queste popolazioni, in combinazione con le analisi dell'espressione genica, può fornire una comprensione completa di come il microambiente ematopoietico cellulare fornisca supporto per l'inizio e la progressione della malattia (Figura 1). Mentre il protocollo descritto di seguito si concentra sul modello di LMA indotto retroviralmente e su un modello genetico di MDS, queste strategie possono essere facilmente adattate per studiare i cambiamenti nella nicchia del midollo osseo di qualsiasi modello murino di interesse.
Protocollo
Tutti gli esperimenti sugli animali sono stati condotti in conformità con i protocolli approvati dal Comitato per le risorse animali dell'Università di Rochester. I topi sono stati allevati e mantenuti nelle strutture per la cura degli animali dell'Università di Rochester. Per modellare le MDS ad alto rischio, viene utilizzato il modello murino NHD1319 disponibile in commercio. In questo modello, le cellule stromali del midollo osseo vengono analizzate in topi femmina NHD13 a 8 settimane di età, prima dell'insorgenza della malattia. De novo L'AML viene generato come descritto in precedenza 6,11,20. Gli oncogeni utilizzati per indurre la LMA, come MLL-AF9 e NRas, sono marcati con GFP o YFP, consentendo l'analisi delle popolazioni di midollo osseo GFP non leucemiche utilizzando la citometria a flusso. In breve, topi femmina C57BL/6J di 10 settimane vengono trapiantati con cellule AML murine GFP/YFP+ e il midollo osseo viene raccolto 2 settimane dopo il trapianto. Mentre i topi femmina sono utilizzati in questo studio a scopo dimostrativo, questo protocollo può essere condotto con topi maschi o femmine. Può anche essere eseguita utilizzando un femore o tutte le ossa lunghe.
1. Prelievo del midollo osseo
NOTA: Per i dettagli sul protocollo di dissezione degli animali, fare riferimento a Amend et al.26.
- Pulire il mortaio e il pestello con etanolo al 70%, sciacquarli con tampone FACS refrigerato (Tabella 1) e metterli sul ghiaccio a raffreddare prima di iniziare la raccolta. Inoltre, posizionare il tampone MACs (Tabella 1) sul banco per consentirgli di raggiungere la temperatura ambiente.
- Sopprimere l'animale seguendo le linee guida e i protocolli istituzionali per la cura e l'uso degli animali.
- Sul piano di lavoro, spruzzare accuratamente il topo con etanolo al 70% fino a quando il pelo non è bagnato. Usando una pinza e delle forbici ricurve, sollevare la pelle sull'addome e praticare due incisioni di circa 0,5 mm di lunghezza su entrambi i lati del topo, lateralmente dall'addome. Successivamente, praticare un'incisione di 0,5 mm distale dall'addome. Tirare verso il basso per rimuovere la pelle e il pelo dalle zampe del topo.
- Posizionare le forbici perpendicolarmente al bacino, premere verso il basso mentre si tira verso l'alto il femore con una pinza. La testa del femore dovrebbe staccarsi dal bacino. Separare il femore e la tibia all'articolazione femoro-rotulea. Posizionare le ossa nel tampone FACS in una piastra a 6 pozzetti su ghiaccio.
- Rimuovere il tessuto dalle ossa utilizzando tessuto di laboratorio e posizionare le ossa pulite in una nuova piastra a 6 pozzetti con tampone FACS fresco su ghiaccio.
- Mettere tutte le ossa nel mortaio con 2-5 ml di tampone FACS in modo che tutte le ossa siano immerse nel tampone (regolare il volume del tampone in base al numero di ossa che si stanno lavorando). Schiacciare e macinare le ossa usando il pestello con un movimento circolare fino a quando il tessuto del midollo osseo non viene rilasciato.
- Utilizzando una siringa da 3 ml, omogeneizzare il midollo osseo tirando verso l'alto e sciacquando il liquido dal mortaio.
- Utilizzando una siringa da 3 ml, estrarre il liquido dalla malta e filtrarlo attraverso un colino cellulare da 70 μm in una provetta da 50 mL su ghiaccio. Sciacquare i pezzi di osso/tessuto dal filtro nel mortaio con tampone FACS e tornare al passaggio 1.7 per omogeneizzare e filtrare una seconda volta. Questa costituisce la frazione del midollo osseo.
- Sciacquare i restanti pezzi di osso (spicole) nella malta con tampone FACS e sciacquarli in una provetta da 15 mL utilizzando un tampone FACS per garantire la massima resa cellulare. Questa è la frazione delle spicole ossee.
2. Digestione del midollo osseo
- Centrifugare il midollo osseo a 300 x g per 5 minuti a 4 °C. Decantare e scartare il surnatante.
- Risospendere il midollo osseo in 2 mL della miscela per la digestione del midollo osseo (Tabella 1) e trasferirlo in una provetta da 15 mL. Incubare a 37 °C per 45 minuti su un rotatore.
- Aggiungere 10 mL di tampone FACS per arrestare la digestione enzimatica. Filtrare la miscela attraverso un colino cellulare da 70 μm in una nuova provetta da 50 ml.
- Pellet la miscela a 400 x g per 7 minuti a 4 °C.
- Risospendere il pellet di midollo osseo in 1 mL di tampone di lisi per globuli rossi (vedere Tabella dei materiali). Incubare per 4 minuti con ghiaccio.
- Aggiungere 10 mL di tampone FACS per arrestare la lisi. Filtrare la miscela attraverso un colino cellulare da 70 μm in una nuova provetta da 50 ml.
- Pellet la miscela a 300 x g per 5 min a 4 °C. Rimuovere il surnatante e risospendere il pellet in 100 μL di tampone FACS.
3. Digestione delle spicole ossee
- Vorticare le spicole ossee dal passaggio 1.9 e lasciarle depositare. Decantare il surnatante e trattenere l'osso sul fondo.
- Risospendere le spicole ossee in 1 mL della miscela per la digestione delle spicole ossee (Tabella 1).
- Posizionare i tubi su un rotatore di tubi per 60 minuti a 37 °C.
- Aggiungere 10 mL di tampone FACS per arrestare la digestione enzimatica. Filtrare la miscela attraverso un colino cellulare da 70 μm nella provetta da 50 mL contenente il midollo osseo lisizzato e digerito dai globuli rossi.
4. Colorazione
- Mescolare delicatamente le spicole ossee e la sospensione delle cellule del midollo osseo.
- Utilizzare 10 μL della sospensione cellulare per contare il numero di cellule vive su un emocitometro utilizzando la colorazione a base di blu di tripano allo 0,4%, come descritto nei protocolli pubblicati27. Raccogli 50.000 cellule per un controllo non colorato dalla sospensione cellulare.
- Centrifugare le restanti cellule a 300 x g per 5 minuti a 4 °C. Rimuovere il surnatante e risospenderlo in 100 μL di tampone FACS.
NOTA: Gli anticorpi possono essere titolati per determinare la diluizione ideale. La selezione degli anticorpi (epitopi e fluorocromi) può essere personalizzata. - Per la colorazione con anticorpi per la deplezione magnetica, aggiungere FC Block (1 μL per 25 x 106 cellule), CD45-APC (10 μL per 25 x 106 cellule) e Ter119-APC (4 μL per 25 x 106 cellule) (vedi Tabella dei materiali).
- Incubare su ghiaccio per 20 min. Lavare con tampone FACS, rimuovere 50.000 cellule (~50 μL) per il controllo colorato con APC, centrifugare a 300 x g per 5 minuti a 4 °C e risospendere in 100 μL di tampone FACS.
- Per la colorazione della sospensione cellulare con microsfere per la deplezione magnetica, aggiungere mIgG (8 μL per 25 x 106 cellule) e microsfere Anti-APC (20 μL per 25 x 106 cellule) (vedere Tabella dei materiali).
- Incubare su ghiaccio per 20 min. Lavare con tampone FACS da 10 mL, centrifugare a 300 x g per 5 minuti a 4 °C.
5. Esaurimento del campione mediante cernita magnetica
NOTA: Questa fase viene eseguita utilizzando un separatore magnetico manuale disponibile in commercio secondo le istruzioni del produttore. Questo passaggio può essere eseguito anche con un separatore automatizzato (vedi Tabella dei materiali).
- Preparare la colonna LD lavandola con 2 mL di tampone MACs (Tabella 1). Scartare l'effluente e sostituire la provetta di raccolta.
- Risospendere fino a 1 x 108 cellule nel tampone MAC e filtrarle attraverso una provetta da 5 mL con un tappo di filtro da 35 μm.
- Posizionare la colonna LD sul supporto del separatore magnetico. Posizionare una provetta da 5 mL sotto la colonna per raccogliere l'eluato.
- Aggiungere la sospensione cellulare alla colonna LD preparata. Lasciare che la frazione negativa fluisca nella provetta di raccolta. Lavare la colonna due volte con 1 mL di tampone MACs, raccogliendo l'eluato nella stessa provetta. Questa è la frazione negativa utilizzata nel passaggio 5.6 di seguito.
- Rimuovere la colonna LD dal supporto del separatore magnetico e posizionarla su una nuova provetta da 5 mL. Utilizzare una pipetta per erogare 3 mL di tampone nella colonna per eliminare le cellule che sono state marcate positivamente, utilizzando lo stantuffo della colonna.
- Centrifugare le frazioni negativa e positiva a 300 x g per 5 minuti a 4 °C. Risospenderli in 100 μL di tampone FACS.
- Contare 10 μL delle frazioni negativa e positiva con lo 0,4% di blu di tripano. I volumi per l'osteoanalisi/colorazione del pannello endoteliale di seguito si baseranno su questa conta cellulare.
- Utilizzare 50.000 cellule vive dalla frazione positiva per i controlli di gating della citometria a flusso.
6. Osteoanalisi/colorazione del pannello endoteliale
NOTA: La compensazione deve essere eseguita seguendo i protocolli standard di citometria a flusso, compresi tutti i controlli appropriati di colorazione e gating.
- Per la colorazione della frazione negativa CD45/Ter119 (1 μL di ciascun anticorpo per 1 x 106 cellule), aggiungere CD31-PE-Cy7, Sca-1-BV421, CD51-PE e CD140a-PE-Cy5 (vedere la tabella dei materiali).
- Incubare su ghiaccio per 20 min. Lavare con 2 mL di tampone FACS, quindi centrifugare a 300 x g per 5 minuti a 4 °C.
- Aggiungere 1 mL di tampone FACS e una diluizione 1:1000 di PI per la colorazione viva/morta, quindi filtrare il campione attraverso una provetta da 5 mL con un tappo di filtro cellulare da 35 μm.
- Analizza le cellule su un citometro a flusso multicolore.
Risultati
Questo articolo descrive un metodo basato sulla citometria a flusso per l'analisi delle popolazioni microambientali del midollo osseo, come le cellule stromali endoteliali e mesenchimali, da modelli murini di MDS e leucemia (Figura 1). La Figura 2 illustra la strategia di gating per l'individuazione delle popolazioni di interesse, a partire dalla selezione delle cellule (P1) nella frazione digerita e depleta di CD45/Ter119 attraverso il profilo di scatter diretto e laterale. Esempi di gating di cellule in un campione di leucemia sono mostrati in P1 (Figura 2A). I singoletti sono selezionati e i doppietti sono esclusi da questa analisi, P2 (Figura 2B). La Figura 2C mostra i gate per selezionare le cellule vive negative allo iodio propidio, P3. Per concentrarsi sulle popolazioni stromali non ematopoietiche, le cellule CD45-/Ter119-, P4 (APC, asse Y) vs. SSC-A (Figura 2D). Questa strategia di gating iniziale è comune a tutti i campioni da analizzare.
Il modello murino di leucemia viene utilizzato per illustrare il gating per le cellule endoteliali nelle Figure 2E-G. La Figura 2E mostra CD31 positivo (Pe-Cy7, asse Y) rispetto a. Cellule SSC-A in un topo non cancerogeno e in un topo leucemico, gated attraverso P4. Le cellule marcate positivamente con CD31 sono cellule endoteliali, P5. Nella Figura 2F, gated through P5, le cellule endoteliali arteriolari sono identificate come CD45-Ter119-CD31+Sca1+, P6 e le cellule endoteliali sinusoidali sono identificate come CD45-Ter119-CD31+Sca1-, P7 (BV421, asse Y) vs. SSC-A.
Sebbene questa analisi si concentri sulle cellule microambientali del midollo osseo non leucemiche, è utile anche per determinare il carico tumorale. Questo può essere fatto con una piccola frazione di campione non digerito/non impoverito prima di iniziare l'esperimento. In questo controllo sperimentale (linee tratteggiate) Figura 2G, P8 rappresenta il carico tumorale nel campione e P9 rappresenta le cellule non cancerose.
Il modello murino MDS viene utilizzato per illustrare l'analisi delle cellule stromali mesenchimali nella Figura 2H-J. La Figura 2H mostra CD31 negativo (Pe-Cy7, asse Y) rispetto a. Cellule SSC-A, gated attraverso P4. Le popolazioni di cellule stromali mesenchimali in un topo di controllo wild-type e in un topo MDS sono mostrate nella Figura 2I. Controllate attraverso P10, le cellule stromali mesenchimali sono identificate come CD45-Ter119-CD31-CD51+CD140a+, P113 (Pe, asse Y; Pe-Cy5, asse X). Il controllo sperimentale (linee tratteggiate), la Figura 2J mostra esempi di controlli di gating monocolore, colorazione singola CD51 e colorazione singola CD140a utilizzata per il gate per le MSC mostrate nei campioni sperimentali nella Figura 2I.
Questi dati indicano che le cellule endoteliali arteriolari si espandono significativamente nel microambiente della LMA, con una concomitante perdita nelle popolazioni endoteliali sinusoidali (Figura 2F), in linea con studi precedenti che utilizzavano xenotrapianti derivati da pazienti in topi immunodeficienti28. È probabile che la piccola espansione nelle cellule stromali mesenchimali osservata nei topi NHD13 a 8 settimane di età (Figura 2I) possa aumentare a 16-20 settimane, quando questi topi iniziano a mostrare le caratteristiche della MDS25. Sebbene solo il modello di leucemia sia utilizzato per illustrare la popolazione di cellule endoteliali e il modello murino MDS sia utilizzato per illustrare le popolazioni di cellule stromali mesenchimali, strategie di colorazione e gating simili possono essere utilizzate per analizzare le diverse popolazioni microambientali in uno di questi modelli, o in effetti, in qualsiasi modello murino geneticamente modificato di interesse.
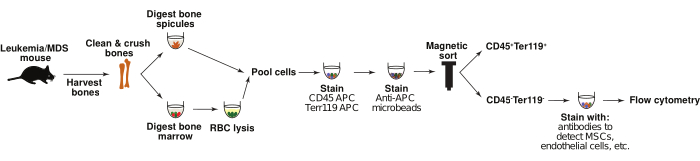
Figura 1: Isolamento delle cellule stromali del midollo osseo. Lo schema mostra il processo di isolamento delle cellule stromali del midollo osseo non ematopoietiche da topi di controllo e leucemici. In breve, le spicole ossee e il midollo osseo vengono digeriti separatamente e poi raggruppati. La popolazione CD45-Ter119- è arricchita mediante smistamento magnetico e colorata con pannelli anticorpali contro popolazioni di interesse, come le cellule stromali mesenchimali e le cellule endoteliali. Le cellule vengono quindi analizzate mediante citometria a flusso. Fare clic qui per visualizzare una versione più grande di questa figura.
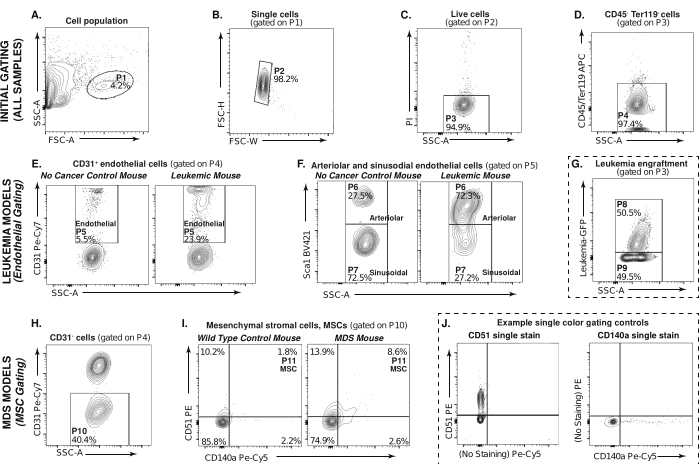
Figura 2: Strategia di gating per midollo osseo non ematopoietico e cellule stromali. (A-D) Strategia di gating della citometria a flusso utilizzata per selezionare popolazioni digerite, CD45-/Ter119-, non ematopoietiche (P4) sia nel modello murino di leucemia che in quello di MDS. (E) Le cellule endoteliali del midollo osseo leucemico (P5, CD31+) possono essere suddivise come (F) cellule endoteliali arteriolari Sca1+ (P6) o Sca1- sinusoidali (P7). (G) Attecchimento della leucemia in un campione di LMA in cui P8 rappresenta l'attecchimento mentre P9 rappresenta le cellule non tumorali. Le linee tratteggiate indicano che questo grafico è un controllo sperimentale. (H) Gated through P4, cellule CD31- del midollo osseo MDS, cellule stromali mesenchimali P10 (I) (CD51+/CD140a+, P11). (J) Esempi di controlli di gating monocolore, CD51 (a sinistra) e CD140a (a destra) utilizzati per determinare le porte per le cellule stromali mesenchimali in (I). Fare clic qui per visualizzare una versione più grande di questa figura.
| Soluzione | Reagente | Concentrazione | Importo da aggiungere |
| Tampone FACS | HBSS | 10 volte | 100 ml |
| EDTA | 0,5 M | 4 mL | |
| Siero fetale bovino | - | 50 ml | |
| Acqua | - | 848 ml | |
| Miscela per la digestione del midollo osseo | HBSS | 1x | 2 mL |
| DNasi 1 | 1 μg/mL in 1x DPBS | 20 μL | |
| Dispasi II Polvere | - | 4 magnesio | |
| Collagenasi di tipo IV | - | magnesio 2 | |
| Miscela per la digestione delle spicole ossee | DPBS (DPBS) | 1x | 320 ml |
| Collagenasi di tipo 1 | - | 1 g | |
| Siero fetale bovino | - | 80 ml | |
| Buffer MAC | BSA | 66 g/mol | 5 grammi |
| DPBS (DPBS) | 10 volte | 100 ml | |
| EDTA | 0,5 M | 4 mL | |
| Acqua | - | 896 L |
Tabella 1: Composizione delle soluzioni e dei tamponi utilizzati nel presente studio.
Discussione
I modelli di leucemia murina sono stati ampiamente utilizzati per identificare i segnali cellulari intrinseci e di nicchia che promuovono la progressione della leucemia mieloide aggressiva 6,19,21. Qui, viene presentato un protocollo completo basato sulla citometria a flusso per definire la composizione cellulare del microambiente del midollo osseo in modelli murini di MDS e AML.
Prima di acquisire i dati citofluorimetrici dai campioni sperimentali, è importante compensare attentamente la sovrapposizione della fluorescenza. È inoltre essenziale includere tutti i controlli appropriati per la colorazione e il gating. Questi passaggi consentiranno allo sperimentatore di confermare che la colorazione anticorpale positiva o negativa rappresenta un'espressione accurata dei marcatori cellulari di interesse e non è un artefatto di fluorescenza, sovrapposizione spettrale o autofluorescenza. Sebbene questo protocollo descriva marcatori di superficie cellulare selezionati, i pannelli anticorpali possono essere ampliati in base alle esigenze sperimentali. Ad esempio, CD144 (Ve-Caderina) può essere somministrato in vivo prima del prelievo dei topi e può fungere da ulteriore marcatore specifico delle cellule endoteliali 5,29. Sebbene i fluorofori e i cloni di anticorpi qui indicati possano essere modificati, è necessario effettuare titolazioni per determinarne la diluizione ideale. Per definire categoricamente tutte le popolazioni cellulari nella nicchia del midollo osseo, il sequenziamento dell'RNA a singola cellula può essere utilizzato per stabilire il panorama della nicchia del midollo osseo durante l'inizio e la progressione della MDS/AML 23,24,30.
È fondamentale preparare il campione con cura secondo i passaggi descritti in questo protocollo. Quando si omogeneizzano le ossa, è fondamentale che il mortaio e il pestello siano raffreddati e che tutti i passaggi vengano eseguiti su ghiaccio per prevenire la morte cellulare e garantire un elevato recupero cellulare. È molto importante rimuovere tutto il tessuto che circonda le ossa prima dell'omogeneizzazione per prevenire la contaminazione di altri tipi di cellule indesiderate. Durante la lisi e la digestione dei globuli rossi, è importante arrestare la reazione enzimatica con una quantità appropriata di tampone FACS e risospendere completamente in tampone fresco, altrimenti le cellule continueranno a digerire e alla fine moriranno.
La separazione delle frazioni ossee e del midollo osseo è essenziale poiché le spicole ossee richiedono un diverso mix di enzimi per il tampone di digestione e richiedono più tempo per digerire. Nella digestione ossea, la collagenasi di tipo 1 è utile per digerire le fibrille di collagenasi che si trovano comunemente nella matrice extracellulare e nelle fibre di collagene31. Inoltre, alcune cellule del midollo osseo situate vicino all'endostio rimarranno attaccate all'osso dopo l'omogeneizzazione e vengono rilasciate solo dalla digestione enzimatica. Quando si digerisce il midollo osseo, la collagenasi di tipo IV viene utilizzata per digerire la membrana basale delle cellule epiteliali ed endoteliali all'interno del midollo osseo32, mentre la dispasi scinde principalmente la fibronectina31. Il midollo osseo richiede meno tempo per essere digerito poiché le associazioni tra cellule e matrice sono più deboli. L'incubazione della frazione del midollo osseo in condizioni simili può danneggiare le popolazioni di interesse. L'utilizzo di due diversi tamponi di digestione aumenta significativamente il numero di popolazioni stomiche che possono essere rilevate e quindi fornisce un set di dati più ampio da analizzare.
La maggior parte dei protocolli disponibili per analizzare le popolazioni microambientali del midollo osseo murino utilizzano una siringa per lavare il midollo osseo solo dalle ossa lunghe13,24. L'attuale metodo di frantumazione delle ossa offre la possibilità di acquisire dati da altre ossa come il bacino, riduce significativamente i tempi di preparazione del campione e mitiga la possibilità di lesioni con aghi affilati. Dato che l'osso è costituito da osteoblasti maturi e altre popolazioni cellulari in grado di fornire supporto alle cellule ematopoietiche normali e maligne, questo metodo di inclusione delle cellule delle spicole ossee consente una rappresentazione più accurata del microambiente del midollo osseo nel campione. Mentre uno studio precedente ha digerito separatamente il midollo osseo e le spicole ossee11, non ha dimostrato la colorazione dell'osteolignaggio e delle cellule endoteliali nello stesso campione. Un secondo studio ha utilizzato miscele enzimatiche proprietarie disponibili in commercio per digerire il midollo osseo e le spicole ossee23 e ha analizzato i dati utilizzando la tecnologia di sequenziamento dell'RNA a singola cellula, significativamente più costosa. Questo metodo di arricchimento per le cellule CD45-/Ter119- seleziona le cellule di interesse e riduce significativamente il tempo necessario per acquisire i dati sul citometro a flusso. Pertanto, rispetto ad altri metodi all'avanguardia come il sequenziamento dell'RNA a singola cellula, questo metodo basato sulla citometria a flusso è più accessibile, economico e non richiede analisi sofisticate da parte di bioinformatici qualificati 23,24,30.
È importante notare che questo protocollo può essere utilizzato per caratterizzare il microambiente del midollo osseo non solo di uno qualsiasi dei modelli murini disponibili di MDS e LMA, ma anche di qualsiasi modello murino genetico. Metodi simili possono anche essere efficaci nell'analisi dei cambiamenti nella nicchia del midollo osseo murino dei modelli di xenotrapianto derivato da pazienti (PDX). Questi metodi possono essere utili per studi volti a determinare i meccanismi attraverso i quali le MDS/LMA influenzano la loro nicchia del midollo osseo. Date le sfide tecniche associate al campionamento di grandi quantità di midollo osseo da pazienti umani, queste analisi di modelli murini sono uno strumento efficace per approfondire la comprensione del microambiente midollo osseo maligno e definire il suo ruolo nella progressione della malattia.
Divulgazioni
Non sono stati dichiarati conflitti di interesse.
Riconoscimenti
Ringraziamo il Flow Cytometry Core di URMC. Questo lavoro è stato sostenuto dall'American Society of Hematology Scholar Award, dal premio della Leukemia Research Foundation e dalle sovvenzioni NIH R01DK133131 e R01CA266617 assegnato a J.B.
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL pipette Tips | Genesee Scientific | 24-165RL | |
| 1.7 mL Microcentrifuge Tubes | AVANT | L211511-CS | |
| 10 µL pipette Tips | Genesee Scientific | 24-140RL | |
| 10 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1760 | |
| 1000 mL Vacuum Filtration Flask | NEST | 344021 | |
| 15 mL Centrifuge Tube | VWR | 10026-076 | |
| 2 mL Aspirating Pipette | NEST | 325011 | |
| 200 µL pipette Tips | Genesee Scientific | 24-150-RL | |
| 25 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1780 | |
| 5 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1740 | |
| 5 mL Polystyrene Round-Bottom Tube 12 x 75 mm style | Falcon | 352054 | |
| 5 mL Polystyrene Round-Bottom Tube with Cell Strainer Cap 12 x 75 mm style | Falcon | 352235 | |
| 50 mL Centrifuge Tube | NEST | 602052 | |
| 6 Well, Flat Bottom with Low Evaporation Lid | Falcon | 353046 | |
| Absorbent Underpads with Waterproof Moisture Barrier | VWR | 56616-031 | |
| APC MicroBeads | Miltenyi | 130-090-855 | |
| autoMACS Pro Separator | Miltenyi Biotec GmBH | 4425745 | |
| BD Pharmingen Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | 0.5 mg/mL |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | 66.000 g/mol |
| Brilliant Violet 421 anti-mouse Ly-6A/E (Sca-1) Antibody (D7) | Invitrogen | 404-5981 | 0.2 mg/mL |
| C57BL/6J Mice | Jackson Laboratory | 664 | |
| Carbon Dioxide Gas Tank | Airgas | CD50 | |
| CD31 (PECAM-1) Monoclonal Antibody (390), PE-Cyanine7 | Invitrogen | 25-0311-82 | 0.2 mg/mL |
| CD45 Monoclonal Antibody (30-F11), APC | Invitrogen | 17-0451-82 | 0.2 mg/mL |
| Cell Strainer 70 µm Nylon | Falcon | 352350 | |
| Cole-Parmer Essentials Mortar and Pestle; Agate, 125 mL | Cole-Parmer | EW-63100-62 | |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C5138-500MG | |
| Collagenase Type I | STEMCELL | 7415 | |
| Corning Mini Centrifuge | CORNING | 6770 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 4099 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D4513 | |
| Dispase II, powder | Gibco | 117105041 | |
| DPBS 10x | gibco | 14200-075 | |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 00-4333-57 | |
| Ethanol absolute, KOPTEC, meets analytical specification of BP, Ph. Eur., USP (200 Proof) | VWR | 89125-174 | |
| Fine scissors - sharp | Fine Science Tools | 14061-10 | |
| Foundation B Fetal Bovine Serum | GeminiBio | 900-208 | |
| Gilson PIPETMAN L Pipette Starter Kits | FisherScientific | F167370G | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Hank's Balanced Salt Solution (HBSS) 10x | gibco | 14185-052 | |
| Hemocytometer | Fisher | 02-671-10 | |
| Incubator | BINDER | C150-UL | |
| Kimwipes | KIMTECH | K222101 | |
| LABGARD Class II, Type A2 Biological Safety Cabinet | Nuaire | NU-425-400 | |
| LD Columns | Miltenyi Biotec GmBH | 130-042-901 | |
| LSE Vortex Mixer | CORNING | 6775 | |
| LSRII/Fortessa/Symphony A1 | Becton, Dickinson and Company | 647800L6 | |
| MACS MULTI STAND | Miltenyi Biotec GmBH | 130-042-303 | |
| MACsmix Tube Rotator | Miltenyi Biotec GmBH | 130-090-753 | |
| mIgG | Millipore-Sigma | 18765-10mg | 2 mg/mL |
| Nup98-HoxD13 (NHD13) Mice | Jackson Laboratory | 010505 | |
| PE anti-mouse CD51 Antibody (RMV-7) | Biolegend | 104106 | 0.2 mg/mL |
| PE/Cyanine5 anti-mouse CD140a Antibody (RUO) | Biolegend | 135920 | 0.2 mg/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 10,000 U/mL |
| Plastipak 3 mL Syringe | Becton, Dickinson and Company | 309657 | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| QuadroMACS Separator | Miltenyi Biotec GmBH | 130-090-976 | |
| Sorvall X Pro / ST Plus Series Centrifuge | Thermo Scientific | 75009521 | |
| TER-119 Monoclonal Antibody (TER-119), APC | Invitrogen | 17-5921-82 | 0.2 mg/mL |
| Trypan Blue Solution 0.4% | Gibco | 15-250-061 | |
| Ultrapure 0.5 M EDTA, pH 8.0 | Invitrogen | 15575-038 |
Riferimenti
- Morrison, S. J., Scadden, D. T. The bone marrow niche for haematopoietic stem cells. Nature. 505 (7483), 327-334 (2014).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Pinho, S., Frenette, P. S. Haematopoietic stem cell activity and interactions with the niche. Nat Rev Mol Cell Biol. 20 (5), 303-320 (2019).
- Kfoury, Y., Scadden, D. T. Mesenchymal cell contributions to the stem cell niche. Cell Stem Cell. 16 (3), 239-253 (2015).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Bajaj, J., et al. Cd98-mediated adhesive signaling enables the establishment and propagation of acute myelogenous leukemia. Cancer Cell. 30 (5), 792-805 (2016).
- Konopleva, M. Y., Jordan, C. T. Leukemia stem cells and microenvironment: Biology and therapeutic targeting. J Clin Oncol. 29 (5), 591-599 (2011).
- Kim, Y. W., et al. Defective notch activation in microenvironment leads to myeloproliferative disease. Blood. 112 (12), 4628-4638 (2008).
- Walkley, C. R., et al. A microenvironment-induced myeloproliferative syndrome caused by retinoic acid receptor gamma deficiency. Cell. 129 (6), 1097-1110 (2007).
- Kode, A., et al. Leukaemogenesis induced by an activating β-catenin mutation in osteoblasts. Nature. 506 (7487), 240-244 (2014).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Raaijmakers, M. H., et al. Bone progenitor dysfunction induces myelodysplasia and secondary leukaemia. Nature. 464 (7290), 852-857 (2010).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Bajaj, J., Diaz, E., Reya, T. Stem cells in cancer initiation and progression. J Cell Biol. 219 (1), e201911053(2020).
- Sekeres, M. A., Taylor, J. Diagnosis and treatment of myelodysplastic syndromes: A review. Jama. 328 (9), 872-880 (2022).
- Zeisig, B. B., Kulasekararaj, A. G., Mufti, G. J., So, C. W. Snapshot: Acute myeloid leukemia. Cancer Cell. 22 (5), 698-698.e1 (2012).
- Krivtsov, A. V., Armstrong, S. A. Mll translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer. 7 (11), 823-833 (2007).
- Yoshimi, A., et al. Coordinated alterations in rna splicing and epigenetic regulation drive leukaemogenesis. Nature. 574 (7777), 273-277 (2019).
- Lin, Y. W., Slape, C., Zhang, Z., Aplan, P. D. Nup98-hoxd13 transgenic mice develop a highly penetrant, severe myelodysplastic syndrome that progresses to acute leukemia. Blood. 106 (1), 287-295 (2005).
- Kwon, H. Y., et al. Tetraspanin 3 is required for the development and propagation of acute myelogenous leukemia. Cell Stem Cell. 17 (2), 152-164 (2015).
- Bajaj, J., et al. An in vivo genome-wide crispr screen identifies the rna-binding protein staufen2 as a key regulator of myeloid leukemia. Nat Cancer. 1 (4), 410-422 (2020).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by mll-af9. Nature. 442 (7104), 818-822 (2006).
- Baryawno, N., et al. A cellular taxonomy of the bone marrow stroma in homeostasis and leukemia. Cell. 177 (7), 1915-1932.e16 (2019).
- Tikhonova, A. N., et al. The bone marrow microenvironment at single-cell resolution. Nature. 569 (7755), 222-228 (2019).
- Balderman, S. R., et al. Targeting of the bone marrow microenvironment improves outcome in a murine model of myelodysplastic syndrome. Blood. 127 (5), 616-625 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. JoVE. 110, e53936(2016).
- JoVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. , JoVE. (2023).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to acute myeloid leukemia progression and drug response. Blood. 128 (22), 2662(2016).
- Xu, C., et al. Stem cell factor is selectively secreted by arterial endothelial cells in bone marrow. Nat Commun. 9 (1), 2449(2018).
- Baccin, C., et al. Combined single-cell and spatial transcriptomics reveal the molecular, cellular and spatial bone marrow niche organization. Nat Cell Biol. 22 (1), 38-48 (2020).
- Ebrahimi Dastgurdi, M., Ejeian, F., Nematollahi, M., Motaghi, A., Nasr-Esfahani, M. H. Comparison of two digestion strategies on characteristics and differentiation potential of human dental pulp stem cells. Arch Oral Biol. 93, 74-79 (2018).
- Abreu-Velez, A. M., Howard, M. S. Collagen IV in normal skin and in pathological processes. N Am J Med Sci. 4 (1), 1-8 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon