Method Article
识别骨髓增生异常综合征和急性髓系白血病中的骨髓微环境群体
摘要
本文介绍了从骨髓增生异常综合征和急性髓系白血病的小鼠模型中分离和表征骨髓微环境群体的详细方案。该技术可识别非造血骨髓生态位(包括内皮细胞和间充质基质细胞)随疾病进展的变化。
摘要
骨髓微环境由不同的细胞群组成,例如间充质基质细胞、内皮细胞、骨系细胞和成纤维细胞,它们为造血干细胞 (HSC) 提供支持。除了支持正常的造血干细胞外,骨髓微环境还在造血干细胞疾病的发展中发挥作用,例如骨髓增生异常综合征 (MDS) 和急性髓系白血病 (AML)。造血干细胞中 MDS 相关突变导致分化受阻和进行性骨髓衰竭,尤其是在老年人中。MDS通常可进展为难治性AML,这是一种以未成熟髓母细胞快速积累为特征的疾病。已知这些骨髓肿瘤患者的骨髓微环境会发生变化。在这里,描述了从骨髓增生异常综合征和急性髓系白血病的小鼠模型中分离和表征骨髓微环境细胞的综合方案。分离和表征骨髓生态位群体的变化有助于确定它们在疾病发生和进展中的作用,并可能导致开发针对骨髓基质群体中促癌改变的新疗法。
引言
骨髓微环境由造血细胞、非造血基质细胞和细胞外基质组成 1,2。这种微环境可以促进造血干细胞自我更新,调节谱系分化,并为骨组织提供结构和机械支持1,2,3,4,5。基质生态位包括骨系细胞、成纤维细胞、神经细胞和内皮细胞6,而造血生态位由淋巴和髓系群体组成 1,2,3。除了支持正常的造血干细胞外,骨髓微环境还可以在造血干细胞疾病的发展中发挥作用,例如MDS和AML 7,8,9,10,11。骨系细胞的突变已被证明可促进 MDS、AML 和其他骨髓增生性肿瘤的发展 10,12,13,14。
骨髓增生异常综合征是一组由造血干细胞突变引起的白血病前期疾病。MDS 通常与 HSC 分化受阻和发育不良细胞的产生有关,这通常会导致骨髓衰竭。MDS是美国最常诊断的髓系肿瘤,3年生存率为35%-45%15。MDS通常与转化为急性髓系白血病的高风险有关。这可能是一种致命的并发症,因为MDS衍生的AML对大多数疗法都有抵抗力,并且可能复发。由于造血干细胞和祖细胞的易位或突变而新发的 AML 也通常对标准化疗产生耐药性 16,17。由于MDS和AML主要是老年人的疾病,大多数患者在60岁以上被诊断出来,因此大多数患者不符合根治性骨髓移植的条件。因此,迫切需要确定疾病进展的新调节因子。由于骨髓微环境可以为恶性细胞提供支持14,因此定义随着疾病进展的骨髓生态位的变化可能导致识别旨在抑制肿瘤生态位重塑的新疗法。因此,非常需要确定疾病进展的新调节因子。为此,识别和表征可能为恶性细胞提供支持的骨髓基质细胞群的变化至关重要。
已经生成了几种AML和MDS的小鼠模型,可用于研究疾病开始和进展期间骨髓微环境的变化6,1,19,20,21,22。在这里,描述了使用逆转录病毒诱导的 AML 6,20 的小鼠模型以及市售的高危 MDS 到AML 转化 19 的 Nup98-HoxD13 (NHD13) 模型来识别骨髓基质细胞群变化的方案。用从头移植 AML 细胞的小鼠在 20-30 天内死于该疾病6.NHD13小鼠在15-20周左右出现血细胞减少和骨髓发育不良,最终转化为AML,近75%的小鼠在32周左右死于这种疾病。为了分析小鼠模型骨髓微环境群体,收获骨骼,使用酶消化消化骨髓和骨针状体,然后通过磁性分选富集细胞以用于CD45-/Ter119-非造血群体。虽然之前已经描述了类似的分析11,13,22,23,24,25,但它们通常集中在骨髓或骨骼上,并且在分析中没有包括来自这两种来源的细胞。这些群体的综合表征与基因表达分析相结合,可以全面了解细胞造血微环境如何为疾病的发生和进展提供支持(图1)。虽然下面描述的方案侧重于逆转录病毒诱导的 AML 模型和遗传 MDS 模型,但这些策略可以很容易地用于研究任何感兴趣的小鼠模型的骨髓生态位的变化。
研究方案
所有动物实验均按照罗切斯特大学动物资源委员会批准的方案进行。小鼠在罗切斯特大学的动物护理设施中饲养和饲养。为了模拟高危 MDS,采用了市售的 NHD13 小鼠模型19。在该模型中,在疾病发作前 8 周龄的雌性 NHD13 小鼠中分析骨髓基质细胞。De novoAML的生成如前所述6,11,20。用于诱导 AML 的癌基因,例如 MLL-AF9 和 NRas,用 GFP 或 YFP 标记,允许使用流式细胞术分析非白血病 GFP-骨髓群体。简而言之,将10周龄的雌性C57BL / 6J小鼠移植小鼠GFP / YFP + AML细胞,并在移植后2周收获骨髓。虽然本研究中使用雌性小鼠进行演示,但该协议可以在雄性或雌性小鼠中进行。它也可以使用一根股骨或所有长骨进行。
1. 骨髓采集
注意:有关动物解剖方案的详细信息,请参阅Amend等人26。
- 用70%乙醇清洁研钵和研杵,用冷却的FACS缓冲液冲洗(表1),并在开始收获之前将它们放在冰上冷却。此外,将MAC缓冲液(表1)放在工作台上,使其达到室温。
- 按照机构动物护理和使用指南和协议对动物实施安乐死。
- 在工作台上,用 70% 乙醇彻底喷洒鼠标,直到其皮毛变湿。使用镊子和弯曲的剪刀,提起腹部的皮肤,并在小鼠的两侧,从腹部外侧做两个约0.5毫米长的切口。接下来,在腹部远端做一个 0.5 毫米的切口。向下拉以去除鼠标腿上的皮肤和皮毛。
- 将剪刀垂直于骨盆放置,向下按压,同时用镊子向上拉股骨。股骨头应与骨盆分离。在髌股关节处分离股骨和胫骨。将骨头放入FACS缓冲液中,放在冰上的6孔板中。
- 使用实验室级组织从骨骼中取出组织,并将清洁后的骨骼放入新的 6 孔板中,并在冰上加入新鲜的 FACS 缓冲液。
- 将所有骨头放入装有 2-5 mL FACS 缓冲液的研钵中,使所有骨头浸入缓冲液中(根据您正在处理的骨头数量调整缓冲液的体积)。用研杵打圈压碎和研磨骨头,直到骨髓组织被释放。
- 使用 3 mL 注射器,通过从研钵中拉起并冲洗液体来均质化骨髓。
- 使用 3 mL 注射器,从研钵中抽出液体,并通过 70 μm 细胞过滤器将其过滤到冰上的 50 mL 管中。用FACS缓冲液将过滤器中的骨/组织块冲洗回研钵中,然后返回步骤1.7进行均质化和第二次过滤。这构成了骨髓部分。
- 用FACS缓冲液将剩余的骨块(针状体)冲洗回研钵中,并使用FACS缓冲液将其冲洗到15mL管中,以确保最大细胞产量。这是骨针状部分。
2.骨髓的消化
- 在4°C下以300× g 离心骨髓5分钟。 倾倒并弃去上清液。
- 将骨髓重悬于2mL骨髓消化混合物(表1)中,并将其转移到15mL管中。在旋转器上在37°C孵育45分钟。
- 加入 10 mL FACS 缓冲液以停止酶消化。通过 70 μm 细胞过滤器将混合物过滤到新的 50 mL 管中。
- 将混合物在4°C下以400× g 沉淀7分钟。
- 将骨髓沉淀重悬于1mL红细胞裂解缓冲液中(参见 材料表)。在冰上孵育 4 分钟。
- 加入 10 mL FACS 缓冲液以停止裂解。通过 70 μm 细胞过滤器将混合物过滤到新的 50 mL 管中。
- 将混合物在4°C下以300× g 沉淀5分钟。 除去上清液并将沉淀重悬于100μL FACS缓冲液中。
3.骨针的消化
- 涡旋步骤1.9中的骨针状物,让它们沉降。倒出上清液,将骨头保留在底部。
- 将骨针重悬于1mL骨针状消化混合物中(表1)。
- 将管子放在管旋转器上,在37°C下60分钟。
- 加入 10 mL FACS 缓冲液以停止酶消化。通过 70 μm 细胞过滤器将混合物过滤到含有红细胞裂解和消化骨髓的 50 mL 管中。
4. 染色
- 轻轻混合骨针和骨髓细胞悬浮液。
- 使用10μL细胞悬液,使用0.4%台盼蓝染色在血细胞计数器上计数活细胞数,如已发表的方案27中所述。从细胞悬液中收集 50,000 个细胞以获得未染色的对照。
- 将剩余细胞在4°C下以300× g 离心5分钟。 除去上清液并将其重悬于100μL FACS缓冲液中。
注意:可以滴定抗体以确定理想的稀释度。抗体选择(表位和荧光染料)可以定制。 - 对于磁耗耗抗体染色,加入 FC Block(每 25 x 106 个细胞 1 μL)、CD45-APC(每 25 x 106 个细胞 10 μL)和 Ter119-APC(每 25 x 106 个细胞 4 μL)(参见 材料表)。
- 在冰上孵育20分钟。用FACS缓冲液洗涤,除去50,000个细胞(~50μL)用于APC染色的对照,在4°C下以300× g 离心5分钟,并重悬于100μLFACS缓冲液中。
- 为了用微珠染色细胞悬液以进行磁耗,加入mIgG(每25 x 106 个细胞8μL)和抗APC微珠(每25 x 106 个细胞20μL)(参见 材料表)。
- 在冰上孵育20分钟。用10mL FACS缓冲液洗涤,在4°C下以300× g 离心5分钟。
5. 通过磁性分选去除样品
注意: 此步骤是根据制造商的说明使用市售的手动磁选机执行的。此步骤也可以使用自动分离器执行(参见 材料表)。
- 用 2 mL MACs 缓冲液洗涤 LD 色谱柱(表 1)。丢弃污水并更换收集管。
- 将多达 1 x 108 个细胞重悬于 MAC 缓冲液中,并通过带有 35 μm 细胞过滤器盖的 5 mL 试管过滤它们。
- 将LD柱放在磁选机支架上。将 5 mL 试管放置在色谱柱下方以收集洗脱液。
- 将细胞悬液加入制备的LD色谱柱中。让负性馏分流入收集管。用 1 mL MACs 缓冲液洗涤色谱柱两次,将洗脱液收集在同一管中。这是下面步骤 5.6 中使用的负分数。
- 从磁选机支架上取下LD柱,并将其放在新的5 mL试管上。使用移液管将 3 mL 缓冲液分配到色谱柱中,以冲洗出已阳性标记的细胞,使用柱柱塞。
- 在4°C下以300× g 离心负极和正极部分5分钟。 将它们重悬于100μL FACS缓冲液中。
- 用 0.4% 台盼蓝计数 10 μL 的负极和阳性馏分。以下骨分析/内皮组染色的体积将基于该细胞计数。
- 使用阳性组分的 50,000 个活细胞进行流式细胞术门控。
6. 骨分析/内皮面板染色
注意:应按照标准流式细胞术方案进行补偿,包括所有适当的染色和门控。
- 对于CD45/Ter119阴性组分(每1×106 个细胞每种抗体1μL)的染色,加入CD31-PE-Cy7,Sca-1-BV421,CD51-PE和CD140a-PE-Cy5(参见 材料表)。
- 在冰上孵育20分钟。用2mL FACS缓冲液洗涤,然后在4°C下以300× g 离心5分钟。
- 加入 1 mL FACS 缓冲液和 1:1000 稀释的 PI 进行活/死染色,然后通过带有 35 μm 细胞过滤器盖的 5 mL 试管过滤样品。
- 在多色流式细胞仪上分析细胞。
结果
本文介绍了一种基于流式细胞术的方法,用于分析来自MDS和白血病小鼠模型的骨髓微环境群体,例如内皮细胞和间充质基质细胞(图1)。 图 2 描述了用于检测目标群体的门控策略,从通过前向和侧面散射曲线选择消化和 CD45/Ter119 耗尽部分中的细胞 (P1) 开始。白血病样品中细胞的门控示例如图1所示(图2A)。选择单峰,从该分析中排除双峰,P2(图2B)。 图2C 显示了选择丙啶碘阴性活细胞P3的门。关注非造血基质群体,CD45-/Ter119-、P4(APC,Y 轴)与 CD45-/Ter119-、P4 细胞群选择SSC-A(图2D)。这种初始门控策略对于所有要分析的样品都是通用的。
白血病小鼠模型用于说明图2E-G中内皮细胞的门控。图 2E 描述了 CD31 阳性(Pe-Cy7,Y 轴)与非癌症对照小鼠和白血病小鼠中的SSC-A细胞,通过P4门控。用 CD31 阳性标记的细胞是内皮细胞 P5。在图 2F 中,通过 P5 门控,小动脉内皮细胞被鉴定为 CD45-Ter119-CD31+Sca1+,P6,正弦内皮细胞被鉴定为 CD45-Ter119-CD31+Sca1-,P7(BV421,Y 轴)vs。SSC-A型。
虽然该分析侧重于非白血病性骨髓微环境细胞,但它也有助于确定肿瘤负荷。在开始实验之前,可以使用一小部分未消化/未耗尽的样品来完成。在 图2G的实验对照(虚线)中,P8代表样品中的肿瘤负荷,P9代表非癌细胞。
MDS小鼠模型用于说明图2H-J中间充质基质细胞的分析。图 2H 描述了 CD31 阴性(Pe-Cy7,Y 轴)与SSC-A 细胞,通过 P4 门控。野生型对照小鼠和MDS小鼠中的间充质基质细胞群如图2I所示。通过 P10 门控,间充质基质细胞被鉴定为 CD45-Ter119-CD31-CD51+CD140a+、P113(Pe、Y 轴;Pe-Cy5,X轴)。实验对照(虚线),图2J显示了单色门控对照、CD51单染色和CD140a单染色的示例,用于门控图2I中实验样品中所示的MSC。
该数据表明,小动脉内皮细胞在AML微环境中显着扩增,同时在正弦内皮细胞群中丢失(图2F),这与早期在免疫缺陷小鼠中使用患者来源的异种移植物的研究一致28。在8周龄的NHD13小鼠中观察到的间充质基质细胞的小扩增(图2I)可能会在16-20周时增加,此时这些小鼠开始表现出MDS25的特征。虽然只有白血病模型用于说明内皮细胞群,而MDS小鼠模型用于说明间充质基质细胞群,但类似的染色和门控策略可用于分析这些模型中的不同微环境群体,或者实际上,在任何感兴趣的基因工程小鼠模型中。
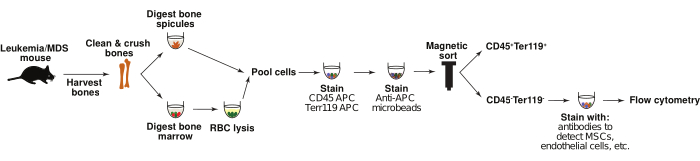
图1:骨髓基质细胞的分离。 示意图显示了从对照和白血病小鼠中分离非造血骨髓基质细胞的过程。简而言之,骨针和骨髓分别消化,然后合并。CD45-Ter119-群体通过磁性分选富集,并用针对目标群体(如间充质基质细胞和内皮细胞)的抗体组合染色。然后通过流式细胞术分析细胞。 请点击这里查看此图的较大版本.
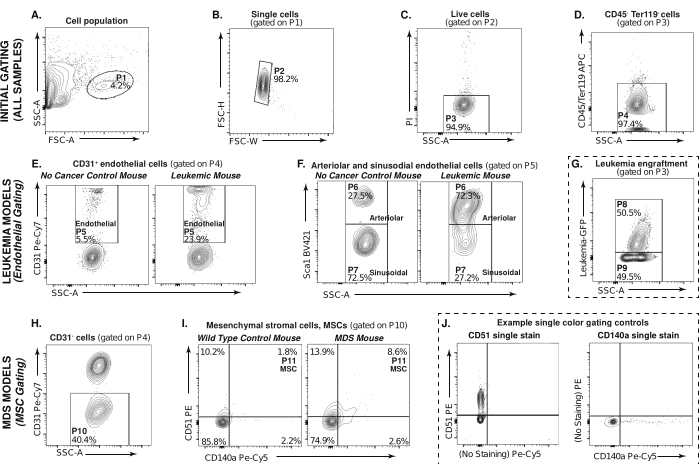
图 2:非造血骨髓和基质细胞的门控策略。 (A-D) 流式细胞术门控策略用于在白血病和 MDS 小鼠模型中选择消化的 CD45-/Ter119-、非造血群体 (P4)。(E)白血病骨髓内皮细胞(P5,CD31+)可细分为(F)Sca1+小动脉(P6)或Sca1-窦内皮细胞(P7)。(G) AML 样本中的白血病植入,其中 P8 代表植入,而 P9 代表非癌细胞。虚线表示该图是实验对照。(H) 通过 P4、MDS 骨髓 CD31- 细胞、P10 (I) 间充质基质细胞 (CD51+/CD140a+、P11) 进行门控。(J) 单色门控示例,CD51(左)和 CD140a(右),用于确定 (I) 中间充质基质细胞的门。请点击这里查看此图的较大版本.
| 溶液 | 试剂 | 浓度 | 添加量 |
| FACS缓冲液 | 哈佛商学院 | 10 倍 | 100毫升 |
| 乙二胺四乙酸 | 0.5 米 | 4 毫升 | |
| 胎牛血清 | - | 50毫升 | |
| 水 | - | 848毫升 | |
| 骨髓消化混合物 | 哈佛商学院 | 1 倍 | 2 毫升 |
| 脱氧核糖核酸酶 1 | 1 μg/mL 在 1x DPBS 中 | 20 微升 | |
| 分散酶 II 粉末 | - | 4 毫克 | |
| IV型胶原酶 | - | 2 毫克 | |
| 骨针状消化混合物 | DPBS的 | 1 倍 | 320毫升 |
| 1型胶原酶 | - | 1 克 | |
| 胎牛血清 | - | 80毫升 | |
| MAC 缓冲区 | 蓝蛋白 | 66 克/摩尔 | 5 克 |
| DPBS的 | 10 倍 | 100毫升 | |
| 乙二胺四乙酸 | 0.5 米 | 4 毫升 | |
| 水 | - | 896 公升 |
表1:本研究中使用的溶液和缓冲液的组成。
讨论
小鼠白血病模型已被广泛用于识别促进侵袭性髓系白血病进展的细胞内在和生态位驱动信号6,19,21。本文介绍了一种基于流式细胞术的综合方案,用于定义MDS和AML小鼠模型中骨髓微环境的细胞组成。
在从实验样品中获取流式细胞术数据之前,仔细补偿荧光重叠非常重要。包括所有适当的染色和门控也很重要。这些步骤将使实验者能够确认阳性或阴性抗体染色代表了目标细胞标记物的准确表达,而不是荧光光谱重叠或自发荧光的伪影。尽管该协议描述了选定的细胞表面标记物,但抗体组合可以根据实验需要进行扩展。例如,CD144(Ve-钙粘蛋白)可以在收获小鼠之前在体内施用,并且可以作为内皮细胞的额外特异性标志物5,29。虽然此处指示的荧光团和抗体克隆可以更改,但应进行滴定以确定其理想的稀释度。为了明确定义骨髓生态位中的所有细胞群,单细胞 RNA 测序可用于在 MDS/AML 起始和进展期间建立骨髓生态位景观 23,24,30。
按照本方案中描述的步骤仔细准备样品至关重要。在均质化骨骼时,研钵和研杵必须冷却,所有步骤都在冰上进行,以防止细胞死亡并确保高细胞回收率。在均质化之前去除骨骼周围的所有组织非常重要,以防止其他不需要的细胞类型受到污染。在红细胞裂解和消化过程中,重要的是用适量的FACS缓冲液停止酶促反应,并彻底重悬于新鲜缓冲液中,否则细胞将继续消化并最终死亡。
分离骨和骨髓组分是必不可少的,因为骨针需要不同的酶混合物作为消化缓冲液,并且需要更长的时间来消化。在骨消化中,1型胶原酶可用于消化常见于细胞外基质和胶原纤维中的胶原酶原纤维31。此外,一些靠近骨内膜的骨髓细胞在均质化后仍会附着在骨骼上,并且仅通过酶消化释放。在消化骨髓时,IV型胶原酶用于消化骨髓内上皮细胞和内皮细胞的基底膜32,而分散酶主要裂解纤连蛋白31。骨髓需要更少的时间来消化,因为细胞和基质之间的关联较弱。在类似条件下孵育骨髓组分会损害感兴趣的群体。使用两种不同的消化缓冲液可显著增加可检测的造口群体数量,从而提供更大的数据集进行分析。
大多数可用于分析小鼠骨髓微环境群体的方案都使用注射器仅从长骨中冲洗骨髓13,24。目前粉碎骨骼的方法提供了从骨盆等其他骨骼获取数据的能力,显着缩短了样品制备时间,并减少了锋利针头受伤的可能性。鉴于骨骼由成熟的成骨细胞和其他可以为正常和恶性造血细胞提供支持的细胞群组成,这种包括来自骨针状细胞的方法能够更准确地表示样本中的骨髓微环境。虽然之前的一项研究分别消化了骨髓和骨针11,但它没有证明同一样本中的骨系和内皮细胞染色。第二项研究使用市售的专有酶混合物来消化骨髓和骨针23,并使用更昂贵的单细胞RNA测序技术分析数据。这种富集CD45-/Ter119-细胞的方法可选择感兴趣的细胞,并显著减少在流式细胞仪上采集数据所需的时间。因此,与其他最先进的方法(如单细胞RNA测序)相比,这种基于流式细胞术的方法更容易获得,具有成本效益,并且不需要训练有素的生物信息学家进行复杂的分析23,24,30。
需要注意的是,该协议不仅可用于表征任何可用的MDS和AML小鼠模型,还可用于表征任何遗传小鼠模型的骨髓微环境。类似的方法也可以有效地分析患者来源的异种移植物(PDX)模型的小鼠骨髓生态位的变化。这些方法可用于旨在确定 MDS/AML 影响其骨髓生态位的机制的研究。鉴于从人类患者身上取样大量骨髓相关的技术挑战,这些小鼠模型分析是进一步了解恶性骨髓微环境并确定其在疾病进展中的作用的有效工具。
披露声明
未申报利益冲突。
致谢
我们要感谢 URMC 流式细胞术核心。这项工作得到了美国血液学会学者奖、白血病研究基金会奖和美国国立卫生研究院R01DK133131资助和R01CA266617授予 JB 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL pipette Tips | Genesee Scientific | 24-165RL | |
| 1.7 mL Microcentrifuge Tubes | AVANT | L211511-CS | |
| 10 µL pipette Tips | Genesee Scientific | 24-140RL | |
| 10 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1760 | |
| 1000 mL Vacuum Filtration Flask | NEST | 344021 | |
| 15 mL Centrifuge Tube | VWR | 10026-076 | |
| 2 mL Aspirating Pipette | NEST | 325011 | |
| 200 µL pipette Tips | Genesee Scientific | 24-150-RL | |
| 25 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1780 | |
| 5 mL Individually Wrapped Sterile Serological Pipettes | Globe scientific | 1740 | |
| 5 mL Polystyrene Round-Bottom Tube 12 x 75 mm style | Falcon | 352054 | |
| 5 mL Polystyrene Round-Bottom Tube with Cell Strainer Cap 12 x 75 mm style | Falcon | 352235 | |
| 50 mL Centrifuge Tube | NEST | 602052 | |
| 6 Well, Flat Bottom with Low Evaporation Lid | Falcon | 353046 | |
| Absorbent Underpads with Waterproof Moisture Barrier | VWR | 56616-031 | |
| APC MicroBeads | Miltenyi | 130-090-855 | |
| autoMACS Pro Separator | Miltenyi Biotec GmBH | 4425745 | |
| BD Pharmingen Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553141 | 0.5 mg/mL |
| Bovine Serum Albumin | Sigma-Aldrich | A7906 | 66.000 g/mol |
| Brilliant Violet 421 anti-mouse Ly-6A/E (Sca-1) Antibody (D7) | Invitrogen | 404-5981 | 0.2 mg/mL |
| C57BL/6J Mice | Jackson Laboratory | 664 | |
| Carbon Dioxide Gas Tank | Airgas | CD50 | |
| CD31 (PECAM-1) Monoclonal Antibody (390), PE-Cyanine7 | Invitrogen | 25-0311-82 | 0.2 mg/mL |
| CD45 Monoclonal Antibody (30-F11), APC | Invitrogen | 17-0451-82 | 0.2 mg/mL |
| Cell Strainer 70 µm Nylon | Falcon | 352350 | |
| Cole-Parmer Essentials Mortar and Pestle; Agate, 125 mL | Cole-Parmer | EW-63100-62 | |
| Collagenase from Clostridium histolyticum | Sigma-Aldrich | C5138-500MG | |
| Collagenase Type I | STEMCELL | 7415 | |
| Corning Mini Centrifuge | CORNING | 6770 | |
| Corning Stripettor Ultra Pipet Controller | Corning | 4099 | |
| Deoxyribonuclease I from bovine pancreas | Sigma-Aldrich | D4513 | |
| Dispase II, powder | Gibco | 117105041 | |
| DPBS 10x | gibco | 14200-075 | |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 00-4333-57 | |
| Ethanol absolute, KOPTEC, meets analytical specification of BP, Ph. Eur., USP (200 Proof) | VWR | 89125-174 | |
| Fine scissors - sharp | Fine Science Tools | 14061-10 | |
| Foundation B Fetal Bovine Serum | GeminiBio | 900-208 | |
| Gilson PIPETMAN L Pipette Starter Kits | FisherScientific | F167370G | |
| Graefe Forceps | Fine Science Tools | 11051-10 | |
| Hank's Balanced Salt Solution (HBSS) 10x | gibco | 14185-052 | |
| Hemocytometer | Fisher | 02-671-10 | |
| Incubator | BINDER | C150-UL | |
| Kimwipes | KIMTECH | K222101 | |
| LABGARD Class II, Type A2 Biological Safety Cabinet | Nuaire | NU-425-400 | |
| LD Columns | Miltenyi Biotec GmBH | 130-042-901 | |
| LSE Vortex Mixer | CORNING | 6775 | |
| LSRII/Fortessa/Symphony A1 | Becton, Dickinson and Company | 647800L6 | |
| MACS MULTI STAND | Miltenyi Biotec GmBH | 130-042-303 | |
| MACsmix Tube Rotator | Miltenyi Biotec GmBH | 130-090-753 | |
| mIgG | Millipore-Sigma | 18765-10mg | 2 mg/mL |
| Nup98-HoxD13 (NHD13) Mice | Jackson Laboratory | 010505 | |
| PE anti-mouse CD51 Antibody (RMV-7) | Biolegend | 104106 | 0.2 mg/mL |
| PE/Cyanine5 anti-mouse CD140a Antibody (RUO) | Biolegend | 135920 | 0.2 mg/mL |
| Penicillin-Streptomycin | Gibco | 15140122 | 10,000 U/mL |
| Plastipak 3 mL Syringe | Becton, Dickinson and Company | 309657 | |
| Propidium Iodide - 1.0 mg/mL Solution in Water | ThermoFisher Scientific | P3566 | |
| QuadroMACS Separator | Miltenyi Biotec GmBH | 130-090-976 | |
| Sorvall X Pro / ST Plus Series Centrifuge | Thermo Scientific | 75009521 | |
| TER-119 Monoclonal Antibody (TER-119), APC | Invitrogen | 17-5921-82 | 0.2 mg/mL |
| Trypan Blue Solution 0.4% | Gibco | 15-250-061 | |
| Ultrapure 0.5 M EDTA, pH 8.0 | Invitrogen | 15575-038 |
参考文献
- Morrison, S. J., Scadden, D. T. The bone marrow niche for haematopoietic stem cells. Nature. 505 (7483), 327-334 (2014).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Pinho, S., Frenette, P. S. Haematopoietic stem cell activity and interactions with the niche. Nat Rev Mol Cell Biol. 20 (5), 303-320 (2019).
- Kfoury, Y., Scadden, D. T. Mesenchymal cell contributions to the stem cell niche. Cell Stem Cell. 16 (3), 239-253 (2015).
- Itkin, T., et al. Distinct bone marrow blood vessels differentially regulate haematopoiesis. Nature. 532 (7599), 323-328 (2016).
- Bajaj, J., et al. Cd98-mediated adhesive signaling enables the establishment and propagation of acute myelogenous leukemia. Cancer Cell. 30 (5), 792-805 (2016).
- Konopleva, M. Y., Jordan, C. T. Leukemia stem cells and microenvironment: Biology and therapeutic targeting. J Clin Oncol. 29 (5), 591-599 (2011).
- Kim, Y. W., et al. Defective notch activation in microenvironment leads to myeloproliferative disease. Blood. 112 (12), 4628-4638 (2008).
- Walkley, C. R., et al. A microenvironment-induced myeloproliferative syndrome caused by retinoic acid receptor gamma deficiency. Cell. 129 (6), 1097-1110 (2007).
- Kode, A., et al. Leukaemogenesis induced by an activating β-catenin mutation in osteoblasts. Nature. 506 (7487), 240-244 (2014).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Raaijmakers, M. H., et al. Bone progenitor dysfunction induces myelodysplasia and secondary leukaemia. Nature. 464 (7290), 852-857 (2010).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Bajaj, J., Diaz, E., Reya, T. Stem cells in cancer initiation and progression. J Cell Biol. 219 (1), e201911053(2020).
- Sekeres, M. A., Taylor, J. Diagnosis and treatment of myelodysplastic syndromes: A review. Jama. 328 (9), 872-880 (2022).
- Zeisig, B. B., Kulasekararaj, A. G., Mufti, G. J., So, C. W. Snapshot: Acute myeloid leukemia. Cancer Cell. 22 (5), 698-698.e1 (2012).
- Krivtsov, A. V., Armstrong, S. A. Mll translocations, histone modifications and leukaemia stem-cell development. Nat Rev Cancer. 7 (11), 823-833 (2007).
- Yoshimi, A., et al. Coordinated alterations in rna splicing and epigenetic regulation drive leukaemogenesis. Nature. 574 (7777), 273-277 (2019).
- Lin, Y. W., Slape, C., Zhang, Z., Aplan, P. D. Nup98-hoxd13 transgenic mice develop a highly penetrant, severe myelodysplastic syndrome that progresses to acute leukemia. Blood. 106 (1), 287-295 (2005).
- Kwon, H. Y., et al. Tetraspanin 3 is required for the development and propagation of acute myelogenous leukemia. Cell Stem Cell. 17 (2), 152-164 (2015).
- Bajaj, J., et al. An in vivo genome-wide crispr screen identifies the rna-binding protein staufen2 as a key regulator of myeloid leukemia. Nat Cancer. 1 (4), 410-422 (2020).
- Krivtsov, A. V., et al. Transformation from committed progenitor to leukaemia stem cell initiated by mll-af9. Nature. 442 (7104), 818-822 (2006).
- Baryawno, N., et al. A cellular taxonomy of the bone marrow stroma in homeostasis and leukemia. Cell. 177 (7), 1915-1932.e16 (2019).
- Tikhonova, A. N., et al. The bone marrow microenvironment at single-cell resolution. Nature. 569 (7755), 222-228 (2019).
- Balderman, S. R., et al. Targeting of the bone marrow microenvironment improves outcome in a murine model of myelodysplastic syndrome. Blood. 127 (5), 616-625 (2016).
- Amend, S. R., Valkenburg, K. C., Pienta, K. J. Murine hind limb long bone dissection and bone marrow isolation. JoVE. 110, e53936(2016).
- JoVE Science Education Database. Science Education Database. Basic Methods in Cellular and Molecular Biology. Using a Hemacytometer to Count Cells. , JoVE. (2023).
- Passaro, D., et al. Increased vascular permeability in the bone marrow microenvironment contributes to acute myeloid leukemia progression and drug response. Blood. 128 (22), 2662(2016).
- Xu, C., et al. Stem cell factor is selectively secreted by arterial endothelial cells in bone marrow. Nat Commun. 9 (1), 2449(2018).
- Baccin, C., et al. Combined single-cell and spatial transcriptomics reveal the molecular, cellular and spatial bone marrow niche organization. Nat Cell Biol. 22 (1), 38-48 (2020).
- Ebrahimi Dastgurdi, M., Ejeian, F., Nematollahi, M., Motaghi, A., Nasr-Esfahani, M. H. Comparison of two digestion strategies on characteristics and differentiation potential of human dental pulp stem cells. Arch Oral Biol. 93, 74-79 (2018).
- Abreu-Velez, A. M., Howard, M. S. Collagen IV in normal skin and in pathological processes. N Am J Med Sci. 4 (1), 1-8 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。