Method Article
Hücre Dışı Vezikül Doku Faktörü Aktivite Testi
Bu Makalede
Özet
Burada kurum içi hücre dışı vezikül dokusu faktör aktivite testini açıklıyoruz. İnsan plazma örneklerinden hücre dışı veziküllerdeki doku faktörünü ölçmek için aktiviteye dayalı testler ve antijen bazlı testler kullanılmıştır. Aktiviteye dayalı tahliller, antijen bazlı tahlillere göre daha yüksek duyarlılık ve özgüllüğe sahiptir.
Özet
Doku faktörü (TF), faktör (F) VII ve FVIIa için bir transmembran reseptörüdür. TF/FVIIa kompleksi, hem FIX hem de FX'i etkinleştirerek pıhtılaşma kademesini başlatır. TF, hücrelerden hücre dışı veziküller (EV'ler) şeklinde dolaşıma salınır. Kanser, bakteriyel ve viral enfeksiyonlar ve siroz dahil olmak üzere çeşitli hastalıklarda TF pozitif (+) EV'lerin seviyesi artar ve tromboz, yaygın damar içi pıhtılaşma, hastalık şiddeti ve mortalite ile ilişkilidir. Plazmada TF+ EV'leri ölçmenin iki yolu vardır: antijen ve aktivite bazlı tahliller. Veriler, aktivite bazlı testlerin antijen bazlı testlerden daha yüksek duyarlılık ve özgüllüğe sahip olduğunu göstermektedir. Bu makale, iki aşamalı bir FXa üretim testine dayanan kurum içi EVTF aktivite testimizi açıklamaktadır. TF'ye bağımlı FXa neslini TF'den bağımsız FXa neslinden ayırt etmek için anti-TF antikorunun varlığında ve yokluğunda FXa oluşturmak için TF+ EV içeren numunelere FVIIa, FX ve kalsiyum eklenir. FXa seviyesini belirlemek için FXa tarafından parçalanmış bir kromojenik substrat kullanılırken, TF konsantrasyonunun belirlenmesi için relipidlenmiş bir rekombinant TF ile oluşturulan standart bir eğri kullanılır. Bu kurum içi EVTF aktivite testi, ticari bir TF aktivite testinden daha yüksek duyarlılığa ve özgüllüğe sahiptir.
Giriş
Faktör (F) VII/VIIa'nın doku faktörüne (TF)1 bağlanması ile kan pıhtılaşması başlatılır. TF / FVIIa kompleksi, kan pıhtılaşmasını etkinleştirmek için hem FIX hem de FX'i aktive eder1. Tam uzunlukta, membrana bağlı TF'nin iki biçimi vardır: şifreli ve aktif. Ek olarak, alternatif olarak eklenmiş bir TF formu (asTF) vardır. Hücre zarının dış broşüründeki sfingomyelin ve fosfatidilkolin, TF'yi şifreli bir durumdatutar 2,3,4. Hücreler aktive edildiğinde veya hasar gördüğünde, fosfolipid scramblase, fosfatidilserin ve diğer negatif yüklü fosfolipidleri dış broşüre1 aktarır. Hücrelerin aktivasyonu ayrıca asit sfingomiyelinazın dış broşüre translokasyonu ile sonuçlanır ve burada sfingomyelini seramid5'e indirger. Bu iki mekanizma şifreli TF'yi aktif forma dönüştürür. Ayrıca, protein disülfid izomerazın, şifreli TF'de Cys186 ve Cys209 arasında disülfid bağı oluşumuna aracılık ettiği ve bunun da TF 6,7,8'in şifresinin çözülmesine neden olduğu öne sürülmektedir. asTF de dolaşımda bulunur ancak transmembran alanından yoksundur ve bu nedenle çözünür 9,10. Daha da önemlisi, asTF, tam uzunlukta aktif TF10,11'e kıyasla çok düşük prokoagülan aktivite seviyelerine sahiptir.
Hücre dışı veziküller (EV'ler) dinlenen, aktive olan ve ölmekte olan konakçı hücrelerin yanı sıra kanser hücrelerindensalınır 12. EV'ler proteinleri ebeveyn hücrelerinden eksprese eder12. Aktif TF taşıyan EV'ler, aktive edilmiş monositlerden, endotel hücrelerinden ve tümör hücrelerinden dolaşımasalınır 13,14,15. Plazmadaki TF seviyeleri, aktivite ve antijen bazlı tahlillerle ölçülebilir. Antijen bazlı testler arasında ELISA ve akış sitometrisi16 bulunur. İki farklı aktivite tabanlı tahlil vardır: bir ve iki aşamalı TF aktivite tahlilleri. Tek aşamalı tahlil, plazma bazlı bir pıhtılaşma tahliline dayanır. TF içeren numune plazmaya eklenir ve yeniden kalsifikasyondan sonra pıhtı oluşturma süresi ölçülür. İki aşamalı tahlil, FVII veya FVIIa, FX ve kalsiyum ekleyerek FXa numune neslini ölçer. FXa seviyeleri, FXa tarafından parçalanmış bir substrat kullanılarak belirlenir.
Hem bir hem de iki aşamalı TF aktivite testlerinde, TF konsantrasyonu, rekombinant TF ile oluşturulan standart bir eğri kullanılarak belirlenir. İki aşamalı tahliller, tek aşamalı tahlilden daha yüksek duyarlılık ve özgüllüğe sahiptir. Birçok çalışma, aktiviteye dayalı testlerin antijen bazlı testlerden daha yüksek duyarlılığa ve özgüllüğe sahip olduğunu doğrulamıştır 17,18,19,20,21. Ek olarak, kurum içi faaliyet tahlili, ticari faaliyet tahlilinden daha yüksek duyarlılık ve özgüllüğe sahiptir22. Sağlıklı bireyler, plazmada çok düşük veya tespit edilemeyen EVTF aktivitesine sahiptir. Buna karşılık, kanser, siroz, sepsis ve viral enfeksiyon gibi patolojik rahatsızlıkları olan bireyler, saptanabilir düzeyde EVTF aktivitesine sahiptir ve bu, tromboz, yaygın damar içi pıhtılaşma, hastalık şiddeti ve mortalite ile ilişkilidir 23,24,25,26,27,28. Burada, bu kurum içi iki aşamalı EVTF aktivite tahlilini açıklayacağız.
Protokol
Araştırma, Chapel Hill'deki North Carolina Üniversitesi Kurumsal İnceleme Kurulu tarafından onaylanmıştır (protokol numarası: 14-2108).
1. Bağışçılardan kan alınması
- 21 G'lik bir iğne ile antekubital ven içine temiz damar delinmesi kullanarak tam kan toplayın. İlk 3 mL kanın atılmasını sağlayın çünkü kanın bu kısmı perivasküler hücrelerden TF içerebilir.
- % 3.2 sodyum sitrat (0.109 mol / L) içeren bir vakutainere 2.7 veya 1.8 mL (tüplerin boyutuna bağlı olarak) kan çekin. Tüpleri fazla veya az doldurmayın. Sodyum sitratı dağıtmak için kan alımından hemen sonra tüpleri hafifçe ters çevirin.
- Tüpler işlenmeden önce taşınırsa çalkalamadan kaçının. Kan alındıktan sonraki 2 saat içinde plazma hazırlayın.
2. Negatif kontrol plazmasının hazırlanması
NOT: Numuneler, son dondurmadan önce hiçbir zaman buz üzerine yerleştirilmemelidir.
- Sağlıklı gönüllülerden alınan tam kanı kullanarak negatif kontrol plazması hazırlayın. Kan alındıktan hemen sonra, trombositsiz plazmayı aşağıdaki gibi hazırlayın.
- Kan örneklerini vakum tüplerinden 15 mL'lik tüplere aktarın.
- Kan örneklerini 2.500 × g'da oda sıcaklığında (20-24 °C) frensiz olarak 15 dakika santrifüjleyin.
- Süpernatanı (trombositten fakir plazma) yeni bir tüpe aktarın ve aynı koşullar altında dönüşü tekrarlayın.
- Süpernatanı (trombositten tükenmiş plazma) yeni bir tüpe aktarın.
- Numuneyi ≥100 μL'lik alikotlara ayırın. Tüpün dibinde yaklaşık 100 μL bırakın.
- Trombositi tükenmiş plazmayı hemen −80 °C'de dondurun (Şekil 1).
3. Pozitif kontrol plazmasının hazırlanması
NOT: Lipopolisakkarite yanıt bireyler arasında değişkendir.
- Vakum cihazlarından alınan kan örneklerini 15 mL'lik tüplere aktarın.
- Escherichia coli O111: B4'ten (10 μg / mL) lipopolisakkarit (LPS) ile uyarılan sağlıklı gönüllülerden alınan tam kanı kullanarak 37 ° C'de ajitasyon ile 5 saat boyunca pozitif kontrol plazması hazırlayın.
- 5 saatlik inkübasyondan sonra, 2.1.2 ila 2.1.6 arasındaki adımları izleyin.
4. Hücre dışı veziküllerin plazmadan izolasyonu
NOT: EV peletleri görünmeyebilir. Defrost süresi numune hacmine bağlıdır, ancak genellikle 100 μL plazmayı 37 °C'de 30 dakika boyunca çözdürürüz.
- Plazma numunelerini 37 °C'de çözdürün.
- 1.5 mL'lik bir tüpte her 100 μL plazma örneğine kalsiyum [HBSA-Ca(-)] tamponu [137 mM NaCl, 5.38 mM KCl, 5.55 mM glikoz, 10 mM HEPES,% 0.1 (a/h) sığır serum albümini] içermeyen 1 mL HBSA ekleyin.
- Plazma örneklerini 20.000 × g'da 4 °C'de 15 dakika santrifüjleyin.
- EV peletini bozmadan süpernatanı 20 μL'ye kadar aspire edin.
- Her tüpe 1 mL HBSA-Ca(-) tamponu ekleyerek EV peletini sulandırın, EV peletinin bulunduğu yerde yukarı ve aşağı pipetleyin ve 4 °C'de 15 dakika boyunca 20.000 × g'da ikinci kez santrifüjlemeden önce her tüpü vorteksleyin.
- EV peletini bozmadan süpernatanı 20 μL'ye kadar aspire edin.
- EV peletini 80 μL HBSA-Ca(-) içinde sulandırın ve EV peletinin bulunduğu yerde yukarı ve aşağı pipetleyin (Şekil 2).
5. Seçenek: Ultrasantrifüj kullanılarak küçük hücre dışı veziküllerin izolasyonu
- Adım 4.3'ten sonra, süpernatan ve ultrasantrifüjü 4 ° C'de 70 dakika boyunca 100.000 × g'da toplayın.
- EV peletini bozmadan süpernatanı 20 μL'ye kadar aspire edin.
- Her tüpe 1 mL HBSA-Ca(-) tamponu ekleyerek EV peletini sulandırın ve 4 °C'de 70 dakika boyunca 100.000 × g'da ikinci kez ultrasantrifüjlemeden önce her tüpü vorteksleyin.
- EV peletini bozmadan süpernatanı 20 μL'ye kadar aspire edin.
- EV peletini 80 μL HBSA-Ca(-) içinde sulandırın.
6. Hücre dışı vezikül dokusu faktör aktivitesinin ölçülmesi
NOT: EV numuneleri, kuyucuklara eklenmeden önce pipetlenmeli ve karıştırmak için iyice vortekslenmelidir. EDTA-disodyum, FXa'nın kromojenik substratı parçalama yeteneğini inhibe edecektir. Bu nedenle, EDTA-disodyum adım 6.7'de EDTA-tetrasodyumun yerine kullanılamaz.
- 96 oyuklu bir plakanın iki kuyucuğuna 40 μL'lik bir EV numunesi ekleyin.
- Bir EV numunesinin bir oyuğuna 11 μL inhibitör fare anti-insan TF IgG [(36.4 μg/mL, nihai konsantrasyon 7.8 μg/mL)] ve 11 μL kontrol faresi IgG [(36.4 μg/mL, son konsantrasyon 7.8 μg/mL)] ekleyin.
- 96 oyuklu plakayı oda sıcaklığında 15 dakika inkübe edin.
- İnkübasyon süresi boyunca, relipidlenmiş rekombinant TF kullanarak 50 μL / kuyu TF standartları (0, 0.32, 0.63, 1.25, 2.5, 5, 10 ve 20 pg / mL) hazırlayın.
- 4 mL HBSA'yı kalsiyum [HBSA-Ca(+)] [HBSA-Ca(-) + 10 mM CaCl2, son konsantrasyon 10 mM], HBSA-Ca(+) içinde 800 μL 900 nM FX (son konsantrasyon: 146.4 nM) ve HBSA-CA(+) içinde 120 μL 200 nM FVIIa (son konsantrasyon: 4.8 nM) ile karıştırarak faktör karışımı hazırlayın.
- Her bir oyuğa 50 μL faktör karışım çözeltisi ekleyin, plakayı filmle örtün ve 37 ° C'de bir inkübatörde 2 saat inkübe edin.
- 2 saat sonra, 25 μL HBSA etilendiamintetraasetik asit (EDTA) tamponu [HBSA-Ca(-) + 25 mM EDTA-tetrasodyum, son konsantrasyon 5 mM] ekleyerek FXa üretimini durdurun ve oda sıcaklığında 5 dakika inkübe edin.
- FXa tarafından 4mM'ye bölünen kromojenik substratı sulandırın (25 mg'lık bir şişeye 8.7 mL damıtılmış su ekleyin).
- Her bir oyuğa 25 μL kromojenik substrat çözeltisi ekleyin, plakayı ışıktan korumak için filmle ve ardından alüminyum folyo ile kaplayın ve 37 ° C'de 15 dakika inkübe edin.
- 15 dakikalık inkübasyondan sonra, kabarcıkları bir iğne ile veya 1.500 × g'da 1 dakika santrifüj ederek çıkarın.
- Okumadan önce bir karışıma sahip bir plaka okuyucu kullanarak plakayı 405 nm'de okuyun.
- Relipidlenmiş rekombinant TF kullanılarak oluşturulan standart eğriyi kullanarak her bir kuyucuğun FXa üretimini TF aktivitesine dönüştürün.
- Denklem (1)'i kullanarak TF'ye bağlı FXa üretimini (EVTF etkinliği) hesaplayın:
TF'ye bağlı FXa üretimi (EVTF aktivitesi [pg/mL]) = Toplam FXa üretimi (IgG kuyusu kontrolü) - TF'den bağımsız FXa üretimi (anti-TF IgG kuyusu) (Şekil 3) (1)
Sonuçlar
Başarılı bir sonuç, ≥0.5 pg/mL'lik bir pozitif kontrol değeri ve <0.5 pg/mL'lik bir negatif kontrol değeri verir. Pozitif bir kontrol için >1.0 pg/mL EVTF aktivitesine sahip yüksek bir LPS yanıtlayıcısı bulmak en iyisidir. Temsili sonuç, LPS aktivasyonu olan ve olmayan 11 sağlıklı donörün tam kanından plazmadan izole edilen EV'lerin EVTF aktivitesini göstermektedir (Şekil 4). On bir donörden altısı (Donör 2, 4, 5, 8, 10, 11) orta ila yüksek LPS yanıtlayıcıları iken, on bir bağışçıdan beşi (Donör 1, 3, 6, 7, 9) düşük LPS yanıtlayıcılarıydı.

Şekil 1: Trombositten arındırılmış plazmanın hazırlanması. Rakam Hisada ve Mackman29'dan değiştirildi. Kısaltma: PDP = trombositten arındırılmış plazma. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 2: Trombosit tükenmiş plazmadan hücre dışı veziküllerin izolasyonu. Rakam Hisada ve Mackman29'dan değiştirildi. Kısaltmalar: PDP = trombositten arındırılmış plazma; EV'ler = hücre dışı veziküller. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
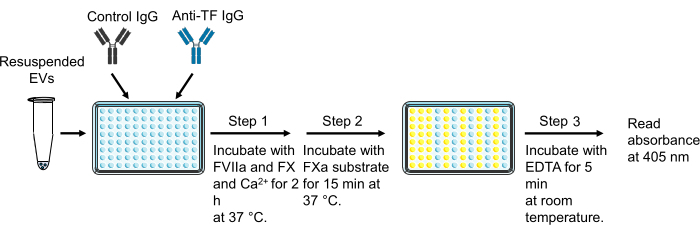
Şekil 3: Hücre dışı vezikül dokusu faktör aktivitesinin ölçümü. Rakam Hisada ve Mackman29'dan değiştirildi. Kısaltmalar: TF = doku faktörü; EV'ler = hücre dışı veziküller. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 4: LPS aktivasyonu olan ve olmayan 11 sağlıklı donörün tam kanından alınan plazmanın EVTF aktivitesi. LPS aktivasyonu, pozitif kontrol ile aynı koşul altında gerçekleştirildi. Pozitif kontrol, bilinen bir LPS yanıtlayıcısından gelirken, 11 sağlıklı donörün LPS'ye verdiği yanıtlar deney sırasında bilinmiyordu. Beyaz ve siyah çubuklar sırasıyla LPS aktivasyonu olan ve olmayan göstergeleri gösterir. Kısaltmalar: EVTF = hücre dışı vezikül dokusu faktörü; LPS = lipopolisakkarit. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tablo 1: Bu kurum içi EVTF aktivite tahlili, ticari bir TF ELISA ve bir aktivite tahlilini karşılaştıran çalışmaların bir özeti. Kısaltmalar: EVTF = hücre dışı vezikül dokusu faktörü; ELISA = enzime bağlı immünosorbent testi. Bu Tabloyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada, kurum içi EVTF aktivite testimizin protokolü sunulmaktadır. Protokolde üç kritik adım vardır. EV peletini sulandırırken, görünür olmasa bile EV peletinin bulunduğu yerde yukarı ve aşağı pipetlemek önemlidir. EV peletinin eksik sulandırılması, numunelerin EVTF aktivite değerlerinin yanlış negatif veya eksik tahmin edilmesine neden olacaktır. İkinci olarak, HBSA-Ca(+) kullanmak protokol adımı 6.5'te kritik öneme sahiptir, çünkü FXa üretimi kalsiyum olmadan oluşturulamaz. Üçüncüsü, FXa oluşumunu durdurmak için EDTA-tetrasodyum kullanmak, ancak EDTA-disodyum kullanmak kritik öneme sahiptir, çünkü ikincisi FXa'nın kromojenik substratı parçalama yeteneğini engeller.
Her reaktif için aşağıdaki saklama ve kullanım yöntemini öneriyoruz. Tahlil tamponlarını ve sulandırılmış substratı 4 °C'de saklıyoruz ve bitene kadar tekrar tekrar kullanıyoruz. Alt tabaka 2-3 hafta içinde bitmezse, sarardığı için atıyoruz. Rekombinant TF, antikorlar, FVIIa ve FX'i -80 °C'de saklıyoruz ve donma-çözülme döngüsünü önlemek için bir tahlil için alikot yapılmasını öneriyoruz.
Bir ön çalışmada, plazma örneklerini oda sıcaklığında 9 saat beklettik, gece boyunca -80 ° C'de tekrar dondurduk ve ertesi gün testi gerçekleştirdik. Kontrol olarak aynı plazmayı çözdürdük ve hemen tekrar dondurduk. Oda sıcaklığında 9 saat bekletilen numunenin, çözülüp hemen yeniden dondurulana kıyasla EVTF aktivitesinde %16'lık bir azalma olduğunu bulduk (Hisada ve Mackman, yayınlanmamış veriler 2017).
LPS'ye yanıttaki farklılığa ek olarak, bireysel donörlerden plazmadaki EV konsantrasyonundaki fark, farklı donörlerin farklı EVTF aktivitesini açıklayabilir. Gerçekten de, LPS ile uyarılan tam kandan plazmadaki EV konsantrasyonlarında bazı farklılıklar gözlemledik (1.9 ± 0.6 ×10 10 partikül / mL, n = 6, ortalama ± standart sapma)30.
Bu kurum içi EVTF aktivite tahlili, ticari tahlillerin sahip olmadığı çeşitli özelliklere sahiptir. İlk olarak, tahlil, TF'ye bağımlı FXa neslini TF'den bağımsız FXa neslinden ayırt etmek için bir anti-TF antikoru kullanır. Plazmada TF aktivitesini ölçtüğü iddia edilen üç ticari aktivite testi, ancak hiçbiri anti-TF antikorları16 kullanmaz. Bu nedenle, bu ticari tahliller sadece toplam FXa üretimini ölçer, ancak TF'ye bağlı FXa üretimini ölçmez. İkinci olarak, FVIIa ile TF'den bağımsız FXa oluşumunu en aza indirmek için 2.4 nM FVIIa (reaksiyondaki son konsantrasyon) kullanıyoruz. Bir ticari aktivite tahlili, reaksiyonda 12 nM FVIIa kullanır ve bu da yüksek bir arka plan22 verir. Gerçekten de FVIIa, TF31'in yokluğunda FVIIa konsantrasyonuna bağlı olarak FX'i doğrusal olarak aktive eder. Bu kurum içi EVTF aktivite tahlili ile ticari TF ELISA ve bir aktivite tahlilini karşılaştıran çalışmaları Tablo 1'de özetledik.
Sitratlı trombositten fakir plazma için EVTF aktivitesinin dört yanıt sınıflandırması önerilmiştir: sıfır (0 ila <0.5 pg/mL); zayıf (0,5 ila <1,0 pg/mL), orta (1,0 ila <2,0 pg/mL) ve güçlü (≥2,0 pg/mL)23. Özellikle, farklı antikoagülanlar EVTF aktivite testlerinin sonuçlarını etkiler. Örneğin, sodyum sitrat ile karşılaştırıldığında LPS stimülasyonundan sonra heparin kullanılarak daha yüksek EVTF aktivitesi seviyeleri gözlenmiştir (Donör A: 4.6 (sitrat) vs 28.6 (heparin) pg/mL ve Donör B: 3.4 (sitrat) vs 26.0 (heparin) pg/mL, sırasıyla, Hisada ve Mackman yayınlanmamış veriler 2017). Buna karşılık, LPS stimülasyonundan sonra sodyum sitrat ile karşılaştırıldığında EDTA kullanılarak daha düşük EVTF aktivitesi seviyeleri gözlenmiştir (Donör C: 3.9 (sitrat) vs 1.4 (EDTA) pg / mL, Donör D: 3.8 (sitrat) vs 0.4 (EDTA) pg / mL, sırasıyla, Tatsumi ve Mackman yayınlanmamış veriler 2016). Bu sonuçlar, farklı antikoagülanlar kullanıldığında EVTF aktivite verilerinin karşılaştırılabilir olmadığını göstermektedir.
Yöntemin birkaç sınırlaması vardır. Varyasyon katsayısı (CV), klinik tahlillere kıyasla nispeten yüksektir. Nitekim, yedi bağımsız çalışmada pozitif kontrol için CV %24 idi17,29. Sadece EV'leri değil, aynı zamanda hücresel kalıntıları da santrifüjleme peletleri kullanarak EV'lerin izolasyonu. Daha önce transmisyon elektron mikroskobu ile trombositten zengin plazma peletini analiz ettik ve trombositleri, EV'leri ve hücresel kalıntılarıgözlemledik 32. Sabit açılı bir rotor kullanıyoruz ve 20.000 × g santrifüjleme için açılır rotor yaşamadık. Yakın zamanda, 100.000 × g ile peletlenebilen ancak 20.000 × g ile peletlenemeyen küçük EV'lerin pankreas kanseri ve COVID-1930 hastalarında EVTF aktivitesine sahip olduğunu bulduk. Bu, bu protokolün eksozomlar gibi küçük EV'lerden EVTF aktivitesini ölçmediğini gösterir. Özellikle, eksozomlar sfingomyelin açısından zengin EV'lerdir ve TF içeren eksozomların varlığı bildirilmiştir 30,33,34,35. Numunedeki toplam EVTF aktivitesi miktarını daha doğru bir şekilde belirlemek için EV'lerin 100.000 × g kullanılarak plazmada peletlenmesini öneririz. Santrifüj süresi 15 dakikadan 70 dakikaya çıktığı için bir ultrasantrifüj ve daha uzun bir test süresi gerektirdiğini unutmayın.
Bu yöntem her türlü hastalıktan alınan plazma örneklerine uygulanabilir. EVTF aktivitesi, kanser, COVID-19, bakteriyel enfeksiyon ve siroz dahil olmak üzere farklı hastalıkları olan hastalarda hastalık şiddeti ve sağkalım ile ilişkilidir 23,26,27.
Açıklamalar
İfşa edilecek hiçbir çıkar çatışması yoktur.
Teşekkürler
Bu çalışma NIH NHLBI R35HL155657 (N.M.) ve John C. Parker profesörlüğü (N.M.) tarafından desteklenmiştir. Yararlı yorumları için Bayan Sierra J. Archibald'a teşekkür ederiz
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube for 20,000 x g centrifuge | any company | N/A | We use the one from Fisher Scientific (Catalog number: 05-408-129). |
| 1.5 mL tube for ultracentrifuge | any company | N/A | We use the one from Beckman Coulter (Catalog number: 357448) |
| 15 mL tube | any company | N/A | We use the one from VWR (Catalog number: 89039-666) |
| 21 G x .75 in. BD Vacutainer Safety-Lok Blood Collection Set with 12 in. tubing and luer adapter | BD | 367281 | |
| 96-well plate | any company | N/A | We use the one from Globe Scientific (Catalog number: 120338). |
| BD Vacutainer Citrate Tubes | BD | 363083 | |
| Bovine serum albumin | Sigma Aldrich | A9418 | |
| Calcium chloride | Fisher Scientific | C69-500 | |
| Centrifuge for 1.5 mL tube | any company | N/A | We use the Centrifuge 5417R (Eppendorf). |
| Centrifuge for 15 mL tube | any company | N/A | We use the Centrifuge 5810R (Eppendorf). |
| D-(+)-Glucose | Sigma Aldrich | G7021 | |
| Ethylenediaminetetraacetic acid tetrasodium salt dihydrate | Sigma Aldrich | E6511 | |
| Hepes | Sigma Aldrich | H4034 | |
| Human FVIIa | Enzyme Research Laboratory | HFVIIa | The solution should be diluted with HBSA-Ca(+). |
| Human FX | Enzyme Research Laboratory | HFX1010 | The solution should be diluted with HBSA-Ca(+). |
| Inhibitory mouse anti-human tissue factor IgG, clone HTF-1 | Fisher Scientific | 550252 | |
| Lipopolysaccharide from Escherichia coli O111:B4 | Sigma Aldrich | L2630 | There are several lipopolysaccharide from different E. coli. Different lipopolysaccharide have different potential to activate monocytes. |
| Mouse IgG | Sigma Aldrich | I5381 | |
| Pefachrome FXa 8595 | Enzyme Research Laboratory | 085-27 | |
| Plate reader | any company | N/A | We use the SpectraMax i3x from Molecular Devices |
| Re-lipidated recombinant tissue factor, Dade Innovin | Siemens | 10873566 | |
| Sodium chloride | Fisher Scientific | S271-500 | |
| Ultracentrifuge | Beckman Coulter | Optima TLX | |
| Ultracentrifuge rotor | Beckman Coulter | TLA-55 |
Referanslar
- Grover, S. P., Mackman, N. Tissue factor: an essential mediator of hemostasis and trigger of thrombosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 38 (4), 709-725 (2018).
- Shaw, A. W., Pureza, V. S., Sligar, S. G., Morrissey, J. H. The local phospholipid environment modulates the activation of blood clotting. Journal of Biological Chemistry. 282 (9), 6556-6563 (2007).
- Tavoosi, N., et al. Molecular determinants of phospholipid synergy in blood clotting. Journal of Biological Chemistry. 286 (26), 23247-23253 (2011).
- Wang, J., Pendurthi, U. R., Rao, L. V. M. Sphingomyelin encrypts tissue factor: ATP-induced activation of A-SMase leads to tissue factor decryption and microvesicle shedding. Blood Advances. 1 (13), 849-862 (2017).
- Kornhuber, J., Rhein, C., Muller, C. P., Muhle, C. Secretory sphingomyelinase in health and disease. Biological Chemistry. 396 (6-7), 707-736 (2015).
- Versteeg, H. H., Ruf, W. Tissue factor coagulant function is enhanced by protein-disulfide isomerase independent of oxidoreductase activity. Journal of Biological Chemistry. 282 (35), 25416-25424 (2007).
- Reinhardt, C., et al. Protein disulfide isomerase acts as an injury response signal that enhances fibrin generation via tissue factor activation. Journal of Clinical Investigation. 118 (3), 1110-1122 (2008).
- Langer, F., et al. Rapid activation of monocyte tissue factor by antithymocyte globulin is dependent on complement and protein disulfide isomerase. Blood. 121 (12), 2324-2335 (2013).
- Bogdanov, V. Y., et al. Alternatively spliced human tissue factor: a circulating, soluble, thrombogenic protein. Nature Medicine. 9 (4), 458-462 (2003).
- Mackman, N. Alternatively spliced tissue factor - one cut too many. Thrombosis and Haemostasis. 97 (1), 5-8 (2007).
- Censarek, P., Bobbe, A., Grandoch, M., Schror, K., Weber, A. A. Alternatively spliced human tissue factor (asHTF) is not pro-coagulant. Thrombosis and Haemostasis. 97 (1), 11-14 (2007).
- Gyorgy, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cellular and Molecular Life Sciences. 68 (16), 2667-2688 (2011).
- Osterud, B., Bjorklid, E. Tissue factor in blood cells and endothelial cells. Frontiers in Bioscience (Elite Edition). 4 (1), 289-299 (2012).
- Hisada, Y., Mackman, N. Cancer cell-derived tissue factor-positive extracellular vesicles: biomarkers of thrombosis and survival. Current Opinion in Hematology. 26 (5), 349-356 (2019).
- Vatsyayan, R., Kothari, H., Pendurthi, U. R., Rao, L. V. 4-Hydroxy-2-nonenal enhances tissue factor activity in human monocytic cells via p38 mitogen-activated protein kinase activation-dependent phosphatidylserine exposure. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (7), 1601-1611 (2013).
- Mackman, N., Sachetto, A. T. A., Hisada, Y. Measurement of tissue factor-positive extracellular vesicles in plasma: strengths and weaknesses of current methods. Current Opinion in Hematology. 29 (5), 266-274 (2022).
- Lee, R. D., et al. Pre-analytical and analytical variables affecting the measurement of plasma-derived microparticle tissue factor activity. Thrombosis Research. 129 (1), 80-85 (2012).
- Claussen, C., et al. Microvesicle-associated tissue factor procoagulant activity for the preoperative diagnosis of ovarian cancer. Thrombosis Research. 141, 39-48 (2016).
- Mackman, N., Hisada, Y., Archibald, S. J., et al. Tissue factor and its procoagulant activity on cancer-associated thromboembolism in pancreatic cancer: Comment by Mackman et al. Cancer Science. 113 (5), 1885-1887 (2022).
- Sachetto, A. T. A., et al. Evaluation of four commercial ELISAs to measure tissue factor in human plasma. Research and Practice in Thrombosis and Haemostasis. 7 (3), 100133 (2023).
- Archibald, S. J., Hisada, Y., Bae-Jump, V. L., Mackman, N. Evaluation of a new bead-based assay to measure levels of human tissue factor antigen in extracellular vesicles in plasma. Research and Practice in Thrombosis and Haemostasis. 6 (2), e12677 (2022).
- Tatsumi, K., et al. Evaluation of a new commercial assay to measure microparticle tissue factor activity in plasma: communication from the SSC of the ISTH. Journal of Thrombosis and Haemostasis. 12 (11), 1932-1934 (2014).
- Hisada, Y., et al. Measurement of microparticle tissue factor activity in clinical samples: A summary of two tissue factor-dependent FXa generation assays. Thrombosis Research. 139, 90-97 (2016).
- Tatsumi, K., Hisada, Y., Connolly, A. F., Buranda, T., Mackman, N. Patients with severe orthohantavirus cardiopulmonary syndrome due to Sin Nombre Virus infection have increased circulating extracellular vesicle tissue factor and an activated coagulation system. Thrombosis Research. 179, 31-33 (2019).
- Schmedes, C. M., et al. Circulating Extracellular Vesicle Tissue Factor Activity During Orthohantavirus Infection Is Associated With Intravascular Coagulation. Journal of Infectious Diseases. 222 (8), 1392-1399 (2020).
- Rosell, A., et al. Patients with COVID-19 have elevated levels of circulating extracellular vesicle tissue factor activity that is associated with severity and mortality-Brief report. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (2), 878-882 (2021).
- Campbell, R. A., et al. Comparison of the coagulopathies associated with COVID-19 and sepsis. Research and Practice in Thrombosis and Haemostasis. 5 (4), e12525 (2021).
- Guervilly, C., et al. Dissemination of extreme levels of extracellular vesicles: tissue factor activity in patients with severe COVID-19. Blood Advances. 5 (3), 628-634 (2021).
- Hisada, Y., Mackman, N. Measurement of tissue factor activity in extracellular vesicles from human plasma samples. Research and Practice in Thrombosis and Haemostasis. 3 (1), 44-48 (2019).
- Sachetto, A. T. A., et al. Tissue factor activity of small and large extracellular vesicles in different diseases. Research and Practice in Thrombosis and Haemostasis. 7 (3), 100124 (2023).
- Bom, V. J., Bertina, R. M. The contributions of Ca2+, phospholipids and tissue-factor apoprotein to the activation of human blood-coagulation factor X by activated factor VII. Biochemical Journal. 265 (2), 327-336 (1990).
- Tilley, R. E., Holscher, T., Belani, R., Nieva, J., Mackman, N. Tissue factor activity is increased in a combined platelet and microparticle sample from cancer patients. Thrombosis Research. 122 (5), 604-609 (2008).
- Gurung, S., Perocheau, D., Touramanidou, L., Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Communication and Signaling. 19 (1), 47 (2021).
- Garnier, D., et al. Cancer cells induced to express mesenchymal phenotype release exosome-like extracellular vesicles carrying tissue factor. Journal of Biological Chemistry. 287 (52), 43565-43572 (2012).
- Park, J. A., et al. Tissue factor-bearing exosome secretion from human mechanically stimulated bronchial epithelial cells in vitro and in vivo. Journal of Allergy and Clinical Immunology. 130 (6), 1375-1383 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır