Method Article
세포외 소포 조직 인자 활성 분석
요약
여기서는 사내 세포외 소포체 조직 인자 활성 분석에 대해 설명합니다. 활성 기반 분석 및 항원 기반 분석은 인간 혈장 샘플에서 세포외 소포체의 조직 인자를 측정하는 데 사용되었습니다. 활성 기반 분석은 항원 기반 분석보다 민감도와 특이도가 더 높습니다.
초록
조직 인자(TF)는 인자 (F) VII 및 FVIIa에 대한 막관통 수용체입니다. TF/FVIIa 복합체는 FIX와 FX를 모두 활성화하여 응고 캐스케이드를 시작합니다. TF는 세포외 소포체(EV)의 형태로 세포에서 순환계로 방출됩니다. TF 양성(+) EV의 수준은 암, 박테리아 및 바이러스 감염, 간경변을 포함한 다양한 질병에서 증가하며 혈전증, 파종성 혈관 내 응고, 질병 중증도 및 사망률과 관련이 있습니다. 혈장에서 TF+ EV를 측정하는 방법에는 항원 기반 분석과 활성 기반 분석의 두 가지가 있습니다. 데이터에 따르면 활성 기반 분석은 항원 기반 분석보다 민감도와 특이도가 더 높습니다. 이 백서는 2단계 FXa 생성 분석을 기반으로 하는 당사의 사내 EVTF 활성 분석에 대해 설명합니다. FVIIa, FX 및 칼슘을 TF+ EV 함유 샘플에 첨가하여 항 TF 항체의 존재 유무에 따라 FXa를 생성하여 TF 의존성 FXa 생성과 TF 독립적 FXa 생성을 구별합니다. FXa에 의해 절단된 발색 기질은 FXa 수준을 결정하는 데 사용되며, TF 농도를 측정하기 위해 relipidated recombinant TF로 생성된 표준 곡선이 사용됩니다. 이 자체 EVTF 활성 분석은 상용 TF 활성 분석보다 민감도와 특이도가 높습니다.
서문
혈액 응고는 인자 (F) VII/VIIa와 조직 인자(TF)1의 결합으로 시작됩니다. TF/FVIIa 복합체는 FIX와 FX를 모두 활성화하여 혈액 응고를 활성화한다1. 전체 길이, 멤브레인 결합 TF에는 암호화와 활성의 두 가지 형태가 있습니다. 또한, 대안적으로 접합된 형태의 TF(asTF)가 있습니다. 세포막의 바깥쪽 엽단에 있는 스핑고미엘린과 포스파티딜콜린은 TF를 암호화된 상태로 유지합니다 2,3,4. 세포가 활성화되거나 손상되면 인지질 스크램블라제는 포스파티딜세린 및 기타 음전하를 띤 인지질을 바깥쪽 전단으로 전달합니다1. 세포의 활성화는 또한 산성 스핑고미엘라아제를 외부 전단지로 전위시켜 스핑고미엘린을 세라마이드로 분해합니다5. 이 두 메커니즘은 암호화된 TF를 활성 형식으로 변환합니다. 또한 단백질 이황화 이소머라제가 암호화된 TF에서 Cys186과 Cys209 사이의 이황화 결합 형성을 매개하여 TF 6,7,8의 해독을 초래하는 것으로 제안되었습니다. asTF는 순환에도 존재하지만 막관통 도메인이 부족하므로 용해성 9,10입니다. 중요한 것은 asTF가 전장 활성 TF10,11에 비해 매우 낮은 수준의 응고제 활성을 가지고 있다는 것입니다.
세포외 소포체(EV)는 암세포뿐만 아니라 휴지기, 활성화 및 죽어가는 숙주 세포에서 방출된다12. EV는 부모 세포에서 단백질을 발현한다12. 활성 TF 함유 EV는 활성화된 단핵구, 내피 세포 및 종양 세포로부터 순환 13,14,15로 방출된다. 혈장 내 TF 수치는 활성 및 항원 기반 분석으로 측정할 수 있습니다. 항원 기반 분석에는 ELISA 및 유세포 분석이 포함됩니다16. 활동 기반 분석에는 1단계 및 2단계 TF 활동 분석의 두 가지가 있습니다. 1단계 분석은 혈장 기반 응고 분석을 기반으로 합니다. TF 함유 샘플을 혈장에 첨가하고 재석회화 후 응고를 형성하는 시간을 측정합니다. 2단계 분석은 FVII 또는 FVIIa, FX 및 칼슘을 추가하여 샘플의 FXa 생성을 측정합니다. FXa 레벨은 FXa에 의해 절단된 기판을 사용하여 결정됩니다.
1단계 및 2단계 TF 활성 분석 모두에서 TF 농도는 재조합 TF로 생성된 표준 곡선을 사용하여 측정됩니다. 2단계 분석은 1단계 분석보다 민감도와 특이도가 높습니다. 많은 연구에서 활성 기반 분석이 항원 기반 분석보다 민감도와 특이도가 더 높다는 것을 확인했습니다 17,18,19,20,21. 또한, 당사의 자체 활성 분석은 상용 활성 분석보다 더 높은 민감도와 특이성을 가지고있습니다 22. 건강한 사람은 혈장에서 EVTF 활성이 매우 낮거나 검출할 수 없는 수준입니다. 대조적으로, 암, 간경변, 패혈증 및 바이러스 감염과 같은 병리학적 상태가 있는 개인은 EVTF 활성이 검출 가능한 수준이며 이는 혈전증, 파종성 혈관 내 응고, 질병 중증도 및 사망률과 관련이 있습니다 23,24,25,26,27,28. 여기에서는 이 사내 2단계 EVTF 활성 분석에 대해 설명합니다.
프로토콜
이 연구는 노스캐롤라이나 대학교 채플힐(University of North Carolina at Chapel Hill)의 기관 검토 위원회(Institutional Review Board)의 승인을 받았습니다(프로토콜 번호: 14-2108).
1. 헌혈자의 혈액 채취
- 깨끗한 정맥 천자를 사용하여 21G 바늘로 전방 정맥에 전혈을 채취합니다. 혈액의 처음 3mL는 혈관 주위 세포의 TF를 포함할 수 있으므로 폐기하십시오.
- 2.7 또는 1.8mL(튜브 크기에 따라 다름)의 혈액을 3.2% 구연산나트륨(0.109mol/L)이 포함된 바큐테이너에 넣습니다. 튜브를 과도하게 채우거나 부족하게 채우지 마십시오. 채혈 직후 튜브를 부드럽게 뒤집어 시트르산나트륨을 분산시킵니다.
- 가공 전에 튜브를 운반하는 경우 교반을 피하십시오. 채혈 후 2시간 이내에 혈장을 준비합니다.
2. 네거티브 대조군 혈장의 제조
알림: samples는 최종 동결 전에 얼음 위에 놓아서는 안 됩니다.
- 건강한 지원자의 전혈을 사용하여 음성 대조 혈장을 준비합니다. 채혈 직후 다음과 같이 무혈소판 혈장을 준비합니다.
- 혈액 샘플을 vacutainer 튜브에서 15mL 튜브로 옮깁니다.
- 브레이크 없이 실온(20-24°C)에서 15분 동안 2,500× g 에서 혈액 샘플을 원심분리합니다.
- 상청액(혈소판 부족 혈장)을 새 튜브로 옮기고 동일한 조건에서 스핀을 반복합니다.
- 상층액(혈소판 고갈 혈장)을 새 튜브로 옮깁니다.
- 샘플을 ≥100 μL 부분 표본으로 분취합니다. 튜브 바닥에 약 100μL를 남겨 둡니다.
- 혈소판이 고갈된 혈장을 -80°C에서 즉시 동결합니다(그림 1).
3. 양성 대조 혈장의 제조
참고: 지질다당류에 대한 반응은 개인마다 다릅니다.
- 혈액 샘플을 vacutainer에서 15mL 튜브로 옮깁니다.
- 대장균 O111:B4(10μg/mL)의 지질다당류(LPS)로 자극된 건강한 지원자의 전혈을 사용하여 37°C에서 5시간 동안 교반하면서 양성 대조 혈장을 준비합니다.
- 5시간 배양 후 2.1.2에서 2.1.6 단계를 따르십시오.
4. 혈장에서 세포외 소포체의 분리
알림: EV 펠릿이 보이지 않을 수 있습니다. 해동 시간은 시료량에 따라 다르지만 일반적으로 37°C에서 30분 동안 100μL 혈장을 해동합니다.
- 혈장 시료를 37°C에서 해동합니다.
- 1.5mL 튜브에 있는 각 100μL의 혈장 샘플에 칼슘[HBSA-Ca(-)] 완충액[137mM NaCl, 5.38mM KCl, 5.55mM 포도당, 10mM HEPES, 0.1%(w/v) 소 혈청 알부민]이 없는 HBSA 1mL를 추가합니다.
- 플라즈마 시료를 20,000 × g 에서 4 °C에서 15분 동안 원심분리합니다.
- EV 펠릿을 방해하지 않고 상층액을 20μL까지 흡입합니다.
- 각 튜브에 HBSA-Ca(-) 완충액 1mL를 첨가하여 EV 펠릿을 재구성하고, EV 펠릿 위치에서 피펫팅을 위아래로 하고, 각 튜브를 소용돌이친 후 4°C에서 15분 동안 20,000× g 에서 두 번째로 원심분리합니다.
- EV 펠릿을 방해하지 않고 상층액을 20μL까지 흡입합니다.
- 80μL의 HBSA-Ca(-)에서 EV 펠릿을 재구성하고 EV 펠릿 위치에서 위아래로 피펫팅합니다(그림 2).
5. 선택권: ultracentrifuge를 사용하여 작은 extracellular 소포의 고립
- 4.3단계 후 상층액과 초원심분리기를 100,000× g 에서 4°C에서 70분 동안 수집합니다.
- EV 펠릿을 방해하지 않고 상층액을 20μL까지 흡입합니다.
- 각 튜브에 1mL의 HBSA-Ca(-) 완충액을 첨가하여 EV 펠릿을 재구성하고 각 튜브를 소용돌이친 후 4°C에서 70분 동안 100,000× g 에서 두 번째로 초원심분리합니다.
- EV 펠릿을 방해하지 않고 상층액을 20μL까지 흡입합니다.
- EV 펠릿을 80μL의 HBSA-Ca(-)로 재구성합니다.
6. 세포외 소포체 조직 인자 활성 측정
알림: EV 샘플은 웰에 추가하기 전에 잘 피펫팅하고 볼텍싱하여 혼합해야 합니다. EDTA-디소듐은 FXa가 발색 기질을 절단하는 능력을 억제합니다. 따라서 EDTA-디소듐은 6.7단계에서 EDTA-테트라소듐의 대체품으로 사용할 수 없습니다.
- 40μL의 EV 샘플을 96웰 플레이트의 웰 2개에 추가합니다.
- 11μL의 억제성 마우스 항인간 TF IgG[(36.4μg/mL, 최종 농도 7.8μg/mL)]를 EV 샘플의 한 웰에 추가하고 11μL의 대조군 마우스 IgG[(36.4μg/mL, 최종 농도 7.8μg/mL)]를 다른 웰에 추가합니다.
- 실온에서 15분 동안 96웰 플레이트를 배양합니다.
- 배양 시간 동안 50μL/웰의 TF 표준물질(0, 0.32, 0.63, 1.25, 2.5, 5, 10 및 20pg/mL)을 relipidated recombinant TF를 사용하여 중복으로 준비합니다.
- 4mL의 HBSA를 칼슘[HBSA-Ca(+)][HBSA-Ca(-) + 10mMCaCl2, 최종 농도 10mM], HBSA-Ca(+)의 900nM FX 800μL(최종 농도: 146.4nM), HBSA-CA(+)의 200nM FVIIa 120μL(최종 농도: 4.8nM)와 혼합하여 인자 혼합물을 준비합니다.
- 각 웰에 50μL의 인자 혼합 용액을 추가하고 플레이트를 필름으로 덮은 다음 37°C의 인큐베이터에서 2시간 동안 배양합니다.
- 2시간 후 HBSA 에틸렌디아민테트라아세트산(EDTA) 완충액 25μL[HBSA-Ca(-) + 25mM EDTA-테트라소듐, 최종 농도 5mM]을 첨가하여 FXa 생성을 중지하고 실온에서 5분 동안 배양합니다.
- FXa에 의해 절단된 발색 기질을 4mM으로 재구성합니다(25mg 바이알에 증류수 8.7mL 추가).
- 각 웰에 25μL의 발색 기질 용액을 추가하고 플레이트를 필름으로 덮은 다음 알루미늄 호일로 덮어 빛으로부터 보호하고 37°C에서 15분 동안 배양합니다.
- 15분 배양 후 바늘로 기포를 제거하거나 1,500× g 에서 1분 동안 원심분리합니다.
- 판독하기 전에 한 번 혼합된 플레이트 리더를 사용하여 405nm에서 플레이트를 판독합니다.
- relipidated recombinant TF를 사용하여 생성된 표준 곡선을 사용하여 각 웰의 FXa 생성을 TF 활성으로 변환합니다.
- 방정식 (1)을 사용하여 TF 종속 FXa 생성(EVTF 활성)을 계산합니다.
TF 종속 FXa 생성(EVTF 활성[pg/mL]) = 총 FXa 생성(제어 IgG 웰) - TF 독립적 FXa 생성(항 TF IgG 웰)(그림 3)(1)
결과
성공적인 결과는 ≥0.5pg/mL의 양성 대조군과 <0.5pg/mL의 음성 대조군을 제공합니다. 양성 대조군을 위해 >1.0pg/mL EVTF 활성을 가진 높은 LPS 반응기를 찾는 것이 가장 좋습니다. 대표적인 결과는 LPS 활성화 유무에 관계없이 건강한 기증자 11명의 전혈에서 혈장에서 분리한 EV의 EVTF 활성을 보여줍니다(그림 4). 11명의 기증자 중 6명(기증자 2, 4, 5, 8, 10, 11명)은 중등도에서 높은 LPS 반응자였고, 11명의 기증자 중 5명(기증자 1, 3, 6, 7, 9)은 낮은 LPS 반응자였다.

그림 1: 혈소판 결핍 혈장 준비. 이 수치는 Hisada 및 Mackman29에서 수정되었습니다. 약어: PDP = 혈소판 결핍 혈장. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 혈소판 결핍 혈장에서 세포외 소포체의 분리. 이 수치는 Hisada 및 Mackman29에서 수정되었습니다. 약어: PDP = 혈소판 결핍 혈장; EVs = 세포외 소포체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
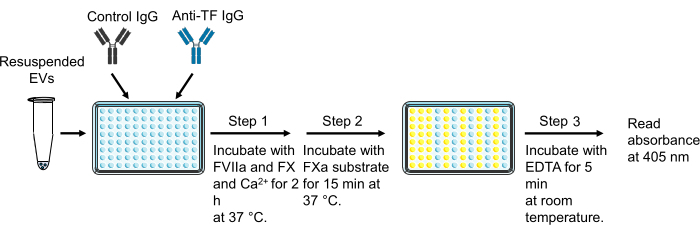
그림 3: 세포외 소포 조직 인자 활성 측정. 이 수치는 Hisada 및 Mackman29에서 수정되었습니다. 약어: TF = 조직 인자; EVs = 세포외 소포체. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: LPS 활성화 유무에 관계없이 건강한 기증자 11명의 전혈에서 추출한 혈장의 EVTF 활성. LPS 활성화는 양성 대조군과 동일한 조건에서 수행되었습니다. 양성 대조군은 알려진 LPS 반응자로부터 얻은 반면, 11명의 건강한 기증자의 LPS에 대한 반응은 실험 당시에는 알려지지 않았습니다. 흰색 및 검은색 막대는 각각 LPS 활성화 유무를 나타냅니다. 약어: EVTF = 세포외 소포 조직 인자; LPS = 지질다당류. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 이 사내 EVTF 활성 분석, 상용 TF ELISA 및 활성 분석을 비교한 연구 요약. 약어: EVTF = 세포외 소포 조직 인자; ELISA = 효소 결합 면역 흡착 분석. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
여기에서는 자체 EVTF 활성 분석의 프로토콜이 제시됩니다. 프로토콜에는 세 가지 중요한 단계가 있습니다. EV 펠릿을 재구성할 때, EV 펠릿이 보이지 않더라도 EV 펠릿의 위치에서 위아래로 피펫팅하는 것이 중요합니다. EV 펠릿의 불완전한 재구성은 샘플의 EVTF 활성 값의 위음성 또는 과소 평가를 초래합니다. 둘째, 칼슘 없이는 FXa 생성이 불가능하기 때문에 프로토콜 단계 6.5에서 HBSA-Ca(+)를 사용하는 것이 중요합니다. 셋째, EDTA-테트라소듐을 사용하지만 EDTA-디소듐을 사용하지 않고 FXa 생성을 막는 것은 FXa가 발색 기질을 절단하는 능력을 억제하기 때문에 매우 중요합니다.
각 시약에 대해 다음과 같은 보관 및 사용 방법을 권장합니다. 분석 완충액과 재구성 된 기질을 4 °C에 보관하고 다 떨어질 때까지 반복적으로 사용합니다. 2-3주 이내에 기판이 떨어지지 않으면 노랗게 변하기 때문에 버립니다. 재조합 TF, 항체, FVIIa 및 FX는 -80°C에서 보관하며 동결-해동 주기를 피하기 위해 한 번의 분석에 대해 부분 표본을 만드는 것이 좋습니다.
예비 연구에서는 혈장 샘플을 실온에서 9시간 동안 방치하고 -80°C에서 밤새 재냉동한 후 다음날 분석을 수행했습니다. 대조군으로, 우리는 동일한 플라즈마를 해동하고 즉시 다시 동결했습니다. 실온에서 9시간 동안 방치한 샘플은 즉시 해동하고 다시 냉동한 샘플에 비해 EVTF 활성이 16% 감소한 것으로 나타났습니다(Hisada and Mackman, 미공개 데이터 2017).
LPS에 대한 반응의 차이 외에도 개별 공여체의 혈장 내 EV 농도 차이는 공여체마다 다른 EVTF 활성을 설명할 수 있습니다. 실제로, LPS 자극 전혈의 혈장 내 EV 농도에서 약간의 변화가 관찰되었습니다(1.9 ± 0.6 ×10 10 입자/mL, n = 6, 평균 ± 표준 편차)30.
이 사내 EVTF 활성 분석에는 상용 분석에는 없는 몇 가지 기능이 있습니다. 첫째, 이 분석은 항 TF 항체를 사용하여 TF 의존적 FXa 세대와 TF 독립적 FXa 세대를 구별합니다. 혈장에서 TF 활성을 측정하기 위해 세 가지 상업적 활성 분석법이 주장되지만, 그 중 어느 것도 항-TF 항체를 사용하지 않는다16. 따라서 이러한 상용 분석은 단순히 전체 FXa 생성을 측정하지만 TF 종속 FXa 생성은 측정하지 않습니다. 둘째, 2.4nM의 FVIIa(반응의 최종 농도)를 사용하여 FVIIa에 의한 TF 독립적 FXa 생성을 최소화합니다. 한 상업적 활성 분석은 반응에서 12nM의 FVIIa를 사용하며, 이는 높은 배경22를 제공합니다. 실제로 FVIIa는 TF31이 없는 경우 FVIIa 농도에 따라 FX를 선형적으로 활성화합니다. 이 자체 EVTF 활성 분석과 상용 TF ELISA 및 활성 분석을 비교한 연구를 표 1에 요약했습니다.
구연산 혈소판 결핍 혈장에 대한 EVTF 활성의 4가지 반응 분류가 제안됩니다: 0(0 내지 <0.5 pg/mL); 약함(0.5 - <1.0pg/mL), 중등도(1.0 - <2.0pg/mL), 강함(≥2.0pg/mL)23. 특히, 다양한 항응고제가 EVTF 활성 분석의 결과에 영향을 미칩니다. 예를 들어, LPS 자극 후 헤파린을 사용하면 구연산나트륨에 비해 더 높은 수준의 EVTF 활성이 관찰되었습니다(Donor A: 4.6 (citrate) vs 28.6 (heparin) pg/mL 및 Donor B: 3.4 (citrate) vs 26.0 (heparin) pg/mL, Hisada 및 Mackman 미공개 데이터 2017). 대조적으로, LPS 자극 후 EDTA를 사용하면 구연산나트륨에 비해 더 낮은 수준의 EVTF 활성이 관찰되었습니다(Donor C: 3.9 (citrate) vs 1.4 (EDTA) pg/mL, Donor D: 3.8 (citrate) vs 0.4 (EDTA) pg/mL, Tatsumi and Mackman unpublished data 2016). 이러한 결과는 서로 다른 항응고제를 사용할 때 EVTF 활성 데이터를 비교할 수 없음을 나타냅니다.
이 방법에는 몇 가지 제한 사항이 있습니다. 변동 계수(CV)는 임상 분석에 비해 상대적으로 높습니다. 실제로, 7개의 독립적인 연구에서 양성 대조군의 CV는 24%였습니다17,29. 원심분리 펠릿을 사용한 EV의 분리는 EV뿐만 아니라 세포 파편도 포함합니다. 우리는 이전에 투과 전자 현미경으로 혈소판이 풍부한 혈장의 펠릿을 분석하고 혈소판, EV 및 세포 파편을 관찰했습니다32. 우리는 고정각 로터를 사용하며 20,000 × g의 원심분리를 위한 스윙 아웃 로터를 경험하지 못했습니다. 우리는 최근 100,000 × g으로 펠릿화할 수 있지만 20,000 × g으로는 펠릿화할 수 없는 소형 EV가 췌장암 및 COVID-19 환자에서 EVTF 활성을 가지고 있음을 발견했습니다30. 이는 이 프로토콜이 엑소좀과 같은 소형 EV의 EVTF 활성을 측정하지 않음을 나타냅니다. 특히, 엑소좀은 스핑고미엘린이 풍부한 EV이며, TF 함유 엑소좀의 존재는 30,33,34,35로 보고되었습니다. 샘플에서 EVTF 활성의 총량을 보다 정확하게 측정하기 위해 100,000 × g을 사용하여 혈장에서 EV를 펠릿화하는 것이 좋습니다. 참고로, 초원심분리기가 필요하며 원심분리 시간이 15분에서 70분으로 증가하기 때문에 더 긴 분석 시간이 필요합니다.
이 방법은 모든 종류의 질병의 혈장 샘플에 적용할 수 있습니다. EVTF 활성은 암, COVID-19, 세균 감염 및 간경변을 포함한 다양한 질병을 가진 환자의 질병 중증도 및 생존과 관련이 있습니다 23,26,27.
공개
공개할 상충되는 이해관계가 없습니다.
감사의 말
이 연구는 NIH NHLBI R35HL155657(N.M.)과 John C. Parker 교수직(N.M.)의 지원을 받았습니다. 도움이 되는 의견을 주신 Ms. Sierra J. Archibald에게 감사드립니다
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube for 20,000 x g centrifuge | any company | N/A | We use the one from Fisher Scientific (Catalog number: 05-408-129). |
| 1.5 mL tube for ultracentrifuge | any company | N/A | We use the one from Beckman Coulter (Catalog number: 357448) |
| 15 mL tube | any company | N/A | We use the one from VWR (Catalog number: 89039-666) |
| 21 G x .75 in. BD Vacutainer Safety-Lok Blood Collection Set with 12 in. tubing and luer adapter | BD | 367281 | |
| 96-well plate | any company | N/A | We use the one from Globe Scientific (Catalog number: 120338). |
| BD Vacutainer Citrate Tubes | BD | 363083 | |
| Bovine serum albumin | Sigma Aldrich | A9418 | |
| Calcium chloride | Fisher Scientific | C69-500 | |
| Centrifuge for 1.5 mL tube | any company | N/A | We use the Centrifuge 5417R (Eppendorf). |
| Centrifuge for 15 mL tube | any company | N/A | We use the Centrifuge 5810R (Eppendorf). |
| D-(+)-Glucose | Sigma Aldrich | G7021 | |
| Ethylenediaminetetraacetic acid tetrasodium salt dihydrate | Sigma Aldrich | E6511 | |
| Hepes | Sigma Aldrich | H4034 | |
| Human FVIIa | Enzyme Research Laboratory | HFVIIa | The solution should be diluted with HBSA-Ca(+). |
| Human FX | Enzyme Research Laboratory | HFX1010 | The solution should be diluted with HBSA-Ca(+). |
| Inhibitory mouse anti-human tissue factor IgG, clone HTF-1 | Fisher Scientific | 550252 | |
| Lipopolysaccharide from Escherichia coli O111:B4 | Sigma Aldrich | L2630 | There are several lipopolysaccharide from different E. coli. Different lipopolysaccharide have different potential to activate monocytes. |
| Mouse IgG | Sigma Aldrich | I5381 | |
| Pefachrome FXa 8595 | Enzyme Research Laboratory | 085-27 | |
| Plate reader | any company | N/A | We use the SpectraMax i3x from Molecular Devices |
| Re-lipidated recombinant tissue factor, Dade Innovin | Siemens | 10873566 | |
| Sodium chloride | Fisher Scientific | S271-500 | |
| Ultracentrifuge | Beckman Coulter | Optima TLX | |
| Ultracentrifuge rotor | Beckman Coulter | TLA-55 |
참고문헌
- Grover, S. P., Mackman, N. Tissue factor: an essential mediator of hemostasis and trigger of thrombosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 38 (4), 709-725 (2018).
- Shaw, A. W., Pureza, V. S., Sligar, S. G., Morrissey, J. H. The local phospholipid environment modulates the activation of blood clotting. Journal of Biological Chemistry. 282 (9), 6556-6563 (2007).
- Tavoosi, N., et al. Molecular determinants of phospholipid synergy in blood clotting. Journal of Biological Chemistry. 286 (26), 23247-23253 (2011).
- Wang, J., Pendurthi, U. R., Rao, L. V. M. Sphingomyelin encrypts tissue factor: ATP-induced activation of A-SMase leads to tissue factor decryption and microvesicle shedding. Blood Advances. 1 (13), 849-862 (2017).
- Kornhuber, J., Rhein, C., Muller, C. P., Muhle, C. Secretory sphingomyelinase in health and disease. Biological Chemistry. 396 (6-7), 707-736 (2015).
- Versteeg, H. H., Ruf, W. Tissue factor coagulant function is enhanced by protein-disulfide isomerase independent of oxidoreductase activity. Journal of Biological Chemistry. 282 (35), 25416-25424 (2007).
- Reinhardt, C., et al. Protein disulfide isomerase acts as an injury response signal that enhances fibrin generation via tissue factor activation. Journal of Clinical Investigation. 118 (3), 1110-1122 (2008).
- Langer, F., et al. Rapid activation of monocyte tissue factor by antithymocyte globulin is dependent on complement and protein disulfide isomerase. Blood. 121 (12), 2324-2335 (2013).
- Bogdanov, V. Y., et al. Alternatively spliced human tissue factor: a circulating, soluble, thrombogenic protein. Nature Medicine. 9 (4), 458-462 (2003).
- Mackman, N. Alternatively spliced tissue factor - one cut too many. Thrombosis and Haemostasis. 97 (1), 5-8 (2007).
- Censarek, P., Bobbe, A., Grandoch, M., Schror, K., Weber, A. A. Alternatively spliced human tissue factor (asHTF) is not pro-coagulant. Thrombosis and Haemostasis. 97 (1), 11-14 (2007).
- Gyorgy, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cellular and Molecular Life Sciences. 68 (16), 2667-2688 (2011).
- Osterud, B., Bjorklid, E. Tissue factor in blood cells and endothelial cells. Frontiers in Bioscience (Elite Edition). 4 (1), 289-299 (2012).
- Hisada, Y., Mackman, N. Cancer cell-derived tissue factor-positive extracellular vesicles: biomarkers of thrombosis and survival. Current Opinion in Hematology. 26 (5), 349-356 (2019).
- Vatsyayan, R., Kothari, H., Pendurthi, U. R., Rao, L. V. 4-Hydroxy-2-nonenal enhances tissue factor activity in human monocytic cells via p38 mitogen-activated protein kinase activation-dependent phosphatidylserine exposure. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (7), 1601-1611 (2013).
- Mackman, N., Sachetto, A. T. A., Hisada, Y. Measurement of tissue factor-positive extracellular vesicles in plasma: strengths and weaknesses of current methods. Current Opinion in Hematology. 29 (5), 266-274 (2022).
- Lee, R. D., et al. Pre-analytical and analytical variables affecting the measurement of plasma-derived microparticle tissue factor activity. Thrombosis Research. 129 (1), 80-85 (2012).
- Claussen, C., et al. Microvesicle-associated tissue factor procoagulant activity for the preoperative diagnosis of ovarian cancer. Thrombosis Research. 141, 39-48 (2016).
- Mackman, N., Hisada, Y., Archibald, S. J., et al. Tissue factor and its procoagulant activity on cancer-associated thromboembolism in pancreatic cancer: Comment by Mackman et al. Cancer Science. 113 (5), 1885-1887 (2022).
- Sachetto, A. T. A., et al. Evaluation of four commercial ELISAs to measure tissue factor in human plasma. Research and Practice in Thrombosis and Haemostasis. 7 (3), 100133 (2023).
- Archibald, S. J., Hisada, Y., Bae-Jump, V. L., Mackman, N. Evaluation of a new bead-based assay to measure levels of human tissue factor antigen in extracellular vesicles in plasma. Research and Practice in Thrombosis and Haemostasis. 6 (2), e12677 (2022).
- Tatsumi, K., et al. Evaluation of a new commercial assay to measure microparticle tissue factor activity in plasma: communication from the SSC of the ISTH. Journal of Thrombosis and Haemostasis. 12 (11), 1932-1934 (2014).
- Hisada, Y., et al. Measurement of microparticle tissue factor activity in clinical samples: A summary of two tissue factor-dependent FXa generation assays. Thrombosis Research. 139, 90-97 (2016).
- Tatsumi, K., Hisada, Y., Connolly, A. F., Buranda, T., Mackman, N. Patients with severe orthohantavirus cardiopulmonary syndrome due to Sin Nombre Virus infection have increased circulating extracellular vesicle tissue factor and an activated coagulation system. Thrombosis Research. 179, 31-33 (2019).
- Schmedes, C. M., et al. Circulating Extracellular Vesicle Tissue Factor Activity During Orthohantavirus Infection Is Associated With Intravascular Coagulation. Journal of Infectious Diseases. 222 (8), 1392-1399 (2020).
- Rosell, A., et al. Patients with COVID-19 have elevated levels of circulating extracellular vesicle tissue factor activity that is associated with severity and mortality-Brief report. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (2), 878-882 (2021).
- Campbell, R. A., et al. Comparison of the coagulopathies associated with COVID-19 and sepsis. Research and Practice in Thrombosis and Haemostasis. 5 (4), e12525 (2021).
- Guervilly, C., et al. Dissemination of extreme levels of extracellular vesicles: tissue factor activity in patients with severe COVID-19. Blood Advances. 5 (3), 628-634 (2021).
- Hisada, Y., Mackman, N. Measurement of tissue factor activity in extracellular vesicles from human plasma samples. Research and Practice in Thrombosis and Haemostasis. 3 (1), 44-48 (2019).
- Sachetto, A. T. A., et al. Tissue factor activity of small and large extracellular vesicles in different diseases. Research and Practice in Thrombosis and Haemostasis. 7 (3), 100124 (2023).
- Bom, V. J., Bertina, R. M. The contributions of Ca2+, phospholipids and tissue-factor apoprotein to the activation of human blood-coagulation factor X by activated factor VII. Biochemical Journal. 265 (2), 327-336 (1990).
- Tilley, R. E., Holscher, T., Belani, R., Nieva, J., Mackman, N. Tissue factor activity is increased in a combined platelet and microparticle sample from cancer patients. Thrombosis Research. 122 (5), 604-609 (2008).
- Gurung, S., Perocheau, D., Touramanidou, L., Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Communication and Signaling. 19 (1), 47 (2021).
- Garnier, D., et al. Cancer cells induced to express mesenchymal phenotype release exosome-like extracellular vesicles carrying tissue factor. Journal of Biological Chemistry. 287 (52), 43565-43572 (2012).
- Park, J. A., et al. Tissue factor-bearing exosome secretion from human mechanically stimulated bronchial epithelial cells in vitro and in vivo. Journal of Allergy and Clinical Immunology. 130 (6), 1375-1383 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유