Method Article
Ensaio de Atividade do Fator Tecidual da Vesícula Extracelular
Neste Artigo
Resumo
Descrevemos aqui um ensaio in house de atividade do fator tecidual da vesícula extracelular. Ensaios baseados em atividade e ensaios baseados em antígenos têm sido usados para medir o fator tecidual em vesículas extracelulares de amostras de plasma humano. Os ensaios baseados em atividade têm maior sensibilidade e especificidade do que os ensaios baseados em antígenos.
Resumo
O fator tecidual (FT) é um receptor transmembrana para o fator (F) VII e FVIIa. O complexo TF/FVIIa inicia a cascata de coagulação ativando tanto o FIX quanto o FX. O FT é liberado das células para a circulação na forma de vesículas extracelulares (EVs). O nível de EVs TF-positivos (+) está aumentado em várias doenças, incluindo câncer, infecções bacterianas e virais e cirrose, e está associado a trombose, coagulação intravascular disseminada, gravidade da doença e mortalidade. Existem duas maneiras de medir os EVs TF+ no plasma: ensaios baseados em antígeno e atividade. Os dados indicam que os ensaios baseados em atividade têm maior sensibilidade e especificidade do que os ensaios baseados em antígenos. Este artigo descreve nosso ensaio interno de atividade de EVTF baseado em um ensaio de geração FXa de dois estágios. FVIIa, FX e cálcio são adicionados às amostras contendo TF+ EV para gerar FXa na presença e ausência de anticorpo anti-TF para distinguir a geração FXa TF-dependente da geração FXa TF-independente. Um substrato cromogênico clivado por FXa é usado para determinar o nível de FXa, enquanto uma curva padrão gerada com um TF recombinante relipidado é usada para a determinação da concentração de FT. Este ensaio interno de atividade de EVTF tem maior sensibilidade e especificidade do que um ensaio comercial de atividade de FT.
Introdução
A coagulação sanguínea é iniciada com a ligação do fator (F) VII/VIIa ao fator tecidual (FT)1. O complexo TF/FVIIa ativa tanto o FIX quanto o FX para ativar a coagulação sanguínea1. Existem duas formas de TF completo, ligado à membrana: criptografado e ativo. Além disso, há uma forma alternativamente emendada de FT (asTF). A esfingomielina e a fosfatidilcolina no folheto externo da membrana celular mantêm os FT criptografados 2,3,4. Quando as células são ativadas ou danificadas, a scramblase fosfolipídica transfere fosfatidilserina e outros fosfolipídios carregados negativamente para o folheto externo1. A ativação celular também resulta na translocação da esfingomielinase ácida para o folheto externo, onde degrada a esfingomielina em ceramida5. Esses dois mecanismos convertem o TF criptografado para a forma ativa. Propõe-se também que a proteína dissulfeto isomerase medeia a formação de ligações dissulfeto entre Cys186 e Cys209 em FT criptografados, o que resulta na descriptografia de FT6,7,8. A ASTF também está presente na circulação, mas não possui o domínio transmembrana e, portanto, é solúvel 9,10. É importante ressaltar que o TF tem níveis muito baixos de atividade pró-coagulante em comparação com o TF ativo de comprimento total10,11.
As vesículas extracelulares (EVs) são liberadas das células do hospedeiro em repouso, ativadas e moribundas, bem como das células cancerígenas12. Os EVs expressam proteínas de suas células parentais12. Os EVs ativos portadores de FT são liberados de monócitos ativados, células endoteliais e células tumorais para a circulação 13,14,15. Os níveis de FT no plasma podem ser medidos por ensaios baseados em atividade e antígeno. Os ensaios baseados em antígenos incluem ELISA e citometria de fluxo16. Existem dois ensaios diferentes baseados em atividades: ensaios de atividade de TF de um e dois estágios. O ensaio de um estágio é baseado em um ensaio de coagulação à base de plasma. A amostra contendo TF é adicionada ao plasma e o tempo para formar um coágulo é medido após a recalcificação. O ensaio de dois estágios mede a geração FXa de amostras adicionando FVII ou FVIIa, FX e cálcio. Os níveis de FXa são determinados usando um substrato que é clivado por FXa.
Nos ensaios de atividade de FT em um e dois estágios, a concentração de FT é determinada usando uma curva padrão gerada com FT recombinante. Os ensaios em dois estágios têm maior sensibilidade e especificidade do que os ensaios em um estágio. Muitos estudos têm confirmado que ensaios baseados em atividade têm maior sensibilidade e especificidade do que ensaios baseados em antígenos17,18,19,20,21. Além disso, nosso ensaio de atividade interna tem maior sensibilidade e especificidade do que um ensaio de atividade comercial22. Indivíduos saudáveis têm níveis muito baixos ou indetectáveis de atividade da EVTF no plasma. Em contraste, indivíduos com condições patológicas, como câncer, cirrose, sepse e infecção viral, apresentam níveis detectáveis de atividade da FVE, o que está associado à trombose, coagulação intravascular disseminada, gravidade da doença e mortalidade 23,24,25,26,27,28. Aqui, descreveremos este ensaio interno de atividade de EVTF em dois estágios.
Protocolo
A pesquisa foi aprovada pelo Comitê de Ética em Pesquisa da University of North Carolina at Chapel Hill (número do protocolo: 14-2108).
1. Coleta de sangue de doadores
- Coletar sangue total usando punção venosa limpa na veia antecubital com uma agulha 21 G. Descarte os primeiros 3 mL de sangue, pois essa porção de sangue pode conter FT das células perivasculares.
- Extrair 2,7 ou 1,8 ml (dependendo do tamanho dos tubos) de sangue num vacutainer contendo 3,2% de citrato de sódio (0,109 mol/L). Não encha demais ou subencha os tubos. Inverter suavemente os tubos imediatamente após a coleta de sangue para dispersar o citrato de sódio.
- Evite agitação se os tubos forem transportados antes do processamento. Preparar o plasma dentro de 2 h após a coleta de sangue.
2. Preparação do plasma de controle negativo
NOTA: As amostras não devem ser colocadas no gelo em nenhum momento antes do congelamento final.
- Preparar plasma de controle negativo usando sangue total de voluntários saudáveis. Imediatamente após a coleta de sangue, preparar o plasma livre de plaquetas da seguinte maneira.
- Transfira amostras de sangue dos tubos de vacutainer para tubos de 15 mL.
- Centrifugar amostras de sangue a 2.500 × g por 15 min à temperatura ambiente (20-24 °C) sem freio.
- Transfira o sobrenadante (plasma pobre em plaquetas) para um novo tubo e repita o spin nas mesmas condições.
- Transfira o sobrenadante (plasma empobrecido de plaquetas) para um novo tubo.
- Alíquota da amostra em alíquotas de ≥100 μL. Deixe aproximadamente 100 μL no fundo do tubo.
- Congelar imediatamente o plasma depletado de plaquetas a −80 °C (Figura 1).
3. Preparação do plasma de controle positivo
NOTA: A resposta ao lipopolissacarídeo é variável entre os indivíduos.
- Transfira amostras de sangue dos vacutainers para tubos de 15 mL.
- Preparar plasma de controle positivo usando sangue total de voluntários saudáveis estimulados com lipopolissacarídeo (LPS) de Escherichia coli O111:B4 (10 μg/mL) por 5 h a 37 °C com agitação.
- Após 5 h de incubação, siga os passos 2.1.2 a 2.1.6.
4. Isolamento de vesículas extracelulares do plasma
NOTA: Os pellets de EV podem não estar visíveis. O tempo de descongelamento é dependente do volume da amostra, mas geralmente descongelamos 100 μL de plasma por 30 min a 37 °C.
- Descongelar amostras de plasma a 37 °C.
- Adicionar 1 mL de HBSA sem tampão [HBSA-Ca(-)] de cálcio [NaCl 137 mM, KCl 5,38 mM, glicose 5,55 mM, HEPES 10 mM, albumina de soro bovino a 0,1% (p/v)] a cada 100 μL de amostra de plasma em um tubo de 1,5 mL.
- Centrifugar amostras de plasma a 20.000 × g durante 15 min a 4 °C.
- Aspirar o sobrenadante até 20 μL sem perturbar a pastilha de EV.
- Reconstituir o pellet de EV adicionando 1 mL de tampão HBSA-Ca(-) a cada tubo, pipetar para cima e para baixo no local do pellet de EV e vórtice cada tubo antes de centrifugar pela segunda vez a 20.000 × g por 15 min a 4 °C.
- Aspirar o sobrenadante até 20 μL sem perturbar a pastilha de EV.
- Reconstituir a pastilha de EV em 80 μL de HBSA-Ca(-) e pipetar para cima e para baixo no local da pastilha de EV (Figura 2).
5. Opção: Isolamento de pequenas vesículas extracelulares usando ultracentrífuga
- Após o passo 4.3, recolher o sobrenadante e a ultracentrífuga a 100.000 × g durante 70 min a 4 °C.
- Aspirar o sobrenadante até 20 μL sem perturbar a pastilha de EV.
- Reconstituir o pellet de EV adicionando 1 mL de tampão HBSA-Ca(-) a cada tubo e vórtice cada tubo antes de ultracentrifugar pela segunda vez a 100.000 × g por 70 min a 4 °C.
- Aspirar o sobrenadante até 20 μL sem perturbar a pastilha de EV.
- Reconstituir a pastilha de EV em 80 μL de HBSA-Ca(-).
6. Mensuração da atividade do fator tecidual da vesícula extracelular
NOTA: As amostras de EV devem ser pipetadas e bem agitadas para misturar antes de adicionar aos poços. EDTA-dissódico inibirá a capacidade do FXa de clivar o substrato cromogênico. Por conseguinte, o EDTA-dissódico não pode ser utilizado como substituto do EDTA-tetrassódico no passo 6.7.
- Adicionar 40 μL de uma amostra de EV a dois poços de uma placa de 96 poços.
- Adicionar 11 μL de um IgG inibitório de camundongo anti-humano TF [(36,4 μg/mL, concentração final 7,8 μg/mL)] a um poço de uma amostra de EV e 11 μL de IgG de camundongo controle [(36,4 μg/mL, concentração final 7,8 μg/mL)] ao outro poço.
- Incubar a placa de 96 poços por 15 min à temperatura ambiente.
- Durante o tempo de incubação, preparar 50 μL/poço dos padrões de FT (0; 0,32; 0,63; 1,25; 2,5; 5; 10 e 20 pg/mL) em duplicata utilizando FT relípidos recombinantes.
- Preparar a mistura de fatores misturando 4 mL de HBSA com cálcio [HBSA-Ca(+)] [HBSA-Ca(-) + 10 mM CaCl2, concentração final 10 mM], 800 μL de 900 nM FX em HBSA-Ca(+) (concentração final: 146,4 nM), e 120 μL de 200 nM FVIIa em HBSA-CA(+) (concentração final: 4,8 nM).
- Adicionar 50 μL da solução de mistura de fatores a cada poço, cobrir a placa com filme e incubar durante 2 h numa incubadora a 37 °C.
- Após 2 h, interromper a geração de FXa adicionando 25 μL de tampão de ácido etilenodiaminotetracético (EDTA) HBSA [HBSA-Ca(-) + 25 mM EDTA-tetrassódico, concentração final de 5 mM] e incubar por 5 min à temperatura ambiente.
- Reconstituir o substrato cromogênico clivado por FXa a 4mM (adicionar 8,7 mL de água destilada a um frasco para injetáveis de 25 mg).
- Adicionar 25 μL da solução do substrato cromogênico a cada poço, cobrir a placa com filme e, em seguida, com papel alumínio para protegê-la da luz e incubar por 15 min a 37 °C.
- Após 15 min de incubação, remover as bolhas com uma agulha ou por centrifugação a 1.500 × g por 1 min.
- Leia a placa a 405 nm usando um leitor de placas com uma mistura antes de ler.
- Converter a geração FXa de cada poço em atividade de TF usando a curva padrão gerada usando TF recombinante relipidado.
- Calcule a geração FXa dependente de TF (atividade EVTF) usando a equação (1):
Geração de FXa dependente de TF (atividade de EVTF [pg/mL]) = Geração total de FXa (poço de IgG de controle) - Geração de FXa independente de TF (poço anti-TF IgG) (Figura 3) (1)
Resultados
Um resultado bem-sucedido fornece um valor de controle positivo de ≥0,5 pg/mL e um valor de controle negativo de <0,5 pg/mL. É melhor encontrar um respondedor de LPS alto com atividade de >1,0 pg/mL EVTF para um controle positivo. O resultado representativo mostra a atividade EVTF de EVs isolados do plasma do sangue total de 11 doadores saudáveis, com e sem ativação do LPS (Figura 4). Seis dos onze doadores (Doadores 2, 4, 5, 8, 10, 11) responderam de médio a alto LPS, enquanto cinco dos onze doadores (Doadores 1, 3, 6, 7, 9) responderam ao LPS baixo.

Figura 1: Preparação do plasma depletado de plaquetas. A figura foi modificada de Hisada e Mackman29. Abreviação: PDP = plasma depletado de plaquetas. Clique aqui para ver uma versão maior desta figura.

Figura 2: Isolamento das vesículas extracelulares do plasma depletado de plaquetas. A figura foi modificada de Hisada e Mackman29. Abreviações: PDP = plasma depletado de plaquetas; EVs = vesículas extracelulares. Clique aqui para ver uma versão maior desta figura.
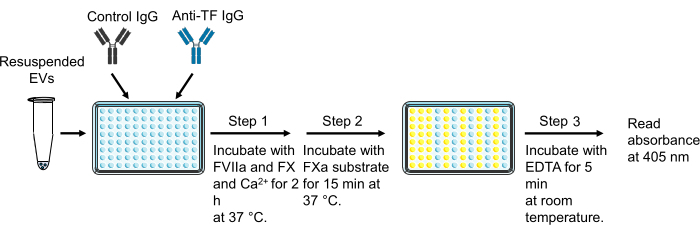
Figura 3: Medida da atividade do fator tecidual da vesícula extracelular. A figura foi modificada de Hisada e Mackman29. Abreviações: TF = fator tecidual; EVs = vesículas extracelulares. Clique aqui para ver uma versão maior desta figura.

Figura 4: Atividade EVTF do plasma do sangue total de 11 doadores saudáveis, com e sem ativação do LPS. A ativação do LPS foi realizada na mesma condição do controle positivo. O controle positivo foi de um respondedor conhecido do LPS, enquanto as respostas ao LPS de 11 doadores saudáveis não eram conhecidas no momento do experimento. Barras brancas e pretas indicam com e sem ativação de LPS, respectivamente. Abreviações: EVTF = extracellular vesicle tissue factor; LPS = lipopolissacarídeo. Clique aqui para ver uma versão maior desta figura.
Tabela 1: Um resumo dos estudos comparando este ensaio interno de atividade de EVTF, um ELISA comercial de TF e um ensaio de atividade. Abreviações: EVTF = extracellular vesicle tissue factor; ELISA = ensaio imunoenzimático. Clique aqui para baixar esta tabela.
Discussão
Aqui, o protocolo do nosso ensaio interno de atividade EVTF é apresentado. Há três etapas críticas no protocolo. Ao reconstituir a pelota de EV, é importante pipetar para cima e para baixo no local da pelota de EV, mesmo que ela não seja visível. A reconstituição incompleta da pastilha de EV resultará em um falso negativo ou subestimação dos valores de atividade de EVTF das amostras. Em segundo lugar, o uso de HBSA-Ca(+) é crítico na etapa 6.5 do protocolo porque a geração FXa não pode ser gerada sem cálcio. Em terceiro lugar, o uso de EDTA-tetrassódico, mas não EDTA-dissódico para interromper a geração de FXa é crítico porque este último inibe a capacidade do FXa de clivar o substrato cromogênico.
Recomendamos o seguinte método de armazenamento e uso para cada reagente. Armazenamos os tampões de ensaio e o substrato reconstituído a 4 °C e os usamos repetidamente até ficarmos sem eles. Se não ficarmos sem o substrato dentro de 2-3 semanas, descartamos porque ele fica amarelo. Armazenamos TF recombinante, anticorpos, FVIIa e FX a -80 °C e recomendamos fazer alíquotas para um ensaio para evitar um ciclo de congelamento-descongelamento.
Em um estudo preliminar, deixamos amostras de plasma por 9 h à temperatura ambiente, as recongelamos a -80 °C durante a noite e realizamos o ensaio no dia seguinte. Como controle, descongelamos o mesmo plasma e o recongelamos imediatamente. Descobrimos que a amostra deixada por 9 h à temperatura ambiente teve uma diminuição de 16% na atividade da EVTF em comparação com a que foi descongelada e recongelada imediatamente (Hisada e Mackman, dados não publicados de 2017).
Além da diferença na resposta ao LPS, a diferença na concentração de EVs no plasma de doadores individuais pode explicar a diferente atividade de EVTF de diferentes doadores. De fato, observamos algumas variações nas concentrações de EVs no plasma a partir de sangue total estimulado por LPS (1,9 ± 0,6 × 1010 partículas/mL, n = 6, média ± desvio padrão)30.
Este ensaio interno de atividade EVTF tem várias características que os ensaios comerciais não têm. Primeiro, o ensaio usa um anticorpo anti-TF para distinguir a geração FXa TF-dependente da geração FXa TF-independente. Três ensaios de atividade comercial são reivindicados para medir a atividade de FT no plasma, mas nenhum deles usa anticorpos anti-TF16. Portanto, esses ensaios comerciais simplesmente medem a geração FXa total, mas não a geração FXa dependente de TF. Em segundo lugar, usamos 2,4 nM de FVIIa (a concentração final na reação) para minimizar a geração de FXa independente de FT por FVIIa. Um ensaio de atividade comercial utiliza 12 nM de FVIIa na reação, o que dá um fundo alto22. De fato, o FVIIa ativa linearmente o FX dependendo da concentração de FVIIa na ausência de TF31. Resumimos os estudos que compararam este ensaio interno de atividade de EVTF e ELISA comercial de TF e um ensaio de atividade na Tabela 1.
Quatro classificações de resposta da atividade da EVTF para plasma pobre em plaquetas citrato são propostas: zero (0 a <0,5 pg/mL); fraca (0,5 a <1,0 pg/mL), moderada (1,0 a <2,0 pg/mL) e forte (≥2,0 pg/mL)23. Notavelmente, diferentes anticoagulantes afetam os resultados dos ensaios de atividade de EVTF. Por exemplo, níveis mais elevados de atividade de EVTF foram observados usando heparina após estimulação com LPS em comparação com citrato de sódio (Doador A: 4,6 (citrato) vs 28,6 (heparina) pg/mL e Doador B: 3,4 (citrato) vs 26,0 (heparina) pg/mL, respectivamente, dados não publicados de Hisada e Mackman de 2017). Em contraste, níveis mais baixos de atividade de EVTF foram observados usando EDTA após estimulação com LPS em comparação com citrato de sódio (Doador C: 3,9 (citrato) vs 1,4 (EDTA) pg/mL, Doador D: 3,8 (citrato) vs 0,4 (EDTA) pg/mL, respectivamente, Tatsumi e Mackman dados não publicados 2016). Esses resultados indicam que os dados de atividade da EVTF não são comparáveis quando diferentes anticoagulantes são usados.
Existem algumas limitações para o método. O coeficiente de variação (CV) é relativamente alto em comparação com ensaios clínicos. De fato, o CV para o controle positivo em sete estudos independentes foi de 24%17,29. Isolamento de EVs usando pellets de centrifugação não apenas EVs, mas também debris celulares. Previamente analisamos o pellet de plasma rico em plaquetas por microscopia eletrônica de transmissão e observamos plaquetas, EVs e debris celulares32. Usamos um rotor de ângulo fixo e não experimentamos um rotor oscilante para centrifugação de 20.000 × g. Descobrimos recentemente que pequenos EVs que podem ser peletizados com 100.000 × g, mas não com 20.000 × g têm atividade EVTF em pacientes com câncer de pâncreas e COVID-1930. Isso indica que esse protocolo não mede a atividade da EVTF a partir de pequenas VEs, como exossomos. Notavelmente, os exossomos são EVs ricos em esfingomielina e a presença de exossomos portadores de FT tem sido relatada 30,33,34,35. Recomendamos a peletização de EVs no plasma usando 100.000 × g para determinar com mais precisão a quantidade total de atividade de EVTF na amostra. Vale ressaltar que requer uma ultracentrífuga e um tempo de ensaio maior, pois o tempo de centrifugação aumenta de 15 min para 70 min.
Este método pode ser aplicado a amostras de plasma de qualquer tipo de doença. A atividade da EVTF está associada à gravidade da doença e à sobrevida em pacientes com diferentes doenças, incluindo câncer, COVID-19, infecção bacteriana e cirrose 23,26,27.
Divulgações
Não há interesses concorrentes a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo NIH NHLBI R35HL155657 (N.M.) e pela cátedra John C. Parker (N.M.). Gostaríamos de agradecer à Sra. Sierra J. Archibald por seus comentários úteis
Materiais
| Name | Company | Catalog Number | Comments |
| 1.5 mL tube for 20,000 x g centrifuge | any company | N/A | We use the one from Fisher Scientific (Catalog number: 05-408-129). |
| 1.5 mL tube for ultracentrifuge | any company | N/A | We use the one from Beckman Coulter (Catalog number: 357448) |
| 15 mL tube | any company | N/A | We use the one from VWR (Catalog number: 89039-666) |
| 21 G x .75 in. BD Vacutainer Safety-Lok Blood Collection Set with 12 in. tubing and luer adapter | BD | 367281 | |
| 96-well plate | any company | N/A | We use the one from Globe Scientific (Catalog number: 120338). |
| BD Vacutainer Citrate Tubes | BD | 363083 | |
| Bovine serum albumin | Sigma Aldrich | A9418 | |
| Calcium chloride | Fisher Scientific | C69-500 | |
| Centrifuge for 1.5 mL tube | any company | N/A | We use the Centrifuge 5417R (Eppendorf). |
| Centrifuge for 15 mL tube | any company | N/A | We use the Centrifuge 5810R (Eppendorf). |
| D-(+)-Glucose | Sigma Aldrich | G7021 | |
| Ethylenediaminetetraacetic acid tetrasodium salt dihydrate | Sigma Aldrich | E6511 | |
| Hepes | Sigma Aldrich | H4034 | |
| Human FVIIa | Enzyme Research Laboratory | HFVIIa | The solution should be diluted with HBSA-Ca(+). |
| Human FX | Enzyme Research Laboratory | HFX1010 | The solution should be diluted with HBSA-Ca(+). |
| Inhibitory mouse anti-human tissue factor IgG, clone HTF-1 | Fisher Scientific | 550252 | |
| Lipopolysaccharide from Escherichia coli O111:B4 | Sigma Aldrich | L2630 | There are several lipopolysaccharide from different E. coli. Different lipopolysaccharide have different potential to activate monocytes. |
| Mouse IgG | Sigma Aldrich | I5381 | |
| Pefachrome FXa 8595 | Enzyme Research Laboratory | 085-27 | |
| Plate reader | any company | N/A | We use the SpectraMax i3x from Molecular Devices |
| Re-lipidated recombinant tissue factor, Dade Innovin | Siemens | 10873566 | |
| Sodium chloride | Fisher Scientific | S271-500 | |
| Ultracentrifuge | Beckman Coulter | Optima TLX | |
| Ultracentrifuge rotor | Beckman Coulter | TLA-55 |
Referências
- Grover, S. P., Mackman, N. Tissue factor: an essential mediator of hemostasis and trigger of thrombosis. Arteriosclerosis, Thrombosis, and Vascular Biology. 38 (4), 709-725 (2018).
- Shaw, A. W., Pureza, V. S., Sligar, S. G., Morrissey, J. H. The local phospholipid environment modulates the activation of blood clotting. Journal of Biological Chemistry. 282 (9), 6556-6563 (2007).
- Tavoosi, N., et al. Molecular determinants of phospholipid synergy in blood clotting. Journal of Biological Chemistry. 286 (26), 23247-23253 (2011).
- Wang, J., Pendurthi, U. R., Rao, L. V. M. Sphingomyelin encrypts tissue factor: ATP-induced activation of A-SMase leads to tissue factor decryption and microvesicle shedding. Blood Advances. 1 (13), 849-862 (2017).
- Kornhuber, J., Rhein, C., Muller, C. P., Muhle, C. Secretory sphingomyelinase in health and disease. Biological Chemistry. 396 (6-7), 707-736 (2015).
- Versteeg, H. H., Ruf, W. Tissue factor coagulant function is enhanced by protein-disulfide isomerase independent of oxidoreductase activity. Journal of Biological Chemistry. 282 (35), 25416-25424 (2007).
- Reinhardt, C., et al. Protein disulfide isomerase acts as an injury response signal that enhances fibrin generation via tissue factor activation. Journal of Clinical Investigation. 118 (3), 1110-1122 (2008).
- Langer, F., et al. Rapid activation of monocyte tissue factor by antithymocyte globulin is dependent on complement and protein disulfide isomerase. Blood. 121 (12), 2324-2335 (2013).
- Bogdanov, V. Y., et al. Alternatively spliced human tissue factor: a circulating, soluble, thrombogenic protein. Nature Medicine. 9 (4), 458-462 (2003).
- Mackman, N. Alternatively spliced tissue factor - one cut too many. Thrombosis and Haemostasis. 97 (1), 5-8 (2007).
- Censarek, P., Bobbe, A., Grandoch, M., Schror, K., Weber, A. A. Alternatively spliced human tissue factor (asHTF) is not pro-coagulant. Thrombosis and Haemostasis. 97 (1), 11-14 (2007).
- Gyorgy, B., et al. Membrane vesicles, current state-of-the-art: emerging role of extracellular vesicles. Cellular and Molecular Life Sciences. 68 (16), 2667-2688 (2011).
- Osterud, B., Bjorklid, E. Tissue factor in blood cells and endothelial cells. Frontiers in Bioscience (Elite Edition). 4 (1), 289-299 (2012).
- Hisada, Y., Mackman, N. Cancer cell-derived tissue factor-positive extracellular vesicles: biomarkers of thrombosis and survival. Current Opinion in Hematology. 26 (5), 349-356 (2019).
- Vatsyayan, R., Kothari, H., Pendurthi, U. R., Rao, L. V. 4-Hydroxy-2-nonenal enhances tissue factor activity in human monocytic cells via p38 mitogen-activated protein kinase activation-dependent phosphatidylserine exposure. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (7), 1601-1611 (2013).
- Mackman, N., Sachetto, A. T. A., Hisada, Y. Measurement of tissue factor-positive extracellular vesicles in plasma: strengths and weaknesses of current methods. Current Opinion in Hematology. 29 (5), 266-274 (2022).
- Lee, R. D., et al. Pre-analytical and analytical variables affecting the measurement of plasma-derived microparticle tissue factor activity. Thrombosis Research. 129 (1), 80-85 (2012).
- Claussen, C., et al. Microvesicle-associated tissue factor procoagulant activity for the preoperative diagnosis of ovarian cancer. Thrombosis Research. 141, 39-48 (2016).
- Mackman, N., Hisada, Y., Archibald, S. J., et al. Tissue factor and its procoagulant activity on cancer-associated thromboembolism in pancreatic cancer: Comment by Mackman et al. Cancer Science. 113 (5), 1885-1887 (2022).
- Sachetto, A. T. A., et al. Evaluation of four commercial ELISAs to measure tissue factor in human plasma. Research and Practice in Thrombosis and Haemostasis. 7 (3), 100133 (2023).
- Archibald, S. J., Hisada, Y., Bae-Jump, V. L., Mackman, N. Evaluation of a new bead-based assay to measure levels of human tissue factor antigen in extracellular vesicles in plasma. Research and Practice in Thrombosis and Haemostasis. 6 (2), e12677 (2022).
- Tatsumi, K., et al. Evaluation of a new commercial assay to measure microparticle tissue factor activity in plasma: communication from the SSC of the ISTH. Journal of Thrombosis and Haemostasis. 12 (11), 1932-1934 (2014).
- Hisada, Y., et al. Measurement of microparticle tissue factor activity in clinical samples: A summary of two tissue factor-dependent FXa generation assays. Thrombosis Research. 139, 90-97 (2016).
- Tatsumi, K., Hisada, Y., Connolly, A. F., Buranda, T., Mackman, N. Patients with severe orthohantavirus cardiopulmonary syndrome due to Sin Nombre Virus infection have increased circulating extracellular vesicle tissue factor and an activated coagulation system. Thrombosis Research. 179, 31-33 (2019).
- Schmedes, C. M., et al. Circulating Extracellular Vesicle Tissue Factor Activity During Orthohantavirus Infection Is Associated With Intravascular Coagulation. Journal of Infectious Diseases. 222 (8), 1392-1399 (2020).
- Rosell, A., et al. Patients with COVID-19 have elevated levels of circulating extracellular vesicle tissue factor activity that is associated with severity and mortality-Brief report. Arteriosclerosis, Thrombosis, and Vascular Biology. 41 (2), 878-882 (2021).
- Campbell, R. A., et al. Comparison of the coagulopathies associated with COVID-19 and sepsis. Research and Practice in Thrombosis and Haemostasis. 5 (4), e12525 (2021).
- Guervilly, C., et al. Dissemination of extreme levels of extracellular vesicles: tissue factor activity in patients with severe COVID-19. Blood Advances. 5 (3), 628-634 (2021).
- Hisada, Y., Mackman, N. Measurement of tissue factor activity in extracellular vesicles from human plasma samples. Research and Practice in Thrombosis and Haemostasis. 3 (1), 44-48 (2019).
- Sachetto, A. T. A., et al. Tissue factor activity of small and large extracellular vesicles in different diseases. Research and Practice in Thrombosis and Haemostasis. 7 (3), 100124 (2023).
- Bom, V. J., Bertina, R. M. The contributions of Ca2+, phospholipids and tissue-factor apoprotein to the activation of human blood-coagulation factor X by activated factor VII. Biochemical Journal. 265 (2), 327-336 (1990).
- Tilley, R. E., Holscher, T., Belani, R., Nieva, J., Mackman, N. Tissue factor activity is increased in a combined platelet and microparticle sample from cancer patients. Thrombosis Research. 122 (5), 604-609 (2008).
- Gurung, S., Perocheau, D., Touramanidou, L., Baruteau, J. The exosome journey: from biogenesis to uptake and intracellular signalling. Cell Communication and Signaling. 19 (1), 47 (2021).
- Garnier, D., et al. Cancer cells induced to express mesenchymal phenotype release exosome-like extracellular vesicles carrying tissue factor. Journal of Biological Chemistry. 287 (52), 43565-43572 (2012).
- Park, J. A., et al. Tissue factor-bearing exosome secretion from human mechanically stimulated bronchial epithelial cells in vitro and in vivo. Journal of Allergy and Clinical Immunology. 130 (6), 1375-1383 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados