Method Article
Rekombinant Protein Üretimi için Leishmania Tarentolae Türetilmiş Hücresiz Protein Ekspresyon Sistemi olan LTE'nin Üretimi ve Optimizasyonu
Bu Makalede
Özet
Leishmania Translasyonel Ekstrakt (LTE), tek hücreli parazit Leishmania tarentolae'den türetilen ökaryotik hücresiz bir protein ekspresyon sistemidir. Bu optimize edilmiş protokol, LTE'nin üretimini basit ve uygun maliyetli hale getirir. Karmaşık ökaryotik proteinlerin ve bunların etkileşimlerinin çok paralel ekspresyonu ve çalışmasına odaklanan çeşitli uygulamalar için uygundur.
Özet
Bu protokol, Leishmania Translasyonel Özü veya LTE olarak adlandırılan tek hücreli kamçılı Leishmania tarentolae'den türetilen ökaryotik Hücresiz Protein Ekspresyon Sisteminin (CFPS) üretimini ve optimizasyonunu ana hatlarıyla belirtir. Bu organizma başlangıçta bir kertenkele paraziti olarak evrimleşmiş olsa da, şişelerde veya biyoreaktörlerde kolay ve ucuz bir şekilde yetiştirilebilir. Leishmania major'dan farklı olarak, insanlar için patojenik değildir ve özel laboratuvar önlemleri gerektirmez. CFPS için Leishmania kullanmanın bir başka avantajı, CFPS'ye tek bir antisens oligonükleotidin eklenmesinin, tüm protein kodlayan RNA'ların 5'-ucunda korunmuş bir ekleme lideri dizisini hedeflemesinin, endojen protein ekspresyonunu baskılayabilmesidir. Önceki sürümlere kıyasla basitleştirilmiş ve geliştirilmiş hücre bozulması ve lizat işleme için prosedürler sunuyoruz. Bu işlemler basit şişe kültürleri ile başlar. Ek olarak, türden bağımsız translasyon başlatma bölgeleri (SITS) içeren vektörler kullanılarak genetik bilginin nasıl tanıtılacağını ve tutarlı protein ekspresyon kalitesini sağlamak için basit parti optimizasyonu ve kalite kontrolünün nasıl gerçekleştirileceğini açıklıyoruz.
Giriş
1960'larda, hücresiz protein ekspresyon sistemleri, genetik kodun ortaya çıkarılmasında çok önemli bir rol oynadı1. Bununla birlikte, esas olarak E. coli'ye dayanan prokaryotik hücresiz protein ekspresyon sistemleri, şu anda hem laboratuvar hem de ticari uygulamalara hakimdir. E. coli bazlı sistemler maliyet etkinliği, ölçeklenebilirlik ve yüksek ekspresyon verimi gibi avantajlar sunarken, aktif formlarında çok alanlı proteinler üretirken ve protein komplekslerinin montajını kolaylaştırırkenzorluklarla karşılaşırlar 2,3. Günümüzde, yaygın olarak kullanılan ökaryotik Hücresiz Protein Sentezi (CFPS) formları arasında buğday tohumu özütü (WGE), tavşan retikülosit lizatı (RRL) ve böcek hücresi lizatı (ICL) bulunur4,5,6. Bu çalışma, tek hücreli kamçılı parazit Leishmania tarentolae'ye dayanan, hem basit hem de ölçeklenebilir alternatif bir ökaryotik hücresiz sistemi tanıtmaktadır.
Leishmania tarentolae , uygun maliyetli ortam kullanılarak şişelerde kolayca yetiştirilebilir ve ayrıca daha yüksek hücre yoğunluğu elde etmek için biyoreaktörlerde ölçeklendirilebilir. Hücre lizatında endojen mRNA'ların varlığı, aksi takdirde tanıtılan mesajlarla rekabet edebilecek, korunmuş Leishmania mRNA ek lideri dizisi7'yi hedefleyen antisens oligonükleotidler kullanılarak nötralize edilebilir. İnsan hastalığına neden olan yakın akrabası Leishmania majörden farklı olarak L. tarentolae , mağribi kertenkeleyi (Tarentolae mauritanica) enfekte ederek, özel önlemlere ihtiyaç duymadan PC2 laboratuvar ortamlarında yetiştiriciliğe uygun hale getirir. Daha önce in vivo protein ekspresyonu8 için transgenik bir organizma olarak kullanılmıştır.
Hücresiz sistemlerde şablon hazırlamayı kolaylaştırmak için, translasyonel başlatmayı geliştiren polimerik RNA yapılarına dayalı olarak evrensel diziler tasarlanmıştır9. Bu türden bağımsız çeviri dizileri (SITS) hem prokaryotik hem de ökaryotik hücresiz sistemlere uygulanabilir ve genetik bilgiyi LTE'ye dahil etmek için uygundur. Bu protokol, LTE hücresi içermeyen protein ekspresyonu için vektör yapımının ayrıntılı bir açıklamasını sağlamasa da, optimizasyon ve kalite kontrolü, SITS bölgesinin aşağı akışında istenen ilgili proteinlerin florofor füzyonlarını içeren uygun vektörler gerektirir. Bu amaçla, Ağ Geçidi klonlama bölgeleri kullanılarak istenen ilgilenilen proteine bir N-terminal eGFP füzyonunu kodlayan pCellFree_G03 vektör gibi uygun LTE vektörleri Addgene gen deposu ile biriktirilmiştir.
LTE, protein kendi kendine montajınınanalizi 10,16, insan integral zar proteinlerinin üretimi17, antiviral ilaç adaylarıüzerinde araştırma 18, biyoteknolojik olarak yararlı enzimlerin geliştirilmesi19, protein biyosensörlerininprototiplenmesi 20,21 ve kancalı kurtlardan elde edilen biyolojiklerin incelenmesi22 dahil olmak üzere protein ekspresyonu gerektiren çok çeşitli uygulamalarda değerini kanıtlamıştır. LTE, viroloji ve hücresel yapılar alanlarında Protein-Protein etkileşim ağlarının haritalanmasında da etkili olmuştur21,32. LTE, daha uygun maliyetli ve ölçeklenebilir üretim sunarken, tam uzunlukta, tek dağılmış ve toplanmamış proteinleri33 ifade etmede diğer ökaryotik hücresiz sistemlere benzer şekilde performans gösterecek şekilde kıyaslanmıştır.
Bu protokol, konakçı organizmayı yetiştirmek ve bozmak, lizat hazırlamak ve birleştirilmiş transkripsiyon / translasyon protein ekspresyonu için bir besleme çözeltisi (FS) takviyesi için teknikler sağlar. Ek olarak, üretim partilerini optimize etmek için bir protokol içerir. Leishmania hücresiz sisteminin ilk versiyonunda, ekspresyon seviyelerinde, tam uzunlukta proteinlerin fraksiyonunda ve protein agregatlarının varlığında istenmeyen partiden partiye varyasyon gözlendi ve bu da partilerinatılmasına yol açtı 34. Bu sorunu gidermek için daha sonraki protokol iyileştirmeleri yapıldı25. Mevcut protokol, bu iyileştirmeler üzerine inşa edilmiştir ve bireysel partilerin en yüksek protein ekspresyonu ve boyutu için optimize edilmesine izin verir. Bunu, hücre bozucu yüklemeyi yakından kontrol ederek (600 nm'de optik yoğunluk olarak ölçülür; OD600nm) ve 280 nm'de (Abs280nm) absorbans kullanarak elde edilen lizat çıkışını normalleştirmek. Ayrıca, üretim sırasında lizatın kısmen rNTP ve magnezyum ile desteklenmesi için bir yöntem içerir ve daha sonra test ifadeleri sırasında bu besleme çözeltisi bileşenlerinin optimizasyonu yapılır. Bu optimizasyon protokolde bir seçenek olarak sunulsa da yazarlar tarafından şiddetle tavsiye edilmektedir.
Protokol
Bu protokol, kültürlemeyi, santrifüjlemeyi, çok modlu bir plaka okuyucu kullanarak GFP floresansının ölçülmesini, OD600nm kültürünün ölçülmesini ve lizat Abs280nm'nin değerlendirilmesini içeren ayrıntılı ortam tariflerini ve adımlarını içerir. Ayrıca SDS-PAGE protein jellerinin kurulumunu ve görüntülenmesini de kapsar. Bu protokol için gerekli olan veya önerilen malzemeler, Malzemeler elektronik tablosunda listelenmiştir. Ortam bileşenleri, santrifüjler, tüpler, spektrofotometreler ve jel elektroforez kurulumları gibi tipik laboratuvar kaynaklarının, aksi belirtilmedikçe büyük olasılıkla birbirinin yerine kullanılabileceğini unutmamak önemlidir. Şekil 1 , LTE üretim sürecinin bir özetini sağlar.
Şekil 1: LTE üretim protokolüne genel bakış. Bu karikatür, LTE üretim protokolünün kısa bir özetini sunmaktadır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
1. Leishmania tarentolae kültürlerinin büyümesi
- En az 3 L TBGG büyüme ortamı hazırlayın (Baktotripton 12 g/L, Maya özütü 24 g/L, gliserol 8 mL/L, glikoz 1 g/L, KH2PO4 2,3 g/L, K2HPO4 2,5 g/L, bkz . Ortamı vakum veya benzer bir kurulum altında 0,22 μm'lik bir filtre kullanarak sterilize edin.
- Ortamı oda sıcaklığında (RT) saklayın, son ilaveler (Hemin, Antibiyotikler) L. tarentolae ile aşılamadan hemen önce eklenir. Hemin (% 50 trietanolamin içinde% 0.25 v / v),% 0.2 v / v, Penisilin (10.000 birim / mL) artı Streptomisin (10.000 μg / mL)% 0.5 v / v'de karıştırılır.
NOT: Bu protokolün başlangıç noktası, bakımı yapılan 2 x 10 mL'lik yabani tip L. tarentolae kültürüdür. Bakım kültürleri 27 °C'de standart 50 mL'lik doku kültürü şişelerinde düşük çalkalama (75 rpm) ile büyütülür. Bu tür 10 mL kültürler, her 2-3 günde bir steril (TBGG + hemin, penisilin, streptomisin) içinde ~ 1/20 seyreltme ile süresiz olarak korunabilir. Bir PC2 laboratuvarında standart bir biyogüvenlik kabini tavsiye edilir; bununla birlikte, bakteriyel kontaminasyonlar eklenen antibiyotikler tarafından önlenme eğilimindeyken, mantar kontaminasyonları genellikle L. tarentolae tarafından büyütülür. - İki gün boyunca, L. tarentolae bakım kültürlerini 200 mL'ye (1. gün) ve daha sonra her gün artan hacimde TBGG + hemin / antibiyotik ile 1: 10 dilüsyon yoluyla 2 L'ye (2. gün) genişletin. Her iki seyreltmeyi de otoklavla sterilize edilmiş şaşkın 5 L'lik cam şişelerde (maksimum 1 L'ye kadar doldurulmuş) gerçekleştirin. İkinci seyreltme, ertesi gün saat 8-11 arasında lizat üretimine başlamak amacıyla öğleden sonra 3-6 arasında yapılmalıdır.
NOT: Bu protokol, LTE üretimi için minimum başlangıç hacmini kullanır (2 x 1 L kültür). Ek bir genişletme adımı dahil ederek LTE üretimi için kültürü 10 L'ye kadar genişletmek de mümkündür (örneğin, Gün 1: 100 mL; 2. Gün: 1 L; 3. Gün: 10 L). Bu protokol, L. tarentolae'yi büyütmek için şaşkın şişeler (Malzeme Tablosuna bakınız) kullansa da, isteğe bağlı olarak, karıştırma hızının 100 rpm'nin altında tutulması koşuluyla, Rushton çarkları ile bakteri üremesi için tasarlanmış geleneksel biyoreaktörler kullanılabilir. Biyoreaktörlerde iyileştirilmiş havalandırma ve pH kontrolü genellikle L. tarentolae kültürlerinin log fazı büyümesini uzatır ve adım 1.4'te kullanılmak üzere600 nm'lik daha yüksek bir hasat OD 10'a izin verir. - Kültürün OD600nm'sini doğrudan spektrofotometre küvetinde TBGG'de 1:10 seyreltme yoluyla üç kopya halinde kaydedin. Lizat yapmak için uygun bir başlangıç aralığı OD600nm = 4.0-8.0'dır.
- OD600nm < 4.0 ise ek inkübasyon süresi sağlayın. OD600nm > 8'e sahip bir kültür kullanılabilir ve daha fazla hacimde hücresiz ekspresyon lizatı ile sonuçlanacaktır, ancak geç log büyüme fazının başlaması nedeniyle daha düşük kaliteye sahiptir. Kültür şişelerini buzun üzerine yerleştirin ve sonraki adımları bekleyin.
NOT: Nihai kültür OD600nm'nin doğru ölçümü, bozulmadan önce konsantre hücreler için nihai hacmi hesaplamak için kullanıldığından kritik öneme sahiptir. Bu hesaplama, protokolü basitleştirmek için kesinti34'ten önce hücre konsantrasyonunu kalibre etmek için LTE üretiminin önceki sürümlerinde kullanılan bir pelet tartım yönteminin yerini alır. OD600nm ölçümü için TBGG'de seyrelttiğinizden emin olun, aksi takdirde ozmotik şok hücre şeklini değiştirerek ölçüm hatasına neden olur. Pipet, spektrofotometrik okumayı yapmadan saniyeler önce OD600nm ölçümü için (doğrudan küvette) 1:10 seyreltmeyi karıştırın, çünkü L. tarentolae hücreleri belirgin bir bulutlu görünümle hızla yerleşir. İfade kültürünün nihai hacminin yaklaşık olduğu kabul edilirse, daha iyi bir tahmini hacim elde etmek için (1 g = 1 mL'de) hasatta şişelerin (uygun boş şişe dara ile) tartılması da önerilir. Şaşkın şişelerde L. tarentolae büyümesinden mümkün olan maksimum OD600nm 15-20'dir, ancak bu, sabit faza ulaşması nedeniyle lizat üretimi için uygun değildir.
2. L. tarentolae kültürlerinin konsantrasyonu
- Leishmania hücreleri, bozulmadan yaklaşık 60 kat önce yıkanmalı ve konsantre edilmelidir. Son konsantre için OD600nm = 300'e dayalı hücre konsantrasyonu için hedef hacmi hesaplayın. Denklem V = hasat hacmi (mL) x (hasat OD600nm/300). Örneğin, hasat OD600 = 5 olan 2 L'lik bir kültür kullanıldığında, hedef hacim 33 mL'dir.
NOT:300'lük OD 600nm hedefi değiştirilebilir; önceki LTE üretiminde 150-350 aralığında değerler kullanılmıştı. Bozulmaya giren daha yüksek hücre konsantrasyonları, daha yüksek protein verimleri ile nihai hücresiz ekspresyon reaksiyonları verme eğiliminde olacaktır, ancak savunmasız proteinlerin toplanma eğilimi artacaktır. OD600nm = 300, LTE üretimi için uygun bir varsayılan hedefi temsil eder. - Hasat edilen kültürleri uygun santrifüj şişelerine aktarın ve 4 °C'de 10 dakika boyunca 2500 x g'da döndürün. Süpernatanı dikkatlice kültür atığına boşaltın.
NOT: Bozulma yüklemesinin hesaplanmasını etkilediğinden, atılan süpernatanta hücre kaybını en aza indirmek önemlidir. Önceki LTE üretim protokollerinde, bozulma için L. tarentolae hücrelerinin konsantrasyonu, hücre konsantresinin bir test mikrosantrifüj tüpünde döndürülmesi ve toplam ağırlığakarşı pelet ağırlığının ölçülmesiyle kalibre edildi 34. Bu basitleştirilmiş protokol bunun yerine, ölçülen hasat OD600nm'ye dayalı olarak konsantre için teorik bir OD600nm hedefi kullanır ve hücre konsantrasyonu ve yıkama sırasında düşük hücre kaybını varsayar. - Hücre peletini SEB tamponunda (45 mM HEPES-KOH pH 7.6, 250 mM sükroz, 100 mM KOAc, 3 mM Mg(OAc)2, buz üzerinde tutulur) üç kez yıkayın, her seferinde 2500 x g'da 4 ° C'de 10 dakika santrifüjleyin. İlk yıkama için, her 1 L peletlenmiş kültürü 100 mL SEB tamponunda yeniden süspanse edin, ardından bunları tek bir santrifüj şişesinde birleştirin. İkinci yıkama için, orijinal kültürün her 1 L'si için 100 mL SEB kullanın.
NOT: Son pelet yeniden süspansiyonu için, nihai hedef yeniden süspansiyon hacminin %50'sine SEB tamponu ekleyin (adım 2.1). Bu, havuzlanan konsantrenin adım 2.4'teki tam olarak nihai hedef hacme kadar dikkatli bir şekilde doldurulmasını sağlar. L. tarentolae'nin erken parçalanmasını önlemek için her bir yeniden süspansiyon mümkün olduğunca yumuşak olmalıdır, örneğin, eklenen SEB'yi boşaltılan peletin etrafında hafifçe döndürerek veya SEB'yi santrifüj tüpü duvarına yapışan pelet üzerine pipetleyerek. Son adım için süpernatantları daha küçük santrifüj tüplerine aktarmak daha uygun olabilir. - Yeniden süspanse edilmiş konsantreyi uygun bir yıkanmış cam hacimsel silindire dökün, ardından ilave soğuk SEB kullanarak hacmi hedef hacme (adım 2.1) doldurun ve hafifçe karıştırın.
3. L. tarentolae konsantresinin parçalanması
- Hücre konsantresini önceden 4 °C'ye soğutulmuş nitrojen kavitasyon cihazına aktarın (Malzeme Tablosuna bakınız), 70 bar nitrojene basınçlandırın ve buz üzerinde 45 dakika inkübe edin.
NOT: Nitrojen kavitasyon bozucular yaygın laboratuvar öğeleri olmasa da, LTE üretimi için önerilir. Hücresel donma-çözülme ve French-press tipi bozucular gibi alternatif yöntemler denenmiş; Bununla birlikte, protein ekspresyon aktivitesi, nitrojen kavitasyon yönteminin kullanılmasına kıyasla% <50 idi. Nitrojen kavitasyon cihazı, bu adımdan itibaren hücre lizatı ile temas eden tüm yeniden kullanılan kaplara (alıcı şişesi gibi) benzer şekilde, kullanımdan önce ve çalışmalar arasında iyice temizlenmelidir. Uygun bir temizleme rejimi, laboratuvar deterjanları ile yıkamayı ve ardından deiyonize su ile iyice durulamayı içerir. - Nitrojen kavitasyon cihazındaki havalandırma deliğini açın ve elde edilen lizatı buz üzerinde bir vakum alıcı şişesi gibi uygun şekilde sağlam bir kaba boşaltın. Elde edilen tüm lizatın çökeldiğinden ve yeni bir santrifüj tüpüne veya benzer bir kaba pipetlenebildiğinden emin olmak için alıcı şişesini eğin.
DİKKAT: Nitrojen kavitasyon bozucular, hücre konsantresinin 70 bar nitrojenden ortam basıncına ani geçişine dayanır, bu da cihazın çıkış valfinden güçlü bir önce sıvı ve ardından nitrojen akışıyla elde edilir. Havalandırma, kimyasal güvenlik başlığında uygun kişisel koruyucu ekipman (KKD) ile yapılmalıdır. Hedef kabın kırılma ve lizatı kaybetme riski vardır, bu nedenle jenerik bir şişe yerine sağlam bir vakum alıcısı kullanıyoruz. Cihazın çıkış valfi bir tüp ise, havalandırma noktasında aşırı basınç oluşmasını önlemek için tüpü doğrudan alıcının içine yerleştirmekten kaçının.
4. Hücre lizatının santrifüjlenmesi
- Lizatı uygun g kuvvetine dayanıklı santrifüj tüplerine aktarın ve 4 ° C'de 15 dakika boyunca 10.000 x g'da santrifüjleyin. Süpernatanı taze, benzer santrifüj tüplerine çıkarın.
- Lizatı 4 ° C'de 15 dakika boyunca 30.000 x g'da santrifüjleyin ve ardından son süpernatanı taze bir santrifüj tüpüne veya buz üzerine yerleştirilmiş benzer bir kaba çıkarın. Toplam hacmi tahmin edin.
5. Hücre lizatının jel filtrasyonu
NOT: Jel filtrasyonu, SEB tamponunda bulunan sakarozun çıkarılması için kullanılır. Sükroz, hücre bozulması sırasında hücresel mekanizmanın stabilize edilmesine yardımcı olurken, protein ekspresyon reaksiyonlarında tutulursa verimi düşürür.
- Yeterli sayıda PD-10 yerçekimi beslemeli jel filtrasyon kolonunu (Malzeme Tablosuna bakınız), bir toplama tepsisine veya altındaki benzer bir kaba damlamalarına izin veren bir raf biçiminde kurun ve tüm lizat hacmini sütun başına 2,5 mL'de filtreleyebilmelerini sağlayın. Kolonları önceden 10 mL 4 °C EB tamponu (45 mM HEPES-KOH pH 7.6, 100 mM KOAc, 3 mM Mg(OAc)2) geçirerek önceden dengeleyin.
NOT: Bu noktadan itibaren tüm adımların 4 °C soğuk odada gerçekleştirilmesi avantajına sahiptir. Bununla birlikte, tüm lizatları ve reaktifleri bir tezgah üstü buz tepsisinde tutmak da uygundur. Bunun bir istisnası, yazarların yeniden tamponlama sırasında 4 °C'lik bir buzdolabının içine bir sütun rafı yerleştirdiği jel filtreleme adımıdır. Bu protokolün orijinal versiyonlarında, yeni jel filtrasyon kolonları, başlangıçta lizatı tamponlayarak ve ilk çıktıyı atarak 'bloke edildi'. Bu gerekli görülmese de, kolonlar EB tamponu ile yıkanmalı ve lizat partileri arasında 4 °C'de saklanmalıdır. İlk çıkış lizatı, yeni kolon üzerinde lizat bileşenlerinin bir miktar arka planda tutulması nedeniyle sonraki çıktılardan daha düşük protein ekspresyon aktivitesine sahip olabilir. - Her sütuna 2,5 mL lizat ekleyin ve sütuna geçene kadar bekleyin. Elüatı atarken lizatı kolona çökeltmek için ek bir 0.5 mL EB ekleyin.
- Her sütuna ek 2,5 mL EB ekleyerek jel filtreli lizatı elute edin, çıktıyı sütunların altına taze, temiz bir tepsi veya başka bir kap yerleştirerek toplayın.
6. Hücre lizatının takviyesi
- Jel filtreli lizatın Abs280nm'sini ölçmek için nanodrop spektrofotometresini (Malzeme Tablosuna bakınız) kullanın. 60'ı aşarsa, ek 4 °C EB tamponu kullanarak Abs280nm = 60'a ulaşacak şekilde seyreltin.
NOT: OD600nm kullanılarak bozulmaya hücre yoğunluğu girişini kontrol ederken, lizat çıkış gücünü yaklaşık olarak belirlerken, lizat bozulması ve işlemeden sonra Abs280nm'yi normalleştirmek, lizat performansının toplu tutarlılığını daha da iyileştirir. Lysate Abs280nm , protein ekspresyonu verimi ve agregasyonu için sonuçlarla birlikte yukarı ve aşağı ayarlanabilir. Takviye edilmemiş lizat, bir Abs280nm < 60'ı gösteriyorsa, bozulma adımına daha fazla Leishmania biyokütlesi dahil etmek, yani hücre bozucu yüklemesini adım2.1'de OD 600nm > 300'e çıkarmak gerekebilir. - 5x Besleme Çözeltisi (5x FS, Tablo 1) lizata 2: 5 oranında ekleyin ve iyice karıştırın. Uygun kaplara (örneğin, 1,5 mL mikrofüj tüpleri) koyun ve sıvı nitrojen içinde dondurun. Aşağıdaki LTE ifade optimizasyonu için isteğe bağlı 7.1-7.3 adımları izleniyorsa, varsayılan 5x FS yerine Tablo 1'deki azaltılmış rNTP.Mg 5x FS'yi kullanın. Optimizasyon deneylerinde kullanılmak üzere dondurma için 5 x 100 μL'lik alikot ekleyin.
NOT: 2:5 oranında varsayılan 5x FS ile dondurma, 7 μL/10 μL ekspresyonda kullanılan, ifadeye hazır takviyeli LTE oluşturur (bu nedenle, 5x FS, son reaksiyonda 1x FS olur). Bununla birlikte, yazarlar, 5x FS'de varsayılan rNTP ve magnezyum miktarının 0,6 katının sağlandığı diğer isteğe bağlı adımların izlenmesini önermektedir. Bunu, test reaksiyonlarını optimize edilmiş bir değere tamamlamak için ikisinin eşmolar bir karışımının (rNTP.Mg olarak adlandırılır) eklendiği bir optimizasyon adımı izler. Kısmi 5x FS ayrıca endojen mRNA ekspresyonunu kapatan bir oligonükleotid içerir (Giriş bölümüne bakınız). Oligonükleotidin dizisi CAATAAAGTACAGAAACTGATACTTATATAGCGTT'dir.
7. Kalite kontrol ve son takviyeli LTE'nin optimizasyonu
NOT: İndirgenmiş rNTP ve magnezyum takviyeli lizata rNTP.Mg'in uygun 'tamamlama' ilavesini belirlemek için gerekli minimum adımlar, bir füzyon partneri olmadan eGFP veya benzer bir floroforun (örn., sfGFP) eksprese edilmesini içerir. İfade seviyesinin (çok modlu bir plaka okuyucu aracılığıyla eGFP RFU olarak ölçülür) optimize edildiği noktayı belirlemek için reaksiyonlara artan rNTP.Mg konsantrasyonları eklenir. Floresan olmayan eGFP'nin erken sonlandırılması, çok yüksek rNTP.Mg konsantrasyonlarında eGFP RFU'nun azalmasıyla belirginleşir. Bununla birlikte, LTE'nin kısa ürün arızaları, daha büyük eksprese edilen proteinlerde (>50 kDa) daha sık görülür. Bu nedenle, bu optimizasyonu eGFP'den daha büyük bir şablon kullanarak gerçekleştirmek mümkündür, özellikle de uygun bir ifade vektöründe mevcutsa, belirli bir uygulama veya çalışma için LTE tarafından üretilmesi istenen bir florofor füzyonu sağlar (Temsili Sonuçlar bölümüne bakın).
- 100 μL'lik bir alikotu çözün ve her biri 6.2. adımdan 7 μL kısmen takviye edilmiş lizat, Tablo 2'ye göre 1 μL tamamlama çözeltisi ve 2 μL ultra saf sudan oluşan altı adet 10 μL ekspresyon reaksiyonu ayarlayın reaksiyonda 50 ng / μL'lik bir nihai konsantrasyon elde etmek için yeterli DNA kontrol şablonu içerir.
- Reaksiyonları 25 ° C'de 2 saat inkübe edin ve çok modlu bir plaka okuyucu kullanarak GFP floresansındaki artışı izleyin.
NOT: GFP için uygun konfigürasyon değerleri, 485 nm'de (bant genişliği 5 nm) uyarma, 516 nm'de emisyon (bant genişliği 5 nm) ve 2 saat boyunca 1 dakikalık bir okuma aralığıdır. - En yüksek eGFP RFU'ya karşılık gelen rNTP.Mg konsantrasyonunu belirlemek için son ifade değerlerini sıralayın. Kinetik veriler mevcutsa, rNTP.Mg fazlalığı, 2 saatlik ekspresyon periyodu boyunca eGFP RFU'da iki fazlı bir artışla da gösterilecektir (Temsili Sonuçlar bölümüne bakınız).
- Optimize edilmiş tamamlama rNTP.Mg konsantrasyonu belirlendikten sonra, önceki adımlarda kısmen takviye edilen LTE partisini kullanarak bunu diğer tüm protein ifadelerine ekleyin.
NOT: Adım 6.2'deki alıntılama sabit hacimlerle dikkatli bir şekilde yapılırsa, ekleme, örneğin alikotlar kuru buz üzerine yerleştirilerek, çözülmeden her bir alikot'a geriye dönük olarak eklenebilir. Bu alikotlar artık tamamen desteklenmektedir, çünkü doğru rNTP.Mg doldurma, çözüldüklerinde ve kullanım için karıştırıldıklarında her biri boyunca karıştırılacaktır.
Sonuçlar
Hücresiz protein ekspresyonunun amacı, çok çeşitli uygulamalar için uygun, katlanmış, aktif bir formda tam uzunlukta proteinler üretmektir. LTE (Leishmania tarentolae özütü) daha önce diğer prokaryotik ve ökaryotik hücresiz ekspresyon sistemleriyle karşılaştırılmış ve özellikle E. coli bazlı hücresiz ekspresyon33 ile karşılaştırıldığında, en iyi şekilde çalışırken kesilme ve agregasyonu önlemek için yüksek bir kapasite göstermiştir. Bununla birlikte, buna daha önce çıktı kalitesinde partiden partiye önemli farklılıklar eşlik ediyordu. Mevcut yöntem, esas olarak LTE'nin alikotlarda ilk dondurulmasından önce gerekli besleme çözeltisinin kısmen eklenmesi yoluyla tutarlı çıktı kalitesi sağlamak için daha fazla iyileştirme içermektedir. Bunu, sonraki her reaksiyona eklenebilen veya donmuş alikotları doğrudan tamamlamak için kullanılabilen bir tamamlama çözeltisinde rNTP.Mg transkripsiyonel girdinin optimizasyonu takip eder. Optimizasyon reaksiyonlarının, proteinleri pratik olarak eksprese etmek için LTE'nin tipik kullanımını temsil etmesi ve reaksiyonların 25 ° C'de 2 saat boyunca gerçekleştirilmesi dikkat çekicidir.
Hücresiz reaksiyonlarda rNTP.Mg konsantrasyonunun optimize edilmesinden elde edilen veriler, temsili bir veri seti sağlar. İfade seviyeleri tipik olarak transkripsiyonel girdi (rNTP.Mg) yükseldikçe artar ve bu da başarılı ifadeyi gösterir. Bununla birlikte, sistemin, özellikle daha büyük proteinler (>50 kDa) söz konusu olduğunda, kesilmiş ürünlerin üretken olmayan ifadesine yöneldiği bir eşiğe ulaşılır. Bu suboptimal ekspresyon, özellikle polipeptitin translasyonunun floroforun kendisine ulaşmadığı C-terminal florofor füzyonlarında belirgin olan, artan rNTP.Mg ile floresan sinyali kaybına yol açar. N-terminal füzyonları için, genel RFU'da (Bağıl Floresan Birimleri) bir azalma, aşırı rNTP.Mg ile mutlaka meydana gelmese de, başarısız ekspresyon, SDS-PAGE jellerinde azalan boyutlarda çoklu floresan ürünler olarak gözle görülür şekilde belirgindir. Bu yaklaşım, numunelerin karıştırıldıktan sonra ısıtılmaması koşuluyla, geleneksel bir SDS-PAGE jeli üzerinde görselleştirildiğinde bile GFP'nin (Yeşil Floresan Protein) floresanı koruma yeteneğinden yararlanır. Bunun yerine, jel yükleme tamponu ile karıştırılır ve doğrudan jel üzerine yüklenir. SDS-PAGE jel malzemeleri ve ekipmanı genellikle birbirinin yerine kullanılabilirken, jel görüntüleyici GFP floresansını görselleştirebilmelidir. GFP görselleştirmesi için tipik bir konfigürasyon, 485 nm'de (bant genişliği 5 nm) uyarma, 516 nm'de emisyon (bant genişliği 5 nm) ve 2 saat boyunca 1 dakikalık bir okuma aralığı ile sağlanır.
Yalnızca eGFP ifadesini kullanarak sistemi optimize etmek mümkündür. Şekil 2A,B (ek), eGFP RFU'nun artan rNTP.Mg konsantrasyonları ile arttığı, maksimum RFU için +0.6x rNTP.Mg ve +0.3x rNTP.Mg'lik optimum bir seviyeye ulaştığı iki LTE partisi için optimizasyon reaksiyonlarının tipik ifade çıktılarını göstermektedir. Azaltılmış rNTP besleme çözümü, 0,6 kat rNTP.Mg içerir ve bu LTE partileri için varsayılan miktarın 1,2 katı ve 0,9 katı toplam rNTP.Mg seviyeleri ile sonuçlanır. Şekil 2C, Şekil 2B'deki LTE partisi için reaksiyon sırasında RFU artışının kinetiğini göstermektedir ve reaksiyon süresi boyunca iki ayrı faz ile iki fazlı bir bifazik reaksiyonu göstermektedir.

Şekil 2: Azaltılmış rNTP 5x FS ile LTE'de rNTP.Mg tamamlama ilavesinin optimizasyonu. (A) Hücresiz ekspresyon reaksiyonunda değişen rNTP.Mg tamamlama seviyelerinde bir kontrol plazmitinden 140 dakikalık ekspresyondan sonra eGFP'nin ekspresyon seviyeleri (n = 3, Ortalama ± SD çizildi). (B) Belirli bir rNTP.Mg eşiğinin ötesinde azaltılmış ifade gösteren farklı bir LTE üretim partisinin optimizasyonu. (C) (B) ile aynı reaksiyonlarda, artan rNTP.Mg doldurma ile eGFP birikiminin kinetiği. Bu veriler aynı zamanda LTE toplu ifadesinde protein birikiminin tipik kinetiğini de temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bununla birlikte, katlanması kolay küçük bir protein (27 kDa) olan eGFP'nin, kullanılan hücresiz ekspresyon sisteminden bağımsız olarak eksprese edilmesi, katlanması ve olgunlaşması muhtemel olduğu unutulmamalıdır. Sistemin arızalanması, ilgilenilen daha büyük proteinleri ifade ederken daha olasıdır ve kesilmiş ürünler 70 kDa'dan daha büyük girdi protein boyutlarında daha belirgin hale gelir33. Bu nedenle, sistemin gerçek kullanım için amaçlanan protein(ler) ile optimize edilmesi daha üstündür, eGFP hala miktar tayini için mevcuttur, ancak ilgilenilen protein ile bir N-terminal füzyonu olarak.
Şekil 3, kesilmiş ürünler (eGFP-Sox18) vermeye eğilimli daha büyük bir protein şablonu kullanıldığında rNTP.Mg tamamlama seviyesinin tipik bir optimizasyonunu temsil eder. Yarı doğal bir jel SDS-PAGE formatı kullanarak (yani, numuneleri ısıtmadan), ifadenin ilerleyici başarısızlığını görselleştirmek mümkündür. +0,1x'te optimum rNTP.Mg ilavesi (kısmi besleme çözeltisindeki 0,6x rNTP.Mg ile birleştiğinde, toplam 0,7x'tir), toplam floresan ekspresyon ürünlerinin bir parçası olarak tam uzunlukta protein bandının fraksiyonunu belirgin bir şekilde azaltır ve fazla rNTP.Mg ilavesi ile sistem arızasını gösterir.
Protokolde belirtildiği gibi, rNTP.Mg optimizasyon adımını atlamak ve adım 6.2'deki jel filtrasyonundan hemen sonra takviye sırasında tam rNTP.Mg miktarını doğrudan "varsayılan" besleme çözeltisine eklemek mümkündür. Bunu yaparak, protokol esasen LTE34 oluşturmak için yayınlanan orijinal yöntemlere geri döner. Bununla birlikte, yazarlar, Şekil 3'te (Lane D'den Lane E'ye) gösterildiği gibi, sistemin optimum performans için uyarlanmasının, ek protokol karmaşıklığından daha ağır bastığına ve bir protein ekspresyon aracı olarak LTE'nin değerini artırdığına inanmaktadır.
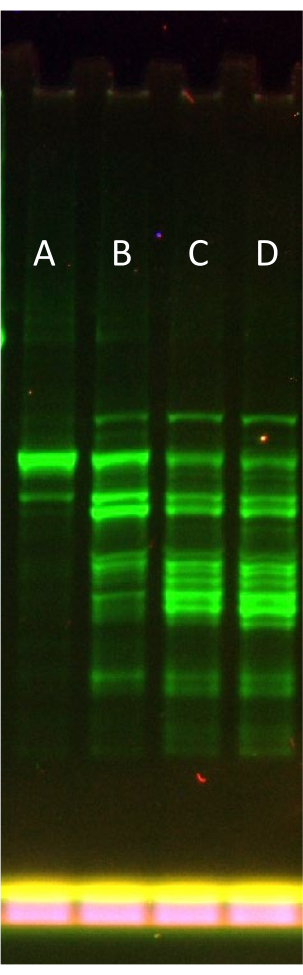
Şekil 3: Kısmen takviye edilmiş LTE'de artan rNTP.Mg yüklemenin eGFP-Sox18 ekspresyonu üzerindeki etkisi. Artan rNTP.Mg yüklemenin eGFP-Sox18 ekspresyonu üzerindeki etkisini gösteren yarı doğal SDS-PAGE jeli. A Şeridi: +0,1x (rNTP.Mg) yükleme, B Şeridi: +0,2x (rNTP.Mg), C Şeridi: +0,3x (rNTP.Mg), D Şeridi: +0,4x (rNTP.Mg). N-terminal eGFP füzyonu, jelin floresan taraması ile görselleştirilir. Şerit A'daki birincil bant, tam uzunlukta eGFP-Sox18'i temsil eder. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Parça | Stok konsantrasyonu | 5x Besleme Çözümü | μL stok/mL 5x Besleme Çözeltisi |
| Varsayılan (azaltılmış rNTP) | Varsayılan (azaltılmış rNTP) | ||
| Spermidin | 100 milyon | 1,25 milyon | 12 |
| DTT (DTT) | 500 milyon | 10 milyon | 20 |
| Kreatin Fosfat | 1000 mM | 200 milyon | 200 |
| HEPES-KOH pH7.6 | 2500 milyon | 100 milyon | 40 |
| PEG3000 | 0,5 V/V | 0,05 V/V | 100 |
| Proteaz İnhibitörü Kokteyli | 120 katı | 5 katı | 43 |
| Amino Asitler | 3,6 mM (adet) | 0,68 mM (adet) | 190 |
| ATP | 100 milyon | 8,5 (5,1) milyon | 85 (51) |
| GTP (Küresel Ticari Ürün Numarası | 100 milyon | 3,2 (1,9) milyon | 32 (19) |
| UTP | 100 milyon | 2,5 (1,5) mM | 25 (15) |
| CTP (Otomotiv Teknolojileri T | 100 milyon | 2,5 (1,5) mM | 25 (15) |
| Mg(OAc)2 | 1 milyon | 16,7 (10) milyon | 16,7 (10) |
| Ekleme önleyici lider oligo | 1 milyon | 0,05 mM | 50 |
| T7 RNA polimeraz | 5 mg / mL | 0.5 mg / mL | 100 |
| Kreatin Fosfokinaz | 5 birim/μL | 0,2 birim/μL | 42 |
| Ultra saf su | 19 (93) |
Tablo 1: LTE için 5x besleme çözeltisinin (5x FS) bileşimi. Jel filtrasyonundan sonra her 2,5 mL takviye edilmemiş lizat için 1 mL 5x FS gereklidir. Varsayılan 5x FS ile takviye, 7 μL/10 μL oranında ekspresyon reaksiyonlarında kullanım için ifadeye hazır bir LTE oluşturur. Azaltılmış rNTP.Mg tarifi (italik olarak yazılan miktarlar) LTE ifade optimizasyonu için önerilir ve varsayılan rNTP ve magnezyum seviyelerinin 0,6 katını içerir. Bunlar, Tablo 2'de özetlenen eklemeler kullanılarak sonraki optimizasyon deneyinde değişken seviyelere (0,6 ila 1,1 kat) ayarlanabilir.
| rNTP yüklemesi | ATP (100 mM) | GTP (100 mM) | UTP (100 mM) | CTP (100 mM) | MgOAc (1 M) | Ultra saf su |
| (1 μL/10 μL rxn) | μL/200 μL | μL/200 μL | μL/200 μL | μL/200 μL | μL/200 μL | |
| +0x | 0 | 0 | 0 | 0 | 0 | 200 |
| +0,1 kat | 3.4 | 1.3 | 1 | 1 | 0.7 | 193 |
| +0,2 kat | 6.8 | 2.5 | 2 | 2 | 1.3 | 185 |
| +0,3 kat | 10.2 | 3.8 | 3 | 3 | 2 | 178 |
| +0,4 kat | 13.6 | 5.1 | 4 | 4 | 2.7 | 171 |
| +0,5 kat | 17 | 6.4 | 5 | 5 | 3.3 | 163 |
Tablo 2: LTE optimizasyonu için (rNTP.Mg) yükleme çözümlerinin bileşimi. Bu çözeltiler, 10 μL protein ekspresyon reaksiyonu başına 1 μL tamamlama çözeltisi ekleyerek LTE'yi optimize etmek için kullanılır. Optimizasyon deneyinde bir tamamlama seviyesi belirlendikten sonra, aynı LTE toplu alikotları kullanılarak sonraki tüm protein ekspresyon reaksiyonlarına tutarlı bir şekilde eklenebilir. Alternatif olarak, 7 μL'de 1 μL ilavesiyle (çözülmeden) doğrudan alikotlara eklenebilir. Çözüldükten ve karıştırıldıktan sonra, bu lizatlar 10 μL protein ekspresyonu başına 8 μL LTE'de kullanılır ve optimizasyon sırasında belirlenen rNTP.Mg tamamlama seviyesini korur.
Tartışmalar
LTE oluşturma protokolleri son on yıldayayınlanmıştır 7 ve periyodik güncellemelerden geçmiştir25,34. Bununla birlikte, tekniğe yeni başlayanlar genellikle dik bir öğrenme eğrisi ile karşılaşırlar ve bu da yüksek kaliteli ve yüksek verimli protein ekspresyonunun elde edilmesinde gecikmelere neden olur. LTE35 ile çalışan diğer araştırma grupları tarafından, özellikle partiden partiye önemli farklılıklarla ilgili olarak benzer zorluklar bildirilmiştir. Video tabanlı protokol formatı, potansiyel olarak potansiyel kullanıcılara fayda sağlayan ek, daha az belirgin kurulum bilgisi sağlayabilir34. Başarı olasılığını artırmayı, prosedürü basitleştirmeyi, süreyi azaltmayı ve karmaşıklıkla ilgili hataları en aza indirmeyi amaçlayan protokolde değişiklikler yapılmıştır.
Hücre bozulmasında, hücrelerin nitrojen kavitasyon hücresi bozucusuna yüklenmesi üzerinde hassas kontrol çok önemlidir34. Hücre konsantrasyonu ve yıkamadan sonra yüksek hücre yoğunluğu nedeniyle bunu başarmak zor olabilir. Orijinal protokollerde, son konsantre kültürün küçük bir hacminin döndürülmesi ve fraksiyonel hücre peletinin miktarının belirlenmesi gibi çeşitli yöntemler kullanılmıştır. Ancak bu protokolde daha basit bir yaklaşım benimsenmiştir. Kültür hasat hacmi ve OD600nm ölçülür ve bu ölçümler, hücre konsantresi için mililitre cinsinden bir hedef hacim hesaplamak için kullanılır ve istenen nihai OD600nm'yi 300 olarak hedefler. Bu hesaplama, yıkama sırasında önemli bir hücre kaybının meydana gelmediğini varsayar. Hücre kaybı şüphesi varsa, yıkama sonrası konsantre hücrelerin üçlü seri 1/10 seyreltmesini içeren alternatif bir yöntem kullanılır ve sonuçta 1/1000'lik bir seyreltme ile sonuçlanır. Bu, gerçek konsantrenin OD600nm'sinin ölçülmesine izin vererek, bozucuya yüklemeden önce hedef OD600nm = 300'e ulaşmasını sağlar.
Hücre bozucu yüklemenin dikkatli bir şekilde kontrol edilmesiyle bile, jel filtrelenmiş takviye edilmemiş lizat34'ün Abs280nm'si ile belirtildiği gibi, bozulma sonrası lizat protein içeriğinde önemli değişkenlik meydana gelebilir. Bu nedenle, lizat takviyesinden önce Abs280nm'lik bir ölçüm yapılır ve lizat, bir Abs280nm = 60 elde etmek için seyreltilir. Protein ekspresyon reaksiyonları sonunda 0.5 v/v lizat içerdiğinden, bu, Abs280nm = 30 ile standartlaştırılmış bir reaksiyon lizatı ile sonuçlanır. Abs280nm = 30'dan daha düşük ile yapılandırılan lizat performansı, uzun süreli, düşük ekspresyonlu reaksiyonlar verme eğilimindeyken, Abs280nm = 30'dan daha büyük değerler daha yüksek ekspresyon verme eğilimindedir, ancak çıktı proteini agregasyonu için artan bir eğilim vardır.
Lizat performans optimizasyonu, isteğe bağlı reaksiyon adımları 7.0-7.3'te lizatı tamamlayan besleme çözeltisindeki transkripsiyonel girdilerin, özellikle rNTP'lerin ve magnezyumun ayarlanmasını içerir. rNTP'lerin ve magnezyumun, LTE25 gibi birleştirilmiş bir transkripsiyon-çeviri sisteminde karmaşık ve çoklu rollere sahip olduğunu belirtmek önemlidir. Bununla birlikte, LTE'nin rNTP (mM) + 1.5'te optimum yaklaşık bir magnezyum ekspresyonuna sahip olduğu gösterilmiştir. Lizatın kendisi nihai reaksiyon karışımına 1.5 mM Mg katkıda bulunduğundan, bu, eşmolar rNTP.Mg değiştirerek Mg'yi birlikte optimize etmeden rNTP girişini değiştirmek ve optimize etmek için basit bir yol sağlar.
Lizat performansı, protein ekspresyonu genellikle optimizasyonun tersine döndüğü bir eşiğe kadar artarak, tam uzunlukta proteinler yerine kısa ürünler şeklinde ekspresyon arızalarına neden olan rNTP.Mg artarken önemli farklılıklar gösterir25. Bu nedenle, bu eşiği belirlemek için sistemin nihai optimizasyonu faydalıdır. Orijinal LTE protokolü, sabit bir besleme çözeltisi tarifi kullandı ve bazı Mg optimizasyonu önerildi34. Bu yaklaşım daha sonra daha kapsamlı rNTP optimizasyonu ile değiştirildi. Bununla birlikte, bu yöntem, nihai lizat ekspresyon seviyelerini düşürme eğiliminde olan bir alikot üzerinde optimizasyonu sağlamak için lizatın takviyesiz formda dondurulmasını gerektiriyordu. Bu azalma, jel filtrasyon adımının hemen ardından takviye edilmemiş lizatın ani dondurulması sırasında besleme çözeltisinin kriyoprotektif özelliklerinin kaybına bağlandı. Mevcut protokol, dondurmadan önce azaltılmış rNTP.Mg içeren bir besleme solüsyonu ile takviye ederek bir denge sağlar ve bu, ifade noktasında optimize edilmiş seviyeye kadar tamamlanabilir.
Bu protokol iyileştirmelerinin, birincil varyasyon kaynaklarını azaltarak ve protein ekspresyonu çıktı tutarlılığını iyileştirerek acemi kullanıcılar için LTE sisteminin faydasını artırması bekleniyor.
Açıklamalar
Rekabet eden hiçbir finansal çıkar mevcut değildir.
Teşekkürler
Yazarlar, son 10 yılda LTE sistemlerinin geliştirilmesine katkıda bulunan birçok Alexandrov laboratuvar üyesine, özellikle de sisteme öncülük eden ve SITS ribozom giriş alanını geliştiren Sergey Mureev'e teşekkür etmek istiyor. Şekil 1 , Biorender.com tarafından oluşturulmuş ve lisans altında çoğaltılmıştır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| PD-10 SuperDex 25 Columns | Cytiva | 17085101 | Gel filtration columns |
| Nitrogen Cavitation cell disrupter | Parr Industries | 4635 or 4639 | Cell Disrupter |
| Bovine derived Hemin | Sigma-Aldrich | H5533 | Culture additive |
| Penicillin/Streptomycin 10000U/ml | Thermo-Fisher | 15140122 | Antibiotic mix |
| Optiplate 384 | Perkin-Elmer | 6007290 | Multiwell plate for 10ul expressions |
| Oligonucleotide | IDT synthesis | Oligo with sequence CAATAAAGTACAGAAACTGATAC TTATATAGCGTT | |
| Creatine Phosphokinase | Sigma-Aldrich | 9001-15-4 | Enzyme |
| Tecan Spark | Tecan | or similar Multimode Platereader | |
| Chemidoc MP Imager | Biorad | or similar SDS-PAGE gel Imager | |
| 4-12% Bis-Tris Gels | Invitrogen | NW04125 | SDS-PAGE gels |
| Biophotometer | Eppendorf | or similar Cuvette Specrophotometer | |
| Nanodrop One | Thermofisher | Nanodrop spectrophotometer | |
| Avanti JXN-26 centrifuge | Beckman Coulter | or similar centrifuge, with rotors/tubes rated 10K and 50K g | |
| 5424R microcentrifuge | Eppendorf | or similar microcentrifuge, with 1.5ml microcentrifuge tubes | |
| Flask Incubator Inova S44i | Eppendorf | or similar flask incubator shaker suitable for 5L Flasks | |
| 5L glass culture flasks | Baffled glass flasks for culture growth | ||
| Bactotryptone | BD | 211705 | Growth medium |
| Yeast Extract | Merck | VM930053 | Growth medium |
| Glycerol | Any analytical grade | ||
| Glucose | Any analytical grade | ||
| KH2PO4 | Any analytical grade | ||
| K2HPO4 | Any analytical grade | ||
| UltraPure water | Invitrogen | 10977-015 | Or output from any MilliQ-type water dispenser |
Referanslar
- Nirenberg, M. W., Matthaei, J. H. The dependence of cell-free protein synthesis in E.coli upon naturally occurring or synthetic polyribonucleotides. Proc Natl Acad Sci USA. 47 (10), 1588-1602 (1961).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Kelwick, R., Webb, A. J., MacDonald, J. T., Freemont, P. S. Development of a Bacillus subtilis cell-free transcription-translation system for prototyping regulatory elements. Metab Eng. 38, 370-381 (2016).
- Ezure, T., et al. Cell-free protein synthesis system prepared from insect cells by freeze-thawing. Biotechnol Prog. 22 (6), 1570-1577 (2006).
- Harbers, M. Wheat germ systems for cell-free protein expression. FEBS Letters. 588 (17), 2762-2773 (2014).
- Kobs, G. Selecting the cell-free protein expression system that meets your experimental goals. Promega Corporation. 21, 6-9 (2008).
- Kovtun, O., et al. Leishmania cell-free protein expression system. Methods. 55 (1), 58-64 (2011).
- Basile, G., Peticca, M. Recombinant protein expression in Leishmania tarentolae. Mol Biotechnol. 43 (3), 273-278 (2009).
- Mureev, S., Kovtun, O., Nguyen, U. T., Alexandrov, K. Species-independent translational leaders facilitate cell-free expression. Nat Biotechnol. 27 (8), 747-752 (2009).
- Gambin, Y., et al. Single-molecule fluorescence reveals the oligomerization and folding steps driving the prion-like behavior of ASC. J Mol Biol. 430 (4), 491-508 (2018).
- Sierecki, E., et al. Rapid mapping of interactions between human SNX-BAR proteins measured in vitro by AlphaScreen and single-molecule spectroscopy. Mol Cell Proteomics. 13 (9), 2233-2245 (2014).
- Sierecki, E., et al. Nanomolar oligomerization and selective co-aggregation of alpha-synuclein pathogenic mutants revealed by single-molecule fluorescence. Sci Rep. 6, 37630 (2016).
- Leitao, A., Bhumkar, A., Hunter, D. J. B., Gambin, Y., Sierecki, E. Unveiling a selective mechanism for the inhibition of alpha-synuclein aggregation by beta-synuclein. Int J Mol Sci. 19 (2), 334 (2018).
- Gambin, Y., et al. Single-molecule analysis reveals self assembly and nanoscale segregation of two distinct cavin subcomplexes on caveolae. Elife. 3, e01434 (2013).
- Ve, T., et al. Structural basis of TIR-domain-assembly formation in MAL- and MyD88-dependent TLR4 signaling. Nat Struct Mol Biol. 24 (9), 743-751 (2017).
- Guo, Z., et al. Subunit organisation of in vitro reconstituted HOPS and CORVET multisubunit membrane tethering complexes. PLoS One. 8 (12), e81534 (2013).
- Ruehrer, S., Michel, H. Exploiting Leishmania tarentolae cell-free extracts for the synthesis of human solute carriers. Mol Membr Biol. 30 (4), 288-302 (2013).
- Varasteh Moradi, S., et al. Mapping Interactions among cell-free expressed Zika virus proteins. J Proteome Res. 19 (4), 1522-1532 (2020).
- Gagoski, D., et al. Cell-free pipeline for discovery of thermotolerant xylanases and endo-1,4-beta-glucanases. J Biotechnol. 259, 191-198 (2017).
- Ergun Ayva, C., et al. Exploring performance parameters of artificial allosteric protein switches. J Mol Biol. 434 (17), 167678 (2022).
- Lau, D., et al. Fluorescence biosensor for real-time interaction dynamics of host proteins with HIV-1 capsid tubes. ACS Appl Mater Interfaces. 11 (38), 34586-34594 (2019).
- Ryan, S. M., et al. Novel antiinflammatory biologics shaped by parasite-host coevolution. Proc Natl Acad Sci USA. 119 (36), e2202795119 (2022).
- McMahon, K. A., et al. Identification of intracellular cavin target proteins reveals cavin-PP1alpha interactions regulate apoptosis. Nat Commun. 10 (1), 3279 (2019).
- Sierecki, E., et al. A cell-free approach to accelerate the study of protein-protein interactions in vitro. Interface Focus. 3 (5), 20230018 (2013).
- Johnston, W. A., Moradi, S. V., Alexandrov, K. Adaption of the Leishmania cell-free expression system to high-throughput analysis of protein interactions. Methods Mol Biol. 2025, 403-421 (2019).
- Jung, W., et al. Cell-free formation and interactome analysis of caveolae. J Cell Biol. 217 (6), 2141-2165 (2018).
- Fontaine, F. R., et al. Functional domain analysis of SOX18 transcription factor using a single-chain variable fragment-based approach. MAbs. 10 (4), 596-606 (2018).
- Overman, J., et al. Pharmacological targeting of the transcription factor SOX18 delays breast cancer in mice. Elife. 6, e21221 (2017).
- Kubala, M. H., et al. Mammalian farnesyltransferase alpha subunit regulates vacuolar protein sorting-associated protein 4A (Vps4A)--dependent intracellular trafficking through recycling endosomes. Biochem Biophys Res Commun. 468 (4), 580-586 (2015).
- Han, S. P., et al. Cortactin scaffolds Arp2/3 and WAVE2 at the epithelial zonula adherens. J Biol Chem. 289 (11), 7764-7775 (2014).
- Das Gupta, K., et al. Class IIa histone deacetylases drive toll-like receptor-inducible glycolysis and macrophage inflammatory responses via pyruvate kinase M2. Cell Rep. 30 (8), 2712-2728.e8 (2020).
- Leitão, A. D. G., et al. Selectivity of protein interactions along the aggregation pathway of α-synuclein. BioRxiv. , (2021).
- Gagoski, D., et al. Performance benchmarking of four cell-free protein expression systems. Biotechnol Bioeng. 113 (2), 292-300 (2016).
- Johnston, W. A., Alexandrov, K. Production of eukaryotic cell-free lysate from Leishmania tarentolae. Methods Mol Biol. 1118, 1-15 (2014).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnol Bioeng. 115 (8), 1904-1914 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır