Method Article
إنتاج وتحسين LTE ، وهو نظام تعبير بروتين خال من الخلايا مشتق من الليشمانيا تارينتولاي لإنتاج البروتين المؤتلف
In This Article
Summary
مستخلص الليشمانيا الانتقالي (LTE) هو نظام تعبير بروتين خال من الخلايا حقيقية النواة مشتق من الطفيلي أحادي الخلية ، Leishmania tarentolae. هذا البروتوكول المحسن يجعل LTE بسيطة وفعالة من حيث التكلفة للتصنيع. وهي مناسبة لمختلف التطبيقات التي تركز على التعبير متعدد التوازي ودراسة البروتينات حقيقية النواة المعقدة وتفاعلاتها.
Abstract
يحدد هذا البروتوكول إنتاج وتحسين نظام التعبير عن البروتين الخالي من الخلايا حقيقي النواة (CFPS) المشتق من السوط أحادي الخلية Leishmania tarentolae ، والمشار إليه باسم مستخلص الليشمانيا الانتقالي أو LTE. على الرغم من أن هذا الكائن الحي تطور في الأصل كطفيلي من الأبراص ، إلا أنه يمكن زراعته بسهولة وبتكلفة زهيدة في قوارير أو مفاعلات حيوية. على عكس الليشمانيا الكبرى ، فهي غير مسببة للأمراض للإنسان ولا تتطلب احتياطات مخبرية خاصة. ميزة أخرى لاستخدام الليشمانيا ل CFPS هي أن إضافة قليل النوكليوتيد واحد مضاد للحساسية إلى CFPS ، يستهدف تسلسل قائد لصق محفوظ على نهاية 5's لجميع الحمض النووي الريبي المشفر للبروتين ، يمكن أن يثبط تعبير البروتين الداخلي. نحن نقدم إجراءات لتعطيل الخلايا ومعالجة المحللة ، والتي تم تبسيطها وتحسينها مقارنة بالإصدارات السابقة. تبدأ هذه الإجراءات بثقافات قارورة بسيطة. بالإضافة إلى ذلك ، نوضح كيفية إدخال المعلومات الجينية باستخدام النواقل التي تحتوي على مواقع بدء الترجمة المستقلة عن الأنواع (SITS) وكيفية إجراء تحسين مباشر للدفعات ومراقبة الجودة لضمان جودة تعبير البروتين المتسقة.
Introduction
في ستينيات القرن العشرين ، لعبت أنظمة التعبير عن البروتين الخالية من الخلايا دورا محوريا في الكشف عن الشفرة الوراثية1. ومع ذلك ، فإن أنظمة التعبير عن البروتين الخالية من الخلايا بدائية النواة ، والتي تعتمد بشكل أساسي على الإشريكية القولونية ، تهيمن حاليا على كل من التطبيقات المختبرية والتجارية. في حين أن الأنظمة القائمة على الإشريكية القولونية توفر مزايا مثل الفعالية من حيث التكلفة وقابلية التوسع وإنتاجية التعبير العالية ، فإنها تواجه تحديات عند إنتاج بروتينات متعددة المجالات في أشكالها النشطة وتسهيل تجميع مجمعات البروتين 2,3. في الوقت الحاضر ، تشمل الأشكال شائعة الاستخدام لتخليق البروتين الخالي من الخلايا حقيقية النواة (CFPS) مستخلص جنين القمح (WGE) ، وتحلل الخلايا الشبكية للأرانب (RRL) ، وتحلل خلايا الحشرات (ICL) 4،5،6. يقدم هذا العمل نظاما بديلا خاليا من الخلايا حقيقية النواة يكون مباشرا وقابلا للتطوير ، استنادا إلى طفيلي السوط أحادي الخلية Leishmania tarentolae.
يمكن زراعة الليشمانيا تارينتولاي بسهولة في قوارير باستخدام وسائط فعالة من حيث التكلفة ويمكن أيضا توسيع نطاقها في المفاعلات الحيوية لتحقيق كثافة خلايا أعلى. يمكن تحييد وجود mRNAs الداخلية في محللات الخلية ، والتي قد تتنافس مع الرسائل المقدمة ، باستخدام oligonucleotides المضادة للحساسية التي تستهدف تسلسل قائد لصق الليشمانياmRNA المحفوظ 7. على عكس قريبها الليشمانيا الكبرى ، التي تسبب الأمراض البشرية ، تصيب L. tarentolae أبو بريص المغربي (Tarentolae mauritanica) ، مما يجعلها مناسبة للزراعة في بيئات مختبر PC2 دون الحاجة إلى احتياطات خاصة. وقد استخدم سابقا ككائن معدل وراثيا للتعبير البروتينيفي الجسم الحي 8.
لتسهيل تحضير القوالب في الأنظمة الخالية من الخلايا ، تم تصميم تسلسلات عالمية بناء على هياكل الحمض النووي الريبي البوليمرية التي تعزز البدء الانتقالي9. تنطبق تسلسلات الترجمة المستقلة عن الأنواع (SITS) هذه على كل من الأنظمة الخالية من الخلايا بدائية النواة وحقيقية النواة وهي مناسبة لإدخال المعلومات الوراثية في LTE. في حين أن هذا البروتوكول لا يقدم شرحا مفصلا لبناء النواقل لتعبير البروتين الخالي من الخلايا LTE ، فإن التحسين ومراقبة الجودة يتطلبان نواقل مناسبة تحتوي على اندماجات فلوروفور للبروتينات المرغوبة ذات الأهمية في اتجاه مجرى موقع خدمة الحشرة العقيمة. ولهذا الغرض، تم إيداع نواقل LTE المناسبة في مستودع جينات Addgene، مثل ناقل pCellFree_G03، الذي يشفر اندماج eGFP الطرفي N إلى البروتين المطلوب محل الاهتمام باستخدام مواقع استنساخ البوابة.
أثبتت LTE قيمتها في مجموعة واسعة من التطبيقات التي تتطلب تعبير البروتين ، بما في ذلك تحليل التجميع الذاتي للبروتين10,16 ، وإنتاج بروتينات الغشاء البشريالمتكاملة 17 ، والبحث عن الأدوية المضادة للفيروساتالمرشحة 18 ، وتطوير إنزيمات مفيدة من الناحية التكنولوجية الحيوية19 ، والنماذج الأولية للمستشعرات الحيوية للبروتين20,21 ، ودراسة البيولوجيا من الديدان الخطافية22. كما لعبت LTE دورا أساسيا في رسم خرائط شبكات تفاعل البروتين والبروتين في مجالات علم الفيروسات والهياكل الخلوية21,32. تم قياس LTE لأداء مشابه للأنظمة الأخرى الخالية من الخلايا حقيقية النواة في التعبير عن البروتينات كاملة الطول وأحادية التشتت وغير المجمعة33 ، كل ذلك مع تقديم إنتاج أكثر فعالية من حيث التكلفة وقابل للتطوير.
يوفر هذا البروتوكول تقنيات لزراعة وتعطيل الكائن الحي المضيف ، وإعداد المحللة ، وتكملة محلول التغذية (FS) للنسخ / التعبير البروتيني المقترن. بالإضافة إلى ذلك ، يتضمن بروتوكولا لتحسين دفعات الإنتاج. في النسخة الأولية من نظام الليشمانيا الخالي من الخلايا ، لوحظ اختلاف غير مرغوب فيه من دفعة إلى أخرى في مستويات التعبير ، وجزء البروتينات كاملة الطول ، ووجود مجاميع البروتين ، مما أدى إلى التخلص من الدفعات34. تم إجراء تحسينات لاحقة على البروتوكول لمعالجة هذه المشكلة25. يعتمد البروتوكول الحالي على هذه التحسينات ، مما يسمح بتحسين الدفعات الفردية لذروة التعبير عن البروتين وحجمه. ويحقق ذلك من خلال التحكم عن كثب في تحميل معطل الخلية (يقاس ككثافة بصرية عند 600 نانومتر. OD600nm) وتطبيع ناتج المحللة الناتج باستخدام الامتصاص عند 280 نانومتر (Abs280 نانومتر). علاوة على ذلك ، فإنه يشتمل على طريقة لتكملة المحللة جزئيا مع rNTP والمغنيسيوم أثناء التصنيع ، مع التحسين اللاحق لمكونات محلول التغذية هذه أثناء تعبيرات الاختبار. على الرغم من تقديم هذا التحسين كخيار في البروتوكول ، إلا أنه يوصى به بشدة من قبل المؤلفين.
Protocol
يتضمن هذا البروتوكول وصفات وخطوات وسائط مفصلة تتضمن الزراعة ، والطرد المركزي ، وقياس مضان GFP باستخدام قارئ صفائح متعدد الأوضاع ، وقياس ثقافة OD600nm ، وتقييم تحلل Abs280nm. كما يغطي إعداد وتصوير المواد الهلامية البروتينية SDS-PAGE. يتم سرد المواد المطلوبة أو المقترحة لهذا البروتوكول في جدول بيانات المواد. من المهم ملاحظة أنه من المحتمل استخدام موارد المختبر النموذجية مثل مكونات الوسائط وأجهزة الطرد المركزي والأنابيب ومقاييس الطيف الضوئي وإعدادات الرحلان الكهربائي الهلامي بالتبادل ما لم ينص على خلاف ذلك. يقدم الشكل 1 ملخصا لعملية تصنيع LTE.
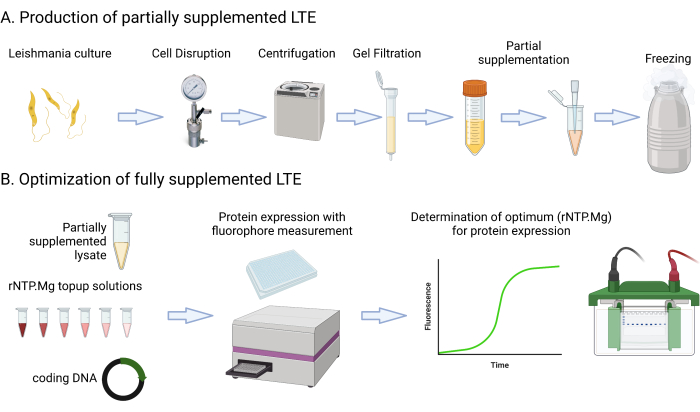
الشكل 1: نظرة عامة على بروتوكول تصنيع LTE. يقدم هذا الكارتون ملخصا موجزا لبروتوكول تصنيع LTE. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
1. نمو ثقافات الليشمانيا تارينتولاي
- تحضير ما لا يقل عن 3 لتر من وسائط نمو TBGG (بكتوتريبتون 12 جم / لتر ، مستخلص الخميرة 24 جم / لتر ، جلسرين 8 مل / لتر ، جلوكوز 1 جم / لتر ، KH2PO4 2.3 جم / لتر ، K2HPO4 2.5 جم / لتر ، انظر جدول المواد). تعقيم الوسائط باستخدام مرشح 0.22 ميكرومتر تحت فراغ أو إعداد مماثل.
- قم بتخزين الوسائط في درجة حرارة الغرفة (RT) ، مع إضافة الإضافات النهائية (Hemin ، المضادات الحيوية) قبل التلقيح مباشرة باستخدام L. tarentolae. يضاف هيمين (0.25٪ v / v في 50٪ ثلاثي إيثانولامين) عند 0.2٪ v / v ، البنسلين (10000 وحدة / مل) بالإضافة إلى مزيج Streptomycin (10000 ميكروغرام / مل) عند 0.5٪ v / v.
ملاحظة: نقطة البداية لهذا البروتوكول هي الحفاظ على 2 × 10 مل من النوع البري L. tarentolae. تزرع مزارع الصيانة عند 27 درجة مئوية في قوارير زراعة الأنسجة القياسية سعة 50 مل مع اهتزاز منخفض (75 دورة في الدقيقة). يمكن الحفاظ على هذه الثقافات 10 مل إلى أجل غير مسمى مع ~ 1/20 التخفيفات في معقمة (TBGG + هيمين ، البنسلين ، الستربتومايسين) كل 2-3 أيام. يوصى باستخدام خزانة قياسية للسلامة الأحيائية في مختبر PC2 ؛ ومع ذلك ، تميل الملوثات البكتيرية إلى الوقاية من المضادات الحيوية المضافة ، في حين أن الملوثات الفطرية تتفوق بشكل عام على L. tarentolae. - على مدار يومين ، قم بتوسيع مزارع صيانة L. tarentolae إلى 200 مل (اليوم 1) ثم 2 لتر (اليوم 2) عبر التخفيفات 1:10 مع زيادة حجم TBGG + hemin / المضادات الحيوية كل يوم. قم بإجراء كلا التخفيفين في قوارير زجاجية معقمة بالأوتوكلاف سعة 5 لتر (مملوءة بحد أقصى 1 لتر). يجب أن يحدث التخفيف الثاني في فترة ما بعد الظهر بين الساعة 3-6 مساء ، بهدف بدء إنتاج المحللة في اليوم التالي بين الساعة 8-11 صباحا.
ملاحظة: يستخدم هذا البروتوكول الحد الأدنى لحجم البدء لإنتاج LTE (مزارع 2 × 1 لتر). من الممكن أيضا توسيع الثقافة حتى 10 لتر لإنتاج LTE من خلال دمج خطوة توسع إضافية (على سبيل المثال ، اليوم 1: 100 مل ؛ اليوم 2: 1 لتر ؛ يوم 3: 10 لتر). على الرغم من أن هذا البروتوكول يستخدم قوارير محيرة (انظر جدول المواد) لزراعة L. tarentolae ، اختياريا ، يمكن استخدام المفاعلات الحيوية التقليدية المصممة لنمو البكتيريا مع دفاعات Rushton ، بشرط أن يظل معدل التحريك أقل من 100 دورة في الدقيقة. يؤدي تحسين التهوية والتحكم في الأس الهيدروجيني في المفاعلات الحيوية عموما إلى توسيع نمو الطور اللوغاريتمي لمزارع L. tarentolae ، مما يسمح باستخدام حصاد أعلى OD600nm من 10 في الخطوة 1.4. - سجل OD600nm للثقافة في ثلاث نسخ عن طريق تخفيف 1:10 في TBGG مباشرة في كوفيت مقياس الطيف الضوئي. نطاق البدء المناسب لصنع المحللة هو OD600nm = 4.0-8.0.
- توفير وقت حضانة إضافي إذا كان OD600nm < 4.0. الثقافة التي تحتوي على OD600nm > 8 قابلة للاستخدام وستؤدي إلى حجم أكبر من محللات التعبير الخالية من الخلايا ، ولكن بجودة أقل بسبب بداية مرحلة النمو المتأخر. ضع قوارير الثقافة على الجليد ، في انتظار الخطوات اللاحقة.
ملاحظة: يعد القياس الدقيق للمزرعة النهائية OD600nm أمرا بالغ الأهمية ، حيث يتم استخدامه لحساب الحجم النهائي للخلايا المركزة قبل الانقطاع. يحل هذا الحساب محل طريقة وزن الحبيبات المستخدمة في الإصدارات السابقة من تصنيع LTE لمعايرة تركيز الخلية قبل التعطيل34 ، من أجل تبسيط البروتوكول. تأكد من التخفيف في TBGG لقياس OD600nm ، وإلا فإن الصدمة الاسموزية تغير شكل الخلية ، مما يتسبب في حدوث خطأ في القياس. تخلط الماصة التخفيف 1:10 لقياس OD600nm (مباشرة في الكوفيت) قبل ثوان من أخذ القراءة الطيفية ، حيث تستقر خلايا L. tarentolae بسرعة بمظهر غائم مميز. إذا تم اعتبار الحجم النهائي لثقافة التعبير تقريبيا ، يوصى أيضا بوزن القوارير عند الحصاد (مع قارورة فارغة مناسبة) للحصول على حجم تقديري أفضل (عند 1 جم = 1 مل). الحد الأقصى لOD 600nm ممكن من نمو L. tarentolae في القوارير المحيرة هو 15-20 ، على الرغم من أن هذا غير مناسب لتصنيع المحللة بسبب الوصول إلى المرحلة الثابتة.
2. تركيز ثقافات L. tarentolae
- يجب غسل خلايا الليشمانيا وتركيزها حوالي 60 ضعفا قبل الانقطاع. احسب الحجم المستهدف لتركيز الخلية بناء على OD600nm = 300 للتركيز النهائي. المعادلة هي V = حجم الحصاد (مل) × (حصاد OD600 نانومتر / 300). على سبيل المثال ، باستخدام ثقافة 2 لتر مع حصاد OD600 = 5 ، الحجم المستهدف هو 33 مل.
ملاحظة: يمكن تعديل هدفOD 600nm البالغ 300 ؛ استخدم إنتاج LTE السابق قيما في نطاق 150-350. تميل التركيزات الأعلى للخلايا التي تتعرض للاضطراب إلى إنتاج تفاعلات تعبير نهائية خالية من الخلايا مع غلة بروتين أعلى ، ولكن مع زيادة ميل البروتينات الضعيفة إلى التجمع. يمثل OD600nm = 300 هدفا افتراضيا مناسبا لإنتاج LTE. - نقل المزارع المحصودة إلى زجاجات أجهزة طرد مركزي مناسبة وتدويرها عند 2500 × جم لمدة 10 دقائق عند 4 درجات مئوية. صب بعناية طاف في النفايات الثقافية.
ملاحظة: من المهم تقليل فقد الخلايا في المادة الطافية المهملة ، لأنها تؤثر على حساب تحميل الاضطراب. في بروتوكولات إنتاج LTE السابقة ، تمت معايرة تركيز خلايا L. tarentolae للاضطراب عن طريق تدوير تركيز الخلية في أنبوب اختبار الطرد المركزي وقياس وزن الحبيبات مقابل الوزن الإجمالي34. يستخدم هذا البروتوكول المبسط بدلا من ذلك هدفا نظريا لOD 600nm للتركيز ، بناء على الحصاد المقاس OD600nm ، ويفترض انخفاض فقدان الخلايا أثناء تركيز الخلية وغسلها. - اغسل حبيبات الخلية في مخزن مؤقت SEB (45 mMM HEPES-KOH pH 7.6 ، 250 mM سكروز ، 100 mM KOAc ، 3 mM Mg (OAc) 2 ، محفوظة على الجليد) ثلاث مرات ، في كل مرة يتم الطرد المركزي عند 2500 × جم لمدة 10 دقائق عند 4 درجات مئوية. بالنسبة للغسل الأول ، أعد تعليق كل 1 لتر من المزرعة الحبيبية في 100 مل من المخزن المؤقت SEB ، ثم ادمجها في قارورة طرد مركزي واحدة. بالنسبة للغسيل الثاني ، استخدم أيضا 100 مل من SEB لكل 1 لتر من الثقافة الأصلية.
ملاحظة: بالنسبة لتعليق الحبيبات النهائي ، أضف المخزن المؤقت SEB إلى 50٪ من حجم إعادة التعليق النهائي المستهدف (الخطوة 2.1). وهذا يسمح بزيادة التركيز المجمع بعناية إلى الحجم المستهدف النهائي بالضبط في الخطوة 2.4. يجب أن تكون كل عملية إعادة تعليق لطيفة قدر الإمكان لتجنب التحلل المبكر ل L. tarentolae ، على سبيل المثال ، عن طريق تدوير SEB المضاف برفق حول الحبيبات المصبوغة أو سحب SEB فوق الحبيبات الملتصقة بجدار أنبوب الطرد المركزي. قد يكون أكثر ملاءمة لنقل المواد الطافية إلى أنابيب الطرد المركزي الأصغر للخطوة النهائية. - صب المركز المعاد تعليقه في أسطوانة حجمية زجاجية مغسولة مناسبة ، ثم قم بزيادة الحجم إلى الحجم المستهدف (الخطوة 2.1) باستخدام SEB بارد إضافي واخلطه برفق.
3. تحلل مركز L. tarentolae
- انقل تركيز الخلية إلى جهاز تجويف النيتروجين (انظر جدول المواد) المبرد مسبقا إلى 4 درجات مئوية ، واضغط عليه إلى 70 بارا من النيتروجين ، واحتضانه لمدة 45 دقيقة على الجليد.
ملاحظة: في حين أن عوامل تعطيل تجويف النيتروجين ليست عناصر مختبرية شائعة ، إلا أنها موصى بها لإنتاج LTE. وقد جربت طرق بديلة مثل التجميد والذوبان الخلوي وعوامل تعطيل نوع الصحافة الفرنسية. ومع ذلك ، كان نشاط التعبير عن البروتين <50٪ مقارنة باستخدام طريقة تجويف النيتروجين. يجب تنظيف جهاز تجويف النيتروجين جيدا قبل الاستخدام وبين الأشواط ، على غرار جميع الأوعية المعاد استخدامها التي تتلامس مع الخلية المحللة من هذه الخطوة فصاعدا (مثل قارورة جهاز الاستقبال). يتضمن نظام التنظيف المناسب الغسيل بالمنظفات المختبرية متبوعا بالشطف الشامل بالماء منزوع الأيونات. - افتح فتحة التهوية الموجودة على جهاز تجويف النيتروجين واطرد المحللة الناتجة في حاوية قوية بشكل مناسب ، مثل قارورة مستقبل الفراغ على الجليد. قم بإمالة قارورة جهاز الاستقبال لضمان استقرار جميع المحللات الناتجة ويمكن سحبها في أنبوب طرد مركزي جديد أو وعاء مماثل.
تنبيه: تعتمد عوامل تعطيل تجويف النيتروجين على الانتقال المفاجئ لتركيز الخلية من 70 بارا من النيتروجين إلى الضغط المحيط ، والذي يتحقق من خلال تدفق قوي للسائل الأول ثم النيتروجين عبر صمام خروج الجهاز. يجب أن يتم التنفيس باستخدام معدات الحماية الشخصية المناسبة (PPE) في غطاء أمان كيميائي. هناك خطر كسر وعاء الوجهة وفقدان المحللة ، وهذا هو السبب في أننا نستخدم مستقبل فراغ قوي بدلا من قارورة عامة. إذا كان صمام خروج الجهاز عبارة عن أنبوب ، فتجنب وضع الأنبوب مباشرة داخل جهاز الاستقبال لمنع تراكم الضغط المفرط عند نقطة التهوية.
4. الطرد المركزي للخلية المحللة
- انقل المحللة إلى أنابيب الطرد المركزي وأجهزة الطرد المركزي المناسبة ذات القوة g عند 10000 × g لمدة 15 دقيقة عند 4 درجات مئوية. قم بإزالة المادة الطافية إلى أنابيب طرد مركزي جديدة مماثلة.
- قم بإذابة المحلول عند 30000 × جم لمدة 15 دقيقة عند 4 درجات مئوية ، ثم قم بإزالة المادة الطافية النهائية إلى أنبوب طرد مركزي جديد أو حاوية مماثلة موضوعة على الجليد. تقدير الحجم الإجمالي.
5. هلام الترشيح من خلية محللة
ملاحظة: يستخدم ترشيح الجل لإزالة السكروز الموجود في المخزن المؤقت SEB. بينما يساعد السكروز في استقرار الآلية الخلوية أثناء اضطراب الخلايا ، فإنه يقلل من المحصول إذا تم الاحتفاظ به في تفاعلات التعبير البروتيني.
- قم بإعداد عدد كاف من أعمدة الترشيح الهلامية PD-10 التي يتم تغذيتها بالجاذبية (انظر جدول المواد) بتنسيق رف يسمح لها بالتنقيط في صينية تجميع أو حاوية مماثلة تحتها ، مما يضمن قدرتها على تصفية حجم المحللة بالكامل عند 2.5 مل لكل عمود. قم بموازنة الأعمدة مسبقا عن طريق تمرير 10 مل من المخزن المؤقت EB 4 °C (45 mMM-KOH pH 7.6 ، 100 mM KOAc ، 3 mM Mg (OAc) 2) من خلالهم مسبقا.
ملاحظة: تستفيد جميع الخطوات من هذه النقطة من إجرائها في غرفة باردة بدرجة حرارة 4 درجات مئوية. ومع ذلك ، فهي مناسبة أيضا للاحتفاظ بجميع المحللات والكواشف على صينية ثلج على الطاولة. أحد الاستثناءات هو خطوة ترشيح الجل ، حيث يضع المؤلفون رفا من الأعمدة داخل ثلاجة 4 درجات مئوية أثناء إعادة التخزين المؤقت. في الإصدارات الأصلية من هذا البروتوكول ، تم "حظر" أعمدة ترشيح الهلام الجديدة عن طريق التخزين المؤقت للمحلل في البداية وتجاهل الإخراج الأول. على الرغم من أن هذا لا يعتبر ضروريا ، إلا أنه يجب مسح الأعمدة باستخدام المخزن المؤقت EB وتخزينها عند 4 درجات مئوية بين دفعات المحللة. قد يكون لمحلول الإخراج الأول نشاط تعبير بروتين أقل من المخرجات اللاحقة بسبب بعض الاحتفاظ في الخلفية لمكونات المحللة في العمود الجديد. - أضف 2.5 مل من المحللة إلى كل عمود وانتظر حتى يمر إلى العمود. أضف 0.5 مل إضافية من EB لتسوية المحللة في العمود مع التخلص من الشح.
- تخلص من المحللة المفلترة بالهلام عن طريق إضافة 2.5 مل إضافية من EB إلى كل عمود ، وجمع الإخراج عن طريق وضع صينية جديدة ونظيفة أو وعاء آخر أسفل الأعمدة.
6. مكملات محللة الخلية
- استخدم مقياس الطيف الضوئي النانوي (انظر جدول المواد) لقياس القيمة المطلقة280 نانومتر من المحللة المفلترة بالهلام. إذا تجاوز 60 ، قم بتخفيفه ليصل إلى ABS280nm = 60 باستخدام مخزن مؤقت إضافي 4 °C EB.
ملاحظة: أثناء التحكم في مدخلات كثافة الخلية في الاضطراب باستخدام OD600nm يحدد تقريبا قوة إخراج المحللة ، فإن تطبيع Abs280nm بعد تعطيل المحللة والمعالجة يحسن من اتساق دفعة أداء المحللات. يمكن تعديل Lysate Abs280nm لأعلى ولأسفل ، مع عواقب على إنتاجية تعبير البروتين وتجميعه (انظر قسم المناقشة). إذا كان المحللة غير المكملة تشير إلى ABS280nm < 60 ، فقد يكون من الضروري تضمين المزيد من الكتلة الحيوية للليشمانيا في خطوة الاضطراب ، أي زيادة تحميل معطل الخلية إلى OD600nm > 300 في الخطوة 2.1. - أضف محلول تغذية 5x (5x FS ، الجدول 1) إلى المحللة بنسبة 2: 5 واخلطها جيدا. قم بقنصتها في حاويات مناسبة (على سبيل المثال ، أنابيب microfuge سعة 1.5 مل) ، وقم بتجميدها في النيتروجين السائل. إذا كان المرء يتبع الخطوات الاختيارية 7.1-7.3 لتحسين تعبير LTE أدناه ، فاستخدم rNTP.Mg 5x FS المخفض من الجدول 1 بدلا من 5x FS الافتراضي. قم بتضمين 5 × 100 ميكرولتر من القسامات للتجميد لاستخدامها في تجارب التحسين.
ملاحظة: يؤدي التجميد باستخدام 5x FS الافتراضي بنسبة 2: 5 إلى إنشاء LTE مكمل جاهز للتعبير ، يستخدم عند تعبير 7 ميكرولتر / 10 ميكرولتر (وبالتالي ، يصبح 5x FS 1x FS في التفاعل النهائي). ومع ذلك ، يوصي المؤلفون باتباع الخطوات الاختيارية الإضافية حيث يتم توفير 0.6x الكمية الافتراضية من rNTPs والمغنيسيوم في 5x FS. يتبع ذلك خطوة تحسين حيث يتم إضافة مزيج متساوي المولي من الاثنين (يشار إليه باسم rNTP.Mg) لزيادة تفاعلات الاختبار إلى قيمة محسنة. يحتوي FS الجزئي 5x أيضا على قليل النوكليوتيد الذي يغلق تعبير mRNA الداخلي المنشأ (انظر قسم المقدمة). تسلسل قليل النوكليوتيد هو CAATAAAGTACAGAAACTACTACTACTTATATAGCGTT.
7. مراقبة الجودة وتحسين LTE المكمل النهائي
ملاحظة: يتضمن الحد الأدنى من الخطوات اللازمة لتحديد الإضافة "الإضافية" المناسبة ل rNTP.Mg إلى rNTP المختزل والمحلول المكمل بالمغنيسيوم التعبير عن eGFP أو فلوروفور مماثل (على سبيل المثال ، sfGFP) بدون شريك اندماج. تتم إضافة تركيزات متزايدة من rNTP.Mg إلى التفاعلات لتحديد النقطة التي يتم عندها تحسين مستوى التعبير (يقاس على أنه eGFP RFU عبر قارئ لوحة متعدد الأوضاع). تصبح عمليات الإنهاء المبكرة ل eGFP ، والتي ليست فلورية ، واضحة من خلال تقليل eGFP RFU بتركيزات rNTP.Mg عالية جدا. ومع ذلك ، تحدث أعطال المنتج القصير من LTE بشكل متكرر في البروتينات المعبر عنها الأكبر (>50 كيلو دالتون). وبالتالي ، من الممكن إجراء هذا التحسين باستخدام قالب أكبر من eGFP ، خاصة إذا كان متاحا في متجه تعبير مناسب ، مما يوفر اندماجا فلوروفوريا مرغوبا في إنتاجه بواسطة LTE لتطبيق أو دراسة معينة (انظر قسم النتائج التمثيلية).
- قم بإذابة قسمة 100 ميكرولتر وقم بإعداد ستة تفاعلات تعبير 10 ميكرولتر ، يتكون كل منها من 7 ميكرولتر مكملة جزئيا من الخطوة 6.2 ، و 1 ميكرولتر من محلول تعبئة كما هو موضح في الجدول 2 ، و 2 ميكرولتر من الماء عالي النقاء الذي يحتوي على قالب تحكم كاف في الحمض النووي لتحقيق تركيز نهائي قدره 50 نانوغرام / ميكرولتر في التفاعل.
- احتضان التفاعلات لمدة 2 ساعة عند 25 درجة مئوية ومراقبة الزيادة في مضان GFP باستخدام قارئ لوحة متعدد الأوضاع.
ملاحظة: قيم التكوين المناسبة ل GFP هي الإثارة عند 485 نانومتر (عرض النطاق الترددي 5 نانومتر) ، والانبعاثات عند 516 نانومتر (عرض النطاق 5 نانومتر) ، مع فاصل قراءة يبلغ 1 دقيقة لمدة 2 ساعة. - رتب قيم التعبير النهائي لتحديد تركيز rNTP.Mg المقابل لأعلى eGFP RFU. إذا توفرت البيانات الحركية ، أيضا الإشارة إلى زيادة rNTP.Mg من خلال زيادة ثنائية الطور في eGFP RFU خلال فترة التعبير 2 h (انظر قسم النتائج التمثيلية).
- بمجرد تحديد تركيز rNTP.Mg زيادة محسن ، أضفه إلى جميع تعبيرات البروتين الإضافية باستخدام دفعة LTE التي تم استكمالها جزئيا في الخطوات السابقة.
ملاحظة: إذا تم إجراء الاقتباس في الخطوة 6.2 بعناية مع أحجام ثابتة ، فيمكن إضافة الزيادة بأثر رجعي إلى كل قسمة دون إذابة ، على سبيل المثال ، مع وضع القسمة على الثلج الجاف. يتم الآن استكمال هذه الحصص بالكامل ، حيث سيتم خلط rNTP.Mg الصحيح من خلال كل منها عند إذابتها وخلطها للاستخدام.
النتائج
الغرض من التعبير البروتيني الخالي من الخلايا هو إنتاج بروتينات كاملة الطول في شكل نشط مطوي مناسب لمجموعة واسعة من التطبيقات. تمت مقارنة LTE (مستخلص الليشمانيا تارينتولا ) سابقا بأنظمة التعبير الخالية من الخلايا بدائية النواة وحقيقية النواة ، مما يدل على قدرة عالية على تجنب الاقتطاع والتجميع عند التشغيل على النحو الأمثل ، لا سيما بالمقارنة مع التعبير الخالي من الخلايا القائم على الإشريكية القولونية 33. ومع ذلك ، كان هذا مصحوبا في السابق بتباين كبير من دفعة إلى أخرى في جودة المخرجات. تتضمن الطريقة الحالية مزيدا من التحسينات لضمان جودة مخرجات متسقة ، وذلك في المقام الأول من خلال المكملات الجزئية لمحلول التغذية الضروري قبل التجميد الأولي ل LTE في القسام. يتبع ذلك تحسين rNTP.Mg إدخال النسخ في محلول تعبئة يمكن إضافته إلى كل تفاعل لاحق أو استخدامه لإكمال القسامات المجمدة مباشرة. من الجدير بالذكر أن تفاعلات التحسين تمثل أيضا الاستخدام النموذجي ل LTE للتعبير عن البروتينات عمليا ، مع إجراء تفاعلات عند 25 درجة مئوية لمدة 2 ساعة.
توفر البيانات الناتجة عن تحسين تركيز rNTP.Mg في التفاعلات الخالية من الخلايا مجموعة بيانات تمثيلية. تزداد مستويات التعبير عادة مع ارتفاع إدخال النسخ (rNTP.Mg) ، مما يشير إلى التعبير الناجح. ومع ذلك ، يتم الوصول إلى عتبة حيث يميل النظام نحو التعبير غير المنتج للمنتجات المقطوعة ، خاصة في حالة البروتينات الأكبر (>50 كيلو دالتون). يؤدي هذا التعبير دون المستوى الأمثل إلى فقدان إشارة مضان مع زيادة rNTP.Mg ، بشكل خاص مع اندماج الفلوروفور C-terminal ، حيث لا تصل ترجمة عديد الببتيد إلى الفلوروفور نفسه. بالنسبة للاندماجات الطرفية N ، في حين أن الانخفاض في وحدات التألق النسبية (RFU) الكلي لا يحدث بالضرورة مع rNTP.Mg الزائدة ، فإن التعبير الفاشل واضح بشكل واضح على المواد الهلامية SDS-PAGE كمنتجات فلورية متعددة ذات أحجام متناقصة. يستفيد هذا النهج من قدرة GFP (بروتين الفلورسنت الأخضر) على الحفاظ على التألق حتى عند تصوره على جل SDS-PAGE التقليدي ، بشرط عدم تسخين العينات بعد الخلط. بدلا من ذلك ، يتم خلطها مع مخزن تحميل الهلام وتحميلها مباشرة على الجل. في حين أن مواد ومعدات هلام SDS-PAGE قابلة للتبديل بشكل عام ، يجب أن يكون جهاز تصوير الهلام قادرا على تصور مضان GFP. يتم توفير تكوين نموذجي لتصور GFP مع الإثارة عند 485 نانومتر (عرض النطاق الترددي 5 نانومتر) ، والانبعاثات عند 516 نانومتر (عرض النطاق الترددي 5 نانومتر) ، وفاصل قراءة 1 دقيقة على مدار 2 ساعة.
من الممكن تحسين النظام باستخدام تعبير eGFP وحده. يصور الشكل 2A ، B (أقحم) مخرجات التعبير النموذجية لتفاعلات التحسين لدفعتين LTE ، مع زيادة eGFP RFU مع ارتفاع تركيزات rNTP.Mg ، لتصل إلى المستوى الأمثل +0.6x rNTP.Mg (الشكل 2A) و + 0.3x rNTP.Mg (الشكل 2B) لأقصى RFU. يتضمن حل تغذية rNTP المنخفض 0.6x rNTP.Mg ، مما ينتج عنه مستويات rNTP.Mg إجمالية تبلغ 1.2x و 0.9x الكمية الافتراضية لدفعات LTE هذه. يوضح الشكل 2C حركية زيادة RFU أثناء تفاعل دفعة LTE في الشكل 2B ، مما يدل على تفاعل ثنائي الطور مع مرحلتين منفصلتين خلال مدة التفاعل.

الشكل 2: تحسين إضافة rNTP.Mg في LTE مع انخفاض rNTP 5x FS. (أ) مستويات التعبير عن eGFP بعد 140 دقيقة من التعبير من بلازميد التحكم عند مستويات rNTP.Mg أعلى متفاوتة في تفاعل التعبير الخالي من الخلايا (n = 3 ، متوسط ± SD مرسوم). (ب) تحسين دفعة إنتاج LTE مختلفة ، مع إظهار تعبير منخفض يتجاوز عتبة rNTP.Mg معينة. (ج) حركية تراكم eGFP في نفس تفاعلات (B) ، مع زيادة rNTP.Mg الأعلى. تمثل هذه البيانات أيضا الحركية النموذجية لتراكم البروتين في تعبير دفعة LTE. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
ومع ذلك ، تجدر الإشارة إلى أن eGFP ، كونه بروتينا صغيرا (27 كيلو دالتون) يسهل طيه ، من المرجح أن يتم التعبير عنه وطيه ونضجه بغض النظر عن نظام التعبير الخالي من الخلايا المستخدم. يكون فشل النظام أكثر احتمالا عند التعبير عن بروتينات أكبر ذات أهمية ، حيث تصبح المنتجات المقطوعة أكثر وضوحا عند أحجام البروتين المدخلات التي تزيد عن 70 كيلو دالتون33. لذلك ، فإن تحسين النظام باستخدام البروتين (البروتينات) المخصص للاستخدام الفعلي هو أفضل ، حيث لا يزال eGFP موجودا للقياس الكمي ولكن كاندماج N-terminal مع البروتين محل الاهتمام.
يمثل الشكل 3 تحسينا نموذجيا لمستوى زيادة rNTP.Mg عند استخدام قالب بروتين أكبر عرضة لتقديم منتجات مقطوعة (eGFP-Sox18). باستخدام تنسيق SDS-PAGE شبه أصلي (أي بدون عينات تسخين) ، من الممكن تصور الفشل التدريجي للتعبير. من الواضح أن إضافة rNTP.Mg المثلى عند +0.1x (جنبا إلى جنب مع rNTP.Mg 0.6x في محلول التغذية الجزئية ، والتي يبلغ مجموعها 0.7x) تقلل بشكل واضح من جزء نطاق البروتين كامل الطول كجزء من إجمالي منتجات التعبير الفلوري ، مما يدل على فشل النظام مع إضافة rNTP.Mg الزائدة.
كما هو مذكور في البروتوكول ، من الممكن تخطي خطوة تحسين rNTP.Mg وإضافة الكمية الكاملة من rNTP.Mg مباشرة في محلول التغذية "الافتراضي" أثناء الإضافة مباشرة بعد ترشيح الجل في الخطوة 6.2. من خلال القيام بذلك ، يعود البروتوكول بشكل أساسي إلى الطرق الأصلية المنشورة لإنشاء LTE34. ومع ذلك ، يعتقد المؤلفون أن تصميم النظام لتحقيق الأداء الأمثل ، كما هو موضح في الشكل 3 (Lane D إلى Lane E) ، يفوق تعقيد البروتوكول الإضافي ويزيد من قيمة LTE كأداة للتعبير عن البروتين.
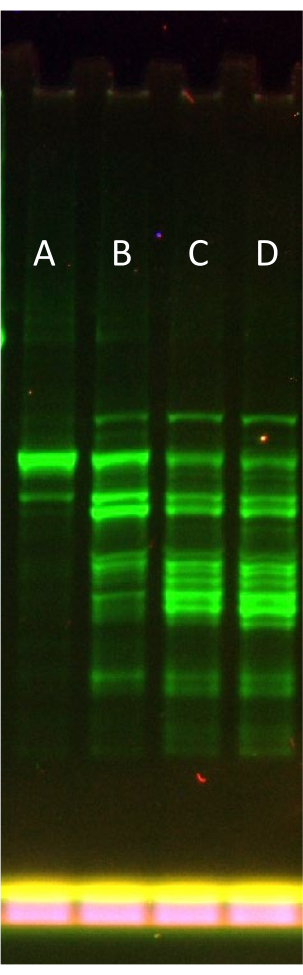
الشكل 3: تأثير زيادة rNTP.Mg على تعبير eGFP-Sox18 في LTE المكمل جزئيا. جل SDS-PAGE شبه أصلي يصور تأثير زيادة rNTP.Mg على تعبير eGFP-Sox18. الحارة أ: +0.1x (rNTP.Mg) تعبئة الرصيد، الحارة B: +0.2x (rNTP.Mg)، الحارة C: +0.3x (rNTP.Mg)، الحارة D: +0.4x (rNTP.Mg). يتم تصور اندماج eGFP الطرفي N عن طريق المسح الفلوري للهلام. يمثل النطاق الأساسي في الحارة A eGFP-Sox18 كامل الطول. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| مكون | تركيز المخزون | 5x حل تغذية | ميكرولتر مخزون / مل 5x حل تغذية |
| الافتراضي (انخفاض rNTP) | الافتراضي (انخفاض rNTP) | ||
| السبيرميدين | 100 مللي متر | 1.25 مللي متر | 12 |
| دي تي تي | 500 مللي متر | 10 مللي متر | 20 |
| فوسفات الكرياتين | 1000 مللي متر | 200 مللي متر | 200 |
| هيبس-كوه درجة الحموضة 7.6 | 2500 مللي متر | 100 مللي متر | 40 |
| PEG3000 | 0.5 فولت / فولت | 0.05 فولت / فولت | 100 |
| كوكتيل مثبطات الأنزيم البروتيني | 120 ضعفا | 5 أضعاف | 43 |
| الأحماض الأمينية | 3.6 مللي مول (ea) | 0.68 مللي مول (ea) | 190 |
| ATP | 100 مللي متر | 8.5 (5.1) مللي متر | 85 (51) |
| جي تي بي | 100 مللي متر | 3.2 (1.9) مللي متر | 32 (19) |
| UTP | 100 مللي متر | 2.5 (1.5) مللي متر | 25 (15) |
| سي تي بي | 100 مللي متر | 2.5 (1.5) مللي متر | 25 (15) |
| المغنيسيوم (OAc) 2 | 1 م | 16.7 (10) مللي متر | 16.7 (10) |
| زعيم مكافحة لصق oligo | 1 مللي متر | 0.05 مللي متر | 50 |
| T7 بوليميراز الحمض النووي الريبي | 5 ملغ/مل | 0.5 مجم / مل | 100 |
| الكرياتين فسفوكيناز | 5 وحدات / ميكرولتر | 0.2 وحدة / ميكرولتر | 42 |
| مياه فائقة النقاء | 19 (93) |
الجدول 1: تركيب محلول تغذية 5x (5x FS) ل LTE. مطلوب 1 مل من 5x FS لكل 2.5 مل من المحللة غير المكملة بعد ترشيح الهلام. يؤدي الاستكمال باستخدام 5x FS الافتراضي إلى إنشاء LTE جاهز للتعبير للاستخدام في تفاعلات التعبير بنسبة 7 ميكرولتر / 10 ميكرولتر. يوصى باستخدام وصفة rNTP.Mg المخفضة (الكميات بخط مائل) لتحسين تعبير LTE وتحتوي على 0.6 ضعف المستويات الافتراضية ل rNTPs والمغنيسيوم. يمكن تعديلها إلى مستويات متغيرة (0.6 إلى 1.1 مرة) في تجربة التحسين اللاحقة باستخدام الإضافات الموضحة في الجدول 2.
| تعبئة rNTP | ATP (100 مللي مول) | GTP (100 مللي مول) | UTP (100 مللي مول) | CTP (100 مللي مول) | مغ أوك (1 م) | مياه فائقة النقاء |
| (1 ميكرولتر / 10 ميكرولتر rxn) | ميكرولتر/200 ميكرولتر | ميكرولتر/200 ميكرولتر | ميكرولتر/200 ميكرولتر | ميكرولتر/200 ميكرولتر | ميكرولتر/200 ميكرولتر | |
| +0x | 0 | 0 | 0 | 0 | 0 | 200 |
| +0.1 مرة | 3.4 | 1.3 | 1 | 1 | 0.7 | 193 |
| +0.2 مرة | 6.8 | 2.5 | 2 | 2 | 1.3 | 185 |
| +0.3 مرة | 10.2 | 3.8 | 3 | 3 | 2 | 178 |
| +0.4x | 13.6 | 5.1 | 4 | 4 | 2.7 | 171 |
| +0.5 مرة | 17 | 6.4 | 5 | 5 | 3.3 | 163 |
الجدول 2: تكوين (rNTP.Mg) حلول زيادة الرصيد لتحسين LTE. تستخدم هذه الحلول لتحسين LTE عن طريق إضافة 1 ميكرولتر من محلول التعبئة لكل 10 ميكرولتر من تفاعل تعبير البروتين. بمجرد تحديد مستوى الزيادة في تجربة التحسين ، يمكن إضافته باستمرار إلى جميع تفاعلات تعبير البروتين اللاحقة باستخدام نفس حصص دفعة LTE. بدلا من ذلك ، يمكن إضافته مباشرة إلى القسامات نفسها عند إضافة 1 ميكرولتر لكل 7 ميكرولتر (بدون ذوبان). بعد الذوبان والخلط ، يتم استخدام هذه المحللات عند 8 ميكرولتر LTE لكل تعبير بروتين 10 ميكرولتر ، مع الحفاظ على مستوى rNTP.Mg زيادة تم تحديده أثناء التحسين.
Discussion
تم نشر بروتوكولات إنشاء LTE على مدار العقد الماضي7 وخضعت لتحديثات دورية25,34. ومع ذلك ، غالبا ما يواجه الوافدون الجدد إلى هذه التقنية منحنى تعليمي حاد ، مما يؤدي إلى تأخير في تحقيق تعبير بروتين عالي الجودة وعالي الغلة. تم الإبلاغ عن تحديات مماثلة من قبل مجموعات بحثية أخرى تعمل مع LTE35 ، لا سيما فيما يتعلق بالاختلافات الكبيرة من دفعة إلى أخرى. يمكن أن يوفر تنسيق البروتوكول المستند إلى الفيديو معرفة إعداد إضافية أقل وضوحا تفيد المستخدمين المحتملين34. تم إدخال تعديلات على البروتوكول ، بهدف زيادة احتمالية النجاح ، وتبسيط الإجراء ، وتقليل الوقت ، وتقليل الأخطاء المتعلقة بالتعقيد.
في اضطراب الخلية ، يعد التحكم الدقيق في تحميل الخلايا في معطل خلية تجويف النيتروجين أمرا بالغ الأهمية34. قد يكون تحقيق ذلك أمرا صعبا بسبب كثافة الخلايا العالية بعد تركيز الخلايا وغسلها. في البروتوكولات الأصلية ، تم استخدام طرق مختلفة ، مثل تدوير حجم صغير من الثقافة المركزة النهائية وتحديد كمية حبيبات الخلية الجزئية. ومع ذلك ، في هذا البروتوكول ، يتم اعتماد نهج أبسط. يتم قياس حجم حصاد الاستزراع وOD 600nm ، وتستخدم هذه القياسات لحساب الحجم المستهدف لتركيز الخلية بالملليلتر ، بهدف الحصول علىOD النهائي المطلوب 600nm من 300. يفترض هذا الحساب أنه لا يحدث فقدان كبير للخلايا أثناء الغسيل. إذا كان هناك اشتباه في فقدان الخلايا ، يتم استخدام طريقة بديلة تتضمن تخفيفات تسلسلية ثلاثية 1/10 للخلايا المركزة بعد الغسيل ، مما يؤدي في النهاية إلى تخفيف 1/1000. يسمح ذلك بقياس OD600nm للتركيز الفعلي ، مما يضمن وصوله إلى الهدف OD600nm = 300 قبل تحميله في المخل.
حتى مع التحكم الدقيق في تحميل معطل الخلية ، يمكن أن يحدث تباين كبير في محتوى بروتين المحللة بعد التعطيل ، كما هو موضح في Abs280nm من المحللة34 غير المفلترة هلاميا. لذلك ، يتم إدخال قياس Abs280nm قبل مكملات المحللة ، ويتم تخفيف المحللة لتحقيق Abs280nm = 60. نظرا لأن تفاعلات تعبير البروتين تتضمن في النهاية 0.5 فولت / فولت محللة ، فإن هذا ينتج عنه تحلل تفاعل موحد مع Abs280nm = 30. يميل أداء المحللة الذي تم تكوينه بأقل من Abs280nm = 30 إلى إنتاج تفاعلات طويلة الأمد ومنخفضة التعبير ، في حين أن القيم الأكبر من Abs280nm = 30 تميل إلى إنتاج تعبير أعلى ولكن ميل متزايد لتجميع البروتين الناتج.
يتضمن تحسين أداء Lysate ضبط مدخلات النسخ في محلول التغذية الذي يكمل المحللة ، وتحديدا rNTPs والمغنيسيوم ، في خطوات التفاعل الاختيارية 7.0-7.3. من المهم ملاحظة أن rNTPs والمغنيسيوم لهما أدوار معقدة ومتعددة في نظام ترجمة النسخ المقترن مثل LTE25. ومع ذلك ، فقد ثبت أن LTE لها تعبير تقريبي عن المغنيسيوم الأمثل عند rNTP (mM) + 1.5. نظرا لأن المحللة نفسها تساهم ب 1.5 mM Mg في خليط التفاعل النهائي ، فإن هذا يوفر طريقة مباشرة لتغيير مدخلات rNTP وتحسينها دون التحسين المشترك ل Mg عن طريق تغيير rNTP.Mg متساوي المولي.
يظهر أداء المحللة تباينا كبيرا عند زيادة rNTP.Mg ، مع زيادة تعبير البروتين بشكل عام حتى عتبة حيث ينعكس التحسين ، مما يؤدي إلى حدوث أعطال في التعبير في شكل منتجات قصيرة بدلا من البروتينات كاملةالطول 25. لذلك ، فإن التحسين النهائي للنظام لتحديد هذه العتبة مفيد. استخدم بروتوكول LTE الأصلي وصفة حل تغذية ثابتة ، مع بعض تحسين Mg المقترح34. تم تعديل هذا النهج لاحقا باستخدام تحسين rNTP أكثر شمولا. ومع ذلك ، تتطلب هذه الطريقة تجميدا مفاجئا للمحللة في شكل غير مكمل لتمكين التحسين على القسمة ، والتي تميل إلى تقليل مستويات تعبير المحللة في نهاية المطاف. ويعزى هذا الانخفاض إلى فقدان خصائص الحماية من البرد لمحلول التغذية عند التجميد المفاجئ للمحللات غير المكملة مباشرة بعد خطوة الترشيح الهلامي. يحقق البروتوكول الحالي توازنا من خلال الاستكمال بمحلول تغذية يحتوي على rNTP.Mg مخفضة قبل التجميد ، والتي يمكن زيادتها إلى المستوى الأمثل عند نقطة التعبير.
من المتوقع أن تعزز تحسينات البروتوكول هذه فائدة نظام LTE للمستخدمين المبتدئين من خلال التخفيف من المصادر الأولية للتنوع وتحسين اتساق مخرجات تعبير البروتين.
Disclosures
لا توجد مصالح مالية متنافسة.
Acknowledgements
يرغب المؤلفون في الاعتراف بالعديد من أعضاء مختبر ألكسندروف الذين ساهموا في تطوير أنظمة LTE على مدى السنوات ال 10 الماضية ، ولا سيما سيرجي مورييف الذي كان رائدا في النظام وطور موقع دخول الريبوسوم SITS. تم إنشاء الشكل 1 بواسطة Biorender.com واستنساخه بموجب ترخيص.
Materials
| Name | Company | Catalog Number | Comments |
| PD-10 SuperDex 25 Columns | Cytiva | 17085101 | Gel filtration columns |
| Nitrogen Cavitation cell disrupter | Parr Industries | 4635 or 4639 | Cell Disrupter |
| Bovine derived Hemin | Sigma-Aldrich | H5533 | Culture additive |
| Penicillin/Streptomycin 10000U/ml | Thermo-Fisher | 15140122 | Antibiotic mix |
| Optiplate 384 | Perkin-Elmer | 6007290 | Multiwell plate for 10ul expressions |
| Oligonucleotide | IDT synthesis | Oligo with sequence CAATAAAGTACAGAAACTGATAC TTATATAGCGTT | |
| Creatine Phosphokinase | Sigma-Aldrich | 9001-15-4 | Enzyme |
| Tecan Spark | Tecan | or similar Multimode Platereader | |
| Chemidoc MP Imager | Biorad | or similar SDS-PAGE gel Imager | |
| 4-12% Bis-Tris Gels | Invitrogen | NW04125 | SDS-PAGE gels |
| Biophotometer | Eppendorf | or similar Cuvette Specrophotometer | |
| Nanodrop One | Thermofisher | Nanodrop spectrophotometer | |
| Avanti JXN-26 centrifuge | Beckman Coulter | or similar centrifuge, with rotors/tubes rated 10K and 50K g | |
| 5424R microcentrifuge | Eppendorf | or similar microcentrifuge, with 1.5ml microcentrifuge tubes | |
| Flask Incubator Inova S44i | Eppendorf | or similar flask incubator shaker suitable for 5L Flasks | |
| 5L glass culture flasks | Baffled glass flasks for culture growth | ||
| Bactotryptone | BD | 211705 | Growth medium |
| Yeast Extract | Merck | VM930053 | Growth medium |
| Glycerol | Any analytical grade | ||
| Glucose | Any analytical grade | ||
| KH2PO4 | Any analytical grade | ||
| K2HPO4 | Any analytical grade | ||
| UltraPure water | Invitrogen | 10977-015 | Or output from any MilliQ-type water dispenser |
References
- Nirenberg, M. W., Matthaei, J. H. The dependence of cell-free protein synthesis in E.coli upon naturally occurring or synthetic polyribonucleotides. Proc Natl Acad Sci USA. 47 (10), 1588-1602 (1961).
- Caschera, F., Noireaux, V. Synthesis of 2.3 mg/ml of protein with an all Escherichia coli cell-free transcription-translation system. Biochimie. 99, 162-168 (2014).
- Kelwick, R., Webb, A. J., MacDonald, J. T., Freemont, P. S. Development of a Bacillus subtilis cell-free transcription-translation system for prototyping regulatory elements. Metab Eng. 38, 370-381 (2016).
- Ezure, T., et al. Cell-free protein synthesis system prepared from insect cells by freeze-thawing. Biotechnol Prog. 22 (6), 1570-1577 (2006).
- Harbers, M. Wheat germ systems for cell-free protein expression. FEBS Letters. 588 (17), 2762-2773 (2014).
- Kobs, G. Selecting the cell-free protein expression system that meets your experimental goals. Promega Corporation. 21, 6-9 (2008).
- Kovtun, O., et al. Leishmania cell-free protein expression system. Methods. 55 (1), 58-64 (2011).
- Basile, G., Peticca, M. Recombinant protein expression in Leishmania tarentolae. Mol Biotechnol. 43 (3), 273-278 (2009).
- Mureev, S., Kovtun, O., Nguyen, U. T., Alexandrov, K. Species-independent translational leaders facilitate cell-free expression. Nat Biotechnol. 27 (8), 747-752 (2009).
- Gambin, Y., et al. Single-molecule fluorescence reveals the oligomerization and folding steps driving the prion-like behavior of ASC. J Mol Biol. 430 (4), 491-508 (2018).
- Sierecki, E., et al. Rapid mapping of interactions between human SNX-BAR proteins measured in vitro by AlphaScreen and single-molecule spectroscopy. Mol Cell Proteomics. 13 (9), 2233-2245 (2014).
- Sierecki, E., et al. Nanomolar oligomerization and selective co-aggregation of alpha-synuclein pathogenic mutants revealed by single-molecule fluorescence. Sci Rep. 6, 37630 (2016).
- Leitao, A., Bhumkar, A., Hunter, D. J. B., Gambin, Y., Sierecki, E. Unveiling a selective mechanism for the inhibition of alpha-synuclein aggregation by beta-synuclein. Int J Mol Sci. 19 (2), 334 (2018).
- Gambin, Y., et al. Single-molecule analysis reveals self assembly and nanoscale segregation of two distinct cavin subcomplexes on caveolae. Elife. 3, e01434 (2013).
- Ve, T., et al. Structural basis of TIR-domain-assembly formation in MAL- and MyD88-dependent TLR4 signaling. Nat Struct Mol Biol. 24 (9), 743-751 (2017).
- Guo, Z., et al. Subunit organisation of in vitro reconstituted HOPS and CORVET multisubunit membrane tethering complexes. PLoS One. 8 (12), e81534 (2013).
- Ruehrer, S., Michel, H. Exploiting Leishmania tarentolae cell-free extracts for the synthesis of human solute carriers. Mol Membr Biol. 30 (4), 288-302 (2013).
- Varasteh Moradi, S., et al. Mapping Interactions among cell-free expressed Zika virus proteins. J Proteome Res. 19 (4), 1522-1532 (2020).
- Gagoski, D., et al. Cell-free pipeline for discovery of thermotolerant xylanases and endo-1,4-beta-glucanases. J Biotechnol. 259, 191-198 (2017).
- Ergun Ayva, C., et al. Exploring performance parameters of artificial allosteric protein switches. J Mol Biol. 434 (17), 167678 (2022).
- Lau, D., et al. Fluorescence biosensor for real-time interaction dynamics of host proteins with HIV-1 capsid tubes. ACS Appl Mater Interfaces. 11 (38), 34586-34594 (2019).
- Ryan, S. M., et al. Novel antiinflammatory biologics shaped by parasite-host coevolution. Proc Natl Acad Sci USA. 119 (36), e2202795119 (2022).
- McMahon, K. A., et al. Identification of intracellular cavin target proteins reveals cavin-PP1alpha interactions regulate apoptosis. Nat Commun. 10 (1), 3279 (2019).
- Sierecki, E., et al. A cell-free approach to accelerate the study of protein-protein interactions in vitro. Interface Focus. 3 (5), 20230018 (2013).
- Johnston, W. A., Moradi, S. V., Alexandrov, K. Adaption of the Leishmania cell-free expression system to high-throughput analysis of protein interactions. Methods Mol Biol. 2025, 403-421 (2019).
- Jung, W., et al. Cell-free formation and interactome analysis of caveolae. J Cell Biol. 217 (6), 2141-2165 (2018).
- Fontaine, F. R., et al. Functional domain analysis of SOX18 transcription factor using a single-chain variable fragment-based approach. MAbs. 10 (4), 596-606 (2018).
- Overman, J., et al. Pharmacological targeting of the transcription factor SOX18 delays breast cancer in mice. Elife. 6, e21221 (2017).
- Kubala, M. H., et al. Mammalian farnesyltransferase alpha subunit regulates vacuolar protein sorting-associated protein 4A (Vps4A)--dependent intracellular trafficking through recycling endosomes. Biochem Biophys Res Commun. 468 (4), 580-586 (2015).
- Han, S. P., et al. Cortactin scaffolds Arp2/3 and WAVE2 at the epithelial zonula adherens. J Biol Chem. 289 (11), 7764-7775 (2014).
- Das Gupta, K., et al. Class IIa histone deacetylases drive toll-like receptor-inducible glycolysis and macrophage inflammatory responses via pyruvate kinase M2. Cell Rep. 30 (8), 2712-2728.e8 (2020).
- Leitão, A. D. G., et al. Selectivity of protein interactions along the aggregation pathway of α-synuclein. BioRxiv. , (2021).
- Gagoski, D., et al. Performance benchmarking of four cell-free protein expression systems. Biotechnol Bioeng. 113 (2), 292-300 (2016).
- Johnston, W. A., Alexandrov, K. Production of eukaryotic cell-free lysate from Leishmania tarentolae. Methods Mol Biol. 1118, 1-15 (2014).
- Hunter, D. J. B., Bhumkar, A., Giles, N., Sierecki, E., Gambin, Y. Unexpected instabilities explain batch-to-batch variability in cell-free protein expression systems. Biotechnol Bioeng. 115 (8), 1904-1914 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved