Method Article
Hematopoetik Sitokin ile Tümör Aşılaması Kullanılarak Deneysel Melanom İmmünoterapi Modeli
Bu Makalede
Özet
Protokol, Flt3L eksprese eden B16-F10 melanomu ile hücre bazlı tümör aşılamasını kullanan bir kanser immünoterapi modeli sunmaktadır. Bu protokol, kültürlenmiş tümör hücrelerinin hazırlanması, tümör implantasyonu, hücre ışınlaması, tümör büyümesinin ölçülmesi, intratümöral immün hücrelerin izolasyonu ve akış sitometrisi analizi dahil olmak üzere prosedürleri göstermektedir.
Özet
Fms benzeri tirozin kinaz 3 ligand (Flt3L), dendritik hücrelerin (DC'ler) hayatta kalmasını ve farklılaşmasını destekleyen hematopoetik bir sitokindir. Tümör aşılarında doğuştan gelen bağışıklığı aktive etmek ve antitümör yanıtlarını arttırmak için kullanılmıştır. Bu protokol, Flt3L eksprese eden B16-F10 melanom hücrelerinden oluşan hücre bazlı tümör aşısının yanı sıra tümör mikroortamındaki (TME) bağışıklık hücrelerinin fenotipik ve fonksiyonel analizini kullanan terapötik bir model göstermektedir. Kültürlü tümör hücresi hazırlığı, tümör implantasyonu, hücre ışınlaması, tümör boyutu ölçümü, intratümöral immün hücre izolasyonu ve akım sitometri analizi için prosedürler tanımlanmıştır. Bu protokolün genel amacı, klinik öncesi katı tümör immünoterapi modeli ve tümör hücreleri ile infiltrasyon yapan bağışıklık hücreleri arasındaki ilişkiyi incelemek için bir araştırma platformu sağlamaktır. Burada tarif edilen immünoterapi protokolü, melanomun kanser terapötik etkisini iyileştirmek için immün kontrol noktası blokajı (anti-CTLA-4, anti-PD-1, anti-PD-L1 antikorları) veya kemoterapi gibi diğer terapötik modalitelerle birleştirilebilir.
Giriş
Kanser immünoterapisi, daha az toksik yan etkileri ve daha dayanıklı yanıtlarına dayanan umut verici bir terapötik strateji olarak kabul edilmiştir. Onkolitik virüs tedavileri, kanser aşıları, sitokin tedavileri, monoklonal antikorlar, evlat edinen hücre transferi (CAR-T hücreleri veya CAR-NK) ve immün kontrol noktası blokajı1 dahil olmak üzere çeşitli immünoterapi türleri geliştirilmiştir.
Kanser aşıları için, tüm hücre bazlı aşılar, protein veya peptit aşıları ve RNA veya DNA aşıları gibi farklı terapötik aşı formları vardır. Aşılama, antijen sunan hücrelerin (APC'ler) tümöre özgü antijenler de dahil olmak üzere tümör antijenlerini işleme ve bunları T hücrelerine immünojenik bir biçimde sunma yeteneğine dayanır. Dendritik hücrelerin (DC'ler) en güçlü APC'ler olduğu bilinmektedir ve antitümör immünitesinde önemli bir rol oynadığına inanılmaktadır 2,3. Bu hücreler tümör antijenlerini alır ve işler ve daha sonra T-hücresi reseptörü (TCR) ve kostimülatör moleküllerin katılımı yoluyla tümöre özgü T efektör (Teff) hücrelerini astarlamak ve aktive etmek için drenaj lenf düğümlerine (dLN) göç eder. Bu, tümöre sızan ve tümör hücrelerini öldüren tümöre özgü sitotoksik T hücrelerinin (CTL) farklılaşması ve genişlemesi ile sonuçlanır4. Sonuç olarak, DC'lerin aktivasyonu ve olgunlaşması, tümör antijenlerine karşı bağışıklığı uyarmak için çekici stratejileri temsil eder.
Flt3L'nin, MHC sınıf II, CD11c, DEC205 ve CD86 proteinlerini5 eksprese eden fonksiyonel olarak olgun DC'lerin olgunlaşmasını ve genişlemesini teşvik ettiği bilinmektedir. Flt3L genini (Adv-Flt3L ) içeren bir adenovirüs vektörünün intratümöral, ancak intravenöz olmayan uygulamasının, ortrotopik tümörlere karşı immün terapötik aktiviteyi teşvik ettiği gösterilmiştir6. Flt3L ayrıca, tümör antijenlerinin DC'ler tarafından çapraz sunumunu arttırmanın ve böylece antitümör yanıtlarını arttırmanın bir yolu olarak retroviral olarak transdüke edilmiş Flt3L'yi kararlı bir şekilde eksprese eden ışınlanmış B16-F10 hücrelerinden oluşan tümör hücresi bazlı aşılarda da kullanılmıştır. Burada açıklanan B16-Flt3L tümör aşılama protokolü, Dr. James Allison'ın grup7'si tarafından yayınlanan bir çalışmaya dayanmaktadır. Bu yazıda, CTLA-4 blokajı ile kombine edilen bir B16-Flt3L aşısının, yerleşik melanomun reddini sinerjik olarak indüklediğini ve sağkalımın artmasına neden olduğunu bildirmişlerdir.
Bu protokolün amacı, melanom için klinik öncesi bir immünoterapi modeli sağlamaktır. Burada, tümör aşılarının nasıl hazırlanacağı ve implante edileceği ve katı tümörden intratümöral immün hücrelerin bileşiminin ve işlevinin nasıl analiz edileceği hakkında ayrıntılı prosedürler açıklanmaktadır.
Protokol
Çalışmada kullanılan tüm fareler, kontrollü sıcaklık ve nem ile spesifik patojensiz koşullar altında La Jolla İmmünoloji Enstitüsü'nün (LJI) vivaryumunda muhafaza edildi ve barındırıldı. Hayvan deneyleri, LJI Hayvan Bakım Komitesi tarafından onaylanan kılavuzlara ve protokollere göre 8-14 haftalık dişi C57BL / 6 farelerle gerçekleştirildi.
1. İmplantasyon için kültürlenmiş tümör hücrelerinin hazırlanması
- Iscove'un Modifiye Dulbecco'nun ortamındaki (IMDM) kültür B16-F10 melanom hücreleri% 10 ısı-inaktive FBS, 2 mM glutamin, 1 mM sodyum piruvat, 1 mM MEM esansiyel olmayan amino asitler ve her biri 100 U / mL penisilin ve streptomisin içerir. Hücre hattını 37 ° C'de% 5 CO2 altında tutun.
- 1.5-2 x 106 B16-F10 hücrelerini 175T şişede ve kültürde 2 gün boyunca tohumlayın. Hücreleri% 75 -% 80 birleştiğinde hasat edin.
- Kültür ortamını çıkarın ve şişeyi PBS ile bir kez yıkayın. PBS'yi aspire edin ve 5 mL% 0.25 tripsin-EDTA ekleyin, ardından kültür şişesinin kenarına sert bir şekilde dokunun.
- Tripsin-EDTA'yı nötralize etmek için 15 mL kültür ortamı ekleyin ve şişenin içeriğini 50 mL'lik bir santrifüj tüpüne dökün. Bulaşık yüzeyini 10 mL PBS ile yıkayın ve aynı 50 mL tüpe dökün.
- Hücreleri 200 x g'da 5 dakika boyunca santrifüj yapın. Süpernatantı atın ve tüpün dibine dokunarak hücre peletini kırın.
- Soğuk 10 mL PBS ekleyin ve hücre süspansiyonunu yavaşça pipetleyin; Daha sonra, hemositometre kullanarak hücreleri manuel olarak sayın. Enjeksiyondan önce hücreleri buz üzerinde tutun.
2. Tümör implantasyonu
- Gaz, duman davlumbazında dakikada 1.0 L gaz akış hızında% 5 izofluran ile fareleri uyuşturur. Fareler tamamen anestezi altına alındıktan sonra akış hızını% 2 izofluran idame dozuna değiştirin. Bu protokol için veteriner hekim tarafından kurumsal hayvan bakımı ve kullanım kılavuzlarına uyularak anestezi uygulanmıştır.
- Farelerin sol kanadındaki saçları tıraş edin ve enjeksiyon bölgesini alkollü mendiller kullanarak sterilize edin. İntradermal olarak (i.d.) B16-F10 tümör hücrelerini, 30 G'lik bir iğne kullanarak sol kanattaki 50 μL soğuk PBS'de 5 x 105 hücrede implante edin.
NOT: İmplante edilmiş B16-F10 tümör hücrelerinin dozunun, başarılı tümör gelişimi için 0.5-5 x 105 hücre aralığında ayarlanması gerekebilir. - İmplantasyondan sonra, elektronik bir dijital kumpas kullanarak tümör uzunluğunu ve genişliğini haftada üç kez ölçün. Aşağıdaki formülü kullanarak tümör hacmini (mm3) hesaplayın:
Tümör hacmi (mm3) = genişlik2 × uzunluk × 0.5
Tümörler ≥2 mm'lik bir boyuta ulaştığında fareleri tümör aşısı ile tedavi edin.
NOT: Tümörler genellikle 5 x 105 tümör hücresinin implantasyonundan sonraki 3. günde ölçülebilir. Erkek C57BL/6, Rag1-/- veya Rag2-/-γc-/-farelerde daha hızlı B16-F10 tümör büyüme hızı gözlendi. Benzer bir gözlem diğer çalışmalarda da tanımlanmıştır8. Farelerin cinsiyetini tutarlı tutmak tavsiye edilir. Bununla birlikte, NIH'nin biyomedikal araştırmalarda önemli bir biyolojik değişken olarak cinsiyete vurgu yaptığını unutmayın.
3. Flt3L eksprese eden B16-F10 (B16-Flt3L) hücrelerinin aşı hazırlanması ve enjeksiyonu
- B16-Flt3L hücrelerini% 8 ısıyla inaktive edilmiş FBS, 2 mM glutamin ve her biri 100 U / mL penisilin ve streptomisin içeren DMEM'de% 5 CO2 altında 37 ° C'de tutun.
- Tohum 1 x 106 B16-Flt3L hücreleri 175T şişe ve kültürde 2 gün boyunca. Hücreleri 1.3 ila 1.6. adımlarda açıklandığı gibi% 75 -% 80 oranında birleştiğinde hasat edin ve 1 mL soğuk PBS'de askıya alın.
- 160 kV ve 25 mA parametre ayarlı X-ışını Işınlayıcısı kullanarak gama ışınlarının 150 Gy dozunda hücreleri ışınlayın. Enjeksiyondan önce tripan mavisi boyama ile hücre canlılığını sayın ve kontrol edin.
- Gaz, daha önce tarif edildiği gibi fareleri anestezi altına alır ve enjeksiyon bölgesini alkollü mendiller kullanarak sterilize eder. Farelere, orijinal tümör implantasyonu ile aynı kanatta, 50 μL soğuk PBS'de 1 x 106 ışınlanmış B16-Flt3L hücreleri ile intradermal olarak, ilk hücre implantasyonundan sonraki 3, 6 ve 9. günlerde birincil tümör bölgesinden ~ 1 cm uzakta enjekte edin.
- Aşı enjeksiyon bölgelerini, birincil tümörden ayırt etmek için renkli bir kalemle işaretleyin.
NOT: Başlangıçta 0,5 x 105 B16-F10 hücresi implante edilirse, aşı tedavisinin 8, 11 ve 14. günlerde yapılması önerilir.
4. İntratümöral immün hücre izolasyonu
- Deneyin sonunda CO2 ve duman davlumbazındaki servikal çıkığı kullanarak fareleri kurban edin (tümör implantasyonundan sonraki 15. günde; Şekil 1).
- Tümörü her fareden deri ile cerrahi olarak çıkarın ve 1 mL% 10 FBS / RPMI-1640 orta ile 24 delikli plakaya koyun. Tümörleri tartmadan önce bir kağıt havlu kullanarak kurulayın.
- Tümörleri küçük parçalara ayırın. 2 mL sindirim tamponu (RPMI-1640 ortamında 100 μg/mL TL Liberaz ve 200 μg/mL DNaz I) ekleyin ve 37 °C'de 25 dakika kuluçkaya yatırın.
- Sindirimi durdurmak için 10 mL% 10 FBS / RPMI-1640 ortamı ekleyin. Hücreleri 25 mL'lik bir serolojik pipet kullanarak aktarın ve 40 μm'lik bir hücre süzgeci üzerindeki dokuyu öğütmek için 1 mL'lik bir şırınganın pistonunu kullanın.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'de santrifüj edin. Pelet, PBS'de% 40 yoğunluk gradyanı spesifik ortamının 5 mL'sinde 1x konsantrasyona seyreltilmiş olarak yeniden askıya alın).
- Hücre süspansiyonunu, PBS içeren %80 yoğunluk gradyanına özgü ortamın 5 mL'sinin üzerine yavaşça ekleyin. Oda sıcaklığında (RT) 23 dakika boyunca düşük fren ayarıyla hücreleri 325 x g'de santrifüj yapın.
- Santrifüjlemeden sonra, lökosit tabakasını arayüzde% 40 ila% 80 yoğunluk gradyanına özgü ortam arasında dikkatlice toplayın ve 40 μm hücre süzgecinden geçirin. Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'de santrifüj edin.
- Pelet, RT'de 5 dakika boyunca 2 mL kırmızı kan hücresi (RBC) lizis tamponunda inkübe edin. Kuluçkadan sonra, RBC lizis tamponunu söndürmek için 10 mL% 10 FBS / RPMI-1640 ortamı ekleyin.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'de santrifüj edin. Hücreleri %10 FBS/RPMI-1640 ortamının 0,5 mL'sinde yeniden askıya alın ve daha fazla analiz için kullanmadan önce toplam hücre sayısını sayın.
NOT: Dalak veya dLN'yi, akış sitometrisi analizi ile immün hücre alt kümelerinin geçit stratejisi için kontroller olarak toplayın. Aşağıdaki değişikliklerle yukarıda açıklandığı gibi hücre izolasyon yöntemini izleyin: 70 μm'lik bir ağ filtresinde dokuyu öğütmek için 1 mL'lik bir şırınganın pistonunu kullanın. Tek hücreli süspansiyonlar elde etmek için dokuyu% 10 FBS / RPMI-1640 ortamı ile yıkayın. RBC'yi açıklandığı gibi lize edin.
5. Akış sitometrisi analizi
NOT: Lökosit tabakasından toplanan hücreler bağışıklık hücreleri ve tümör hücreleri içerir. İki bağımsız boyama paneli önerilir.
- Yüzey boyama
- Hücreleri 96 delikli V şeklinde bir alt plakaya aktarın. Hücreleri PBS ile yıkayın ve RT'de 15 dakika boyunca hücre canlılığı boyası (50-100 μL / kuyu) ile lekeleyin.
- Hücreleri 4 ° C'de 5 dakika boyunca 500 x g'de santrifüj edin. Karışık antikorlarla yüzey belirteçlerini ( Malzeme Tablosunda ayrıntılı seyreltme sağlanmıştır) FACS tamponunda (PBS'de% 1 FBS ve% 0.05 NaN3 ) buz üzerinde 30 dakika (50-100 μL / kuyu) sabitleyin.
- Hücreleri 5 dakika boyunca 500 x g'de santrifüj edin ve iki kez FACS tamponu ile yıkayın.
- Hücreleri buz üzerinde 35 dakika boyunca hücre fiksasyon tamponu (50-100 μL / kuyu) ile sabitleyin. Hücreleri 5 dakika boyunca 500 x g'de santrifüj edin ve FACS tamponu ile iki kez yıkayın.
- Numuneleri 4 °C'de FACS tamponunda (150-200 μL/tüp) saklayın ve ışıktan koruyun. Örnekleri bir akış sitometresinde alın. DC'ler ve T hücreleri popülasyonu için, Şekil 2B ve Şekil 3A'da sağlanan geçit stratejilerini izleyin.
NOT: Miyeloid DC'lerin boyanması için, yüzey antikorlarının inkübasyonundan önce (adım 5.1.2) buz üzerinde 15 dakika boyunca FC-blokerinin (Sıçan anti-fare CD16 / CD32) inkübe edilmesi önerilir.
- Ex vivo yeniden stimülasyon üzerine sitokin analizi
- Hücreleri tam ortamda (% 10 FBS, 10 mM HEPES, pH 7.2-7.6, 0.1 mM esansiyel olmayan amino asit, 1 mM sodyum piruvat, her biri 100 U / mL penisilin ve streptomisin, 50 μM 2-merkaptoetanol ve 2 mM L-glutamin ile desteklenmiş RPMI-1640) plakalayın ve% 5 CO2 altında 37 ° C'de 4 saat boyunca protein taşıma inhibitörü varlığında 50 ng / mL PMA artı 1 μM iyonomisin ile uyarın.
- Yukarıda adım 5.1'de açıklandığı gibi yüzey işaretleyicileri için yüzey boyama işlemi gerçekleştirin.
- Geçirgenlik çözeltisini (50-100 μL / kuyu) ekleyin ve hücre içi boyama için RT'de 5 dakika inkübe edin. Sitokinlere veya nükleer proteinlere özgü antikorlara sahip hücreleri, permeabilizasyon çözeltisinde (50-100 μL / kuyu) buz üzerinde 60 dakika boyunca veya 4 ° C'de bir gecede inkübe edin.
- Hücreleri 5 dakika boyunca 500 x g'de santrifüj edin ve iki kez FACS tamponu ile yıkayın. Numuneleri 4 °C'de saklayın ve ışıktan koruyun. Örnekleri bir akış sitometresinde alın.
NOT: Optimum boyama işlemini gerçekleştirmek için antikor seyreltmesinin gerektiği gibi ayarlanması gerekebilir.
Sonuçlar
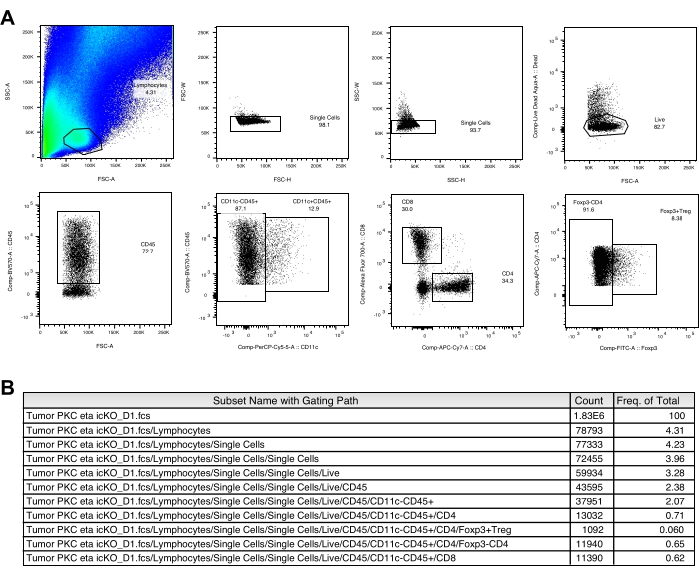
İmplante edilen B16-F10 hücrelerinin görünür siyah bir noktası genellikle tümör implantasyonundan ~ 3 gün sonra cilt yüzeyinde gözlenir. Fareler, tümör nodülünün ≥2 mm'lik bir boyuta ulaşmasından 3, 6 ve 9 gün sonra tümör aşısı ile tedavi edilir. Tümör implantasyonundan ~ 2 hafta sonra aşılanmış farelerde tümör büyümesinde anlamlı bir azalma gözlemledik (Şekil 1). Deneyin sonunda, intratümöral immün hücreleri izole ettik ve yukarıda tarif edildiği gibi kısa bir in vitro stimülasyondan sonra sitokin üretiminin yanı sıra sayı ve hücre yüzey belirteci ekspresyonlarını analiz ettik. Lökosit tabakasından toplanan hücreler hala birçok tümör hücresi içerir ve bu da lenfosit popülasyonunu kolayca tanımlamayı biraz zorlaştırır. Bu nedenle, akım sitometri analizinde intratümöral immün hücre alt kümelerinin uygun geçişi için paralel splenositlerde kullanılması önerilmektedir (Şekil 2A). Burada, CD103+CD11c+DC, CD8+, CD4+ ve Treg'in geçiş stratejileri kompanzasyon matrisi ile birlikte gösterilmiştir (Şekil 2B ve Şekil 3A) (Tablo 1 ve Tablo 2). Edinilen sayımların ve her popülasyonun sıklığının temsili verileri de Şekil 2C ve Şekil 3B'de verilmiştir.
Aşılanmış farelerden en güçlü tümör antijen işleme vesunum hücrelerini temsil eden intratümöral CD103 + CD11c + DC'ler, CD86'nın önemli ölçüde yükselmiş bir ekspresyonunu göstermiştir (Şekil 4). Aşılanmış fareler ayrıca tümör infiltrasyonu yapan CD8 + ve CD4 + Foxp3 − T hücrelerinde (Şekil 5A) ve ayrıca CD8 + GzmB + ve IFN-γ + CTL'lerde (Şekil 5B) bir artış göstermiştir. Bu sonuçlar, bu tümör aşılamasının DC olgunlaşmasını desteklediğini ve daha güçlü antitümör bağışıklığı indüklediğini göstermektedir.
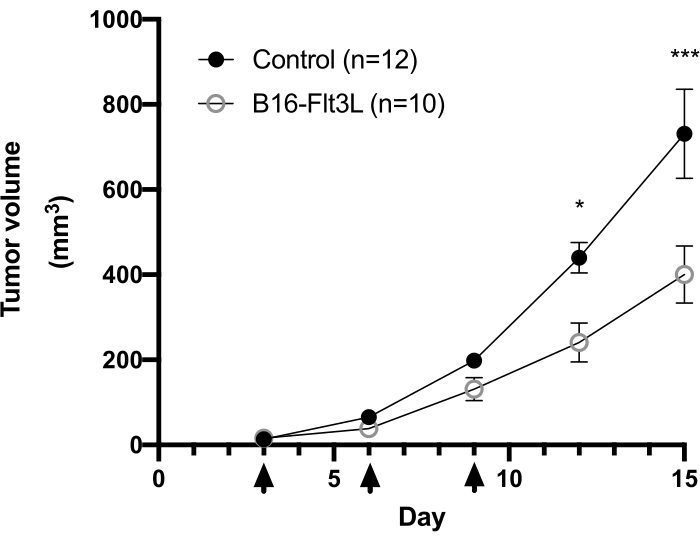
Şekil 1: Flt3L eksprese eden B16-F10 melanom hücreleri kullanılarak hücre bazlı tümör aşısının terapötik bir modelinde tümör büyümesinin analizi. Dişi C57BL / 6 fareleri, B16-F10 hücreleri (5 x 105) ile implante edildi ve aynı kanattaki bitişik bir bölgede ışınlanmış (150 Gy) B16-Flt3L hücreleri (1 x 106) ile enjekte edildi. Ok uçları aşılamanın zaman noktalarını gösterir. Dört deneyin kümülatif verileri gösterilmiştir (Kontrol, n = 12; B16-Flt3L, n = 10). Veriler ortalama ± SEM olarak sunulmuştur. Bonferroni son testi ile iki yönlü tekrarlanan ölçümler ANOVA testi ile istatistiksel analiz. *P < 0,05; ***P 0,001 <. Bu rakam11'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Lenfositlerin ve CD103+CD11c+DC'lerin geçiş stratejileri. (A) Dalak ve tümör örneklerinde lenfositlerin geçit stratejileri. (B) Tümör örneğinde intratümöral CD103+CD11c+DC'lerin geçiş stratejileri. (C) Temsili bir aşılanmamış kontrol faresinden her popülasyonun edinilmiş sayıları ve sıklığı gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Şekil 3: CD8+, CD4+ ve Treg'in geçit stratejileri. (A) Tümör örneğinde T hücrelerinin geçit stratejileri. (B) Temsili aşılanmamış bir kontrol faresinden her popülasyonun edinilmiş sayıları ve sıklığı gösterilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
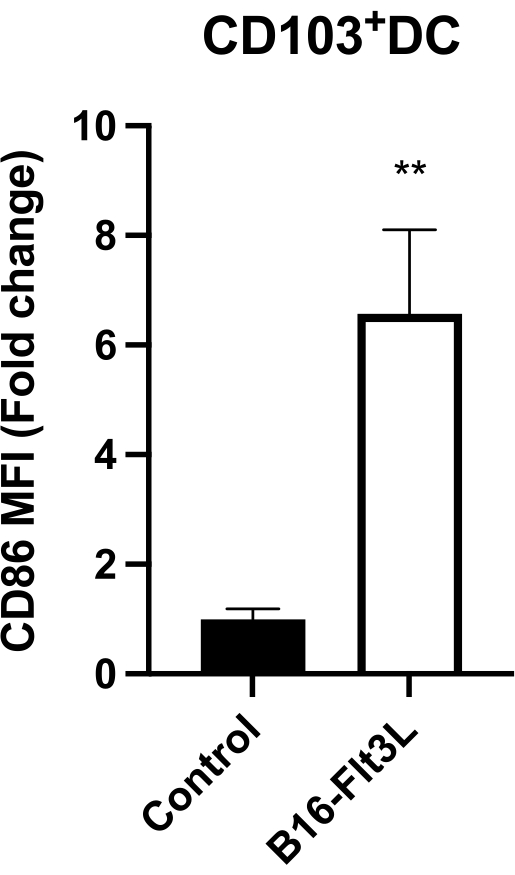
Şekil 4: CD103+ intratümöral DC'lerde CD86 yüzey ekspresyonu. İfade, kontrol grubunda ortalama MFI'ye normalleştirilmiş medyan floresan yoğunluğu (MFI) olarak rapor edilir (= 1). Kontrol, n = 8; B16-Flt3L, n = 10. Veriler ortalama ± SEM olarak sunulmuştur. Eşlenmemiş Öğrencinin t-testi ile istatistiksel analiz. **P 0,01 <. Bu rakam11'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Kontrol ve aşılanmış farelerdeki intratümöral T hücrelerinin analizi. (A) Tümör dokusunun gramı başına CD8 + (solda) ve Treg olmayan CD4 + (sağ) infiltrasyon yapan tümörün sayımı. (B) İntratümöral GzmB+ (solda) ve IFNγ+ (sağda) CD8+ T hücrelerinin sayımı. Kontrol, n = 11; B16-Flt3L, n = 10. Veriler ortalama ± SEM olarak sunulmuştur. Eşlenmemiş Öğrencinin t-testi ile istatistiksel analiz. *P < 0,05; **P 0,01 <. Bu rakam11'den değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tablo 1: Şekil 2'nin telafi matrisi. Bu tabloyu indirmek için lütfen tıklayınız.
Tablo 2: Şekil 3'ün telafi matrisi. Bu tabloyu indirmek için lütfen tıklayınız.
Tartışmalar
Burada açıklanan protokol, Allison'ın grubu tarafından yapılan çalışmaya dayanıyor. B16-Flt3L aşısının CTLA-4 blokajı ile kombinasyonunun sağkalım oranı ve tümör büyümesi üzerinde sinerjik bir etki gösterdiğini, oysa B16-Flt3L aşısı veya tek başına anti-CTLA-4 antikor tedavisi alan farelerde tümör büyümesinde bir azalma görülmediğini gösterdiler7. Son zamanlarda yapılan çalışmalar, Treg11'in temasa bağımlı baskılayıcı aktivitesinin düzenlenmesinde önemli bir zorunlu rol oynayan yeni bir Treg-intrinsic CTLA4-PKCη sinyal yolunu ortaya koymuştur. Hem tek başına B16-Flt3L aşı tedavisi hem de Treg-spesifik PKCη delesyonu ile aşı kombinasyonu, Allison'un çalışmasında (1 x 104) olduğundan daha fazla sayıda B16-F10 melanom hücresi (0.5-5 x 105) hücre implante edildiğinde tümörün büyümesini önemli ölçüde azalttı. Melanom hücrelerinin veya farelerin kaynağındaki ince farklılıklar bu farkı açıklayabilir. Bu nedenle, implante edilen tümör hücrelerinin sayısının titre edilmesi önerilir. Primer tümörde CD8 + T hücrelerinin artmış infiltrasyonu önceki çalışmada benzer şekilde gözlenmiştir7. Ek olarak, intratümöral CD103 + CD11c + DC'lerde artmış CD86 ekspresyonunu gözlemledik, bu da muhtemelen CD8 + CTL'lere sızan tümörün daha güçlü bir aktivasyonunu ve genişlemesini açıklar.
Flt3L'yi eksprese eden hücre bazlı bir tümör aşısı kullanan bu protokol, kullanımı kolay ve basittir ve DC'ler de dahil olmak üzere intratümöral immün hücre infiltrasyonlarını incelemek için güvenilir bir model olarak hizmet eder. Örneğin, PKCη sinyali, Treg'in temasa bağımlı bastırıcı etkinliği için gereklidir. Böylece, Prkch−/− Treg, bir Treg -DC in vitro kokültür sistemindeki APC'lerle daha yüksek konjugasyon verimliliği gösterdi ve bu da Prkch−/− Treg'in teması kesme ve bağlı DC'lerdenayrılma yeteneğinde bir kusur olduğunu gösterdi. B16-Flt3L aşılaması muhtemelen tümöre özgü antijenleri daha verimli bir şekilde sunan daha olgun DC'leri işe alır ve bu nedenle, tümöre sızan Treg ve DC arasındaki etkileşimin canlı hücre görüntülemesi ile gözlemlenmesini kolaylaştırması muhtemeldir.
Primer tümör ile tümör aşısı arasında yeterli mesafenin korunması bu protokolün önemli bir özelliğidir. Bu fiziksel ayrım, primer tümörün büyümesine yer açmak ve iki tümör implantı arasında potansiyel füzyonu önlemek için kritik öneme sahiptir. Alternatif olarak, tümör aşısı primer tümöre göre karşı kanatta implante edilebilir, çünkü bunun tümör büyümesini inhibe ettiği de bildirilmiştir7. Çalışmanın bir sınırlaması, ticari bir B16-Flt3L hücre hattı kaynağının olmamasıdır, ancak aynı kavram, örneğin TRAMP-C2 prostat adenokarsinomları7 gibi diğer tümör tiplerine de uygulanabilir.
Burada tarif edilen protokol bir tümör modeli olarak B16-F10 melanom hücrelerini kullanmasına rağmen, altta yatan prensipler diğer solid tümörler için immünoterapötik modeller oluşturmak için gerektiğinde uyarlanabilir ve değiştirilebilir. Ayrıca, kullandığımız aşılama protokolü, potansiyel olarak daha güçlü antitümör bağışıklığı ve daha fazla sağkalım ile sonuçlanabilecek katkı maddesi veya sinerjik etkiler elde etmek için CTLA-4 veya PD-1 tabanlı kontrol noktası blokajı gibi diğer terapötik modalitelerle kolayca birleştirilebilir.
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
B16-Flt3L hücreleri sağladığı için Dr. Stephen Schoenberger'e ve LJI hayvan ve akış sitometri tesislerinin personeline mükemmel destek için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | 25200-056 | |
| 10% heat-inactivated FBS | Omega Scientific | FB-02 | Lot# 209018 |
| 30G needle | BD Biosciences | 305106 | |
| 96 well V-shape-bottom plate | SARSTEDT | 83.3926.500 | |
| B16 cell line expressing Fms-like tyrosine kinase 3 ligand (B16-Flt3L) | Gift of Dr. Stephen Schoenberger, LJI | Flt3L cDNAs were cloned into the pMG-Lyt2 retroviral vector, as in refernce 5, Supplemental Figure 1 | |
| B16-F10 cell lines | ATCC | CRL-6475 | |
| Centrifuge 5810R | Eppendorf | ||
| Cytofix fixation buffer | BD Biosciences | BDB554655 | Cell fixation buffer (4.2% PFA) |
| Cytofix/Cytoperm kit | BD Biosciences | 554714 | Fixation/Permeabilization Solution Kit |
| DNase I | Sigma | 11284932001 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10013CV | |
| Electronic digital caliper | Fisherbrand | 14-648-17 | |
| FlowJo software | Tree Star | Flow cytometer data analysis | |
| GolgiStop (protein transport inhibitor) | BD Biosciences | 554724 | 1:1500 dilution |
| HEPES (1M) | Gibco | 15630-080 | |
| Ionomycin | Sigma | I0634 | |
| Iscove’s modified Dulbecco’s medium (IMDM) | Thermo Fisher | 12440053 | |
| LSR-II cytometers | BD Biosciences | Flow cytometer | |
| MEM nonessential amino acids | Gibco | 11140-050 | |
| penicillin and streptomycin | Gibco | 15140-122 | |
| Percoll | GE Healthcare Life Sciences | GE17-0891-02 | density gradient specific medium |
| PMA | Sigma | P1585 | |
| Red Blood Cell Lysing Buffer Hybri-Max liquid | Sigma | R7757-100ML | |
| RPMI 1640 medium | Corning | 10-040-CV | |
| RS2000 X-ray Irradiator | Rad Source Technologies | ||
| sodium pyruvate | Gibco | 11360-070 | |
| Sterile cell strainer 40 μm | Fisherbrand | 22-363-547 | |
| Sterile cell strainer 70 μm | Fisherbrand | 22-363-548 | |
| TL Liberase | Roche | 477530 | |
| Zombie Aqua fixable viability kit | BioLegend | 423101 | |
| Antibodies | |||
| Anti-mCD45 | BioLegend | 103135 | Clone: 30-F11 Fluorophore: BV570 Dilution: 1:200 |
| Anti-mCD3ε | BioLegend | 100327 | Clone: 145-2C11 Fluorophore: PerCP-Cy5.5 Dilution: 1:200 |
| Anti-mCD8 | BioLegend | 100730 100724 | Clone: 53-6.7 Fluorophore: Alexa Fluor 700, Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD4 | BioLegend | 100414 | Clone: GK1.5 Fluorophore: APC-Cy7 Dilution: 1:200 |
| Anti-mFoxp3 | Thermo Fisher Scientific | 11577382 | Clone: FJK-16s Fluorophore: FITC Dilution: 1:100 |
| Anti-m/hGzmB | BioLegend | 372208 | Clone: QA16A02 Fluorophore: PE Dilution: 1:100 |
| Anti-mIFNg | BioLegend | 505826 | Clone: XMG1.2 Fluorophore: PE-Cy7 Dilution: 1:100 |
| Anti-mCD19 | BioLegend | 115543 | Clone: 6D5 Fluorophore: BV785 Dilution: 1:100 |
| Anti-mGr1 | BioLegend | 108423 | Clone: RB6-8C5 Fluorophore: APC/Cy7 Dilution: 1:200 |
| Anti-mCD11b | BioLegend | 101223 | Clone: M1/70 Fluorophore: Pacific blue Dilution: 1:100 |
| Anti-mF4/80 | BioLegend | 123114 | Clone: BM8 Fluorophore: PECy7 Dilution: 1:100 |
| Anti-mCD11c | BioLegend | 117328 | Clone: N418 Fluorophore: PerCP Cy5.5 Dilution: 1:100 |
| Anti-mMHCII | BioLegend | 107622 | Clone: M5/114.15.2 Fluorophore: AF700 Dilution: 1:400 |
| Anti-mCD103 | BioLegend | 121410 | Clone: 2E7 Fluorophore: Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD86 | BioLegend | 105007 | Clone: GL-1 Fluorophore: PE Dilution: 1:200 |
| FC-blocker (Rat anti-mouse CD16/CD32) | BD Biosciences | 553141 | Clone: 2.4G2 Dilution: 1:200 |
Referanslar
- Zhang, Y., Zhang, Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell & Molecular Immunology. 17 (8), 807-821 (2020).
- Banchereau, J., Steinman, R. M. Dendritic cells and the control of immunity. Nature. 392 (6673), 245-252 (1998).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Martinez-Lostao, L., Anel, A., Pardo, J. How do cytotoxic lymphocytes kill cancer cells. Clinical Cancer Research. 21 (22), 5047-5056 (2015).
- Maraskovsky, E., et al. Dramatic increase in the numbers of functionally mature dendritic cells in Flt3 ligand-treated mice: multiple dendritic cell subpopulations identified. Journal of Experimental Medicine. 184 (5), 1953-1962 (1996).
- Talmadge, J. E., et al. Intratumoral, injection of adenoviral Flt3 ligand has therapeutic activity in association with increased intratumoral levels of T cells but not dendritic cells. Blood. 104 (11), 5280 (2004).
- Curran, M. A., Allison, J. P. Tumor vaccines expressing flt3 ligand synergize with ctla-4 blockade to reject preimplanted tumors. American Association for Cancer Research. 69 (19), 7747-7755 (2009).
- Simon, S. R., Ershler, W. B. Hormonal influences on growth of B16 murine melanoma. Journal of the National Cancer Institute. 74 (5), 1085-1088 (1985).
- Broz, M. L., et al. Dissecting the tumor myeloid compartment reveals rare activating antigen-presenting cells critical for T cell immunity. Cancer Cell. 26 (6), 938 (2014).
- Salmon, H., et al. Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity. 44 (4), 924-938 (2016).
- Liu, H. Y., et al. Leveraging the Treg-intrinsic CTLA4-PKCeta signaling pathway for cancer immunotherapy. Journal for Immunotherapy Cancer. 9 (9), 002792 (2021).
- Kong, K. F., et al. Protein kinase C-eta controls CTLA-4-mediated regulatory T cell function. Nature Immunology. 15 (5), 465-472 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır