Method Article
Modello sperimentale di immunoterapia del melanoma utilizzando la vaccinazione tumorale con una citochina ematopoietica
In questo articolo
Riepilogo
Il protocollo presenta un modello di immunoterapia del cancro che utilizza la vaccinazione tumorale basata su cellule con melanoma B16-F10 che esprime Flt3L. Questo protocollo dimostra le procedure, compresa la preparazione di cellule tumorali in coltura, l'impianto del tumore, l'irradiazione cellulare, la misurazione della crescita tumorale, l'isolamento delle cellule immunitarie intratumorali e l'analisi della citometria a flusso.
Abstract
Il ligando tirosin-chinas-simile 3 (Flt3L) è una citochina ematopoietica che promuove la sopravvivenza e la differenziazione delle cellule dendritiche (DC). È stato utilizzato nei vaccini tumorali per attivare l'immunità innata e migliorare le risposte antitumorali. Questo protocollo dimostra un modello terapeutico che utilizza un vaccino tumorale basato su cellule costituito da cellule di melanoma B16-F10 che esprimono Flt3L insieme all'analisi fenotipica e funzionale delle cellule immunitarie nel microambiente tumorale (TME). Vengono descritte le procedure per la preparazione delle cellule tumorali in coltura, l'impianto del tumore, l'irradiazione cellulare, la misurazione delle dimensioni del tumore, l'isolamento delle cellule immunitarie intratumorali e l'analisi della citometria a flusso. L'obiettivo generale di questo protocollo è quello di fornire un modello preclinico di immunoterapia dei tumori solidi e una piattaforma di ricerca per studiare la relazione tra cellule tumorali e cellule immunitarie infiltranti. Il protocollo di immunoterapia qui descritto può essere combinato con altre modalità terapeutiche, come il blocco del checkpoint immunitario (anticorpi anti-CTLA-4, anti-PD-1, anti-PD-L1) o la chemioterapia al fine di migliorare l'effetto terapeutico del melanoma sul cancro.
Introduzione
L'immunoterapia del cancro è stata riconosciuta come una strategia terapeutica promettente basata sui suoi effetti collaterali meno tossici e risposte più durature. Sono stati sviluppati diversi tipi di immunoterapie, tra cui terapie con virus oncolitici, vaccini contro il cancro, terapie con citochine, anticorpi monoclonali, trasferimento cellulare adottivo (cellule CAR-T o CAR-NK) e blocco del checkpoint immunitario1.
Per i vaccini contro il cancro, ci sono diverse forme di vaccini terapeutici, come vaccini a base di cellule intere, vaccini proteici o peptidici e vaccini a RNA o DNA. La vaccinazione si basa sulla capacità delle cellule presentanti l'antigene (APC) di elaborare gli antigeni tumorali, compresi gli antigeni tumorali specifici, e presentarli in forma immunogenica alle cellule T. Le cellule dendritiche (DC) sono note per essere le APC più potenti e si ritiene che svolgano un ruolo importante nell'immunità antitumorale 2,3. Queste cellule assorbono ed elaborano gli antigeni tumorali e quindi migrano verso i linfonodi drenanti (dLN) per innescare e attivare le cellule effettrici T tumore-specifiche (Teff) attraverso l'impegno del recettore delle cellule T (TCR) e delle molecole costimolatorie. Ciò si traduce nella differenziazione e nell'espansione delle cellule T citotossiche tumore-specifiche (CTL), che si infiltrano nel tumore e uccidono le cellule tumorali4. Di conseguenza, l'attivazione e la maturazione delle DC rappresentano strategie interessanti per stimolare l'immunità contro gli antigeni tumorali.
Flt3L è noto per promuovere la maturazione e l'espansione di DC funzionalmente mature che esprimono le proteine MHC di classe II, CD11c, DEC205 e CD865. La somministrazione intratumorale, ma non endovenosa, di un vettore adenovirus che incorpora il gene Flt3L (Adv-Flt3L) ha dimostrato di promuovere l'attività terapeutica immunitaria contro i tumori ortotopici6. Flt3L è stato utilizzato anche in vaccini basati su cellule tumorali costituiti da cellule B16-F10 irradiate che esprimono stabilmente Flt3L trasdotta in modo retroviralmente come un modo per migliorare la presentazione incrociata degli antigeni tumorali da parte delle DC e, quindi, aumentare le risposte antitumorali. Il protocollo di vaccinazione antitumorale B16-Flt3L qui descritto si basa su uno studio pubblicato dal gruppo7 del Dr. James Allison. In questo articolo, hanno riferito che un vaccino B16-Flt3L combinato con il blocco CTLA-4 ha indotto sinergicamente il rigetto del melanoma stabilito, con conseguente aumento della sopravvivenza.
L'obiettivo di questo protocollo è quello di fornire un modello di immunoterapia preclinica per il melanoma. Qui vengono descritte procedure dettagliate su come preparare e impiantare vaccini tumorali e come analizzare la composizione e la funzione delle cellule immunitarie intratumorali dal tumore solido.
Protocollo
Tutti i topi utilizzati nello studio sono stati mantenuti e ospitati nel vivaio dell'Istituto di immunologia La Jolla (LJI) in specifiche condizioni prive di agenti patogeni con temperatura e umidità controllate. Gli esperimenti sugli animali sono stati eseguiti con topi femmina C57BL / 6 di 8-14 settimane secondo le linee guida e i protocolli approvati dal LJI Animal Care Committee.
1. Preparazione di cellule tumorali in coltura per l'impianto
- Cellule di melanoma B16-F10 di coltura nel terreno di Dulbecco modificato (IMDM) di Iscove contenenti il 10% di FBS inattivato dal calore, 2 mM di glutammina, 1 mM di piruvato di sodio, 1 mM di aminoacidi non essenziali MEM e 100 U / mL ciascuno di penicillina e streptomicina. Mantenere la linea cellulare a 37 °C sotto il 5% di CO2.
- Seminare 1,5-2 x 106 cellule B16-F10 in un matraccio da 175T e coltura per 2 giorni. Raccogli le cellule quando sono confluenti al 75% -80%.
- Rimuovere il terreno di coltura e lavare il pallone una volta con PBS. Aspirare PBS e aggiungere 5 ml di tripsina-EDTA allo 0,25%, quindi picchiettare bruscamente sul bordo del pallone di coltura.
- Aggiungere 15 mL di terreno di coltura per neutralizzare la tripsina-EDTA e versare il contenuto del matraccio in una provetta da centrifuga da 50 ml. Lavare la superficie del piatto con 10 ml di PBS e versare nello stesso tubo da 50 ml.
- Centrifugare le celle per 5 minuti a 200 x g. Scartare il surnatante e rompere il pellet cellulare toccando con le dita il fondo del tubo.
- Aggiungere 10 ml freddi di PBS e pipetare delicatamente la sospensione cellulare; Quindi, contare manualmente le cellule usando l'emocitometro. Tenere le cellule sul ghiaccio prima dell'iniezione.
2. Impianto tumorale
- Anestetizzare i topi con isoflurano al 5% alla portata del gas di 1,0 L al minuto nella cappa aspirante. Cambiare la portata alla dose di mantenimento del 2% di isoflurano una volta che i topi sono completamente anestetizzati. Per questo protocollo, l'anestetizzazione è stata eseguita dal veterinario seguendo le linee guida istituzionali per la cura e l'uso degli animali.
- Radere i capelli sul fianco sinistro dei topi e sterilizzare il sito di iniezione usando salviettine imbevute di alcool. Impiantare per via intradermica (i.d.) cellule tumorali B16-F10 a 5 x 105 cellule in 50 μL di PBS freddo nel fianco sinistro utilizzando un ago da 30 G.
NOTA: Potrebbe essere necessario aggiustare la dose di cellule tumorali B16-F10 impiantate nell'intervallo di 0,5-5 x 105 cellule per uno sviluppo tumorale di successo. - Dopo l'impianto, misurare la lunghezza e la larghezza del tumore tre volte alla settimana utilizzando un calibro digitale elettronico. Calcolare il volume del tumore (mm3) usando la formula:
Volume del tumore (mm3) = larghezza2 × lunghezza × 0,5
Trattare i topi con il vaccino tumorale quando i tumori hanno raggiunto una dimensione di ≥2 mm.
NOTA: I tumori di solito possono essere misurati il giorno 3 dopo l'impianto di 5 x 105 cellule tumorali. Un tasso di crescita tumorale B16-F10 più veloce è stato osservato nei topi maschi C57BL / 6, Rag1-/-, o Rag2-/-γc-/-. Un'osservazione simile è stata descritta in altri studi8. Si raccomanda di mantenere coerente il sesso dei topi. Tuttavia, si noti che il NIH pone l'accento sul sesso come importante variabile biologica nella ricerca biomedica.
3. Preparazione del vaccino e iniezione di cellule B16-F10 (B16-Flt3L) che esprimono Flt3L
- Mantenere le cellule B16-Flt3L in DMEM contenenti l'8% di FBS inattivato dal calore, 2 mM di glutammina e 100 U / mL ciascuno di penicillina e streptomicina a 37 ° C sotto il 5% di CO2.
- Seminare 1 x 106 cellule B16-Flt3L in un matraccio da 175T e coltura per 2 giorni. Prelevare le cellule quando sono confluenti al 75%-80% come descritto nelle fasi da 1.3 a 1.6 e sospenderle in 1 mL di PBS freddo.
- Irradiare le celle alla dose di 150 Gy di raggi gamma utilizzando irradiatore a raggi X con impostazione dei parametri 160 kV e 25 mA. Contare e controllare la vitalità cellulare mediante colorazione blu tripano prima dell'iniezione.
- Anestetizzare i topi con gas come descritto in precedenza e sterilizzare il sito di iniezione usando salviettine imbevute di alcool. Iniettare per via intradermica i topi con 1 x 10 6 cellule B16-Flt3L irradiate in 50 μL di PBS freddo sullo stesso fianco dell'impianto tumorale originale, a ~ 1 cm di distanza dal sito del tumore primario nei giorni 3,6 e 9 dopo l'impianto iniziale della cellula.
- Contrassegnare i siti di iniezione del vaccino con una penna colorata per distinguerlo dal tumore primario.
NOTA: Se inizialmente vengono impiantate 0,5 x 105 cellule B16-F10, si raccomanda di eseguire il trattamento vaccinale nei giorni 8, 11 e 14.
4. Isolamento delle cellule immunitarie intratumorali
- Sacrificare topi usando CO2 e lussazione cervicale nella cappa aspirante alla fine dell'esperimento (il giorno 15 dopo l'impianto del tumore; Figura 1).
- Rimuovere chirurgicamente il tumore con la pelle da ciascun topo e metterlo in una piastra a 24 pozzetti con 1 mL 10% di mezzo FBS / RPMI-1640. Asciugare i tumori con un tovagliolo di carta prima di pesarlo.
- Tagliare i tumori in piccoli pezzi. Aggiungere 2 mL di tampone digestivo (100 μg/mL TL Liberase e 200 μg/mL DNasi I in RPMI-1640 mezzo) e incubare per 25 minuti a 37 °C.
- Aggiungere 10 ml di mezzo FBS/RPMI-1640 al 10% per interrompere la digestione. Trasferire le cellule utilizzando una pipetta sierologica da 25 ml e utilizzare lo stantuffo di una siringa da 1 mL per macinare il tessuto su un filtro cellulare da 40 μm.
- Centrifugare le celle a 500 x g per 5 minuti a 4 °C. Risospendere il pellet in 5 ml di mezzo specifico con gradiente di densità del 40% in PBS, diluito a concentrazione 1x).
- Aggiungere lentamente la sospensione cellulare sopra 5 mL di mezzo specifico per gradiente di densità all'80% contenente PBS. Centrifugare le celle a 325 x g con regolazione del freno basso per 23 minuti a temperatura ambiente (RT).
- Dopo la centrifugazione, raccogliere con cura lo strato di leucociti all'interfaccia tra il 40% e l'80% del mezzo specifico del gradiente di densità e farlo passare attraverso un filtro cellulare da 40 μm. Centrifugare le celle a 500 x g per 5 minuti a 4 °C.
- Incubare il pellet in 2 ml di tampone di lisi dei globuli rossi (RBC) per 5 minuti a RT. Dopo l'incubazione, aggiungere 10 ml di terreno FBS/RPMI-1640 al 10% per estinguere il tampone di lisi dei globuli rossi.
- Centrifugare le celle a 500 x g per 5 minuti a 4 °C. Risospendere le cellule in 0,5 ml di terreno FBS/RPMI-1640 al 10% e contare il numero totale di cellule prima dell'uso per ulteriori analisi.
NOTA: Raccogliere la milza o il dLN come controlli per la strategia di gating dei sottogruppi di cellule immunitarie mediante analisi della citometria a flusso. Seguire il metodo di isolamento cellulare come descritto sopra con le seguenti modifiche: Utilizzare lo stantuffo di una siringa da 1 mL per macinare il tessuto su un filtro a maglie da 70 μm. Lavare il tessuto con il 10% di mezzo FBS/RPMI-1640 per ottenere sospensioni monocellulari. Lisare i globuli rossi come descritto.
5. Analisi della citometria a flusso
NOTA: Le cellule raccolte dallo strato dei leucociti contengono cellule immunitarie e cellule tumorali. Si consigliano due pannelli di colorazione indipendenti.
- Colorazione superficiale
- Trasferire le celle in una piastra inferiore a forma di V a 96 pozzetti. Lavare le cellule con PBS e colorarle con colorante di vitalità cellulare (50-100 μL / pozzetto) per 15 minuti a RT.
- Centrifugare le celle a 500 x g per 5 minuti a 4 °C. Colorare i marcatori superficiali con anticorpi misti (la diluizione dettagliata è fornita nella tabella dei materiali) in tampone FACS (1% FBS e 0,05% NaN3 in PBS) per 30 minuti su ghiaccio (50-100 μL / pozzetto).
- Centrifugare le cellule a 500 x g per 5 minuti e lavarle due volte con tampone FACS.
- Fissare le cellule con tampone di fissazione cellulare (50-100 μL / pozzetto) per 35 minuti sul ghiaccio. Centrifugare le celle a 500 x g per 5 minuti e lavarle due volte con tampone FACS.
- Conservare i campioni in tampone FACS (150-200 μL/tubo) a 4 °C e proteggere dalla luce. Acquisire i campioni su un citometro a flusso. Per le DC e la popolazione di cellule T, seguire le strategie di gating fornite nella Figura 2B e nella Figura 3A.
NOTA: Per la colorazione delle DC mieloidi, si raccomanda di incubare il bloccante FC (ratto anti-topo CD16/CD32) per 15 minuti sul ghiaccio prima dell'incubazione degli anticorpi di superficie (punto 5.1.2).
- Analisi delle citochine dopo ristimolazione ex vivo
- Placcare le cellule in mezzo completo (RPMI-1640 integrato con 10% FBS, 10 mM HEPES, pH 7,2-7,6, 0,1 mM di amminoacido non essenziale, 1 mM di piruvato di sodio, 100 U / mL di penicillina e streptomicina, 50 μM 2-mercaptoetanolo e 2 mM di L-glutammina) e stimolare con 50 ng / mL di PMA più 1 μM di ionomicina in presenza di inibitore del trasporto proteico per 4 ore a 37 °C sotto il 5% di CO2.
- Eseguire la colorazione superficiale per i marcatori di superficie come descritto sopra al punto 5.1.
- Aggiungere la soluzione di permeabilizzazione (50-100 μL/pozzetto) e incubare per 5 minuti a RT per la colorazione intracellulare. Incubare le cellule con anticorpi specifici per citochine o proteine nucleari in soluzione di permeabilizzazione (50-100 μL/pozzetto) per 60 minuti su ghiaccio o per una notte a 4 °C.
- Centrifugare le cellule a 500 x g per 5 minuti e lavarle due volte con tampone FACS. Conservare i campioni a 4 °C e proteggere dalla luce. Acquisire i campioni su un citometro a flusso.
NOTA: potrebbe essere necessario regolare la diluizione degli anticorpi secondo necessità per ottenere una colorazione ottimale.
Risultati
Un punto nero visibile delle cellule B16-F10 impiantate viene solitamente osservato sulla superficie della pelle ~ 3 giorni dopo l'impianto del tumore. I topi vengono trattati con il vaccino tumorale 3, 6 e 9 giorni dopo che il nodulo tumorale ha raggiunto una dimensione di ≥2 mm. Abbiamo osservato una significativa riduzione della crescita tumorale nel gruppo di topi vaccinati ~ 2 settimane dopo l'impianto del tumore (Figura 1). Alla fine dell'esperimento, abbiamo isolato le cellule immunitarie intratumorali e analizzato il loro numero e l'espressione dei marcatori di superficie cellulare, nonché la produzione di citochine dopo una breve stimolazione in vitro come descritto sopra. Le cellule raccolte dallo strato di leucociti contengono ancora molte cellule tumorali, rendendo un po 'difficile definire facilmente la popolazione di linfociti. Pertanto, l'uso in splenociti paralleli è raccomandato per il corretto gating di sottogruppi di cellule immunitarie intratumorali nell'analisi della citometria a flusso (Figura 2A). Qui sono mostrate le strategie di gating di CD103+CD11c+DC, CD8+, CD4+ e Treg (Figura 2B e Figura 3A) insieme alla matrice di compensazione (Tabella 1 e Tabella 2). I dati rappresentativi dei conteggi acquisiti e della frequenza di ciascuna popolazione sono forniti anche nelle figure 2C e 3B.
I CD103+CD11c+DC intratumorali, che rappresentano le cellule più potenti di elaborazione dell'antigene tumorale e di presentazione 9,10, da topi vaccinati hanno mostrato un'espressione significativamente elevata del ligando costimolatorio CD86 (Figura 4). I topi vaccinati hanno anche mostrato un aumento delle cellule T CD8+ e CD4+Foxp3− infiltranti il tumore (Figura 5A), così come nei CTL CD8+GzmB+ e IFN-γ+ (Figura 5B). Questi risultati suggeriscono che questa vaccinazione tumorale promuove la maturazione DC e induce una più forte immunità antitumorale.
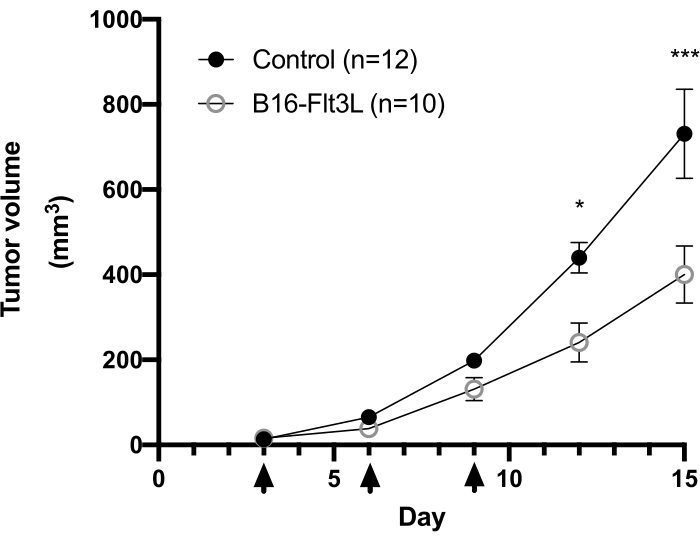
Figura 1: Analisi della crescita tumorale in un modello terapeutico di vaccino tumorale basato su cellule utilizzando cellule di melanoma B16-F10 che esprimono Flt3L. Topi femmina C57BL/6 sono stati impiantati i.d. con cellule B16-F10 (5 x 105) e iniettati con cellule B16-Flt3L irradiate (1 x 106) in un sito adiacente sullo stesso fianco. Le punte delle frecce indicano i punti temporali della vaccinazione. Sono mostrati i dati cumulativi di quattro esperimenti (Controllo, n = 12; B16-Flt3L, n = 10). I dati sono presentati come media ± SEM. Analisi statistica mediante misure ripetute bidirezionali Test ANOVA con Bonferroni post-test. *P < 0,05; ***P < 0,001. Questa cifra è stata modificata da11. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 2: Strategie di gating dei linfociti e CD103+CD11c+DC. (A) Strategie di gating dei linfociti in campioni di milza e tumore. (B) Strategie di gating di CD103+CD11c+DC intratumorali in campioni tumorali. (C) Vengono mostrati i conteggi acquisiti e la frequenza di ciascuna popolazione da un topo di controllo rappresentativo non vaccinato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
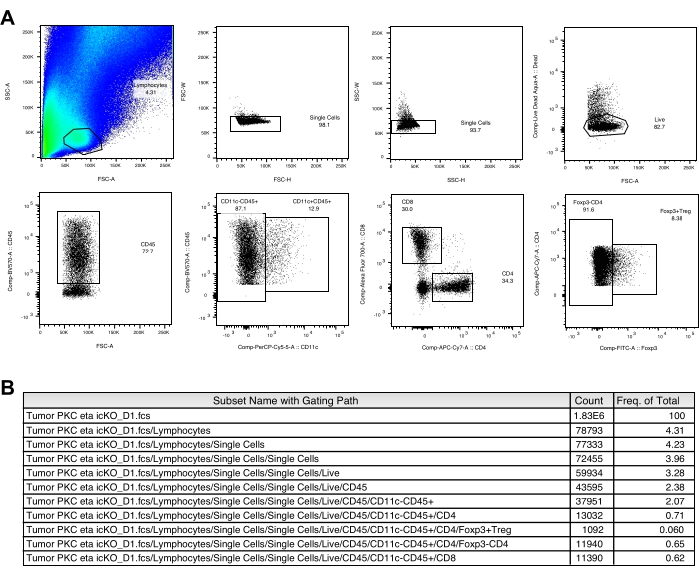
Figura 3: Strategie di gating di CD8+, CD4+ e Treg. (A) Strategie di gating delle cellule T nel campione tumorale. (B) Vengono mostrati i conteggi acquisiti e la frequenza di ciascuna popolazione da un topo di controllo rappresentativo non vaccinato. Fare clic qui per visualizzare una versione ingrandita di questa figura.
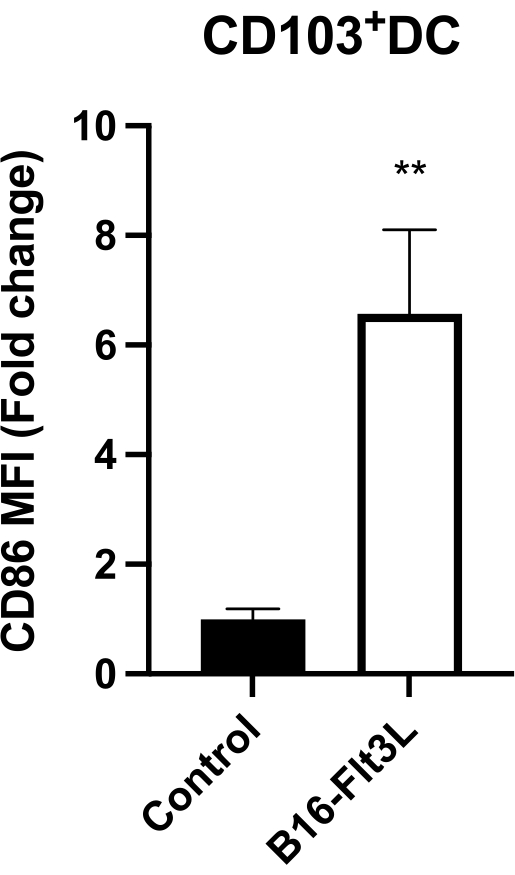
Figura 4: Espressione superficiale di CD86 su DC intratumorali CD103+ . L'espressione è riportata come intensità mediana di fluorescenza (MFI) normalizzata alla MFI media nel gruppo di controllo (= 1). Controllo, n = 8; B16-Flt3L, n = 10. I dati sono presentati come media ± SEM. Analisi statistica mediante test t di Student spaiato. **P < 0,01. Questa cifra è stata modificata da11. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 5: Analisi delle cellule T intratumorali in topi di controllo e vaccinati. (A) Enumerazione dei CD4+ infiltranti il tumore CD8+ (a sinistra) e CD4+ non-Treg (a destra) per grammo di tessuto tumorale. (B) Enumerazione delle cellule T CD8+ intratumorali GzmB+ (a sinistra) e IFNγ+ (a destra). Controllo, n = 11; B16-Flt3L, n = 10. I dati sono presentati come media ± SEM. Analisi statistica mediante test t di Student spaiato. *P < 0,05; **P < 0,01. Questa cifra è stata modificata da11. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Tabella 1: Matrice di compensazione della figura 2. Clicca qui per scaricare questa tabella.
Tabella 2: Matrice di compensazione della figura 3. Clicca qui per scaricare questa tabella.
Discussione
Il protocollo qui descritto si basa sullo studio del gruppo di Allison. Hanno dimostrato che la combinazione del vaccino B16-Flt3L con il blocco CTLA-4 ha mostrato un effetto sinergico sul tasso di sopravvivenza e sulla crescita del tumore, mentre nessuna riduzione della crescita tumorale è stata osservata nei topi che hanno ricevuto il vaccino B16-Flt3L o il trattamento con anticorpi anti-CTLA-4 da solo7. Studi recenti hanno rivelato una nuova via di segnalazione CTLA4-PKCη intrinseca Treg-intrinseca che svolge un importante ruolo obbligatorio nella regolazione dell'attività soppressiva contatto-dipendente di Treg11. Sia il trattamento vaccinale B16-Flt3L da solo che la combinazione di vaccini con delezione PKCη specifica di Treg hanno ridotto significativamente la crescita del tumore quando sono state impiantate cellule di melanoma B16-F10 più elevate (0,5 x 105) rispetto allo studio di Allison (1 x 104). Sottili differenze nella fonte delle cellule di melanoma o dei topi possono spiegare questa differenza. Pertanto, si raccomanda di titolare il numero di cellule tumorali impiantate. L'aumento dell'infiltrazione delle cellule T CD8+ nel tumore primario è stato osservato in modo simile nello studio precedente7. Inoltre, abbiamo osservato un aumento dell'espressione di CD86 su CD103 + CD11c + DC intratumorali, che probabilmente spiega una maggiore attivazione ed espansione dei CTL CD8 + infiltranti il tumore.
Questo protocollo, che utilizza un vaccino tumorale a base cellulare che esprime Flt3L, è comodo e semplice da usare e funge da modello affidabile per studiare gli infiltrati intratumorali delle cellule immunitarie, comprese le DC. Ad esempio, la segnalazione PKCη è necessaria per l'attività soppressiva dipendente dal contatto di Treg. Pertanto, Prkch−/− Treg ha mostrato una maggiore efficienza di coniugazione con APC in un sistema di cocoltura in vitro Treg-DC, indicando un difetto nella capacità di Prkch−/− Treg di rompere il contatto e disimpegnarsi dai DC attaccati12. La vaccinazione B16-Flt3L probabilmente recluta più DC mature che presentano antigeni tumore-specifici in modo più efficiente e, quindi, è probabile che faciliti l'osservazione dell'interazione tra Treg e DC infiltranti il tumore mediante imaging di cellule vive.
Mantenere una distanza sufficiente tra il tumore primario e il vaccino tumorale è una caratteristica importante di questo protocollo. Questa separazione fisica è fondamentale per consentire spazio alla crescita del tumore primario ed evitare la potenziale fusione tra i due impianti tumorali. In alternativa, il vaccino contro il tumore può essere impiantato nel fianco opposto rispetto al tumore primario, poiché questo è stato anche segnalato per inibire la crescita tumorale7. Una limitazione dello studio è la mancanza di una fonte commerciale di linea cellulare B16-Flt3L, ma lo stesso concetto può essere applicato ad altri tipi di tumore, ad esempio gli adenocarcinomi prostatici TRAMP-C27.
Sebbene il protocollo qui descritto utilizzi cellule di melanoma B16-F10 come modello tumorale, i principi sottostanti possono essere adattati e modificati secondo necessità per stabilire modelli immunoterapeutici per altri tumori solidi. Inoltre, il protocollo di vaccinazione che abbiamo utilizzato può essere facilmente combinato con altre modalità terapeutiche, ad esempio il blocco del checkpoint basato su CTLA-4 o PD-1, al fine di ottenere effetti additivi o sinergici che possono potenzialmente portare a un'immunità antitumorale più potente e ad una maggiore sopravvivenza.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Dr. Stephen Schoenberger per aver fornito cellule B16-Flt3L e il personale delle strutture di citometria animale e a flusso LJI per l'eccellente supporto.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | 25200-056 | |
| 10% heat-inactivated FBS | Omega Scientific | FB-02 | Lot# 209018 |
| 30G needle | BD Biosciences | 305106 | |
| 96 well V-shape-bottom plate | SARSTEDT | 83.3926.500 | |
| B16 cell line expressing Fms-like tyrosine kinase 3 ligand (B16-Flt3L) | Gift of Dr. Stephen Schoenberger, LJI | Flt3L cDNAs were cloned into the pMG-Lyt2 retroviral vector, as in refernce 5, Supplemental Figure 1 | |
| B16-F10 cell lines | ATCC | CRL-6475 | |
| Centrifuge 5810R | Eppendorf | ||
| Cytofix fixation buffer | BD Biosciences | BDB554655 | Cell fixation buffer (4.2% PFA) |
| Cytofix/Cytoperm kit | BD Biosciences | 554714 | Fixation/Permeabilization Solution Kit |
| DNase I | Sigma | 11284932001 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10013CV | |
| Electronic digital caliper | Fisherbrand | 14-648-17 | |
| FlowJo software | Tree Star | Flow cytometer data analysis | |
| GolgiStop (protein transport inhibitor) | BD Biosciences | 554724 | 1:1500 dilution |
| HEPES (1M) | Gibco | 15630-080 | |
| Ionomycin | Sigma | I0634 | |
| Iscove’s modified Dulbecco’s medium (IMDM) | Thermo Fisher | 12440053 | |
| LSR-II cytometers | BD Biosciences | Flow cytometer | |
| MEM nonessential amino acids | Gibco | 11140-050 | |
| penicillin and streptomycin | Gibco | 15140-122 | |
| Percoll | GE Healthcare Life Sciences | GE17-0891-02 | density gradient specific medium |
| PMA | Sigma | P1585 | |
| Red Blood Cell Lysing Buffer Hybri-Max liquid | Sigma | R7757-100ML | |
| RPMI 1640 medium | Corning | 10-040-CV | |
| RS2000 X-ray Irradiator | Rad Source Technologies | ||
| sodium pyruvate | Gibco | 11360-070 | |
| Sterile cell strainer 40 μm | Fisherbrand | 22-363-547 | |
| Sterile cell strainer 70 μm | Fisherbrand | 22-363-548 | |
| TL Liberase | Roche | 477530 | |
| Zombie Aqua fixable viability kit | BioLegend | 423101 | |
| Antibodies | |||
| Anti-mCD45 | BioLegend | 103135 | Clone: 30-F11 Fluorophore: BV570 Dilution: 1:200 |
| Anti-mCD3ε | BioLegend | 100327 | Clone: 145-2C11 Fluorophore: PerCP-Cy5.5 Dilution: 1:200 |
| Anti-mCD8 | BioLegend | 100730 100724 | Clone: 53-6.7 Fluorophore: Alexa Fluor 700, Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD4 | BioLegend | 100414 | Clone: GK1.5 Fluorophore: APC-Cy7 Dilution: 1:200 |
| Anti-mFoxp3 | Thermo Fisher Scientific | 11577382 | Clone: FJK-16s Fluorophore: FITC Dilution: 1:100 |
| Anti-m/hGzmB | BioLegend | 372208 | Clone: QA16A02 Fluorophore: PE Dilution: 1:100 |
| Anti-mIFNg | BioLegend | 505826 | Clone: XMG1.2 Fluorophore: PE-Cy7 Dilution: 1:100 |
| Anti-mCD19 | BioLegend | 115543 | Clone: 6D5 Fluorophore: BV785 Dilution: 1:100 |
| Anti-mGr1 | BioLegend | 108423 | Clone: RB6-8C5 Fluorophore: APC/Cy7 Dilution: 1:200 |
| Anti-mCD11b | BioLegend | 101223 | Clone: M1/70 Fluorophore: Pacific blue Dilution: 1:100 |
| Anti-mF4/80 | BioLegend | 123114 | Clone: BM8 Fluorophore: PECy7 Dilution: 1:100 |
| Anti-mCD11c | BioLegend | 117328 | Clone: N418 Fluorophore: PerCP Cy5.5 Dilution: 1:100 |
| Anti-mMHCII | BioLegend | 107622 | Clone: M5/114.15.2 Fluorophore: AF700 Dilution: 1:400 |
| Anti-mCD103 | BioLegend | 121410 | Clone: 2E7 Fluorophore: Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD86 | BioLegend | 105007 | Clone: GL-1 Fluorophore: PE Dilution: 1:200 |
| FC-blocker (Rat anti-mouse CD16/CD32) | BD Biosciences | 553141 | Clone: 2.4G2 Dilution: 1:200 |
Riferimenti
- Zhang, Y., Zhang, Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell & Molecular Immunology. 17 (8), 807-821 (2020).
- Banchereau, J., Steinman, R. M. Dendritic cells and the control of immunity. Nature. 392 (6673), 245-252 (1998).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Martinez-Lostao, L., Anel, A., Pardo, J. How do cytotoxic lymphocytes kill cancer cells. Clinical Cancer Research. 21 (22), 5047-5056 (2015).
- Maraskovsky, E., et al. Dramatic increase in the numbers of functionally mature dendritic cells in Flt3 ligand-treated mice: multiple dendritic cell subpopulations identified. Journal of Experimental Medicine. 184 (5), 1953-1962 (1996).
- Talmadge, J. E., et al. Intratumoral, injection of adenoviral Flt3 ligand has therapeutic activity in association with increased intratumoral levels of T cells but not dendritic cells. Blood. 104 (11), 5280 (2004).
- Curran, M. A., Allison, J. P. Tumor vaccines expressing flt3 ligand synergize with ctla-4 blockade to reject preimplanted tumors. American Association for Cancer Research. 69 (19), 7747-7755 (2009).
- Simon, S. R., Ershler, W. B. Hormonal influences on growth of B16 murine melanoma. Journal of the National Cancer Institute. 74 (5), 1085-1088 (1985).
- Broz, M. L., et al. Dissecting the tumor myeloid compartment reveals rare activating antigen-presenting cells critical for T cell immunity. Cancer Cell. 26 (6), 938 (2014).
- Salmon, H., et al. Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity. 44 (4), 924-938 (2016).
- Liu, H. Y., et al. Leveraging the Treg-intrinsic CTLA4-PKCeta signaling pathway for cancer immunotherapy. Journal for Immunotherapy Cancer. 9 (9), 002792 (2021).
- Kong, K. F., et al. Protein kinase C-eta controls CTLA-4-mediated regulatory T cell function. Nature Immunology. 15 (5), 465-472 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon