Method Article
نموذج العلاج المناعي التجريبي للورم الميلانيني باستخدام التطعيم ضد الورم باستخدام السيتوكين المكونة للدم
In This Article
Summary
يقدم البروتوكول نموذجا للعلاج المناعي للسرطان باستخدام التطعيم ضد الورم القائم على الخلايا مع سرطان الجلد B16-F10 المعبر عن Flt3L. يوضح هذا البروتوكول الإجراءات ، بما في ذلك تحضير الخلايا السرطانية المستزرعة ، وزرع الورم ، وتشعيع الخلايا ، وقياس نمو الورم ، وعزل الخلايا المناعية داخل الورم ، وتحليل قياس التدفق الخلوي.
Abstract
التيروزين كيناز 3 ليجند الشبيه ب Fms (Flt3L) هو سيتوكين مكون للدم يعزز بقاء وتمايز الخلايا المتغصنة (DCs). تم استخدامه في لقاحات الأورام لتنشيط المناعة الفطرية وتعزيز الاستجابات المضادة للأورام. يوضح هذا البروتوكول نموذجا علاجيا باستخدام لقاح الورم القائم على الخلايا الذي يتكون من خلايا الورم الميلانيني B16-F10 المعبرة عن Flt3L جنبا إلى جنب مع التحليل الظاهري والوظيفي للخلايا المناعية في البيئة المكروية للورم (TME). يتم وصف إجراءات تحضير الخلايا السرطانية المستزرعة ، وزرع الورم ، وتشعيع الخلايا ، وقياس حجم الورم ، وعزل الخلايا المناعية داخل الورم ، وتحليل قياس التدفق الخلوي. الهدف العام من هذا البروتوكول هو توفير نموذج العلاج المناعي للورم الصلب قبل السريري ، ومنصة بحثية لدراسة العلاقة بين الخلايا السرطانية والخلايا المناعية المتسللة. يمكن دمج بروتوكول العلاج المناعي الموصوف هنا مع طرق علاجية أخرى ، مثل حصار نقاط التفتيش المناعية (الأجسام المضادة ل CTLA-4 ، والأجسام المضادة ل PD-1 ، والأجسام المضادة ل PD-L1) أو العلاج الكيميائي من أجل تحسين التأثير العلاجي للسرطان لسرطان الجلد.
Introduction
تم التعرف على العلاج المناعي للسرطان كاستراتيجية علاجية واعدة بناء على آثاره الجانبية الأقل سمية والاستجابات الأكثر ديمومة. تم تطوير عدة أنواع من العلاجات المناعية ، بما في ذلك علاجات فيروس الأورام ، ولقاحات السرطان ، وعلاجات السيتوكين ، والأجسام المضادة وحيدة النسيلة ، ونقل الخلايا بالتبني (خلايا CAR-T أو CAR-NK) ، وحصار نقطة التفتيش المناعية1.
بالنسبة للقاحات السرطان ، هناك أشكال مختلفة من اللقاحات العلاجية ، مثل اللقاحات القائمة على الخلايا الكاملة ، ولقاحات البروتين أو الببتيد ، ولقاحات الحمض النووي الريبي أو الحمض النووي. يعتمد التطعيم على قدرة الخلايا المقدمة للمستضد (APCs) على معالجة مستضدات الورم ، بما في ذلك المستضدات الخاصة بالورم ، وتقديمها في شكل مناعي للخلايا التائية. من المعروف أن الخلايا المتغصنة (DCs) هي أقوى APCs ويعتقد أنها تلعب دورا مهما في المناعة المضادة للأورام 2,3. تمتص هذه الخلايا مستضدات الورم وتعالجها ، ثم تهاجر إلى الغدد الليمفاوية المستنزفة (dLN) لتجهيز وتنشيط خلايا المستجيب التائية الخاصة بالورم (Teff) من خلال إشراك مستقبلات الخلايا التائية (TCR) والجزيئات المكلفة. ينتج عن هذا تمايز وتوسع الخلايا التائية السامة للورم (CTL) ، والتي تتسلل إلى الورم وتقتل الخلايا السرطانية4. وبالتالي ، فإن تنشيط ونضج DCs يمثلان استراتيجيات جذابة لتحفيز المناعة ضد مستضدات الورم.
من المعروف أن Flt3L يعزز نضوج وتوسع DCs الناضجة وظيفيا التي تعبر عن بروتينات MHC من الفئة II و CD11c و DEC205 و CD865. ثبت أن الإدارة داخل الورم ، ولكن ليس عن طريق الوريد ، لناقل الفيروس الغدي الذي يتضمن جين Flt3L (Adv-Flt3L) تعزز النشاط العلاجي المناعي ضد أورام الخصية6. كما تم استخدام Flt3L في اللقاحات القائمة على الخلايا السرطانية التي تتكون من خلايا B16-F10 المشععة التي تعبر بثبات عن Flt3L المحول بالفيروسات القهقرية كوسيلة لتعزيز العرض المتقاطع لمستضدات الورم بواسطة DCs ، وبالتالي زيادة الاستجابات المضادة للأورام. يعتمد بروتوكول التطعيم ضد الورم B16-Flt3L الموصوف هنا على دراسة نشرتها مجموعة الدكتور جيمس أليسون7. في هذه الورقة ، أفادوا أن لقاح B16-Flt3L جنبا إلى جنب مع حصار CTLA-4 أدى بشكل تآزري إلى رفض سرطان الجلد الثابت ، مما أدى إلى زيادة البقاء على قيد الحياة.
الهدف من هذا البروتوكول هو توفير نموذج العلاج المناعي قبل السريري لسرطان الجلد. هنا ، يتم وصف الإجراءات التفصيلية لكيفية تحضير وزرع لقاحات الورم ، وكيفية تحليل تكوين ووظيفة الخلايا المناعية داخل الورم من الورم الصلب.
Protocol
تم الحفاظ على جميع الفئران المستخدمة في الدراسة وإيوائها في حظيرة معهد لا جولا لعلم المناعة (LJI) في ظل ظروف محددة خالية من مسببات الأمراض مع التحكم في درجة الحرارة والرطوبة. تم إجراء تجارب على الحيوانات مع إناث الفئران C57BL / 6 البالغة من العمر 8-14 أسبوعا وفقا للإرشادات والبروتوكولات المعتمدة من قبل لجنة رعاية الحيوان LJI.
1. تحضير الخلايا السرطانية المستزرعة للزرع
- خلايا سرطان الجلد B16-F10 في وسط دولبيكو المعدل من Iscove (IMDM) يحتوي على 10٪ FBS المعطل بالحرارة ، و 2 mM الجلوتامين ، و 1 mM من بيروفات الصوديوم ، و 1 mM MEM من الأحماض الأمينية غير الأساسية ، و 100 وحدة / مل من كل من البنسلين والستربتومايسين. الحفاظ على خط الخلية عند 37 درجة مئوية تحت 5٪ CO2.
- البذور 1.5-2 × 106 خلايا B16-F10 في قارورة 175T وثقافة لمدة يومين. حصاد الخلايا عندما تكون 75٪ -80٪ متقاربة.
- قم بإزالة وسط الثقافة واغسل القارورة مرة واحدة باستخدام برنامج تلفزيوني. نضح برنامج تلفزيوني وأضف 5 مل من 0.25٪ تربسين-EDTA متبوعا بالنقر بقسوة على حافة قارورة الثقافة.
- أضف 15 مل من وسط الاستزراع لتحييد التربسين-EDTA وصب محتويات القارورة في أنبوب طرد مركزي سعة 50 مل. اغسل سطح الطبق ب 10 مل من PBS واسكبه في نفس الأنبوب سعة 50 مل.
- أجهزة الطرد المركزي للخلايا لمدة 5 دقائق عند 200 × جم. تخلص من المادة الطافية وكسر حبيبات الخلية عن طريق النقر بالإصبع على قاع الأنبوب.
- أضف 10 مل باردة من PBS وقم بسحب تعليق الخلية برفق ؛ بعد ذلك ، عد الخلايا يدويا باستخدام مقياس الدم. الحفاظ على الخلايا على الجليد قبل الحقن.
2. زرع الورم
- تخدير الفئران بالغاز بنسبة 5٪ إيزوفلوران بمعدل تدفق غاز يبلغ 1.0 لتر في الدقيقة في غطاء الدخان. قم بتغيير معدل التدفق إلى جرعة الصيانة البالغة 2٪ إيزوفلوران بمجرد تخدير الفئران بالكامل. بالنسبة لهذا البروتوكول ، تم إجراء التخدير من قبل الطبيب البيطري باتباع إرشادات رعاية واستخدام الحيوانات المؤسسية.
- حلق الشعر على الجانب الأيسر من الفئران وتعقيم موقع الحقن باستخدام مناديل الكحول. داخل الأدمة (i.d.) زرع الخلايا السرطانية B16-F10 في 5 × 105 خلايا في 50 ميكرولتر من PBS الباردة في الجانب الأيسر باستخدام إبرة 30 G.
ملاحظة: قد تحتاج إلى تعديل جرعة الخلايا السرطانية المزروعة B16-F10 في حدود 0.5-5 × 105 خلايا لتطوير الورم بنجاح. - بعد الزرع ، قم بقياس طول الورم وعرضه ثلاث مرات في الأسبوع باستخدام الفرجار الرقمي الإلكتروني. احسب حجم الورم (مم3) باستخدام الصيغة:
حجم الورم (مم3) = العرض2 × الطول × 0.5
علاج الفئران بلقاح الورم عندما تصل الأورام إلى حجم ≥2 ملم.
ملاحظة: يمكن قياس الأورام عادة في اليوم 3 بعد زرع 5 × 105 خلايا ورمية. لوحظ معدل نمو أسرع للورم B16-F10 في ذكور C57BL / 6 أو Rag1-/- أو Rag2-/-γc-/-الفئران. تم وصف ملاحظة مماثلة في دراسات أخرى8. يوصى بالحفاظ على اتساق جنس الفئران. ومع ذلك ، لاحظ أن المعاهد الوطنية للصحة تركز على الجنس كمتغير بيولوجي مهم في البحوث الطبية الحيوية.
3. تحضير اللقاح وحقن خلايا B16-F10 (B16-Flt3L) المعبرة عن Flt3L
- الحفاظ على خلايا B16-Flt3L في DMEM التي تحتوي على 8٪ FBS المعطل بالحرارة ، و 2 mM الجلوتامين ، و 100 وحدة / مل لكل من البنسلين والستربتومايسين عند 37 درجة مئوية تحت 5٪ CO2.
- البذور 1 × 106 B16-Flt3L الخلايا في قارورة 175T وثقافة لمدة 2 أيام. حصاد الخلايا عندما تكون 75٪ -80٪ متقاربة كما هو موضح في الخطوات من 1.3 إلى 1.6 وتعليقها في 1 مل من PBS البارد.
- تشعيع الخلايا بجرعة 150 جراي من أشعة جاما باستخدام الأشعة السينية Irradiator مع إعداد معلمة 160 كيلو فولت و 25 مللي أمبير. عد وتحقق من صلاحية الخلية عن طريق تلطيخ تريبان الأزرق قبل الحقن.
- تخدير الغاز الفئران كما هو موضح سابقا وتعقيم موقع الحقن باستخدام مناديل الكحول. حقن الفئران داخل الأدمة بخلايا B16-Flt3L المشععة 1 × 10 6 في 50 ميكرولتر من PBS البارد على نفس الجناح مثل زرع الورم الأصلي ، ~ 1 سم بعيدا عن موقع الورم الرئيسي في الأيام 3 و6 و 9 بعد زرع الخلية الأولي.
- ضع علامة على مواقع حقن اللقاح بقلم ملون لتمييزه عن الورم الرئيسي.
ملاحظة: إذا تم زرع 0.5 × 105 خلايا B16-F10 في البداية ، فمن المستحسن إجراء علاج اللقاح في الأيام 8 و 11 و 14.
4. عزل الخلايا المناعية داخل الورم
- التضحية الفئران باستخدام CO2 وخلع عنق الرحم في غطاء الدخان في نهاية التجربة (في اليوم 15 بعد زرع الورم; الشكل 1).
- قم بإزالة الورم جراحيا مع الجلد من كل فأر ووضعه في لوحة 24 بئر مع 1 مل 10٪ FBS / RPMI-1640 المتوسطة. جفف الأورام باستخدام منشفة ورقية قبل وزنها.
- قطع الأورام إلى قطع صغيرة. أضف 2 مل من محلول الهضم (100 ميكروغرام / مل TL Liberase و 200 ميكروغرام / مل DNase I في وسط RPMI-1640) واحتضانه لمدة 25 دقيقة عند 37 درجة مئوية.
- أضف 10 مل من 10٪ FBS / RPMI-1640 متوسطة لوقف عملية الهضم. انقل الخلايا باستخدام ماصة مصلية سعة 25 مل واستخدم مكبس حقنة سعة 1 مل لطحن الأنسجة على مصفاة خلية 40 ميكرومتر.
- أجهزة الطرد المركزي للخلايا عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليق الحبيبات في 5 مل من وسط محدد التدرج بكثافة 40٪ في PBS ، مخفف إلى تركيز 1x).
- أضف معلق الخلية ببطء فوق 5 مل من وسط خاص بتدرج الكثافة بنسبة 80٪ يحتوي على PBS. أجهزة الطرد المركزي للخلايا عند 325 × جم مع ضبط فرامل منخفض لمدة 23 دقيقة في درجة حرارة الغرفة (RT).
- بعد الطرد المركزي ، اجمع بعناية طبقة الكريات البيض عند الواجهة بين 40٪ و 80٪ وسط خاص بتدرج الكثافة ومررها عبر مصفاة خلية 40 ميكرومتر. أجهزة الطرد المركزي للخلايا عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية.
- احتضان الحبيبات في 2 مل من محلول تحلل خلايا الدم الحمراء (RBC) لمدة 5 دقائق في RT. بعد الحضانة ، أضف 10 مل من وسيط FBS / RPMI-1640 بنسبة 10٪ لإخماد مخزن تحلل كرات الدم الحمراء.
- أجهزة الطرد المركزي للخلايا عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. أعد تعليق الخلايا في 0.5 مل من وسيط FBS / RPMI-1640 بنسبة 10٪ واحسب العدد الإجمالي للخلايا قبل الاستخدام لمزيد من التحليل.
ملاحظة: اجمع الطحال أو dLN كعناصر تحكم لاستراتيجية بوابة مجموعات فرعية من الخلايا المناعية عن طريق تحليل قياس التدفق الخلوي. اتبع طريقة عزل الخلية كما هو موضح أعلاه مع التغييرات التالية: استخدم مكبس حقنة سعة 1 مل لطحن الأنسجة على مرشح شبكي 70 ميكرومتر. اغسل المنديل بوسط FBS / RPMI-1640 بنسبة 10٪ للحصول على معلقات أحادية الخلية. Lyse RBC كما هو موضح.
5. تحليل التدفق الخلوي
ملاحظة: تحتوي الخلايا التي تم جمعها من طبقة الكريات البيض على خلايا مناعية وخلايا ورمية. يوصى باستخدام لوحين تلطيخ مستقلين.
- تلطيخ السطح
- انقل الخلايا إلى لوحة سفلية على شكل حرف V 96 بئرا. اغسل الخلايا باستخدام PBS وقم بتلطيخها بصبغة صلاحية الخلية (50-100 ميكرولتر / بئر) لمدة 15 دقيقة في RT.
- أجهزة الطرد المركزي للخلايا عند 500 × جم لمدة 5 دقائق عند 4 درجات مئوية. قم بتلطيخ علامات السطح بأجسام مضادة مختلطة (يتم توفير التخفيف التفصيلي في جدول المواد) في مخزن FACS المؤقت (1٪ FBS و 0.05٪ NaN3 في PBS) لمدة 30 دقيقة على الجليد (50-100 ميكرولتر / بئر).
- قم بالطرد المركزي للخلايا بسرعة 500 × جم لمدة 5 دقائق واغسلها باستخدام مخزن FACS مرتين.
- ثبت الخلايا بمخزن مؤقت لتثبيت الخلايا (50-100 ميكرولتر / بئر) لمدة 35 دقيقة على الثلج. قم بالطرد المركزي للخلايا بسرعة 500 × جم لمدة 5 دقائق واغسلها مرتين باستخدام مخزن FACS.
- قم بتخزين العينات في مخزن FACS (150-200 ميكرولتر / أنبوب) عند 4 درجات مئوية وحمايتها من الضوء. الحصول على العينات على مقياس التدفق الخلوي. بالنسبة لسكان الخلايا التائية والخلايا التائية ، اتبع استراتيجيات البوابات الواردة في الشكل 2B والشكل 3A.
ملاحظة: لتلطيخ DCs النخاعية ، يوصى باحتضان حاصرات FC (الفئران المضادة للفأر CD16 / CD32) لمدة 15 دقيقة على الجليد قبل حضانة الأجسام المضادة السطحية (الخطوة 5.1.2).
- تحليل السيتوكين عند إعادة التحفيز خارج الجسم الحي
- قم بطلاء الخلايا في وسط كامل (RPMI-1640 مكمل ب 10٪ FBS ، 10 mM HEPES ، درجة الحموضة 7.2-7.6 ، 0.1 mM من الأحماض الأمينية غير الأساسية ، 1 mM من بيروفات الصوديوم ، 100 وحدة / مل لكل من البنسلين والستربتومايسين ، 50 ميكرومتر 2-mercaptoethanol ، و 2 mM L-glutamine) وتحفيز مع 50 نانوغرام / مل من PMA بالإضافة إلى 1 ميكرومتر أيونوميسين في وجود مثبط نقل البروتين لمدة 4 ساعات عند 37 درجة مئوية تحت 5٪ CO2.
- قم بإجراء تلطيخ السطح لعلامات السطح كما هو موضح أعلاه في الخطوة 5.1.
- أضف محلول النفاذية (50-100 ميكرولتر / بئر) واحتضانه لمدة 5 دقائق في RT للتلطيخ داخل الخلايا. احتضان الخلايا بأجسام مضادة خاصة بالسيتوكينات أو البروتينات النووية في محلول نفاذية (50-100 ميكرولتر / بئر) لمدة 60 دقيقة على الجليد أو طوال الليل عند 4 درجات مئوية.
- قم بالطرد المركزي للخلايا بسرعة 500 × جم لمدة 5 دقائق واغسلها باستخدام مخزن FACS مرتين. قم بتخزين العينات في درجة حرارة 4 درجات مئوية وحمايتها من الضوء. الحصول على العينات على مقياس التدفق الخلوي.
ملاحظة: قد يلزم تعديل تخفيف الأجسام المضادة حسب الضرورة لتحقيق التلوين الأمثل.
النتائج
عادة ما يتم ملاحظة نقطة سوداء مرئية لخلايا B16-F10 المزروعة على سطح الجلد ~ 3 أيام بعد زرع الورم. يتم علاج الفئران بلقاح الورم بعد 3 و 6 و 9 أيام من وصول العقيدة الورمية إلى حجم ≥2 مم. لاحظنا انخفاضا كبيرا في نمو الورم في مجموعة الفئران الملقحة ~ 2 أسابيع بعد زرع الورم (الشكل 1). في نهاية التجربة ، قمنا بعزل الخلايا المناعية داخل الورم وتحليل عددها وتعبير علامة سطح الخلية ، وكذلك إنتاج السيتوكين بعد تحفيز قصير في المختبر كما هو موضح أعلاه. لا تزال الخلايا التي تم جمعها من طبقة الكريات البيض تحتوي على العديد من الخلايا السرطانية ، مما يجعل من الصعب إلى حد ما تحديد مجموعة الخلايا الليمفاوية بسهولة. لذلك ، يوصى باستخدام خلايا الطحال المتوازية للبوابات المناسبة للمجموعات الفرعية للخلايا المناعية داخل الورم في تحليل قياس التدفق الخلوي (الشكل 2 أ). هنا ، يتم عرض استراتيجيات بوابات CD103 + CD11c + DC و CD8 + و CD4 + و Treg (الشكل 2B والشكل 3A) جنبا إلى جنب مع مصفوفة التعويض (الجدول 1 والجدول 2). كما يتم توفير بيانات تمثيلية عن الأعداد المكتسبة وتواتر كل مجموعة سكانية في الشكل 2C والشكل 3B.
أظهر CD103 + CD11c + DCs داخل الورم ، والذي يمثل أقوى خلايا معالجة مستضد الورم وتقديم الخلايا 9,10 ، من الفئران الملقحة تعبيرا مرتفعا بشكل ملحوظ عن الرباط المكلف CD86 (الشكل 4). أظهرت الفئران الملقحة أيضا زيادة في الخلايا التائية CD8 + و CD4 + Foxp3− المتسللة إلى الورم (الشكل 5 أ) ، وكذلك في CD8 + GzmB + و IFN-γ + CTLs (الشكل 5 ب). تشير هذه النتائج إلى أن هذا التطعيم ضد الورم يعزز نضوج التيار المستمر ويحث على مناعة أقوى مضادة للأورام.
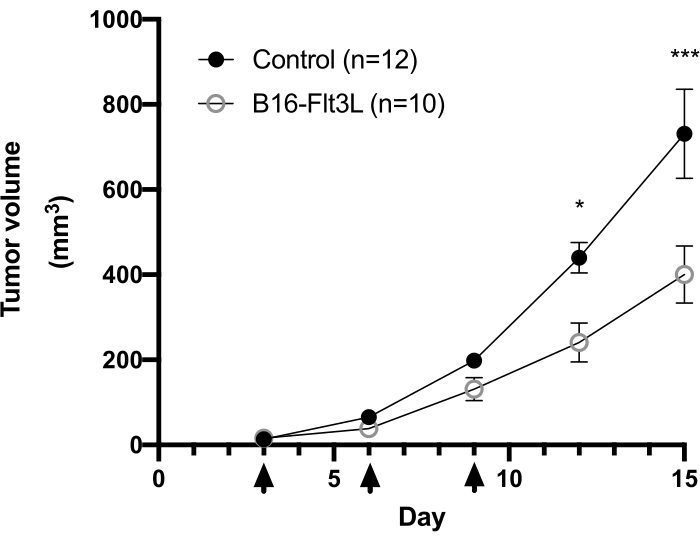
الشكل 1: تحليل نمو الورم في نموذج علاجي للقاح الورم القائم على الخلايا باستخدام خلايا الورم الميلانيني B16-F10 المعبرة عن Flt3L. تم زرع إناث الفئران C57BL / 6 ID مع خلايا B16-F10 (5 × 105) وحقنها بخلايا B16-Flt3L المشععة (150 Gy) (1 × 106) في موقع مجاور على نفس الجناح. تشير رؤوس الأسهم إلى النقاط الزمنية للتطعيم. يتم عرض البيانات التراكمية لأربع تجارب (التحكم، ن = 12; B16-Flt3L ، ن = 10). يتم تقديم البيانات كمتوسط ± SEM. التحليل الإحصائي عن طريق المقاييس المتكررة ثنائية الاتجاه اختبار ANOVA مع اختبار Bonferroni اللاحق. *P < 0.05; ***P < 0.001. تم تعديل هذا الرقم من11. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: استراتيجيات بوابات الخلايا الليمفاوية و CD103 + CD11c + DCs. أ: استراتيجيات بوابات الخلايا الليمفاوية في عينات الطحال والأورام. (ب) استراتيجيات بوابات CD103 + CD11c + DCs داخل الورم في عينة الورم. (ج) يتم عرض الأعداد المكتسبة وتكرار كل مجموعة سكانية من فأر تحكم تمثيلي غير ملقح. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
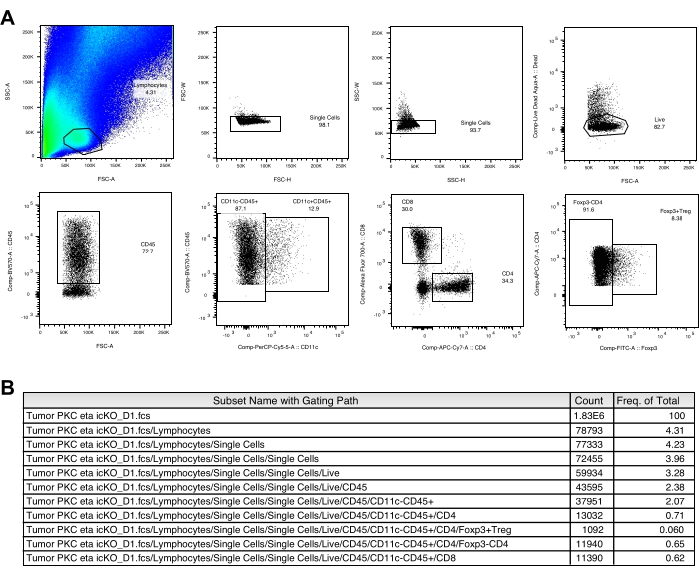
الشكل 3: استراتيجيات بوابات CD8+ وCD4+ وTreg. أ: استراتيجيات بوابات الخلايا التائية في عينة الورم. (ب) يتم عرض الأعداد المكتسبة وتكرار كل مجموعة سكانية من فأر تحكم تمثيلي غير ملقح. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
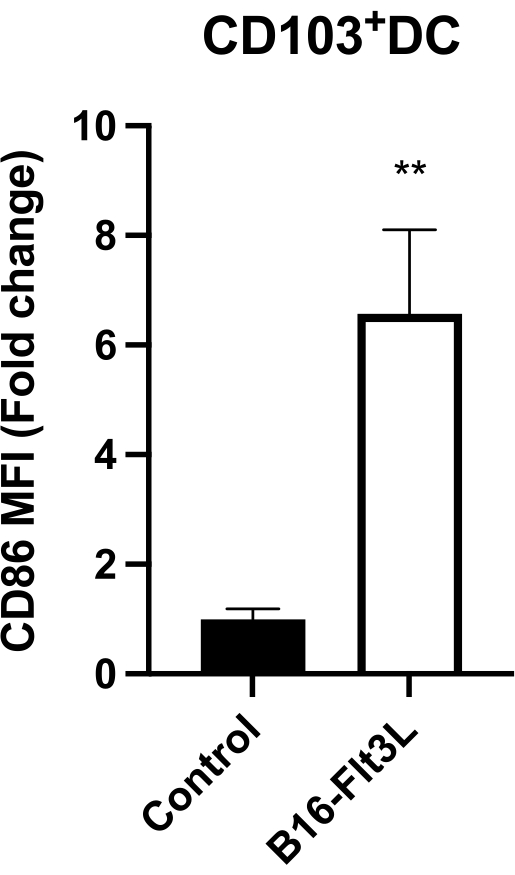
الشكل 4: التعبير السطحي CD86 على CD103 + DCs داخل الورم. تم الإبلاغ عن التعبير كمتوسط شدة مضان (MFI) تم تطبيعه إلى متوسط MFI في المجموعة الضابطة (= 1). التحكم ، ن = 8 ؛ B16-Flt3L ، ن = 10. يتم تقديم البيانات كمتوسط ± SEM. التحليل الإحصائي بواسطة اختبار t للطالب غير المزدوج. ** ف < 0.01. تم تعديل هذا الرقم من11. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: تحليل الخلايا التائية داخل الورم في المجموعة الضابطة والفئران الملقحة. (أ) تعداد الورم المتسلل CD8+ (يسار) وغير Treg CD4+ (يمين) لكل جرام من أنسجة الورم. (ب) تعداد الخلايا التائية CD8+ داخل الورم (يسار) وIFNγ+ (يمين). التحكم ، ن = 11 ؛ B16-Flt3L ، ن = 10. يتم تقديم البيانات كمتوسط ± SEM. التحليل الإحصائي بواسطة اختبار t للطالب غير المزدوج. *P < 0.05; ** ف < 0.01. تم تعديل هذا الرقم من11. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
الجدول 1: مصفوفة التعويض في الشكل 2. الرجاء الضغط هنا لتحميل هذا الجدول.
الجدول 2: مصفوفة التعويض في الشكل 3. الرجاء الضغط هنا لتحميل هذا الجدول.
Discussion
يعتمد البروتوكول الموصوف هنا على الدراسة التي أجرتها مجموعة أليسون. لقد أظهروا أن الجمع بين لقاح B16-Flt3L مع حصار CTLA-4 أظهر تأثيرا تآزريا على معدل البقاء على قيد الحياة ونمو الورم ، في حين لم يلاحظ أي انخفاض في نمو الورم في الفئران التي تتلقى لقاح B16-Flt3L أو علاج الأجسام المضادة ل CTLA-4 وحده7. كشفت الدراسات الحديثة عن مسار إشارات CTLA4-PKCη الجديد Treg-intrinsic الذي يلعب دورا إلزاميا مهما في تنظيم النشاط القمعي المعتمد على الاتصال ل Treg11. أدى كل من علاج لقاح B16-Flt3L وحده أو تركيبة اللقاح مع حذف PKCη الخاص ب Treg إلى تقليل نمو الورم بشكل كبير عندما تم زرع عدد أكبر (0.5-5-5 × 105) من خلايا الورم الميلانيني B16-F10 مقارنة بدراسة أليسون (1 × 104). قد تفسر الاختلافات الدقيقة في مصدر خلايا سرطان الجلد أو الفئران هذا الاختلاف. لذلك ، يوصى بمعايرة عدد الخلايا السرطانية المزروعة. وبالمثل لوحظ زيادة تسلل الخلايا التائية CD8 + في الورم الرئيسي في الدراسة السابقة7. بالإضافة إلى ذلك ، لاحظنا زيادة تعبير CD86 على CD103 + CD11c + DCs داخل الورم ، والذي من المحتمل أن يمثل تنشيطا وتوسعا أقوى لتسلل الورم CD8 + CTLs.
هذا البروتوكول ، باستخدام لقاح الورم القائم على الخلايا الذي يعبر عن Flt3L ، مناسب ومباشر للاستخدام ، ويعمل كنموذج موثوق لدراسة تسلل الخلايا المناعية داخل الورم ، بما في ذلك DCs. على سبيل المثال ، إشارات PKCη مطلوبة للنشاط القمعي المعتمد على الاتصال ل Treg. وهكذا ، أظهر Prkch− / − Treg كفاءة اقتران أعلى مع APCs في نظام Treg -DC في الاستزراع المشترك في المختبر ، مما يشير إلى وجود خلل في قدرة Prkch− / − Treg على قطع الاتصال وفك الارتباط من DCsالمرفقة 12. من المحتمل أن يجند التطعيم B16-Flt3L DCs أكثر نضجا تقدم مستضدات خاصة بالورم بشكل أكثر كفاءة ، وبالتالي ، فمن المحتمل أن تسهل مراقبة التفاعل بين Treg المتسلل إلى الورم و DC عن طريق تصوير الخلايا الحية.
يعد الحفاظ على مسافة كافية بين الورم الرئيسي ولقاح الورم سمة مهمة لهذا البروتوكول. هذا الفصل الجسدي أمر بالغ الأهمية من أجل إتاحة مساحة لنمو الورم الرئيسي وتجنب الاندماج المحتمل بين غرستي الورم. بدلا من ذلك ، يمكن زرع لقاح الورم في الجهة المقابلة بالنسبة للورم الرئيسي ، حيث تم الإبلاغ أيضا عن أن هذا يمنع نمو الورم7. أحد قيود الدراسة هو عدم وجود مصدر تجاري لخط خلايا B16-Flt3L ، ولكن يمكن تطبيق نفس المفهوم على أنواع الأورام الأخرى ، على سبيل المثال ، أورام البروستاتا الغدية TRAMP-C27.
على الرغم من أن البروتوكول الموصوف هنا يستخدم خلايا الورم الميلانيني B16-F10 كنموذج للورم ، إلا أنه يمكن تكييف المبادئ الأساسية وتعديلها حسب الضرورة لإنشاء نماذج علاجية مناعية للأورام الصلبة الأخرى. علاوة على ذلك ، يمكن دمج بروتوكول التطعيم الذي استخدمناه بسهولة مع طرق علاجية أخرى ، على سبيل المثال ، حصار نقطة التفتيش القائم على CTLA-4- أو PD-1 ، من أجل تحقيق تأثيرات مضافة أو تآزرية يمكن أن تؤدي إلى مناعة أكثر قوة مضادة للأورام وزيادة البقاء على قيد الحياة.
Disclosures
ليس لدى المؤلفين ما يكشفون عنه.
Acknowledgements
نشكر الدكتور ستيفن شوينبيرجر على توفير خلايا B16-Flt3L وموظفي مرافق قياس الحيوان والتدفق الخلوي LJI للحصول على دعم ممتاز.
Materials
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | 25200-056 | |
| 10% heat-inactivated FBS | Omega Scientific | FB-02 | Lot# 209018 |
| 30G needle | BD Biosciences | 305106 | |
| 96 well V-shape-bottom plate | SARSTEDT | 83.3926.500 | |
| B16 cell line expressing Fms-like tyrosine kinase 3 ligand (B16-Flt3L) | Gift of Dr. Stephen Schoenberger, LJI | Flt3L cDNAs were cloned into the pMG-Lyt2 retroviral vector, as in refernce 5, Supplemental Figure 1 | |
| B16-F10 cell lines | ATCC | CRL-6475 | |
| Centrifuge 5810R | Eppendorf | ||
| Cytofix fixation buffer | BD Biosciences | BDB554655 | Cell fixation buffer (4.2% PFA) |
| Cytofix/Cytoperm kit | BD Biosciences | 554714 | Fixation/Permeabilization Solution Kit |
| DNase I | Sigma | 11284932001 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10013CV | |
| Electronic digital caliper | Fisherbrand | 14-648-17 | |
| FlowJo software | Tree Star | Flow cytometer data analysis | |
| GolgiStop (protein transport inhibitor) | BD Biosciences | 554724 | 1:1500 dilution |
| HEPES (1M) | Gibco | 15630-080 | |
| Ionomycin | Sigma | I0634 | |
| Iscove’s modified Dulbecco’s medium (IMDM) | Thermo Fisher | 12440053 | |
| LSR-II cytometers | BD Biosciences | Flow cytometer | |
| MEM nonessential amino acids | Gibco | 11140-050 | |
| penicillin and streptomycin | Gibco | 15140-122 | |
| Percoll | GE Healthcare Life Sciences | GE17-0891-02 | density gradient specific medium |
| PMA | Sigma | P1585 | |
| Red Blood Cell Lysing Buffer Hybri-Max liquid | Sigma | R7757-100ML | |
| RPMI 1640 medium | Corning | 10-040-CV | |
| RS2000 X-ray Irradiator | Rad Source Technologies | ||
| sodium pyruvate | Gibco | 11360-070 | |
| Sterile cell strainer 40 μm | Fisherbrand | 22-363-547 | |
| Sterile cell strainer 70 μm | Fisherbrand | 22-363-548 | |
| TL Liberase | Roche | 477530 | |
| Zombie Aqua fixable viability kit | BioLegend | 423101 | |
| Antibodies | |||
| Anti-mCD45 | BioLegend | 103135 | Clone: 30-F11 Fluorophore: BV570 Dilution: 1:200 |
| Anti-mCD3ε | BioLegend | 100327 | Clone: 145-2C11 Fluorophore: PerCP-Cy5.5 Dilution: 1:200 |
| Anti-mCD8 | BioLegend | 100730 100724 | Clone: 53-6.7 Fluorophore: Alexa Fluor 700, Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD4 | BioLegend | 100414 | Clone: GK1.5 Fluorophore: APC-Cy7 Dilution: 1:200 |
| Anti-mFoxp3 | Thermo Fisher Scientific | 11577382 | Clone: FJK-16s Fluorophore: FITC Dilution: 1:100 |
| Anti-m/hGzmB | BioLegend | 372208 | Clone: QA16A02 Fluorophore: PE Dilution: 1:100 |
| Anti-mIFNg | BioLegend | 505826 | Clone: XMG1.2 Fluorophore: PE-Cy7 Dilution: 1:100 |
| Anti-mCD19 | BioLegend | 115543 | Clone: 6D5 Fluorophore: BV785 Dilution: 1:100 |
| Anti-mGr1 | BioLegend | 108423 | Clone: RB6-8C5 Fluorophore: APC/Cy7 Dilution: 1:200 |
| Anti-mCD11b | BioLegend | 101223 | Clone: M1/70 Fluorophore: Pacific blue Dilution: 1:100 |
| Anti-mF4/80 | BioLegend | 123114 | Clone: BM8 Fluorophore: PECy7 Dilution: 1:100 |
| Anti-mCD11c | BioLegend | 117328 | Clone: N418 Fluorophore: PerCP Cy5.5 Dilution: 1:100 |
| Anti-mMHCII | BioLegend | 107622 | Clone: M5/114.15.2 Fluorophore: AF700 Dilution: 1:400 |
| Anti-mCD103 | BioLegend | 121410 | Clone: 2E7 Fluorophore: Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD86 | BioLegend | 105007 | Clone: GL-1 Fluorophore: PE Dilution: 1:200 |
| FC-blocker (Rat anti-mouse CD16/CD32) | BD Biosciences | 553141 | Clone: 2.4G2 Dilution: 1:200 |
References
- Zhang, Y., Zhang, Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell & Molecular Immunology. 17 (8), 807-821 (2020).
- Banchereau, J., Steinman, R. M. Dendritic cells and the control of immunity. Nature. 392 (6673), 245-252 (1998).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Martinez-Lostao, L., Anel, A., Pardo, J. How do cytotoxic lymphocytes kill cancer cells. Clinical Cancer Research. 21 (22), 5047-5056 (2015).
- Maraskovsky, E., et al. Dramatic increase in the numbers of functionally mature dendritic cells in Flt3 ligand-treated mice: multiple dendritic cell subpopulations identified. Journal of Experimental Medicine. 184 (5), 1953-1962 (1996).
- Talmadge, J. E., et al. Intratumoral, injection of adenoviral Flt3 ligand has therapeutic activity in association with increased intratumoral levels of T cells but not dendritic cells. Blood. 104 (11), 5280 (2004).
- Curran, M. A., Allison, J. P. Tumor vaccines expressing flt3 ligand synergize with ctla-4 blockade to reject preimplanted tumors. American Association for Cancer Research. 69 (19), 7747-7755 (2009).
- Simon, S. R., Ershler, W. B. Hormonal influences on growth of B16 murine melanoma. Journal of the National Cancer Institute. 74 (5), 1085-1088 (1985).
- Broz, M. L., et al. Dissecting the tumor myeloid compartment reveals rare activating antigen-presenting cells critical for T cell immunity. Cancer Cell. 26 (6), 938 (2014).
- Salmon, H., et al. Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity. 44 (4), 924-938 (2016).
- Liu, H. Y., et al. Leveraging the Treg-intrinsic CTLA4-PKCeta signaling pathway for cancer immunotherapy. Journal for Immunotherapy Cancer. 9 (9), 002792 (2021).
- Kong, K. F., et al. Protein kinase C-eta controls CTLA-4-mediated regulatory T cell function. Nature Immunology. 15 (5), 465-472 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved