Method Article
Modèle expérimental d’immunothérapie du mélanome utilisant la vaccination tumorale avec une cytokine hématopoïétique
Dans cet article
Résumé
Le protocole présente un modèle d’immunothérapie du cancer utilisant la vaccination tumorale cellulaire avec le mélanome B16-F10 exprimant Flt3L. Ce protocole démontre les procédures, y compris la préparation de cellules tumorales en culture, l’implantation tumorale, l’irradiation cellulaire, la mesure de la croissance tumorale, l’isolement des cellules immunitaires intratumorales et l’analyse par cytométrie en flux.
Résumé
Le ligand tyrosine kinase 3 de type FMS (Flt3L) est une cytokine hématopoïétique qui favorise la survie et la différenciation des cellules dendritiques (DC). Il a été utilisé dans les vaccins contre les tumeurs pour activer l’immunité innée et améliorer les réponses antitumorales. Ce protocole démontre un modèle thérapeutique utilisant un vaccin tumoral à base de cellules composé de cellules de mélanome B16-F10 exprimant Flt3L ainsi qu’une analyse phénotypique et fonctionnelle des cellules immunitaires dans le microenvironnement tumoral (TME). Les procédures pour la préparation de cellules tumorales en culture, l’implantation tumorale, l’irradiation cellulaire, la mesure de la taille de la tumeur, l’isolement des cellules immunitaires intratumorales et l’analyse de cytométrie en flux sont décrites. L’objectif global de ce protocole est de fournir un modèle préclinique d’immunothérapie des tumeurs solides et une plate-forme de recherche pour étudier la relation entre les cellules tumorales et les cellules immunitaires infiltrantes. Le protocole d’immunothérapie décrit ici peut être combiné à d’autres modalités thérapeutiques, telles que le blocage des points de contrôle immunitaires (anticorps anti-CTLA-4, anti--1, anti--L1) ou la chimiothérapie afin d’améliorer l’effet thérapeutique cancéreux du mélanome.
Introduction
L’immunothérapie du cancer a été reconnue comme une stratégie thérapeutique prometteuse basée sur ses effets secondaires moins toxiques et ses réponses plus durables. Plusieurs types d’immunothérapies ont été développés, notamment les thérapies virales oncolytiques, les vaccins contre le cancer, les thérapies à base de cytokines, les anticorps monoclonaux, le transfert de cellules adoptives (cellules CAR-T ou CAR-NK) et le blocage des points de contrôle immunitaires1.
Pour les vaccins contre le cancer, il existe différentes formes de vaccins thérapeutiques, tels que les vaccins à base de cellules entières, les vaccins à base de protéines ou de peptides et les vaccins à ARN ou à ADN. La vaccination repose sur la capacité des cellules présentatrices d’antigènes (APC) à traiter les antigènes tumoraux, y compris les antigènes spécifiques de la tumeur, et à les présenter sous une forme immunogène aux lymphocytes T. Les cellules dendritiques (DC) sont connues pour être les APC les plus puissants et joueraient un rôle important dans l’immunité antitumorale 2,3. Ces cellules absorbent et traitent les antigènes tumoraux, puis migrent vers les ganglions lymphatiques drainants (dLN) pour amorcer et activer les cellules effectrices T spécifiques de la tumeur (Teff) par l’engagement du récepteur des cellules T (TCR) et des molécules costimulatrices. Il en résulte une différenciation et une expansion des cellules T cytotoxiques spécifiques à la tumeur (CTL), qui infiltrent la tumeur et tuent les cellules tumorales4. Par conséquent, l’activation et la maturation des DC représentent des stratégies attrayantes pour stimuler l’immunité contre les antigènes tumoraux.
Flt3L est connu pour favoriser la maturation et l’expansion des DC fonctionnellement matures qui expriment les protéines CMH de classe II, CD11c, DEC205 et CD865. Il a été démontré que l’administration intratumorale, mais non intraveineuse, d’un vecteur adénovirus incorporant le gène Flt3L (Adv-Flt3L) favorise l’activité thérapeutique immunitaire contre les tumeurs orthrotopiques6. Flt3L a également été utilisé dans des vaccins à base de cellules tumorales constitués de cellules B16-F10 irradiées exprimant de manière stable Flt3L transduit rétroviralement comme un moyen d’améliorer la présentation croisée des antigènes tumoraux par les DC et, par conséquent, d’augmenter les réponses antitumorales. Le protocole de vaccination contre les tumeurs B16-Flt3L décrit ici est basé sur une étude publiée par le groupe7 du Dr James Allison. Dans cet article, ils ont rapporté qu’un vaccin B16-Flt3L combiné au blocage CTLA-4 induisait de manière synergique le rejet du mélanome établi, entraînant une survie accrue.
L’objectif de ce protocole est de fournir un modèle d’immunothérapie préclinique pour le mélanome. Ici, des procédures détaillées sur la façon de préparer et d’implanter des vaccins tumoraux, et comment analyser la composition et la fonction des cellules immunitaires intratumorales à partir de tumeurs solides sont décrites.
Protocole
Toutes les souris utilisées dans l’étude ont été maintenues et logées dans le vivarium de l’Institut d’immunologie La Jolla (LJI) dans des conditions spécifiques exemptes d’agents pathogènes avec une température et une humidité contrôlées. Des expériences sur des animaux ont été réalisées sur des souris C57BL/6 femelles âgées de 8 à 14 semaines conformément aux lignes directrices et aux protocoles approuvés par le Comité de protection des animaux de l’INJ.
1. Préparation de cellules tumorales en culture pour l’implantation
- Culture de cellules de mélanome B16-F10 dans le milieu modifié de Dulbecco (IMDM) d’Iscove contenant 10 % de FBS inactivé par la chaleur, 2 mM de glutamine, 1 mM de pyruvate de sodium, 1 mM d’acides aminés non essentiels MEM et 100 U/mL de pénicilline et de streptomycine. Maintenir la lignée cellulaire à 37 °C sous 5% CO2.
- Semer 1,5-2 x 106 cellules B16-F10 dans une fiole de 175T et les cultiver pendant 2 jours. Récoltez les cellules lorsqu’elles sont confluentes à 75 % à 80 %.
- Retirer le milieu de culture et laver la fiole une fois avec du PBS. Aspirer le PBS et ajouter 5 mL de trypsine-EDTA à 0,25 % puis tapoter durement le bord du ballon de culture.
- Ajouter 15 mL de milieu de culture pour neutraliser la trypsine-EDTA et verser le contenu de la fiole dans un tube à centrifuger de 50 mL. Lavez la surface de la vaisselle avec 10 ml de PBS et versez-la dans le même tube de 50 ml.
- Centrifuger les cellules pendant 5 min à 200 x g. Jetez le surnageant et cassez la pastille de cellule en tapotant le fond du tube.
- Ajouter 10 ml de PBS à froid et pipeter doucement la suspension cellulaire; Ensuite, comptez manuellement les cellules à l’aide d’un hémocytomètre. Gardez les cellules sur la glace avant l’injection.
2. Implantation tumorale
- Anesthésier au gaz des souris avec 5 % d’isoflurane à un débit de gaz de 1,0 L par minute dans la hotte. Changer le débit à la dose d’entretien de 2% d’isoflurane une fois que les souris sont complètement anesthésiées. Pour ce protocole, l’anesthésie a été effectuée par le vétérinaire conformément aux lignes directrices de l’établissement en matière de soins et d’utilisation des animaux.
- Rasez les poils sur le flanc gauche des souris et stérilisez le site d’injection à l’aide de lingettes alcoolisées. Implanter par voie intradermique (i.d.) des cellules tumorales B16-F10 à 5 x 105 cellules dans 50 μL de PBS froid dans le flanc gauche à l’aide d’une aiguille de 30 G.
REMARQUE: La dose de cellules tumorales B16-F10 implantées peut devoir être ajustée dans la plage de 0,5-5 x 105 cellules pour un développement tumoral réussi. - Après l’implantation, mesurez la longueur et la largeur de la tumeur trois fois par semaine à l’aide d’un pied à coulisse numérique électronique. Calculez le volume tumoral (mm3) en utilisant la formule:
Volume tumoral (mm3) = largeur2 × longueur × 0,5
Traiter les souris avec un vaccin contre les tumeurs lorsque les tumeurs ont atteint une taille de ≥2 mm.
REMARQUE: Les tumeurs peuvent généralement être mesurées le jour 3 après l’implantation de 5 x 105 cellules tumorales. Un taux de croissance tumorale B16-F10 plus rapide a été observé chez les souris mâles C57BL/6, Rag1-/- ou Rag2-/-γc-/-. Une observation similaire a été décrite dans d’autres études8. Il est recommandé de garder le sexe des souris cohérent. Cependant, notez que les NIH mettent l’accent sur le sexe en tant que variable biologique importante dans la recherche biomédicale.
3. Préparation vaccinale et injection de cellules B16-F10 (B16-Flt3L) exprimant Flt3L
- Maintenir les cellules B16-Flt3L dans le DMEM contenant 8 % de FBS inactivé par la chaleur, 2 mM de glutamine et 100 U/mL chacun de pénicilline et de streptomycine à 37 °C sous 5 % de CO2.
- Semer 1 x 106 cellules B16-Flt3L dans une fiole de 175T et cultiver pendant 2 jours. Récolter les cellules lorsqu’elles sont confluentes à 75 % à 80 % comme décrit aux étapes 1.3 à 1.6 et les suspendre dans 1 mL de PBS froid.
- Irradier les cellules à une dose de 150 Gy de rayons gamma à l’aide d’un irradiateur à rayons X avec réglage des paramètres de 160 kV et 25 mA. Compter et vérifier la viabilité cellulaire par coloration au bleu de trypan avant l’injection.
- Anesthésier les souris au gaz comme décrit précédemment et stériliser le site d’injection à l’aide de lingettes alcoolisées. Injecter par voie intradermique aux souris 1 x 10 6 cellules B16-Flt3L irradiées dans 50 μL de PBS froid sur le même flanc que l’implantation tumorale d’origine, à ~1 cm du site de la tumeur primaire les jours 3,6 et 9 après l’implantation cellulaire initiale.
- Marquez les sites d’injection du vaccin avec un stylo coloré pour le distinguer de la tumeur primaire.
REMARQUE: Si 0,5 x 105 cellules B16-F10 sont initialement implantées, il est recommandé d’effectuer un traitement vaccinal aux jours 8, 11 et 14.
4. Isolement des cellules immunitaires intratumorales
- Sacrifier des souris en utilisant du CO2 et une luxation cervicale dans la hotte à la fin de l’expérience (le jour 15 après l’implantation de la tumeur; Graphique 1).
- Retirez chirurgicalement la tumeur avec la peau de chaque souris et placez-la dans une plaque de 24 puits avec 1 ml 10% FBS / RPMI-1640 milieu. Sécher les tumeurs à l’aide d’une serviette en papier avant de la peser.
- Couper les tumeurs en petits morceaux. Ajouter 2 mL de tampon de digestion (100 μg/mL TL Liberase et 200 μg/mL DNase I en milieu RPMI-1640) et incuber pendant 25 min à 37 °C.
- Ajouter 10 mL de milieu FBS/RPMI-1640 à 10 % pour arrêter la digestion. Transférer les cellules à l’aide d’une pipette sérologique de 25 mL et utiliser le piston d’une seringue de 1 mL pour broyer le tissu sur une crépine cellulaire de 40 μm.
- Centrifuger les cellules à 500 x g pendant 5 min à 4 °C. Resuspendre la pastille dans 5 mL de milieu spécifique au gradient de densité à 40 % dans du PBS, dilué à une concentration de 1x).
- Ajouter lentement la suspension cellulaire sur 5 ml de milieu spécifique au gradient de densité à 80 % contenant du PBS. Centrifuger les cellules à 325 x g avec un faible réglage des freins pendant 23 min à température ambiante (RT).
- Après centrifugation, prélever soigneusement la couche de leucocytes à l’interface entre 40% et 80% du milieu spécifique du gradient de densité et la faire passer à travers une crépine cellulaire de 40 μm. Centrifuger les cellules à 500 x g pendant 5 min à 4 °C.
- Incuber la pastille dans 2 mL de tampon de lyse des globules rouges (GR) pendant 5 min à TA. Après l’incubation, ajouter 10 mL de milieu FBS/RPMI-1640 à 10 % pour étancher le tampon de lyse des globules rouges.
- Centrifuger les cellules à 500 x g pendant 5 min à 4 °C. Remettez les cellules en suspension dans 0,5 mL de milieu FBS/RPMI-1640 à 10 % et comptez le nombre total de cellules avant utilisation pour une analyse plus approfondie.
REMARQUE: Recueillir la rate ou la dLN comme témoins pour la stratégie de déclenchement des sous-ensembles de cellules immunitaires par analyse de cytométrie en flux. Suivez la méthode d’isolement cellulaire décrite ci-dessus avec les modifications suivantes : Utilisez le piston d’une seringue de 1 mL pour broyer le tissu sur un filtre à mailles de 70 μm. Lavez le tissu avec 10% FBS / RPMI-1640 milieu pour obtenir des suspensions unicellulaires. Lyse le RBC tel que décrit.
5. Analyse de cytométrie en flux
REMARQUE: Les cellules prélevées dans la couche de leucocytes contiennent des cellules immunitaires et des cellules tumorales. Deux panneaux de coloration indépendants sont recommandés.
- Coloration de surface
- Transférer les cellules dans une plaque inférieure en forme de V à 96 puits. Lavez les cellules avec du PBS et colorez-les avec un colorant de viabilité cellulaire (50-100 μL/puits) pendant 15 min à TA.
- Centrifuger les cellules à 500 x g pendant 5 min à 4 °C. Colorer les marqueurs de surface avec des anticorps mixtes (la dilution détaillée est fournie dans le tableau des matériaux) dans le tampon FACS (1 % FBS et 0,05 % NaN3 dans PBS) pendant 30 minutes sur glace (50-100 μL/ puits).
- Centrifuger les cellules à 500 x g pendant 5 min et les laver deux fois avec un tampon FACS.
- Fixez les cellules avec un tampon de fixation cellulaire (50-100 μL / puits) pendant 35 minutes sur de la glace. Centrifuger les cellules à 500 x g pendant 5 min et les laver deux fois avec un tampon FACS.
- Conserver les échantillons dans un tampon FACS (150-200 μL/tube) à 4 °C et les protéger de la lumière. Acquérir les échantillons sur un cytomètre en flux. Pour la population de DC et de lymphocytes T, suivez les stratégies de contrôle fournies à la figure 2B et à la figure 3A.
REMARQUE : Pour la coloration des CD myéloïdes, il est recommandé d’incuber le bloquant FC (CD16/CD32 anti-souris chez le rat) pendant 15 minutes sur de la glace avant l’incubation des anticorps de surface (étape 5.1.2).
- Analyse des cytokines lors d’une restimulation ex vivo
- Plaquer les cellules dans un milieu complet (RPMI-1640 supplémenté avec 10% FBS, 10 mM HEPES, pH 7,2-7,6, 0,1 mM d’acide aminé non essentiel, 1 mM de pyruvate de sodium, 100 U/mL de pénicilline et de streptomycine, 50 μM de 2-mercaptoéthanol et 2 mM de L-glutamine) et stimuler avec 50 ng/mL de PMA plus 1 μM d’ionomycine en présence d’inhibiteur de transport protéique pendant 4 h à 37 °C sous 5% de CO2.
- Effectuer la coloration de surface des marqueurs de surface comme décrit ci-dessus à l’étape 5.1.
- Ajouter la solution de perméabilisation (50-100 μL/puits) et incuber pendant 5 min à TA pour la coloration intracellulaire. Incuber les cellules avec des anticorps spécifiques aux cytokines ou aux protéines nucléaires dans une solution de perméabilisation (50-100 μL/puits) pendant 60 min sur glace ou toute la nuit à 4 °C.
- Centrifuger les cellules à 500 x g pendant 5 min et les laver deux fois avec un tampon FACS. Conservez les échantillons à 4 °C et à l’abri de la lumière. Acquérir les échantillons sur un cytomètre en flux.
REMARQUE: La dilution des anticorps peut devoir être ajustée au besoin pour obtenir une coloration optimale.
Résultats
Un point noir visible des cellules B16-F10 implantées est généralement observé à la surface de la peau ~ 3 jours après l’implantation de la tumeur. Les souris sont traitées avec le vaccin tumoral 3, 6 et 9 jours après que le nodule tumoral a atteint une taille de ≥2 mm. Nous avons observé une réduction significative de la croissance tumorale dans le groupe de souris vaccinées ~2 semaines après l’implantation de la tumeur (Figure 1). À la fin de l’expérience, nous avons isolé les cellules immunitaires intratumorales et analysé leur nombre et l’expression de marqueurs de surface cellulaire, ainsi que la production de cytokines après une courte stimulation in vitro comme décrit ci-dessus. Les cellules recueillies dans la couche de leucocytes contiennent encore de nombreuses cellules tumorales, ce qui rend quelque peu difficile la définition facile de la population lymphocytaire. Par conséquent, l’utilisation de splénocytes parallèles est recommandée pour le contrôle approprié des sous-ensembles de cellules immunitaires intratumorales dans l’analyse de cytométrie en flux (Figure 2A). Ici, les stratégies de contrôle de CD103+CD11c+DC, CD8+, CD4+ et Treg sont présentées (Figure 2B et Figure 3A) ainsi que la matrice de compensation (Tableau 1 et Tableau 2). Des données représentatives des comptes acquis et de la fréquence de chaque population sont également fournies à la figure 2C et à la figure 3B.
Les CD103+CD11c+DCs intratumoraux, qui représentent le traitement de l’antigène tumoral le plus puissant et les cellules présentatrices 9,10, provenant de souris vaccinées ont présenté une expression significativement élevée du ligand costimulateur CD86 (Figure 4). Les souris vaccinées ont également montré une augmentation des lymphocytes T CD8+ et CD4+Foxp3− infiltrant les tumeurs (Figure 5A), ainsi que des CTL CD8+GzmB+ et IFN-γ+ (Figure 5B). Ces résultats suggèrent que cette vaccination tumorale favorise la maturation DC et induit une immunité antitumorale plus forte.
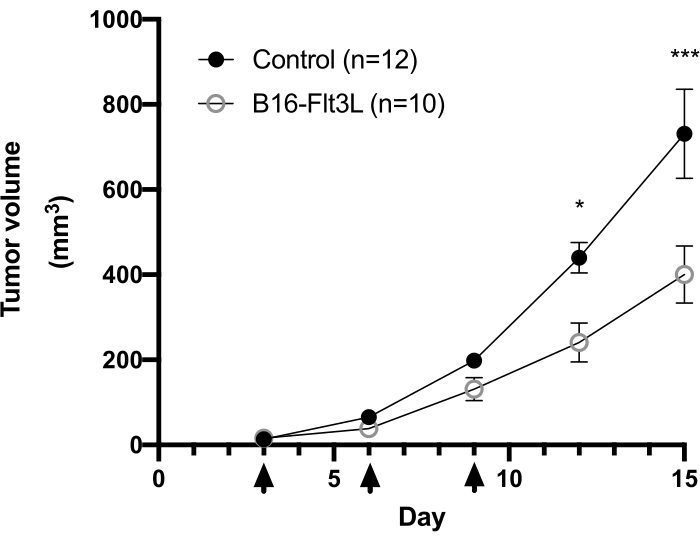
Figure 1 : Analyse de la croissance tumorale dans un modèle thérapeutique de vaccin tumoral à base de cellules utilisant des cellules de mélanome B16-F10 exprimant Flt3L. Des souris C57BL/6 femelles ont été implantées i.d. avec des cellules B16-F10 (5 x 105) et injectées avec des cellules B16-Flt3L irradiées (150 Gy) (1 x 106) dans un site adjacent sur le même flanc. Les pointes de flèches indiquent les points temporels de la vaccination. Les données cumulatives de quatre expériences sont présentées (Contrôle, n = 12; B16-Flt3L, n = 10). Les données sont présentées comme la moyenne ± SEM. Analyse statistique par test ANOVA à mesures répétées bidirectionnelles avec test de Bonferroni post-test. *P < 0,05; ***P < 0,001. Ce chiffre a été modifié par rapport à11. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Stratégies de déclenchement des lymphocytes et des CD103+CD11c+DC. (A) Stratégies de déclenchement des lymphocytes dans les échantillons de rate et de tumeur. (B) Stratégies de déclenchement des CD103 + CD11c + DC intratumoraux dans un échantillon tumoral. (C) Les numérations acquises et la fréquence de chaque population provenant d’une souris témoin non vaccinée représentative sont indiquées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
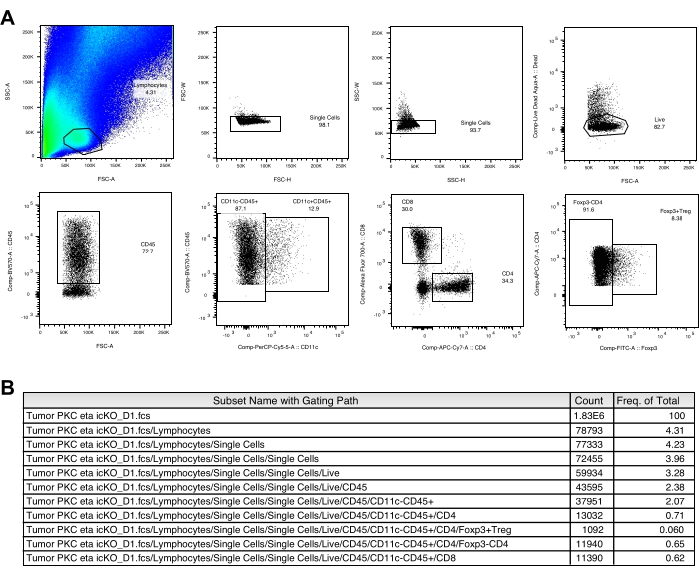
Figure 3 : Stratégies de contrôle des CD8+, CD4+ et Treg. (A) Stratégies de déclenchement des lymphocytes T dans l’échantillon tumoral. (B) Les numérations acquises et la fréquence de chaque population à partir d’une souris témoin non vaccinée représentative sont indiquées. Veuillez cliquer ici pour voir une version agrandie de cette figure.
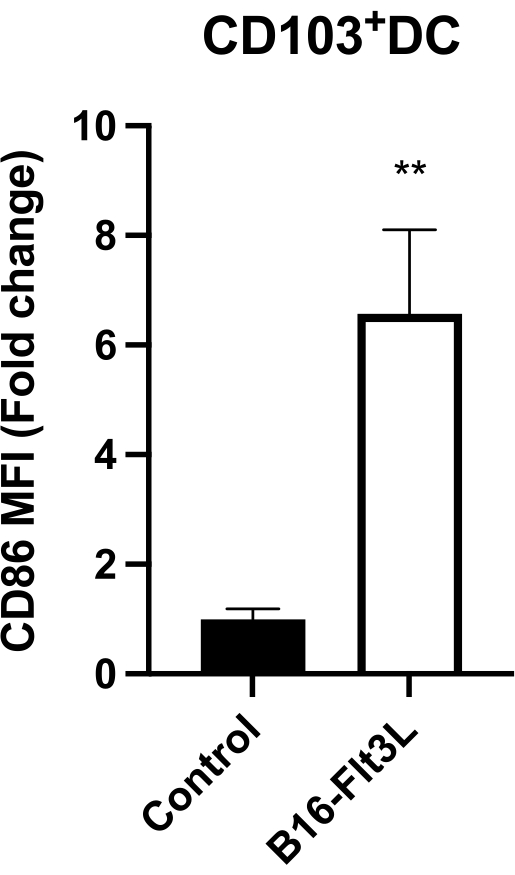
Figure 4 : Expression de surface de CD86 sur les DC intratumoraux CD103+. L’expression est rapportée sous forme d’intensité médiane de fluorescence (IFM) normalisée à l’IFM moyenne dans le groupe témoin (= 1). Contrôle, n = 8; B16-Flt3L, n = 10. Les données sont présentées sous forme de moyenne ± SEM. Analyse statistique par test t de Student non apparié. **P < 0,01. Ce chiffre a été modifié par rapport à11. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 5 : Analyse des lymphocytes T intratumoraux chez des souris témoins et vaccinées. (A) Dénombrement des CD8+ infiltrant la tumeur (à gauche) et CD4+ non Treg (à droite) par gramme de tissu tumoral. (B) Dénombrement des lymphocytes T CD8+ intratumoraux GzmB+ (à gauche) et IFNγ+ (à droite). Contrôle, n = 11; B16-Flt3L, n = 10. Les données sont présentées sous forme de moyenne ± SEM. Analyse statistique par test t de Student non apparié. *P < 0,05; **P < 0,01. Ce chiffre a été modifié par rapport à11. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau 1 : Matrice de rémunération de la figure 2. Veuillez cliquer ici pour télécharger ce tableau.
Tableau 2 : Matrice de rémunération de la figure 3. Veuillez cliquer ici pour télécharger ce tableau.
Discussion
Le protocole décrit ici est basé sur l’étude du groupe d’Allison. Ils ont démontré que la combinaison du vaccin B16-Flt3L avec le blocage CTLA-4 a montré un effet synergique sur le taux de survie et la croissance tumorale, alors qu’aucune réduction de la croissance tumorale n’a été observée chez les souris recevant le vaccin B16-Flt3L ou le traitement par anticorps anti-CTLA-4 seul7. Des études récentes ont révélé une nouvelle voie de signalisation CTLA4-PKCη intrinsèque à Treg qui joue un rôle obligatoire important dans la régulation de l’activité suppressive dépendante du contact de Treg11. Le traitement vaccinal B16-Flt3L seul ou la combinaison vaccinale avec une délétion PKCη spécifique de Treg a significativement réduit la croissance de la tumeur lorsqu’un nombre plus élevé (0,5-5 x 105) de cellules de mélanome B16-F10 que dans l’étude d’Allison (1 x 104) cellules ont été implantées. Des différences subtiles dans la source des cellules de mélanome ou des souris peuvent expliquer cette différence. Par conséquent, il est recommandé de titrer le nombre de cellules tumorales implantées. Une infiltration accrue de lymphocytes T CD8+ dans la tumeur primaire a été observée de manière similaire dans l’étude précédente7. De plus, nous avons observé une augmentation de l’expression de CD86 sur les CD103+CD11c+DC intratumoraux, ce qui explique probablement une activation et une expansion plus fortes des CTL CD8+ infiltrant la tumeur.
Ce protocole, utilisant un vaccin tumoral à base de cellules exprimant Flt3L, est pratique et simple à utiliser, et sert de modèle fiable pour étudier les infiltrats de cellules immunitaires intratumorales, y compris les DC. Par exemple, la signalisation PKCη est nécessaire pour l’activité suppressive dépendante du contact de Treg. Ainsi, Prkch−/− Treg a montré une efficacité de conjugaison plus élevée avec les APC dans un système de coculture in vitro Treg-DC, indiquant un défaut dans la capacité de Prkch−/− Treg à rompre le contact et à se désengager des DC attachés12. La vaccination B16-Flt3L recrute probablement plus efficacement des DC plus matures qui présentent des antigènes spécifiques de la tumeur et, par conséquent, elle est susceptible de faciliter l’observation de l’interaction entre Treg infiltrant la tumeur et DC par imagerie de cellules vivantes.
Garder une distance suffisante entre la tumeur primaire et le vaccin tumoral est une caractéristique importante de ce protocole. Cette séparation physique est essentielle afin de laisser de la place pour la croissance de la tumeur primaire et éviter une fusion potentielle entre les deux implants tumoraux. Alternativement, le vaccin contre la tumeur peut être implanté dans le flanc opposé par rapport à la tumeur primaire, car cela inhibe également la croissance tumorale7. L’une des limites de l’étude est l’absence d’une source commerciale de lignée cellulaire B16-Flt3L, mais le même concept peut être appliqué à d’autres types de tumeurs, par exemple, les adénocarcinomes de la prostate TRAMP-C27.
Bien que le protocole décrit ici utilise des cellules de mélanome B16-F10 comme modèle tumoral, les principes sous-jacents peuvent être adaptés et modifiés si nécessaire pour établir des modèles immunothérapeutiques pour d’autres tumeurs solides. De plus, le protocole de vaccination que nous avons utilisé peut être facilement combiné avec d’autres modalités thérapeutiques, par exemple, le blocage des points de contrôle basé sur CTLA-4 ou-1, afin d’obtenir des effets additifs ou synergiques qui peuvent potentiellement entraîner une immunité antitumorale plus puissante et une survie accrue.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions le Dr Stephen Schoenberger d’avoir fourni des cellules B16-Flt3L et le personnel des installations de cytométrie animale et de cytométrie en flux de l’INLJ pour un excellent soutien.
matériels
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | 25200-056 | |
| 10% heat-inactivated FBS | Omega Scientific | FB-02 | Lot# 209018 |
| 30G needle | BD Biosciences | 305106 | |
| 96 well V-shape-bottom plate | SARSTEDT | 83.3926.500 | |
| B16 cell line expressing Fms-like tyrosine kinase 3 ligand (B16-Flt3L) | Gift of Dr. Stephen Schoenberger, LJI | Flt3L cDNAs were cloned into the pMG-Lyt2 retroviral vector, as in refernce 5, Supplemental Figure 1 | |
| B16-F10 cell lines | ATCC | CRL-6475 | |
| Centrifuge 5810R | Eppendorf | ||
| Cytofix fixation buffer | BD Biosciences | BDB554655 | Cell fixation buffer (4.2% PFA) |
| Cytofix/Cytoperm kit | BD Biosciences | 554714 | Fixation/Permeabilization Solution Kit |
| DNase I | Sigma | 11284932001 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10013CV | |
| Electronic digital caliper | Fisherbrand | 14-648-17 | |
| FlowJo software | Tree Star | Flow cytometer data analysis | |
| GolgiStop (protein transport inhibitor) | BD Biosciences | 554724 | 1:1500 dilution |
| HEPES (1M) | Gibco | 15630-080 | |
| Ionomycin | Sigma | I0634 | |
| Iscove’s modified Dulbecco’s medium (IMDM) | Thermo Fisher | 12440053 | |
| LSR-II cytometers | BD Biosciences | Flow cytometer | |
| MEM nonessential amino acids | Gibco | 11140-050 | |
| penicillin and streptomycin | Gibco | 15140-122 | |
| Percoll | GE Healthcare Life Sciences | GE17-0891-02 | density gradient specific medium |
| PMA | Sigma | P1585 | |
| Red Blood Cell Lysing Buffer Hybri-Max liquid | Sigma | R7757-100ML | |
| RPMI 1640 medium | Corning | 10-040-CV | |
| RS2000 X-ray Irradiator | Rad Source Technologies | ||
| sodium pyruvate | Gibco | 11360-070 | |
| Sterile cell strainer 40 μm | Fisherbrand | 22-363-547 | |
| Sterile cell strainer 70 μm | Fisherbrand | 22-363-548 | |
| TL Liberase | Roche | 477530 | |
| Zombie Aqua fixable viability kit | BioLegend | 423101 | |
| Antibodies | |||
| Anti-mCD45 | BioLegend | 103135 | Clone: 30-F11 Fluorophore: BV570 Dilution: 1:200 |
| Anti-mCD3ε | BioLegend | 100327 | Clone: 145-2C11 Fluorophore: PerCP-Cy5.5 Dilution: 1:200 |
| Anti-mCD8 | BioLegend | 100730 100724 | Clone: 53-6.7 Fluorophore: Alexa Fluor 700, Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD4 | BioLegend | 100414 | Clone: GK1.5 Fluorophore: APC-Cy7 Dilution: 1:200 |
| Anti-mFoxp3 | Thermo Fisher Scientific | 11577382 | Clone: FJK-16s Fluorophore: FITC Dilution: 1:100 |
| Anti-m/hGzmB | BioLegend | 372208 | Clone: QA16A02 Fluorophore: PE Dilution: 1:100 |
| Anti-mIFNg | BioLegend | 505826 | Clone: XMG1.2 Fluorophore: PE-Cy7 Dilution: 1:100 |
| Anti-mCD19 | BioLegend | 115543 | Clone: 6D5 Fluorophore: BV785 Dilution: 1:100 |
| Anti-mGr1 | BioLegend | 108423 | Clone: RB6-8C5 Fluorophore: APC/Cy7 Dilution: 1:200 |
| Anti-mCD11b | BioLegend | 101223 | Clone: M1/70 Fluorophore: Pacific blue Dilution: 1:100 |
| Anti-mF4/80 | BioLegend | 123114 | Clone: BM8 Fluorophore: PECy7 Dilution: 1:100 |
| Anti-mCD11c | BioLegend | 117328 | Clone: N418 Fluorophore: PerCP Cy5.5 Dilution: 1:100 |
| Anti-mMHCII | BioLegend | 107622 | Clone: M5/114.15.2 Fluorophore: AF700 Dilution: 1:400 |
| Anti-mCD103 | BioLegend | 121410 | Clone: 2E7 Fluorophore: Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD86 | BioLegend | 105007 | Clone: GL-1 Fluorophore: PE Dilution: 1:200 |
| FC-blocker (Rat anti-mouse CD16/CD32) | BD Biosciences | 553141 | Clone: 2.4G2 Dilution: 1:200 |
Références
- Zhang, Y., Zhang, Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell & Molecular Immunology. 17 (8), 807-821 (2020).
- Banchereau, J., Steinman, R. M. Dendritic cells and the control of immunity. Nature. 392 (6673), 245-252 (1998).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Martinez-Lostao, L., Anel, A., Pardo, J. How do cytotoxic lymphocytes kill cancer cells. Clinical Cancer Research. 21 (22), 5047-5056 (2015).
- Maraskovsky, E., et al. Dramatic increase in the numbers of functionally mature dendritic cells in Flt3 ligand-treated mice: multiple dendritic cell subpopulations identified. Journal of Experimental Medicine. 184 (5), 1953-1962 (1996).
- Talmadge, J. E., et al. Intratumoral, injection of adenoviral Flt3 ligand has therapeutic activity in association with increased intratumoral levels of T cells but not dendritic cells. Blood. 104 (11), 5280 (2004).
- Curran, M. A., Allison, J. P. Tumor vaccines expressing flt3 ligand synergize with ctla-4 blockade to reject preimplanted tumors. American Association for Cancer Research. 69 (19), 7747-7755 (2009).
- Simon, S. R., Ershler, W. B. Hormonal influences on growth of B16 murine melanoma. Journal of the National Cancer Institute. 74 (5), 1085-1088 (1985).
- Broz, M. L., et al. Dissecting the tumor myeloid compartment reveals rare activating antigen-presenting cells critical for T cell immunity. Cancer Cell. 26 (6), 938 (2014).
- Salmon, H., et al. Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity. 44 (4), 924-938 (2016).
- Liu, H. Y., et al. Leveraging the Treg-intrinsic CTLA4-PKCeta signaling pathway for cancer immunotherapy. Journal for Immunotherapy Cancer. 9 (9), 002792 (2021).
- Kong, K. F., et al. Protein kinase C-eta controls CTLA-4-mediated regulatory T cell function. Nature Immunology. 15 (5), 465-472 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon