Method Article
Experimentelles Melanom-Immuntherapiemodell mit Tumorimpfung mit einem hämatopoetischen Zytokin
In diesem Artikel
Zusammenfassung
Das Protokoll stellt ein Krebsimmuntherapiemodell mit zellbasierter Tumorimpfung mit Flt3L-exprimierendem B16-F10-Melanom vor. Dieses Protokoll demonstriert die Verfahren, einschließlich der Vorbereitung kultivierter Tumorzellen, der Tumorimplantation, der Zellbestrahlung, der Messung des Tumorwachstums, der Isolierung intratumoraler Immunzellen und der Durchflusszytometrieanalyse.
Zusammenfassung
Der Fms-ähnliche Tyrosinkinase-3-Ligand (Flt3L) ist ein hämatopoetisches Zytokin, das das Überleben und die Differenzierung von dendritischen Zellen (DCs) fördert. Es wurde in Tumorimpfstoffen verwendet, um die angeborene Immunität zu aktivieren und die Antitumorreaktionen zu verbessern. Dieses Protokoll zeigt ein therapeutisches Modell mit zellbasiertem Tumorimpfstoff, bestehend aus Flt3L-exprimierenden B16-F10-Melanomzellen sowie phänotypischer und funktioneller Analyse von Immunzellen in der Tumormikroumgebung (TME). Verfahren zur kultivierten Tumorzellpräparation, Tumorimplantation, Zellbestrahlung, Tumorgrößenmessung, intratumorale Immunzellisolierung und Durchflusszytometrieanalyse werden beschrieben. Das übergeordnete Ziel dieses Protokolls ist es, ein präklinisches solides Tumorimmuntherapiemodell und eine Forschungsplattform zur Untersuchung der Beziehung zwischen Tumorzellen und infiltrierenden Immunzellen bereitzustellen. Das hier beschriebene Immuntherapieprotokoll kann mit anderen therapeutischen Modalitäten wie Immun-Checkpoint-Blockade (Anti-CTLA-4, Anti-PD-1, Anti-PD-L1-Antikörper) oder Chemotherapie kombiniert werden, um die krebstherapeutische Wirkung des Melanoms zu verbessern.
Einleitung
Die Krebsimmuntherapie wurde aufgrund ihrer weniger toxischen Nebenwirkungen und dauerhafteren Reaktionen als vielversprechende therapeutische Strategie anerkannt. Es wurden verschiedene Arten von Immuntherapien entwickelt, darunter onkolytische Virustherapien, Krebsimpfstoffe, Zytokintherapien, monoklonale Antikörper, adoptiver Zelltransfer (CAR-T-Zellen oder CAR-NK) und Immun-Checkpoint-Blockade1.
Für Krebsimpfstoffe gibt es verschiedene Formen von therapeutischen Impfstoffen, wie Ganzzellimpfstoffe, Protein- oder Peptidimpfstoffe sowie RNA- oder DNA-Impfstoffe. Die Impfung beruht auf der Fähigkeit von Antigen-präsentierenden Zellen (APCs), Tumorantigene, einschließlich tumorspezifischer Antigene, zu verarbeiten und sie in immunogener Form T-Zellen zu präsentieren. Dendritische Zellen (DCs) sind bekanntermaßen die stärksten APCs und es wird angenommen, dass sie eine wichtige Rolle bei der Antitumorimmunität spielen 2,3. Diese Zellen nehmen Tumorantigene auf und verarbeiten sie und wandern dann zu den drainierenden Lymphknoten (dLN), um tumorspezifische T-Effektorzellen (Teff) durch Engagement des T-Zell-Rezeptors (TCR) und kostimulatorischer Moleküle vorzubereiten und zu aktivieren. Dies führt zu einer Differenzierung und Expansion von tumorspezifischen zytotoxischen T-Zellen (CTL), die den Tumor infiltrieren und Tumorzellen abtöten4. Folglich stellen Aktivierung und Reifung von DCs attraktive Strategien dar, um die Immunität gegen Tumorantigene zu stimulieren.
Es ist bekannt, dass Flt3L die Reifung und Expansion von funktionell reifen DCs fördert, die MHC-Proteine der Klassen II, CD11c, DEC205 und CD86 exprimieren5. Es wurde gezeigt, dass die intratumorale, aber nicht intravenöse Verabreichung eines Adenovirusvektors mit dem Flt3L-Gen (Adv-Flt3L) die immuntherapeutische Aktivität gegen orthrotope Tumoren fördert6. Flt3L wurde auch in Tumorzell-basierten Impfstoffen verwendet, die aus bestrahlten B16-F10-Zellen bestehen, die stabil retroviral transduziertes Flt3L exprimieren, um die Kreuzpräsentation von Tumorantigenen durch DCs zu verbessern und somit die Antitumorreaktionen zu erhöhen. Das hier beschriebene Protokoll der B16-Flt3L-Tumorimpfung basiert auf einer Studie, die von Dr. James Allisons Gruppe7 veröffentlicht wurde. In dieser Arbeit berichteten sie, dass ein B16-Flt3L-Impfstoff in Kombination mit der CTLA-4-Blockade synergistisch die Abstoßung des etablierten Melanoms induzierte, was zu einem erhöhten Überleben führte.
Das Ziel dieses Protokolls ist es, ein präklinisches Immuntherapiemodell für Melanome bereitzustellen. Hier werden detaillierte Verfahren zur Herstellung und Implantation von Tumorimpfstoffen sowie zur Analyse der Zusammensetzung und Funktion intratumoraler Immunzellen aus soliden Tumoren beschrieben.
Protokoll
Alle in der Studie verwendeten Mäuse wurden im Vivarium des La Jolla Institute for Immunology (LJI) unter spezifischen pathogenfreien Bedingungen mit kontrollierter Temperatur und Luftfeuchtigkeit gepflegt und untergebracht. Tierversuche wurden mit 8-14 Wochen alten weiblichen C57BL/6-Mäusen gemäß den vom LJI Animal Care Committee genehmigten Richtlinien und Protokollen durchgeführt.
1. Vorbereitung kultivierter Tumorzellen für die Implantation
- Kultur von B16-F10-Melanomzellen in Iscoves modifiziertem Dulbecco-Medium (IMDM), das 10% hitzeinaktiviertes FBS, 2 mM Glutamin, 1 mM Natriumpyruvat, 1 mM MEM nichtessentielle Aminosäuren und jeweils 100 U / ml Penicillin und Streptomycin enthält. Halten Sie die Zelllinie bei 37 °C unter 5% CO2.
- Aussaat 1,5-2 x 106 B16-F10 Zellen in einem 175T-Kolben und Kultur für 2 Tage. Ernten Sie Zellen, wenn sie zu 75% -80% konfluieren.
- Entfernen Sie das Kulturmedium und waschen Sie den Kolben einmal mit PBS. PBS aspirieren und 5 ml 0,25% Trypsin-EDTA hinzufügen, gefolgt von einem harten Klopfen auf den Rand des Kulturkolbens.
- 15 ml Kulturmedium zugeben, um das Trypsin-EDTA zu neutralisieren, und den Inhalt des Kolbens in ein 50-ml-Zentrifugenröhrchen gießen. Waschen Sie die Geschirroberfläche mit 10 ml PBS und gießen Sie sie in dasselbe 50-ml-Röhrchen.
- Zentrifugieren Sie die Zellen für 5 min bei 200 x g. Verwerfen Sie den Überstand und brechen Sie das Zellpellet, indem Sie mit dem Finger auf den Boden des Röhrchens klopfen.
- Fügen Sie kalte 10 ml PBS hinzu und pipepisieren Sie vorsichtig die Zellsuspension; Dann zählen Sie die Zellen manuell mit dem Hämozytometer. Halten Sie die Zellen vor der Injektion auf Eis.
2. Tumorimplantation
- Gasanästhesieren Mäuse mit 5% Isofluran bei einer Gasdurchflussrate von 1,0 l pro min im Abzug. Ändern Sie die Flussrate auf die Erhaltungsdosis von 2% Isofluran, sobald die Mäuse vollständig betäubt sind. Für dieses Protokoll wurde die Anästhesie vom Tierarzt gemäß den Richtlinien für die institutionelle Tierpflege und -verwendung durchgeführt.
- Rasieren Sie die Haare an der linken Flanke der Mäuse und sterilisieren Sie die Injektionsstelle mit Alkoholtüchern. Intradermal (i.d.) implantieren B16-F10 Tumorzellen an 5 x 105 Zellen in 50 μL kaltem PBS in der linken Flanke mit einer 30 G Nadel.
HINWEIS: Die Dosis der implantierten B16-F10-Tumorzellen muss möglicherweise im Bereich von 0,5-5 x 105 Zellen für eine erfolgreiche Tumorentwicklung angepasst werden. - Nach der Implantation messen Sie die Tumorlänge und -breite dreimal pro Woche mit einem elektronischen digitalen Messschieber. Berechnen Sie das Tumorvolumen (mm3) mit der Formel:
Tumorvolumen (mm3) = Breite2 × Länge × 0,5
Behandeln Sie Mäuse mit Tumorimpfstoff, wenn Tumore eine Größe von ≥2 mm erreicht haben.
HINWEIS: Tumore können in der Regel am Tag 3 nach Implantation von 5 x 105 Tumorzellen gemessen werden. Eine schnellere B16-F10-Tumorwachstumsrate wurde bei männlichen C57BL/6-, Rag1-/- oder Rag2-/-γc-/---Mäusen beobachtet. Eine ähnliche Beobachtung wurde in anderen Studien beschrieben8. Es wird empfohlen, das Geschlecht der Mäuse konsistent zu halten. Beachten Sie jedoch, dass das NIH den Schwerpunkt auf das Geschlecht als wichtige biologische Variable in der biomedizinischen Forschung legt.
3. Impfstoffherstellung und Injektion von Flt3L-exprimierenden B16-F10 (B16-Flt3L)-Zellen
- Halten Sie die B16-Flt3L-Zellen in DMEM, die 8% hitzeinaktiviertes FBS, 2 mM Glutamin und jeweils 100 U / ml Penicillin und Streptomycin enthalten, bei 37 ° C unter 5% CO2.
- Aussaat 1 x 106 B16-Flt3L-Zellen in einem 175T-Kolben und Kultur für 2 Tage. Ernten Sie Zellen, wenn sie 75% -80% konfluent sind, wie in den Schritten 1.3 bis 1.6 beschrieben, und suspendieren Sie in 1 ml kaltem PBS.
- Bestrahlung von Zellen mit 150 Gy Gammastrahlendosis mit Röntgenbestrahlungsgerät mit 160 kV und 25 mA Parametereinstellung. Zählen und überprüfen Sie die Zelllebensfähigkeit durch Trypanblau-Färbung vor der Injektion.
- Gasanästhesieren Sie Mäuse wie zuvor beschrieben und sterilisieren Sie die Injektionsstelle mit Alkoholtüchern. Intradermal injizieren Sie den Mäusen 1 x 10 6 bestrahlte B16-Flt3L-Zellen in 50 μL kaltem PBS auf derselben Flanke wie die ursprüngliche Tumorimplantation, ~1 cm entfernt von der Stelle des Primärtumors an den Tagen 3,6 und 9 nach der ersten Zellimplantation.
- Markieren Sie die Impfstoffinjektionsstellen mit einem farbigen Stift, um sie vom Primärtumor zu unterscheiden.
HINWEIS: Wenn anfänglich 0,5 x 105 B16-F10-Zellen implantiert werden, wird empfohlen, eine Impfbehandlung an den Tagen 8, 11 und 14 durchzuführen.
4. Intratumorale Immunzellisolierung
- Opfern Sie Mäuse mit CO2 und zervikaler Dislokation im Abzug am Ende des Experiments (am Tag 15 nach der Tumorimplantation; Abbildung 1).
- Entfernen Sie den Tumor chirurgisch mit der Haut von jeder Maus und legen Sie ihn in eine 24-Well-Platte mit 1 ml 10% FBS / RPMI-1640-Medium. Trocknen Sie die Tumore mit einem Papiertuch, bevor Sie es wiegen.
- Schneiden Sie die Tumore in kleine Stücke. 2 ml Aufschlusspuffer (100 μg/ml TL Liberase und 200 μg/ml DNase I in RPMI-1640 Medium) zugeben und 25 min bei 37 °C inkubieren.
- Fügen Sie 10 ml 10% FBS / RPMI-1640-Medium hinzu, um die Verdauung zu stoppen. Übertragen Sie die Zellen mit einer 25-ml-serologischen Pipette und verwenden Sie den Kolben einer 1-ml-Spritze, um Gewebe auf einem 40-μm-Zellsieb zu schleifen.
- Zentrifugieren Sie die Zellen bei 500 x g für 5 min bei 4 °C. Resuspendieren Sie das Pellet in 5 mL 40% Dichte gradient spezifisches Medium in PBS, verdünnt auf 1x Konzentration).
- Fügen Sie die Zellsuspension langsam auf 5 ml 80% dichtegradientenspezifisches Medium hinzu, das PBS enthält. Zentrifugieren Sie die Zellen bei 325 x g mit niedriger Bremseinstellung für 23 min bei Raumtemperatur (RT).
- Nach der Zentrifugation die Leukozytenschicht an der Grenzfläche zwischen 40% und 80% dichtegradientenspezifischem Medium vorsichtig auffangen und durch ein 40 μm großes Zellsieb leiten. Zentrifugieren Sie die Zellen bei 500 x g für 5 min bei 4 °C.
- Inkubieren Sie das Pellet in 2 ml Erythrozyten-Lysepuffer (RBC) für 5 Minuten bei RT. Nach der Inkubation 10 ml 10% FBS/RPMI-1640-Medium hinzufügen, um den RBC-Lysepuffer zu löschen.
- Zentrifugieren Sie die Zellen bei 500 x g für 5 min bei 4 °C. Resuspendieren Sie die Zellen in 0,5 ml 10% FBS/RPMI-1640-Medium und zählen Sie die Gesamtzahl der Zellen vor der weiteren Analyse.
HINWEIS: Sammeln Sie die Milz oder dLN als Kontrollen für die Gating-Strategie von Immunzelluntergruppen durch Durchflusszytometrie-Analyse. Befolgen Sie die oben beschriebene Zellisolierungsmethode mit den folgenden Änderungen: Verwenden Sie den Kolben einer 1-ml-Spritze, um Gewebe auf einem 70-μm-Netzfilter zu schleifen. Waschen Sie das Gewebe mit 10% FBS / RPMI-1640-Medium, um einzellige Suspensionen zu erhalten. Lysieren Sie die RBC wie beschrieben.
5. Durchflusszytometrie-Analyse
HINWEIS: Zellen, die aus der Leukozytenschicht gewonnen werden, enthalten Immunzellen und Tumorzellen. Zwei unabhängige Färbeplatten werden empfohlen.
- Oberflächenfärbung
- Übertragen Sie die Zellen in eine 96-Well-V-förmige Bodenplatte. Waschen Sie die Zellen mit PBS und färben Sie sie mit Zelllebensfähigkeitsfarbstoff (50-100 μL / Well) für 15 min bei RT.
- Zentrifugieren Sie die Zellen bei 500 x g für 5 min bei 4 °C. Färben Sie die Oberflächenmarker mit gemischten Antikörpern (detaillierte Verdünnung finden Sie in der Materialtabelle) in FACS-Puffer (1% FBS und 0,05% NaN3 in PBS) für 30 min auf Eis (50-100 μL / Well).
- Zentrifugieren Sie die Zellen bei 500 x g für 5 min und waschen Sie sie zweimal mit FACS-Puffer.
- Fixieren Sie die Zellen mit Zellfixierpuffer (50-100 μL/ Well) für 35 min auf Eis. Zentrifugieren Sie die Zellen bei 500 x g für 5 min und waschen Sie sie zweimal mit FACS-Puffer.
- Lagern Sie die Proben im FACS-Puffer (150-200 μL/Röhrchen) bei 4 °C und schützen Sie sie vor Licht. Erfassen Sie die Proben mit einem Durchflusszytometer. Befolgen Sie für DCs und T-Zellen die Gating-Strategien in Abbildung 2B und Abbildung 3A.
HINWEIS: Für die Färbung myeloider DCs wird empfohlen, FC-Blocker (Ratten-Anti-Maus-CD16/CD32) für 15 min auf Eis zu inkubieren, bevor die Oberflächenantikörperinkubation (Schritt 5.1.2) inkubiert wird.
- Zytokinanalyse bei ex vivo Restimulation
- Die Zellen werden in vollständigem Medium (RPMI-1640 ergänzt mit 10% FBS, 10 mM HEPES, pH 7,2-7,6, 0,1 mM nicht-essentieller Aminosäure, 1 mM Natriumpyruvat, je 100 U/ml Penicillin und Streptomycin, 50 μM 2-Mercaptoethanol und 2 mM L-Glutamin) beschichtet und mit 50 ng/ml PMA plus 1 μM Ionomycin in Gegenwart von Proteintransportinhibitor für 4 h bei 37 °C unter 5%CO2 stimuliert.
- Führen Sie die Oberflächenfärbung für Oberflächenmarker wie oben in Schritt 5.1 beschrieben durch.
- Fügen Sie die Permeabilisierungslösung (50-100 μL / Well) hinzu und inkubieren Sie für 5 min bei RT für die intrazelluläre Färbung. Inkubieren Sie die Zellen mit Antikörpern, die spezifisch für Zytokine oder Kernproteine sind, in Permeabilisierungslösung (50-100 μL/Well) für 60 min auf Eis oder über Nacht bei 4 °C.
- Zentrifugieren Sie die Zellen bei 500 x g für 5 min und waschen Sie sie zweimal mit FACS-Puffer. Die Proben bei 4 °C lagern und vor Licht schützen. Erfassen Sie die Proben mit einem Durchflusszytometer.
HINWEIS: Die Antikörperverdünnung muss möglicherweise bei Bedarf angepasst werden, um eine optimale Färbung zu erreichen.
Ergebnisse
Ein sichtbarer schwarzer Punkt der implantierten B16-F10-Zellen wird normalerweise ~3 Tage nach der Tumorimplantation auf der Hautoberfläche beobachtet. Mäuse werden 3, 6 und 9 Tage nach Erreichen einer Größe von ≥2 mm mit dem Tumorimpfstoff behandelt. Wir beobachteten eine signifikante Verringerung des Tumorwachstums in der Gruppe der geimpften Mäuse ~2 Wochen nach der Tumorimplantation (Abbildung 1). Am Ende des Experiments isolierten wir die intratumoralen Immunzellen und analysierten ihre Anzahl und Zelloberflächenmarkerexpression sowie die Zytokinproduktion nach einer kurzen in vitro Stimulation wie oben beschrieben. Zellen, die aus der Leukozytenschicht gewonnen werden, enthalten immer noch viele Tumorzellen, was es etwas schwierig macht, die Lymphozytenpopulation leicht zu definieren. Daher wird die Verwendung paralleler Splenozyten für die korrekte Gating von intratumoralen Immunzelluntergruppen in der Durchflusszytometrie-Analyse empfohlen (Abbildung 2A). Hier sind die Gating-Strategien von CD103+CD11c+DC, CD8+, CD4+ und Treg (Abbildung 2B und Abbildung 3A) zusammen mit der Kompensationsmatrix (Tabelle 1 und Tabelle 2) dargestellt. Repräsentative Daten der erfassten Anzahl und Häufigkeit jeder Population sind auch in Abbildung 2C und Abbildung 3B enthalten.
Intratumorale CD103+CD11c+DCs, die die stärksten Tumorantigen-verarbeitenden und präsentierenden Zellen 9,10 darstellen, von geimpften Mäusen zeigten eine signifikant erhöhte Expression des kostimulatorischen Liganden CD86 (Abbildung 4). Geimpfte Mäuse zeigten auch einen Anstieg der tumorinfiltrierenden CD8+ und CD4+Foxp3− T-Zellen (Abbildung 5A) sowie der CD8+GzmB+ und IFN-γ+ CTLs (Abbildung 5B). Diese Ergebnisse deuten darauf hin, dass diese Tumorimpfung die DC-Reifung fördert und eine stärkere Antitumorimmunität induziert.
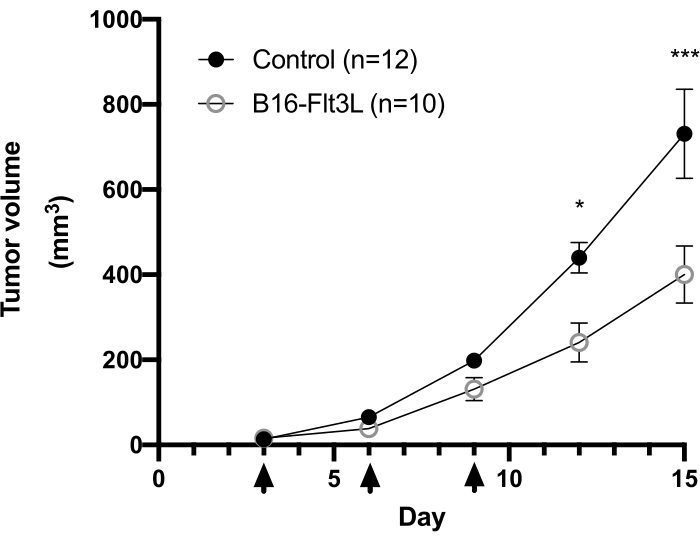
Abbildung 1: Analyse des Tumorwachstums in einem therapeutischen Modell eines zellbasierten Tumorimpfstoffs unter Verwendung von Flt3L-exprimierenden B16-F10-Melanomzellen. Weiblichen C57BL/6-Mäusen wurden i.d. B16-F10-Zellen (5 x 105) implantiert und bestrahlte (150 Gy) B16-Flt3L-Zellen (1 x 106) an einer benachbarten Stelle an derselben Flanke injiziert. Die Pfeilspitzen zeigen die Zeitpunkte der Impfung an. Kumulative Daten von vier Experimenten werden gezeigt (Control, n = 12; B16-Flt3L, n = 10). Die Daten werden als Mittelwert ± REM dargestellt. Statistische Analyse durch bidirektionale wiederholte Messungen ANOVA-Test mit Bonferroni Post-Test. *P < 0,05; P < 0,001. Diese Zahl wurde von11 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 2: Gating-Strategien von Lymphozyten und CD103+CD11c+DCs. (A) Gating-Strategien von Lymphozyten in Milz- und Tumorproben. (B) Gating-Strategien von intratumoralen CD103+CD11c+DCs in Tumorproben. (C) Es werden die Anzahl und Häufigkeit jeder Population von einer repräsentativen ungeimpften Kontrollmaus gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
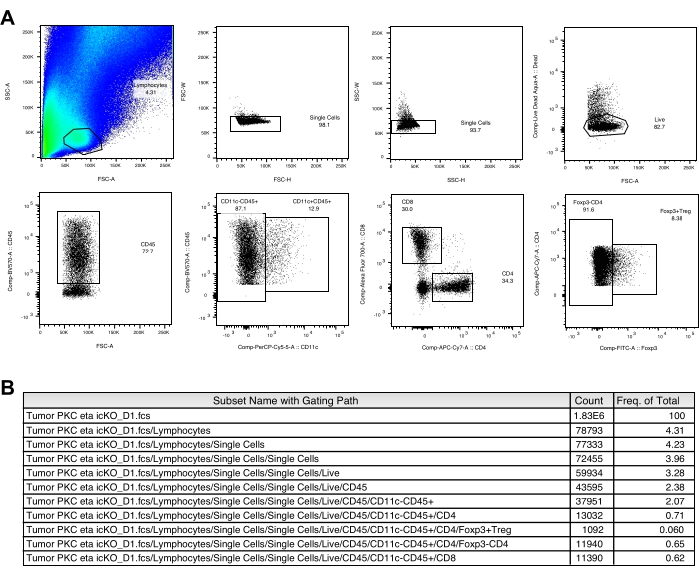
Abbildung 3: Gating-Strategien von CD8+, CD4+ und Treg. (A) Gating-Strategien von T-Zellen in Tumorproben. (B) Erfasste Anzahl und Häufigkeit jeder Population von einer repräsentativen ungeimpften Kontrollmaus werden gezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
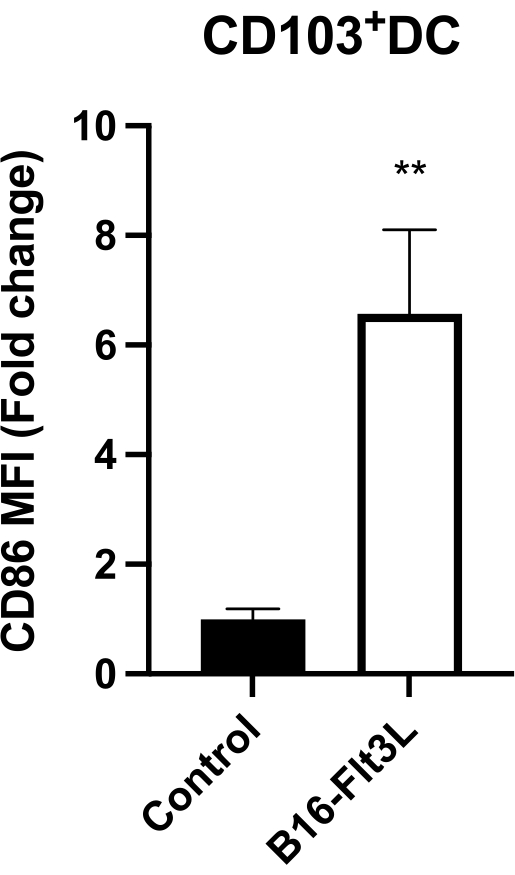
Abbildung 4: CD86-Oberflächenexpression auf CD103+ intratumoralen DCs. Die Expression wird als mediane Fluoreszenzintensität (MFI) angegeben, normiert auf durchschnittliche MFI in der Kontrollgruppe (= 1). Kontrolle, n = 8; B16-Flt3L, n = 10. Die Daten werden als Mittelwert ± SEM dargestellt. Statistische Analyse durch ungepaarten Student's t-Test. **P < 0,01. Diese Zahl wurde von11 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.

Abbildung 5: Analyse intratumoraler T-Zellen in kontrollierten und geimpften Mäusen. (A) Zählung von tumorinfiltrierenden CD8+ (links) und Nicht-Treg CD4+ (rechts) pro Gramm Tumorgewebe. (B) Zählung intratumoraler GzmB+ (links) und IFNγ+ (rechts) CD8+ T-Zellen. Kontrolle, n = 11; B16-Flt3L, n = 10. Die Daten werden als Mittelwert ± SEM dargestellt. Statistische Auswertung durch ungepaarten Student's t-Test. *P < 0,05; **P < 0,01. Diese Zahl wurde von11 geändert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Tabelle 1: Kompensationsmatrix von Abbildung 2. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Tabelle 2: Kompensationsmatrix von Abbildung 3. Bitte klicken Sie hier, um diese Tabelle herunterzuladen.
Diskussion
Das hier beschriebene Protokoll basiert auf der Studie von Allisons Gruppe. Sie zeigten, dass die Kombination von B16-Flt3L-Impfstoff mit CTLA-4-Blockade einen synergistischen Effekt auf die Überlebensrate und das Tumorwachstum zeigte, während bei Mäusen, die den B16-Flt3L-Impfstoff oder die Anti-CTLA-4-Antikörperbehandlung allein erhielten, keine Verringerung des Tumorwachstums beobachtet wurde7. Neuere Studien haben einen neuartigen Treg-intrinsischen CTLA4-PKCη-Signalweg aufgedeckt, der eine wichtige obligatorische Rolle bei der Regulierung der kontaktabhängigen suppressiven Aktivität von Treg11 spielt. Sowohl die B16-Flt3L-Impfstoffbehandlung allein als auch die Impfstoffkombination mit Treg-spezifischer PKCη-Deletion reduzierten signifikant das Tumorwachstum, wenn eine höhere Anzahl (0,5-5 x 105) von B16-F10-Melanomzellen als in der Allison-Studie (1 x 104) implantiert wurde. Subtile Unterschiede in der Quelle von Melanomzellen oder Mäusen können für diesen Unterschied verantwortlich sein. Daher wird empfohlen, die Anzahl der implantierten Tumorzellen zu titrieren. Eine erhöhte Infiltration von CD8+ T-Zellen im Primärtumor wurde in ähnlicher Weise in der vorherigen Studiebeobachtet 7. Darüber hinaus beobachteten wir eine erhöhte CD86-Expression auf intratumoralen CD103 + CD11c + DCs, was wahrscheinlich für eine stärkere Aktivierung und Expansion von tumorinfiltrierenden CD8+ CTLs verantwortlich ist.
Dieses Protokoll, das einen zellbasierten Tumorimpfstoff verwendet, der Flt3L exprimiert, ist bequem und unkompliziert zu bedienen und dient als zuverlässiges Modell zur Untersuchung intratumoraler Immunzellinfiltrate, einschließlich DCs. Beispielsweise ist PKCη-Signalisierung für die kontaktabhängige Unterdrückungsaktivität von Treg erforderlich. Somit zeigte Prkch−/− Treg eine höhere Konjugationseffizienz mit APCs in einem Treg-DC-In-vitro-Kokultursystem, was auf einen Defekt in der Fähigkeit von Prkch−/− Treg hinweist, den Kontakt zu brechen und sich von angeschlossenen DCszu lösen 12. Die B16-Flt3L-Impfung rekrutiert wahrscheinlich reifere DCs, die tumorspezifische Antigene effizienter präsentieren, und erleichtert daher wahrscheinlich die Beobachtung der Interaktion zwischen tumorinfiltrierendem Treg und DC durch Lebendzellbildgebung.
Ein ausreichender Abstand zwischen dem Primärtumor und dem Tumorimpfstoff ist ein wichtiges Merkmal dieses Protokolls. Diese physische Trennung ist entscheidend, um Raum für das Wachstum des Primärtumors zu schaffen und eine mögliche Fusion zwischen den beiden Tumorimplantaten zu vermeiden. Alternativ kann der Tumorimpfstoff in die gegenüberliegende Flanke relativ zum Primärtumor implantiert werden, da dies auch das Tumorwachstum hemmt7. Eine Einschränkung der Studie ist das Fehlen einer kommerziellen Quelle der B16-Flt3L-Zelllinie, aber das gleiche Konzept kann auf andere Tumorarten angewendet werden, zum Beispiel TRAMP-C2 Prostata-Adenokarzinome7.
Obwohl das hier beschriebene Protokoll B16-F10-Melanomzellen als Tumormodell verwendet, können die zugrunde liegenden Prinzipien bei Bedarf angepasst und modifiziert werden, um immuntherapeutische Modelle für andere solide Tumoren zu etablieren. Darüber hinaus kann das von uns verwendete Impfprotokoll leicht mit anderen therapeutischen Modalitäten kombiniert werden, z. B. CTLA-4- oder PD-1-basierte Checkpoint-Blockade, um additive oder synergistische Effekte zu erzielen, die möglicherweise zu einer stärkeren Antitumorimmunität und einem erhöhten Überleben führen können.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Wir danken Dr. Stephen Schoenberger für die Bereitstellung von B16-Flt3L-Zellen und den Mitarbeitern der LJI-Tier- und Durchflusszytometrie-Einrichtungen für hervorragende Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.25% trypsin-EDTA | Gibco | 25200-056 | |
| 10% heat-inactivated FBS | Omega Scientific | FB-02 | Lot# 209018 |
| 30G needle | BD Biosciences | 305106 | |
| 96 well V-shape-bottom plate | SARSTEDT | 83.3926.500 | |
| B16 cell line expressing Fms-like tyrosine kinase 3 ligand (B16-Flt3L) | Gift of Dr. Stephen Schoenberger, LJI | Flt3L cDNAs were cloned into the pMG-Lyt2 retroviral vector, as in refernce 5, Supplemental Figure 1 | |
| B16-F10 cell lines | ATCC | CRL-6475 | |
| Centrifuge 5810R | Eppendorf | ||
| Cytofix fixation buffer | BD Biosciences | BDB554655 | Cell fixation buffer (4.2% PFA) |
| Cytofix/Cytoperm kit | BD Biosciences | 554714 | Fixation/Permeabilization Solution Kit |
| DNase I | Sigma | 11284932001 | |
| Dulbecco's Modified Eagle Medium (DMEM) | Corning | 10013CV | |
| Electronic digital caliper | Fisherbrand | 14-648-17 | |
| FlowJo software | Tree Star | Flow cytometer data analysis | |
| GolgiStop (protein transport inhibitor) | BD Biosciences | 554724 | 1:1500 dilution |
| HEPES (1M) | Gibco | 15630-080 | |
| Ionomycin | Sigma | I0634 | |
| Iscove’s modified Dulbecco’s medium (IMDM) | Thermo Fisher | 12440053 | |
| LSR-II cytometers | BD Biosciences | Flow cytometer | |
| MEM nonessential amino acids | Gibco | 11140-050 | |
| penicillin and streptomycin | Gibco | 15140-122 | |
| Percoll | GE Healthcare Life Sciences | GE17-0891-02 | density gradient specific medium |
| PMA | Sigma | P1585 | |
| Red Blood Cell Lysing Buffer Hybri-Max liquid | Sigma | R7757-100ML | |
| RPMI 1640 medium | Corning | 10-040-CV | |
| RS2000 X-ray Irradiator | Rad Source Technologies | ||
| sodium pyruvate | Gibco | 11360-070 | |
| Sterile cell strainer 40 μm | Fisherbrand | 22-363-547 | |
| Sterile cell strainer 70 μm | Fisherbrand | 22-363-548 | |
| TL Liberase | Roche | 477530 | |
| Zombie Aqua fixable viability kit | BioLegend | 423101 | |
| Antibodies | |||
| Anti-mCD45 | BioLegend | 103135 | Clone: 30-F11 Fluorophore: BV570 Dilution: 1:200 |
| Anti-mCD3ε | BioLegend | 100327 | Clone: 145-2C11 Fluorophore: PerCP-Cy5.5 Dilution: 1:200 |
| Anti-mCD8 | BioLegend | 100730 100724 | Clone: 53-6.7 Fluorophore: Alexa Fluor 700, Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD4 | BioLegend | 100414 | Clone: GK1.5 Fluorophore: APC-Cy7 Dilution: 1:200 |
| Anti-mFoxp3 | Thermo Fisher Scientific | 11577382 | Clone: FJK-16s Fluorophore: FITC Dilution: 1:100 |
| Anti-m/hGzmB | BioLegend | 372208 | Clone: QA16A02 Fluorophore: PE Dilution: 1:100 |
| Anti-mIFNg | BioLegend | 505826 | Clone: XMG1.2 Fluorophore: PE-Cy7 Dilution: 1:100 |
| Anti-mCD19 | BioLegend | 115543 | Clone: 6D5 Fluorophore: BV785 Dilution: 1:100 |
| Anti-mGr1 | BioLegend | 108423 | Clone: RB6-8C5 Fluorophore: APC/Cy7 Dilution: 1:200 |
| Anti-mCD11b | BioLegend | 101223 | Clone: M1/70 Fluorophore: Pacific blue Dilution: 1:100 |
| Anti-mF4/80 | BioLegend | 123114 | Clone: BM8 Fluorophore: PECy7 Dilution: 1:100 |
| Anti-mCD11c | BioLegend | 117328 | Clone: N418 Fluorophore: PerCP Cy5.5 Dilution: 1:100 |
| Anti-mMHCII | BioLegend | 107622 | Clone: M5/114.15.2 Fluorophore: AF700 Dilution: 1:400 |
| Anti-mCD103 | BioLegend | 121410 | Clone: 2E7 Fluorophore: Alexa Fluor 647 Dilution: 1:200 |
| Anti-mCD86 | BioLegend | 105007 | Clone: GL-1 Fluorophore: PE Dilution: 1:200 |
| FC-blocker (Rat anti-mouse CD16/CD32) | BD Biosciences | 553141 | Clone: 2.4G2 Dilution: 1:200 |
Referenzen
- Zhang, Y., Zhang, Z. The history and advances in cancer immunotherapy: understanding the characteristics of tumor-infiltrating immune cells and their therapeutic implications. Cell & Molecular Immunology. 17 (8), 807-821 (2020).
- Banchereau, J., Steinman, R. M. Dendritic cells and the control of immunity. Nature. 392 (6673), 245-252 (1998).
- Banchereau, J., et al. Immunobiology of dendritic cells. Annual Review of Immunology. 18, 767-811 (2000).
- Martinez-Lostao, L., Anel, A., Pardo, J. How do cytotoxic lymphocytes kill cancer cells. Clinical Cancer Research. 21 (22), 5047-5056 (2015).
- Maraskovsky, E., et al. Dramatic increase in the numbers of functionally mature dendritic cells in Flt3 ligand-treated mice: multiple dendritic cell subpopulations identified. Journal of Experimental Medicine. 184 (5), 1953-1962 (1996).
- Talmadge, J. E., et al. Intratumoral, injection of adenoviral Flt3 ligand has therapeutic activity in association with increased intratumoral levels of T cells but not dendritic cells. Blood. 104 (11), 5280 (2004).
- Curran, M. A., Allison, J. P. Tumor vaccines expressing flt3 ligand synergize with ctla-4 blockade to reject preimplanted tumors. American Association for Cancer Research. 69 (19), 7747-7755 (2009).
- Simon, S. R., Ershler, W. B. Hormonal influences on growth of B16 murine melanoma. Journal of the National Cancer Institute. 74 (5), 1085-1088 (1985).
- Broz, M. L., et al. Dissecting the tumor myeloid compartment reveals rare activating antigen-presenting cells critical for T cell immunity. Cancer Cell. 26 (6), 938 (2014).
- Salmon, H., et al. Expansion and activation of CD103(+) dendritic cell progenitors at the tumor site enhances tumor responses to therapeutic PD-L1 and BRAF inhibition. Immunity. 44 (4), 924-938 (2016).
- Liu, H. Y., et al. Leveraging the Treg-intrinsic CTLA4-PKCeta signaling pathway for cancer immunotherapy. Journal for Immunotherapy Cancer. 9 (9), 002792 (2021).
- Kong, K. F., et al. Protein kinase C-eta controls CTLA-4-mediated regulatory T cell function. Nature Immunology. 15 (5), 465-472 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten