Method Article
Yüksek Canlılık Doku Toplanması için Kemirgenlerde Minimal İnvaziv Beyin Tümörü Rezeksiyonunun Uygulanması
Bu Makalede
Özet
Mevcut protokol, entegre bir doku koruma sistemi ile minimal invaziv bir yaklaşımla kemirgenlerde beyin tümörlerinin standartlaştırılmış bir rezeksiyonunu tanımlamaktadır. Bu tekniğin, kemirgen ve diğer hayvan modellerindeki bakım standardını doğru bir şekilde yansıtmak için etkileri vardır.
Özet
Mevcut protokol, kemirgen beyin tümörü rezeksiyonu ve doku muhafazası için standartlaştırılmış bir paradigmayı tanımlamaktadır. Klinik pratikte, maksimal tümör rezeksiyonu çoğu beyin tümörü için standart bakım tedavisidir. Bununla birlikte, şu anda mevcut olan preklinik beyin tümörü modellerinin çoğu ya rezeksiyon içermez ya da zaman alıcı olan ve önemli postoperatif morbidite, mortalite veya deneysel değişkenliğe yol açan cerrahi rezeksiyon modellerini kullanır. Ek olarak, kemirgenlerde rezeksiyon yapmak, klinik olarak karşılaştırılabilir cerrahi aletlerin veya protokollerin eksikliği ve standartlaştırılmış doku toplama için kurulmuş bir platformun bulunmaması gibi çeşitli nedenlerden dolayı göz korkutucu olabilir. Bu protokol, çok işlevli, ablatif olmayan bir rezeksiyon cihazının ve cihazın klinik versiyonundan uyarlanmış entegre bir doku koruma sisteminin kullanımını vurgulamaktadır. Bu çalışmada uygulanan cihaz, hassas bir şekilde problama, kesme ve emme dokusu için ayarlanabilir emme ve diyafram açıklığında silindirik bir bıçağı birleştirir. Minimal invaziv rezeksiyon cihazı , işlevlerini ilk tümör implantasyonu için kullanılan aynı çapak deliğinden yerine getirir. Bu yaklaşım, biyopsi veya rezeksiyon ameliyatları sırasında bölgesel anatomideki değişiklikleri en aza indirir ve önemli kan kaybı riskini azaltır. Bu faktörler ameliyat süresini önemli ölçüde azaltmıştır (<2 dk/hayvan), postoperatif hayvan sağkalımını iyileştirmiş, deney gruplarında değişkenliği azaltmış ve gelecekteki analizler için rezeke edilmiş doku ve hücrelerin yüksek canlılığı ile sonuçlanmıştır. Bu işlem, ~ 1.400 döngü / dak'lık bir bıçak hızı ile kolaylaştırılır, bu da dokuların fizyolojik bir çözelti ile doldurulabilen steril bir kapalı sisteme toplanmasına izin verir. Cerrahinin etkisini, bölgeselleştirilmiş tümör rezeksiyon örneklerinin korunmasını ve titiz karşılaştırmalı analizini ve kavite içi verilen terapötikleri incelemenin ve doğru bir şekilde modellemenin ortaya çıkan önemi göz önüne alındığında, bu eşsiz protokol, beyin tümörü hastaları için perioperatif yönetim ve terapötik keşif hakkında cevaplanmamış soruları keşfetme fırsatlarını genişletecektir.
Giriş
Glioblastoma (GBM) erişkinlerde en sık görülen ve agresif primer beyin tümörüdür. Nöroşirürji, hedefe yönelik ilaç geliştirme ve radyasyon tedavisindeki son gelişmelere rağmen, GBM hastaları için 5 yıllık sağkalım oranı% 5'in altındadır ve otuz yıldan fazla bir süredir önemli ölçüde iyileşmemiş biristatistiktir1. Bu nedenle daha etkili tedavi stratejilerine ihtiyaç vardır.
Yeni tedaviler geliştirmek için, araştırma protokollerinin (1) tümör heterojenliğini ve mikro çevreyi doğru bir şekilde özetleyen çevrilebilir klinik öncesi modelleri kullanması, (2) GBM'li hastalarda kullanılan ve şu anda cerrahi, radyoterapi ve kemoterapiyi içeren standart terapötik rejimi yansıtması ve (3) rezeke edilmiş çekirdek ile kalıntı arasındaki farkı hesaba katması gerektiği giderek daha belirgin hale gelmektedir. invaziv tümör dokuları 2,3,4,5. Bununla birlikte, şu anda mevcut olan preklinik beyin tümörü modellerinin çoğu ya cerrahi rezeksiyon uygulamıyor ya da nispeten zaman alıcı olan cerrahi rezeksiyon modellerini kullanıyor, bu da önemli miktarda kan kaybına yol açıyor veya standardizasyon eksikliğine neden oluyor. Ayrıca, kemirgen beyin tümörlerinin rezeksiyonunu gerçekleştirmek, klinik olarak karşılaştırılabilir cerrahi aletlerin veya protokollerin eksikliği ve sistematik doku toplama için yerleşik bir platform6'nın bulunmaması nedeniyle zor olabilir (Tablo 1).
Bu protokol, kemirgen beyin tümörü rezeksiyonu ve doku koruması için çok fonksiyonlu ablatif olmayan minimal invaziv rezeksiyon sistemi (MIRS) ve entegre bir doku koruma sistemi (TPS) kullanarak standartlaştırılmış bir paradigmayı tanımlamayı amaçlamaktadır (Şekil 1). Bu eşsiz tekniğin, GBM ve diğer beyin tümörü modelleri için klinik öncesi araştırmalarda çeşitli çalışmalarda kullanılabilecek standartlaştırılmış bir platform sağlaması beklenmektedir. Beyin tümörleri için terapötik veya tanısal modaliteleri araştıran araştırmacılar, çalışmalarında standartlaştırılmış bir rezeksiyon elde etmek için bu protokolü uygulayabilirler.
Protokol
Tüm hayvan çalışmaları Maryland Üniversitesi ve Johns Hopkins Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından onaylanmıştır. Bu çalışmada 6-8 haftalık C57BL/6 dişi fareler kullanıldı. Fareler ticari kaynaklardan elde edilmiştir (bakınız Malzeme Tablosu). Maske, eldiven ve önlük kullanımı da dahil olmak üzere tüm Biyogüvenlik Seviye 2 (BSL-2) düzenlemelerine uyulmuştur.
1. İlk intrakraniyal tümör implantasyonu
- Çalışmanın ilk aşamasında, her fareye, daha önce yayınlanan rapor7'yi takiben 4 μL fosfat tamponlu salin (1x PBS) içinde asılı 100.000 hücre (GL261 murin glioma hücre hattı) ile intrakraniyal olarak 2.5 mm derinliğe enjekte edin.
- Tümör implantasyonundan8 9 gün sonra in vivo görüntüleme sistemini kullanarak her faredeki tümör sinyalini ölçün.
NOT: Gerekirse, fareleri tümör yüküne göre iki gruba ayırın. Bu çalışmada, iki grup şunlardı: (1) nispeten küçük tümör yüküne sahip fareler (ortalama biyolüminesan sinyal = 5.5e + 006 ± 0.1e + 006 foton / s, n = 10) ve (2) nispeten büyük tümör yüküne sahip fareler (ortalama biyolüminesan sinyal = 1.69e + 007 ± 0.2e + 007 foton / s, n = 10), (p < 0.05, Mann-Whitney testi)9. - Her grubu karşılaştırılabilir iki alt gruba bölün.
NOT: Bu çalışmada iki alt grup: Tedavi edilmemiş fareler (n=5) ve MIRS kullanılarak cerrahi rezeksiyon uygulanan tümörlü fareler (n = 5), (p > 0.05, Mann-Whitney testi)9. - Rezeksiyon gününden itibaren, tümör büyüme paternine dayanan bir frekansta in vivo görüntüleme sistemini kullanarak tümör ilerlemesini izleyin.
NOT: GL261 hücre hattı için, rezeksiyon gününde ve daha sonra her 3-6 günde bir tümör ilerlemesini izleyin.
2. MIRS kullanarak tümör rezeksiyonu
- Bir indüksiyon odasında izofluran-O2 gaz karışımı veya intraperitoneal ksilazin / ketamin çözeltisi enjeksiyonu kullanarak fareyi anestezi altına alın.
- Gaz anestezik kullanıyorsanız, anestezi indüksiyonu için gaz akış hızını 1.0 mL / dak'ya ve buharlaştırıcıyı% 2.0'a ayarlayın, tipik olarak odada 3-5 dakika gerekir (bkz.
- Enjekte edilebilir anestezi kullanılıyorsa, intraperitoneal olarak 0.2 mL anestezik çözelti (80-100 mg / kg ketamin ve 10-12.5 mg / kg ksilazin) enjekte ederek fareleri anestezi altına alın.
- Ayak parmağını sıkıştırarak hayvanı yeterli sedasyon için değerlendirin. Korneanın kurumasını önlemek için gözlere oftalmik merhem uygulayın. İşlemden önce bir analjezik (0.03-0.06 mg / kg buprenorfin deri altından) uygulayın.
- Tam sedasyon onaylandıktan sonra fareyi stereotaktik çerçevenin üzerine yerleştirin ( Malzeme Tablosuna bakınız).
NOT: Gaz anestezisi kullanıyorsanız, farenin burnunu, işlem sırasında izofluran-O2 karışımını almaya devam edeceği bir burun konisine yerleştirin (%1,5). - Önceki zımbayı çıkarın, ardından saçları tüy dökücü bir kremle veya tıraş ederek çıkarın. Klorheksidin/betadin bazlı ovma ve alkolün alternatif döngüleri ile cildi dezenfekte edin. Daha sonra, steril bir neşter kullanarak, önceki cerrahi skar boyunca 1 cm uzunlamasına orta hat kesisi oluşturun.
- Gelişmiş stabilite ve hassasiyet için MIRS el parçasını sahne adaptörü/el aleti tutucusu aracılığıyla stereotaktik kola takın.
- MIRS makinesini aşağıdaki ayarları kullanarak ayarlayın (bkz. Malzeme Tablosu) (Şekil 1).
- Arka panelde ayarlanan güç kablosunu güç kablosu prizine takın. Geçiş yaparak sistemin gücünü açın veya kapatın (1 = AÇIK, 0 = KAPALI).
- Nitrojen hortumunun bir ucunu (konsolla birlikte verilir) konsolun arka panelindeki erkek bağlantı parçasına yerleştirin. Bağlantıyı sıkmak için bağlantı somununu saat yönünde döndürün.
NOT: Hortumun karşı ucunun azot beslemesine bağlanması gerekir. - Hortumu nitrojen beslemesine takmadan önce, besleme basıncının konsol için önerilen giriş besleme basıncı olan 100 psig'yi geçmediğini doğrulayın.
NOT: Azot konsola sağlandıktan sonra konsol, ayak pedalı tarafından etkinleştirildiğinde kendi aspirasyonunu üretecektir. - Vakum portunun kapağını sabitleyin ve vakum sisteminde herhangi bir sızıntıyı önlemek için kapatın. Aspirasyon sistemindeki herhangi bir sızıntı, MIRS konsolunun performansını etkileyecektir.
- Kurulum veya astarlama sırasında aspirasyon 17'nin altındaysa, konsolun önündeki aspirasyon düğmesinin maksimum seviyede (100) ayarlandığından emin olun, aspirasyon sisteminde sızıntı olmadığından emin olun ve azot giriş besleme basıncının doğru olduğundan emin olun.
- Ayak pedalını konsola bağlamak için, gri ayak pedalı konektörünü tıklayana ve yerine oturana kadar gri kabına takın.
NOT: Ayak pedalı konektörü konsola tek bir yönde bağlanır ve anahtarlanır. - El parçasını konsola bağlamak için, mavi el aleti konektörünü tıklatıp yerine oturana kadar mavi haznesine takın.
NOT: El aleti konektörü konsola tek bir yönde bağlanır ve anahtarlanır. - Sistemi kullanmadan önce steril sıvıyı küçük bir kaseden açıklığa, boru ve el aletinden ve daha sonra doku tıkanıklıklarını azaltmak için borunun ve el aletinin iç kısmının yağlanmasını sağlamak için teneke kutuya aspire ederek her bir el parçasını astarlayın.
- Konsolun ön panelinde uygun modu seçerek tek başına aspirasyona veya kesme ile aspirasyona hazırlanın. Ayak pedalını kullanarak başlayın.
- 23 G MIRS kanülünü çapak deliğine 2,5 mm derinliğe kadar yerleştirin.
- Kanüle bağlı ayak pedalına basarak rezeksiyon işlemini başlatın. El parçasındaki kontrol düğmesini kullanarak bir tam döngü (360°) veya daha fazla rezeksiyon gerçekleştirin.
NOT: Ne kadar çok döngü yapılırsa, tümör dokusunun hacmi o kadar fazla rezeke edilir. - Rezeksiyon işlemi tamamlandıktan sonra, 23 G MIRS kanülünü çapak deliğinden çekin ve boruyu yıkamak ve artık kalıntıları yerinden çıkarmak için 5 mL 1x PBS kullanın.
- Fareyi stereotaktik çerçeveden çıkarın ve yarayı zımba veya 4-0 dikiş malzemesiyle kapatın (bkz.
- Fareyi bir ısıtma yastığına veya anesteziden kurtulma sırasında kafesine geri döndürmeden önce ısınan bir ışığın altına yerleştirin.
- Deney tamamlandıktan sonra, kanülü kızartarak temizleyin. Rezeke edilen tüm dokuyu toplama kabına geri "itmek" için soğutulmuş ortam ve hava ile değiştirin. Toplama kabını sistemden çıkarın ve birlikte verilen kapakla kapatın.
- Adım 2.12'yi tamamladıktan sonra, kanülün distal ucunu% 3 H 2 O2'yeyerleştirin ve emme hattını emme toplama kabına geri doldurmak için Hg'de 24-25'te emme uygulayın ve 60-90 s bekletin. Steril ortamla havayı ve ortamı aralıklı olarak titreşen suyla yıkayın.
- İşlemi takiben fareleri herhangi bir nörolojik belirti (anormal düzensiz hareketler veya nöbetler) açısından izleyin.
- Ciddi nörolojik bozuklukları olan fareleri ötenazi haline getirin (uyuşuklaşır, gösterişli bir görünüme sahip olur, kamburlaşır veya düzensiz hareketlere sahip olur).
NOT: Bu çalışmada, her fareyi ötenazi yapmak için 200 mg / kg ticari olarak temin edilebilen bir ötenazi çözeltisi ( bakınız Malzeme Tablosu) kullanılmıştır.
3. TPS ile doku toplama
- Tümör örneğini RBC lizis ortamı içeren bir doku kültürü kabına daldırın (bakınız Malzeme Tablosu) oda sıcaklığında 5 dakika boyunca.
NOT: MIRS'den TPS'ye toplanan doku, öncelikle küçük doku parçaları ile birlikte tek hücreler şeklinde olacaktır. - 50 mL'lik bir konik tüp üzerine 70 μm'lik bir filtre yerleştirin (Malzeme Tablosuna bakınız) ve tümör örneğini filtreden geçirmek için 5 mL'lik bir şırınganın bir pistonunu kullanın.
- Bir transfer pipeti ile, hücrelerin ve herhangi bir doku kütlesinin filtreden geçmesini kolaylaştırmak için RPMI-1640 ortamını kullanın.
- 4 °C'de 5 dakika boyunca 428 x g'de santrifüj. Süpernatantı bir pipetle atın.
- Her numuneyi 5 mL'lik hazırlanmış RPMI-1640 ortamında yeniden askıya alın.
- Doku canlılığını artırmak için, özellikle de büyük doku parçaları ilk izlenimde görselleştirilirse, enzim kokteylinin gerekli hacimlerini (DNAse I, kollajenaz IV, dispase, Papain ve EDTA içeren, Malzeme Tablosuna bakınız) her numuneye ekleyin. Çözümleri karıştırmak için girdabı kullanın.
NOT: Adım 3.6 isteğe bağlıdır. Enzim kokteylinin bileşimi (toplam 5 mL / numune hacmi için): 300 μL DNAse I Grade II, 150 μL Kollajenaz / Dispaz (fibronektin, kollajenaz IV, I ve polar olmayan amino asitleri parçalar), 250 μL Papain (spesifik olmayan proteaz) ve 6 μL 0.5 M EDTA. - Numuneleri 20 dakika boyunca 200 rpm, 37 °C'ye ayarlanmış bir çalkalayıcı inkübatöre yerleştirin.
- 20 dakika sonra, numuneleri 4 ° C'de 5 dakika boyunca 428 x g'de döndürün. Süper natantı atın.
- Tek hücreleri 70 μm'lik bir hücre süzgecinden süzün ve 4 ° C'de 3 dakika boyunca 274 x g'de aşağı doğru döndürün. Trypan Blue ve Hemocytometer ile hücre canlılığı analizi10 yapın (bakınız Malzeme Tablosu).
NOT: 0. Gün canlılığı %30-%70 arasında değişir ve 2-3 gün içinde önemli ölçüde artar. - Gerekli uygulanabilirlik testine bağlı olarak Adım 4, 5 veya 6'ya geçin.
4. Yapışkan kültürde büyüyen hücreler
- Sertifikalı bir laminer akış başlığında, peleti serum içeren yapışkan ortamda (DMEM,% 10 fetal sığır serumu (FBS) ve% 1 penisilin / streptomisin (P / S) çözeltisi gibi) ve yapışkan bir hücre şişesindeki plaka hücrelerinde yeniden askıya alın.
- Hücreleri kontrollü bir inkübe ortamında tutun (37 °C,% 5 CO2).
5. Süspansiyon kültüründe büyüyen hücreler (nörosferler)
- Sertifikalı bir laminer akış başlığında, peleti serumsuz tam kök hücre ortamı11'de ve plakayı bir süspansiyon şişesinde yeniden askıya alın.
- Nörosfer oluşumuna izin vermek için hücrelerikontrollü bir inkübe ortamında (37 ° C, % 5 CO 2) 2-3 gün boyunca saklayın.
- Kültür ortamındaki nörosferlerin görselleştirilmesinden sonra, pasaj için tek hücreli süspansiyonlar elde etmek için Tripsin-EDTA veya Accutase kullanın ( Malzeme Tablosuna bakınız).
NOT: Hasat sırasında özel dikkat gösterildiği ve nöral kök hücreleri destekleyen uygun ortam kullanıldığı sürece, hasat edilen dokudaki kök hücreler birkaç gün içinde nörosferler oluşturmalıdır.
6. Hücrelerin reimplantasyon için hazırlanması
- Pelet, 4 μL 1x PBS başına 100.000 canlı hücre konsantrasyonunda yeniden askıya alın.
- İntrakraniyal tümör implantasyon yöntemini kullanarak hemen naif farelere enjekte edin (adım 1).
7. Histolojik analiz
- Rezeksiyonun hemen ardından, beyinleri 24 saat12 boyunca% 4 paraformaldehit (PFA) içinde çıkarın ve sabitleyin.
- Beyinleri, sakkaroz ile doyurulana kadar% 30'luk bir sakkaroz çözeltisine aktarın (kabın dibine batırılmış).
- Beyinleri% 70'lik bir etanol çözeltisine aktarın.
- Daha önce yayınlanan rapor13'ü takiben parafin blok gömme, kesitleme ve standart hematoksilin ve eozin (H & E) boyama işlemini gerçekleştirin.
NOT: Boyama için alınan her bölümün kalınlığı 10 μm idi.
Sonuçlar
MIRS kullanılarak yapılan cerrahi rezeksiyon, tümör yükünde önemli bir azalmaya neden olur.
Daha küçük tümör yükü olan grupta, rezeksiyon uygulanan alt grupta ortalama başlangıç biyolüminesan sinyali 5.5e + 006 foton / s ± 0.2e + 006 idi. Rezeksiyonu takiben, ortalama biyolüminesan sinyal 0.3e+006 ± 3.09e+006 foton/sn'ye düşmüştür (p <0.0001, Mann-Whitney testi)9 (Şekil 2). Biyolüminesan sinyal, fareler ötenazi yapılana kadar takip eden birkaç gün içinde arttı. Benzer şekilde, daha büyük bir tümör yüküne sahip grupta, rezeksiyon yapılan alt grupta ortalama başlangıç biyolüminesan sinyali 1.68e + 007 foton / s ± 0.1e + 007 idi. Rezeksiyonu takiben, ortalama biyolüminesan sinyal 0.2e+006 ± 5.19e+006 foton/sn'ye düşmüştür (p <0.0001, Mann-Whitney testi)9. Biyolüminesan sinyal, fareler ötenazi yapılana kadar takip eden birkaç gün içinde arttı.
MIRS kullanılarak rezeksiyon, istenen rezeksiyon hacmine göre ayarlanabilir
Sinjenik CT2A tümörlerinin rezeksiyon öncesi görüntülemesinde, tümör genellikle T2 ağırlıklı (T2w) hipo ve hiper yoğunluğun heterojen alanları ile gösterilen parankimal mimarisi bozulmuş parankimal mimarisi ve peritümöral ödem ve kanaması olan aşılama bölgesinde heterojen bir kitle olarak tanımlanabilir. Stereotaktik tümör hücresi enjeksiyonu için kullanılan iğne izi T2w MRI taramalarında tanımlanabilir14.
Rezeksiyon sonrası T2w MRG taramalarında rezeksiyon boşluğu, tümör aşılama bölgesinde geniş yuvarlak bir hipointens alan olarak tanımlanabilir (Şekil 3). Rezeksiyon prosedürü önemli miktarda kan kaybına veya çevredeki beyin mimarisinin bozulmasına neden olmadı. Bazı durumlarda, rezeksiyon boşluğunda sıvı birikmiştir. Şekil 4'te gösterildiği gibi, rezeksiyon hacmi, kesme açıklığının bir dönüşü için 9.4 mm 3'ten iki rotasyon için 23.2 mm3'e (p = 0.0117) önemli ölçüde artmış ve bilinen bir tümör yükü için optimize etmek üzere hacim rezeksiyonunun ayarlanmasına izin vermiştir.
MIRS kullanılarak tümör rezeksiyonu, tümör taşıyan farelerin medyan sağkalımında herhangi bir nörolojik bulguya neden olmadan 7 günlük bir uzamaya yol açar.
Şekil 5'te gösterildiği gibi, küçük (6 gün) ve büyük (7 gün) tümörleri olan her iki grupta da cerrahi rezeksiyon uygulanan farelerin sağkalımında bir uzama vardı. Daha küçük tümör yükü olan grupta kontrol alt grubunun medyan sağkalımı 16 gün iken, rezeksiyon yapılan alt grubun medyan sağkalımı 22 gün idi (p=0.0044). Benzer şekilde, tümör yükü daha büyük olan grupta, kontrol alt grubunun medyan sağkalımı 12 gün iken, rezeksiyon uygulanan alt grubun medyan sağkalımı 19 gün idi (p = 0.0043). Ek olarak, MIRS kullanılarak rezeksiyon yapılan farelerin hiçbiri, işlemden sonra herhangi bir nörolojik yaralanma belirtisi göstermedi. Bu, MIRS'nin güvenli rezeksiyon elde edebileceğini gösterir.
MIRS kullanılarak rezeke edilen doku in vitro ve in vivo canlılığı yüksektir.
Rezeke edilen dokudan ekstrakte edilen hücreler, in vitro veya in vivo canlılık deneyleri yapılmadan önce uygun ortamda (Şekil 6) filtrelenmiş, nicelleştirilmiş ve yeniden askıya alınmıştır. Hücrelerin in vitro canlılığını incelemek ve normal beyin parankimi değil tümörün rezeksiyonunu doğrulamak için, süspansiyon kültüründe hücreler yetiştirildi. Tümör başlatma potansiyelinin bir göstergesi olan nörosfer oluşumu, rezeksiyon sonrası minimal doku işleme ile meydana geldi. Bu, MIRS platformunun iyi ayrışmış dokuyu topladığını ve rezeke edilen dokunun sağlığı ve yaşayabilirliği üzerinde minimum etkiye sahip olduğunu ileri sürdü. Doğrudan TPS'den ışık mikroskobuna alınan örneklerin, birkaç küçük doku parçasının varlığı ile birlikte öncelikle tek hücreler şeklinde olduğu ortaya çıktı. 0. Gün canlılığı %30-%70 arasında değişmekteydi (bu, numuneyi 70 μm'lik bir filtreden geçirdikten sonra ve kaplamadan önce canlılığı temsil eder). Rezeksiyon cihazı, rezeksiyon probunun ekseni üzerinde 360 ° dönebilen ve eşmerkezli doku hacimlerinin rezeksiyonuna izin veren bir kesme açıklığına sahiptir. Ortalama olarak, kesme açıklığının bir 360 ° dönüşü ile 2-3 milyon hücre, iki tur ile yaklaşık 7 milyon hücre ve kesme açıklığının üç 360 ° dönüşü ile toplam 12-14 milyon hücre elde edilebilir. Serumsuz tam kök hücre ortamı içeren süspansiyon şişelerine kaplandıktan sonra, nörosferler 2. günde ışık mikroskobu ile ve 7. günde çıplak gözle görülebiliyordu (Şekil 7).
İn vivo canlılığı incelemek için, ekstrakte edilen hücreler intrakraniyal olarak naif C57BL / 6 farelere (n = 8 fare, 100.000 canlı hücre / fare) implante edildi. Tümör büyümesi in vivo görüntüleme sistemi kullanılarak doğrulandı. Tümör sinyali, tümör implantasyonu sonrası 14. günde tüm hayvanlar ötenazi yapılana kadar artmaya devam etti (medyan sağkalım 11 gün).
Temsili H&E doku bölümü (Şekil 3B), kan ürünleri (koyu pembe), inflamasyon ve artık tümör hücreleri (koyu mor hücreler) ile açık, dairesel bir rezeksiyon boşluğu içerir. Makroskopik olarak, rezidüel tümör hücreleri doğada mezenkimal ve infiltratiftir, yaygın perivasküler invazyon ve proliferasyon sergiler. Mikroskopik olarak belirgin nükleer atipiler ve mitotik rakamlar tespit edildi. Enfarktüs dokusu ve mikrohemoraji alanları etrafında tümörle ilişkili makrofajlar da tanımlandı. Çevredeki beyin parankimindeki doku mimarisi rahatsız görünmüyordu.

Şekil 1: MIRS sistem kurulumu. (A) Entegre doku koruma sistemine sahip kemirgen modellerinde beyin tümörü için minimal invaziv rezeksiyon sistemi (MIRS). (B) MIRS konsolunun ön paneli. 1 = Sistem Gücü, 2 = Ayak Pedalı, 3 = Prime Düğmesi, 4 = Aspirasyon, 5 = Aspirasyon Seviyesi Kontrol Kadranı, 6 = Aspirasyon Seviyesi Göstergesi, 7 = El Parçası, 8 = Kesici Etkinleştir Düğmesi. (C) MIRS konsolunun arka paneli. 1 = Güç Kablosu Prizi, 2 = Devre Kesici, 3 = Azot Besleme Girişi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Tedavi edilmemiş tümörleri olan farelerde ortalama tümör yükündeki değişiklikler, MIRS tarafından tümörlerin rezeksiyonu yapılan farelere karşı . (A) küçük bazal tümör yüküne sahip fareler ve (B) büyük taban çizgisi tümör yüküne sahip fareler (p < 0.0001, SD ≤0.3e + 006, her zaman noktasında tüm gruplarda ve grafikte görüntülenemeyecek kadar küçük). Hayvanlar ya tümör yüküne yenik düştü ya da ötenazi yapıldı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: MRG ve H&E analizi. (A) Rezeksiyon öncesi ve sonrası T2 ağırlıklı beyin MRG görüntüleri ve (B) kan ürünleri (koyu pembe), inflamasyon ve artık tümör hücrelerinin (koyu mor hücreler) bir kenarı ile net, dairesel bir rezeksiyon boşluğu gösteren temsili bir H & E boyalı koronal beyin bölümü. MRG görüntüleri ve H&E kesitleri rezeksiyondan hemen sonra elde edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: Tümör rezeksiyon hacminin belirlenmesi. Rezeksiyon boşluklarının MRG görüntülerinden hesaplanan ortalama hacimler, bire karşı bir ile oluşturuldu. kesme açıklığının iki dönüşü, grup başına n = 4. p = 0.01, iki kuyruklu T-testi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Tedavi edilmemiş tümörleri olan farelerin MIRS tarafından tümörlerin rezeksiyonu yapılan farelere karşı Kaplan-Meier eğrileri. (A) Küçük taban çizgisi tümör yüküne sahip fareler. (B) Büyük bazal tümör yüküne sahip fareler. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6: Rezeke edilen tümör hücrelerinin canlılık testi . (A) 0. günde 20x'te MIRS ile toplanan dokunun temsili ışık mikroskopisi görüntüleri. (B) Kaplan-Meier eğrisi, rezeke edilen dokudan toplanan hücrelerin intrakraniyal implantasyonundan sonra farelerin hayatta kalmasını tanımlar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
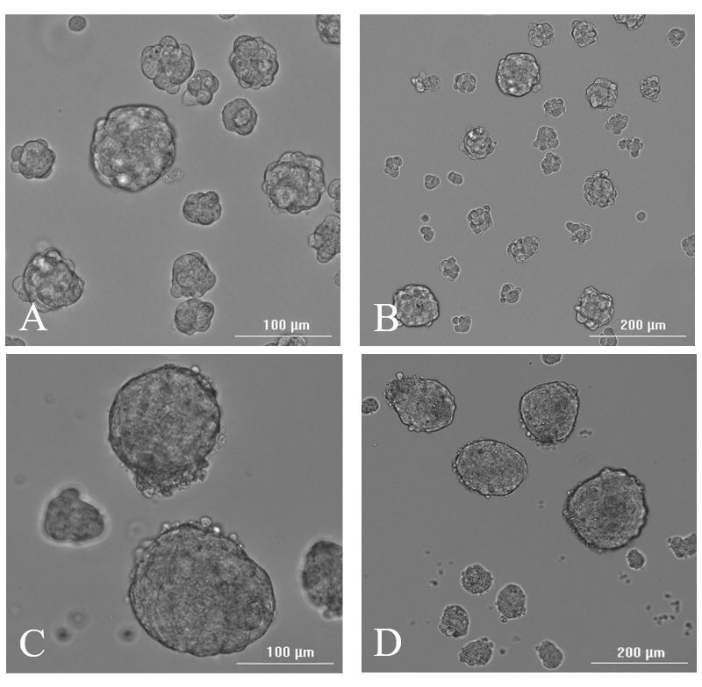
Şekil 7: Nörosferlerin oluşumu. Rezeksiyon sonrası 2. günde (A) 20x ve (B) 10x'te rezeksiyon sonrası nörosferlerin temsili ışık mikroskobu görüntüleri ve rezeksiyon sonrası 7. günde (C) 20x ve (D) 10x. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
| Minimal İnvaziv Rezeksiyon Sistemi | Tarihi Rezeksiyon | |||
| Ameliyat süresi ve becerileri | Minimum ameliyat süresi (her hayvan için <2 dakika). Minimum beceri gerekli. | Cerrahi zaman standartlaştırılmamıştır ve küçük hayvanlarda cerrahi deneyim ve mikrocerrahi faydalıdır. | ||
| Kan kaybı | En az | Öngörülemeyen | ||
| Standartlaştırılmış rezeksiyon hacmi | Rezeksiyon aracının dönüş sayısı ile belirlenen/ayarlanan rezeksiyon hacmi | Hacim, konular arasında büyük farklılıklar gösterir | ||
Tablo 1: Minimal invaziv rezeksiyon sistemi (MIRS) ile tarihsel cerrahi rezeksiyon modelleri arasındaki karşılaştırma.
Tartışmalar
Tümör rezeksiyonu, hem düşük dereceli hem de yüksek dereceli beyin tümörleri için nöroşirürji onkolojisi tedavi planlarının temel taşıdır. Tümörün sitoredüksiyonu ve debulkingi, beyin tümörlü hastalarda iyileşmiş nörolojik fonksiyon ve genel sağkalım ile ilişkilidir 1,2,5,6. Cerrahi rezeksiyon protokolleri daha önce kemirgen modellerinde tanımlanmış olmasına rağmen, bu protokoller üretilen sonuçları ve klinik öncesi modelin genel çevrilebilirliğini karıştırabilecek çeşitli sınırlamalardan muzdariptir. Örneğin, daha önce bildirilen cerrahi rezeksiyon protokolleri, bir kemik flebi oluşturmak için 3-4 küçük çapak delikli bir kraniyotomi ve daha sonra tümörün renklenmesinin ve kıvamının normal beyin dokusuna kıyasla ustaca ayırt edilmesini ve farklılaşmasını içermektedir6. Bu protokoller zaman alıcıdır ve araştırma personelinin cerrahi mikroskop kullanımı, cerrahi aletleri kullanma, çevredeki normal beyin dokusu ile ilgili tümör sınırlarını belirleme ve yeterli homeostaz elde etme konusunda ileri becerilere sahip olmasını gerektirir. Bu tür prosedürler genellikle önemli kan kaybına ve hayvan ölümüne yol açar. Ek olarak, aynı deneyde farklı hayvanlar arasında rezeke edilen karşılaştırılabilir hacimlerde tümör dokusu ile standartlaştırılmış rezeksiyon elde etmek zor olabilir. Bu süreklilik ve tekdüzelik, prosedürü gerçekleştiren birden fazla personel ile daha da zorlaşır.
Buna karşılık, burada açıklanan MIRS protokolü bu sınırlamaları ortadan kaldırır (Tablo 1). Mevcut protokol, ilk tümör implantasyonu için kullanılan aynı çapak deliğinden minimal invaziv bir yaklaşım gerektirir. Protokol bölümünde ayrıntılı olarak açıklandığı gibi, rezeksiyon aracı, kanülün tümör boşluğuna doğru şekilde yerleştirilmesini sağlayan stereotaktik bir çerçeveye monte edilebilir. Bıçağın hızı ve gerçekleştirilen rezeksiyon döngülerinin sayısı, önemli miktarda kan kaybına neden olmadan standart bir şekilde rezeke edilen tümörün hacmini kontrol etmek için araştırma personeli tarafından kullanılan bir el aleti aracılığıyla kolayca ayarlanabilir.
Sonuçlarda belirtildiği gibi, MIRS cihazı ile rezeksiyon yapılan fareler, rezeke edilmemiş tümörleri olan farelerin kohortuna kıyasla uzun süreli sağkalım göstermiştir. Bu, verilerle birlikte, rezeke edilen grupta tümör yükünün rezeke edilmemiş kontrol grubuna kıyasla önemli ölçüde azaldığını göstermektedir, bu da MIRS cihazının tümörü çevreleyen sağlıklı beyin dokularına minimum rahatsızlıkla etkili bir şekilde bulduğunu göstermektedir. Ayrıca, rezeksiyonu takip eden günlerde, tümör yükü, artık bir tümörün varlığı ve BT-2A tümör hücre hattının infiltratif doğası nedeniyle istikrarlı bir şekilde ilerlemiştir. MIRS modeli böylece, insan beyin tümörü tedavi protokollerindeki tedavi rejimini daha yakından yansıtmak için kemoterapötikler veya radyasyon tedavisi ile takip edilebilen infiltratif tümör tiplerinin debulking sürecini çoğaltabilir15,16,17.
Herhangi bir emme cihazında olduğu gibi, aspirasyon borusunun tıkanması MIRS sisteminin sınırlamalarından biri olabilir. Bu, makineyi kullanırken veya kullandıktan sonra kuru doku veya kan birikmesi nedeniyle oluşabilir. Bunu önlemek için, her rezeksiyon seansının hemen sonunda, rezeke edilen tüm dokuyu toplama kabına "itmek" için hava ile dönüşümlü soğutulmuş medya ile yıkanarak el parçası kanülünün temizlenmesi ve ardından% 3H2O2 ile yıkanması önerilir. Bu, rezeksiyon sırasında elde edilen tüm dokuları yakalayacak ve kanülde veya tüpte hiçbirinin kalmamasını sağlayacaktır. Ayrıca, sistem aspirasyon yapmıyorsa/kesmiyorsa, bunun nedeni el parçasının takılı olmaması, rezeksiyon kanül kesicisinin açılmaması, konsoldan aspirasyon hattının teneke kutuya bağlı olmaması, teneke kutu kapağının sıkı olmaması veya ayak pedalının takılı olmaması olabilir.
Ek olarak, MIRS'nin rezeke edilen dokunun in vitro ve in vivo canlılığı yüksek olan etkili ve standartlaştırılmış rezeksiyon için kullanılabileceğini göstermiş olsak da, gelecekteki çalışmaların beyin tümörü araştırmalarında bu tür sistemlerin uygulanmasının diğer yönlerini daha fazla araştırması teşvik edilmektedir. Bunlar, rezeksiyon işleminin tümör kütlesinin moleküler ve hücresel bileşenleri ve tümör mikroçevresi üzerindeki etkisinin incelenmesini içerir. Ek olarak, MIRS cihazı kullanılarak rezeke edilen dokunun ebeveyn tümörünü özetlediğini doğrulamak için çalışmalara ihtiyaç vardır15.
Sonuç olarak, entegre ve otomatik bir doku koruma sistemi ile birleştirilen bir kemirgen beyin tümörü modelinde standartlaştırılmış cerrahi rezeksiyon için minimal invaziv bir yaklaşımın bir protokolü tanımlanmıştır. Bu protokol, yüksek oranda translasyonel ve preklinik öncesi beyin tümörü araştırma modellerinin oluşturulmasına giden yolu açmaktadır. Bu protokolün gelecekteki uygulamaları, beyin tümörleri için farklı terapötik veya tanısal modaliteleri araştıran ve bu protokolü standartlaştırılmış bir rezeksiyon elde etmek için uygulayabilecek preklinik çalışmaları potansiyel olarak içerebilir.
Açıklamalar
BT, NIH'den araştırma fonuna sahiptir ve Hızlandırıcı Kombinasyon Terapileri* için ortak bir ortaktır ve Ashvattha Therapeutics Inc. patentlerinden birini lisanslamıştır. GW, NIH finansmanına sahiptir (R01NS107813). HB, Insightec'e ücretli bir danışman ve şirketin Tıbbi Danışma Kurulu başkanıdır. Bu düzenleme, Johns Hopkins Üniversitesi tarafından çıkar çatışması politikalarını izleyerek gözden geçirilmiş ve onaylanmıştır. HB, NIH, Johns Hopkins Üniversitesi ve hayırseverlikten araştırma fonuna sahiptir ve CraniUS, Candel Therepeutics, Inc., Accelerating Combination Therapies*, Catalio Nexus Fund II, LLC*, LikeMinds, Inc*, Galen Robotics, Inc.* ve Nurami Medical* için danışmanlık yapmaktadır. (*özkaynak veya opsiyonları içerir).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | BD | 309628 | |
| 15 mL conical tubes | Corning | 430052 | |
| 200 proof ethanol | PharmCo | 111000200 | |
| 5 mL pipettes | CoStar | 4487 | |
| 70 micron filter | Fisher | 08-771-2 | |
| Accutase | Millipore Sigma | SIG-SCR005 | |
| Anased (Xylazine injection, 100 mg/mL) | Covetrus | 33198 | |
| Anesthesia System | Patterson Scientific | 78935903 | |
| Anesthesic Gas Waste Container | Patterson Scientific | 78909457 | |
| Bench protector underpad | Covidien | 10328 | |
| C57Bl/6, 6-8 week old mice | Charles River Laboratories | Strain Code 027 | |
| ChroMini Pro | Moser | Type 1591-Q | |
| Collagenase-Dispase | Roche | #10269638001 | |
| Countess II Automated Cell Counter | Thermo Fisher | ||
| Countess II FL Hemacytometer | Thermo Fisher | A25750 | |
| Debris Removal Solution | Miltenyi Biotech | #130-109-398 | |
| D-Luciferin | Goldbio | LUCK-1G | |
| DMEM F12 media | Corning | 10-090-CV | |
| DMEM media | Corning | 10-013-CV | |
| DNAse I | Sigma Aldrich | #10104159001 | |
| Eppendorf tubes | Posi-Click | 1149K01 | |
| Euthanasia solution | Henry Schein | 71073 | |
| FBS | Millipore Sigma | F4135 | |
| Fetal Bovine Serum | Thermo Fisher | 10437-028 | |
| Formalin | Invitrogen | INV-28906 | |
| Gauze | Henry Schein | 101-4336 | |
| hEGF | PeproTech EC | 100-15 | |
| Heparin | Sigma | H-3149 | |
| hFGF-b | PeproTech EC | 1001-18B | |
| Induction Chamber | Patterson Scientific | 78933388 | |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Isoflurane Vaporizer | Patterson Scientific | 78916954 | |
| Ketamine | Covetrus | 11695-0703-1 | |
| Kopf Stereotactic frame | Kopf Instruments | 5001 | |
| Lightfield Microscope | BioTek | Cytation 5 | |
| Microinjection Unit | Kopf | 5001 | |
| Micromotor drill | Foredom | F210418 | |
| MRI system | Bruker | 7T Biospec Avance III MRI Scanner | |
| NICO Myriad System | NICO Corporation | ||
| Ophthalmic ointment | Puralube vet ointment | ||
| Papain | Sigma Aldrich | #P4762 | |
| PBS | Invitrogen | #14190250 | |
| PenStrep | Millipore Sigma | N1638 | |
| Percoll solution | Sigma Aldrich | #P4937 | |
| Pipette controller | Falcon | A07260 | |
| Povidone-iodine solution | Aplicare | 52380-1905-08 | |
| Progesterone | Sigma | P-8783 | |
| Putrescine | Sigma | P-5780 | |
| RPMI Media | Invitrogen | INV-72400120 | |
| Scalpel blade | Covetrus | 7319 | |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Skin marker | Time Out | D538,851 | |
| Staple remover | MikRon | ACR9MM | |
| Stapler | MikRon | ACA9MM | |
| Staples | Clay Adams | 427631 | |
| Stereotactic Frame | Kopf Instruments | 5000 | |
| Sucrose | Sigma Aldrich | S9378 | |
| Suture, vicryl 4-0 | Ethicon | J494H | |
| T-75 culture flask | Sarstedt | 83-3911-002 | |
| TheraPEAKTM ACK Lysing Buffer (1x) | Lonza | BP10-548E | |
| Trypsin-EDTA | Corning | MDT-25-053-CI |
Referanslar
- Mineo, J. F., et al. Prognosis factors of survival time in patients with glioblastoma multiforme: a multivariate analysis of 340 patients. Acta Neurochirurgica. 149 (3), 245-252 (2007).
- Miyai, M., et al. Current trends in mouse models of glioblastoma. Journal of Neuro-Oncology. 135 (3), 423-432 (2017).
- Raj, D., Agrawal, P., Gaitsch, H., Wicks, E., Tyler, B. Pharmacological strategies for improving the prognosis of glioblastoma. Expert Opinion on Pharmacotherapy. 22 (15), 2019-2031 (2021).
- Alomari, S., et al. Drug repurposing for Glioblastoma and current advances in drug delivery-a comprehensive review of the literature. Biomolecules. 11 (12), 1870(2021).
- Serra, R., et al. Combined intracranial Acriflavine, temozolomide and radiation extends survival in a rat glioma model. European Journal of Pharmaceutics and Biopharmaceutics : Official Journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik eV. 170, 179-186 (2022).
- Tang, B., Foss, K., Lichtor, T., Phillips, H., Roy, E. Resection of orthotopic murine brain glioma. Neuroimmunology and Neuroinflammation. 8 (1), 64-69 (2021).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of Visualized Experiments. (41), e1986(2010).
- Poussard, A., et al. In vivo imaging systems (IVIS) detection of a neuro-invasive encephalitic virus. Journal of Visualized Experiments. (70), e4429(2012).
- Lachin, J. M. Nonparametric statistical analysis. JAMA. 323 (20), 2080-2081 (2020).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods in Molecular Biology. 740, 7-12 (2011).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Flow cytometry-based drug screening system for the identification of small molecules that promote cellular differentiation of Glioblastoma stem cells. Journal of Visualized Experiments. (131), e56176(2018).
- Rodgers, G., et al. Virtual histology of an entire mouse brain from formalin fixation to paraffin embedding. Part 2: Volumetric strain fields and local contrast changes. Journal of Neuroscience Methods. 365, 109385(2022).
- Connolly, N. P., et al. Elevated fibroblast growth factor-inducible 14 expression transforms proneural-like gliomas into more aggressive and lethal brain cancer. GLIA. 69 (9), 2199-2214 (2021).
- Stall, B., et al. Comparison of T2 and FLAIR imaging for target delineation in high grade gliomas. Radiation Oncology. 5, 5(2010).
- Das, A., et al. Establishing a standardized method for the effective intraoperative collection and biological preservation of brain tumor tissue samples using a novel tissue preservation system: a pilot study. World Neurosurgery. , (2022).
- Zusman, E., et al. Tissues harvested using an automated surgical approach confirm molecular heterogeneity of Glioblastoma and enhance specimen's translational research value. Frontiers in Oncology. 9, (2019).
- McLaughlin, N., et al. Side-cutting aspiration device for endoscopic and microscopic tumor removal. Journal of Neurological Surgery Part B. 73 (1), 11-20 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır