Method Article
تنفيذ استئصال ورم الدماغ بأقل قدر من التدخل الجراحي في القوارض لجمع الأنسجة عالية الجدوى
In This Article
Summary
يصف البروتوكول الحالي استئصالا موحدا لأورام الدماغ في القوارض من خلال نهج طفيف التوغل مع نظام متكامل للحفاظ على الأنسجة. هذه التقنية لها آثار على عكس مستوى الرعاية بدقة في القوارض والنماذج الحيوانية الأخرى.
Abstract
يصف هذا البروتوكول نموذجا موحدا لاستئصال أورام دماغ القوارض والحفاظ على الأنسجة. في الممارسة السريرية ، يعد استئصال الورم الأقصى هو العلاج القياسي للرعاية لمعظم أورام الدماغ. ومع ذلك ، فإن معظم نماذج أورام الدماغ قبل السريرية المتاحة حاليا إما لا تشمل الاستئصال ، أو تستخدم نماذج الاستئصال الجراحي التي تستغرق وقتا طويلا وتؤدي إلى اعتلال كبير بعد العملية الجراحية أو الوفيات أو التباين التجريبي. بالإضافة إلى ذلك ، يمكن أن يكون إجراء الاستئصال في القوارض أمرا شاقا لعدة أسباب ، بما في ذلك عدم وجود أدوات أو بروتوكولات جراحية قابلة للمقارنة سريريا وعدم وجود منصة راسخة لجمع الأنسجة الموحدة. يسلط هذا البروتوكول الضوء على استخدام جهاز استئصال متعدد الوظائف وغير استئصالي ونظام متكامل للحفاظ على الأنسجة مقتبس من النسخة السريرية من الجهاز. يجمع الجهاز المطبق في هذه الدراسة بين الشفط القابل للضبط وشفرة أسطوانية عند الفتحة لفحص الأنسجة وقطعها وشفطها بدقة. يؤدي جهاز الاستئصال الأقل بضعا وظائفه عبر نفس ثقب اللدغ المستخدم في زرع الورم الأولي. يقلل هذا النهج من التغييرات في التشريح الإقليمي أثناء خزعة أو جراحات الاستئصال ويقلل من خطر فقدان الدم بشكل كبير. هذه العوامل خفضت بشكل كبير من وقت العملية (<2 دقيقة /) ، وتحسين بقاء الحيوان بعد العملية الجراحية ، وانخفاض التباين في المجموعات التجريبية ، وتؤدي إلى قابلية عالية للأنسجة والخلايا المقطوعة للتحليلات المستقبلية. يتم تسهيل هذه العملية من خلال سرعة شفرة تبلغ ~ 1400 دورة / دقيقة ، مما يسمح بحصاد الأنسجة في نظام مغلق معقم يمكن ملؤه بمحلول فسيولوجي من اختيارك. ونظرا للأهمية الناشئة لدراسة ونمذجة تأثير الجراحة بدقة، والحفاظ على عينات استئصال الورم الإقليمية وتحليلها المقارن الدقيق، والعلاجات التي يتم تسليمها داخل التجويف، فإن هذا البروتوكول الفريد من نوعه سيوسع الفرص لاستكشاف الأسئلة التي لم تتم الإجابة عليها حول الإدارة المحيطة بالجراحة والاكتشاف العلاجي لمرضى أورام الدماغ.
Introduction
الورم الأرومي الدبقي (GBM) هو ورم الدماغ الأولي الأكثر شيوعا وعدوانية لدى البالغين. على الرغم من التطورات الحديثة في جراحة المخ والأعصاب ، وتطوير الأدوية المستهدفة ، والعلاج الإشعاعي ، فإن معدل البقاء على قيد الحياة لمدة 5 سنوات لمرضى GBM أقل من 5٪ ، وهي إحصائية لم تتحسن بشكل كبير منذ أكثر من ثلاثة عقود1. وبالتالي ، هناك حاجة إلى استراتيجيات علاج أكثر فعالية.
لتطوير علاجات جديدة ، أصبح من الواضح بشكل متزايد أن البروتوكولات الاستقصائية تحتاج إلى (1) استخدام نماذج ما قبل السريرية القابلة للترجمة التي تلخص بدقة عدم تجانس الورم والبيئة الدقيقة ، (2) تعكس النظام العلاجي القياسي المستخدم في المرضى الذين يعانون من GBM ، والذي يشمل حاليا الجراحة والعلاج الإشعاعي والعلاج الكيميائي ، و (3) حساب الفرق بين النواة المقطوعة والمتبقية ، أنسجة الورم الغازية2،3،4،5. ومع ذلك ، فإن معظم نماذج أورام الدماغ قبل السريرية المتاحة حاليا إما لا تنفذ الاستئصال الجراحي أو تستخدم نماذج الاستئصال الجراحي التي تستغرق وقتا طويلا نسبيا ، مما يؤدي إلى كمية كبيرة من فقدان الدم أو تفتقر إلى التوحيد. علاوة على ذلك ، يمكن أن يكون إجراء استئصال أورام دماغ القوارض أمرا صعبا بسبب عدم وجود أدوات أو بروتوكولات جراحية قابلة للمقارنة سريريا وعدم وجود منصة6 ثابتة لجمع الأنسجة بشكل منهجي (الجدول 1).
يهدف هذا البروتوكول إلى وصف نموذج موحد لاستئصال أورام دماغ القوارض والحفاظ على الأنسجة باستخدام نظام استئصال طفيف التوغل غير استئصالي متعدد الوظائف (MIRS) ونظام متكامل للحفاظ على الأنسجة (TPS) (الشكل 1). ومن المتوقع أن توفر هذه التقنية الفريدة منصة موحدة يمكن استخدامها في دراسات مختلفة في البحوث قبل السريرية ل GBM وأنواع أخرى من نماذج أورام الدماغ. يمكن للباحثين الذين يحققون في الطرائق العلاجية أو التشخيصية لأورام الدماغ تنفيذ هذا البروتوكول لتحقيق استئصال موحد في دراساتهم.
Protocol
تمت الموافقة على جميع الدراسات التي أجريت على الحيوانات من قبل جامعة ميريلاند ولجنة جامعة جونز هوبكنز المؤسسية لرعاية الحيوانات واستخدامها. تم استخدام C57BL/6 إناث الفئران، 6-8 أسابيع من العمر، لهذه الدراسة. تم الحصول على الفئران من مصادر تجارية (انظر جدول المواد). تم اتباع جميع لوائح السلامة الأحيائية من المستوى 2 (BSL-2) ، بما في ذلك استخدام الأقنعة والقفازات والعباءات.
1. زرع الورم الأولي داخل الجمجمة
- في المرحلة الأولية من الدراسة ، حقن كل فأر داخل الجمجمة مع 100000 خلية (خط خلايا الورم الدبقي الفئران GL261) معلقة في 4 ميكرولتر من المالحة العازلة بالفوسفات (1x PBS) على عمق 2.5 مم بعد التقريرالمنشور سابقا 7.
- تحديد كمية إشارة الورم في كل فأر باستخدام نظام التصوير في الجسم الحي 8 9 أيام بعد زرع الورم.
ملاحظة: إذا لزم الأمر، قم بتقسيم الفئران إلى مجموعتين بناء على عبء الورم. في هذه الدراسة ، كانت المجموعتان: (1) الفئران ذات عبء الورم الصغير نسبيا (متوسط إشارة اللمعان الحيوي = 5.5e + 006 ± 0.1e + 006 فوتونات / فوتونات ، n = 10) و (2) الفئران ذات عبء الورم الكبير نسبيا (متوسط إشارة الإنارة الحيوية = 1.69e + 007 ± 0.2e + 007 فوتونات / فوتونات ، n = 10) ، (p < 0.05 ، اختبار مان ويتنى)9. - قسم كل مجموعة إلى مجموعتين فرعيتين متشابهتين.
ملاحظة: في هذه الدراسة ، كانت المجموعتان الفرعيتان: الفئران غير المعالجة (n = 5) والفئران التي لديها أورام تخضع للاستئصال الجراحي باستخدام MIRS (n = 5) ، (p > 0.05 ، اختبار Mann-Whitney)9. - بدءا من يوم الاستئصال ، تتبع تطور الورم باستخدام نظام التصوير في الجسم الحي بتردد يعتمد على نمط نمو الورم.
ملاحظة: بالنسبة لخط الخلايا GL261 ، تتبع تطور الورم في يوم الاستئصال ثم كل 3-6 أيام.
2. استئصال الورم باستخدام MIRS
- تخدير الفأر باستخدام خليط غاز isoflurane-O2 في غرفة الحث أو الحقن داخل الصفاق من محلول الزيلازين / الكيتامين.
- في حالة استخدام مخدر الغاز، اضبط معدل تدفق الغاز على 1.0 ملليلتر/دقيقة والمبخر على 2.0٪ لتحريض التخدير، وعادة ما يتطلب 3-5 دقائق في الغرفة (انظر جدول المواد).
- في حالة استخدام المخدر القابل للحقن ، قم بتخدير الفئران عن طريق حقن 0.2 مل من محلول مخدر (80-100 مجم / كجم من الكيتامين و 10-12.5 مجم / كجم من الزيلازين ، انظر جدول المواد) داخل الصفاق.
- تقييم الحيوان للتخدير الكافي عن طريق معسر إصبع القدم. ضع مرهم العيون على العينين لتجنب جفاف القرنية. إعطاء مسكن (0.03-0.06 مغ/كغ من البوبرينورفين تحت الجلد) قبل الإجراء.
- ضع الماوس على الإطار التجسيمي (انظر جدول المواد) بمجرد تأكيد التخدير الكامل.
ملاحظة: في حالة استخدام مخدر الغاز، ضع أنف الفأر في مخروط الأنف حيث سيستمر في تلقي خليط الأيزوفلوران-O2 أثناء الإجراء (1.5٪). - قم بإزالة الدبابيس السابقة ، ثم قم بإزالة الشعر إما باستخدام كريم مزيل للشعر أو عن طريق الحلاقة. قم بتطهير الجلد بدورات متناوبة من مقشر والكحول القائم على الكلورهيكسيدين / البيتادين. ثم، باستخدام مشرط معقم، قم بإنشاء شق طولي في خط الوسط طوله 1 سم على طول الندبة الجراحية السابقة.
- قم بتوصيل قبضة MIRS بالذراع التجسيمي من خلال محول المرحلة / حامل القبضة لتعزيز الاستقرار والدقة.
- قم بإعداد جهاز MIRS (انظر جدول المواد) باستخدام الإعدادات التالية (الشكل 1).
- أدخل سلك الطاقة المثبت على اللوحة الخلفية في وعاء سلك الطاقة. قم بتشغيل الطاقة إلى النظام أو إيقاف تشغيله عن طريق التبديل (1 = ON، 0 = OFF).
- أدخل أحد طرفي خرطوم النيتروجين (المرفق مع وحدة التحكم) في التركيب الذكري على اللوحة الخلفية لوحدة التحكم. قم بتدوير صمولة الاتصال في اتجاه عقارب الساعة لتشديد الاتصال.
ملاحظة: يجب توصيل الطرف الآخر من الخرطوم بإمدادات النيتروجين. - قبل توصيل الخرطوم بمصدر النيتروجين ، تأكد من أن ضغط الإمداد لا يتجاوز 100 رطل لكل بوصة مربعة ، وهو ضغط إمداد الإدخال الموصى به لوحدة التحكم.
ملاحظة: ستقوم وحدة التحكم بإنشاء طموحها الخاص عند تنشيطها بواسطة دواسة القدم بمجرد تزويد النيتروجين بوحدة التحكم. - قم بتأمين غطاء منفذ التفريغ وختمه لتجنب أي تسرب في نظام التفريغ. ستؤثر أي تسريبات في نظام الشفط على أداء وحدة تحكم MIRS.
- إذا كان الطموح أقل من 17 أثناء الإعداد أو التحضير، فتحقق من ضبط مقبض الشفط الموجود في الجزء الأمامي من وحدة التحكم على المستوى الأقصى (100)، وتأكد من عدم وجود تسرب في نظام الشفط، وتأكد من صحة ضغط إمداد مدخلات النيتروجين.
- لتوصيل دواسة القدم بوحدة التحكم، أدخل موصل دواسة القدم الرمادي في الوعاء الرمادي الخاص به حتى ينقر ويتناسب مع موضعه.
ملاحظة: يتصل موصل دواسة القدم بوحدة التحكم في اتجاه واحد، ويتم إدخاله بمفتاح. - لتوصيل القبضة بوحدة التحكم، أدخل موصل القبضة الزرقاء في الوعاء الأزرق الخاص بها حتى ينقر ويتناسب مع موضعه.
ملاحظة: يتصل موصل القبضة بوحدة التحكم في اتجاه واحد، ويتم إدخاله. - قم بتعبئة كل قبضة قبل استخدام النظام عن طريق شفط السائل المعقم من وعاء صغير إلى الفتحة ، من خلال الأنابيب والقبضة ، ثم إلى العلبة لضمان تشحيم الجزء الداخلي من الأنابيب والقبضة لتقليل انسداد الأنسجة.
- استعد للطموح وحده أو الطموح مع القطع عن طريق تحديد الوضع المناسب على اللوحة الأمامية لوحدة التحكم. ابدأ باستخدام دواسة القدم.
- أدخل قنية MIRS 23 G في فتحة النتوء على عمق 2.5 مم.
- ابدأ عملية الاستئصال عن طريق تثبيط دواسة القدم المتصلة بالقنية. قم بإجراء دورة كاملة واحدة (360 درجة) أو أكثر من الاستئصال باستخدام مقبض التحكم الموجود في القبضة.
ملاحظة: كلما زاد عدد الدورات التي تم إجراؤها ، زاد حجم أنسجة الورم التي تم استئصالها. - بمجرد اكتمال عملية الاستئصال ، اسحب قنية MIRS 23 G من ثقب النتوء واستخدم 5 مل من 1x PBS لطرد الأنابيب وإزاحة أي حطام متبقي.
- قم بإزالة الماوس من الإطار التجسيمي وأغلق الجرح بدباسة أو مادة خياطة 4-0 (انظر جدول المواد).
- ضع الماوس على وسادة تدفئة أو تحت ضوء الاحترار أثناء التعافي من التخدير قبل إعادته إلى قفصه.
- بعد اكتمال التجربة ، قم بتطهير القنية عن طريق التنظيف. قم بالتناوب مع الوسائط المبردة والهواء "لدفع" جميع الأنسجة المقطوعة مرة أخرى إلى علبة التجميع. قم بإزالة علبة التجميع من النظام وقم بإيقاف الغطاء بالغطاء المقدم.
- بعد الانتهاء من الخطوة 2.12 ، ضع الطرف البعيد للقنية في 3٪ H 2 O2وتطبيق الشفط عند 24-25 في Hg لملء خط الشفط مرة أخرى إلى علبة جمع الشفط واتركه يقف لمدة 60-90 ثانية. اغسل بالهواء النابض المعقم للوسائط والوسائط بشكل متقطع.
- راقب الفئران بحثا عن أي علامات عصبية (حركات أو نوبات غير منتظمة غير طبيعية) بعد الإجراء.
- القتل الرحيم للفئران التي تعاني من إعاقات عصبية شديدة (تصبح خاملة ، أو لها مظهر هزيل ، أو منحنية الظهر ، أو لديها حركات غير منتظمة).
ملاحظة: بالنسبة لهذه الدراسة، استخدم 200 مغ/كغ من محلول القتل الرحيم المتاح تجاريا (انظر جدول المواد) للقتل الرحيم لكل فأر.
3. جمع الأنسجة عبر TPS
- اغمر عينة الورم في طبق زراعة الأنسجة الذي يحتوي على وسط تحلل RBC (انظر جدول المواد) لمدة 5 دقائق في درجة حرارة الغرفة.
ملاحظة: الأنسجة التي يتم حصادها من MIRS إلى TPS ستكون في المقام الأول في شكل خلايا مفردة جنبا إلى جنب مع قطع صغيرة من الأنسجة. - ضع مرشحا بسعة 70 ميكرومتر (انظر جدول المواد) على أنبوب مخروطي سعة 50 مل واستخدم مكبس حقنة سعة 5 مل لتمرير عينة الورم عبر الفلتر.
- باستخدام ماصة النقل ، استخدم وسائط RPMI-1640 لتسهيل مرور الخلايا وأي كتلة أنسجة عبر الفلتر.
- جهاز طرد مركزي عند 428 × جم لمدة 5 دقائق عند 4 درجات مئوية. تخلص من السوبرناتانت بواسطة ماصة.
- أعد تعليق كل عينة في 5 مل من وسط RPMI-1640 المحضر.
- لزيادة صلاحية الأنسجة ، خاصة إذا تم تصور قطع الأنسجة الكبيرة عند الانطباع الأولي ، أضف الكميات المطلوبة من كوكتيل الإنزيم (الذي يحتوي على الحمض النووي الأول ، والكولاجيناز الرابع ، و dispase ، و Papain ، و EDTA ، انظر جدول المواد) إلى كل عينة. استخدم الدوامة لخلط الحلول.
ملاحظة: الخطوة 3.6 اختيارية. تكوين كوكتيل الإنزيم (لحجم إجمالي قدره 5 مل / عينة): 300 ميكرولتر من الحمض النووي الأول من الدرجة الثانية ، و 150 ميكرولتر من الكولاجيناز / ديسباز (يشق الفيبرونيكتين ، والكولاجيناز الرابع ، الأول ، والأحماض الأمينية غير القطبية) ، و 250 ميكرولتر من الغراء (البروتياز غير المحدد) ، و 6 ميكرولتر من 0.5 م EDTA. - ضع العينات في حاضنة اهتزاز عند 200 دورة في الدقيقة ، 37 درجة مئوية لمدة 20 دقيقة.
- بعد 20 دقيقة ، قم بتدوير العينات عند 428 × g لمدة 5 دقائق عند 4 درجات مئوية. تخلص من السوبرناتانت.
- قم بتصفية الخلايا المفردة من خلال مصفاة خلية 70 ميكرومتر وقم بالدوران لأسفل عند 274 × g لمدة 3 دقائق عند 4 درجات مئوية. قم بإجراء تحليل جدوى الخلية10 باستخدام Trypan Blue ومقياس الدم (انظر جدول المواد).
ملاحظة: تتراوح صلاحية اليوم 0 من 30٪ إلى 70٪ وتزداد بشكل كبير في غضون 2-3 أيام. - انتقل إلى الخطوات 4 أو 5 أو 6، بناء على اختبار الجدوى المطلوب.
4. نمو الخلايا في ثقافة الالتصاق
- في غطاء التدفق الرقائقي المعتمد، أعد تعليق الكريات في وسط ملتصق يحتوي على مصل (مثل DMEM، ومصل بقري جنيني بنسبة 10٪ (FBS)، ومحلول البنسلين/الستربتومايسين (P/S) بنسبة 1٪) وخلايا الصفيحة في قارورة خلية ملتصقة.
- الحفاظ على الخلايا في بيئة محتضنة خاضعة للرقابة (37 درجة مئوية ، 5٪ CO2).
5. الخلايا النامية في ثقافة التعليق (الغلاف العصبي)
- في غطاء التدفق الرقائقي المعتمد، أعد تعليق الكريات في وسط الخلايا الجذعية الكاملة الخالية من المصل11 والصفيحة في قارورة تعليق.
- الحفاظ على الخلايا في بيئة محتضنة خاضعة للرقابة (37 درجة مئوية ، 5٪ CO 2) لمدة2-3 أيام للسماح بتكوين الغلاف العصبي.
- بعد تصور الغلاف العصبي في وسط الزرع، استخدم التربسين-EDTA أو Accutase (انظر جدول المواد) للحصول على معلقات أحادية الخلية للمرور.
ملاحظة: طالما يتم توخي الحذر بشكل خاص أثناء الحصاد ويتم استخدام الوسائط المناسبة التي تدعم الخلايا الجذعية العصبية ، يجب أن تشكل الخلايا الجذعية في الأنسجة التي تم حصادها أغلفة عصبية في غضون أيام قليلة.
6. إعداد الخلايا لإعادة زرعها
- أعد تعليق الكريات بتركيز 100000 خلية حية لكل 4 ميكرولتر من 1x PBS.
- حقن على الفور في الفئران الساذجة باستخدام طريقة زرع الورم داخل الجمجمة (الخطوة 1).
7. التحليل النسيجي
- مباشرة بعد الاستئصال ، استخراج وإصلاح الأدمغة في 4 ٪ بارافورمالديهايد (PFA) لمدة 24 ساعة12.
- انقل الأدمغة إلى محلول السكروز بنسبة 30٪ حتى يتم تشبعها بالسكروز (الغارقة حتى أسفل الحاوية).
- نقل الأدمغة إلى محلول الإيثانول بنسبة 70٪.
- قم بإجراء تضمين كتلة البارافين وتقسيمها وتلطيخ الهيماتوكسيلين والإيوسين القياسي (H & E) بعد التقرير المنشور سابقا13.
ملاحظة: سمك كل قسم مأخوذ للتلطيخ كان 10 ميكرومتر.
النتائج
الاستئصال الجراحي باستخدام MIRS يؤدي إلى انخفاض كبير في عبء الورم
في المجموعة ذات عبء الورم الأصغر ، كان متوسط إشارة خط الأساس الحيوي 5.5e + 006 فوتونات / ثانية ± 0.2e + 006 في المجموعة الفرعية التي خضعت للاستئصال. بعد الاستئصال، انخفض متوسط إشارة الإنارة الحيوية إلى 3.09e+006 فوتونات/ثانية ± 0.3e+006، (p <0.0001، اختبار مان-ويتني)9 (الشكل 2). زادت إشارة الإنارة الحيوية في الأيام القليلة التالية حتى تم قتل الفئران الرحيم. وبالمثل ، في المجموعة التي لديها عبء ورم أكبر ، كان متوسط إشارة خط الأساس الحيوي 1.68e + 007 فوتونات / ثانية ± 0.1e + 007 في المجموعة الفرعية التي خضعت للاستئصال. بعد الاستئصال، انخفض متوسط إشارة الإنارة الحيوية إلى 5.19e+006 فوتونات/ثانية ± 0.2e+006، (p <0.0001، اختبار مان-ويتني)9. زادت إشارة الإنارة الحيوية في الأيام القليلة التالية حتى تم قتل الفئران الرحيم.
يمكن ضبط الاستئصال باستخدام MIRS للحجم المطلوب من الاستئصال
في التصوير قبل الاستئصال للأورام المتجانسة CT2A ، يمكن تحديد الورم بشكل عام على أنه كتلة غير متجانسة في موقع التطعيم مع بنية متني مضطربة ووذمة حول الفخذ ونزيف تشير إليه المناطق غير المتجانسة من T2-weighted (T2w) ناقصة الكثافة ومفرطة الكثافة. يمكن تحديد مسار الإبرة المستخدم في حقن الخلايا السرطانية التجسيمية في فحوصات التصوير بالرنين المغناطيسي T2w14.
يمكن تحديد تجويف الاستئصال في فحوصات التصوير بالرنين المغناطيسي T2w بعد الاستئصال كمنطقة كبيرة مستديرة منخفضة الكثافة في موقع تلقيح الورم (الشكل 3). لم يتسبب إجراء الاستئصال في فقدان كبير للدم أو اضطراب في بنية الدماغ المحيطة. في بعض الحالات ، تراكم السوائل في تجويف الاستئصال. وكما هو مبين في الشكل 4، زاد حجم الاستئصال زيادة كبيرة من 9.4 مم 3 لدورة واحدة لفتحة القطع إلى 23.2 مم3 لدورتين (p = 0.0117)، مما يسمح بتعديل استئصال الحجم لتحسين عبء الورم المعروف.
استئصال الورم باستخدام MIRS يؤدي إلى إطالة لمدة 7 أيام في متوسط بقاء الفئران الحاملة للورم دون التسبب في أي علامات عصبية
كما هو موضح في الشكل 5 ، كان هناك إطالة في بقاء الفئران التي خضعت للاستئصال الجراحي في كلتا المجموعتين مع أورام صغيرة (6 أيام) وكبيرة (7 أيام). في المجموعة ذات عبء الورم الأصغر ، كان متوسط بقاء المجموعة الفرعية الضابطة 16 يوما ، في حين كان متوسط بقاء المجموعة الفرعية التي خضعت للاستئصال 22 يوما (p = 0.0044). وبالمثل ، في المجموعة التي لديها عبء ورم أكبر ، كان متوسط بقاء المجموعة الفرعية الضابطة 12 يوما ، في حين كان متوسط بقاء المجموعة الفرعية التي خضعت للاستئصال 19 يوما (p = 0.0043). بالإضافة إلى ذلك ، لم تظهر أي من الفئران التي تخضع للاستئصال باستخدام MIRS أي علامة على الإصابة العصبية بعد العملية. هذا يشير إلى أن MIRS يمكن أن يحقق الاستئصال الآمن.
الأنسجة المستأردة باستخدام MIRS لديها قدرة عالية في المختبر وفي الجسم الحي
تمت تصفية الخلايا المستخرجة من الأنسجة المقطوعة وتحديدها كميا وإعادة تعليقها في الوسط المناسب (الشكل 6) قبل إجراء تجارب الجدوى في المختبر أو في الجسم الحي . لفحص الجدوى في المختبر للخلايا وتأكيد استئصال الورم وليس حمة الدماغ الطبيعية ، نمت الخلايا في ثقافة التعليق. حدث تكوين الغلاف العصبي ، وهو مؤشر على إمكانية بدء الورم ، مع الحد الأدنى من معالجة الأنسجة بعد الاستئصال. وهذا يشير إلى أن منصة MIRS تحصد الأنسجة المنفصلة جيدا وكان لها تأثير ضئيل على صحة وصلاحية الأنسجة المقطوعة. يبدو أن العينات المأخوذة مباشرة من TPS إلى المجهر الضوئي كانت في المقام الأول في شكل خلايا مفردة إلى جانب وجود بضع قطع صغيرة من الأنسجة. تراوحت صلاحية اليوم 0 من 30٪ إلى 70٪ (وهذا يمثل الجدوى بعد تمرير العينة من خلال مرشح 70 ميكرومتر وقبل الطلاء). يحتوي جهاز الاستئصال على فتحة قطع يمكنها تدوير 360 درجة على محور مسبار الاستئصال ، مما يسمح باستئصال أحجام الأنسجة متحدة المركز. في المتوسط ، يمكن حصاد 2-3 ملايين خلية مع دوران واحد 360 درجة من فتحة القطع ، وحوالي 7 ملايين خلية مع دورتين ، ويمكن الحصول على ما مجموعه 12-14 مليون خلية مع ثلاث لفات 360 درجة من فتحة القطع. بعد الطلاء في قوارير معلقة تحتوي على وسط كامل للخلايا الجذعية خال من المصل ، كانت الأغلفة العصبية مرئية بواسطة المجهر الضوئي في اليوم 2 وبالعين المجردة بحلول اليوم 7 (الشكل 7).
لفحص الجدوى في الجسم الحي ، تم زرع الخلايا المستخرجة داخل الجمجمة في الفئران الساذجة C57BL / 6 (n = 8 فئران ، 100000 خلية حية / فأر). تم تأكيد نمو الورم باستخدام نظام التصوير في الجسم الحي . استمرت إشارة الورم في الزيادة حتى تم قتل جميع الحيوانات بالقتل الرحيم بحلول اليوم 14 بعد زرع الورم (متوسط البقاء على قيد الحياة لمدة 11 يوما).
يحتوي قسم أنسجة H&E التمثيلي (الشكل 3B) على تجويف استئصال دائري واضح مع حافة من منتجات الدم (وردي عميق) ، والتهاب ، وخلايا ورم متبقية (خلايا أرجوانية داكنة). من الناحية العيانية ، تكون الخلايا السرطانية المتبقية وسيطة بطبيعتها ومتسللة ، وتظهر غزوا وانتشارا واسعا حول الأوعية الدموية. ومن الناحية المجهرية، تم تحديد عدم النمط النووي الملحوظ والأرقام الانقسامية. كما تم تحديد البلاعم المرتبطة بالورم حول مناطق الأنسجة المحتقنة والنزيف الدقيق. لا يبدو أن بنية الأنسجة في حمة الدماغ المحيطة بها منزعجة.

الشكل 1: إعداد نظام MIRS. (أ) نظام استئصال طفيف التوغل (MIRS) لورم الدماغ في نماذج القوارض مع نظام متكامل للحفاظ على الأنسجة. (ب) اللوحة الأمامية لوحدة تحكم MIRS. 1 = قوة النظام، 2 = دواسة القدم، 3 = زر برايم، 4 = الطموح، 5 = قرص التحكم في مستوى الطموح، 6 = مؤشر مستوى الطموح، 7 = قبضة، 8 = زر تمكين القاطع. (ج) اللوحة الخلفية لوحدة تحكم MIRS. 1 = وعاء سلك الطاقة ، 2 = قاطع الدائرة ، 3 = مدخلات إمدادات النيتروجين. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: التغيرات في متوسط عبء الورم في الفئران المصابة بأورام غير معالجة مقابل الفئران التي تخضع لاستئصال الأورام بواسطة MIRS. (أ) الفئران ذات عبء الورم الأساسي الصغير و (ب) الفئران ذات عبء الورم الأساسي الكبير (p < 0.0001 ، SD ≤0.3e + 006 في جميع المجموعات في كل نقطة زمنية وصغيرة جدا بحيث لا يمكن عرضها على الرسم البياني). الحيوانات إما استسلمت لعبء الورم أو تم القتل الرحيم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: التصوير بالرنين المغناطيسي وتحليل H&E. (أ) صور التصوير بالرنين المغناطيسي للدماغ الموزونة T2 قبل وبعد الاستئصال T2 و (ب) قسم ممثل للدماغ الإكليلي الملطخ H & E يظهر تجويفا دائريا دائريا واضحا مع حافة من منتجات الدم (الوردي الداكن) والالتهاب والخلايا السرطانية المتبقية (الخلايا الأرجوانية الداكنة). تم الحصول على صور التصوير بالرنين المغناطيسي وأقسام H & E مباشرة بعد الاستئصال. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: تحديد حجم استئصال الورم. متوسط الأحجام المحسوبة من صور التصوير بالرنين المغناطيسي لتجاويف الاستئصال التي تم إنشاؤها باستخدام واحد مقابل. دوران لفتحة القطع ، n = 4 لكل مجموعة. p = 0.01 ، اختبار T ثنائي الذيل. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 5: منحنيات كابلان-ماير للفئران المصابة بأورام غير معالجة مقابل الفئران التي تخضع لاستئصال الأورام بواسطة MIRS . (أ) الفئران ذات عبء الورم الأساسي الصغير. (ب) الفئران ذات العبء الأساسي الكبير للورم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: اختبار الجدوى للخلايا السرطانية المستأصلة . (أ) صور المجهر الضوئي التمثيلي للأنسجة التي تم حصادها باستخدام MIRS في اليوم 0 عند 20x. (B) منحنى كابلان-ماير يصف بقاء الفئران بعد الزرع داخل الجمجمة للخلايا التي تم حصادها من الأنسجة المقطوعة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
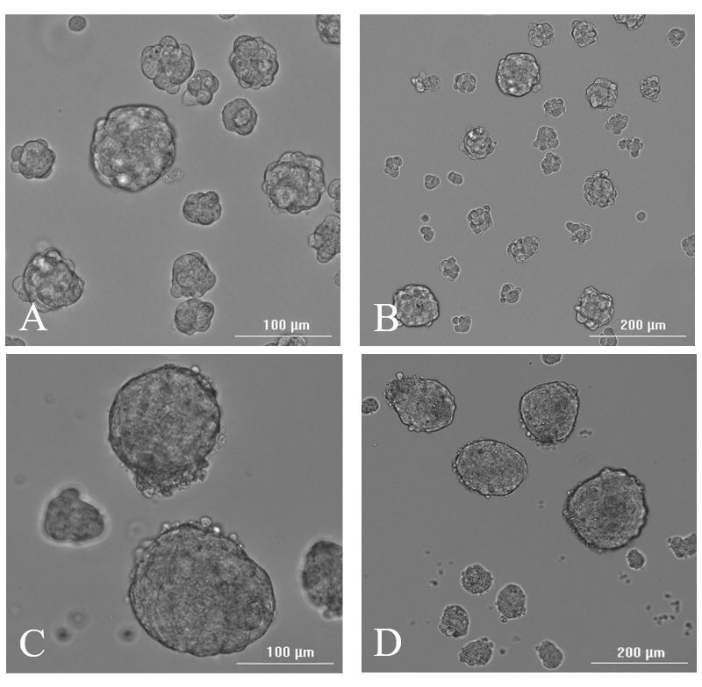
الشكل 7: تشكيل الكرات العصبية. صور المجهر الضوئي التمثيلي للغلاف العصبي المتولد من الأنسجة المقطوعة في اليوم 2 بعد الاستئصال في (A) 20x و (B) 10x ، وفي اليوم 7 بعد الاستئصال في (C) 20x و (D) 10x . يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
| نظام الاستئصال بأقل قدر من التدخل الجراحي | الاستئصال التاريخي | |||
| الوقت التشغيلي والمهارات | الحد الأدنى من وقت التشغيل (<2 دقيقة لكل). الحد الأدنى من المهارات اللازمة. | الوقت الجراحي ليس موحدا والخبرة الجراحية مع الحيوانات الصغيرة والجراحة المجهرية مفيدة. | ||
| فقدان الدم | الحد الادني | غير متوقعه | ||
| الحجم الموحد للاستئصال | حجم الاستئصال الذي تم تحديده/تعديله حسب عدد دورات أداة الاستئصال | يختلف الحجم اختلافا كبيرا بين الموضوعات | ||
الجدول 1: مقارنة بين نظام الاستئصال الأقل بضعا (MIRS) ونماذج الاستئصال الجراحي التاريخية.
Discussion
استئصال الورم هو حجر الزاوية في خطط علاج الأورام العصبية الجراحية لكل من أورام الدماغ منخفضة الدرجة وعالية الجودة. يرتبط الحد من الخلايا وإزالة الضخامة من الورم مع تحسين الوظيفة العصبية والبقاء على قيد الحياة بشكل عام في المرضى الذين يعانون من أورام الدماغ1،2،5،6. على الرغم من أن بروتوكولات الاستئصال الجراحي قد تم وصفها سابقا في نماذج القوارض ، إلا أن هذه البروتوكولات عانت من العديد من القيود التي يمكن أن تربك النتائج الناتجة وقابلية الترجمة الشاملة للنموذج قبل السريري. على سبيل المثال ، تضمنت بروتوكولات الاستئصال الجراحي التي تم الإبلاغ عنها سابقا بضع القحف مع 3-4 ثقوب لدغ صغيرة لإنشاء رفرف عظمي ثم التمييز الماهر والتمايز بين تلوين الورم واتساقه مقارنة بأنسجة المخ الطبيعية6. تستغرق هذه البروتوكولات وقتا طويلا وتتطلب من موظفي البحث أن يكون لديهم مهارات متقدمة في استخدام المجهر الجراحي ، والتعامل مع الأدوات الجراحية ، وتحديد حدود الورم فيما يتعلق بأنسجة المخ الطبيعية المحيطة ، وتحقيق التوازن الكافي. غالبا ما تؤدي هذه الإجراءات إلى فقدان كبير للدم وموت الحيوانات. بالإضافة إلى ذلك ، قد يكون من الصعب تحقيق استئصال موحد مع كميات مماثلة من أنسجة الورم التي تم استئصالها عبر مختلفة في نفس التجربة. تصبح هذه الاستمرارية والتوحيد أكثر تحديا مع قيام العديد من الموظفين بتنفيذ الإجراء.
وعلى النقيض من ذلك، يزيل بروتوكول MIRS الموصوف هنا هذه القيود (الجدول 1). يتطلب البروتوكول الحالي اتباع نهج طفيف التوغل من خلال نفس ثقب اللدغ المستخدم في زرع الورم الأولي. كما هو مفصل في قسم البروتوكول ، يمكن تثبيت أداة الاستئصال على إطار جسيمي يسمح بإدخال القنية بدقة في تجويف الورم. يمكن تعديل سرعة الشفرة وعدد دورات الاستئصال التي يتم إجراؤها بسهولة من خلال قبضة يستخدمها موظفو البحث للتحكم في حجم الورم الذي يتم استئصاله بطريقة موحدة دون التسبب في فقدان كمية كبيرة من الدم.
كما لوحظ في النتائج ، أظهرت الفئران التي خضعت للاستئصال باستخدام جهاز MIRS البقاء على قيد الحياة لفترة طويلة مقارنة بمجموعة الفئران التي لديها أورام غير مستأصلة. هذا ، إلى جانب البيانات ، يظهر أن عبء الورم قد انخفض بشكل كبير في المجموعة التي تم استئصالها مقارنة بالمجموعة الضابطة غير المقطوعة ، مما يشير إلى أن جهاز MIRS يزيل الورم بشكل فعال مع الحد الأدنى من الاضطراب في أنسجة المخ السليمة المحيطة. علاوة على ذلك ، في الأيام التالية للاستئصال ، تقدم عبء الورم بشكل مطرد بسبب وجود ورم متبقي والطبيعة الارتشاحية لخط الخلايا السرطانية CT-2A. وبالتالي ، يمكن لنموذج MIRS تكرار عملية إزالة الضخامة من أنواع الأورام الارتشاحية ، والتي يمكن اتباعها مع العلاج الكيميائي أو العلاج الإشعاعي لتعكس بشكل أوثق نظام العلاج في بروتوكولات علاج أورام الدماغ البشري15،16،17.
كما هو الحال مع أي جهاز شفط ، يمكن أن يكون انسداد أنابيب الشفط أحد قيود نظام MIRS. يمكن أن يحدث هذا بسبب تراكم الأنسجة الجافة أو الدم أثناء أو بعد استخدام الجهاز. لتجنب ذلك ، على الفور في نهاية كل جلسة من جلسات الاستئصال ، يوصى بتطهير قنية القبضة عن طريق التنظيف باستخدام وسائط مبردة بالتناوب مع الهواء "لدفع" جميع الأنسجة المقطوعة إلى علبة التجميع ، تليها التنظيف بنسبة 3٪ H 2 O2. سيؤدي ذلك إلى التقاط جميع الأنسجة المكتسبة أثناء الاستئصال وضمان عدم بقاء أي منها في القنية أو الأنابيب. علاوة على ذلك ، إذا كان النظام لا يستنشق / يقطع ، فقد يكون ذلك بسبب عدم توصيل القبضة ، أو عدم تشغيل قاطع قنية الاستئصال ، أو عدم توصيل خط الشفط من وحدة التحكم بالعلبة ، أو غطاء العلبة غير مشدود ، أو عدم توصيل دواسة القدم.
بالإضافة إلى ذلك ، في حين أننا أظهرنا أنه يمكن استخدام MIRS لاستئصال فعال وموحد مع قابلية عالية في المختبر وفي الجسم الحي للأنسجة المستأردة ، يتم تشجيع الدراسات المستقبلية على مواصلة التحقيق في الجوانب الأخرى لتنفيذ هذه الأنظمة في أبحاث أورام الدماغ. ويشمل ذلك فحص تأثير عملية الاستئصال على المكونات الجزيئية والخلوية لكتلة الورم والبيئة الدقيقة للورم. بالإضافة إلى ذلك ، هناك حاجة إلى دراسات للتأكد من أن الأنسجة المستأردة باستخدام جهاز MIRS تلخص الورم الأبوي15.
في الختام ، يتم وصف بروتوكول نهج الحد الأدنى من التدخل الجراحي للاستئصال الجراحي الموحد في نموذج ورم دماغ القوارض الذي يقترن بنظام متكامل وآلي للحفاظ على الأنسجة. يمهد هذا البروتوكول الطريق نحو إنشاء نماذج أبحاث أورام الدماغ قبل السريرية الانتقالية والتنبؤية للغاية. يمكن أن تشمل التطبيقات المستقبلية لهذا البروتوكول دراسات ما قبل السريرية التي تبحث في طرق علاجية أو تشخيصية مختلفة لأورام الدماغ والتي يمكنها تنفيذ هذا البروتوكول لتحقيق استئصال موحد.
Disclosures
حصلت BT على تمويل بحثي من المعاهد الوطنية للصحة وهي مالك مشارك ل Acceleration Combination Therapy * ، وقد رخصت Ashvattha Therapeutics Inc. إحدى براءات اختراعها. GW لديها تمويل المعاهد الوطنية للصحة (R01NS107813). HB هو مستشار مدفوع الأجر لشركة Insightec ورئيس المجلس الاستشاري الطبي للشركة. وقد تمت مراجعة هذا الترتيب والموافقة عليه من قبل جامعة جونز هوبكنز وفقا لسياسات تضارب المصالح. لدى HB تمويل بحثي من المعاهد الوطنية للصحة وجامعة جونز هوبكنز والعمل الخيري وهو مستشار لشركة CraniUS و Candel Therepeutics, Inc. و Acceleration Combination Therapy * و Catalio Nexus Fund II و LLC * و LikeMinds, Inc * و Galen Robotics, Inc. * و Nurami Medical *. (*يشمل الأسهم أو الخيارات).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | BD | 309628 | |
| 15 mL conical tubes | Corning | 430052 | |
| 200 proof ethanol | PharmCo | 111000200 | |
| 5 mL pipettes | CoStar | 4487 | |
| 70 micron filter | Fisher | 08-771-2 | |
| Accutase | Millipore Sigma | SIG-SCR005 | |
| Anased (Xylazine injection, 100 mg/mL) | Covetrus | 33198 | |
| Anesthesia System | Patterson Scientific | 78935903 | |
| Anesthesic Gas Waste Container | Patterson Scientific | 78909457 | |
| Bench protector underpad | Covidien | 10328 | |
| C57Bl/6, 6-8 week old mice | Charles River Laboratories | Strain Code 027 | |
| ChroMini Pro | Moser | Type 1591-Q | |
| Collagenase-Dispase | Roche | #10269638001 | |
| Countess II Automated Cell Counter | Thermo Fisher | ||
| Countess II FL Hemacytometer | Thermo Fisher | A25750 | |
| Debris Removal Solution | Miltenyi Biotech | #130-109-398 | |
| D-Luciferin | Goldbio | LUCK-1G | |
| DMEM F12 media | Corning | 10-090-CV | |
| DMEM media | Corning | 10-013-CV | |
| DNAse I | Sigma Aldrich | #10104159001 | |
| Eppendorf tubes | Posi-Click | 1149K01 | |
| Euthanasia solution | Henry Schein | 71073 | |
| FBS | Millipore Sigma | F4135 | |
| Fetal Bovine Serum | Thermo Fisher | 10437-028 | |
| Formalin | Invitrogen | INV-28906 | |
| Gauze | Henry Schein | 101-4336 | |
| hEGF | PeproTech EC | 100-15 | |
| Heparin | Sigma | H-3149 | |
| hFGF-b | PeproTech EC | 1001-18B | |
| Induction Chamber | Patterson Scientific | 78933388 | |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Isoflurane Vaporizer | Patterson Scientific | 78916954 | |
| Ketamine | Covetrus | 11695-0703-1 | |
| Kopf Stereotactic frame | Kopf Instruments | 5001 | |
| Lightfield Microscope | BioTek | Cytation 5 | |
| Microinjection Unit | Kopf | 5001 | |
| Micromotor drill | Foredom | F210418 | |
| MRI system | Bruker | 7T Biospec Avance III MRI Scanner | |
| NICO Myriad System | NICO Corporation | ||
| Ophthalmic ointment | Puralube vet ointment | ||
| Papain | Sigma Aldrich | #P4762 | |
| PBS | Invitrogen | #14190250 | |
| PenStrep | Millipore Sigma | N1638 | |
| Percoll solution | Sigma Aldrich | #P4937 | |
| Pipette controller | Falcon | A07260 | |
| Povidone-iodine solution | Aplicare | 52380-1905-08 | |
| Progesterone | Sigma | P-8783 | |
| Putrescine | Sigma | P-5780 | |
| RPMI Media | Invitrogen | INV-72400120 | |
| Scalpel blade | Covetrus | 7319 | |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Skin marker | Time Out | D538,851 | |
| Staple remover | MikRon | ACR9MM | |
| Stapler | MikRon | ACA9MM | |
| Staples | Clay Adams | 427631 | |
| Stereotactic Frame | Kopf Instruments | 5000 | |
| Sucrose | Sigma Aldrich | S9378 | |
| Suture, vicryl 4-0 | Ethicon | J494H | |
| T-75 culture flask | Sarstedt | 83-3911-002 | |
| TheraPEAKTM ACK Lysing Buffer (1x) | Lonza | BP10-548E | |
| Trypsin-EDTA | Corning | MDT-25-053-CI |
References
- Mineo, J. F., et al. Prognosis factors of survival time in patients with glioblastoma multiforme: a multivariate analysis of 340 patients. Acta Neurochirurgica. 149 (3), 245-252 (2007).
- Miyai, M., et al. Current trends in mouse models of glioblastoma. Journal of Neuro-Oncology. 135 (3), 423-432 (2017).
- Raj, D., Agrawal, P., Gaitsch, H., Wicks, E., Tyler, B. Pharmacological strategies for improving the prognosis of glioblastoma. Expert Opinion on Pharmacotherapy. 22 (15), 2019-2031 (2021).
- Alomari, S., et al. Drug repurposing for Glioblastoma and current advances in drug delivery-a comprehensive review of the literature. Biomolecules. 11 (12), 1870(2021).
- Serra, R., et al. Combined intracranial Acriflavine, temozolomide and radiation extends survival in a rat glioma model. European Journal of Pharmaceutics and Biopharmaceutics : Official Journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik eV. 170, 179-186 (2022).
- Tang, B., Foss, K., Lichtor, T., Phillips, H., Roy, E. Resection of orthotopic murine brain glioma. Neuroimmunology and Neuroinflammation. 8 (1), 64-69 (2021).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of Visualized Experiments. (41), e1986(2010).
- Poussard, A., et al. In vivo imaging systems (IVIS) detection of a neuro-invasive encephalitic virus. Journal of Visualized Experiments. (70), e4429(2012).
- Lachin, J. M. Nonparametric statistical analysis. JAMA. 323 (20), 2080-2081 (2020).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods in Molecular Biology. 740, 7-12 (2011).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Flow cytometry-based drug screening system for the identification of small molecules that promote cellular differentiation of Glioblastoma stem cells. Journal of Visualized Experiments. (131), e56176(2018).
- Rodgers, G., et al. Virtual histology of an entire mouse brain from formalin fixation to paraffin embedding. Part 2: Volumetric strain fields and local contrast changes. Journal of Neuroscience Methods. 365, 109385(2022).
- Connolly, N. P., et al. Elevated fibroblast growth factor-inducible 14 expression transforms proneural-like gliomas into more aggressive and lethal brain cancer. GLIA. 69 (9), 2199-2214 (2021).
- Stall, B., et al. Comparison of T2 and FLAIR imaging for target delineation in high grade gliomas. Radiation Oncology. 5, 5(2010).
- Das, A., et al. Establishing a standardized method for the effective intraoperative collection and biological preservation of brain tumor tissue samples using a novel tissue preservation system: a pilot study. World Neurosurgery. , (2022).
- Zusman, E., et al. Tissues harvested using an automated surgical approach confirm molecular heterogeneity of Glioblastoma and enhance specimen's translational research value. Frontiers in Oncology. 9, (2019).
- McLaughlin, N., et al. Side-cutting aspiration device for endoscopic and microscopic tumor removal. Journal of Neurological Surgery Part B. 73 (1), 11-20 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved