Method Article
高生存率組織採取のためのげっ歯類における低侵襲脳腫瘍切除術の実施
要約
本プロトコルは、統合された組織保存システムを用いた低侵襲アプローチによるげっ歯類の脳腫瘍の標準化された切除を記載する。この技術は、げっ歯類や他の動物モデルにおける標準治療を正確に反映するための意味を持ちます。
要約
本プロトコルは、げっ歯類脳腫瘍切除および組織保存のための標準化されたパラダイムを記載する。臨床診療では、最大腫瘍切除術はほとんどの脳腫瘍の標準治療です。ただし、現在利用可能なほとんどの前臨床脳腫瘍モデルには切除が含まれていないか、時間がかかり、術後の罹患率、死亡率、または実験の変動性が大きい外科的切除モデルを利用しています。さらに、げっ歯類の切除を行うことは、臨床的に比較可能な手術器具またはプロトコルの欠如、標準化された組織収集のための確立されたプラットフォームの欠如など、いくつかの理由で困難な場合があります。このプロトコルは、多機能、非切除切除装置の使用と、デバイスの臨床バージョンから適応された統合組織保存システムを強調しています。本研究で適用する装置は、調整可能な吸引と開口部の円筒形のブレードを組み合わせて、組織を正確にプローブ、切断、および吸引します。低侵襲切除装置は、最初の腫瘍移植に使用されるのと同じバリ穴 を介して その機能を実行します。このアプローチは、生検または切除手術中の局所解剖学的構造の変化を最小限に抑え、重大な失血のリスクを軽減します。これらの因子は、手術時間(<2分/動物)を大幅に短縮し、術後の動物の生存率を改善し、実験群の変動性を低下させ、将来の分析のために切除された組織および細胞の高い生存率をもたらしました。このプロセスは、~1,400サイクル/分のブレード速度によって促進され、選択した生理学的溶液で満たすことができる滅菌閉鎖システムに組織を採取することができます。手術の影響を研究し、正確にモデル化することの重要性が高まっていることを考えると、局所化された腫瘍切除標本の保存と厳密な比較分析、および腔内送達治療、このユニークなプロトコルは、周術期管理と脳腫瘍患者の治療法の発見に関する未回答の質問を探求する機会を拡大します。
概要
膠芽腫(GBM)は、成人で最も一般的で攻撃的な原発性脳腫瘍です。脳神経外科、標的薬開発、放射線療法の最近の進歩にもかかわらず、GBM患者の5年生存率は5%未満であり、この統計は30年以上にわたって有意に改善されていません1。したがって、より効果的な治療戦略が必要です。
新しい治療法を開発するためには、治験実施計画書が(1)腫瘍の不均一性と微小環境を正確に再現する翻訳可能な前臨床モデルを利用し、(2)現在手術、放射線療法、化学療法を含むGBM患者で使用されている標準的な治療レジメンを反映し、(3)切除されたコアと残存の違いを説明する必要があることがますます明らかになっています。 浸潤性腫瘍組織2,3,4,5。しかし、現在利用可能な前臨床脳腫瘍モデルのほとんどは、外科的切除を実施していないか、比較的時間のかかる外科的切除モデルを利用しているため、かなりの量の失血につながるか、標準化が不足しています。さらに、げっ歯類脳腫瘍の切除を行うことは、臨床的に比較可能な手術器具またはプロトコルの欠如、および体系的な組織収集のための確立されたプラットフォーム6の欠如のために困難であり得る(表1)。
本プロトコルは、多機能非切除低侵襲切除システム(MIRS)および統合組織保存システム(TPS)を使用したげっ歯類脳腫瘍切除および組織保存のための標準化されたパラダイムを記述することを目的としています(図1)。本技術により、GBMをはじめとする脳腫瘍モデルの前臨床研究における様々な研究に活用できる標準化されたプラットフォームが提供されることが期待されます。脳腫瘍の治療法または診断法を調査している研究者は、このプロトコルを実装して、研究で標準化された切除を達成することができます。
プロトコル
すべての動物実験は、メリーランド大学とジョンズホプキンス大学施設動物管理および使用委員会によって承認されました。C57BL/6雌マウス、6〜8週齢を本研究に用いた。マウスは市販の供給源から入手した( 材料表参照)。マスク、手袋、ガウンの使用を含む、すべてのバイオセーフティレベル2(BSL-2)規制が守られました。
1.最初の頭蓋内腫瘍移植
- 研究の初期段階では、以前に発表された第7相に続いて、4 μLのリン酸緩衝生理食塩水(1x PBS)に懸濁した100,000個の細胞(GL261マウスグリオーマ細胞株)を各マウスに2.5 mmの深さまで頭蓋内注射します。
- 腫瘍移植後8から9日目のin vivoイメージングシステムを用いて各マウスにおける腫瘍シグナルを定量化する。
注:必要に応じて、腫瘍量に基づいてマウスを2つのグループに層別化します。本研究では、2つのグループは、(1)腫瘍量が比較的小さいマウス(平均生物発光シグナル= 5.5e + 006 ± 0.1e + 006光子/ s、n = 10)および(2)比較的大きな腫瘍量を持つマウス(平均生物発光シグナル= 1.69e + 007 ± 0.2e + 007光子/ s、n = 10)、(p < 0.05、マンホイットニー検定)9。 - 各グループを2つの比較可能なサブグループに分けます。
注:この研究では、2つのサブグループは、未治療のマウス(n = 5)と、MIRSを使用して外科的切除を受けている腫瘍のあるマウス(n = 5)、(p > 0.05、マンホイットニー検定)9でした。 - 切除の日から開始して、腫瘍成長パターンに基づく頻度で in vivo イメージングシステムを使用して腫瘍進行を追跡する。
注:GL261細胞株の場合、切除当日の腫瘍の進行を追跡し、その後3〜6日ごとに追跡します。
2. MIRSを用いた腫瘍切除術
- 誘導チャンバー内のイソフルラン-O2 ガス混合物またはキシラジン/ケタミン溶液の腹腔内注射を使用してマウスを麻酔します。
- ガス麻酔薬を使用する場合は、麻酔誘導のためにガス流量を1.0 mL / minに設定し、気化器を2.0%に設定し、通常チャンバー内で3〜5分かかります(材料の表を参照)。
- 注射可能な麻酔薬を使用する場合は、0.2 mLの麻酔液(80〜100 mg / kgのケタミンと10〜12.5 mg / kgのキシラジン、 材料の表を参照)を腹腔内に注射してマウスに麻酔をかけます。.
- つま先をつまんで動物の適切な鎮静を評価します。角膜の乾燥を避けるために眼科用軟膏を目に塗ります。手順の前に鎮痛薬(0.03-0.06 mg / kgブプレノルフィンを皮下投与)を投与します。.
- 完全な鎮静が確認されたら、マウスを定位フレーム( 材料の表を参照)に置きます。
注:ガス麻酔薬を使用する場合は、マウスの鼻をノーズコーンに入れ、手順中にイソフルラン-O2 混合物(1.5%)を受け取り続けます。 - 前のステープルを取り除き、脱毛クリームまたはひげそりで髪を取り除きます。クロルヘキシジン/ベタジンベースのスクラブとアルコールの交互のサイクルで皮膚を消毒します。.次に、滅菌メスを使用して、前の外科的瘢痕に沿って1cmの縦正中線切開を作成します。
- MIRSハンドピースをステージアダプター/ハンドピースホルダーを介して定位アームに取り付け、安定性と精度を高めます。
- 次の設定を使用して、MIRSマシン( 材料表を参照)をセットアップします(図1)。
- 背面パネルにセットされている電源コードを電源コードレセプタクルに挿入します。切り替えて、システムの電源をオンまたはオフにします(1 =オン、0 =オフ)。
- 窒素ホース(本体に付属)の一端を本体の背面パネルのオスフィッティングに挿入します。接続ナットを時計回りに回して接続を締めます。
注意: ホースの反対側の端を窒素供給に接続する必要があります。 - ホースを窒素供給に取り付ける前に、供給圧力がコンソールに推奨される入力供給圧力である 100 psig を超えていないことを確認してください。
注意: 窒素がコンソールに供給されると、フットペダルで作動すると、コンソールは独自の吸引を生成します。 - 真空ポートの蓋を固定し、真空システムの漏れを防ぐために密閉します。吸引システムのリークは、MIRSコンソールのパフォーマンスに影響します。
- セットアップ中またはプライミング中に吸引量が17未満の場合は、コンソールの前面にある吸引ノブが最大レベル(100)に設定されていることを確認し、吸引システムに漏れがないことを確認し、窒素入力供給圧力が正しいことを確認します。
- フット ペダルを本体に接続するには、灰色のフット ペダル コネクターをカチッと所定の位置に収まるまで灰色のレセプタクルに挿入します。
メモ: フットペダルコネクタは、コンソールに一方向で接続され、キーが付けられています。 - ハンドピースを本体に接続するには、青色のハンドピース コネクタを青色のレセプタクルにカチッと音がして所定の位置に収まるまで挿入します。
メモ: ハンドピースコネクタは、コンソールに一方向で接続され、キーが付けられています。 - システムを使用する前に、小さなボウルから開口部、チューブとハンドピース、キャニスターに滅菌液を吸引して、各ハンドピースをプライミングし、チューブとハンドピースの内側が潤滑され、組織の閉塞を減らします。
- コンソールのフロントパネルで適切なモードを選択して、吸引のみまたは切断を伴う吸引の準備をします。フットペダルの使用を開始します。
- 23 G MIRSカニューレをバリ穴に2.5 mmの深さまで挿入します。
- カニューレに接続されているフットペダルを押して、切除プロセスを開始します。ハンドピースのコントロールノブを使用して、1サイクル(360°)以上の切除を行います。
注:実行されるサイクルが多いほど、切除される腫瘍組織の量が多くなります。 - 切除プロセスが完了したら、23 G MIRSカニューレをバリ穴から引き出し、5 mLの1x PBSを使用してチューブを洗い流し、残留破片を取り除きます。
- マウスを定位フレームから取り外し、ホッチキスまたは4-0縫合材料で傷を閉じます( 材料の表を参照)。
- マウスをケージに戻す前に、麻酔からの回復中に加熱パッドの上または暖かい光の下に置きます。
- 実験が完了したら、フラッシングによってカニューレをパージ します 。冷やした培地と空気を交互に使用して、切除されたすべての組織を収集キャニスターに「押し戻します」。システムから回収キャニスターを取り外し、付属のキャップでキャップを外します。
- ステップ2.12を完了した後、カニューレの遠位先端を3%H 2 O2に配置し、24〜25インチHgで吸引を適用して吸引ラインを吸引収集キャニスターに戻し、60〜90秒間放置します。空気と媒体を断続的にパルスする滅菌媒体で洗い流します。
- 手順に従って、神経学的兆候(異常な不規則な動きまたは発作)がないかマウスを監視します。
- 重度の神経障害(無気力になる、罵倒された外観、腰を下ろす、または不規則な動きをする)を持つマウスを安楽死させます。
注:本研究では、市販の安楽死溶液200 mg / kg( 材料の表を参照)を使用して、各マウスを安楽死させました。
3. TPS による 組織採取
- 腫瘍サンプルをRBC溶解培地( 材料の表を参照)を含む組織培養皿に室温で5分間浸します。
注:MIRSからTPSに採取された組織は、主に組織の小さな塊とともに単一細胞の形になります。 - 70 μmのフィルター( 材料の表を参照)を50 mLのコニカルチューブに置き、5 mLシリンジのプランジャーを使用して腫瘍サンプルをフィルターに通します。
- トランスファーピペットでは、RPMI-1640培地を使用して、細胞や組織塊をフィルターに通すことができます。
- 428 x g で4°Cで5分間遠心分離します。 上清をピペットで捨てる。
- 各サンプルを調製したRPMI-1640培地5 mLに再懸濁します。
- 組織の生存率を高めるには、特に最初の印象で大きな組織チャンクを視覚化する場合は、必要な量の酵素カクテル(DNAアーゼI、コラゲナーゼIV、ディスパーゼ、パパイン、EDTAを含む、 材料表を参照)を各サンプルに追加します。渦を使用して溶液を混合します。
メモ: ステップ 3.6 はオプションです。酵素カクテルの組成(総容量5 mL/サンプル):300 μLのDNAアーゼIグレードII、150 μLのコラゲナーゼ/ディスパーゼ(フィブロネクチン、コラゲナーゼIV、I、および非極性アミノ酸を切断)、250 μLのパパイン(非特異的プロテアーゼ)、および6 μLの0.5 M EDTA。 - サンプルを200rpm、37°Cに設定したシェーカーインキュベーターに20分間入れます。
- 20分後、サンプルを428 x g で4°Cで5分間回転させます。 上澄み液を捨てる。
- 70 μmのセルストレーナーで単一細胞をろ過し、274 x g で4°Cで3分間スピンダウンします。 トリパンブルーと血球計算盤を使用して細胞生存率分析10 を実施します( 材料の表を参照)。
注:0日目の生存率は30%〜70%の範囲で、2〜3日以内に大幅に増加します。 - 必要な生存率テストに応じて、手順 4、5、または 6 に進みます。
4. 接着培養における細胞の増殖
- 認定された層流フードで、ペレットを血清含有付着培地(DMEM、10%ウシ胎児血清(FBS)、1%ペニシリン/ストレプトマイシン(P / S)溶液など)に再懸濁し、接着細胞フラスコ内の細胞をプレートします。
- 細胞を制御されたインキュベート環境(37°C、5%CO2)に維持する。
5. 浮遊培養(ニューロスフェア)での細胞増殖
- 認定された層流フードで、ペレットを無血清完全幹細胞培地11 に再懸濁し、懸濁フラスコにプレートします。
- 細胞を制御されたインキュベート環境(37°C、5%CO2)で2〜3日間維持して、ニューロスフェアの形成を可能にします。
- 培地中のニューロスフェアを可視化した後、トリプシン-EDTAまたはアキュターゼ( 材料表を参照)を使用して、継代用の単一細胞懸濁液を取得します。
注:採取時に特別な注意が払われ、神経幹細胞をサポートする適切な培地が使用される限り、採取された組織の幹細胞は数日以内にニューロスフェアを形成する必要があります。
6.再移植のための細胞の準備
- 1x PBSの4 μLあたり100,000生細胞の濃度でペレットを再懸濁します。
- 頭蓋内腫瘍移植法を用いてナイーブマウスに直ちに注射する(ステップ1)。
7.組織学的分析
- 切除直後に、脳を抽出し、4%パラホルムアルデヒド(PFA)で24時間12時間固定します。
- 脳をスクロースで飽和するまで30%スクロース溶液に移します(容器の底まで沈みます)。
- 脳を70%エタノール溶液に移します。
- 以前に発表された第13報告書に続いて、パラフィンブロック包埋、切片化、および標準的なヘマトキシリンおよびエオジン(H&E)染色を実行します。
注:染色のために採取した各切片の厚さは10μmであった。
結果
MIRSを用いた外科的切除は腫瘍量の有意な減少をもたらす
腫瘍量が少ないグループでは、平均ベースライン生物発光シグナルは5.5e + 006光子/秒±切除を受けたサブグループでは0.2e + 006でした。切除後、平均生物発光シグナルは0.3e+006±3.09e+006光子/秒に減少しました(p <0.0001、マン・ホイットニー検定)9 (図2)。生物発光シグナルは、マウスが安楽死するまでの次の数日で増加した。同様に、腫瘍量が多いグループでは、平均ベースライン生物発光シグナルは、切除を受けたサブグループでは1.68e + 007光子/秒±0.1e + 007でした。切除後、平均生物発光シグナルは0.2e+006±5.19e+006光子/sに減少した(p <0.0001、マン・ホイットニー検定)9。生物発光シグナルは、マウスが安楽死するまでの次の数日で増加した。
MIRSを使用した切除は、所望の切除量に合わせて調整することができます
同系CT2A腫瘍の切除前イメージングでは、腫瘍は一般に接種部位の不均一な腫瘤として識別でき、実質構造が破壊され、腫瘍周囲浮腫および出血はT2強調(T2w)低強度および高強度の不均一な領域によって示されます。定位腫瘍細胞注入に使用される針トラックは、T2w MRIスキャン14で識別できます。
切除後のT2w MRIスキャンでは、腫瘍接種部位の大きな丸い低信号領域として切除腔を特定できます(図3)。切除手順は、重大な失血または周囲の脳構造の破壊を引き起こさなかった。場合によっては、体液が切除腔内に蓄積した。図4に示すように、切除容積は切断開口1回転の9.4mm3から2回転23.2mm3に有意に増加し(p=0.0117)、既知の腫瘍量に最適化するための切除容積の調整が可能となった。
MIRSを用いた腫瘍切除は、神経学的徴候を誘発することなく、担癌マウスの生存期間中央値を7日間延長する。
図5に示すように、外科的切除を受けたマウスの生存期間は、腫瘍が小さい(6日)群と大きい腫瘍(7日)の両群で延長が認められた。腫瘍量が少ない群では、対照サブグループの生存期間中央値は16日でしたが、切除を受けたサブグループの生存期間中央値は22日でした(p = 0.0044)。同様に、腫瘍量が大きい群では、対照サブグループの生存期間中央値は12日でしたが、切除を受けたサブグループの生存期間中央値は19日でした(p = 0.0043)。さらに、MIRSを用いて切除を受けたマウスはいずれも、処置後に神経学的損傷の徴候を示さなかった。これは、MIRSが安全な切除を達成できることを示しています。
MIRSを使用して切除された組織は、高いインビトロおよびインビボ生存率を持っています
切除された組織から抽出した細胞をろ過、定量し、適切な培地に再懸濁してから(図6)、 in vitro または in vivo の生存率実験を実施しました。細胞の in vitro 生存率を調べ、正常ではない脳実質の腫瘍の切除を確認するために、細胞を浮遊培養で増殖させた。腫瘍開始可能性の指標であるニューロスフェア形成は、切除後の最小限の組織処理で発生しました。これは、MIRSプラットフォームが十分に解離した組織を採取し、切除された組織の健康と生存能力への影響が最小限であることを示唆しています。TPSから光学顕微鏡に直接採取されたサンプルは、主に単一細胞の形であり、組織のいくつかの小さな塊が存在するように見えました。0日目の生存率は30%〜70%の範囲であった(これは、サンプルを70μmフィルターに通した後、メッキ前の生存率を表す)。切除装置は、切除プローブの軸上で360°回転できる切断開口部を有し、同心円状の組織体積の切除を可能にする。平均して、切断開口部の1つの360°回転で2〜300万個の細胞、2回転で約700万個の細胞、および切断開口部の3つの360°回転で合計12〜1400万個の細胞を得ることができます。無血清完全幹細胞培地を含む懸濁フラスコにプレーティングした後、ニューロスフェアは2日目に光学顕微鏡で、7日目までに肉眼で視認できました(図7)。
in vivo生存率を調べるために、抽出した細胞をナイーブC57BL/6マウス(n = 8匹のマウス、100,000生細胞/マウス)に頭蓋内移植しました。腫瘍増殖は、in vivoイメージングシステムを用いて確認した。腫瘍シグナルは、腫瘍移植後14日目までにすべての動物が安楽死されるまで増加し続けた(生存期間中央値は11日)。
代表的なH&E組織切片(図3B)には、血液製剤(濃いピンク色)、炎症、および残存腫瘍細胞(濃い紫色の細胞)の縁を持つ透明な円形の切除腔が含まれています。肉眼的には、残存腫瘍細胞は本質的に間葉系であり、浸潤性であり、広範な血管周囲浸潤および増殖を示す。顕微鏡的には、顕著な核異型および有糸分裂の数字が同定された。腫瘍関連マクロファージは、梗塞組織および微小出血の領域周辺でも同定された。周囲の脳実質の組織構造は乱されていないようでした。

図1:MIRSシステムのセットアップ。 (A)統合された組織保存システムを備えたげっ歯類モデルの脳腫瘍に対する低侵襲切除システム(MIRS)。(B) MIRS コンソールのフロントパネル。1 =システム電源、2 =フットペダル、3 =プライムボタン、4 =吸引、5 =吸引レベルコントロールダイヤル、6 =吸引レベルインジケーター、7 =ハンドピース、8 =カッターイネーブルボタン。(C) MIRSコンソールの背面パネル。1 = 電源コード・レセプタクル、2 = 回路ブレーカー、3 = 窒素供給入力。 この図の拡大版を表示するには、ここをクリックしてください。

図2:未治療の腫瘍を有するマウスとMIRSによる腫瘍の切除を受けたマウスの平均腫瘍量の変化。 (A)ベースライン腫瘍量が小さいマウスおよび(B)ベースライン腫瘍量が大きいマウス(p < 0.0001、SD ≤0.3e + 006、各時点ですべてのグループで、グラフに表示するには小さすぎます)。動物は腫瘍量に屈したか、安楽死させた。 この図の拡大版を表示するには、ここをクリックしてください。

図3:MRIおよびH&E分析 。 (A)切除前および切除後のT2強調脳MRI画像、および(B)血液製剤(濃いピンク色)、炎症、および残存腫瘍細胞(濃い紫色の細胞)の縁のある透明な円形の切除腔を示す代表的なH&E染色冠状脳切片。MRI画像とH&E切片は切除直後に得られた。 この図の拡大版を表示するには、ここをクリックしてください。

図4:腫瘍切除量の決定。1対で作成された切除腔のMRI画像から計算された平均体積。切断開口の2回転、n=4グループあたり。p = 0.01、両側T検定。この図の拡大版を表示するには、ここをクリックしてください。

図5:未治療の腫瘍を有するマウスとMIRSによる腫瘍の切除を受けたマウスのKaplan-Meier曲線 。 (A)ベースライン腫瘍量が小さいマウス。(B)ベースライン腫瘍量が大きいマウス。 この図の拡大版を表示するには、ここをクリックしてください。

図6:切除した腫瘍細胞の生存率試験 。 (A)20xで0日目にMIRSで採取した組織の代表的な光学顕微鏡画像。 (B)切除組織から採取した細胞の頭蓋内移植後のマウスの生存率を説明するカプラン・マイヤー曲線。 この図の拡大版を表示するには、ここをクリックしてください。
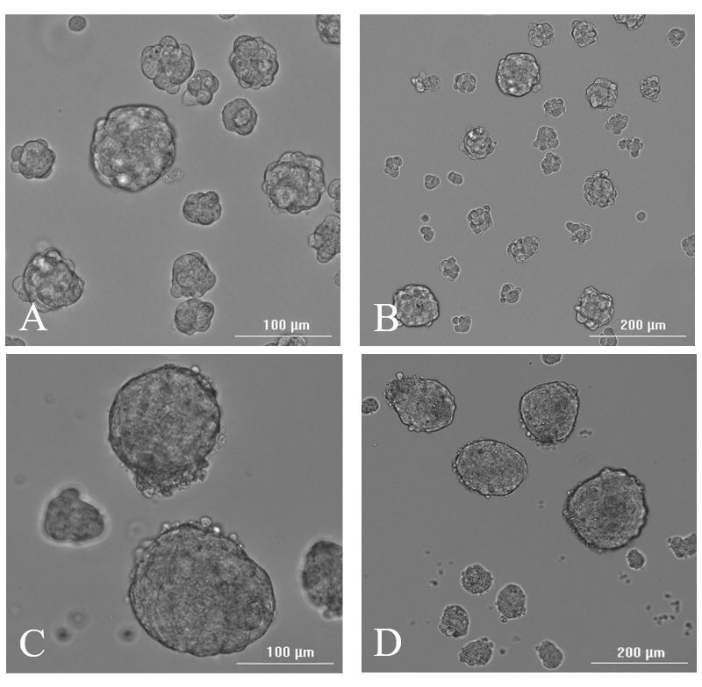
図7:ニューロスフェアの形成。 切除後2日目に(A)20倍と(B)10倍、切除後7日目に(C)20倍と(D)10倍で切除された組織から生成されたニューロスフェアの代表的な光学顕微鏡画像。 この図の拡大版を表示するには、ここをクリックしてください。
| 低侵襲切除システム | 歴史的切除 | |||
| 手術時間とスキル | 最小手術時間(各動物につき<2分)。最小限のスキルが必要です。 | 手術時間は標準化されておらず、小動物や顕微手術での手術経験は有益です。 | ||
| 失血 | 極小 | 予測できない | ||
| 標準化された切除量 | 切除ツールは回転数で決定・調整する切除量 | ボリュームは被験者によって大きく異なります | ||
表1:低侵襲切除システム(MIRS)と過去の外科的切除モデルとの比較。
ディスカッション
腫瘍切除は、低悪性度と高悪性度の両方の脳腫瘍に対する脳神経外科腫瘍治療計画の基礎です。腫瘍の細胞縮小および減量は、脳腫瘍患者の神経機能および全生存期間の改善と相関する1,2,5,6。外科的切除のプロトコルはげっ歯類モデルで以前に説明されていますが、これらのプロトコルは、生成された結果と前臨床モデルの全体的な翻訳可能性を混乱させる可能性のあるいくつかの制限に苦しんでいます。たとえば、以前に報告された外科的切除プロトコルには、骨皮弁を作成するための3〜4個の小さなバリ穴を備えた開頭術が含まれ、正常な脳組織と比較して腫瘍の色と一貫性を巧みに区別および区別します6。これらのプロトコルは時間がかかり、研究担当者は、手術用顕微鏡の利用、手術器具の取り扱い、周囲の正常な脳組織に関する腫瘍の境界の特定、および適切な恒常性の実現に関する高度なスキルを持っている必要があります。そのような処置はしばしば重大な失血および動物の死につながる。さらに、同じ実験で異なる動物間で切除された同等の量の腫瘍組織を使用して標準化された切除を達成することは困難な場合があります。この継続性と均一性は、複数の担当者が手順を実行するにつれて、より困難になります。
対照的に、ここで説明するMIRSプロトコルは、これらの制限を取り除きます(表1)。本プロトコルは、最初の腫瘍移植に使用されるのと同じバリ穴を介した低侵襲アプローチを必要とする。プロトコルのセクションで詳述されているように、切除ツールは、腫瘍腔へのカニューレの正確な挿入を可能にする定位フレームに取り付けることができます。ブレードの速度と実行される切除サイクルの数は、研究担当者が使用するハンドピースを介して簡単に調整でき、大量の失血を引き起こすことなく、標準化された方法で切除される腫瘍の量を制御できます。
結果に示されているように、MIRS装置で切除を受けたマウスは、切除されていない腫瘍を有するマウスのコホートと比較して、生存期間の延長を示した。これは、データとともに、切除群で腫瘍量が切除されていない対照群と比較して有意に減少したことを示しており、MIRSデバイスが周囲の健康な脳組織への妨害を最小限に抑えて腫瘍を効果的にデバルキングすることを示しています。さらに、切除後の数日間で、残存腫瘍の存在とCT-2A腫瘍細胞株の浸潤性により、腫瘍量は着実に進行しました。したがって、MIRSモデルは、浸潤性腫瘍タイプのデバルキングプロセスを再現することができ、化学療法または放射線療法に従って、ヒト脳腫瘍治療プロトコルにおける治療レジメンをより厳密に反映することができます15、16、17。
他の吸引装置の場合と同様に、吸引チューブの目詰まりはMIRSシステムの制限の1つになる可能性があります。これは、機械の使用中または使用後の乾燥組織または血液の蓄積が原因で発生する可能性があります。これを避けるために、切除の各セッションの直後に、切除されたすべての組織を収集キャニスターに「押し込む」ために空気と交互に冷却された媒体で洗い流し、続いて3%H 2 O2で洗い流すことによってハンドピースカニューレをパージすることが推奨される。これにより、切除中に取得したすべての組織が捕捉され、カニューレまたはチューブに何も残っていないことが保証されます。さらに、システムが吸引/切断されていない場合は、ハンドピースが接続されていない、切除カニューレカッターがオンになっていない、コンソールからの吸引ラインがキャニスターに接続されていない、キャニスターの蓋がきつくない、またはフットペダルが接続されていないことが原因である可能性があります。
さらに、MIRSは、切除された組織の高いin vitro および in vivo 生存率を備えた効果的で標準化された切除に使用できることを示しましたが、将来の研究は、脳腫瘍研究におけるそのようなシステムの実装の他の側面をさらに調査することが奨励されています。これらには、腫瘍塊および腫瘍微小環境の分子および細胞成分に対する切除プロセスの影響を調べることが含まれます。さらに、MIRS装置を用いて切除した組織が親腫瘍15を複製することを確認するための研究が必要である。
結論として、低侵襲アプローチのプロトコルは、統合および自動化された組織保存システムと結合されたげっ歯類脳腫瘍モデルにおける標準化された外科的切除について説明されています。このプロトコルは、高度に翻訳的で予測的な前臨床脳腫瘍研究モデルの確立への道を開きます。このプロトコルの将来のアプリケーションには、標準化された切除を達成するためにこのプロトコルを実装できる脳腫瘍のさまざまな治療法または診断方法を調査する前臨床試験が含まれる可能性があります。
開示事項
BTはNIHから研究資金を受けており、Acceleration Combination Therapies*の共同所有者であり、Ashvattha Therapeutics Inc.は彼女の特許の1つをライセンスしています。GWにはNIHの資金があります(R01NS107813)。HBは、Insightecの有給コンサルタントであり、同社の医療諮問委員会の会長です。この取り決めは、利益相反ポリシーに従ってジョンズホプキンス大学によってレビューおよび承認されています。HBは、NIH、ジョンズホプキンス大学、および慈善活動から研究資金を受けており、CraniUS、Candel Therepeutics、Inc.、Acceleration Combination Therapies*、Catalio Nexus Fund II、LLC*、LikeMinds、Inc*、Galen Robotics、Inc.*、Nurami Medical*のコンサルタントです。(*エクイティまたはオプションを含む)。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | BD | 309628 | |
| 15 mL conical tubes | Corning | 430052 | |
| 200 proof ethanol | PharmCo | 111000200 | |
| 5 mL pipettes | CoStar | 4487 | |
| 70 micron filter | Fisher | 08-771-2 | |
| Accutase | Millipore Sigma | SIG-SCR005 | |
| Anased (Xylazine injection, 100 mg/mL) | Covetrus | 33198 | |
| Anesthesia System | Patterson Scientific | 78935903 | |
| Anesthesic Gas Waste Container | Patterson Scientific | 78909457 | |
| Bench protector underpad | Covidien | 10328 | |
| C57Bl/6, 6-8 week old mice | Charles River Laboratories | Strain Code 027 | |
| ChroMini Pro | Moser | Type 1591-Q | |
| Collagenase-Dispase | Roche | #10269638001 | |
| Countess II Automated Cell Counter | Thermo Fisher | ||
| Countess II FL Hemacytometer | Thermo Fisher | A25750 | |
| Debris Removal Solution | Miltenyi Biotech | #130-109-398 | |
| D-Luciferin | Goldbio | LUCK-1G | |
| DMEM F12 media | Corning | 10-090-CV | |
| DMEM media | Corning | 10-013-CV | |
| DNAse I | Sigma Aldrich | #10104159001 | |
| Eppendorf tubes | Posi-Click | 1149K01 | |
| Euthanasia solution | Henry Schein | 71073 | |
| FBS | Millipore Sigma | F4135 | |
| Fetal Bovine Serum | Thermo Fisher | 10437-028 | |
| Formalin | Invitrogen | INV-28906 | |
| Gauze | Henry Schein | 101-4336 | |
| hEGF | PeproTech EC | 100-15 | |
| Heparin | Sigma | H-3149 | |
| hFGF-b | PeproTech EC | 1001-18B | |
| Induction Chamber | Patterson Scientific | 78933388 | |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Isoflurane Vaporizer | Patterson Scientific | 78916954 | |
| Ketamine | Covetrus | 11695-0703-1 | |
| Kopf Stereotactic frame | Kopf Instruments | 5001 | |
| Lightfield Microscope | BioTek | Cytation 5 | |
| Microinjection Unit | Kopf | 5001 | |
| Micromotor drill | Foredom | F210418 | |
| MRI system | Bruker | 7T Biospec Avance III MRI Scanner | |
| NICO Myriad System | NICO Corporation | ||
| Ophthalmic ointment | Puralube vet ointment | ||
| Papain | Sigma Aldrich | #P4762 | |
| PBS | Invitrogen | #14190250 | |
| PenStrep | Millipore Sigma | N1638 | |
| Percoll solution | Sigma Aldrich | #P4937 | |
| Pipette controller | Falcon | A07260 | |
| Povidone-iodine solution | Aplicare | 52380-1905-08 | |
| Progesterone | Sigma | P-8783 | |
| Putrescine | Sigma | P-5780 | |
| RPMI Media | Invitrogen | INV-72400120 | |
| Scalpel blade | Covetrus | 7319 | |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Skin marker | Time Out | D538,851 | |
| Staple remover | MikRon | ACR9MM | |
| Stapler | MikRon | ACA9MM | |
| Staples | Clay Adams | 427631 | |
| Stereotactic Frame | Kopf Instruments | 5000 | |
| Sucrose | Sigma Aldrich | S9378 | |
| Suture, vicryl 4-0 | Ethicon | J494H | |
| T-75 culture flask | Sarstedt | 83-3911-002 | |
| TheraPEAKTM ACK Lysing Buffer (1x) | Lonza | BP10-548E | |
| Trypsin-EDTA | Corning | MDT-25-053-CI |
参考文献
- Mineo, J. F., et al. Prognosis factors of survival time in patients with glioblastoma multiforme: a multivariate analysis of 340 patients. Acta Neurochirurgica. 149 (3), 245-252 (2007).
- Miyai, M., et al. Current trends in mouse models of glioblastoma. Journal of Neuro-Oncology. 135 (3), 423-432 (2017).
- Raj, D., Agrawal, P., Gaitsch, H., Wicks, E., Tyler, B. Pharmacological strategies for improving the prognosis of glioblastoma. Expert Opinion on Pharmacotherapy. 22 (15), 2019-2031 (2021).
- Alomari, S., et al. Drug repurposing for Glioblastoma and current advances in drug delivery-a comprehensive review of the literature. Biomolecules. 11 (12), 1870(2021).
- Serra, R., et al. Combined intracranial Acriflavine, temozolomide and radiation extends survival in a rat glioma model. European Journal of Pharmaceutics and Biopharmaceutics : Official Journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik eV. 170, 179-186 (2022).
- Tang, B., Foss, K., Lichtor, T., Phillips, H., Roy, E. Resection of orthotopic murine brain glioma. Neuroimmunology and Neuroinflammation. 8 (1), 64-69 (2021).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of Visualized Experiments. (41), e1986(2010).
- Poussard, A., et al. In vivo imaging systems (IVIS) detection of a neuro-invasive encephalitic virus. Journal of Visualized Experiments. (70), e4429(2012).
- Lachin, J. M. Nonparametric statistical analysis. JAMA. 323 (20), 2080-2081 (2020).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods in Molecular Biology. 740, 7-12 (2011).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Flow cytometry-based drug screening system for the identification of small molecules that promote cellular differentiation of Glioblastoma stem cells. Journal of Visualized Experiments. (131), e56176(2018).
- Rodgers, G., et al. Virtual histology of an entire mouse brain from formalin fixation to paraffin embedding. Part 2: Volumetric strain fields and local contrast changes. Journal of Neuroscience Methods. 365, 109385(2022).
- Connolly, N. P., et al. Elevated fibroblast growth factor-inducible 14 expression transforms proneural-like gliomas into more aggressive and lethal brain cancer. GLIA. 69 (9), 2199-2214 (2021).
- Stall, B., et al. Comparison of T2 and FLAIR imaging for target delineation in high grade gliomas. Radiation Oncology. 5, 5(2010).
- Das, A., et al. Establishing a standardized method for the effective intraoperative collection and biological preservation of brain tumor tissue samples using a novel tissue preservation system: a pilot study. World Neurosurgery. , (2022).
- Zusman, E., et al. Tissues harvested using an automated surgical approach confirm molecular heterogeneity of Glioblastoma and enhance specimen's translational research value. Frontiers in Oncology. 9, (2019).
- McLaughlin, N., et al. Side-cutting aspiration device for endoscopic and microscopic tumor removal. Journal of Neurological Surgery Part B. 73 (1), 11-20 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved