Method Article
יישום כריתה זעיר פולשנית של גידולי מוח במכרסמים לאיסוף רקמות בעלות כדאיות גבוהה
In This Article
Summary
הפרוטוקול הנוכחי מתאר כריתה סטנדרטית של גידולי מוח במכרסמים באמצעות גישה זעיר פולשנית עם מערכת שימור רקמות משולבת. לטכניקה זו יש השלכות על שיקוף מדויק של סטנדרט הטיפול במכרסמים ובמודלים אחרים של בעלי חיים.
Abstract
הפרוטוקול הנוכחי מתאר פרדיגמה סטנדרטית לכריתת גידולי מוח של מכרסמים ושימור רקמות. בפרקטיקה הקלינית, כריתה מקסימלית של הגידול היא הטיפול הסטנדרטי עבור רוב גידולי המוח. עם זאת, רוב המודלים של גידולי מוח פרה-קליניים הזמינים כיום אינם כוללים כריתה, או משתמשים במודלים של כריתה כירורגית שגוזלים זמן רב ומובילים לתחלואה משמעותית לאחר הניתוח, לתמותה או לשונות ניסיונית. בנוסף, ביצוע כריתה במכרסמים יכול להיות מרתיע מכמה סיבות, כולל היעדר כלי ניתוח או פרוטוקולים דומים מבחינה קלינית והיעדר פלטפורמה מבוססת לאיסוף רקמות סטנדרטי. פרוטוקול זה מדגיש את השימוש בהתקן כריתה רב-תכליתי ולא אבלטיבי ובמערכת שימור רקמות משולבת המותאמת מהגרסה הקלינית של המכשיר. המכשיר שהופעל במחקר הנוכחי משלב יניקה הניתנת לכוונון ולהב גלילי בצמצם כדי לחקור, לחתוך ולינוק רקמות במדויק. מכשיר הכריתה הזעיר פולשני מבצע את תפקידיו דרך אותו חור בור המשמש להשתלת הגידול הראשונית. גישה זו ממזערת שינויים באנטומיה האזורית במהלך ניתוחי ביופסיה או כריתה ומפחיתה את הסיכון לאיבוד דם משמעותי. גורמים אלה הפחיתו באופן משמעותי את זמן הניתוח (<2 דקות/חיה), שיפרו את הישרדות בעלי החיים לאחר הניתוח, השתנות נמוכה יותר בקבוצות ניסוי, והביאו לכדאיות גבוהה של רקמות ותאים שנכרתו לניתוחים עתידיים. תהליך זה מתאפשר על ידי מהירות להב של ~ 1,400 מחזורים לדקה, המאפשרת קצירת רקמות למערכת סגורה סטרילית שניתן למלא בפתרון פיזיולוגי מועדף. בהתחשב בחשיבות המתפתחת של לימוד ומידול מדויק של ההשפעה של ניתוחים, שימור וניתוח השוואתי קפדני של דגימות כריתת גידולים אזוריות, וטיפולים תוך חלליים, פרוטוקול ייחודי זה ירחיב את ההזדמנויות לחקור שאלות ללא מענה על ניהול פריאופרטיבי וגילוי טיפולי עבור חולי גידולי מוח.
Introduction
גליובלסטומה (GBM) הוא גידול המוח הראשוני הנפוץ והאגרסיבי ביותר במבוגרים. למרות ההתקדמות האחרונה בתחום הנוירוכירורגיה, פיתוח תרופות ממוקדות מטרה וטיפול בהקרנות, שיעור ההישרדות של 5 שנים עבור חולי GBM הוא פחות מ -5%, נתון שלא השתפר באופן משמעותי במשך יותר משלושה עשורים1. לפיכך, יש צורך באסטרטגיות טיפול יעילות יותר.
כדי לפתח טיפולים חדשים, מתברר יותר ויותר כי פרוטוקולים ניסיוניים צריכים (1) להשתמש במודלים פרה-קליניים הניתנים לתרגום המשחזרים במדויק את ההטרוגניות והמיקרו-סביבה של הגידול, (2) לשקף את משטר הטיפול הסטנדרטי המשמש בחולים עם GBM, הכולל כיום ניתוח, הקרנות וכימותרפיה, ו-(3) להסביר את ההבדל בין ליבה כרתית לשארית, רקמות גידול פולשניות 2,3,4,5. עם זאת, רוב המודלים של גידולי מוח פרה-קליניים הזמינים כיום אינם מיישמים כריתה כירורגית או משתמשים במודלים של כריתה כירורגית שגוזלים זמן רב יחסית, מה שמוביל לכמות משמעותית של איבוד דם או לחוסר סטנדרטיזציה. יתר על כן, ביצוע כריתה של גידולי מוח מכרסמים יכול להיות מאתגר בשל היעדר כלי ניתוח או פרוטוקולים דומים מבחינה קלינית והיעדר פלטפורמה מבוססת6 לאיסוף רקמות שיטתי (טבלה 1).
הפרוטוקול הנוכחי נועד לתאר פרדיגמה מתוקננת לכריתת גידולי מוח של מכרסמים ושימור רקמות באמצעות מערכת כריתה זעיר פולשנית זעיר פולשנית רב-תפקודית (MIRS) ומערכת שימור רקמות משולבת (TPS) (איור 1). צפוי כי טכניקה ייחודית זו תספק פלטפורמה סטנדרטית שניתן להשתמש בה במחקרים שונים במחקרים פרה-קליניים עבור GBM וסוגים אחרים של מודלים של גידולי מוח. חוקרים החוקרים שיטות טיפוליות או אבחוניות לגידולי מוח יכולים ליישם פרוטוקול זה כדי להשיג כריתה סטנדרטית במחקריהם.
Protocol
כל המחקרים בבעלי חיים אושרו על ידי אוניברסיטת מרילנד והוועדה המוסדית לטיפול ושימוש בבעלי חיים של אוניברסיטת ג'ונס הופקינס. C57BL/6 נקבות עכברים, בנות 6-8 שבועות, שימשו למחקר הנוכחי. העכברים התקבלו ממקורות מסחריים (ראו טבלת חומרים). כל תקנות הבטיחות הביולוגית ברמה 2 (BSL-2) בוצעו, כולל שימוש במסכות, כפפות ושמלות.
1. השתלת גידול תוך גולגולתי ראשונית
- בשלב הראשוני של המחקר, הזריקו תוך גולגולתי לכל עכבר 100,000 תאים (GL261 קו תאי גליומה מורין) התלויים ב-4 μL של תמיסת מלח עם אגירת פוספטים (1x PBS) לעומק של 2.5 מ"מ בעקבות הדו"חשפורסם קודם לכן 7.
- כימות אות הגידול בכל עכבר באמצעות מערכת ההדמיה in vivo 8 9 ימים לאחר השתלת הגידול.
הערה: במידת הצורך, חלקו את העכברים לשתי קבוצות על פי עומס הגידול. במחקר הנוכחי, שתי הקבוצות היו: (1) עכברים עם עומס גידול קטן יחסית (אות ביולומינסנטי ממוצע = 5.5e+006 ± 0.1e+006 פוטונים/s, n = 10) ו-(2) עכברים עם עומס גידול גדול יחסית (אות ביולומינסנטי ממוצע = 1.69e+007 ± 0.2e+007 פוטונים/s, n = 10), (p < 0.05, מבחן מאן-וויטני)9. - חלקו כל קבוצה לשתי תת-קבוצות דומות.
הערה: במחקר זה, שתי תת-הקבוצות היו: עכברים לא מטופלים (n = 5) ועכברים עם גידולים שעברו כריתה כירורגית באמצעות MIRS (n = 5), (p > 0.05, מבחן מאן-וויטני)9. - החל מיום הכריתה, עקבו אחר התקדמות הגידול באמצעות מערכת ההדמיה in vivo בתדירות המבוססת על דפוס צמיחת הגידול.
הערה: עבור קו התאים GL261, עקוב אחר התקדמות הגידול ביום הכריתה ולאחר מכן כל 3-6 ימים.
2. כריתת הגידול באמצעות מירס
- הרדמת העכבר באמצעות תערובת גזים איזופלורן-O2 בתא אינדוקציה או הזרקה תוך-צפקית של תמיסת קסילזין/קטמין.
- אם משתמשים בהרדמת הגז, הגדירו את קצב זרימת הגז ל-1.0 מ"ל/דקה ואת מכשיר האידוי ל-2.0% להשראת הרדמה, הדורשת בדרך כלל 3-5 דקות בתא (ראו טבלת חומרים).
- אם משתמשים בחומר ההרדמה הניתן להזרקה, מרדימים את העכברים על ידי הזרקת 0.2 מ"ל של תמיסת הרדמה (80-100 מ"ג/ק"ג קטמין ו-10-12.5 מ"ג/ק"ג של קסילזין, ראו טבלת חומרים) באופן תוך-צפקי.
- להעריך את החיה עבור הרגעה נאותה על ידי צביטה של הבוהן. החל משחה אופטלמית על העיניים כדי למנוע יובש של הקרנית. מתן משכך כאבים (0.03-0.06 מ"ג / ק"ג buprenorphine תת עורית) לפני ההליך.
- הנח את העכבר על המסגרת הסטריאוטקטית (ראה טבלת חומרים) לאחר אישור טשטוש מלא.
הערה: אם משתמשים בהרדמת גז, הניחו את אפו של העכבר בתוך חרוט אף, שם הוא ימשיך לקבל את תערובת האיזופלורן-O2 במהלך ההליך (1.5%). - הסר את הסיכות הקודמות, ולאחר מכן הסר את השיער עם קרם דפילציה או על ידי גילוח. יש לחטא את העור במחזורים מתחלפים של פילינג על בסיס כלורהקסידין/בטאדין ואלכוהול. לאחר מכן, באמצעות אזמל סטרילי, יש ליצור חתך קו אמצע אורכי של 1 ס"מ לאורך הצלקת הניתוחית הקודמת.
- חברו את ידית ה-MIRS לזרוע הסטריאוטקטית דרך מתאם הבמה/מחזיק הידית ליציבות ודיוק משופרים.
- הגדר את מכונת MIRS (ראה טבלת חומרים) באמצעות ההגדרות הבאות (איור 1).
- הכנס את כבל החשמל שנקבע בלוח האחורי לכלי הקיבול של כבל החשמל. הפעל או כבה את אספקת החשמל למערכת על-ידי מעבר למצב (1 = מופעל, 0 = כבוי).
- הכנס קצה אחד של צינור החנקן (המסופק עם הקונסולה) לתוך ההתאמה הגברית בלוח האחורי של הקונסולה. סובב את אום החיבור בכיוון השעון כדי להדק את החיבור.
הערה: הקצה הנגדי של הצינור צריך להיות מחובר לאספקת החנקן. - לפני חיבור הצינור לאספקת החנקן, ודא כי לחץ האספקה אינו עולה על 100 psig, שהוא לחץ אספקת הקלט המומלץ עבור הקונסולה.
הערה: הקונסולה תיצור שאיפה משלה כאשר היא מופעלת על ידי דוושת הרגל לאחר שהחנקן סופק לקונסולה. - אבטחו את המכסה של יציאת הוואקום ואטמו אותו כדי למנוע דליפה במערכת הוואקום. כל דליפה במערכת השאיפה תשפיע על הביצועים של קונסולת מירס.
- אם השאיפה נמוכה מ-17 במהלך ההתקנה או ההדבקה, בדוק שידית השאיפה בחזית הקונסולה מוגדרת ברמה המרבית (100), ודא שאין דליפה במערכת השאיפה, וודא שלחץ אספקת קלט החנקן נכון.
- כדי לחבר את דוושת הרגל לקונסולה, הכנס את מחבר דוושת הרגל האפורה לכלי הקיבול האפור שלו עד שהוא ילחץ ויתאים למקומו.
הערה: מחבר דוושת הרגל מתחבר לקונסולה בכיוון אחד, והוא ממוקלד. - כדי לחבר את הידית לקונסולה, הכנס את מחבר הידית הכחולה לכלי הקיבול הכחול שלה עד שהוא ילחץ ויתאים למקומו.
הערה: מחבר הידית מתחבר לקונסולה בכיוון אחד, והוא מוקלד. - הכינו כל ידית לפני השימוש במערכת על ידי שאיפת נוזל סטרילי מקערה קטנה לתוך הפתח, דרך הצינורות והידית, ולאחר מכן לתוך המכל כדי להבטיח שהחלק הפנימי של הצינור והידית משומנים כדי להפחית את חסימות הרקמות.
- התכונן לשאיפה בלבד או לשאיפה עם חיתוך על ידי בחירת המצב המתאים בלוח הקדמי של הקונסולה. התחל באמצעות דוושת כף הרגל.
- הכנס את צינורית 23 G MIRS לתוך חור הבור לעומק של 2.5 מ"מ.
- התחל את תהליך הכריתה על ידי לחיצה על דוושת כף הרגל המחוברת לצינורית. בצע מחזור מלא אחד (360°) או יותר של כריתה באמצעות ידית הבקרה בידית.
הערה: ככל שבוצעו יותר מחזורים, כך נפח גדול יותר של רקמת הגידול נכרת. - לאחר השלמת תהליך הכריתה, משכו את צינורית 23 G MIRS מחור הבור והשתמשו ב-5 מ"ל של PBS 1x כדי לשטוף את הצינורות ולהיפטר מכל שאריות הפסולת.
- הסר את העכבר מהמסגרת הסטריאוטקטית וסגור את הפצע באמצעות מהדק או חומר תפירה 4-0 (ראה טבלת חומרים).
- הניחו את העכבר על כרית חימום או תחת אור מחמם במהלך ההתאוששות מההרדמה לפני שתחזירו לכלוב שלו.
- לאחר סיום הניסוי, יש לטהר את הצינורית באמצעות שטיפה. החליפו עם מדיה צוננת ואוויר כדי "לדחוף" את כל הרקמה שנכרתה בחזרה למכל האיסוף. הסר את מכל האיסוף מהמערכת וסגור את המכסה עם המכסה שסופק.
- לאחר השלמת שלב 2.12, מניחים את הקצה הדיסטלי של הצינורית לתוך 3% H 2O2 ומורחים יניקה ב 24-25 ב Hg כדי למלא את קו היניקה בחזרה למכל איסוף היניקה ולתת לעמוד במשך 60-90 שניות. יש לשטוף עם מדיה סטרילית הפועמת באוויר ובמדיה לסירוגין.
- עקוב אחר העכברים אחר סימנים נוירולוגיים (תנועות לא סדירות חריגות או התקפים) לאחר ההליך.
- להרדים את העכברים עם ליקויים נוירולוגיים חמורים (להיות רדומים, יש מראה כחוש, מחובק לאחור, או יש תנועות לא יציבות).
הערה: במחקר הנוכחי, נעשה שימוש ב-200 מ"ג/ק"ג של תמיסת המתת חסד מסחרית (ראו טבלת חומרים) כדי להרדים כל עכבר.
3. איסוף רקמות באמצעות TPS
- לטבול את דגימת הגידול בצלחת תרבית רקמה המכילה מדיום ליזה RBC (ראו טבלת חומרים) למשך 5 דקות בטמפרטורת החדר.
הערה: הרקמה שנקטפה מהמירס לתוך התב"ע תהיה בעיקר בצורה של תאים בודדים יחד עם גושי רקמה קטנים. - מניחים מסנן של 70 מיקרומטר (ראו טבלת חומרים) על צינור חרוטי של 50 מ"ל ומשתמשים בבוכנה של מזרק 5 מ"ל כדי להעביר את דגימת הגידול דרך המסנן.
- עם פיפטה העברה, השתמש במדיה RPMI-1640 כדי להקל על מעבר של תאים וכל מסת רקמה דרך המסנן.
- צנטריפוגה ב 428 x גרם במשך 5 דקות ב 4 מעלות צלזיוס. השליכו את הסופר-נאטנט על ידי פיפטה.
- יש להשעות כל דגימה ב-5 מ"ל של מדיום RPMI-1640 מוכן.
- כדי להגדיל את כדאיות הרקמות, במיוחד אם מדמיינים גושי רקמה גדולים ברושם הראשוני, הוסיפו את הנפחים הנדרשים של קוקטייל האנזים (המכיל DNAse I, collagenase IV, dispase, Papain ו-EDTA, ראו טבלת חומרים) לכל דגימה. השתמש במערבולת כדי לערבב את הפתרונות.
הערה: שלב 3.6 הוא אופציונלי. הרכב קוקטייל האנזים (בנפח כולל של 5 מ"ל/דגימה): 300 μL של DNAse I דרגה II, 150 μL של קולגןאז/Dispase (פיברונקטין קליפס, קולגן IV, I, וחומצות אמינו לא קוטביות), 250 μL של פפאין (פרוטאז לא ספציפי), ו-6 μL של 0.5 M EDTA. - מניחים את הדגימות באינקובטור שייקר שנקבע ב-200 סל"ד, 37 מעלות צלזיוס למשך 20 דקות.
- לאחר 20 דקות, סובב את הדגימות ב 428 x g במשך 5 דקות ב 4 מעלות צלזיוס. השליכו את הסופר-נטנט.
- סנן תאים בודדים דרך מסננת תאים של 70 מיקרומטר והסתובב כלפי מטה ב-274 x g למשך 3 דקות ב-4 מעלות צלזיוס. בצע ניתוח כדאיות תאים10 עם טריפאן כחול והמוציטומטר (ראה טבלת חומרים).
הערה: הכדאיות ביום 0 נעה בין 30%-70% ועולה משמעותית תוך 2-3 ימים. - המשך לשלבים 4, 5 או 6, בהתאם לבדיקת הכדאיות הדרושה.
4. גידול תאים בתרבית דבק
- במכסה מנוע זרימה למינרית מאושר, יש להשעות את הכדור במדיום דבק המכיל סרום (כגון DMEM, 10% סרום בקר עוברי (FBS) ותמיסת פניצילין/סטרפטומיצין (P/S) של 1% פניצילין) ותאי צלחת בבקבוק תאים דבק.
- לשמור על התאים בסביבה דגירה מבוקרת (37 מעלות צלזיוס, 5% CO2).
5. גידול תאים בתרבית השעיה (נוירוספרות)
- במכסה מנוע זרימה למינרית מאושר, יש לתלות מחדש את הכדור בתא גזע שלם ללא סרוםבינוני 11 וצלחת בבקבוק תלייה.
- לשמור על התאים בסביבה דגירה מבוקרת (37 מעלות צלזיוס, 5% CO 2) במשך2-3 ימים כדי לאפשר היווצרות נוירוספרה.
- לאחר הדמיה של הנוירוספרות במדיום התרבית, השתמש בטריפסין-EDTA או Accutase (ראה טבלת חומרים) כדי להשיג תרחיפים חד-תאיים לצורך מעבר.
הערה: כל עוד ננקטת זהירות מיוחדת במהלך הקציר ונעשה שימוש במדיה מתאימה התומכת בתאי גזע עצביים, תאי הגזע ברקמה שנקטפה חייבים ליצור נוירוספרות תוך מספר ימים.
6. הכנת תאים להשתלה מחדש
- יש להשעות את הכדור בריכוז של 100,000 תאים חיים לכל 4 μL של PBS אחד.
- יש להזריק מיד לעכברים תמימים בשיטת השתלת הגידול התוך גולגולתי (שלב 1).
7. ניתוח היסטולוגי
- מיד לאחר הכריתה, חלצו וקבעו את המוחות ב-4% פרפורמלדהיד (PFA) למשך 24 שעות12.
- מעבירים את המוחות לתמיסת סוכרוז של 30% עד שהם רוויים בסוכרוז (שקוע עד לתחתית המיכל).
- להעביר את המוח לתמיסת אתנול של 70%.
- בצע הטמעת בלוק פרפין, חתך, והכתמה סטנדרטית של המטוקסילין ואאוסין (H&E) בעקבות דו"ח13 שפורסם בעבר.
הערה: העובי של כל מקטע שנלקח להכתמה היה 10 מיקרומטר.
תוצאות
כריתה כירורגית באמצעות המירס מביאה לירידה משמעותית בנטל הגידול
בקבוצה עם עומס גידול קטן יותר, האות הביולומינסנטי הבסיסי הממוצע היה 5.5e+006 פוטונים/שנייה ± 0.2e+006 בתת-הקבוצה שעברה כריתה. לאחר כריתה, האות הביולומינסנטי הממוצע ירד ל-3.09e+006 פוטונים/שנייה ± 0.3e+006, (p <0.0001, מבחן מאן-וויטני)9 (איור 2). האות הביולומינסנטי עלה בימים שלאחר מכן עד שהעכברים הומתו. באופן דומה, בקבוצה עם עומס גידול גדול יותר, האות הביולומינסנטי הבסיסי הממוצע היה 1.68e+007 פוטונים/שניה ± 0.1e+007 בתת-הקבוצה שעברה כריתה. לאחר כריתה, האות הביולומינסנטי הממוצע ירד ל-5.19e+006 פוטונים/שנייה ± 0.2e+006, (p <0.0001, מבחן מאן-וויטני)9. האות הביולומינסנטי עלה בימים שלאחר מכן עד שהעכברים הומתו.
ניתן להתאים כריתה באמצעות MIRS לנפח הכריתה הרצוי
בהדמיה טרום כריתה של גידולי CT2A סינגנטיים, ניתן לזהות את הגידול באופן כללי כמסה הטרוגנית באתר החיסון עם ארכיטקטורה פרנכימלית משובשת ובצקת פריטומורלית ודימום המסומנים על ידי אזורים הטרוגניים של תת-עוצמה והיפר-עוצמה משוקללת T2 (T2w). ניתן לזהות את מסלול המחט המשמש להזרקת תאי גידול סטריאוטקטיים בסריקות MRIT2w 14.
ניתן לזהות את חלל הכריתה בסריקות MRI T2w שלאחר הכריתה כאזור היפו-אינטנסיבי עגול גדול באתר החיסון של הגידול (איור 3). הליך הכריתה לא גרם לאיבוד דם משמעותי או להפרעה בארכיטקטורת המוח שמסביב. במקרים מסוימים, נוזל הצטבר בחלל הכריתה. כפי שניתן לראות באיור 4, נפח הכריתה גדל באופן משמעותי מ-9.4 מ"מ 3 עבור סיבוב אחד של מפתח החיתוך ל-23.2 מ"מ3 עבור שני סיבובים (p = 0.0117), מה שמאפשר התאמה של כריתת נפח כדי לייעל את נטל הגידול הידוע.
כריתת הגידול באמצעות ה- MIRS מובילה להארכה של 7 ימים בהישרדות החציונית של עכברים נושאי גידול ללא גרימת סימנים נוירולוגיים כלשהם
כפי שניתן לראות באיור 5, הייתה התארכות בהישרדותם של עכברים שעברו כריתה כירורגית בשתי הקבוצות עם גידולים קטנים (6 ימים) וגדולים (7 ימים). בקבוצה עם נטל גידול קטן יותר, ההישרדות החציונית של תת-קבוצת הביקורת הייתה 16 ימים, ואילו ההישרדות החציונית של תת-הקבוצה שעברה כריתה הייתה 22 יום (p = 0.0044). באופן דומה, בקבוצה עם נטל גידול גדול יותר, ההישרדות החציונית של תת-קבוצת הביקורת הייתה 12 יום, ואילו ההישרדות החציונית של תת-הקבוצה שעברה כריתה הייתה 19 ימים (p = 0.0043). בנוסף, אף אחד מהעכברים שעברו כריתה באמצעות MIRS לא הראה שום סימן לפגיעה נוירולוגית לאחר ההליך. זה מצביע על כך שה- MIRS יכול להשיג כריתה בטוחה.
לרקמה שנכרתה באמצעות ה- MIRS יש כדאיות גבוהה במבחנה וב- in vivo
תאים שחולצו מהרקמה שנכרתה סוננו, כומתו ועברו החייאה במדיום המתאים (איור 6) לפני שערכו ניסויי קיום במבחנה או in vivo . כדי לבחון את הכדאיות במבחנה של התאים ולאשר כריתה של הגידול ולא של פרנכימה מוחית תקינה, גידלו תאים בתרבית תרחיף. היווצרות נוירוספרה, אינדיקטור לפוטנציאל התחלת הגידול, התרחשה עם עיבוד רקמות מינימלי לאחר כריתה. זה הציע שפלטפורמת MIRS קצרה רקמה מנותקת היטב והייתה לה השפעה מינימלית על הבריאות והכדאיות של הרקמה שנכרתה. דגימות שנלקחו היישר מה-TPS למיקרוסקופיה קלה נראו בעיקר בצורה של תאים בודדים יחד עם נוכחות של כמה גושי רקמה קטנים. הכדאיות ביום 0 נעה בין 30%-70% (נתון זה מייצג את הכדאיות לאחר העברת הדגימה דרך מסנן של 70 מיקרומטר ולפני הציפוי). למכשיר הכריתה יש מפתח צמצם חיתוך שיכול להסתובב 360° על ציר בדיקת הכריתה, מה שמאפשר כריתה של נפחי רקמה קונצנטריים. בממוצע, ניתן לקצור 2-3 מיליון תאים עם סיבוב אחד של 360° של מפתח החיתוך, כ-7 מיליון תאים עם שני סיבובים, ובסך הכל ניתן להשיג 12-14 מיליון תאים עם שלושה סיבובים של 360° של מפתח החיתוך. לאחר ציפוי צלוחיות תרחיף המכילות מדיום שלם של תאי גזע ללא סרום, נוירוספרות נראו על-ידי מיקרוסקופיית אור ביום 2 ובעין בלתי על-ידי יום 7 (איור 7).
כדי לבחון את הכדאיות של in vivo , התאים שחולצו הושתלו תוך גולגולתי בעכברי C57BL/6 נאיביים (n = 8 עכברים, 100,000 תאים חיים/עכבר). צמיחת הגידול אושרה באמצעות מערכת ההדמיה in vivo . אות הגידול המשיך לגדול עד שכל בעלי החיים הומתו ביום 14 לאחר ההשתלה של הגידול (הישרדות חציונית של 11 יום).
מקטע רקמת H&E המייצג (איור 3B) מכיל חלל כריתה עגול ושקוף עם שפה של מוצרי דם (ורוד עמוק), דלקת ותאי גידול שיוריים (תאים סגולים כהים). מבחינה מקרוסקופית, תאי הגידול הנותרים הם מזנכימליים באופיים ומסתננים, ומציגים פלישה פריווסקולרית נרחבת והתפשטות. באופן מיקרוסקופי זוהו אטיפיה גרעינית מסומנת ודמויות מיטוטיות. מקרופאגים הקשורים לגידול זוהו גם באזורים של רקמות אוטמות ומיקרו-דימומים. נראה כי ארכיטקטורת הרקמות בפרנכימה המוחית שמסביב לא הופרעה.

איור 1: הגדרת מערכת MIRS. (A) מערכת כריתה זעיר פולשנית (MIRS) לגידול במוח במודלים של מכרסמים עם מערכת שימור רקמות משולבת. (B) הלוח הקדמי של קונסולת MIRS. 1 = כוח מערכת, 2 = דוושת רגל, 3 = לחצן ראשוני, 4 = שאיפה, 5 = חוגת בקרת רמת שאיפה, 6 = מחוון רמת שאיפה, 7 = ידית, 8 = לחצן הפעלה חותך. (C) לוח אחורי של קונסולת מירס. 1 = כלי קיבול לכבל חשמל, 2 = מפסק, 3 = כניסת אספקת חנקן. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: שינויים בעומס הגידול הממוצע בעכברים עם גידולים לא מטופלים לעומת עכברים שעברו כריתה של גידולים על ידי MIRS . (A) עכברים עם עומס גידול בסיסי קטן ו-(B) עכברים עם עומס גידול בסיסי גדול (p < 0.0001, SD ≤0.3e+006 בכל הקבוצות בכל נקודת זמן וקטן מכדי להיות מוצג בגרף). בעלי חיים נכנעו לנטל הגידול או שהומתו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: ניתוח MRI ו-H&E. (A) תמונות MRI מוח משוקללות לפני ואחרי כריתת T2 ו-(B) מקטע מוח קורונלי מייצג המוכתם ב-H&E מראה חלל כריתה ברור ועגול עם שפה של מוצרי דם (ורוד עמוק), דלקת ותאי גידול שיוריים (תאים סגולים כהים). תמונות MRI וקטעי H&E התקבלו מיד לאחר הכריתה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: קביעת נפח כריתת הגידול. הנפחים הממוצעים המחושבים מתמונות MRI של חללי כריתה שנוצרו עם אחד לעומת אחד. שני סיבובים של מפתח החיתוך, n = 4 לכל קבוצה. p = 0.01, מבחן T דו-זנב. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: עקומות קפלן-מאייר של עכברים עם גידולים לא מטופלים לעומת עכברים שעברו כריתה של גידולים על ידי MIRS . (A) עכברים עם עומס גידול בסיסי קטן. (B) עכברים עם עומס גידול בסיסי גדול. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: בדיקת הכדאיות של תאי הגידול שנכרתו . (A) תמונות מיקרוסקופיית אור מייצגות של רקמות שנקטפו עם מירס ביום 0 בשעה 20x. (B) עקומת קפלן-מאייר המתארת הישרדות של עכברים לאחר השתלה תוך גולגולתית של תאים שנקטפו מרקמה שנכרתה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
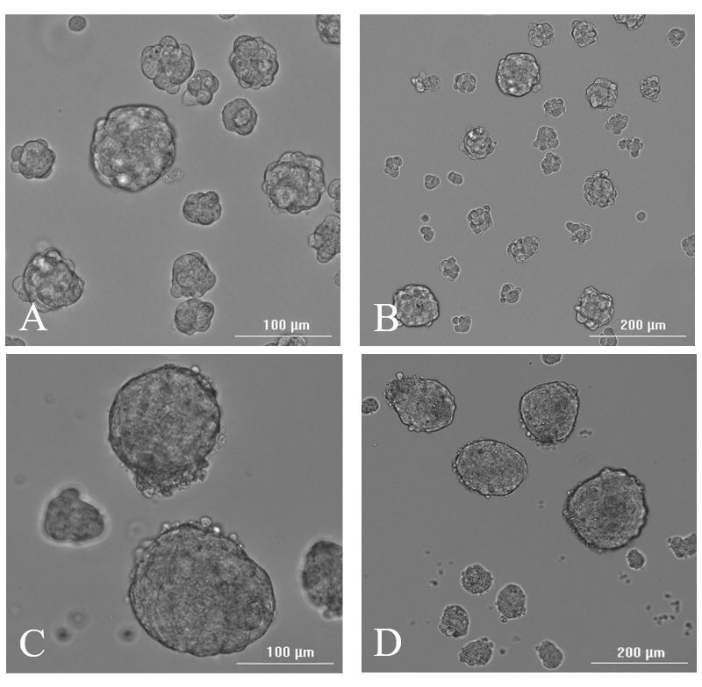
איור 7: היווצרות נוירוספרות. תמונות מיקרוסקופיות אור מייצגות של נוירוספרות שנוצרו מרקמה שנכרתה ביום 2 לאחר כריתה ב-(A) 20x ו-(B) 10x, וביום 7 לאחר כריתה ב-(C) 20x ו-(D) 10x. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| מערכת כריתה זעיר פולשנית | כריתה היסטורית | |||
| זמן ומיומנויות אופרטיביות | זמן הפעלה מינימלי (<2 דקות לכל חיה). יש צורך בכישורים מינימליים. | זמן הניתוח אינו סטנדרטי וניסיון כירורגי עם בעלי חיים קטנים ומיקרו-כירורגיה מועיל. | ||
| איבוד דם | מינימלי | בלתי צפוי | ||
| נפח סטנדרטי של כריתה | נפח הכריתה נקבע/מותאם על-ידי מספר הסיבובים של כלי הכריתה | הנפח משתנה מאוד בין הנושאים | ||
טבלה 1: השוואה בין מערכת הכריתה הזעיר פולשנית (MIRS) לבין מודלים היסטוריים של כריתה כירורגית.
Discussion
כריתת גידולים היא אבן פינה בתוכניות טיפול אונקולוגיות נוירוכירורגיות עבור גידולי מוח בדרגה נמוכה וגבוהה. ציטו-הפחתה והתפוררות של הגידול מתואמות עם שיפור בתפקוד הנוירולוגי והישרדות כללית בחולים עם גידולי מוח 1,2,5,6. למרות שפרוטוקולים לכריתה כירורגית תוארו בעבר במודלים של מכרסמים, פרוטוקולים אלה סבלו ממספר מגבלות שיכולות לבלבל את התוצאות שנוצרו ואת יכולת התרגום הכוללת של המודל הפרה-קליני. לדוגמה, פרוטוקולי כריתה כירורגית שדווחו בעבר כללו קרניוטומיה עם 3-4 חורי בור קטנים ליצירת דש עצם ולאחר מכן הבחנה מיומנת והבחנה של צבע הגידול ועקביותו בהשוואה לרקמת מוח רגילה6. פרוטוקולים אלה גוזלים זמן רב ודורשים מאנשי המחקר מיומנויות מתקדמות בשימוש במיקרוסקופ הכירורגי, טיפול במכשירי ניתוח, זיהוי גבולות הגידול הנוגעים לרקמת המוח התקינה שמסביב, והשגת הומאוסטזיס הולם. נהלים כאלה מובילים לעתים קרובות לאיבוד דם משמעותי ולמוות של בעלי חיים. בנוסף, זה יכול להיות מאתגר להשיג כריתה סטנדרטית עם נפחים דומים של רקמת גידול שנכרתה על פני בעלי חיים שונים באותו ניסוי. ההמשכיות והאחידות הזו הופכת למאתגרת יותר עם ריבוי אנשי צוות המבצעים את ההליך.
לעומת זאת, פרוטוקול MIRS המתואר כאן מסיר מגבלות אלה (טבלה 1). הפרוטוקול הנוכחי דורש גישה זעיר פולשנית דרך אותו חור בור המשמש להשתלה ראשונית של הגידול. כמפורט בסעיף הפרוטוקול, ניתן להתקין את כלי הכריתה על מסגרת סטריאוטקטית המאפשרת החדרה מדויקת של הצינורית לחלל הגידול. ניתן להתאים בקלות את מהירות הלהב ואת מספר מחזורי הכריתה שבוצעו באמצעות ידית המשמשת את אנשי המחקר כדי לשלוט בנפח הגידול שנכרת באופן סטנדרטי מבלי לגרום לכמות משמעותית של אובדן דם.
כפי שצוין בתוצאות, העכברים שעברו כריתה עם מכשיר MIRS הפגינו הישרדות ממושכת בהשוואה לקבוצה של עכברים עם גידולים שלא נותחו. עובדה זו, יחד עם הנתונים, מראה כי נטל הגידול הופחת באופן משמעותי בקבוצת הכריתות בהשוואה לקבוצת הביקורת שלא נותחה, מה שמצביע על כך שמכשיר ה-MIRS למעשה מחדיר את הגידול עם הפרעה מינימלית לרקמות המוח הבריאות שמסביב. יתר על כן, בימים שלאחר הכריתה, נטל הגידול התקדם בהתמדה בשל נוכחות של גידול שיורי ואת האופי המסתנן של קו תאי הגידול CT-2A. מודל MIRS יכול אפוא לשכפל את תהליך הפירוק של סוגי גידולים מסתננים, אשר ניתן לעקוב אחריו עם כימותרפיה או הקרנות כדי לשקף בצורה קרובה יותר את משטר הטיפול בפרוטוקולי טיפול בגידולי מוח אנושיים15,16,17.
כמו במקרה של כל מכשיר יניקה, סתימה של צינורות השאיפה יכולה להיות אחת המגבלות של מערכת מירס. זה יכול להתרחש עקב הצטברות של רקמה יבשה או דם במהלך או לאחר השימוש במכונה. כדי להימנע מכך, מיד בסוף כל סשן של כריתות, מומלץ לטהר את צינורית הידית על ידי שטיפה עם מדיה צוננת לסירוגין עם אוויר כדי "לדחוף" את כל הרקמה שנכרתה למכל האיסוף, ולאחר מכן שטיפה עם 3% H 2 O2. פעולה זו תתפוס את כל הרקמה שנרכשה במהלך הכריתה ותבטיח שאף אחת מהן לא תישאר בצינורית או בצינור. יתר על כן, אם המערכת אינה שואפת / חותכת, זה יכול להיות בגלל הידית אינה מחוברת לחשמל, חותך צינורית כריתה אינו מופעל, קו השאיפה מהקונסולה אינו מחובר למכל, מכסה המכל אינו הדוק, או שדוושת הרגל אינה מחוברת לחשמל.
בנוסף, בעוד שהראינו כי ניתן להשתמש ב- MIRS לכריתה יעילה וסטנדרטית עם כדאיות גבוהה במבחנה ו - in vivo של הרקמה הכרותה, מחקרים עתידיים מעודדים להמשיך ולחקור היבטים אחרים של יישום מערכות כאלה בחקר גידולי מוח. אלה כוללים בחינת ההשפעה של תהליך הכריתה על המרכיבים המולקולריים והתאיים של מסת הגידול ועל המיקרו-סביבה של הגידול. בנוסף, יש צורך במחקרים כדי לאשר כי הרקמה שנכרתה באמצעות מכשיר מירס משחזרת את הגידול ההורי15.
לסיכום, פרוטוקול של גישה זעיר פולשנית מתואר לכריתה כירורגית סטנדרטית במודל גידול מוח מכרסם בשילוב עם מערכת שימור רקמות משולבת ואוטומטית. פרוטוקול זה סולל את הדרך לביסוס מודלים תרגומיים מאוד של מחקר גידולי מוח פרה-קליניים ומנבאים. יישומים עתידיים של פרוטוקול זה עשויים לכלול מחקרים פרה-קליניים החוקרים שיטות טיפוליות או אבחוניות שונות עבור גידולי מוח אשר יכולים ליישם פרוטוקול זה כדי להשיג כריתה סטנדרטית.
Disclosures
ל-BT יש מימון מחקר מ-NIH והיא בעלים משותף של טיפולים משולבים מואצים*, ו-Ashvattha Therapeutics Inc. העניקה רישיון לאחד הפטנטים שלה. ל-GW יש מימון NIH (R01NS107813). HB הוא יועץ בתשלום ל-Insightec ויו"ר הוועדה המייעצת הרפואית של החברה. הסדר זה נבדק ואושר על ידי אוניברסיטת ג'ונס הופקינס בעקבות מדיניות ניגוד העניינים שלה. ל-HB יש מימון מחקר מ-NIH, אוניברסיטת ג'ונס הופקינס ופילנתרופיה, והוא יועץ ל-CraniUS, Candel Therepeutics, Inc., האצת טיפולים משולבים*, Catalio Nexus Fund II, LLC*, LikeMinds, Inc*, Galen Robotics, Inc.* ו-Nurami Medical*. (*כולל הון עצמי או אופציות).
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | BD | 309628 | |
| 15 mL conical tubes | Corning | 430052 | |
| 200 proof ethanol | PharmCo | 111000200 | |
| 5 mL pipettes | CoStar | 4487 | |
| 70 micron filter | Fisher | 08-771-2 | |
| Accutase | Millipore Sigma | SIG-SCR005 | |
| Anased (Xylazine injection, 100 mg/mL) | Covetrus | 33198 | |
| Anesthesia System | Patterson Scientific | 78935903 | |
| Anesthesic Gas Waste Container | Patterson Scientific | 78909457 | |
| Bench protector underpad | Covidien | 10328 | |
| C57Bl/6, 6-8 week old mice | Charles River Laboratories | Strain Code 027 | |
| ChroMini Pro | Moser | Type 1591-Q | |
| Collagenase-Dispase | Roche | #10269638001 | |
| Countess II Automated Cell Counter | Thermo Fisher | ||
| Countess II FL Hemacytometer | Thermo Fisher | A25750 | |
| Debris Removal Solution | Miltenyi Biotech | #130-109-398 | |
| D-Luciferin | Goldbio | LUCK-1G | |
| DMEM F12 media | Corning | 10-090-CV | |
| DMEM media | Corning | 10-013-CV | |
| DNAse I | Sigma Aldrich | #10104159001 | |
| Eppendorf tubes | Posi-Click | 1149K01 | |
| Euthanasia solution | Henry Schein | 71073 | |
| FBS | Millipore Sigma | F4135 | |
| Fetal Bovine Serum | Thermo Fisher | 10437-028 | |
| Formalin | Invitrogen | INV-28906 | |
| Gauze | Henry Schein | 101-4336 | |
| hEGF | PeproTech EC | 100-15 | |
| Heparin | Sigma | H-3149 | |
| hFGF-b | PeproTech EC | 1001-18B | |
| Induction Chamber | Patterson Scientific | 78933388 | |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Isoflurane Vaporizer | Patterson Scientific | 78916954 | |
| Ketamine | Covetrus | 11695-0703-1 | |
| Kopf Stereotactic frame | Kopf Instruments | 5001 | |
| Lightfield Microscope | BioTek | Cytation 5 | |
| Microinjection Unit | Kopf | 5001 | |
| Micromotor drill | Foredom | F210418 | |
| MRI system | Bruker | 7T Biospec Avance III MRI Scanner | |
| NICO Myriad System | NICO Corporation | ||
| Ophthalmic ointment | Puralube vet ointment | ||
| Papain | Sigma Aldrich | #P4762 | |
| PBS | Invitrogen | #14190250 | |
| PenStrep | Millipore Sigma | N1638 | |
| Percoll solution | Sigma Aldrich | #P4937 | |
| Pipette controller | Falcon | A07260 | |
| Povidone-iodine solution | Aplicare | 52380-1905-08 | |
| Progesterone | Sigma | P-8783 | |
| Putrescine | Sigma | P-5780 | |
| RPMI Media | Invitrogen | INV-72400120 | |
| Scalpel blade | Covetrus | 7319 | |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Skin marker | Time Out | D538,851 | |
| Staple remover | MikRon | ACR9MM | |
| Stapler | MikRon | ACA9MM | |
| Staples | Clay Adams | 427631 | |
| Stereotactic Frame | Kopf Instruments | 5000 | |
| Sucrose | Sigma Aldrich | S9378 | |
| Suture, vicryl 4-0 | Ethicon | J494H | |
| T-75 culture flask | Sarstedt | 83-3911-002 | |
| TheraPEAKTM ACK Lysing Buffer (1x) | Lonza | BP10-548E | |
| Trypsin-EDTA | Corning | MDT-25-053-CI |
References
- Mineo, J. F., et al. Prognosis factors of survival time in patients with glioblastoma multiforme: a multivariate analysis of 340 patients. Acta Neurochirurgica. 149 (3), 245-252 (2007).
- Miyai, M., et al. Current trends in mouse models of glioblastoma. Journal of Neuro-Oncology. 135 (3), 423-432 (2017).
- Raj, D., Agrawal, P., Gaitsch, H., Wicks, E., Tyler, B. Pharmacological strategies for improving the prognosis of glioblastoma. Expert Opinion on Pharmacotherapy. 22 (15), 2019-2031 (2021).
- Alomari, S., et al. Drug repurposing for Glioblastoma and current advances in drug delivery-a comprehensive review of the literature. Biomolecules. 11 (12), 1870(2021).
- Serra, R., et al. Combined intracranial Acriflavine, temozolomide and radiation extends survival in a rat glioma model. European Journal of Pharmaceutics and Biopharmaceutics : Official Journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik eV. 170, 179-186 (2022).
- Tang, B., Foss, K., Lichtor, T., Phillips, H., Roy, E. Resection of orthotopic murine brain glioma. Neuroimmunology and Neuroinflammation. 8 (1), 64-69 (2021).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of Visualized Experiments. (41), e1986(2010).
- Poussard, A., et al. In vivo imaging systems (IVIS) detection of a neuro-invasive encephalitic virus. Journal of Visualized Experiments. (70), e4429(2012).
- Lachin, J. M. Nonparametric statistical analysis. JAMA. 323 (20), 2080-2081 (2020).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods in Molecular Biology. 740, 7-12 (2011).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Flow cytometry-based drug screening system for the identification of small molecules that promote cellular differentiation of Glioblastoma stem cells. Journal of Visualized Experiments. (131), e56176(2018).
- Rodgers, G., et al. Virtual histology of an entire mouse brain from formalin fixation to paraffin embedding. Part 2: Volumetric strain fields and local contrast changes. Journal of Neuroscience Methods. 365, 109385(2022).
- Connolly, N. P., et al. Elevated fibroblast growth factor-inducible 14 expression transforms proneural-like gliomas into more aggressive and lethal brain cancer. GLIA. 69 (9), 2199-2214 (2021).
- Stall, B., et al. Comparison of T2 and FLAIR imaging for target delineation in high grade gliomas. Radiation Oncology. 5, 5(2010).
- Das, A., et al. Establishing a standardized method for the effective intraoperative collection and biological preservation of brain tumor tissue samples using a novel tissue preservation system: a pilot study. World Neurosurgery. , (2022).
- Zusman, E., et al. Tissues harvested using an automated surgical approach confirm molecular heterogeneity of Glioblastoma and enhance specimen's translational research value. Frontiers in Oncology. 9, (2019).
- McLaughlin, N., et al. Side-cutting aspiration device for endoscopic and microscopic tumor removal. Journal of Neurological Surgery Part B. 73 (1), 11-20 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved