Method Article
Реализация минимально инвазивной резекции опухоли головного мозга у грызунов для сбора тканей высокой жизнеспособности
В этой статье
Резюме
Настоящий протокол описывает стандартизированную резекцию опухолей головного мозга у грызунов с помощью минимально инвазивного подхода с интегрированной системой сохранения тканей. Этот метод имеет значение для точного отражения стандарта ухода за грызунами и другими моделями животных.
Аннотация
Настоящий протокол описывает стандартизированную парадигму резекции опухоли головного мозга грызунов и сохранения тканей. В клинической практике максимальная резекция опухоли является стандартом лечения большинства опухолей головного мозга. Однако большинство доступных в настоящее время доклинических моделей опухолей головного мозга либо не включают резекцию, либо используют хирургические модели резекции, которые отнимают много времени и приводят к значительной послеоперационной заболеваемости, смертности или экспериментальной вариабельности. Кроме того, выполнение резекции у грызунов может быть сложным по нескольким причинам, включая отсутствие клинически сопоставимых хирургических инструментов или протоколов и отсутствие установленной платформы для стандартизированного сбора тканей. Этот протокол подчеркивает использование многофункционального, неаблятивного резекционного устройства и интегрированной системы сохранения тканей, адаптированной из клинической версии устройства. Устройство, примененное в настоящем исследовании, сочетает в себе перестраиваемое всасывание и цилиндрическое лезвие в отверстии для точного зондирования, разрезания и всасывания ткани. Минимально инвазивное резекционное устройство выполняет свои функции через то же отверстие заусенца, которое использовалось для первоначальной имплантации опухоли. Такой подход сводит к минимуму изменения в региональной анатомии во время биопсии или резекционных операций и снижает риск значительной кровопотери. Эти факторы значительно сократили время операции (<2 мин / животное), улучшили послеоперационную выживаемость животных, снизили вариабельность в экспериментальных группах и привели к высокой жизнеспособности резецированных тканей и клеток для будущих анализов. Этому процессу способствует скорость лезвия ~ 1 400 циклов / мин, что позволяет собирать ткани в стерильную замкнутую систему, которая может быть заполнена физиологическим раствором по выбору. Учитывая растущую важность изучения и точного моделирования воздействия хирургии, сохранения и строгого сравнительного анализа регионализированных образцов резекции опухоли и внутриполостных терапевтических средств, этот уникальный протокол расширит возможности для изучения оставшихся без ответа вопросов о периоперационном лечении и терапевтическом открытии для пациентов с опухолями головного мозга.
Введение
Глиобластома (ГБМ) является наиболее распространенной и агрессивной первичной опухолью головного мозга у взрослых. Несмотря на недавние достижения в области нейрохирургии, разработки целевых лекарств и лучевой терапии, 5-летняя выживаемость пациентов с ГБМ составляет менее 5%, статистика, которая существенно не улучшилась за последние три десятилетия1. Следовательно, существует потребность в более эффективных стратегиях лечения.
Для разработки новых методов лечения становится все более очевидным, что протоколы исследований должны (1) использовать переводимые доклинические модели, которые точно повторяют гетерогенность опухоли и микроокружение, (2) отражать стандартный терапевтический режим, используемый у пациентов с ГБМ, который в настоящее время включает хирургию, лучевую терапию и химиотерапию, и (3) учитывать разницу между резецированным ядром и остатком, инвазивные опухолевые ткани 2,3,4,5. Тем не менее, большинство доступных в настоящее время доклинических моделей опухолей головного мозга либо не реализуют хирургическую резекцию, либо используют модели хирургической резекции, которые занимают относительно много времени, что приводит к значительной кровопотере или отсутствию стандартизации. Кроме того, выполнение резекции опухолей головного мозга грызунов может быть сложной задачей из-за отсутствия клинически сопоставимых хирургических инструментов или протоколов и отсутствия установленной платформы6 для систематического сбора тканей (таблица 1).
Настоящий протокол направлен на описание стандартизированной парадигмы резекции опухоли головного мозга грызунов и сохранения тканей с использованием многофункциональной неаблятивной минимально инвазивной резекционной системы (MIRS) и интегрированной системы сохранения тканей (TPS) (рисунок 1). Ожидается, что этот уникальный метод обеспечит стандартизированную платформу, которая может быть использована в различных исследованиях доклинических исследований для GBM и других типов моделей опухолей головного мозга. Исследователи, изучающие терапевтические или диагностические методы для опухолей головного мозга, могут реализовать этот протокол для достижения стандартизированной резекции в своих исследованиях.
протокол
Все исследования на животных были одобрены Университетом Мэриленда и Комитетом по институциональному уходу за животными и их использованию Университета Джона Хопкинса. Для настоящего исследования использовались самки мышей C57BL/6 в возрасте 6-8 недель. Мыши были получены из коммерческих источников (см. Таблицу материалов). Были соблюдены все правила уровня биобезопасности 2 (BSL-2), включая использование масок, перчаток и халатов.
1. Начальная имплантация внутричерепной опухоли
- На начальном этапе исследования интракраниально вводили каждой мыши 100 000 клеток (клеточная линия глиомы мыши GL261), взвешенных в 4 мкл фосфатно-буферного физиологического раствора (1x PBS) на глубину 2,5 мм после ранее опубликованного отчета7.
- Количественно оцените сигнал опухоли у каждой мыши с помощью системы визуализации in vivo через 8 9 дней после имплантации опухоли.
ПРИМЕЧАНИЕ: При необходимости стратифицируйте мышей на две группы в зависимости от опухолевой нагрузки. В настоящем исследовании двумя группами были: (1) мыши с относительно небольшой опухолевой нагрузкой (средний биолюминесцентный сигнал = 5,5e + 006 ± 0,1e + 006 фотонов / с, n = 10) и (2) мыши с относительно большой опухолевой нагрузкой (средний биолюминесцентный сигнал = 1,69e + 007 ± 0,2e + 007 фотонов / с, n = 10), (p < 0,05, тест Манна-Уитни)9. - Разделите каждую группу на две сопоставимые подгруппы.
ПРИМЕЧАНИЕ: В этом исследовании двумя подгруппами были: необработанные мыши (n = 5) и мыши с опухолями, подвергающимися хирургической резекции с использованием MIRS (n = 5), (p > 0,05, тест Манна-Уитни)9. - Начиная со дня резекции, отслеживайте прогрессирование опухоли с помощью системы визуализации in vivo с частотой, основанной на картине роста опухоли.
ПРИМЕЧАНИЕ: Для клеточной линии GL261 отслеживайте прогрессирование опухоли в день резекции, а затем каждые 3-6 дней.
2. Резекция опухоли с помощью MIRS
- Обезболивают мышь с помощью газовой смеси изофлурана-О2 в индукционной камере или внутрибрюшинной инъекции раствора ксилазина/кетамина.
- При использовании газового анестетика установите расход газа на 1,0 мл/мин, а испаритель на 2,0% для индукции анестезии, обычно требующей 3-5 мин в камере (см. Таблицу материалов).
- При использовании инъекционного анестетика обезболивают мышей путем введения 0,2 мл раствора анестетика (80-100 мг/кг кетамина и 10-12,5 мг/кг ксилазина, см. Таблицу материалов) внутрибрюшинно.
- Оцените животное для адекватной седации, зажав палец ноги. Нанесите офтальмологическую мазь на глаза, чтобы избежать сухости роговицы. Вводят анальгетик (0,03-0,06 мг/кг бупренорфина подкожно) перед процедурой.
- Поместите мышь на стереотаксическую рамку (см. Таблицу материалов) после подтверждения полной седации.
ПРИМЕЧАНИЕ: При использовании газового анестетика поместите нос мыши в носовой конус, где она будет продолжать получать смесь изофлуран-О2 во время процедуры (1,5%). - Удалите предыдущий штапель, затем удалите волосы либо кремом для депиляции, либо бритьем. Дезинфицируйте кожу чередующимися циклами скраба на основе хлоргексидина/бетадина и спирта. Затем, используя стерильный скальпель, создайте продольный разрез средней линии 1 см вдоль предыдущего хирургического рубца.
- Прикрепите наконечник MIRS к стереотаксическому кронштейну через адаптер сцены/держатель наконечника для повышения стабильности и точности.
- Настройте машину MIRS (см. Таблицу материалов), используя следующие настройки (рисунок 1).
- Вставьте кабель питания, установленный на задней панели, в розетку шнура питания. Включите или выключите питание системы путем переключения (1 = ВКЛ, 0 = ВЫКЛ).
- Вставьте один конец азотного шланга (входит в комплект поставки консоли) в штекерный фитинг на задней панели консоли. Поверните соединительную гайку по часовой стрелке, чтобы затянуть соединение.
ПРИМЕЧАНИЕ: Противоположный конец шланга должен быть подключен к подаче азота. - Перед подключением шланга к подаче азота убедитесь, что давление подачи не превышает 100 фунтов на квадратный дюйм, что является входным давлением подачи, рекомендуемым для консоли.
ПРИМЕЧАНИЕ: Консоль будет генерировать свою собственную аспирацию при активации ножной педалью после подачи азота на консоль. - Закрепите крышку вакуумного порта и закройте его, чтобы избежать утечки в вакуумной системе. Любые утечки в системе аспирации повлияют на производительность консоли MIRS.
- Если аспирация ниже 17 во время настройки или грунтовки, проверьте, что ручка аспирации на передней панели консоли установлена на максимальном уровне (100), убедитесь в отсутствии утечки в системе аспирации и убедитесь, что входное давление подачи азота правильное.
- Чтобы подключить ножную педаль к консоли, вставьте разъем серой ножной педали в ее серую розетку, пока она не щелкнет и не впишется в нужное положение.
ПРИМЕЧАНИЕ: Разъем ножной педали подключается к консоли в одной ориентации, и она имеет ключ. - Чтобы подключить наконечник к консоли, вставьте синий разъем наконечника в синюю розетку, пока он не щелкнет и не впишется в нужное положение.
ПРИМЕЧАНИЕ: Разъем наконечника подключается к консоли в одной ориентации, и он имеет ключ. - Загрунтуйте каждый наконечник перед использованием системы, аспирируя стерильную жидкость из небольшой чаши в отверстие, через трубку и наконечник, а затем в канистру, чтобы убедиться, что внутренняя часть трубки и наконечника смазаны для уменьшения окклюзии тканей.
- Подготовьтесь к аспирации в одиночку или аспирации с помощью резки, выбрав соответствующий режим на передней панели консоли. Инициируйте с помощью ножной педали.
- Вставьте канюлю 23 G MIRS в отверстие заусенца на глубину 2,5 мм.
- Инициируйте процесс резекции, нажимая на ножную педаль, соединенную с канюлей. Выполните один полный цикл (360°) или более резекции с помощью ручки управления в наконечнике.
ПРИМЕЧАНИЕ: Чем больше циклов выполняется, тем больший объем резецируется опухолевой тканью. - Как только процесс резекции будет завершен, извлеките канюлю 23 G MIRS из отверстия заусенца и используйте 5 мл 1x PBS для промывки трубки и вытеснения любого остаточного мусора.
- Извлеките мышь из стереотаксической рамки и закройте рану степлером или 4-0 шовным материалом (см. Таблицу материалов).
- Поместите мышь на грелку или под согревающий свет во время восстановления после анестезии, прежде чем вернуть ее в клетку.
- После завершения эксперимента очистите канюлю путем промывки. Чередуйте с охлажденными средами и воздухом, чтобы «протолкнуть» всю резецированную ткань обратно в канистру для сбора. Извлеките канистру для сбора из системы и снимите крышку с помощью прилагаемого колпачка.
- После завершения этапа 2.12 поместите дистальный наконечник канюли в 3%H2 O2и примените всасывание при 24-25 в Hg, чтобы заполнить всасывающую линию обратно в канистру для всасывания и дайте постоять в течение 60-90 с. Промывайте стерильными средами, пульсирующими воздухом и средами с перерывами.
- Следите за мышами на наличие любых неврологических признаков (аномальные неустойчивые движения или судороги) после процедуры.
- Усыпляйте мышей с тяжелыми неврологическими нарушениями (становятся вялыми, имеют изможденный вид, сгорбленную спину или имеют беспорядочные движения).
ПРИМЕЧАНИЕ: Для настоящего исследования для эвтаназии каждой мыши использовалось 200 мг/кг коммерчески доступного раствора для эвтаназии (см. Таблицу материалов).
3. Сбор тканей с помощью TPS
- Поместите образец опухоли в чашку для культивирования тканей, содержащую среду лизиса эритроцитов (см. Таблицу материалов) на 5 мин при комнатной температуре.
ПРИМЕЧАНИЕ: Ткань, собранная из MIRS в TPS, будет в основном в форме одиночных клеток вместе с небольшими кусками ткани. - Поместите фильтр 70 мкм (см. Таблицу материалов) на коническую трубку объемом 50 мл и используйте поршень шприца объемом 5 мл для пропускания образца опухоли через фильтр.
- С переносной пипеткой используйте среду RPMI-1640 для облегчения прохождения клеток и любой тканевой массы через фильтр.
- Центрифуга при 428 х г в течение 5 мин при 4 °C. Выбросьте супернатант пипеткой.
- Повторно суспендировать каждый образец в 5 мл подготовленной среды RPMI-1640.
- Чтобы повысить жизнеспособность тканей, особенно если большие куски ткани визуализируются при первоначальном впечатлении, добавьте необходимые объемы ферментного коктейля (содержащего DNAse I, коллагеназу IV, диспазу, папаин и ЭДТА, см. Таблицу материалов) к каждому образцу. Используйте вихрь для смешивания растворов.
ПРИМЕЧАНИЕ: Шаг 3.6 является необязательным. Состав ферментного коктейля (для общего объема 5 мл/образец): 300 мкл ДНКазы I степени II, 150 мкл коллагеназы/диспазы (расщепляет фибронектин, коллагеназу IV, I и неполярные аминокислоты), 250 мкл папаина (неспецифическая протеаза) и 6 мкл 0,5 М ЭДТА. - Поместите образцы в шейкер-инкубатор, установленный при 200 об/мин, 37 °C в течение 20 мин.
- Через 20 мин вращайте образцы при 428 х г в течение 5 мин при 4 °C. Выбросьте супернатант.
- Фильтруйте отдельные ячейки через клеточный сетчатый фильтр 70 мкм и вращайте вниз при 274 х г в течение 3 мин при 4 °C. Провести анализ жизнеспособности клеток10 с помощью Трипан блю и гемоцитометра (см. Таблицу материалов).
ПРИМЕЧАНИЕ: Жизнеспособность дня 0 колеблется в пределах 30%-70% и значительно возрастает в течение 2-3 дней. - Перейдите к шагам 4, 5 или 6, в зависимости от требуемого теста на жизнеспособность.
4. Выращивание клеток в адгезивной культуре
- В сертифицированной ламинарной вытяжке повторно суспендировать гранулу в сывороточной адгезивной среде (такой как DMEM, 10% фетальная бычья сыворотка (FBS) и 1% раствор пенициллина/ стрептомицина (P/ S)) и пластинчатых клетках в клееной клеточной колбе.
- Поддерживать клетки в контролируемой инкубированной среде (37 °C, 5% CO2).
5. Выращивание клеток в суспензионной культуре (невросферах)
- В сертифицированной ламинарной вытяжке повторно суспендируйте гранулу в бессывороточной полной среде стволовых клеток11 и пластине в суспензионной колбе.
- Поддерживайте клетки в контролируемой инкубированной среде (37 °C, 5% CO2) в течение 2-3 дней, чтобы обеспечить образование нейросферы.
- После визуализации невросфер в питательной среде используют трипсин-ЭДТА или аккутазу (см. Таблицу материалов) для получения одноклеточных суспензий для пассирования.
ПРИМЕЧАНИЕ: До тех пор, пока во время сбора урожая соблюдается особая осторожность и используются соответствующие среды, поддерживающие нервные стволовые клетки, стволовые клетки в собранной ткани должны сформировать невросферы в течение нескольких дней.
6. Подготовка клеток к реимплантации
- Повторно суспендировать гранулу в концентрации 100 000 живых клеток на 4 мкл 1x PBS.
- Немедленно вводят инъекции наивным мышам с помощью метода имплантации внутричерепной опухоли (шаг 1).
7. Гистологический анализ
- Сразу после резекции извлекают и фиксируют мозг в 4% параформальдегиде (ПФА) в течение 24 ч12.
- Переведите мозги на 30% раствор сахарозы до тех пор, пока они не насытятся сахарозой (опустились на дно контейнера).
- Переведите мозг на 70% раствор этанола.
- Выполните встраивание парафиновых блоков, секционирование и стандартное окрашивание гематоксилином и эозином (H&E) в соответствии с ранее опубликованным отчетом13.
ПРИМЕЧАНИЕ: Толщина каждого участка, взятого для окрашивания, составляла 10 мкм.
Результаты
Хирургическая резекция с использованием MIRS приводит к значительному снижению опухолевой нагрузки
В группе с меньшей опухолевой нагрузкой средний исходный биолюминесцентный сигнал составлял 5,5e+006 фотонов/с ± 0,2e+006 в подгруппе, подвергшейся резекции. После резекции средний биолюминесцентный сигнал уменьшился до 3,09e+006 фотон/с ± 0,3e+006,(p <0,0001, тест Манна-Уитни)9 (рисунок 2). Биолюминесцентный сигнал увеличивался в течение следующих нескольких дней, пока мыши не были усыплены. Аналогичным образом, в группе с большей опухолевой нагрузкой средний исходный биолюминесцентный сигнал составлял 1,68e + 007 фотонов / с ± 0,1e + 007 в подгруппе, которая подверглась резекции. После резекции средний биолюминесцентный сигнал снизился до 5,19e+006 фотон/с ± 0,2e+006 (p <0,0001, тест Манна-Уитни)9. Биолюминесцентный сигнал увеличивался в течение следующих нескольких дней, пока мыши не были усыплены.
Резекция с помощью MIRS может быть отрегулирована для желаемого объема резекции
При предрезекционной визуализации сингенных опухолей CT2A опухоль обычно может быть идентифицирована как гетерогенная масса в месте инокуляции с нарушенной паренхиматозной архитектурой и перитуморальным отеком и кровоизлиянием, на которые указывают гетерогенные области Т2-взвешенной (T2w) гипо- и гиперинтенсивности. Игольчатый трек, используемый для стереотаксической инъекции опухолевых клеток, может быть идентифицирован на T2w МРТ-сканировании14.
Резекционная полость может быть идентифицирована на МРТ-сканировании после резекции T2w как большая круглая область гипопоинтенса в месте посева опухоли (рисунок 3). Процедура резекции не вызвала значительной кровопотери или нарушения окружающей архитектуры мозга. В некоторых случаях жидкость накапливается в резекционной полости. Как показано на фиг.4, объем резекции значительно увеличился с 9,4мм3 за один оборот режущего отверстия до 23,2мм3 за два вращения (p = 0,0117), что позволило отрегулировать резекцию объема для оптимизации для известной опухолевой нагрузки.
Резекция опухоли с использованием MIRS приводит к 7-дневному продлению медианы выживаемости опухоленосных мышей без каких-либо неврологических признаков
Как показано на рисунке 5, наблюдалось продление выживаемости мышей, перенесших хирургическую резекцию в обеих группах с небольшими (6 дней) и большими (7 дней) опухолями. В группе с меньшей опухолевой нагрузкой медиана выживаемости контрольной подгруппы составила 16 дней, в то время как медиана выживаемости подгруппы, подвергшейся резекции, составила 22 дня (p = 0,0044). Аналогичным образом, в группе с большей опухолевой нагрузкой медиана выживаемости контрольной подгруппы составляла 12 дней, в то время как медиана выживаемости подгруппы, подвергшейся резекции, составляла 19 дней (p = 0,0043). Кроме того, ни у одной из мышей, подвергшихся резекции с использованием MIRS, не было обнаружено никаких признаков неврологической травмы после процедуры. Это указывает на то, что MIRS может достичь безопасной резекции.
Резецированная ткань с использованием MIRS обладает высокой жизнеспособностью in vitro и in vivo
Клетки, извлеченные из резецированной ткани, фильтровали, количественно оценивали и повторно суспендировали в соответствующей среде (рисунок 6) перед проведением экспериментов по жизнеспособности in vitro или in vivo . Чтобы исследовать жизнеспособность клеток in vitro и подтвердить резекцию опухоли, а не нормальную паренхиму головного мозга, клетки выращивали в культуре суспензии. Формирование невросферы, индикатора потенциала инициации опухоли, происходило при минимальной обработке тканей после резекции. Это говорит о том, что платформа MIRS собирала хорошо диссоциированную ткань и оказывала минимальное влияние на здоровье и жизнеспособность резецированной ткани. Образцы, взятые прямо из TPS для световой микроскопии, по-видимому, были в основном в форме отдельных клеток вместе с наличием нескольких небольших кусков ткани. Жизнеспособность 0-го дня варьировалась от 30% до 70% (это представляет собой жизнеспособность после пропускания образца через фильтр 70 мкм и перед покрытием). Резекционное устройство имеет режущее отверстие, которое может вращаться на 360° по оси резекционного зонда, что позволяет проводить резекцию концентрических объемов тканей. В среднем 2-3 миллиона клеток могут быть собраны с одним поворотом режущего отверстия на 360°, примерно 7 миллионов ячеек с двумя витками, и в общей сложности 12-14 миллионов клеток могут быть получены с тремя поворотами режущего отверстия на 360°. После нанесения покрытия в суспензионные колбы, содержащие бессывороточную полную среду стволовых клеток, нейросферы были видны с помощью световой микроскопии на 2-й день и невооруженным глазом на 7-й день (рисунок 7).
Чтобы исследовать жизнеспособность in vivo , извлеченные клетки были интракрационно имплантированы наивным мышам C57BL /6 (n = 8 мышей, 100 000 живых клеток / мышь). Рост опухоли был подтвержден с помощью системы визуализации in vivo . Сигнал опухоли продолжал увеличиваться до тех пор, пока все животные не были усыплены к 14-му дню после имплантации опухоли (медиана выживаемости 11 дней).
Репрезентативный участок ткани H&E (рисунок 3B) содержит четкую, круглую резекционную полость с ободком продуктов крови (темно-розовый), воспаление и остаточные опухолевые клетки (темно-фиолетовые клетки). Макроскопически остаточные опухолевые клетки носят мезенхимальный характер и инфильтративны, проявляя обширную периваскулярную инвазию и пролиферацию. Микроскопически были выявлены выраженные ядерные атипии и митотические фигуры. Опухолеассоциированные макрофаги также были идентифицированы вокруг областей инфарктной ткани и микрогемортов. Тканевая архитектура в окружающей паренхиме мозга, по-видимому, не нарушена.

Рисунок 1: Настройка системы MIRS. (A) Минимально инвазивная резекционная система (MIRS) для опухоли головного мозга у моделей грызунов с интегрированной системой сохранения тканей. (B) Передняя панель консоли MIRS. 1 = мощность системы, 2 = ножная педаль, 3 = основная кнопка, 4 = аспирация, 5 = регулятор уровня аспирации, 6 = индикатор уровня аспирации, 7 = наконечник, 8 = кнопка включения резака. (C) Задняя панель консоли MIRS. 1 = розетка шнура питания, 2 = автоматический выключатель, 3 = вход подачи азота. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Изменения средней опухолевой нагрузки у мышей с необработанными опухолями по сравнению с мышами, перенесшими резекцию опухолей с помощью MIRS. (A) Мыши с небольшой исходной опухолевой нагрузкой и (B) мыши с большой базовой опухолевой нагрузкой (p < 0,0001, SD ≤0,3e + 006 во всех группах в каждый момент времени и слишком малы, чтобы отображаться на графике). Животные либо поддавались опухолевой нагрузке, либо подвергались эвтаназии. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: МРТ и анализ H&E. (A) МРТ головного мозга, взвешенные до и после резекции, и (B) репрезентативный H&E-окрашенный корональный участок мозга, показывающий четкую, круговую резекционную полость с ободком продуктов крови (темно-розовый), воспаление и остаточные опухолевые клетки (темно-фиолетовые клетки). Снимки МРТ и Срезы H&E были получены сразу после резекции. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 4: Определение объема резекции опухоли. Средние объемы, рассчитанные по МРТ-изображениям резекционных полостей, созданных с помощью одного vs. два вращения режущего отверстия, n = 4 на группу. p = 0,01, двуххвостый Т-тест. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Кривые Каплана-Мейера мышей с необработанными опухолями по сравнению с мышами, перенесшими резекцию опухолей MIRS. (A) Мыши с небольшой исходной опухолевой нагрузкой. (B) Мыши с большой исходной опухолевой нагрузкой. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Тест на жизнеспособность резецированных опухолевых клеток. (A) Репрезентативные изображения световой микроскопии ткани, собранной с помощью MIRS в день 0 в 20x. (B) Кривая Каплана-Мейера, описывающая выживаемость мышей после внутричерепной имплантации клеток, собранных из резецированной ткани. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
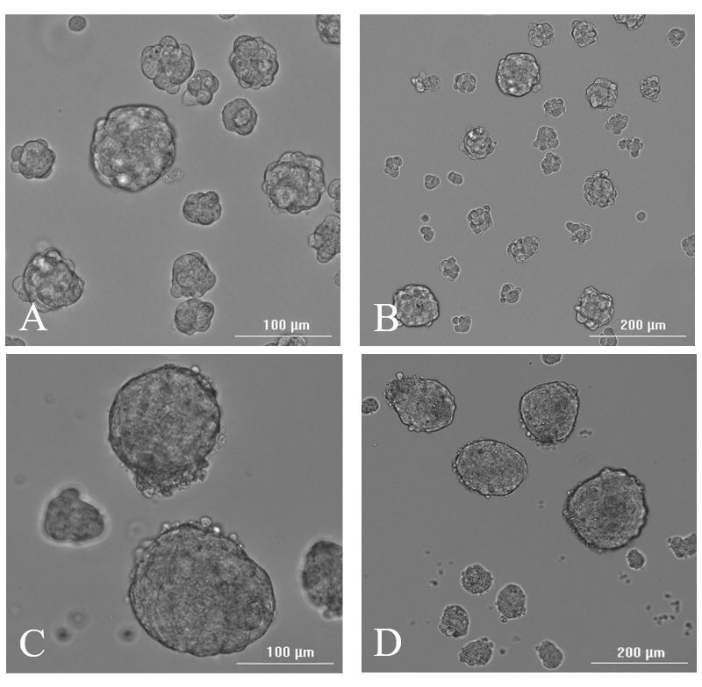
Рисунок 7: Формирование невросфер. Репрезентативная световая микроскопия изображений невросфер, полученных из резецированной ткани на 2-й день после резекции при (A) 20x и (B) 10x, и на 7-й день после резекции при (C) 20x и (D) 10x. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Минимально инвазивная резекционная система | Историческая резекция | |||
| Оперативное время и навыки | Минимальное время работы (<2 мин для каждого животного). Необходимы минимальные навыки. | Хирургическое время не стандартизировано, и хирургический опыт с мелкими животными и микрохирургией полезен. | ||
| Кровопотеря | Минимальный | Непредсказуемый | ||
| Стандартизированный объем резекции | Объем резекции определяется/регулируется количеством оборотов резекционного инструмента | Объем сильно варьируется в зависимости от тематики | ||
Таблица 1: Сравнение минимально инвазивной резекционной системы (MIRS) и исторических моделей хирургической резекции.
Обсуждение
Резекция опухоли является краеугольным камнем планов лечения нейрохирургической онкологии как для низкосортных, так и для высокосортных опухолей головного мозга. Циторедукция и дебулкция опухоли коррелируют с улучшением неврологической функции и общей выживаемостью у пациентов с опухолями головного мозга 1,2,5,6. Хотя протоколы хирургической резекции были ранее описаны в моделях грызунов, эти протоколы страдали от нескольких ограничений, которые могут спутать полученные результаты и общую переводимость доклинической модели. Например, ранее сообщалось о протоколах хирургической резекции, включая трепанацию черепа с 3-4 небольшими отверстиями для заусенцев для создания костного лоскута, а затем умелое различие и дифференцировку окраски и консистенции опухоли по сравнению с нормальной тканью мозга6. Эти протоколы отнимают много времени и требуют, чтобы исследовательский персонал обладал передовыми навыками в использовании хирургического микроскопа, обращении с хирургическими инструментами, выявлении границ опухоли, касающихся окружающей нормальной ткани мозга, и достижении адекватного гомеостаза. Такие процедуры часто приводят к значительной кровопотере и гибели животных. Кроме того, может быть сложно достичь стандартизированной резекции с сопоставимыми объемами опухолевой ткани, резецированной у разных животных в одном эксперименте. Эта преемственность и единообразие становятся более сложными с несколькими сотрудниками, выполняющими процедуру.
Напротив, протокол MIRS, описанный здесь, устраняет эти ограничения (таблица 1). Настоящий протокол требует минимально инвазивного подхода через то же отверстие заусенца, которое использовалось для первоначальной имплантации опухоли. Как подробно описано в разделе протокола, инструмент резекции может быть установлен на стереотаксической раме, которая позволяет точно вводить канюлю в полость опухоли. Скорость лезвия и количество выполняемых циклов резекции могут быть легко отрегулированы с помощью наконечника, используемого исследовательским персоналом для контроля объема резецируемой опухоли стандартизированным образом, не вызывая значительного количества кровопотери.
Как отмечается в результатах, мыши, перенесшие резекцию с помощью устройства MIRS, продемонстрировали длительную выживаемость по сравнению с когортой мышей с несектированными опухолями. Это, наряду с данными, показывает, что опухолевая нагрузка была значительно снижена в резецированной группе по сравнению с несектированной контрольной группой, что указывает на то, что устройство MIRS эффективно очищает опухоль с минимальным нарушением окружающих здоровых тканей мозга. Кроме того, в дни после резекции опухолевая нагрузка неуклонно прогрессировала из-за наличия остаточной опухоли и инфильтративной природы клеточной линии опухоли CT-2A. Таким образом, модель MIRS может воспроизводить процесс дебуляции инфильтративных типов опухолей, за которым можно следовать с помощью химиотерапевтических или лучевых терапий, чтобы более точно отражать схему лечения в протоколах лечения опухолей головного мозга человека 15,16,17.
Как и в случае с любым всасывающим устройством, засорение аспирационной трубки может быть одним из ограничений системы MIRS. Это может произойти из-за накопления сухой ткани или крови во время или после использования машины. Чтобы этого избежать, сразу в конце каждого сеанса резекции рекомендуется продувка канюли наконечника путем промывки охлажденной средой, чередующейся с воздухом, чтобы «протолкнуть» всю резецированную ткань к коллекционной канистре с последующим промывкой 3% H2O2. Это захватит всю ткань, приобретенную во время резекции, и гарантирует, что ни одна из них не останется в канюле или трубке. Кроме того, если система не аспирирует/не режет, это может быть связано с тем, что наконечник не подключен, резекционный канюльный резак не включен, аспирационная линия от консоли не подключена к канистре, крышка канистры не затянута, или ножная педаль не подключена.
Кроме того, хотя мы показали, что MIRS может быть использован для эффективной и стандартизированной резекции с высокой жизнеспособностью in vitro и in vivo резецированной ткани, будущие исследования поощряются для дальнейшего изучения других аспектов внедрения таких систем в исследованиях опухолей головного мозга. К ним относится изучение влияния процесса резекции на молекулярные и клеточные компоненты опухолевой массы и микроокружение опухоли. Кроме того, необходимы исследования, чтобы подтвердить, что резецированная ткань с использованием устройства MIRS рекапитулирует родительскую опухоль15.
В заключение описан протокол минимально инвазивного подхода для стандартизированной хирургической резекции в модели опухоли головного мозга грызунов, которая сочетается с интегрированной и автоматизированной системой сохранения тканей. Этот протокол прокладывает путь к созданию высокотрансляционных и прогностических доклинических моделей исследования опухолей головного мозга. Будущие приложения этого протокола потенциально могут включать доклинические исследования, изучающие различные терапевтические или диагностические методы для опухолей головного мозга, которые могут реализовать этот протокол для достижения стандартизированной резекции.
Раскрытие информации
BT финансирует исследования от NIH и является совладельцем Accelerating Combination Therapies*, а Ashvattha Therapeutics Inc. лицензировала один из ее патентов. GW имеет финансирование NIH (R01NS107813). HB является оплачиваемым консультантом Insightec и председателем Медицинского консультативного совета компании. Этот механизм был рассмотрен и одобрен Университетом Джона Хопкинса после его политики конфликта интересов. HB финансирует исследования от NIH, Университета Джона Хопкинса и филантропии и является консультантом CraniUS, Candel Therepeutics, Inc., Accelerating Combination Therapies*, Catalio Nexus Fund II, LLC*, LikeMinds, Inc*, Galen Robotics, Inc.* и Nurami Medical*. (*включая эквити или опционы).
Материалы
| Name | Company | Catalog Number | Comments |
| 1 mL syringes | BD | 309628 | |
| 15 mL conical tubes | Corning | 430052 | |
| 200 proof ethanol | PharmCo | 111000200 | |
| 5 mL pipettes | CoStar | 4487 | |
| 70 micron filter | Fisher | 08-771-2 | |
| Accutase | Millipore Sigma | SIG-SCR005 | |
| Anased (Xylazine injection, 100 mg/mL) | Covetrus | 33198 | |
| Anesthesia System | Patterson Scientific | 78935903 | |
| Anesthesic Gas Waste Container | Patterson Scientific | 78909457 | |
| Bench protector underpad | Covidien | 10328 | |
| C57Bl/6, 6-8 week old mice | Charles River Laboratories | Strain Code 027 | |
| ChroMini Pro | Moser | Type 1591-Q | |
| Collagenase-Dispase | Roche | #10269638001 | |
| Countess II Automated Cell Counter | Thermo Fisher | ||
| Countess II FL Hemacytometer | Thermo Fisher | A25750 | |
| Debris Removal Solution | Miltenyi Biotech | #130-109-398 | |
| D-Luciferin | Goldbio | LUCK-1G | |
| DMEM F12 media | Corning | 10-090-CV | |
| DMEM media | Corning | 10-013-CV | |
| DNAse I | Sigma Aldrich | #10104159001 | |
| Eppendorf tubes | Posi-Click | 1149K01 | |
| Euthanasia solution | Henry Schein | 71073 | |
| FBS | Millipore Sigma | F4135 | |
| Fetal Bovine Serum | Thermo Fisher | 10437-028 | |
| Formalin | Invitrogen | INV-28906 | |
| Gauze | Henry Schein | 101-4336 | |
| hEGF | PeproTech EC | 100-15 | |
| Heparin | Sigma | H-3149 | |
| hFGF-b | PeproTech EC | 1001-18B | |
| Induction Chamber | Patterson Scientific | 78933388 | |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Isoflurane Vaporizer | Patterson Scientific | 78916954 | |
| Ketamine | Covetrus | 11695-0703-1 | |
| Kopf Stereotactic frame | Kopf Instruments | 5001 | |
| Lightfield Microscope | BioTek | Cytation 5 | |
| Microinjection Unit | Kopf | 5001 | |
| Micromotor drill | Foredom | F210418 | |
| MRI system | Bruker | 7T Biospec Avance III MRI Scanner | |
| NICO Myriad System | NICO Corporation | ||
| Ophthalmic ointment | Puralube vet ointment | ||
| Papain | Sigma Aldrich | #P4762 | |
| PBS | Invitrogen | #14190250 | |
| PenStrep | Millipore Sigma | N1638 | |
| Percoll solution | Sigma Aldrich | #P4937 | |
| Pipette controller | Falcon | A07260 | |
| Povidone-iodine solution | Aplicare | 52380-1905-08 | |
| Progesterone | Sigma | P-8783 | |
| Putrescine | Sigma | P-5780 | |
| RPMI Media | Invitrogen | INV-72400120 | |
| Scalpel blade | Covetrus | 7319 | |
| Scalpel handle | Fine Science Tools | 91003-12 | |
| Skin marker | Time Out | D538,851 | |
| Staple remover | MikRon | ACR9MM | |
| Stapler | MikRon | ACA9MM | |
| Staples | Clay Adams | 427631 | |
| Stereotactic Frame | Kopf Instruments | 5000 | |
| Sucrose | Sigma Aldrich | S9378 | |
| Suture, vicryl 4-0 | Ethicon | J494H | |
| T-75 culture flask | Sarstedt | 83-3911-002 | |
| TheraPEAKTM ACK Lysing Buffer (1x) | Lonza | BP10-548E | |
| Trypsin-EDTA | Corning | MDT-25-053-CI |
Ссылки
- Mineo, J. F., et al. Prognosis factors of survival time in patients with glioblastoma multiforme: a multivariate analysis of 340 patients. Acta Neurochirurgica. 149 (3), 245-252 (2007).
- Miyai, M., et al. Current trends in mouse models of glioblastoma. Journal of Neuro-Oncology. 135 (3), 423-432 (2017).
- Raj, D., Agrawal, P., Gaitsch, H., Wicks, E., Tyler, B. Pharmacological strategies for improving the prognosis of glioblastoma. Expert Opinion on Pharmacotherapy. 22 (15), 2019-2031 (2021).
- Alomari, S., et al. Drug repurposing for Glioblastoma and current advances in drug delivery-a comprehensive review of the literature. Biomolecules. 11 (12), 1870(2021).
- Serra, R., et al. Combined intracranial Acriflavine, temozolomide and radiation extends survival in a rat glioma model. European Journal of Pharmaceutics and Biopharmaceutics : Official Journal of Arbeitsgemeinschaft fur Pharmazeutische Verfahrenstechnik eV. 170, 179-186 (2022).
- Tang, B., Foss, K., Lichtor, T., Phillips, H., Roy, E. Resection of orthotopic murine brain glioma. Neuroimmunology and Neuroinflammation. 8 (1), 64-69 (2021).
- Ozawa, T., James, C. D. Establishing intracranial brain tumor xenografts with subsequent analysis of tumor growth and response to therapy using bioluminescence imaging. Journal of Visualized Experiments. (41), e1986(2010).
- Poussard, A., et al. In vivo imaging systems (IVIS) detection of a neuro-invasive encephalitic virus. Journal of Visualized Experiments. (70), e4429(2012).
- Lachin, J. M. Nonparametric statistical analysis. JAMA. 323 (20), 2080-2081 (2020).
- Louis, K. S., Siegel, A. C. Cell viability analysis using trypan blue: manual and automated methods. Methods in Molecular Biology. 740, 7-12 (2011).
- Spina, R., Voss, D. M., Asnaghi, L., Sloan, A., Bar, E. E. Flow cytometry-based drug screening system for the identification of small molecules that promote cellular differentiation of Glioblastoma stem cells. Journal of Visualized Experiments. (131), e56176(2018).
- Rodgers, G., et al. Virtual histology of an entire mouse brain from formalin fixation to paraffin embedding. Part 2: Volumetric strain fields and local contrast changes. Journal of Neuroscience Methods. 365, 109385(2022).
- Connolly, N. P., et al. Elevated fibroblast growth factor-inducible 14 expression transforms proneural-like gliomas into more aggressive and lethal brain cancer. GLIA. 69 (9), 2199-2214 (2021).
- Stall, B., et al. Comparison of T2 and FLAIR imaging for target delineation in high grade gliomas. Radiation Oncology. 5, 5(2010).
- Das, A., et al. Establishing a standardized method for the effective intraoperative collection and biological preservation of brain tumor tissue samples using a novel tissue preservation system: a pilot study. World Neurosurgery. , (2022).
- Zusman, E., et al. Tissues harvested using an automated surgical approach confirm molecular heterogeneity of Glioblastoma and enhance specimen's translational research value. Frontiers in Oncology. 9, (2019).
- McLaughlin, N., et al. Side-cutting aspiration device for endoscopic and microscopic tumor removal. Journal of Neurological Surgery Part B. 73 (1), 11-20 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены