Method Article
Fare Torasik Aortunda Endotele Bağlı Vazogevşemenin Tensometrik Küçük Hacimli Oda Miyografisi ile Ölçülmesi
Bu Makalede
Özet
Bu protokol, fare aort endotel fonksiyonunun deneysel ex vivo değerlendirmesinde çok odacıklı bir miyograf sistemi kullanılarak tensometrik miyograf tekniğinin kavramlarını ve teknik uygulamasını açıklamaktadır.
Özet
Küçük hacimli kamara tensometrik miyografi, laboratuvar hayvanlarında ve insan dokusundan izole edilen küçük arterlerde küçük ve büyük kan damarlarının vasküler kontraktilitesini değerlendirmek için yaygın olarak kullanılan bir tekniktir. Bu teknik, araştırmacıların izole kan damarlarını sıkı bir şekilde kontrol edilen ve standartlaştırılmış (fizyolojik) bir ortamda, çeşitli çevresel faktörlere uyum sağlama seçeneğiyle korumalarını sağlarken, izole edilmiş damarlara vazokonstriksiyon veya vazodilatasyona neden olabilecek farklı farmakolojik ajanlarla meydan okur. Miyograf odası ayrıca, düz kas ve endotel katmanlarının işlevini ayrı ayrı veya aynı anda etkileyebilecek çeşitli hormonlara, inhibitörlere ve agonistlere yanıt olarak vasküler reaktiviteyi ölçmek için bir platform sağlar. Kan damarı duvarı üç farklı tabakadan oluşan karmaşık bir yapıdır: intima (endotel tabakası), media (düz kas ve elastin lifleri) ve adventiti (kollajen ve diğer bağ dokusu). Her katmanın işlevsel özelliklerini net bir şekilde anlamak için, üç katmanı aynı anda incelemek için kombinasyonel bir yaklaşıma izin verecek deneysel bir platforma ve sisteme erişebilmek çok önemlidir. Böyle bir yaklaşım, ex vivo bir ortamda in vivo ortamı taklit edecek yarı fizyolojik bir duruma erişim gerektirir. Küçük hacimli kamara tensometrik miyografi, çevresel ipuçlarının, deneysel değişkenlerin veya farmakolojik agonist ve antagonistlerin vasküler özellikler üzerindeki etkisini değerlendirmek için ideal bir ortam sağlamıştır. Uzun yıllar boyunca, bilim adamları farklı ajanlara yanıt olarak endotel fonksiyonunu ve düz kas kontraktilitesini ölçmek için tensometrik miyograf tekniğini kullandılar. Bu yazıda, izole fare aortunda endotel fonksiyonunu ölçmek için küçük hacimli odacıklı tensometrik miyograf sistemi kullanılmıştır. Bu rapor, torasik aort gibi büyük bir arterin küçük segmentlerinde endotelin fonksiyonel bütünlüğünü değerlendirmek için küçük hacimli kamara tensometrik miyografinin nasıl kullanılabileceğine odaklanmaktadır.
Giriş
Son birkaç on yıldır, küçük oda miyografi sistemi, ex vivo, gerçek zamanlı bir ortamda çeşitli farmakolojik ajanlara ve nörotransmitterlere yanıt olarak farklı kan damarı duvarlarının reaktivitesini ölçmek için kullanılmıştır. Vasküler reaktivite, sağlıklı bir fonksiyonel kan damarının önemli bir bileşenidir ve periferik ve serebral vaskülatür 1'de kan akışının ve perfüzyonun düzenlenmesi için kritiköneme sahiptir. Kan damarı duvarı içinde, endotel ve düz kas katmanları arasındaki etkileşim, kan damarı duvarını çevreleyen bağ dokusu tabakasındaki yapısal değişikliklerden (adventitia) sürekli olarak etkilenen vasküler tonusun önemli bir belirleyicisidir.
Endotel tabakası, nitrik oksit (NO), prostasiklin (PGI2) ve endotel kaynaklı hiperpolarize edici faktör (EDHF) dahil olmak üzere birkaç vazodilatatör faktörü serbest bırakarak veya endotelin-1 (ET-1) ve tromboksan (TXA2) 2,3,4 gibi vazokonstrüktif ajanlar üreterek vazohareketi kontrol eder. Bu faktörler arasında, NO'nun kapsamlı bir şekilde çalışıldığı ve inflamasyon, göç, sağkalım ve proliferasyon gibi diğer kritik hücresel fonksiyonlardaki önemli düzenleyici rolleri bilimsel literatürde yüksek oranda belirtilmiştir 2,5.
Vasküler biyoloji alanında, oda miyografisi, vasküler fizyologlara ve farmakologlara, sıkı bir şekilde kontrol edilen yarı fizyolojik sistemde endotel fonksiyonunu ölçmek için değerli ve güvenilir bir araç sağlamıştır1. Şu anda, bilim adamları için iki farklı miyograf sistemi vardır: tel (veya iğne) tensometrik (izometrik) miyografi ve basınç miyografisi. Bir tel miyografi sisteminde, kan damarı iki tel veya pim arasında gerilir, bu da kan damarının duvarındaki kuvvet veya gerginlik gelişiminin izometrik ölçümüne izin verirken, basınç miyografisi, kan basıncındaki değişikliklerin vasküler ton ve vazohareketteki değişiklikler için ana uyaran olarak kabul edildiği küçük dirençli arterlerde vasküler reaktivite ölçümleri için tercih edilen bir platformdur. Mezenterik ve serebral arterler gibi küçük dirençli arterler için, basınç miyografisinin insan vücudundaki fizyolojik koşullara daha yakın bir durum yarattığı konusunda genel bir anlaşma vardır. Küçük odacıklı miyograf, aort gibi çok küçük çaplara (200-500 μm) sahip damarlar için kullanılabilir.
Tel miyograf, izometrik koşullar altında kan damarı gerginliğini kaydetmek için güçlü bir sistem olsa da, basınçlı miyograf, izobarik koşullardaki değişikliklere yanıt olarak damar çapındaki değişiklikleri ölçmek için daha uygun bir sistemdir. Basınç veya akıştaki değişikliklere yanıt olarak damardaki çap değişiklikleri, küçük bir kaslı arterde (arteriol) aort gibi büyük elastik arterlere kıyasla çok daha büyüktür. Bu nedenlerden dolayı, basınçlı miyograf, önemli vazoreaktivite1'e sahip küçük kan damarları için daha iyi bir araç olarak kabul edilir. Çok odacıklı küçük hacimli odacıklı tensometrik miyografinin diğer pratik güçlerinden biri, değişkenliği azaltmak ve sağlam ve kesin veriler üretmek için aynı arterin ve aynı hayvanın birden fazla (dörde kadar) segmentini inceleyerek farklı mekanizmaların vasküler reaktiviteye katkısını ayırt edebilmesidir. Teknik olarak kurulumu ve bakımı da nispeten kolaydır. Hemen hemen her büyüklükteki damarlar bir tel miyograf ile incelenebilir. Vasküler fonksiyonun değerlendirilmesi için daha uygun maliyetli bir çözümdür ve disseke edilen damarın uzunluğunun basınçlı miyograf protokolü için çok kısa olduğu deneylerde basınç miyografisine iyi bir alternatiftir.
Bu raporda, DMT-620 çok odacıklı miyograf sistemi (DMT-USA) kullanılarak küçük hacimli kamaralı tensometrik miyografi tekniğindeki montaj pimleri kullanılarak izole fare torasik aort halkasındaki endotel fonksiyonunun değerlendirilmesi için ayrıntılı bir protokol sunulmaktadır. Bu protokol, ortalama ağırlığı 25-35 g arasında olan 6 aylık bir erkek C57BL6 fare kullanır. Neyse ki, bu protokol, bu protokolün kullanılabileceği çok çeşitli damar tipleri ve çapları göz önüne alındığında, çeşitli hayvan türlerine ve ağırlıklarına uygulanabilir.
Protokol
Tüm cerrahi prosedürler ve hayvan bakımı, Midwestern Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı ve Bakım Komitesi (IACUC) (IACUC # AZ-3006, AZ-2936) tarafından onaylanmıştır.
1. Tampon hazırlama
NOT: HEPES fizyolojik tuz çözeltisi (HEPES-PSS) tamponu 7 gün boyunca 4 ° C'de stabil olmasına rağmen, tüm tamponların her deney gününde taze olarak yapılması önerilir. Diğer tüm reaktifler ve agonistler her deney için taze olarak hazırlanmalıdır. Bu protokolde kullanılan HEPES-PSS tamponu, bu deneysel protokolün ana odağı olan damarın vazodilatatör yanıtlarını korurken 12 saatten fazla bir süredir sitoprotektif olduğu gösterilen ex vivo vasküler çalışmalar için iyi kurulmuş bir tampondur 6,7.
- HEPES-PSS çözeltisini (pH 7.4) aşağıdaki gibi hazırlayın: 10 mmol / L HEPES, 6 mmol / L glikoz, 1.5 mmol / L CaCl 2, 130 mmol / L NaCl, 4 mmol / L KCl, 4 mmol / L NaHCO3, 1.2 mmol / L MgSO 4, 1.2 mmol / L KH2 PO4 ve 0.03 mmol / L EDTA karıştırın.
- HEPES-PSS yüksek K+ tamponunu hazırlayın. Bu, HEPES-PSS çözeltisi ile aynıdır, ancak 5 mmol / L HEPES, 65 mmol / L NaCl, 10 mmol / L glikoz, 1 mmol / L MgCl2, 80 mmol / L KCl içerir ve MgSO4 ve EDTA içermez.
2. Miyograf ünitesi hazırlığı
- Açın ve su banyosunu 37 ° C'ye ayarlayın. Uygun bir su seviyesi sağlayın.
- Su banyosuna uygun şekilde etiketlenmiş iki beheri yerleştirin, biri 600 mL HEPES-PSS çözeltisi ve diğeri 150 mL yüksek K + çözeltisi ile.
- 300 mL HEPES-PSS çözeltisinden oluşan bir beheri en az 10 dakika boyunca karbojen gazı (%5 CO2 ve %95O2) ile havalandırın.
- 50 mL'lik bir santrifüj tüpüne 30 mL havalandırılmış HEPES-PSS çözeltisi ekleyin, uygun şekilde etiketleyin (göğüs kafesi, fare tanımlama numarası) ve buzun üzerine yerleştirin. Kalan havalandırılmış HEPES-PSS solüsyonunu aort diseksiyonu işlemi sırasında kullanılmak üzere buz üzerinde tutun.
- Dört odacıklı miyograf ünitesini açın; Her miyograf odasına 6 mL HEPES-PSS çözeltisi ekleyin ve ısıyı 37 ° C'ye ayarlayın. Her odadaki çözeltinin 30 dakika boyunca havalandırılmasına izin verin (karbojen karışımı ile) ve odaların istenen 37 ° C'ye ulaştığından emin olmak için kontrol edin (fare aortunu incelemek için bu bekleme süresini kullanın).
- Miyograf veri toplama donanımını ve bilgisayarını açın.
3. Fare aort izolasyonu
- Deneysel fareyi %5 izofluran inhalasyonu ile anestezi altına alın ve servikal çıkık ile ötenazi yapın (bu gösterim için 6 aylık erkek C57BL/6J fare kullanılır).
- Fareyi sırtüstü pozisyonda bir cerrahi tahtaya yerleştirin ve cerrahi bant kullanarak ekleri tahtaya sabitleyin.
- Karın bölgesine% 70 alkol püskürtün, böylece kürk tamamen ıslaktır ve gevşek / kuru tüyler insizyona girmez. Fazla çözeltiyi nazikçe silin.
- Sternumun ksifoid sürecinden hemen daha düşük olan karın derisini bulmak ve izole etmek için forseps kullanın.
- Cildi düz bir şekilde yukarı kaldırarak gerginlik yaratın. Makas kullanarak künt bir kesim yapın ve göğüs boşluğunu açığa çıkararak yüzeysel cildi çıkarın.
- Ksifoid süreci kaldırın ve lateral insizyonları subkostal kenar boşlukları boyunca işlemden daha düşük yapın.
- Göğüs kafesinin ön kısmını çıkarmak için lateral kesileri kraniyal olarak uzatın.
- Göğüs kafesini omurgadan, diyaframın altından ve boyundan künt bir kesim yaparak çıkarın.
NOT: Araştırmacılar ayrıca aortu doğrudan hayvandan çıkarabilir, ancak damarı korumak ve pıhtılaşmış kanı aorttan temizlemek için özen gösterilmelidir. Bu protokol, göğüs kafesinin çıkarılması ve aortun dikkatlice temizlenmesi ve diseke edilmesi örneğini kullanır. Uygulamayla, bu yöntem hızlı ve verimli bir şekilde gerçekleştirilebilir ve immünohistokimya, histoloji ve batı lekelenmesi gibi diğer çalışmalar için ekstra dokunun korunmasında faydalıdır. - Torasik kafesi, buz gibi soğuk havalandırılmış HEPES-PSS tamponu ile doldurulmuş şeffaf silikon elastomer kaplı Petri kabına aktarın ve her iki tarafa da sabitleyin.
NOT: Bir silikon elastomer kiti kullanın (Malzeme Tablosu). Baz ve kürleme maddesini karıştırın (ağırlıkça 10: 1), daha sonra bir cam Petri kabına dökün ve 25 ° C'de 24 saat boyunca kürlenmeye bırakın. - Petri kabını stereo zoom mikroskobunun altına yerleştirin, kalbi ve bağlı aortu göğüs kafesinden yavaşça kesin ve çıkarın ve temiz, berrak silikon elastomer kaplı bir kaba aktarın (Şekil 1).
- Daha sonra, yağ ve bağ dokusunu ve pıhtılaşmış kanı aorttan yavaşça çıkarın. Keskin, küçük makas kullanarak, tüm aortu ark bölgesinden başlayarak inen aortun alt kısmına kadar diseke edin ve izole edin. Aort arkının miyografi deneyleri için uygun olmadığını, ancak histolojik çalışmalar için kullanılabileceğini unutmayın.
- Diseksiyon boyunca soğuk gazlı HEPES-PSS çözeltisi kullanın. Çözümü her 10 dakikada bir veya görünürlük tehlikeye girdiğinde, önce ne olursa olsun değiştirin. Her bir aort halkasının diseksiyon sonrası 20 dakika içinde (maksimum 60 dakika) miyograf odasına monte edilmesi önerilir.
4. Aort segmentlerinin miyograf odalarına montajı
- Disseke edilmiş aortu keskin küçük cerrahi makas kullanarak her biri 2 mm'lik dört segmente bölün. Çanak içindeki mini cetveli referans olarak kullanın.
- Pimleri kolayca görselleştirmek için miyograf odasını stereo zoom mikroskobunun altına yerleştirin ve mikrometreleri pimler neredeyse temas edecek şekilde ayarlayın (Şekil 2).
- Her iki doku tutucu pimin de düzgün hizalandığından emin olun.
- Dikkat edin ve endotelin zarar görmesini önlemek için segmentleri monte ederken aortu sıkıştırmaktan kaçının.
- Zaten 5 mL ısıtılmış ve havalandırılmış HEPES-PSS tamponu içeren odalarda, forseps kullanarak 2 mm'lik aort segmentlerinin her birini iki montaj pimine dikkatlice kaydırın. Aort segmentlerini pimlerin üzerinden kaydırırken çok nazik olun. Endotel tabakası çok kırılgandır ve luminal taraftan çok kolay çıkar.
- Mikrometreyi saat yönünün tersine döndürerek pimleri yavaşça birbirinden ayırın, böylece odayı miyograf ünitesine geri yerleştirirken aort segmenti pimlerden kaymaz (Şekil 3).
- Cetvelin başlangıcını segmentin bir ucuna konumlandırarak (doku ucu α1 olarak işaretlenmiş) ve oküler bölümlerde (doku ucu α2 olarak işaretlenmiş) aort segmentinin diğer ucundaki ölçümü not ederek monte edilmiş aort halkasının gerçek ve doğru uzunluğunu ölçmek için diseksiyon mikroskobunun önceden kalibre edilmiş göz merceği gratikülünü kullanın8. Bu değerler, bölüm 5'teki normalleştirme adımları sırasında kullanılacaktır.
- Her miyograf odasını üniteye geri döndürün ve odaları 30 dakika boyunca 37 ° C'de havalandırmaya başlayın.
NOT: Aortun dört segmenti aynı tedavi için replika olarak kullanılabilir veya aortun her segmenti farklı deneyler için aynı anda kullanılabilir.
5. Normalleştirme
NOT: Deney koşullarının uygun şekilde standartlaştırıldığından ve toplanan verilerin güvenilir ve tekrarlanabilir olduğundan emin olmak için bir normalleştirme prosedürü gereklidir. "IC1 / IC100" veya "Normalizasyon Faktörü", bir vazokonstriktöre (örneğin, 60 mM KCl) maksimum yanıtın kaydedilmesinin mümkün olduğu arterin iç çevresinin, 100 mm Hg'lik bir transmural duvar basıncının (yani IC100) kaydedildiği iç çevreye bölünmesiyle elde edilen oran olarak tanımlanır. Bu nedenle, IC100'ü bu oranla çarparak, optimal bir yanıtın (yani IC1) kurulabileceği arterin iç çevresini belirleyebiliriz.
- Mikrometreyi, pimler neredeyse temas edecek şekilde ayarlayın.
- Tüm miyograf odaları için kuvvetleri sıfıra ayarlayın ve 1-2 dakika daha dengelenmesini sağlayın.
- Mikrometreden ilk çap okumasını not edin. Bu, iki pim arasındaki boşluğun sıfır olarak kabul edildiği konumdur (adım 5.7 için gereklidir).
- DMT açılır menüsünün altındaki veri toplama yazılımı Normalleştirme Ayarları'nı açın; aşağıdaki ayarları ve varsayılan değerleri içeren yeni bir ekran açılır:
Göz merceği kalibrasyonu (mm/div): 0.36
Hedef basıncı (kPa): 13.3
IC1/IC100: 0,9
Çevrimiçi ortalama süre(ler): 2
Gecikme süresi: 60
Tamamlanma gecikmesinde ses çal (onay kutusu)
Sesler (açılır seçim menüsü veya Gözat işleviyle) - Segment sayısına bağlı olarak, ekranda bulunan doğru kanal sayısını seçin ve grafik kaydını başlatın.
- İlgilendiğiniz kanalı seçmek için açılır menüyü kullanın; normalleştirme ekranı görünecektir.
- Sabit değerleri pencerelere aşağıdaki gibi girin: Doku uç noktaları α1; Doku uç noktaları α2; Pin çapı: 40 μm; Analog mikrometre ölçeğinden mikrometre okuma değeri.
- İlk noktayı (X veya X0'ın başlangıç değeri) kaydetmek için, Nokta Ekle düğmesine tıklayın. 60 sn'lik bir gecikmeyi takiben, bu mikrometreye karşılık gelen kuvvet ve etkin basınç (ERTP) değerleri görüntülenecek ve mikrometre okuma kutusu aktif ve kullanılabilir hale gelecektir.
- Mikrometreyi saat yönünün tersine çevirerek kabı germeye başlayın. Değeri girmek için mikrometre okuma kutusunu kullanın ve Nokta Ekle düğmesine tıklayın (tekrar 60 sn'lik bir gecikme süresi olacaktır).
- Kabı germeye devam edin ve gemiyi IC1'ine germek için kullanılan hesaplanmış mikrometre ayarı olan Mikrometre X1 değeri görülene kadar mikrometre değerleri eklemeye devam edin.
- Mikrometreyi X1 değerine ayarlayın.
NOT: 6 aylık bir C57BL6 fare için normalleştirilmiş (optimal) gerilim 6 mN'dir. - Normalleştirmeden sonra, dokunun 30 dakika dinlenmesine ve dengelenmesine izin verin. Bu noktada odalardaki HEPES-PSS solüsyonunun değiştirilmesine gerek yoktur.
NOT: Her hazne 8 mL çözelti tutabilir. Bu protokol, kabın ve montaj pimlerinin tamamen suya batırılmasını sağlayan 5 mL kullanılarak yazılmıştır. - Aşağıdakileri hazırlamak için dinlenme ve denge süresini kullanın.
- Damıtılmış suda (RO suyu) asetilkolin seri seyreltmelerinin çalışma stoğunu en düşükten en yüksek konsantrasyonlara kadar aşağıdaki gibi hazırlayın: 50 nM, 100 nM, 500 nM, 1 μM, 5 μM, 10 μM, 50 μM, 100 μM, 500 μM ve 1 mM. Deney süresince tüm tüpleri buz üzerinde tutun.
- Çift damıtılmış suda 100 mM'lik bir N-nitro-L-arginin metil ester (L-NAME) çalışma çözeltisi hazırlayın ve çözeltiyi deney süresince buz üzerinde tutun.
- Ayrı bir deney setinde belirlenen alt maksimum fenilefrin dozunu (10 μM) hazırlayın.
NOT: Denge periyodu, kan damarı segmentinin miyograf odasındaki yeni ortama uyum sağlaması, iyon gradyanlarını sıfırlaması ve farklı farmakolojik ve mekanik zorluklara maruz kalmadan önce sabit bir pasif gerilim seviyesine ulaşması için gereklidir.
6. Aort halkalarında endotele bağımlı vazogevşemenin ölçülmesi
- 30 dakikalık denge süresinin sonunda, odaları boşaltın ve her odaya 5 mL taze, ılık, havalandırılmış HEPES-PSS çözeltisi ekleyin. Dokunun havaya maruz kalmasını en aza indirmek için her seferinde bir odacığı boşaltın. Odaların boşaltılması, 60 cmHg'ye ayarlanmış bir vakum pompası ve 5 mL'lik çözeltinin çıkarılmasını sağlamak için miyograf valfleri 6 s gecikmeye ayarlanarak gerçekleştirilir.
- Gerekirse, 6 mN'lik optimum gerilimi okumak için kuvvet ölçümlerini yeniden ayarlayın. Kuvveti, her inkübasyon döneminde ve her yeni deney setinden önce optimum gerilime göre yeniden ayarlamak çok önemlidir. Dokuyu 15-20 dakika daha dinlendirin.
- Veri toplama yazılımını açın, takip numaralarını 50:1'den 500:1'e değiştirin ve Başlat'a basın. Bu aşamada, her oda için kayıtlı kuvvet yazılımda görülebilir.
- Yeni bir denemenin başlamasından hemen önce, veri toplama yazılımına uygun etiketi eklediğinizden emin olun.
- Her odaya 5 mL yüksek K+ çözeltisi eklemeden önce odaları bir kez daha boşaltın. Bu, dokuyu başka herhangi bir deneysel protokol için kullanmadan önce aort dokusunun yaşayabilirliğini ve membran depolarizasyonuna karşı düz kas kontraktil yanıtının bütünlüğünü test etmek için uygundur. Bu, kan damarı segmentinin daha fazla deney için kullanılabilir olup olmadığını belirlemeye yardımcı olur.
- Yüksek K+ çözeltisine kontraktil yanıt kuvvet üretimi için bir platoya ulaşır ulaşmaz odaları tekrar boşaltın (Şekil 4).
NOT: Yüksek K+ çözeltisini dokulara zarar vereceği için odalarda 3 dakikadan fazla bırakmayın. - Dokuyu HEPES-PSS çözeltisi 3x ile yıkayın. Her odaya 5 mL yüksek K+ çözeltisi ekleyin. Yüksek K+ çözeltisine kontraktil yanıt kuvvet üretimi için bir platoya ulaşır ulaşmaz odaları boşaltın ve dokunun 15 dakika daha dinlenmesine izin vermeden önce dokuyu HEPES-PSS ile 3 kat yıkayın.
NOT: Bazı laboratuvarlarda, miyograf deneylerine başlamadan önce kan damarının değişkenliğini sağlamak için kan segmentleri üç kez üst üste yüksek bir K + çözeltisine tabi tutulur. Bu protokolde, yeni izole edilmiş aort segmentleri, dokuyu daha ileri deneyler için kullanmadan önce iki kez yüksek bir K + çözeltisine tabi tutulur. Bunu tüm deneylerde tutarlı tutmak önemlidir. - Deneyde kullanılan diğer vazokonstriktör ve vazodilatör ajanlara yanıt olarak kayıtlı değerleri normalleştirmek için yüksek bir K + çözeltisine yanıt olarak iki kayıtlı kuvvet geliştirme zirvesinin (büzülme kuvveti) ortalamasını kullanın.
- Dokuyu 15-20 dakika dinlendirin.
- Aort segmentlerini vazokonstriktör ajan fenilefrin (PE) ile önceden belirlenmiş bir sub-maksimum dozda (odadaki 10 μM nihai konsantrasyon) önceden sözleşmelendirin.
NOT: Alt maksimum fenilefrin dozu (10 μM), aort segmentlerinin 1 nM, 5 nM, 10 nM, 50 nM, 100 nM, 500 nM, 1 μM, 5 μM, 10 μM ve 50 μM'lik nihai konsantrasyonlarda artan konsantrasyonlarda fenilefrin çözeltisinin artan konsantrasyonlarına tabi tutulduğu ayrı bir deney setinde belirlenmiştir. Sonuç olarak, 10 μM fenilefrin nihai konsantrasyonunun, kasılma kuvveti bir platoya ulaşmadan hemen önce olan 2 mm aort segmentlerinde alt maksimum büzülme kuvvetini (maksimum kuvvetin% 90'ı) üretebileceği belirlenmiştir. Sub-maximum fenilefrin konsantrasyonunun kullanılmasının nedeni, aort dokusu doygunluğu veya vazokonstriksiyon agonistine duyarsızlaşma ile ilgili sorunlardan kaçınmaktır. - PE kaynaklı büzülme eğrisinin gerilim (kuvvet) gelişimi için bir platoya ulaşmasına izin verin (Şekil 5).
- Fenilefrin için gerilim gelişimi platosunda, miyograf odasında asetilkolinin nihai konsantrasyonlarını aşağıdaki gibi oluşturmak için 3 dakikalık aralıklarla 5 μL artan dozlarda asetilkolin çalışma stok çözeltileri ekleyerek asetilkolin doz-yanıt eğrisini gerçekleştirin: 50 pM, 100 pM, 500 pM, 1 nM, 5 nM, 10 nM, 50 nM, 100 nM, 500 nm ve 1 μM (Şekil 6).
NOT: Her bir asetilkolin dozunu ekledikten sonra, bir sonraki dozu eklemeden önce en az 3 dakika bekleyin (gerginliğin bir platoya ulaşması için). - Her adımda, herhangi bir doku rahatsızlığını önlemek için asetilkolin stok çözeltisini odaya çok yavaş ve aort halkalarından çok uzakta pipetleyin.
- Doz-yanıt deneyini tamamladıktan sonra, odaları boşaltın ve ilacın kalan kalıntılarını gidermek için aort segmentlerini ılık ve havalandırılmış HEPES-PSS çözeltisi 3x ile yıkayın.
- Bir sonraki deney adımlarına başlamadan önce dokuyu 30 dakika dinlendirin. Aortun canlılığı, HEPES-PSS yüksek K+ çözeltisi kullanılarak her deneysel adımdan önce kontrol edilir. Tüm hazırlık ve deney adımları doğru bir şekilde takip edilirse, aort dokusunun yaşayabilirliği tüm deney süresince (4-6 saat) aynı kalacaktır.
7. NO üretiminin genel inhibitörlerinin endotel aracılı vazogevşeme üzerine etkileri
- Segmentleri en az 30 dakika boyunca dikkatlice yıkadıktan ve dinlendirdikten sonra deneyin bu kısmı için aynı aort dokusunu kullanın.
NOT: Çift damıtılmış suda 100 mM'lik bir N-nitro-L-arginin metil ester (L-NAME) çalışma çözeltisi hazırlamak için 30 dakikalık dinlenme süresini kullanın ve çözeltiyi deney süresince buz üzerinde tutun. - Aort segmentlerini 30 dakika dinlendirdikten sonra, odaları boşaltın ve her odaya taze, ılık yüksek K + (60 mM KCl) çözeltisi ekleyin.
NOT: Deneyin her bir parçası için, aort dokusuna en az bir kez yüksek bir K + çözeltisi ile meydan okunması önemlidir. Kaydedilen büzülme zirvesi, deneyin bu bölümünde toplanan verileri normalleştirmek için kullanılacaktır. - Yüksek K+ çözeltisine kasılma tepkisi bir platoya ulaşır ulaşmaz odaları tekrar boşaltın ve dokuyu HEPES-PSS çözeltisi 3x ile yıkayın.
- NO üretiminin gözlenen asetilkolin kaynaklı vazogevşemeye katkısını değerlendirmek için (bakınız bölüm 6.), bu aşamada, her miyograf odasında 200 μM'lik bir nihai konsantrasyon elde etmek için her miyograf odasına (5mL tampon çözeltisi içeren) L-NAME'in hazırlanan 100 mM çalışma stok çözeltisinin 10 μL'sini ekleyerek aort segmentlerini genel bir NO üretim inhibitörü (L-NAME) ile önceden inkübe edin.
NOT: L-NAME, NOS'un tüm izoformlarının (NO üretiminden sorumlu bir enzim) seçici olmayan ve güçlü bir inhibitörüdür ve bu nedenle, kan damarı duvarı9'da NO üretimini bloke etmek için etkili bir araç olarak kabul edilir. - L-NAME (30 dk) ile ön inkübasyon süresi boyunca aort segmentlerinin dinlenmesine izin verin.
- Bu noktada yıkamayın.
- L-NAME'i çıkarmadan, aort kasılmasını indüklemek için odaya maksimum fenilefrin dozunun (10 μM nihai konsantrasyonu) altını ekleyin.
NOT: L-NAME'in endojen NO üretimi üzerindeki inhibitör etkisi nedeniyle, fenilefrin kaynaklı aort kontraksiyonu için yeni kaydedilen zirve, dokunun L-NAME ile inkübe edilmesinden önce kaydedilen ilk zirveden çok daha yüksek olacaktır. Bu, L-NAME'in aort duvarındaki bazal NO üretimi üzerindeki etkisinden dolayı beklenir, bu da daha yüksek kuvvet üretimine yol açar (düz kas tarafından daha yüksek kasılma kuvveti üretimi nedeniyle). - Fenilefrin kaynaklı kasılma eğrisi gerilim (kasılma kuvveti) gelişimi için bir platoya ulaşana kadar bekleyin.
- Bu noktada, 500 nM'lik bir nihai konsantrasyon elde etmek için miyograf odasına asetilkolin ekleyin (bu, protokolün 5. bölümünde açıklanan deneyler sırasında oluşturulan asetilkolinin alt maksimum konsantrasyonudur).
- Oluşan plato stabil olana kadar kuvvet gelişimindeki olası değişiklikleri kaydetmek için birkaç dakika bekleyin (Şekil 7).
NOT: L-NAME'in endotel tabakasının asetilkoline yanıt olarak NO üretme kabiliyeti üzerindeki inhibitör etkisi nedeniyle, aort endotelyal NOS (eNOS) asetilkolin uygulamasına yanıt olarak NO üretemediğinden, fenilefrine yanıt olarak kayıtlı kuvvet üretiminde herhangi bir değişiklik görülmesi beklenmemektedir. - Odaları boşaltın ve dokuyu ılık, havalandırılmış HEPES-PSS çözeltisi 3x ile yıkayın.
8. Endotel tabakasının aort vazogevşemesine katkısı
- Aort vazogevşemesinde endotel tabakasının rolünü vurgulamak için, endotel tabakalarının çıkarıldığı endotel kaynaklı aort segmentlerinde asetilkolin kaynaklı vazogevşemeyi test edin.
- Miyograf odasını mikroskop altına yerleştirin ve aortun lümeninden küçük bir teli (tel miyografisi için kullanılan aynı tel burada kullanılabilir) yavaşça geçirin. Teli kısa bir süre için lümenden (yumuşak dairesel hareket) yavaşça hareket ettirin. Bu, endotel veya intima'yı çıkarmak için yeterlidir.
- Aortu 2 mm'lik aort halkaları halinde kesin ve bu halkaları daha önce tarif edildiği gibi miyograf odasına monte edin.
- Optimum gerilimi 6 mN'ye ayarlayın ve dokunun havalandırılmış, sıcak HEPES-PSS tamponunda 30 dakika dinlenmesine izin verin
- 30 dakikalık denge süresinin sonunda, odaları boşaltın ve her odaya 5 mL taze, ılık, havalandırılmış HEPES-PSS çözeltisi ekleyin.
- Mikrometreyi saat yönünün tersine çevirerek tüm miyograf odaları için kuvveti sıfırlayın.
- Kaydedilen kuvvet fare aortu için istenen optimum gerilime ulaşana kadar pimler arasındaki mesafeyi artırmak için mikrometreyi saat yönünün tersine yavaşça döndürün (C57BL/6J fare aortu için 6 mN). Dokuyu optimal gerginlikte (6 mN) 15-20 dakika daha dinlendirin.
- Her odaya 5 mL yüksek K+ çözeltisi eklemeden önce odaları 1 kat daha boşaltın.
- Yüksek K+ çözeltisine kasılma tepkisi bir platoya ulaşır ulaşmaz odaları tekrar boşaltın ve dokuyu HEPES-PSS çözeltisi 3x ile yıkayın. Dokuyu 15-20 dakika dinlendirin
- Aort segmentlerini vazokonstriktör ajan fenilefrin (odadaki 10 μM nihai konsantrasyon) ile önceden sözleşmelendirin.
NOT: Endotelin çıkarılması nedeniyle, aort duvarındaki bazal NO üretimi önemli ölçüde azalır; bu nedenle, fenilefrin kaynaklı kontraksiyonun zirvesinin (kuvvet üretiminin zirvesi), endotel tabakasından yoksun aort dokusunda daha yüksek olması beklenmektedir. - Fenilefrin kaynaklı kuvvet bir platoya ulaştığında, 500 nM'lik bir nihai konsantrasyon elde etmek için miyograf odasına maksimum asetilkolin konsantrasyonunu ekleyin.
NOT: Endotel tabakasının çıkarılması uygun şekilde yapılırsa, endotel tarafından asetilkolin ile indüklenen NO üretimi, endotel tabakasının çıkarılması nedeniyle azalmış olacağından, kayıtlı fenilefrin kaynaklı kuvvette herhangi bir değişiklik olmayacaktır. Kaydedilen iz, L-NAME varlığında gözlemlenene çok benzer olacaktır (bölüm 7.). - Deneyi sonlandırmadan önce fenilefrin kaynaklı kuvvet gelişimi için kayıtlı platonun değişmediğinden emin olmak için 3 dakika bekleyin (Şekil 8).
NOT: Asetilkolin uygulaması platodayken fenilefrin kaynaklı kasılmada herhangi bir düşüşe neden oluyorsa, bu endotel tabakasının tamamen çıkarılmadığının bir göstergesidir.
Sonuçlar
Burada açıklanan tensometrik küçük oda miyografi protokolü, küçük ve büyük arterlerde vasküler reaktiviteyi ölçmek için standart yöntemdir ve aynı deneysel küçük laboratuvar hayvanından dört kan damarı segmentine kadar vasküler reaktivitenin eşzamanlı ölçümlerine izin verir. Bu yazıda, sistemi özellikle izole fare aortundaki endotel fonksiyonunu ölçmek için kullanıyoruz (Şekil 1). Bu protokolde, izole aort segmentleri, iki küçük paslanmaz çelik pim (Şekil 3) arasındaki küçük bir organ odasına (Şekil 2) monte edilir. Miyograf odası, 8 mL'ye kadar tampon çözeltisi tutabilir ve deneyler süresince izole edilmiş damarlar için yarı fizyolojik bir ortam sağlayabilir. Her deneyden önce, izole edilmiş her bir segmentin yaşayabilirliğinin test edilmesi ve doğrulanması çok önemlidir. Her izole damar segmentinin bütünlüğünü ve yaşayabilirliğini sağlamak için standart protokol, düz kas zarı depolarizasyonunu indüklemek için yüksek konsantrasyonda potasyum klorür içeren dokuya meydan okumaktır. İzole edilen kabın sağlıklı ve duyarlı olduğu senaryosunda, büzülme kuvveti oluşumunu ekrana kaydedebiliriz (Şekil 4). Kaydedilen kuvvetin zirvesi daha sonra protokol sırasında kullanılan agonistlere (örneğin, fenilefrin) yanıt olarak aynı segment için kuvvet üretimini normalleştirmek için kullanılır. Endotel aracılı vazogevşemeyi ölçmek için, aort dokusunu, düz kas aracılı kasılmaya ve kuvvet oluşumuna neden olan fenilefrin sub-maksimum konsantrasyonu (10 μM) ile önceden kasılmak gerekir (Şekil 5). Fenilefrin kaynaklı kontraksiyon bir platoya ulaştığında (Şekil 6), izole segmentte maksimum vazogevşemeyi sağlamak için artan asetilkolin dozları birden fazla adımda uygulanır (Şekil 6). Damar gevşeme seviyesi, endotel aracılı nitrik oksit üretiminin dolaylı bir ölçümüdür. Aort halkalarında asetilkolin kaynaklı vazogevşemenin nitrik oksit üretimine bağlı olduğunu daha da doğrulamak için, aort segmentleri, fenilefrin uygulamasından önce 30 dakika boyunca genel bir nitrik oksit üretimi inhibitörü (200 μM L-NAME) ile ön işlemden geçirilir. Şekil 7'de gösterildiği gibi, L-NAME, önceden kontrakte edilmiş aortta asetilkolin kaynaklı vazogevşemeyi tamamen bloke edebilir ve asetilkolinin nitrik oksit üretimini artırarak aort vazogevşemesini indüklediği gerçeğini vurgulamaktadır. Öte yandan, endotel tabakasının aort segmentlerinden çıkarılması da asetilkolin kaynaklı vazogevşemeyi bloke ederek endotelin kan damarı gevşemesinde oynadığı rolün altını çizer (Şekil 8).
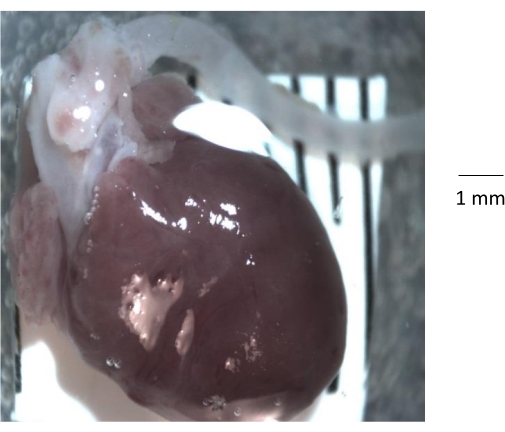
Şekil 1: 6 aylık bir kontrol faresinden izole edilen kalbin, aort kökünün ve inen aortun kaba anatomik görünümü. Göğüs kafesini fareden çıkardıktan sonra, kalp ve aort göğüs kafesinden izole edilir ve temiz bir silikon elastomer kaplı Petri kabına aktarılır. Aortu izole etmeden önce, tüm yağ ve bağ dokusunu ve herhangi bir kan pıhtısını aortun lümeninden çıkarmak önemlidir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: 200 μm montaj pimlerini gösteren miyograf ünitesinin bir odasının temsili bir görüntüsü. Gösterildiği gibi, miyograf odasının içindeki iki pim zar zor dokunuyor. Odayı kullanmadan önce, pimlerin düzgün bir şekilde hizalandığından emin olmak çok önemlidir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Aort segmentlerinin miyograf odasına sabitlenmesi. 6 aylık bir C57BL/6 fareden izole edilen 2 mm'lik bir fare aort segmenti, bir miyograf odasının içindeki iki pim tarafından tutulur. Bu, forseps kullanarak aortun iki montaj pimine hafifçe kaydırılmasıyla elde edilir. Kırmızı noktalı kutu, miyograf odasındaki iki pim arasına monte edilen 2 mm'lik aort segmentinin yakınlaştırılmış görüntüsünü gösterir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
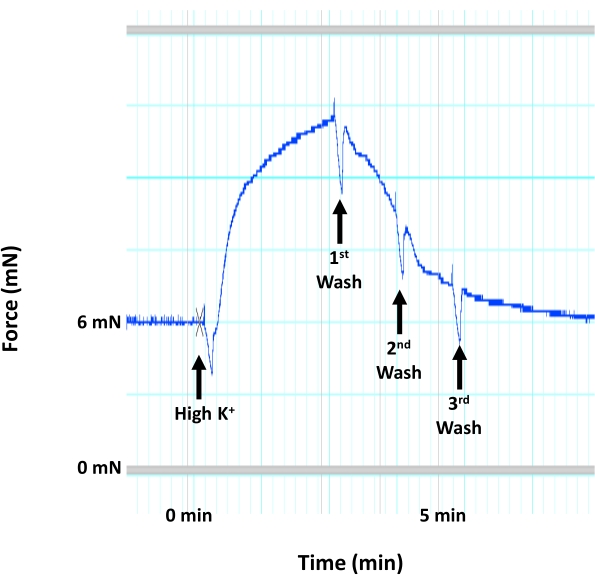
Şekil 4: Düz kas zarı depolarizasyonuna bağlı aort kasılması. Aortun medial tabakasında düz kas zarı depolarizasyonunu ve kasılmasını indükleyecek yüksek konsantrasyonda K+ (60 mM KCl) yanıt olarak fare aort kasılmasının (kuvvet oluşturma) izini gösteren temsili görüntü. Yüksek K+ çözeltisinin uygulanmasının hemen ardından sıcak, havalandırılmış HEPES-PSS çözeltisi kullanılarak üç ardışık yıkama yapılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
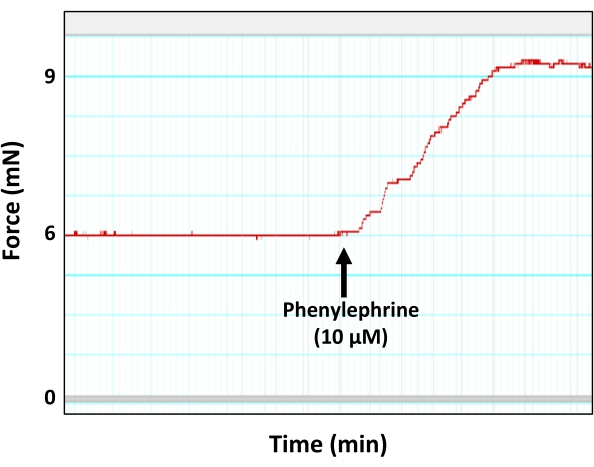
Şekil 5: Vazokonstriktasyon ajanı fenilefrine yanıt olarak aort kontraksiyonu. Fenilefrin (10 μM) sub-maksimum konsantrasyonuna yanıt olarak aort halkası tarafından kuvvet oluşumunu (kasılmayı) gösteren temsili miyograf izi. Gösterildiği gibi, fenilefrin kaynaklı kasılmanın zirvesi sonunda bir platoya ulaşır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
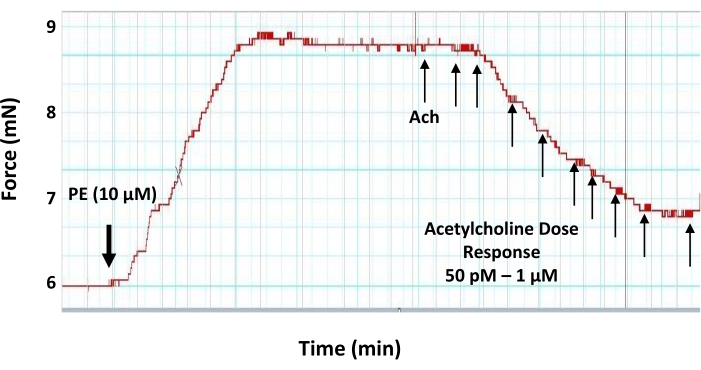
Şekil 6: Asetilkolinin önceden kontrakte edilmiş aort halkası üzerindeki doz-yanıt etkileri. Vazodilatör nörotransmitter asetilkolinin 2 mm önceden kontrakte edilmiş bir aort halkası üzerindeki doz-yanıt (50 pM-1 μM) vazodilatatör etkisini gösteren temsili miyograf izi. Aort halkası, asetilkolin uygulamasından önce 10 μM fenilefrin ile önceden büzülür. İlk asetilkolin dozu, fenilefrin kaynaklı gerilim bir platoya ulaştığında eklenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
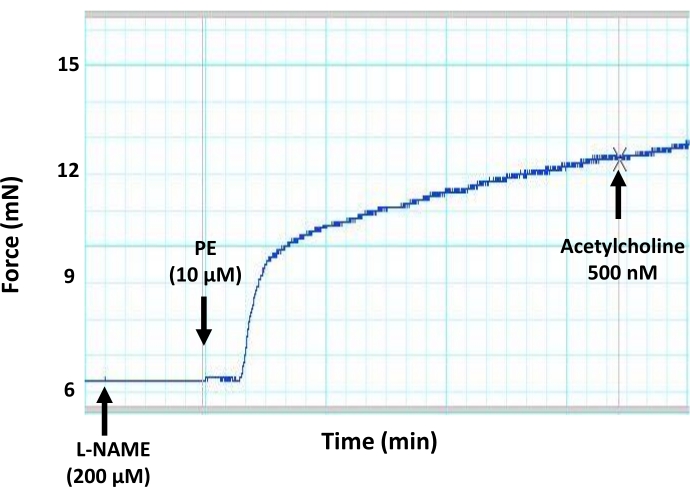
Şekil 7: Genel bir NO üretim inhibitörünün (L-NAME) fare aortunda endotel aracılı vazogevşeme üzerine etkileri. Aort segmentlerinin genel bir NO üretim inhibitörü (L-NAME, 200 μM nihai konsantrasyon) ile preinkübasyonunun, önceden kontrakte edilmiş bir aort halkasında asetilkolin kaynaklı vazodilatasyonu bloke ettiğini gösteren temsili miyograf izi. Bunun nedeni, L-NAME'in eNOS üzerindeki inhibitör etkisine bağlı olarak endotel tarafından NO üretiminin inhibe edilmesidir. Asetilkolin, önceden kontrakte edilmiş aort segmentine 500 nM'nin altındaki maksimum konsantrasyonda ilave edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
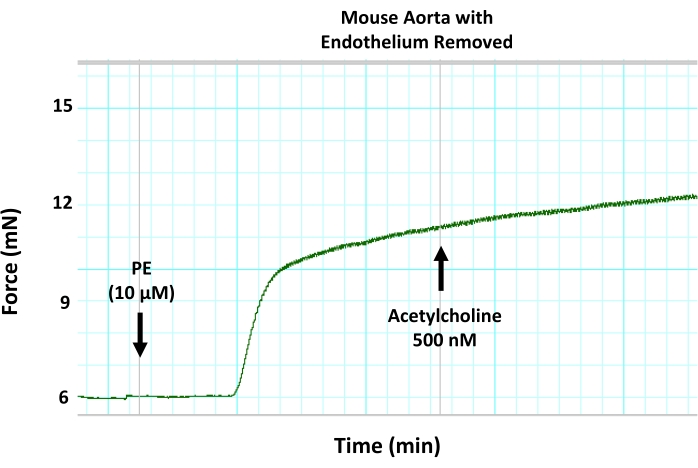
Şekil 8: Fare aortunda mekanik endotel çıkarılmasının endotel aracılı vazogevşeme üzerine etkileri. Tel denudasyonu kullanılarak endotelin aort segmentlerinden çıkarılmasının, önceden kontrakte edilmiş bir aort halkasında asetilkolin kaynaklı vazodilatasyonu bloke ettiğini gösteren temsili miyograf izi. Bunun nedeni endotel aracılı vazogevşemenin inhibisyonudur. Asetilkolin, önceden kontrakte edilmiş aort segmentine 500 nM'nin altındaki maksimum konsantrasyonda ilave edildi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Vasküler biyoloji alanı, araştırmacıların kan damarı duvarının fonksiyonel ve yapısal bütünlüğünü değerlendirmelerine yardımcı olan araçlara büyük ölçüde dayanmaktadır. Ayrıca, üç kan damarı katmanı arasındaki doğrudan ve dolaylı etkileşimlere özel dikkat gösterilmesini gerektirir: intima, medya ve adventitia. Bu üç katman arasında intima, endotel hücrelerinin tek katmanından oluşur ve vasküler sağlığı ve hemostazı düzenlemede çok önemli bir işleve sahiptir.
Endotel tabakasına verilen herhangi bir hasarın, NO ve diğer vazodilatatör faktörleri serbest bırakma yeteneğini olumsuz yönde etkileyebileceği, ateroskleroz, anevrizma ve vaskülit10,11,12 gibi çeşitli vasküler bozukluklarda gözlenen vasküler fonksiyonun düzensizliğine yol açabileceği iyi bilinmektedir. Normal endotel fonksiyonunu kontrol eden altta yatan mekanizmaları anlamak ve vasküler duvar içindeki endotelin vazodilatatör fonksiyonunu ve bütünlüğünü değerlendirmek için, in vivo fizyolojik koşulları taklit eden standart bir deney sistemi kullanmak zorunludur.
Aort gibi büyük arterler için, küçük odacıklı tensometrik (izometrik) miyografi, ex vivo bir ortamda kan damarı için mevcut en iyi, fizyolojik koşullara yakın koşulları yaratan güvenilir bir araç olarak kabul edilmektedir. Sistem ayrıca, laboratuvar ortamında dokunun canlılığını oldukça uzun bir süre (6-8 saate kadar) korumaya izin vererek tekniği değerli ve çok yönlü bir araç haline getirir. Diğer bir avantaj, miyograf odasının kan damarı halkalarının arka arkaya farklı deneyler için tutulmasına ve yeniden kullanılmasına izin vermesidir, böylece çok sayıda deneysel fareye olan ihtiyacı azaltırken uygun maliyetli bir yaklaşım haline getirir. Dört odacıklı bir miyograf sistemi kullanılarak aynı anda dört adede kadar kan damarı segmenti test edilebilir, bu da deneyler arasındaki varyasyonları azaltırken tutarlılığı arttırır.
Endotel tabakasının kan damarlarındaki işlevini incelemek için çeşitli farmakolojik ve mekanik araçlar kullanılabilir. Fonksiyonel bir endotelin ana belirteci, endotel tabakası tarafından üretilen ve salınan en önemli vazodilatatör ajan olarak bilinen NO'nun normal üretimidir. Endotel disfonksiyonu esas olarak NO üretiminde önemli bir düşüşle ilişkilidir ve hipertansiyon, tromboz ve ateroskleroz gibi farklı vasküler bozuklukların ilerlemesinde rol oynadığı gösterilmiştir.
Vasküler yatak içinde, NO üretimi esas olarak kan akışı ve basıncındaki değişikliklerle veya sitoplazmik kalsiyum konsantrasyonunda değişikliklere veya hormonlara ve büyüme faktörlerine yanıt olarak sinyal yolaklarının aktivasyonuna yol açabilecek diğer hücre içi olaylarla kontrol edilir13,14. NO üretimindeki değişiklikler, endotel disfonksiyonunun erken ve güvenilir belirteçlerinden biri olarak kabul edilir ve genellikle kardiyovasküler bozuklukların ilerlemesi sırasında erken tespit edilebilir. Hastalık modelinden bağımsız olarak, vasküler biyologlar endotel fonksiyonunun ölçülmesine izin veren araçlar ve tahlillerle çok ilgilenmektedir. Fizyolojik koşulları taklit eden bir platform kullanarak kan damarının çeşitli katmanlarının katkısı arasında ayrım yapabilmek özellikle önemlidir.
Küçük bir odacıklı miyografta, araştırmacılar sıkı bir şekilde kontrol edilen bir ortamda endotel fonksiyonunu ölçmek için farmakolojik ve mekanik araçları kullanabilirler. Miyograf odasının içinde, kan damarının normal işlevini destekleyebilecek yapay bir ortam yaratılır. Böyle yapay bir ortamda, izole kan damarı segmentleri çevreleyen bağ dokusu ve diğer organlar tarafından desteklenmediğinden, izole segmentlerin vazopresörlere yanıt olarak mümkün olan maksimum kasılmayı üretebileceği optimal pasif gerilimi belirlemek önemlidir. Optimal gerginlikte, kan damarı duvarının düz kas tabakasının yapısal ve fonksiyonel bütünlüğünü test etmek için fenilefrin veya norepinefrin gibi vazokonstriktleştirici ajanlara normal maksimum kontraktil yanıt ölçülebilir. Laboratuvarda, 6 mN'lik pasif gerilimin 2 mm fare aort segmentleri15 için uygun bir gerilim olduğu belirlenmiştir. Bununla birlikte, farklı türlerdeki farklı arter tipleri için optimal pasif gerilim belirlenmelidir16.
Ek olarak, izole kan damarları ile herhangi bir deney yapmadan önce, canlı ve kullanılabilir doku için dahil etme ve dışlama kriterlerini karşıladıklarından emin olmak için izole halkaların yaşayabilirliğini test etmek zorunludur. Bu genellikle izole halkaların yüksek konsantrasyonlu K+ çözeltisine (60 mM KCl) maruz bırakılmasıyla elde edilir. Bu, voltaj kapılı kalsiyum kanallarının (VGCC) açılması nedeniyle düz kas zarının depolarizasyonu ile sonuçlanır ve düz kas kasılmasına ve aort vazokonstriksiyonuna yol açar. Bu yöntem, daha sonraki deneyler için bu segmentleri kullanmadan önce aort segmentlerinin yaşayabilirliğini doğrulamak için kullanılır.
Öte yandan, endotel tabakasının fonksiyonel özelliklerini test etmek için asetilkolin gibi vazodilatasyon ajanları kullanılabilir. Endotel tabakası sağlam ve işlevsel ise, o zaman maksimum asetilkolin konsantrasyonu, önceden büzülmüş bir kan damarı segmenti17'de gevşemeye neden olabilir. Asetilkolin kaynaklı gevşemenin büyüklüğü, endotel tabakasından NO salınım seviyesinin bir göstergesidir. Endotel tabakasındaki herhangi bir hasar (mekanik veya fonksiyonel) NO üretimi ve damar vazodilatatör yanıtı üzerinde bir etkiye sahip olacaktır. Bu protokolde, sağlanan veriler, asetilkolinin önceden büzülmüş fare aortunda doza bağımlı bir şekilde gevşemeye neden olabileceğini ve 500 nM'lik son konsantrasyonda elde edilen maksimum gevşemenin altında olduğunu göstermektedir (Şekil 6).
Bazı deneylerde, araştırmacılar vazodilatör NO'ya düz kas doğrudan tepkisini ölçmekle ilgileniyorlar. Bu tür deneylerin odağı sadece düz kas fonksiyonu üzerinde olduğundan, araştırmacıların endotel tabakasını kan damarı segmentinden çıkararak (inuding) endotel katkısını atlamalarına izin verecek bir protokol vardır. Endotel, hava, parmaklar arasında yuvarlanma veya tel ile çıkarılma dahil olmak üzere çeşitli yöntemlerle çıkarılabilir. Bu tür deneysel ortamlarda, denuded kan damarı (endotel tabakası olmadan) nitrogliserin ve sodyum nitroprusside gibi NO donörlerine maruz kalır. Bu, NO'ya yanıt veren düz kas siklik GMP-protein kinaz G sinyal yolunun sağlam ve işlevsel olup olmadığını belirlemeye izin verir 7,18. Bu yazıda, izole aort segmentindeki endotel tabakasının çıkarılmasının asetilkolin vazodilatatör etkilerini nasıl tamamen bloke ettiği açıklanmış, kan damarı gevşemesi ve vazodilatasyonunda NO salınımının önemini vurgulamıştır (Şekil 8).
Tel ve tensometrik miyograf teknikleri vasküler biyoloji deneylerinde geniş bir faydaya sahip olsa da, potansiyel sınırlamalara dikkat etmek önemlidir. Spesifik olarak, tensometrik sistemin doku boyutu sınırlamaları vardır (yani, daha küçük vaskülatür). Ek olarak, bu tekniğin ex vivo doğası, in vivo vasküler fonksiyonun ve hemodinamik parametrelerin daha hassas bir şekilde taklit edilmesi için intraluminal basıncın ve akışın manipülasyonuna izin vermez. Basınçlı miyograf kurulumları aslında bu değişkenleri hesaba katacak ve gerçek zamanlı vasküler dinamikleri simüle ederken, aynı zamanda daha küçük dirençli arterlerin kullanılmasına izin verecektir. Ek olarak, tel miyograf deneyleri fizyolojik koşulları tam olarak kopyalayamaz veya dolaşımdaki kan, damar duvarları ve çevredeki doku arasındaki etkileşimleri doğru bir şekilde modelleyemez ve bu da vücuttaki vasküler fonksiyonun düzenlenmesinde önemli rol oynar.
Miyografi deneylerinde kullanılan deneysel protokolden veya deneyde seçilen vazokonstriktör/vazodilatörden bağımsız olarak, küçük odacıklı miyografi sistemi, kan damarı reaktivitesini ve fonksiyonel bütünlüğünü ölçmek için güvenilir, tekrarlanabilir ve stabil bir yarı fizyolojik platform sağlar. Bu raporun odak noktası sadece endotel fonksiyonunun temel ölçümü olmasına rağmen, miyografi sistemi kan damarının stres/gerinim ilişkisi, vasküler duvar kuvveti, rüptür noktası ve pasif ve aktif kontraksiyon gibi diğer birçok fonksiyonel özelliğini değerlendirmek için kullanılabilir. Bu, miyograf sisteminin vasküler biyoloji alanında güvenilir bir araç olarak değerini vurgulamaktadır.
Açıklamalar
Yazarlar, rekabet eden finansal çıkarları olmadığını beyan ederler.
Teşekkürler
Bu çalışma, Ulusal Sağlık Enstitüleri (R15HL145646) ve Midwestern Üniversitesi Lisansüstü Çalışmalar Koleji'nin finansmanıyla desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetylcholine | SigmaAldrich | A6625-100G | |
| CaCl2 | SigmaAldrich | C4901-1KG | |
| Carbogen gas | Matheson | H103847 | |
| Dissecting scissors | FST | 91460-11 | |
| DMT 620 Multi chamber myograph system | DMT | DMT 620 | Multi chamber myograph system |
| Dumont forceps | FST | 91150-20 | |
| EDTA | SigmaAldrich | E5134-10G | |
| Glucose | SigmaAldrich | G8270-1KG | |
| HEPES | SigmaAldrich | H7006-1KG | |
| KCl | SigmaAldrich | P9541-1KG | |
| KH2PO4 | SigmaAldrich | P5655-1KG | |
| LabChart | ADI instruments | Data acquisition software | |
| Light source | Volpi | 14363 | |
| L-Name | Fischer Scientific | 50-200-7725 | |
| MgSO4 | SigmaAldrich | M2643-500G | |
| Microscope | Leica | S6D | stereo zoom microscope |
| NaCl | SigmaAldrich | S5886-5KG | |
| NaHCO3 | SigmaAldrich | S5761-500G | |
| Organ bath system | DMT | 720MO | |
| Phenylephrine | SigmaAldrich | P6126-10G | |
| Pump | Welch | 2546B-01 | |
| Software | ADI instruments | LabChart 8.1.20 | |
| Spring Scissors | FST | 15003-08 | |
| Sylgard 184 Kit | Electron Microscopy Services | 24236-10 | silicone elastomer kit |
| Tank Regulator | Fischer Scientific | 10575147 | |
| Water bath system | Fischer Scientific | 15-462-10 |
Referanslar
- Wenceslau, C. F., et al. Guidelines for the measurement of vascular function and structure in isolated arteries and veins. American Journal of Physiology-Heart and Circulatory Physiology. 321 (1), 77-111 (2021).
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction: Testing and clinical relevance. Circulation. 115 (10), 1285-1295 (2007).
- Lerman, A., Zeiher, A. M. Endothelial function: Cardiac events. Circulation. 111 (3), 363-368 (2005).
- Rajendran, P., et al. The vascular endothelium and human diseases. International Journal of Biological Sciences. 9 (10), 1057-1069 (2013).
- Galley, H. F., Webster, N. R. Physiology of the endothelium. British Journal of Anaesthesia. 93 (1), 105-113 (2004).
- Orita, H., et al. In vitro evaluation of phosphate, bicarbonate, and Hepes buffered storage solutions on hypothermic injury to immature myocytes. Cardiovascular Drugs and Therapy. 8 (6), 851-859 (1994).
- Liu, Y. H., Bian, J. S. Bicarbonate-dependent effect of hydrogen sulfide on vascular contractility in rat aortic rings. American Journal of Physiology. Cell Physiology. 299 (4), 866-872 (2010).
- Griffiths, K., Madhani, M. The use of wire myography to investigate vascular tone and function. Methods in Molecular Biology: Atherosclerosis. 2419, 361-367 (2022).
- Pfeiffer, S., Leopold, E., Schmidt, K., Brunner, F., Mayer, B. Inhibition of nitric oxide synthesis by NG-nitro-L-arginine methyl ester (L-NAME): Requirement for bioactivation to the free acid, NG-nitro-L-arginine. British Journal of Pharmacology. 118 (6), 1433-1440 (1996).
- Bacon, P. A. Endothelial cell dysfunction in systemic vasculitis: New developments and therapeutic prospects. Current Opinion in Rheumatology. 17 (1), 49-55 (2005).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: Current concepts and clinical implications. Frontiers in Medicine. 8, 798958(2021).
- Mikolajczyk, K., et al. The important role of endothelium and extracellular vesicles in the cellular mechanism of aortic aneurysm formation. International Journal of Molecular Sciences. 22 (23), 13157(2021).
- Vallance, P., Hingorani, A. Endothelial nitric oxide in humans in health and disease. International Journal of Experimental Pathology. 80 (6), 291-303 (1999).
- Tousoulis, D., Kampoli, A. M., Tentolouris, C., Papageorgiou, N., Stefanadis, C. The role of nitric oxide on endothelial function. Current Vascular Pharmacology. 10 (1), 4-18 (2012).
- Gibson, C., et al. Mild aerobic exercise blocks elastin fiber fragmentation and aortic dilatation in a mouse model of Marfan syndrome associated aortic aneurysm. Journal of Applied Physiology. 123 (1), 147-160 (2017).
- Xiao, X., Ping, N. N., Li, S., Cao, L., Cao, Y. X. An optimal initial tension for rat basilar artery in wire myography. Microvascular Research. 97, 156-158 (2015).
- Chung, A. W., Yang, H. H., Yeung, K. A., van Breemen, C. Mechanical and pharmacological approaches to investigate the pathogenesis of Marfan syndrome in the abdominal aorta. Journal of Vascular Research. 45 (4), 314-322 (2008).
- Zhong, C., et al. Age impairs soluble guanylyl cyclase function in mouse mesenteric arteries. International Journal of Molecular Sciences. 22 (21), 11412(2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır