Method Article
テンソメトリック小容量チャンバーミオグラフィを用いたマウス胸部大動脈の内皮依存性血管弛緩の測定
要約
本プロトコルは、マウス大動脈内皮機能の実験的 ex vivo 評価におけるマルチチャンバーミオグラフシステムを用いたテンソメトリックミオグラフ技術の概念および技術的適用を記載する。
要約
小容量チャンバーテンソメトリックミオグラフィは、実験動物およびヒト組織から分離された小動脈の小血管および大血管の血管収縮性を評価するために一般的に使用される技術です。この技術により、研究者は、血管収縮または血管拡張を誘発する可能性のあるさまざまな薬理学的物質で孤立した血管に挑戦しながら、さまざまな環境要因に適応するオプションを使用して、厳密に制御および標準化された(生理学的に近い)設定で孤立した血管を維持することができます。ミオグラフチャンバーはまた、平滑筋および内皮層の機能に別個または同時に影響を与える可能性のある様々なホルモン、阻害剤、およびアゴニストに応答して血管反応性を測定するためのプラットフォームを提供する。血管壁は、内膜(内皮層)、中膜(平滑筋およびエラスチン線維)、外膜(コラーゲンおよび他の結合組織)の3つの異なる層からなる複雑な構造である。各層の機能特性を明確に理解するには、3つの層すべてを同時に研究するための組み合わせアプローチを可能にする実験プラットフォームとシステムにアクセスすることが重要です。そのようなアプローチは、ex vivo設定におけるin vivo環境を模倣するであろう半生理学的状態へのアクセスを要求する。小容量チャンバーテンソメトリックミオグラフィは、血管特性に対する環境手がかり、実験変数、または薬理学的アゴニストおよびアンタゴニストの影響を評価するための理想的な環境を提供してきました。長年にわたり、科学者たちはテンソメトリックミオグラフ技術を使用して、さまざまな薬剤に応答して内皮機能と平滑筋収縮性を測定してきました。本報告では、小容量チャンバーテンソメトリックミオグラフシステムを使用して、単離されたマウス大動脈の内皮機能を測定します。このレポートは、胸部大動脈などの大きな動脈の小さなセグメントにおける内皮の機能的完全性を評価するために、小容量チャンバーテンソメトリックミオグラフィーをどのように使用できるかに焦点を当てています。
概要
過去数十年にわたり、小チャンバー筋電図システムは、 ex vivoのリアルタイム設定で、さまざまな薬理学的物質および神経伝達物質に応答して血管壁のさまざまな層の反応性を測定するために使用されてきました。血管反応性は、健康な機能的血管の主要成分であり、末梢および脳血管系の血流および灌流の調節に重要です1。血管壁内では、内皮層と平滑筋層の間の相互作用が血管緊張の主要な決定要因であり、血管壁(外膜)を取り巻く結合組織層の構造変化によっても常に影響を受けます。
内皮層は、一酸化窒素(NO)、プロスタサイクリン(PGI2)、内皮由来過分極因子(EDHF)などのいくつかの血管拡張因子を放出するか、エンドセリン-1(ET-1)やトロンボキサン(TXA2)などの血管収縮薬を産生することによって血管運動を制御します2,3,4。これらの要因の中で、NOは広く研究されており、炎症、遊走、生存、増殖などの他の重要な細胞機能におけるその重要な調節的役割は、科学文献で非常に引用されています2,5。
血管生物学の分野では、チャンバーミオグラフィは、血管生理学者および薬理学者に、厳密に制御された半生理学的システムにおける内皮機能を測定するための貴重で信頼性の高いツールを提供してきました1。現在、科学者が利用できる2つの異なる筋電視システムがあります:ワイヤー(またはピン)テンソメトリック(等尺性)筋電視と圧力筋図。ワイヤー筋電図システムでは、血管が2本のワイヤーまたはピンの間に引き伸ばされ、血管壁の力または張力の発達の等尺性測定が可能になりますが、圧力筋電図は、血圧の変化が血管緊張および血管運動の変化の主な刺激と見なされる小さな抵抗動脈における血管反応性の測定に適したプラットフォームです。腸間膜動脈や脳動脈などの小さな抵抗動脈の場合、圧迫筋電図検査は人体の生理学的条件に近い状態を作り出すという一般的な合意があります。小室筋計は、非常に小さな直径(200〜500μm)の血管から大動脈などのはるかに大きな血管に利用できます。
ワイヤーミオグラフが等尺性条件下で血管の張力を記録するための強力なシステムであるのに対し、圧力ミオグラフは等圧条件の変化に応じた血管径の変化を測定するためのより適切なシステムです。圧力または流れの変化に応じた血管の直径変化は、大動脈などの大きな弾性動脈と比較して、小さな筋肉動脈(細動脈)ではるかに大きくなります。これらの理由から、圧力筋計は、実質的な血管活性を有する小血管のためのより良いツールと考えられています1。マルチチャンバー小容量チャンバーテンソメトリックミオグラフィの他の実用的な強みの1つは、同じ動脈の複数の(最大4つの)セグメントを研究し、同じ動物から変動を減らし、堅牢で決定的なデータを生成することにより、血管反応性に対するさまざまなメカニズムの寄与を識別できることです。また、技術的にセットアップと保守も比較的簡単です。ほとんどすべてのサイズの血管は、ワイヤー筋グラフで研究することができます。これは、血管機能を評価するためのより費用効果の高いソリューションであり、解剖された血管の長さが圧力筋電視プロトコルに対して短すぎる実験における圧力筋電図の優れた代替手段です。
このレポートは、DMT-620マルチチャンバーミオグラフシステム(DMT-USA)を使用した小容量チャンバーテンソメトリックミオグラフィ技術の取り付けピンを使用して、孤立したマウス胸部大動脈リングの内皮機能を評価するための詳細なプロトコルを提供します。このプロトコルは、平均体重が25〜35 gの生後6か月のオスのC57BL6マウスを利用します。幸いなことに、このプロトコルは、このプロトコルを使用できる幅広い血管の種類と直径を考慮すると、さまざまな動物の種類と体重に適用できます。
プロトコル
すべての外科的処置および動物の世話は、中西部大学の施設内動物管理および使用および世話委員会(IACUC)によって承認されました(IACUC#AZ-3006、AZ-2936)。
1. バッファー調製
注:HEPES生理塩溶液(HEPES-PSS)バッファーは4°Cで7日間安定ですが、すべてのバッファーは各実験の日に作りたてにすることをお勧めします。他のすべての試薬およびアゴニストは、実験ごとに新たに調製する必要があります。このプロトコルで使用されるHEPES-PSSバッファーは、血管の血管拡張応答を維持しながら12時間以上細胞保護であることが示されている、ex vivo血管研究用の十分に確立されたバッファーです-この実験プロトコルの主な焦点6,7。
- HEPES-PSS溶液(pH 7.4)を調製する:10ミリモル/L HEPES、6ミリモル/Lグルコース、1.5ミリモル/L CaCl 2、130ミリモル/L NaCl、4ミリモル/L KCl、4ミリモル/L NaHCO3、1.2ミリモル/L MgSO 4、1.2ミリモル/L KH2 PO4、および0.03ミリモル/L EDTAを混合する。
- HEPES-PSS高K+ バッファーを調製します。これはHEPES-PSS溶液と同じですが、5 mmol/L HEPES、65 mmol/L NaCl、10 mmol/Lグルコース、1 mmol/L MgCl2、80 mmol/L KClを含み、MgSO4 およびEDTAを含まない点が異なります。
2.ミオグラフユニットの準備
- 電源を入れ、ウォーターバスを37°Cに設定します。 適切な水位を確保してください。
- 適切にラベル付けされた2つのビーカーを水浴に入れます.1つは600 mLのHEPES-PSS溶液、もう1つは150 mLの高K + 溶液です。
- 300 mLのHEPES-PSS溶液のビーカーをカルボゲンガス(5%CO2 および95%O2)で少なくとも10分間通気します。
- 通気したHEPES-PSS溶液30 mLを50 mLの遠沈管に加え、適切にラベル付け(胸郭、マウス識別番号)、氷上に置きます。残りの通気HEPES-PSS溶液を氷上に保ち、大動脈解離プロセス中に使用します。
- 4室筋電視ユニットの電源を入れます。各筋電計チャンバーにHEPES-PSS溶液6 mLを加え、熱を37°Cに設定します。 各チャンバー内の溶液を(カルボゲン混合物で)30分間通気し、チャンバーが目的の37°Cに達したことを確認します(この待機期間を使用してマウス大動脈を解剖します)。
- ミオグラフデータ収集ハードウェアとコンピューターの電源を入れます。
3.マウス大動脈分離
- 実験用マウスを5%イソフルラン吸入で麻酔し、頸部脱臼により安楽死させます(このデモンストレーションには生後6か月のオスのC57BL / 6Jマウスを使用します)。
- マウスを仰臥位の外科用ボードに置き、サージカルテープを使用して付属肢をボードに固定します。
- 腹部に70%アルコールをスプレーして、毛皮が完全に濡れ、緩んだ/乾いた毛が切開部に入らないようにします。余分な溶液をそっと拭き取ります。
- 鉗子を使用して、胸骨の剣状突起よりすぐ下の腹部皮膚を見つけて隔離します。
- 肌をまっすぐ持ち上げて緊張感を高めます。ハサミを使用して鈍いカットを行い、表面の皮膚を取り除き、胸腔を露出させます。
- 剣状突起を持ち上げ、肋骨下縁に沿った突起のすぐ下の側方切開を行います。
- 外側切開を頭蓋状に伸ばして、胸郭の前部を取り除きます。
- 背骨、横隔膜の下、首を鈍く切って胸郭を取り外します。
注:研究者は動物から直接大動脈を取り除くこともできますが、血管を保護し、凝固した血液を大動脈から洗い流すように注意する必要があります。このプロトコルは、胸郭を取り外し、大動脈を注意深く洗浄して解剖する例を使用しています。実際には、この方法は迅速かつ効率的に実行でき、免疫組織化学、組織学、ウェスタンブロッティングなどの他の研究のために余分な組織を保存するのに有益です。 - 胸郭を氷冷曝気HEPES-PSSバッファーで満たされた透明なシリコーンエラストマーコーティングされたペトリ皿に移し、両側に固定します。
注意: シリコーンエラストマーキット(材料表)を使用してください。基剤と硬化剤(重量比10:1)を混合し、ガラスシャーレに注ぎ、25°Cで24時間硬化させます。 - ペトリ皿をステレオズーム顕微鏡下に置き、心臓と付着した大動脈を胸郭から静かに切断して取り外し、清潔で透明なシリコーンエラストマーコーティングされた皿に移します(図1)。
- 次に、脂肪と結合組織、および凝固した血液を大動脈からそっと取り除きます。鋭利で小さなハサミを使用して、アーチ領域から下行大動脈の下部まで大動脈全体を解剖して分離します。大動脈弓は筋電図実験には適していませんが、組織学的研究には使用できることを忘れないでください。
- 解剖全体を通して冷曝気HEPES-PSS溶液を使用してください。ソリューションは 10 分ごと、または可視性が損なわれたときに、最初に変更します。各大動脈リングは、解剖後20分以内(最大60分)に筋鏡室に取り付けることをお勧めします。
4.大動脈セグメントの筋鏡室への取り付け
- 鋭利な小さな外科用ハサミを使用して、解剖した大動脈をそれぞれ2 mmの4つのセグメントに切断します。皿の中のミニ定規を参考にしてください。
- ミオグラフチャンバーをステレオズーム顕微鏡の下に置き、ピンを簡単に視覚化し、ピンがほぼ接触するようにマイクロメータを設定します(図2)。
- 両方のティッシュ保持ピンが正しく位置合わせされていることを確認してください。
- 内皮への損傷を防ぐために、セグメントを取り付けている間は大動脈を挟まないように注意してください。
- すでに5 mLの加温および通気されたHEPES-PSSバッファーを含むチャンバーで、鉗子を使用して2 mmの大動脈セグメントのそれぞれを2つの取り付けピンに慎重にスライドさせます。大動脈セグメントをピンの上にスライドさせる間、非常に穏やかになります。内皮層は非常に壊れやすく、管腔側から非常に簡単に剥がれます。
- マイクロメータを反時計回りに回転させてピンをゆっくりと離し、チャンバーをミオグラフユニットに戻すときに大動脈セグメントがピンから滑り落ちないようにします(図3)。
- 解剖顕微鏡の以前に較正された接眼レンズの経緯線を使用して、定規の始点をセグメントの一方の端(組織端α1としてマーク)に配置し、眼の分割(組織端α2としてマーク)8の大動脈セグメントのもう一方の端で測定値をメモすることにより、取り付けられた大動脈リングの正確で正確な長さを測定します。これらの値は、セクション 5 の正規化手順で使用されます。
- 各筋計チャンバーをユニットに戻し、チャンバーを37°Cで30分間通気し始めます。
注:大動脈の4つのセグメントは、同じ治療の反復として使用することも、大動脈の各セグメントを異なる実験に同時に使用することもできます。
5. 正規化
注:実験条件が適切に標準化され、収集されたデータの信頼性と再現性を確保するために、正規化手順が必要です。「IC1/IC100」または「正規化係数」は、血管収縮薬(例えば、60mM KCl)に対する最大応答を記録することができる動脈の内周を、100mmHg(すなわちIC100)の壁面圧力が記録される内周で割ったものとして定義される。したがって、IC100にこの比率を掛けることにより、最適な応答(すなわちIC1)を確立できる動脈の内周を決定することができる。
- ピンがほぼ接触するようにマイクロメータを設定します。
- すべての筋電図チャンバーの力をゼロに設定し、さらに1〜2分間平衡化させます。
- マイクロメータからの最初の直径の読み取り値をメモします。これは、2つのピン間のギャップがゼロと見なされる位置です(手順5.7で必要)。
- DMTドロップダウンメニューでデータ収集ソフトウェアの正規化設定を開きます。次の設定とデフォルト値で新しい画面が開きます。
接眼レンズキャリブレーション(ミリメートル/ディビジョン):0.36
目標圧力(キロパスカル):13.3
IC1/IC100: 0.9
オンライン平均時間(秒): 2
遅延時間: 60
遅延完了時にサウンドを再生する (チェック ボックス)
サウンド(ドロップダウン選択メニューまたはブラウズ機能付き) - セグメントの数に応じて、画面上で使用可能な正しいチャンネル数を選択し、チャートの記録を開始します。
- ドロップダウンメニューを使用して、目的のチャネルを選択します。正規化画面が表示されます。
- 次のようにウィンドウに定数値を入力します:組織エンドポイントα1;組織エンドポイントα2;ピン直径:40μm;アナログマイクロメータースケールからのマイクロメータ読み取り値。
- 最初のポイント(XまたはX0の初期値)を記録するには、[ ポイントの追加 ]ボタンをクリックします。60秒の遅延の後、このマイクロメータに対応する力と有効圧力(ERTP)の値が表示され、マイクロメータの読み取り用のボックスがアクティブになり、使用可能になります。
- マイクロメータを反時計回りに回して容器のストレッチを開始します。マイクロメータの読み取りボックスを使用して値を入力し、[ ポイントの追加 ]ボタンをクリックします(再び60秒の遅延時間があります)。
- 容器を伸ばし続け、血管をIC1まで伸ばすために使用される計算されたマイクロメータ設定であるマイクロメータX1の値が表示されるまでマイクロメータ値を追加し続けます。
- マイクロメータをX1値に設定します。
注:生後6か月のC57BL6マウスの正規化された(最適な)張力は6mNです。 - 正規化後、組織を休ませて30分間平衡化させます。この時点でチャンバー内のHEPES-PSSソリューションを変更する必要はありません。
注:各チャンバーは8mLの溶液を保持することができます。このプロトコルは5mLを使用して書かれており、容器と取り付けピンを完全に沈めることができます。 - 休息時間と平衡時間を使用して、次の準備をします。
- 蒸留水(RO水)中のアセチルコリン連続希釈液のワーキングストックを、50 nM、100 nM、500 nM、1 μM、5 μM、10 μM、50 μM、500 μM、500 μM、および1 mMのように調製します。実験期間中、すべてのチューブを氷上に置いてください。
- 二重蒸留水中でN-ニトロ-L-アルギニンメチルエステル(L-NAME)の100 mM作業溶液を調製し、実験期間中、溶液を氷上に保ちます。
- 別の実験セットで決定されたフェニレフリン(10μM)の準最大用量を調製する。
注:平衡期間は、血管セグメントが筋鏡チャンバー内の新しい環境に適応し、イオン勾配をリセットし、さまざまな薬理学的および機械的課題にさらされる前に安定したレベルの受動的張力を達成するために必要です。
6. 大動脈輪における内皮依存性血管弛緩の測定
- 30分の平衡化期間が終了したら、チャンバーを排出し、5 mLの新鮮で温かい通気HEPES-PSS溶液を各チャンバーに追加します。組織が空気にさらされるのを最小限に抑えるために、一度に1つのチャンバーを排出します。チャンバーの排水は、60 cmHgに設定された真空ポンプと6秒の遅延に設定されたミオグラフバルブを使用して実行され、5 mLの溶液を確実に除去します。
- 必要に応じて、力の測定値を再調整して、6mNの最適な張力を読み取ります。インキュベーション期間ごと、および新しい実験セットの前に、力を最適な張力に再調整することが非常に重要です。さらに15〜20分間組織を休ませます。
- データ収集ソフトウェアを開き、追跡番号を50:1から500:1に変更して、[ 開始]を押します。この段階では、各チャンバーの登録力をソフトウェアで確認できます。
- 新しい実験を開始する直前に、データ集録ソフトウェアに適切なラベルを追加してください。
- チャンバーに5 mLの高K + 溶液を追加する前に、チャンバーをもう一度排出します。これは、大動脈組織の生存率および膜脱分極に対する平滑筋収縮応答の完全性を、他の実験プロトコルに使用する前に試験するのに適している。これは、血管セグメントがさらなる実験に使用できるかどうかを判断するのに役立ちます。
- 高K+ 溶液に対する収縮応答が力発生のプラトーに達したらすぐに、チャンバーを再度排出します(図4)。
注意: 高K + 溶液は、組織を損傷するため、チャンバー内に3分以上放置しないでください。 - HEPES-PSS溶液で組織を3回洗浄します。各チャンバーに5 mLの高K + 溶液を追加します。高K + 溶液に対する収縮反応が力発生のプラトーに達したらすぐにチャンバーを排水し、組織をさらに15分間休ませる前にHEPES-PSSで組織を3倍洗浄します。
注:一部の検査室では、筋グラフ実験を開始する前に、血管の変動性を確保するために、血液セグメントを高K + 溶液に3回連続してさらします。このプロトコルでは、新たに単離された大動脈セグメントは、さらなる実験のために組織を使用する前に、高K + 溶液に2回さらされます。すべての実験でこの一貫性を保つことが重要です。 - 高いK + 溶液に応答した力の発生(収縮力)の2つの登録ピークの平均を使用して、実験で使用された他の血管収縮薬および血管拡張薬に応答して登録された値を正規化します。
- 組織を15〜20分間休ませます。
- 血管収縮剤フェニレフリン(PE)と大動脈セグメントを、すでに確立されたサブ最大用量(チャンバー内の最終濃度10μM)で事前に契約します。
注:フェニレフリンのサブ最大用量(10μM)は、大動脈セグメントを最終濃度1 nM、5 nM、10 nM、50 nM、100 nM、500 nM、1 μM、5 μM、1 μM、10 μM、10 μM、および50 μMで増加濃度のフェニレフリン溶液にさらした別の一連の実験で決定されました。その結果、フェニレフリンの終濃度10μMは、収縮力がプラトーに達する直前の2mm大動脈節において、準最大収縮力(最大力の90%)を発生させることができると判断された。フェニレフリンのサブ最大濃度を使用する理由は、血管収縮アゴニストに対する大動脈組織の飽和または脱感作に関連する問題を回避するためです。 - PE誘発収縮曲線が張力(力)の発達のプラトーに達するまで待ちます(図5)。
- フェニレフリンへの緊張発達のプラトーで、次のように筋鏡チャンバー内のアセチルコリンの最終濃度を確立するために、3分間隔で5μLの増加用量のアセチルコリンワーキングストック溶液を加えてアセチルコリン用量反応曲線を実行します:50 pM、100 pM、500 pM、1 nM、5 nM、10 nM、50 nM、 100nM、500nM、および1μM(図6)。
注:アセチルコリンの各用量を追加した後、次の用量を追加する前に、少なくとも3分間(緊張がプラトーに達するまで)待ちます。. - 各ステップで、アセチルコリンストック溶液を非常にゆっくりと大動脈リングから遠く離れたチャンバーにピペットで入れ、組織の乱れを防ぎます。
- 用量反応実験が完了したら、チャンバーを排水し、大動脈セグメントを温かく通気したHEPES-PSS溶液で3回洗浄して、薬物の残留物を取り除きます。
- 次の実験ステップを開始する前に、組織を30分間休ませます。大動脈の生存率は、HEPES-PSS高K+ 溶液を使用して各実験ステップの前にチェックされます。すべての準備と実験手順が正しく実行されれば、大動脈組織の生存率は実験全体(4〜6時間)の間同じままです。
7.内皮媒介血管弛緩に対するNO産生の一般的な阻害剤の影響
- セグメントを注意深く洗浄し、少なくとも30分間休ませた後、実験のこの部分に同じ大動脈組織を使用します。
注:30分の休息時間を使用して、二重蒸留水中のN-ニトロ-L-アルギニンメチルエステル(L-NAME)の100 mM作業溶液を調製し、実験期間中、溶液を氷上に保ちます。 - 大動脈セグメントを30分間休ませた後、チャンバーを排出し、新鮮で温かい高K+(60 mM KCl)溶液を各チャンバーに追加します。
注:実験の各部分について、大動脈組織に少なくとも1回は高K + 溶液で挑戦することが重要です。記録された収縮ピークは、実験のその部分で収集されたデータを正規化するために使用されます。 - 高K + 溶液に対する収縮反応がプラトーに達したらすぐにチャンバーを再度排出し、HEPES-PSS溶液で組織を3回洗浄します。
- 観察されたアセチルコリン誘発血管弛緩(セクション6を参照)に対するNO産生の寄与を評価するために、この段階で、各筋鏡チャンバーで200μMの最終濃度を達成するために、L-NAMEの調製された100 mMの作業ストック溶液10 μLを各ミオグラフチャンバー(5mLバッファー溶液を含む)に添加することにより、NO産生の一般的な阻害剤(L-NAME)で大動脈セグメントをプレインキュベートします。
注:L-NAMEは、NOS(NO産生に関与する酵素)のすべてのアイソフォームの非選択的で強力な阻害剤であるため、血管壁9でのNOの産生を阻止するための効果的なツールと考えられています。 - L-NAMEを使用したプレインキュベーション時間(30分)の間、大動脈セグメントを休ませます。
- この時点では洗わないでください。
- L-NAMEを除去せずに、フェニレフリンのサブ最大用量(最終濃度10μM)をチャンバーに追加して、大動脈収縮を誘発します。
注:内因性NO産生に対するL-NAMEの阻害作用により、フェニレフリン誘発大動脈収縮の新たに登録されたピークは、L-NAMEで組織をインキュベートする前に記録された初期ピークよりもはるかに高くなります。これは、大動脈壁における基底NO産生に対するL-NAMEの効果により、より高い力の発生につながると予想されます(平滑筋によるより高い収縮力の発生による)。 - フェニレフリン誘発収縮曲線が緊張(収縮力)発達のプラトーに達するまで待ちます。
- この時点で、アセチルコリンを筋鏡チャンバーに追加して、500nMの最終濃度を達成します(これは、プロトコルのセクション5に記載されている実験中に確立されたアセチルコリンの準最大濃度です)。
- 形成されたプラトーが安定するまで、力の発達に起こりうる変化を記録するために数分待ちます(図7)。
注:アセチルコリンに応答してNOを生成する内皮層の能力に対するL-NAMEの阻害作用により、大動脈内皮NOS(eNOS)はアセチルコリンの適用に応答してNOを生成できないため、フェニレフリンに応答して登録された力の生成に変化は見られないと予想されます。 - チャンバーを排水し、温かい通気HEPES-PSS溶液で組織を3回洗浄します。
8.大動脈血管弛緩に対する内皮層の寄与
- 大動脈血管弛緩における内皮層の役割を強調するために、内皮層が除去された内皮露出大動脈セグメントにおけるアセチルコリン誘発血管弛緩をテストする。
- 顕微鏡の下に筋鏡室を配置し、小さなワイヤー(ワイヤー筋電図に使用されるのと同じワイヤーをここで使用できます)を大動脈の内腔にそっと通します。ワイヤーをルーメンに通して短時間ゆっくりと動かします(穏やかな円運動)。これは内皮または内膜を除去するのに十分です。
- 大動脈を2 mmの大動脈リングに切断し、前述のようにそれらのリングを筋鏡室に取り付けます。
- 最適な張力を6 mNに設定し、組織を通気された温かいHEPES-PSSバッファーで30分間静ませます。
- 30分の平衡化期間の終わりに、チャンバーを排水し、5 mLの新鮮で温かい通気HEPES-PSS溶液を各チャンバーに追加します。
- マイクロメータを反時計回りに回して、すべての筋鏡チャンバーの力をゼロにします。
- マイクロメータを反時計回りにゆっくりと回転させて、登録された力がマウス大動脈の望ましい最適張力(C57BL / 6Jマウス大動脈の場合は6 mN)に達するまでピン間の距離を広げます。最適な張力(6 mN)でさらに15〜20分間組織を休ませます。
- チャンバーをさらに1倍排出してから、各チャンバーに5 mLの高K + 溶液を追加します。
- 高K + 溶液に対する収縮反応がプラトーに達したらすぐにチャンバーを再度排出し、HEPES-PSS溶液で組織を3回洗浄します。組織を15〜20分間休ませます
- 血管収縮剤フェニレフリン(チャンバー内の最終濃度10μM)で大動脈セグメントを事前に契約します。
注:内皮の除去により、大動脈壁における基底NO産生は著しく減少する。したがって、フェニレフリン誘発収縮のピーク(力発生のピーク)は、内皮層を欠く大動脈組織で高くなると予想されます。 - フェニレフリン誘発力がプラトーに達したら、アセチルコリンのサブ最大濃度を筋鏡室に追加して、最終濃度500nMを達成します。
注:内皮層の除去が適切に行われれば、内皮によるアセチルコリン誘発NO産生が内皮層の除去により減少するため、登録されたフェニレフリン誘発力に変化はありません。記録されたトレースは、L-NAMEの存在下で観察されたものと非常によく似ています(セクション7)。 - 実験を終了する前に、フェニレフリン誘発力の発生のために登録されたプラトーが変化していないことを確認するために3分間待ちます(図8)。
注:アセチルコリンの適用がプラトーにいる間にフェニレフリン誘発収縮の低下を引き起こす場合、これは内皮層が完全に除去されていないことを示しています。
結果
ここで説明するテンソメトリック小チャンバーミオグラフィプロトコルは、小動脈と大動脈の血管反応性を測定するための標準的な方法であり、同じ実験小実験動物の最大4つの血管セグメントの血管反応性を同時に測定できます。本報告では、このシステムを用いて、単離マウス大動脈の内皮機能を測定します(図1)。このプロトコルでは、孤立した大動脈セグメントが、2つの小さなステンレス鋼ピン(図3)の間の小さな臓器室(図2)に取り付けられます。ミオグラフチャンバーは最大8mLの緩衝液を保持することができ、実験期間中、単離された血管に半生理学的環境を提供します。各実験の前に、各単離されたセグメントの実行可能性をテストおよび検証することが非常に重要です。各単離された血管セグメントの完全性と生存率を確立するための標準的なプロトコルは、高濃度の塩化カリウムで組織に挑戦して、平滑筋膜の脱分極を誘導することです。孤立した血管が健康で応答性が高いというシナリオでは、収縮力の発生をディスプレイに記録することができます(図4)。記録された力のピークは、プロトコル中に使用されたアゴニスト(例えば、フェニレフリン)に応答して同じセグメントに対する力発生を正規化するために後に使用される。内皮を介した血管弛緩を測定するためには、大動脈組織をフェニレフリンの最大濃度以下(10μM)で事前に収縮させる必要があり、これが平滑筋を介した収縮と力の発生を引き起こします(図5)。フェニレフリン誘発収縮がプラトーに達すると(図6)、アセチルコリンの用量の増加が複数のステップで適用され、孤立したセグメントで最大の血管緩和が達成されます(図6)。血管弛緩のレベルは、内皮媒介一酸化窒素産生の間接的な測定値です。大動脈輪におけるアセチルコリン誘発血管弛緩が一酸化窒素の産生によるものであることをさらに確認するために、大動脈セグメントは、フェニレフリン適用前に30分間、一酸化窒素産生の一般的な阻害剤(200μMのL-NAME)で前処理される。図7に示すように、L-NAMEは、収縮前の大動脈におけるアセチルコリン誘発血管弛緩を完全に遮断することができ、アセチルコリンが一酸化窒素産生の増加を通じて大動脈血管弛緩を誘発するという事実を強調しています。一方、大動脈セグメントからの内皮層の除去は、アセチルコリン誘発血管弛緩もブロックし、血管弛緩において内皮が果たす役割を強調しています(図8)。
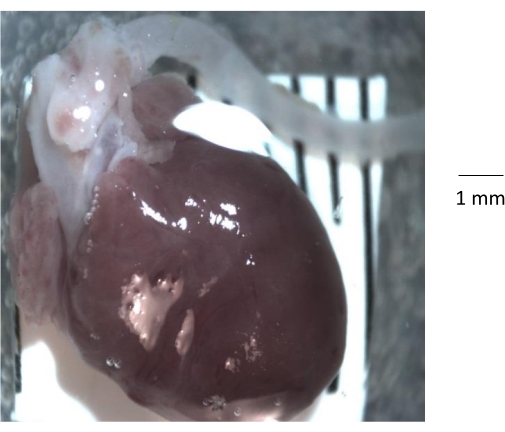
図1:生後6か月のコントロールマウスから分離された心臓、大動脈根、および下行大動脈の肉眼解剖学的ビュー。 マウスから胸郭を取り外した後、心臓と大動脈を胸郭から分離し、清潔なシリコーンエラストマーでコーティングされたペトリ皿に移します。大動脈を単離する前に、大動脈の内腔からすべての脂肪と結合組織、および血栓を除去することが重要です。 この図の拡大版を表示するには、ここをクリックしてください。

図2:200μmの取り付けピンを示す筋電図ユニットのチャンバーの代表画像。図に示すように、筋鏡チャンバー内の2つのピンはほとんど接触していません。チャンバーを使用する前に、ピンが正しく位置合わせされていることを確認することが重要です。この図の拡大版を表示するには、ここをクリックしてください。

図3:大動脈セグメントを筋電図室に固定する。 生後6か月のC57BL/6マウスから分離された2 mmマウス大動脈セグメントは、筋鏡チャンバー内の2本のピンで保持されます。これは、鉗子を使用して大動脈を2つの取り付けピンに静かにスライドさせることによって達成されます。赤い点線のボックスは、筋電図チャンバー内の2つのピンの間に取り付けられている2mmの大動脈セグメントの拡大画像を示しています。この図の拡大版を表示するには、ここをクリックしてください。
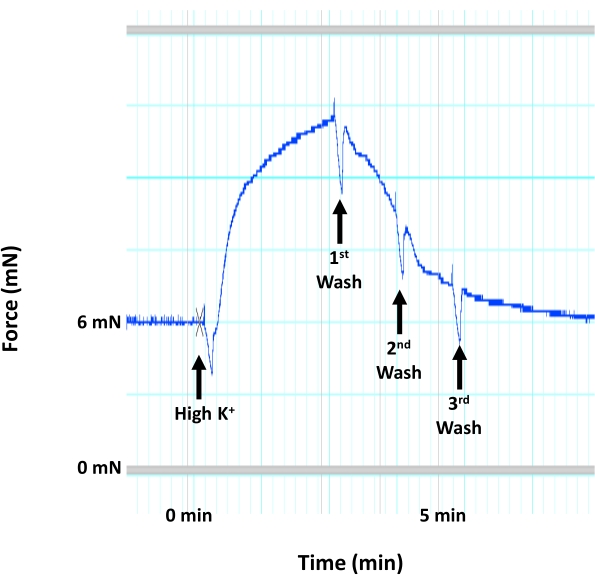
図4:平滑筋膜脱分極による大動脈収縮。 大動脈の内側層内で平滑筋膜の脱分極および収縮を誘発する高濃度のK+( 60mM KCl)に応答したマウス大動脈収縮(力発生)の痕跡を示す代表的な画像。高K+ 溶液の適用に続いて、温かい通気HEPES-PSS溶液を使用して3回連続洗浄します。 この図の拡大版を表示するには、ここをクリックしてください。
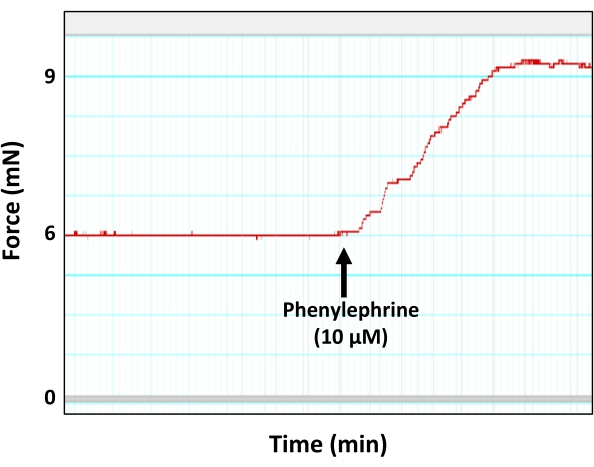
図5:血管収縮薬フェニレフリンに応答した大動脈収縮。 フェニレフリンの準最大濃度(10μM)に応答した大動脈輪による力の発生(収縮)を示す代表的な筋電図トレース。図示されるように、フェニレフリン誘発収縮のピークは最終的にプラトーに達する。 この図の拡大版を表示するには、ここをクリックしてください。
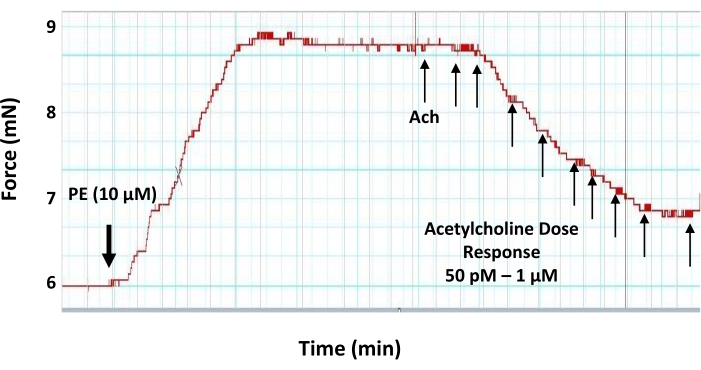
図6:収縮前の大動脈輪に対するアセチルコリンの用量反応効果。 2mmの収縮前大動脈輪に対する血管拡張神経伝達物質アセチルコリンの用量反応(50pM〜1μM)血管拡張効果を示す代表的なミオグラフトレース。大動脈リングは、アセチルコリンの適用前に10μMのフェニレフリンで事前に収縮している。アセチルコリンの最初の用量は、フェニレフリン誘発性張力がプラトーに達したときに追加されます。. この図の拡大版を表示するには、ここをクリックしてください。
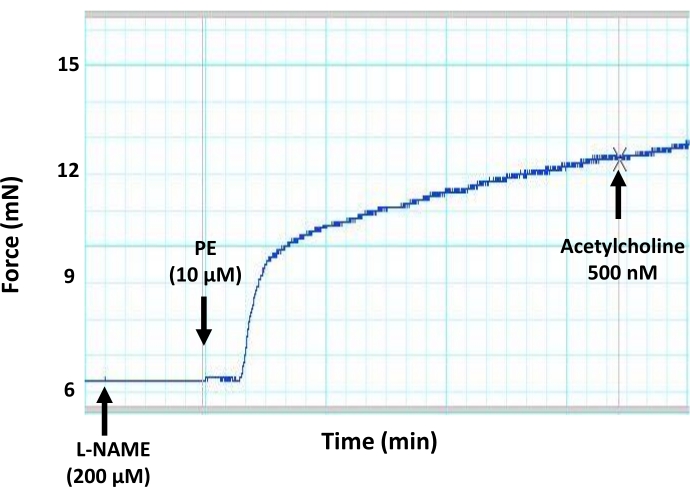
図7:マウス大動脈の内皮媒介血管弛緩に対するNO産生の一般的な阻害剤(L-NAME)の効果。 NO産生の一般的な阻害剤(L-NAME、200μM最終濃度)による大動脈セグメントのプレインキュベーションが、収縮前の大動脈輪におけるアセチルコリン誘発血管拡張をブロックすることを示す代表的な筋グラフトレース。これは、eNOSに対するL-NAMEの阻害作用による内皮によるNO産生の阻害によるものである。アセチルコリンを、500nMの準最大濃度で事前に収縮した大動脈セグメントに添加した。 この図の拡大版を表示するには、ここをクリックしてください。
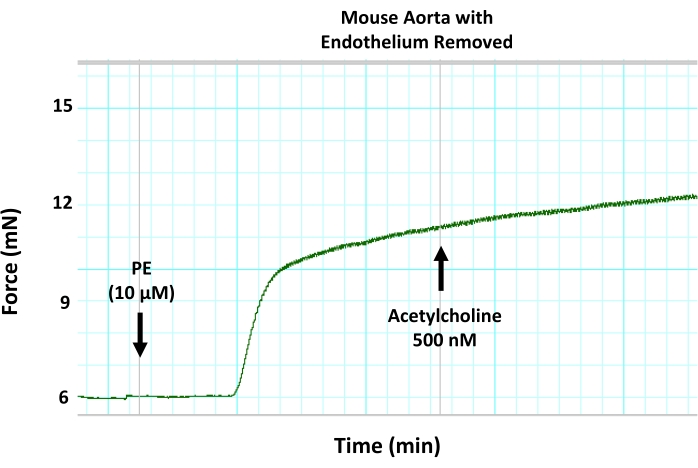
図8:マウス大動脈の内皮媒介血管弛緩に対する機械的内皮除去の影響。 ワイヤー露出を用いて大動脈セグメントから内皮を除去することが、収縮前の大動脈リングにおけるアセチルコリン誘発性血管拡張をブロックすることを示す代表的な筋グラフトレース。これは、内皮媒介性血管弛緩の阻害によるものです。アセチルコリンを、500nMの準最大濃度で事前に収縮した大動脈セグメントに添加した。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
血管生物学の分野は、研究者が血管壁の機能的および構造的完全性を評価するのに役立つツールに大きく依存しています。また、血管の3つの層(内膜、中膜、外膜)間の直接的および間接的な相互作用にも特別な注意が必要です。これらの3つの層のうち、内膜は内皮細胞の単層によって形成され、血管の健康と止血を調節する上で非常に重要な機能を持っています。
内皮層への損傷は、NOおよび他の血管拡張因子を放出する能力に悪影響を及ぼし、アテローム性動脈硬化症、動脈瘤、および血管炎などの様々な血管障害において観察される血管機能の調節不全をもたらす可能性があることは十分に確立されている10、11、12。正常な内皮機能を制御する根本的なメカニズムを理解し、血管壁内の血管拡張機能と内皮の完全性を評価するためには、in vivo生理学的条件を模倣した標準的な実験システムを利用することが不可欠です。
大動脈などの大きな動脈の場合、小チャンバーテンソメトリック(等尺性)筋電図は、 ex vivo 環境で血管に利用可能な最良の生理学的条件を作り出す信頼性の高いツールとして広く認識されています。このシステムはまた、実験室の設定でかなり長い期間(最大6〜8時間)組織の生存率を維持することを可能にし、この技術を貴重で用途の広いツールにします。もう1つの利点は、ミオグラフチャンバーにより、血管リングを保持して、連続した異なる実験に再利用できるため、多数の実験マウスの必要性を減らしながら、費用対効果の高いアプローチになることです。4チャンバー筋電視システムを使用して最大4つの血管セグメントを同時に検査できるため、実験間のばらつきを減らしながら一貫性を高めることができます。
血管内の内皮層の機能を研究するために、様々な薬理学的および機械的ツールを使用することができる。機能的な内皮の主要なマーカーはNOの正常な産生であり、これは内皮層によって産生および放出される最も重要な血管拡張剤として知られている。内皮機能障害は主にNO産生の有意な低下に関連しており、高血圧、血栓症、アテローム性動脈硬化症などのさまざまな血管障害の進行に関与していることが示されています。
血管床内では、NO産生は主に血流および圧力の変化、またはホルモンおよび成長因子に応答して細胞質カルシウム濃度の変化またはシグナル伝達経路の活性化をもたらす可能性のある他の細胞内事象によって制御される13,14。NO産生の変化は、内皮機能障害の初期かつ信頼できるマーカーの1つと考えられており、通常、心血管障害の進行の初期に検出可能です。疾患モデルに関係なく、血管生物学者は内皮機能の測定を可能にするツールとアッセイに非常に関心を持っています。生理学的条件を模倣するプラットフォームを使用して、血管のさまざまな層の寄与を区別できることが特に重要です。
小さなチャンバーミオグラフでは、研究者は薬理学的および機械的ツールを使用して、厳密に制御された環境で内皮機能を測定できます。筋鏡室の内部には、血管の正常な機能を支えることができる人工環境が作り出されます。このような人工環境では、孤立した血管セグメントは周囲の結合組織や他の臓器によって支持されていないため、孤立したセグメントが昇圧剤に応答して可能な限り最大の収縮を生成できる最適な受動張力を決定することが重要です。最適な張力で、フェニレフリンやノルエピネフリンなどの血管収縮剤に対する正常な最大収縮反応を測定して、血管壁の平滑筋層の構造的および機能的完全性を試験することができます。実験室では、6mNの受動張力が2mmマウス大動脈セグメント15に対する適切な張力であると決定された。ただし、最適な受動張力は、異なる種の異なるタイプの動脈に対して決定する必要があります16。
さらに、単離された血管で実験を行う前に、単離されたリングの生存率をテストして、生存可能で使用可能な組織の包含基準と除外基準を満たしていることを確認することが不可欠です。これは通常、単離されたリングを高濃度のK+ 溶液(60 mM KCl)にかけることによって達成されます。これは、電位依存性カルシウムチャネル(VGCC)の開口による平滑筋膜の脱分極をもたらし、平滑筋収縮および大動脈血管収縮をもたらす。この方法は、大動脈セグメントをさらなる実験に使用する前に、それらのセグメントの生存率を検証するために使用されます。
一方、アセチルコリンなどの血管拡張剤は、内皮層の機能特性を試験するために使用することができる。内皮層が無傷で機能的である場合、アセチルコリンの最大濃度以下は、事前に収縮した血管セグメント17において弛緩を誘発し得る。アセチルコリン誘発弛緩の大きさは、内皮層からのNO放出のレベルを示すものである。内皮層(機械的または機能的)への損傷は、NO産生および血管血管拡張反応に影響を与える。このプロトコルでは、提供されたデータは、アセチルコリンが用量依存的に収縮前のマウス大動脈に弛緩を誘導し、最終濃度500 nMで最大以下の弛緩が達成されることを示しています(図6)。
いくつかの実験では、研究者は血管拡張薬NOに対する平滑筋の直接応答を測定することに興味を持っています。このような実験の焦点は平滑筋機能のみにあるため、研究者が血管セグメントから内皮層を除去(露出)することによって内皮の寄与をバイパスできるようにするプロトコルがあります。内皮は、空気、指間の転がり、ワイヤーによる除去など、さまざまな方法で除去できます。このような実験環境では、露出した血管(内皮層なし)は、ニトログリセリンやニトロプルシドナトリウムなどのNOドナーにさらされます。.これにより、NOに応答する平滑筋環状GMPプロテインキナーゼGシグナル伝達経路が無傷で機能的であるかどうかを決定することができる7、18。この原稿は、孤立した大動脈セグメントの内皮層の除去がどのようにアセチルコリン血管拡張効果を完全にブロックするかを説明し、血管の弛緩と血管拡張におけるNO放出の重要性を強調しています(図8)。
ワイヤーおよびテンソメトリックミオグラフ技術は血管生物学実験において幅広い有用性を持っていますが、潜在的な限界に注目する価値があります。具体的には、張力測定系は、組織サイズの制限(すなわち、より小さな血管系)を有する。さらに、この技術の生体 外 の性質は、 生体 内血管機能および血行動態パラメータのより正確な模倣のための管腔内圧力および流れの操作を可能にしない。実際、圧力筋計のセットアップは、これらの変数を考慮し、リアルタイムの血管ダイナミクスをシミュレートすると同時に、より小さな抵抗動脈の使用を可能にします。さらに、ワイヤー筋鏡実験では、生理学的状態を完全に再現したり、循環血液、血管壁、および周囲の組織間の相互作用を正確にモデル化したりすることはできません。
ミオグラフィ実験で使用された実験プロトコルや実験で選択された血管収縮薬/血管拡張薬に関係なく、小チャンバーミオグラフィシステムは、血管反応性と機能的完全性を測定するための信頼性が高く、再現性があり、安定した半生理学的プラットフォームを提供します。このレポートの焦点は内皮機能の基本的な測定のみでしたが、ミオグラフィシステムは、ストレス/ひずみ関係、血管壁強度、破裂点、受動的および能動的収縮など、血管の他の多くの機能特性を評価するために使用できます。これは、血管生物学の分野における信頼できるツールとしてのミオグラフシステムの価値を浮き彫りにします。
開示事項
著者は、競合する経済的利益はないと宣言しています。
謝辞
この研究は、国立衛生研究所(R15HL145646)および中西部大学大学院大学からの資金提供によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Acetylcholine | SigmaAldrich | A6625-100G | |
| CaCl2 | SigmaAldrich | C4901-1KG | |
| Carbogen gas | Matheson | H103847 | |
| Dissecting scissors | FST | 91460-11 | |
| DMT 620 Multi chamber myograph system | DMT | DMT 620 | Multi chamber myograph system |
| Dumont forceps | FST | 91150-20 | |
| EDTA | SigmaAldrich | E5134-10G | |
| Glucose | SigmaAldrich | G8270-1KG | |
| HEPES | SigmaAldrich | H7006-1KG | |
| KCl | SigmaAldrich | P9541-1KG | |
| KH2PO4 | SigmaAldrich | P5655-1KG | |
| LabChart | ADI instruments | Data acquisition software | |
| Light source | Volpi | 14363 | |
| L-Name | Fischer Scientific | 50-200-7725 | |
| MgSO4 | SigmaAldrich | M2643-500G | |
| Microscope | Leica | S6D | stereo zoom microscope |
| NaCl | SigmaAldrich | S5886-5KG | |
| NaHCO3 | SigmaAldrich | S5761-500G | |
| Organ bath system | DMT | 720MO | |
| Phenylephrine | SigmaAldrich | P6126-10G | |
| Pump | Welch | 2546B-01 | |
| Software | ADI instruments | LabChart 8.1.20 | |
| Spring Scissors | FST | 15003-08 | |
| Sylgard 184 Kit | Electron Microscopy Services | 24236-10 | silicone elastomer kit |
| Tank Regulator | Fischer Scientific | 10575147 | |
| Water bath system | Fischer Scientific | 15-462-10 |
参考文献
- Wenceslau, C. F., et al. Guidelines for the measurement of vascular function and structure in isolated arteries and veins. American Journal of Physiology-Heart and Circulatory Physiology. 321 (1), 77-111 (2021).
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction: Testing and clinical relevance. Circulation. 115 (10), 1285-1295 (2007).
- Lerman, A., Zeiher, A. M. Endothelial function: Cardiac events. Circulation. 111 (3), 363-368 (2005).
- Rajendran, P., et al. The vascular endothelium and human diseases. International Journal of Biological Sciences. 9 (10), 1057-1069 (2013).
- Galley, H. F., Webster, N. R. Physiology of the endothelium. British Journal of Anaesthesia. 93 (1), 105-113 (2004).
- Orita, H., et al. In vitro evaluation of phosphate, bicarbonate, and Hepes buffered storage solutions on hypothermic injury to immature myocytes. Cardiovascular Drugs and Therapy. 8 (6), 851-859 (1994).
- Liu, Y. H., Bian, J. S. Bicarbonate-dependent effect of hydrogen sulfide on vascular contractility in rat aortic rings. American Journal of Physiology. Cell Physiology. 299 (4), 866-872 (2010).
- Griffiths, K., Madhani, M. The use of wire myography to investigate vascular tone and function. Methods in Molecular Biology: Atherosclerosis. 2419, 361-367 (2022).
- Pfeiffer, S., Leopold, E., Schmidt, K., Brunner, F., Mayer, B. Inhibition of nitric oxide synthesis by NG-nitro-L-arginine methyl ester (L-NAME): Requirement for bioactivation to the free acid, NG-nitro-L-arginine. British Journal of Pharmacology. 118 (6), 1433-1440 (1996).
- Bacon, P. A. Endothelial cell dysfunction in systemic vasculitis: New developments and therapeutic prospects. Current Opinion in Rheumatology. 17 (1), 49-55 (2005).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: Current concepts and clinical implications. Frontiers in Medicine. 8, 798958(2021).
- Mikolajczyk, K., et al. The important role of endothelium and extracellular vesicles in the cellular mechanism of aortic aneurysm formation. International Journal of Molecular Sciences. 22 (23), 13157(2021).
- Vallance, P., Hingorani, A. Endothelial nitric oxide in humans in health and disease. International Journal of Experimental Pathology. 80 (6), 291-303 (1999).
- Tousoulis, D., Kampoli, A. M., Tentolouris, C., Papageorgiou, N., Stefanadis, C. The role of nitric oxide on endothelial function. Current Vascular Pharmacology. 10 (1), 4-18 (2012).
- Gibson, C., et al. Mild aerobic exercise blocks elastin fiber fragmentation and aortic dilatation in a mouse model of Marfan syndrome associated aortic aneurysm. Journal of Applied Physiology. 123 (1), 147-160 (2017).
- Xiao, X., Ping, N. N., Li, S., Cao, L., Cao, Y. X. An optimal initial tension for rat basilar artery in wire myography. Microvascular Research. 97, 156-158 (2015).
- Chung, A. W., Yang, H. H., Yeung, K. A., van Breemen, C. Mechanical and pharmacological approaches to investigate the pathogenesis of Marfan syndrome in the abdominal aorta. Journal of Vascular Research. 45 (4), 314-322 (2008).
- Zhong, C., et al. Age impairs soluble guanylyl cyclase function in mouse mesenteric arteries. International Journal of Molecular Sciences. 22 (21), 11412(2021).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved