Method Article
Измерение эндотелий-зависимого вазорелаксации в грудной аорте мыши с помощью тензометрической малообъемной камерной миографии
В этой статье
Резюме
Настоящий протокол описывает концепции и техническое применение метода тензометрического миографа с использованием многокамерной системы миографа в экспериментальной оценке ex vivo функции эндотелия аорты мыши.
Аннотация
Тензометрическая миография малой камеры является широко используемым методом оценки сократимости сосудов мелких и крупных кровеносных сосудов у лабораторных животных и мелких артерий, выделенных из тканей человека. Метод позволяет исследователям поддерживать изолированные кровеносные сосуды в строго контролируемой и стандартизированной (почти физиологической) обстановке с возможностью адаптации к различным факторам окружающей среды, одновременно бросая вызов изолированным сосудам различными фармакологическими агентами, которые могут вызывать сужение сосудов или вазодилатацию. Камера миографа также обеспечивает платформу для измерения сосудистой реактивности в ответ на различные гормоны, ингибиторы и агонисты, которые могут влиять на функцию гладких мышц и эндотелиальных слоев отдельно или одновременно. Стенка кровеносного сосуда представляет собой сложную структуру, состоящую из трех различных слоев: интима (эндотелиальный слой), среда (гладкомышечные и эластиновые волокна) и адвентиция (коллаген и другая соединительная ткань). Чтобы получить четкое представление о функциональных свойствах каждого слоя, крайне важно иметь доступ к экспериментальной платформе и системе, которые позволили бы использовать комбинационный подход к изучению всех трех слоев одновременно. Такой подход требует доступа к полуфизиологическому состоянию, которое имитировало бы среду in vivo в условиях ex vivo . Тензометрическая миография малообъемной камеры обеспечила идеальную среду для оценки влияния сигналов окружающей среды, экспериментальных переменных или фармакологических агонистов и антагонистов на сосудистые свойства. В течение многих лет ученые использовали метод тензометрического миографа для измерения функции эндотелия и сократимости гладких мышц в ответ на различные агенты. В этом отчете тензометрическая система миографа с малой объемной камерой используется для измерения эндотелиальной функции в изолированной аорте мыши. В этом отчете основное внимание уделяется тому, как тензометрическая миография малой камеры может быть использована для оценки функциональной целостности эндотелия в небольших сегментах большой артерии, такой как грудная аорта.
Введение
В течение последних нескольких десятилетий малокамерная миографическая система использовалась для измерения реактивности различных слоев стенок кровеносных сосудов в ответ на различные фармакологические агенты и нейротрансмиттеры в условиях ex vivo в режиме реального времени. Сосудистая реактивность является основным компонентом здорового функционального кровеносного сосуда и имеет решающее значение для регуляции кровотока и перфузии в периферических и церебральных сосудах1. В стенке кровеносного сосуда взаимодействие между эндотелиальными и гладкими мышечными слоями является основным фактором, определяющим тонус сосудов, на который также постоянно влияют структурные изменения в слое соединительной ткани, окружающем стенку кровеносного сосуда (адвентиция).
Эндотелиальный слой контролирует вазомоцию путем высвобождения нескольких сосудорасширяющих факторов, включая оксид азота (NO), простациклин (PGI2) и гиперполяризующий фактор, полученный из эндотелия (EDHF), или путем производства сосудосуживающих агентов, таких как эндотелин-1 (ET-1) и тромбоксан (TXA2)2,3,4. Среди этих факторов NO был широко изучен, и его важные регуляторные роли в других критических клеточных функциях, таких как воспаление, миграция, выживание и пролиферация, были широко упомянуты в научной литературе 2,5.
В области сосудистой биологии камерная миография предоставила сосудистым физиологам и фармакологам ценный и надежный инструмент для измерения функции эндотелия в жестко контролируемой полуфизиологической системе1. В настоящее время ученым доступны две различные системы миографа: проволочная (или штифтовая) тензометрическая (изометрическая) миография и напорная миография. В проволочной миографической системе кровеносный сосуд растягивается между двумя проводами или штифтами, что позволяет изометрически измерять развитие силы или напряжения в стенке кровеносного сосуда, в то время как миография давления является предпочтительной платформой для измерения реактивности сосудов в артериях с малым сопротивлением, где изменения артериального давления считаются основным стимулом для изменения сосудистого тонуса и вазомоции. Существует общее мнение, что для артерий с малым сопротивлением, таких как брыжеечные и мозговые артерии, миография давления создает состояние, которое ближе к физиологическим условиям в организме человека. Малый камерный миограф может быть использован для сосудов с очень малыми диаметрами (200-500 мкм) для гораздо более крупных сосудов, таких как аорта.
В то время как проволочный миограф является мощной системой для регистрации напряжения кровеносных сосудов в изометрических условиях, миограф давления является более подходящей системой для измерения изменений диаметра сосудов в ответ на изменения изобарических условий. Изменения диаметра сосуда в ответ на изменения давления или потока намного больше в небольшой мышечной артерии (артериоле) по сравнению с крупными эластичными артериями, такими как аорта. По этим причинам миограф давления считается лучшим средством для мелких кровеносных сосудов с существенной вазореактивностью1. Одной из других практических сильных сторон многокамерной тензометрической миографии малой камеры является то, что можно различить вклад различных механизмов в сосудистую реактивность, изучая множественные (до четырех) сегменты одной и той же артерии и одного и того же животного для снижения изменчивости и получения надежных и убедительных данных. Он также относительно прост в настройке и обслуживании технически. Сосуды практически любого размера можно изучать с помощью проволочного миографа. Это более экономичное решение для оценки сосудистой функции и хорошая альтернатива миографии давления в экспериментах, где длина рассеченного сосуда слишком коротка для протокола миографа давления.
В настоящем отчете представлен подробный протокол оценки функции эндотелия в изолированном грудном аортальном кольце мыши с использованием крепежных штифтов в методе тензометрической миографии малообъемной камеры с использованием многокамерной миографической системы DMT-620 (DMT-США). В этом протоколе используется 6-месячный самец мыши C57BL6 со средним весом от 25 до 35 г. К счастью, этот протокол может быть применен к различным типам животных и весам, учитывая широкий диапазон типов и диаметров сосудов, для которых этот протокол может быть использован.
протокол
Все хирургические процедуры и уход за животными были одобрены Институциональным комитетом по уходу за животными и их использованию и уходу (IACUC) Университета Среднего Запада (IACUC# AZ-3006, AZ-2936).
1. Подготовка буфера
ПРИМЕЧАНИЕ: Хотя буфер физиологического солевого раствора HEPES (HEPES-PSS) стабилен при 4 °C в течение 7 дней, рекомендуется, чтобы все буферы были свежеприготовлены в день каждого эксперимента. Все остальные реагенты и агонисты должны быть приготовлены свежими для каждого эксперимента. Буфер HEPES-PSS, используемый в этом протоколе, является хорошо зарекомендовавшим себя буфером для сосудистых исследований ex vivo, который, как было показано, является цитопротекторным в течение более 12 ч при сохранении сосудорасширяющих реакций сосуда - основной фокус этого экспериментального протокола 6,7.
- Приготовьте раствор HEPES-PSS (рН 7,4) следующим образом: смешайте 10 ммоль/л HEPES, 6 ммоль/л глюкозы, 1,5 ммоль/л CaCl2, 130 ммоль/л NaCl, 4 ммоль/л KCl, 4 ммоль/л NaHCO3, 1,2 ммоль/л MgSO4, 1,2 ммоль/л KH2PO4 и 0,03 ммоль/л ЭДТА.
- Подготовьте буфер HEPES-PSS с высоким K+ . Это идентично раствору HEPES-PSS, за исключением того, что он содержит 5 ммоль / л HEPES, 65 ммоль / л NaCl, 10 ммоль / л глюкозы, 1 ммоль / л MgCl2, 80 ммоль / л KCl и не содержит MgSO4 и ЭДТА.
2. Подготовка блока миографа
- Включите и установите водяную баню на 37 °C. Обеспечьте соответствующий уровень воды.
- Поместите на водяную баню два стакана, помеченных соответствующим образом, один с 600 мл раствора HEPES-PSS и один с 150 мл раствора с высоким содержанием K+ .
- Аэрировать стакан из 300 мл раствора HEPES-PSS с газообразным карбогеном (5% CO2 и 95% O2) в течение не менее 10 мин.
- Добавьте 30 мл аэрированного раствора HEPES-PSS в 50 мл центрифужной трубки, соответствующим образом маркируйте (грудной клетка, идентификационный номер мыши) и поместите его на лед. Держите оставшийся аэрированный раствор HEPES-PSS на льду для использования в процессе расслоения аорты.
- Включите четырехкамерный миограф; добавьте 6 мл раствора HEPES-PSS в каждую камеру миографа и установите температуру на 37 °C. Дайте раствору в каждой камере аэрировать (с карбогенной смесью) в течение 30 мин и проверьте, чтобы камеры достигли желаемых 37 °C (используйте этот период ожидания для рассечения аорты мыши).
- Включите аппаратное обеспечение и компьютер для сбора данных миографа.
3. Изоляция аорты мыши
- Обезболить экспериментальную мышь 5% вдыханием изофлурана и усыпить при вывихе шейки матки (для этой демонстрации используется 6-месячный самец мыши C57BL/6J).
- Уложите мышь на хирургическую доску в лежачем положении и закрепите придатки к доске хирургическим скотчем.
- Опрыскивайте брюшную область 70% спиртом, чтобы мех был полностью влажным и любые распущенные / сухие волоски не попадали в разрез. Аккуратно протрите лишний раствор.
- Используйте щипцы, чтобы локализовать и изолировать кожу живота, как раз уступающую мечевидному отростку грудины.
- Создавайте напряжение, поднимая кожу прямо вверх. Сделайте тупой разрез ножницами, и удалите поверхностную кожу, обнажив грудную полость.
- Поднимите мечевидный отросток и сделайте боковые разрезы чуть ниже отростка вдоль подреберных краев.
- Вытяните боковые разрезы краниально, чтобы удалить переднюю часть грудной клетки.
- Удалите грудной клетку, сделав тупой разрез через позвоночник, ниже диафрагмы и в шее.
ПРИМЕЧАНИЕ: Исследователи могут также удалить аорту непосредственно у животного, но следует позаботиться о защите сосуда и смыть свернувшуюся кровь из аорты. В этом протоколе используется пример удаления грудной клетки и тщательной очистки и рассечения аорты. С практикой этот метод может быть выполнен быстро и эффективно и полезен для сохранения дополнительной ткани для других исследований, таких как иммуногистохимия, гистология и вестерн-блоттинг. - Переложите грудной клетку в прозрачную силиконовую чашку Петри, покрытую эластомером, заполненную ледяным аэрированным буфером HEPES-PSS, и закрепите ее с обеих сторон.
ПРИМЕЧАНИЕ: Используйте комплект силиконовых эластомеров (Таблица материалов). Смешайте основу и отверждающее средство (10:1 по весу), затем перелейте в стеклянную чашку Петри и дайте затвердеть в течение 24 ч при 25 °C. - Поместите чашку Петри под микроскоп со стереозумом, аккуратно вырежьте и извлеките сердце и прикрепленную аорту из грудной клетки и перенесите в чистую, прозрачную силиконовую чашку, покрытую эластомером (рисунок 1).
- Затем аккуратно удалите жир и соединительную ткань и любую свернувшуюся кровь из аорты. Используя острые, мелкие ножницы, рассекните и изолируйте всю аорту, начиная от области арки до нижней части нисходящей аорты. Помните, что дуга аорты не подходит для миографических экспериментов, но может быть использована для гистологических исследований.
- Используйте холодный аэрированный раствор HEPES-PSS на протяжении всего рассечения. Меняйте решение каждые 10 минут или когда видимость скомпрометирована, все, что наступит раньше. Рекомендуется, чтобы каждое аортальное кольцо монтировалось на камеру миографа в течение 20 минут после рассечения (макс. 60 мин).
4. Монтаж сегментов аорты на камеры миографа
- Разрезайте рассеченную аорту на четыре сегмента по 2 мм каждый с помощью острых небольших хирургических ножниц. Используйте мини-линейку внутри блюда в качестве ориентира.
- Поместите камеру миографа под стереозум-микроскоп, чтобы легко визуализировать контакты, и установите микрометры так, чтобы штифты почти касались (рисунок 2).
- Убедитесь, что оба удерживающих ткани штифта правильно выровнены.
- Обратите внимание и избегайте защемления аорты при монтаже сегментов, чтобы предотвратить повреждение эндотелия.
- В камерах, уже содержащих 5 мл нагретого и аэрированного буфера HEPES-PSS, осторожно сдвиньте каждый из 2 мм сегментов аорты на два крепежных штифта с помощью щипцов. Будьте очень нежны при скольжении сегментов аорты по штифтам. Эндотелиальный слой очень хрупкий и очень легко отрывается с просветной стороны.
- Медленно перемещайте штифты друг от друга, вращая микрометр против часовой стрелки, чтобы сегмент аорты не соскальзывал со штифтов при размещении камеры обратно в блок миографа (рисунок 3).
- Используйте предварительно откалиброванную окулярную решетку рассекающего микроскопа для измерения истинной и точной длины установленного кольца аорты, расположив начало линейки на одном конце сегмента (обозначенного как конец ткани α1) и сделав запись измерения на другом конце сегмента аорты в глазных отделах (помеченных как конец ткани α2)8. Эти значения будут использоваться на этапах нормализации, описанных в разделе 5.
- Верните каждую камеру миографа в блок и начните аэрацию камер при 37 °C в течение 30 минут.
ПРИМЕЧАНИЕ: Четыре сегмента аорты могут быть использованы в качестве реплик для одного и того же лечения, или каждый сегмент аорты может быть использован одновременно для разных экспериментов.
5. Нормализация
ПРИМЕЧАНИЕ: Процедура нормализации необходима для обеспечения надлежащей стандартизации экспериментальных условий и надежности и воспроизводимости собранных данных. "IC1/IC100", или "Коэффициент нормализации", определяется как отношение внутренней окружности артерии, при котором можно зафиксировать максимальный ответ на сосудосуживающее средство (например, 60 мМ KCl), деленное на внутреннюю окружность, при которой регистрируется давление в трансмуральной стенке 100 мм рт.ст. (т.е. IC100). Поэтому, умножив IC100 на это соотношение, мы можем определить внутреннюю окружность артерии, при которой может быть установлен оптимальный ответ (т.е. IC1).
- Установите микрометр так, чтобы штифты почти касались.
- Установите усилия равными нулю для всех камер миографа и дайте ему уравновеситься еще 1-2 мин.
- Запишите показания первого диаметра с микрометра. Это положение, где зазор между двумя контактами считается нулевым (необходим для шага 5.7.).
- Откройте настройки нормализации программного обеспечения для сбора данных в раскрывающемся меню DMT ; откроется новый экран со следующими настройками и значениями по умолчанию:
Калибровка окуляра (мм/дел): 0.36
Целевое давление (кПа): 13,3
IC1/IC100: 0.9
Время усреднения в режиме онлайн: 2
Время задержки (с): 60
Воспроизведение звука при завершении задержки (флажок)
Звуки (с раскрывающимся меню выбора или функцией Обзора) - В зависимости от количества сегментов выберите правильное количество каналов, доступных на экране, и начните запись графика.
- Используйте выпадающее меню для выбора интересующего канала; появится экран нормализации.
- Введите значения констант в окна следующим образом: Конечные точки ткани α1; Тканевые конечные точки α2; Диаметр штифта: 40 мкм; Значение показаний микрометра из аналоговой микрометровой шкалы.
- Для того чтобы записать первую точку (начальное значение X или X0), нажмите на кнопку Добавить точку . После задержки в 60 с будут отображены значения силы и эффективного давления (ERTP), соответствующие этому микрометру, и коробка для показаний микрометра станет активной и доступной.
- Начните растягивать сосуд, повернув микрометр против часовой стрелки. Используйте поле считывания микрометра, чтобы ввести значение и нажать кнопку Добавить точку (снова будет время задержки 60 с).
- Продолжайте растягивать сосуд и продолжайте добавлять значения микрометра до тех пор, пока не будет видно значение микрометра X1, которое является расчетной настройкой микрометра, используемой для растяжения сосуда до его IC1.
- Установите для микрометра значение X1.
ПРИМЕЧАНИЕ: Нормализованное (оптимальное) напряжение для 6-месячной мыши C57BL6 составляет 6 мН. - После нормализации дайте тканям отдохнуть и уравновеситься в течение 30 мин. На этом этапе нет необходимости менять раствор HEPES-PSS в камерах.
ПРИМЕЧАНИЕ: Каждая камера способна удерживать 8 мл раствора. Этот протокол написан с использованием 5 мл, что позволяет полностью погрузить сосуд и установить штифты. - Используйте время отдыха и уравновешивания, чтобы подготовить следующее.
- Подготовьте рабочий состав последовательных разбавлений ацетилхолина в дистиллированной воде (водой обратного осмоса) от самых низких до самых высоких концентраций следующим образом: 50 нМ, 100 нМ, 500 нМ, 1 мкМ, 5 мкМ, 10 мкМ, 500 мкМ, 500 мкМ и 1 мМ. Держите все трубки на льду на время эксперимента.
- Готовят 100 мМ рабочего раствора N-нитро-L-аргинина метилового эфира (L-NAME) в двухдистиллированной воде и держат раствор на льду в течение всего эксперимента.
- Готовят субмаксимальную дозу фенилэфрина (10 мкМ), определяемую в отдельной серии экспериментов.
ПРИМЕЧАНИЕ: Период равновесия необходим для того, чтобы сегмент кровеносных сосудов приспособился к новой среде в камере миографа, сбросил градиенты ионов и достиг стабильного уровня пассивного напряжения до того, как подвергнется различным фармакологическим и механическим испытаниям.
6. Измерение эндотелий-зависимой вазорелаксации в кольцах аорты
- В конце 30-минутного периода уравновешивания слейте камеры и добавьте в каждую камеру по 5 мл свежего, теплого, аэрированного раствора HEPES-PSS. Сливайте по одной камере за раз, чтобы свести к минимуму воздействие воздуха на ткани. Осушение камер осуществляется с помощью вакуумного насоса, установленного на 60 смHg, и клапанов миографа, установленных на задержку 6 с, чтобы обеспечить удаление 5 мл раствора.
- При необходимости перенастройте измерения силы для считывания оптимального напряжения 6 мН. Очень важно корректировать силу до оптимального напряжения в течение каждого инкубационного периода, а также перед каждым новым набором экспериментов. Отдохните ткань еще на 15-20 мин.
- Откройте программное обеспечение для сбора данных, измените номера отслеживания с 50:1 на 500:1 и нажмите кнопку Пуск. На этом этапе зарегистрированную силу для каждой камеры можно увидеть в программном обеспечении.
- Непосредственно перед началом нового эксперимента обязательно добавьте соответствующую метку на программное обеспечение для сбора данных.
- Процедите камеры еще раз, прежде чем добавлять 5 мл раствора с высоким содержанием K+ в каждую камеру. Это подходит для проверки жизнеспособности ткани аорты и целостности сократительного ответа гладкой мускулатуры на деполяризацию мембраны перед использованием ткани для любого другого экспериментального протокола. Это помогает определить, можно ли использовать сегмент кровеносного сосуда для дальнейших экспериментов.
- Снова осушите камеры, как только сократительная реакция на раствор с высоким K+ достигнет плато для генерации силы (рисунок 4).
ПРИМЕЧАНИЕ: Не оставляйте раствор с высоким содержанием K+ в камерах более чем на 3 мин, так как это может повредить ткани. - Промыть ткань раствором HEPES-PSS 3x. Добавьте 5 мл раствора с высоким содержанием K+ в каждую камеру. Осушите камеры, как только сократительная реакция на высокий раствор K+ достигнет плато для генерации силы и промыть ткань 3x с помощью HEPES-PSS, прежде чем дать ткани отдохнуть еще 15 минут.
ПРИМЕЧАНИЕ: В некоторых лабораториях сегменты крови подвергают высокому раствору K+ три раза подряд, чтобы обеспечить изменчивость кровеносного сосуда перед началом экспериментов с миографом. В этом протоколе вновь выделенные сегменты аорты дважды подвергают воздействию раствора с высоким содержанием K+ перед использованием ткани для дальнейших экспериментов. Важно поддерживать эту последовательность во всех экспериментах. - Используйте среднее из двух зарегистрированных пиков развития силы (силы сжатия) в ответ на высокий раствор K+ для нормализации зарегистрированных значений в ответ на другие сосудосуживающие и сосудорасширяющие агенты, используемые в эксперименте.
- Отдохните ткань в течение 15-20 мин.
- Предварительно сжимают сегменты аорты с сосудосуживающим агентом фенилэфрином (ПЭ) в уже установленной субмаксимальной дозе (конечная концентрация 10 мкМ в камере).
ПРИМЕЧАНИЕ: Субмаксимальную дозу фенилэфрина (10 мкМ) определяли в отдельной серии экспериментов, где сегменты аорты подвергали повышению концентраций раствора фенилэфрина при конечных концентрациях 1 нМ, 5 нМ, 10 нМ, 50 нМ, 100 нМ, 500 нМ, 1 мкМ, 5 мкМ, 5 мкМ, 10 мкМ и 50 мкМ. В результате было определено, что конечная концентрация фенилэфрина в 10 мкМ может генерировать субмаксимальную силу сжатия (90% от максимальной силы) в сегментах аорты 2 мм, которая находится прямо перед тем, как сила сжатия достигнет плато. Причина использования субмаксимальной концентрации фенилэфрина заключается в том, чтобы избежать проблем, связанных с насыщением ткани аорты или десенсибилизацией к агонисту сосудосуживающих веществ. - Позвольте Индуцированной ПЭ кривой сжатия достичь плато для развития напряжения (силы) (рисунок 5).
- На плато развития напряжения к фенилэфрину выполняют кривую «доза-реакция» ацетилхолина, добавляя 5 мкл возрастающих доз рабочих растворов ацетилхолина с интервалом в 3 мин с целью установления конечных концентраций ацетилхолина в камере миографа следующим образом: 50 пМ, 100 пМ, 500 пМ, 1 нМ, 5 нМ, 10 нМ, 50 нМ, 100 нМ, 500 нМ и 1 мкМ (рисунок 6).
ПРИМЕЧАНИЕ: После добавления каждой дозы ацетилхолина подождите не менее 3 минут (чтобы напряжение достигло плато), прежде чем добавлять следующую дозу. - На каждом этапе пипетка раствора ацетилхолина в камеру очень медленно и далеко от аортальных колец, чтобы избежать каких-либо нарушений тканей.
- После завершения эксперимента «доза-реакция» дренируют камеры и промывают сегменты аорты теплым и аэрированным раствором HEPES-PSS 3x для удаления оставшихся остатков препарата.
- Отдохните ткань в течение 30 минут перед началом следующих шагов эксперимента. Жизнеспособность аорты проверяется перед каждым экспериментальным этапом с использованием раствора HEPES-PSS с высоким K+ . При правильном соблюдении всех подготовительных и экспериментальных этапов жизнеспособность ткани аорты останется неизменной на протяжении всего эксперимента (4-6 ч).
7. Влияние общих ингибиторов продукции NO на эндотелий-опосредованную вазорелаксацию
- Используйте ту же ткань аорты для этой части эксперимента после тщательного промывания и отдыха сегментов в течение не менее 30 минут.
ПРИМЕЧАНИЕ: Используйте 30-минутное время отдыха для приготовления 100 мМ рабочего раствора N-нитро-L-аргинина метилового эфира (L-NAME) в двухдистиллированной воде и держите раствор на льду в течение всего эксперимента. - После отдыха сегментов аорты в течение 30 мин процедить камеры и добавить в каждую камеру свежий, теплый раствор с высоким содержанием K+ (60 мМ KCl).
ПРИМЕЧАНИЕ: Важно, чтобы для каждой части эксперимента ткань аорты оспаривалась с помощью высокого K+ раствора по крайней мере один раз. Зарегистрированный пик сокращения будет использоваться для нормализации данных, собранных во время этой части эксперимента. - Снова процедите камеры, как только реакция сокращения на высокий У+ раствор достигнет плато и промыть ткань раствором HEPES-PSS 3x.
- Чтобы оценить вклад продукции NO в наблюдаемую ацетилхолин-индуцированную вазорелаксацию (см. раздел 6.), на этом этапе преинкубируют сегменты аорты общим ингибитором продукции NO (L-NAME), добавляя 10 мкл приготовленного 100 мМ рабочего раствора L-NAME в каждую камеру миографа (содержащую буферный раствор 5 мл) для достижения конечной концентрации 200 мкМ в каждой камере миографа.
ПРИМЕЧАНИЕ: L-NAME является неселективным и мощным ингибитором всех изоформ NOS (фермента, ответственного за выработку NO), и, следовательно, он считается эффективным средством для блокирования производства NO в стенке кровеносного сосуда9. - Дайте сегментам аорты отдохнуть во время прединкубации с помощью L-NAME (30 мин).
- Не мойте в этот момент.
- Не удаляя L-NAME, добавьте субмаксимальную дозу фенилэфрина (конечная концентрация 10 мкМ) в камеру, чтобы индуцировать сокращение аорты.
ПРИМЕЧАНИЕ: Из-за ингибирующего действия L-NAME на эндогенную продукцию NO, вновь зарегистрированный пик для фенилэфрин-индуцированного сокращения аорты будет намного выше, чем первоначальный пик, который был зарегистрирован до инкубации ткани с L-NAME. Это ожидается из-за влияния L-NAME на базальную выработку NO в стенке аорты, что приводит к более высокой генерации силы (из-за более высокой генерации сократительной силы гладкой мускулатурой). - Подождите, пока кривая сокращения, вызванная фенилэфрином, не достигнет плато для развития напряжения (сократительной силы).
- В этот момент добавляют ацетилхолин в камеру миографа для достижения конечной концентрации 500 нМ (это субмаксимальная концентрация ацетилхолина, которая была установлена в ходе экспериментов, описанных в разделе 5. протокола).
- Подождите несколько минут, чтобы зарегистрировать любые возможные изменения в развитии силы, пока сформированное плато не станет стабильным (рисунок 7).
ПРИМЕЧАНИЕ: Из-за ингибирующего действия L-NAME на способность эндотелиального слоя продуцировать NO в ответ на ацетилхолин, не ожидается каких-либо изменений в регистрируемой генерации силы в ответ на фенилэфрин, поскольку эндотелиальный NOS аорты (eNOS) не способен генерировать NO в ответ на применение ацетилхолина. - Процедите камеры и промойте ткань теплым, газированным раствором HEPES-PSS 3x.
8. Вклад эндотелиального слоя в вазорелаксацию аорты
- Чтобы подчеркнуть роль эндотелиального слоя в аортальной вазорелаксации, проверьте ацетилхолин-индуцированную вазорелаксацию в эндотелийно-оголенных сегментах аорты, в которых удаляются эндотелиальные слои.
- Расположите камеру миографа под микроскопом и аккуратно пропустите небольшой провод (здесь можно использовать тот же провод, который используется для проволочной миографии) через просвет аорты. Осторожно перемещайте проволоку через просвет (мягкое круговое движение) в течение короткого периода времени. Этого достаточно для удаления эндотелия или интимы.
- Разрежьте аорту на кольца аорты 2 мм и установите эти кольца на камеру миографа, как описано выше.
- Установите оптимальное натяжение на 6 мН и дайте ткани отдохнуть в течение 30 мин в аэрированном, теплом буфере HEPES-PSS
- В конце 30-минутного периода уравновешивания слейте камеры и добавьте в каждую камеру по 5 мл свежего, теплого, газированного раствора HEPES-PSS.
- Обнулите усилие для всех камер миографа, повернув микрометр против часовой стрелки.
- Медленно поворачивайте микрометр против часовой стрелки, чтобы увеличить расстояние между штифтами, пока зарегистрированная сила не достигнет желаемого оптимального напряжения для аорты мыши (6 мН для мышиной аорты C57BL/6J). Отдохните ткань еще на 15-20 мин при оптимальном растяжении (6 мН).
- Слейте камеры еще в 1 раз, прежде чем добавлять в каждую камеру 5 мл раствора с высоким содержанием K+.
- Снова процедите камеры, как только реакция сокращения на высокий У+ раствор достигнет плато и промыть ткань раствором HEPES-PSS 3x. Оставьте ткань на 15-20 мин
- Предварительно сжимает сегменты аорты с сосудосуживающим агентом фенилэфрином (конечная концентрация 10 мкМ в камере).
ПРИМЕЧАНИЕ: Из-за удаления эндотелия базальная no-продукция в стенке аорты значительно уменьшается; таким образом, пик сокращения, вызванного фенилэфрином (пик генерации силы), как ожидается, будет выше в ткани аорты, в которой отсутствует эндотелиальный слой. - Когда сила, индуцированная фенилэфрином, достигнет плато, добавьте субмаксимальную концентрацию ацетилхолина в камеру миографа для достижения конечной концентрации 500 нМ.
ПРИМЕЧАНИЕ: Если удаление эндотелиального слоя выполнено правильно, не будет никаких изменений в регистрируемой фенилэфрин-индуцированной силе, так как ацетилхолин-индуцированная NO продукция эндотелия будет уменьшена из-за удаления эндотелиального слоя. Зафиксированный след будет очень похож на тот, который наблюдается в присутствии L-NAME (раздел 7.). - Подождите 3 мин, чтобы убедиться, что зарегистрированное плато для развития силы, вызванной фенилэфрином, не меняется, прежде чем закончить эксперимент (рисунок 8).
ПРИМЕЧАНИЕ: Если применение ацетилхолина вызывает какое-либо падение сокращения, вызванного фенилэфрином, во время нахождения на плато, это указывает на то, что эндотелиальный слой не был полностью удален.
Результаты
Протокол тензометрической малокамерной миографии, описанный здесь, является стандартным методом измерения сосудистой реактивности в малых и крупных артериях и позволяет одновременно измерять реактивность сосудов в четырех сегментах кровеносных сосудов у одного и того же экспериментального мелкого лабораторного животного. В этом отчете мы специально используем систему для измерения эндотелиальной функции в изолированной аорте мыши (рисунок 1). В этом протоколе изолированные сегменты аорты устанавливаются на небольшую камеру органа (рисунок 2) между двумя небольшими штифтами из нержавеющей стали (рисунок 3). Камера миографа может вмещать до 8 мл буферного раствора и обеспечивать полуфизиологическую среду для изолированных сосудов на время экспериментов. Очень важно, чтобы перед каждым экспериментом проверялась и проверялась жизнеспособность каждого изолированного сегмента. Стандартный протокол для установления целостности и жизнеспособности каждого изолированного сегмента сосуда заключается в том, чтобы бросить вызов ткани с высокой концентрацией хлорида калия, чтобы вызвать деполяризацию гладкомышечной мембраны. В сценарии, в котором изолированный сосуд здоров и реагирует, мы сможем записать генерацию силы сжатия на дисплее (рисунок 4). Пик регистрируемой силы позже используется для нормализации генерации силы для того же сегмента в ответ на агонисты, используемые во время протокола (например, фенилэфрин). Для измерения эндотелий-опосредованной вазорелаксации необходимо предварительно сократить ткань аорты субмаксимальной концентрацией (10 мкМ) фенилэфрина, который вызывает опосредованное гладкой мускулатурой сокращение и генерацию силы (рисунок 5). Когда сокращение, вызванное фенилэфрином, достигает плато (рисунок 6), увеличивают дозы ацетилхолина в несколько этапов для достижения максимального вазорелаксации в изолированном сегменте (рисунок 6). Уровень релаксации сосудов является косвенным измерением эндотелий-опосредованной продукции оксида азота. Чтобы дополнительно подтвердить, что ацетилхолин-индуцированная вазорелаксация в аортальных кольцах обусловлена образованием оксида азота, сегменты аорты предварительно обрабатывают общим ингибитором производства оксида азота (200 мкМ L-NAME) в течение 30 мин до применения фенилэфрина. Как показано на рисунке 7, L-NAME способен полностью блокировать ацетилхолин-индуцированную вазорелаксацию в предварительно сжатой аорте, подчеркивая тот факт, что ацетилхолин индуцирует вазорелаксацию аорты за счет увеличения производства оксида азота. С другой стороны, удаление эндотелиального слоя из сегментов аорты также блокирует ацетилхолин-индуцированную вазорелаксацию, подчеркивая роль, которую эндотелий играет в расслаблении кровеносных сосудов (рисунок 8).
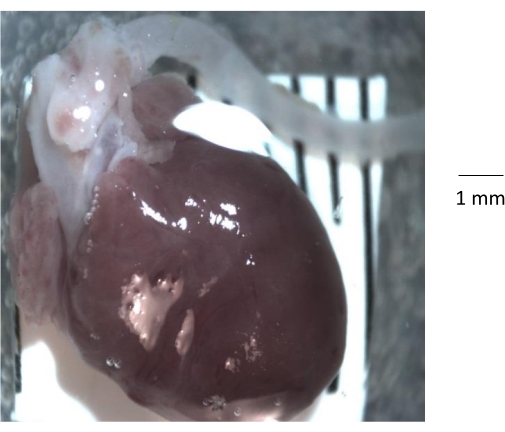
Рисунок 1: Грубый анатомический вид сердца, корня аорты и нисходящей аорты, выделенный у 6-месячной контрольной мыши. После удаления грудной клетки у мыши сердце и аорту выделяют из грудной клетки и переносят в чистую силиконовую чашку Петри, покрытую эластомером. Перед выделением аорты важно удалить всю жировую и соединительную ткань и любой сгусток крови из просвета аорты. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 2: Репрезентативное изображение камеры блока миографа, показывающее 200-мкм монтажные штифты. Как показано на рисунке, два штифта внутри камеры миографа едва соприкасаются. Перед использованием камеры очень важно убедиться, что штифты правильно выровнены. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Закрепление сегментов аорты на камере миографа. 2-миллиметровый сегмент аорты мыши, выделенный от 6-месячной мыши C57BL/6, удерживается двумя штифтами внутри камеры миографа. Это достигается путем осторожного скольжения аорты на два крепежных штифта с помощью щипцов. Красное пунктирное поле показывает увеличенное изображение 2-миллиметрового сегмента аорты, который установлен между двумя штифтами внутри камеры миографа. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
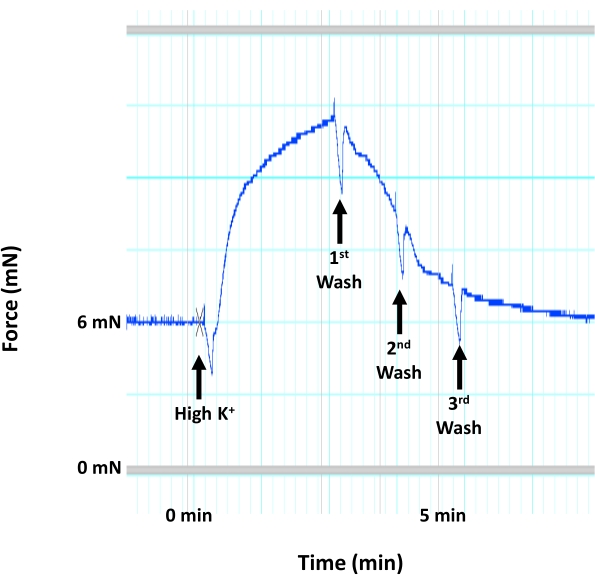
Рисунок 4: Сокращение аорты вследствие деполяризации гладкой мускулатуры. Репрезентативное изображение, показывающее след сокращения аорты мыши (генерации силы) в ответ на высокую концентрацию K+ (60 мМ KCl), которая индуцирует деполяризацию и сокращение гладкомышечной мембраны в медиальном слое аорты. Применение раствора с высоким содержанием K+ сопровождается сразу же тремя последовательными промывками с использованием теплого, аэрированного раствора HEPES-PSS. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
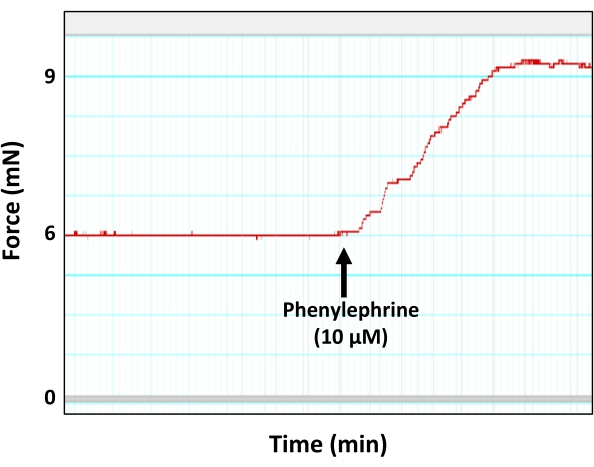
Рисунок 5: Сокращение аорты в ответ на сосудосуживающий агент фенилэфрин. Репрезентативный след миографа, показывающий генерацию силы (сжатие) аортальным кольцом в ответ на субмаксимальную концентрацию фенилэфрина (10 мкМ). Как показано, пик фенилэфрин-индуцированного сокращения в конечном итоге достигает плато. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
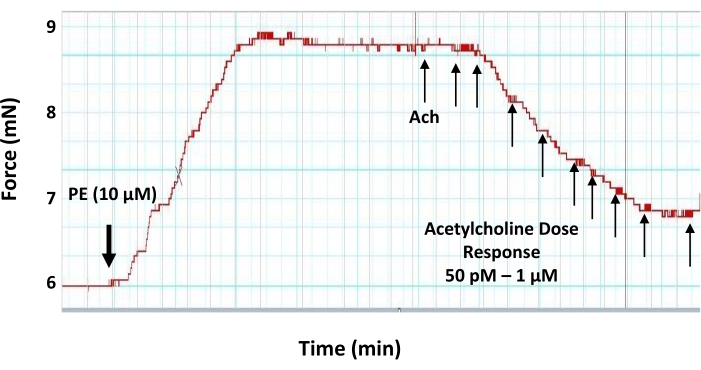
Рисунок 6: Эффекты "доза-реакция" ацетилхолина на предварительно сжатое кольцо аорты. Репрезентативный след миографа, показывающий дозу-ответ (50 пМ-1 мкМ) сосудорасширяющий нейромедиатор ацетилхолин на 2 мм предварительно законтрактованном аортальном кольце. Аортальное кольцо предварительно сжимается 10 мкМ фенилэфрина перед применением ацетилхолина. Первая доза ацетилхолина добавляется, когда напряжение, вызванное фенилэфрином, достигает плато. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
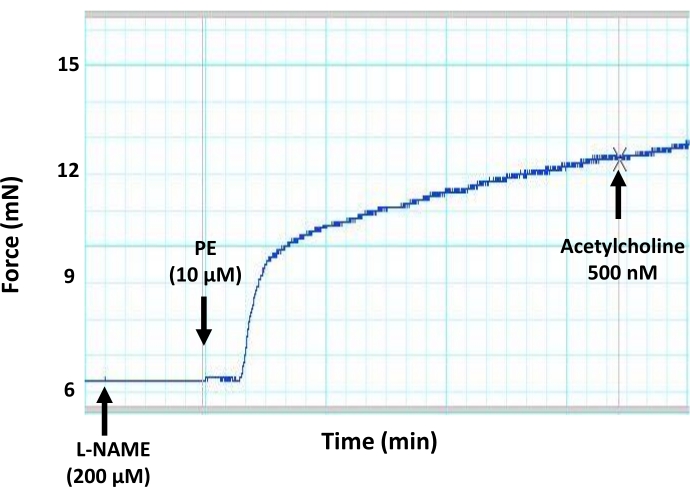
Рисунок 7: Эффекты общего ингибитора продукции NO (L-NAME) на эндотелий-опосредованную вазорелаксацию в аорте мыши. Репрезентативный след миографа показывает, что преинкубация сегментов аорты общим ингибитором продукции NO (L-NAME, конечная концентрация 200 мкМ) блокирует ацетилхолин-индуцированную вазодилатацию в предварительно законтрактованном аортальном кольце. Это связано с ингибированием продукции NO эндотелием из-за ингибирующего действия L-NAME на eNOS. Ацетилхолин добавляли в предварительно сжатый сегмент аорты при субмаксимальной концентрации 500 нМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
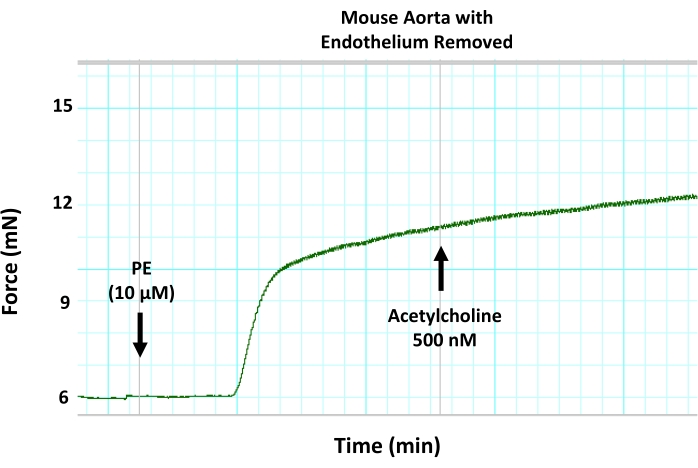
Рисунок 8: Влияние механического удаления эндотелия на эндотелий-опосредованную вазорелаксацию в аорте мыши. Репрезентативный след миографа показывает, что удаление эндотелия из сегментов аорты с помощью денудации проволоки блокирует ацетилхолин-индуцированную вазодилатацию в предварительно сжатом аортальном кольце. Это связано с ингибированием эндотелий-опосредованной вазорелаксации. Ацетилхолин добавляли в предварительно сжатый сегмент аорты при субмаксимальной концентрации 500 нМ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Область сосудистой биологии в значительной степени опирается на инструменты, которые помогают исследователям оценить функциональную и структурную целостность стенки кровеносных сосудов. Это также требует особого внимания к прямым и косвенным взаимодействиям между тремя слоями кровеносных сосудов: интимой, медиа и адвентицией. Среди этих трех слоев интима образована монослоем эндотелиальных клеток и имеет очень важную функцию в регулировании здоровья сосудов и гемостаза.
Хорошо известно, что любое повреждение эндотелиального слоя может негативно сказаться на его способности высвобождать NO и другие сосудорасширяющие факторы, приводя к дисрегуляции сосудистой функции, что наблюдается при различных сосудистых нарушениях, таких как атеросклероз, аневризма, васкулит 10,11,12. Чтобы понять основные механизмы, которые контролируют нормальную функцию эндотелия и оценить сосудорасширяющую функцию и целостность эндотелия в сосудистой стенке, необходимо использовать стандартную экспериментальную систему, которая имитирует физиологические условия in vivo.
Для крупных артерий, таких как аорта, малокамерная тензометрическая (изометрическая) миография широко признана надежным инструментом, который создает наилучшие доступные, почти физиологические условия для кровеносного сосуда в условиях ex vivo . Система также позволяет поддерживать жизнеспособность ткани в течение значительно длительного периода времени (до 6-8 ч) в лабораторных условиях, что делает технику ценным и универсальным инструментом. Еще одним преимуществом является то, что камера миографа позволяет хранить кольца кровеносных сосудов и повторно использовать их для различных экспериментов, что делает ее экономически эффективным подходом при одновременном снижении потребности в большом количестве экспериментальных мышей. До четырех сегментов кровеносных сосудов могут быть протестированы одновременно с использованием четырехкамерной системы миографа, увеличивая согласованность при одновременном уменьшении вариаций в экспериментах.
Различные фармакологические и механические инструменты могут быть использованы для изучения функции эндотелиального слоя в кровеносных сосудах. Основным маркером функционального эндотелия является нормальная выработка NO, который известен как наиболее важный сосудорасширяющий агент, продуцируемый и высвобождаемый эндотелиальным слоем. Эндотелиальная дисфункция в основном связана со значительным снижением производства NO и, как было показано, участвует в прогрессировании различных сосудистых расстройств, таких как гипертония, тромбоз и атеросклероз.
В сосудистом русле производство NO в основном контролируется изменениями кровотока и давления или другими внутриклеточными событиями, которые могут привести к изменениям концентрации цитоплазматического кальция или активации сигнальных путей в ответ на гормоны и факторы роста13,14. Изменения в продукции NO считаются одним из ранних и надежных маркеров эндотелиальной дисфункции, и они обычно обнаруживаются на ранней стадии прогрессирования сердечно-сосудистых расстройств. Независимо от модели заболевания, сосудистые биологи очень заинтересованы в инструментах и анализах, которые позволяют измерять функцию эндотелия. Особенно важно, что можно дифференцировать вклад различных слоев кровеносного сосуда с помощью платформы, имитирующей физиологические условия.
В небольшом камерном миографе исследователи могут использовать фармакологические и механические инструменты для измерения функции эндотелия в жестко контролируемой среде. Внутри камеры миографа создается искусственная среда, которая может поддерживать нормальную функцию кровеносного сосуда. В такой искусственной среде, поскольку изолированные сегменты кровеносных сосудов не поддерживаются окружающей соединительной тканью и другими органами, важно определить оптимальное пассивное напряжение, при котором изолированные сегменты могут генерировать максимально возможное сокращение в ответ на вазопрессоры. При оптимальном напряжении можно измерить нормальную максимальную сократительную реакцию на сосудосуживающие агенты, такие как фенилэфрин или норадреналин, чтобы проверить структурную и функциональную целостность гладкомышечного слоя стенки кровеносного сосуда. В лаборатории было определено, что пассивное напряжение 6 мН является правильным натяжением для 2 мм мышиных сегментов аорты15. Однако оптимальное пассивное напряжение должно быть определено для разных типов артерий у разных видов16.
Кроме того, прежде чем проводить какие-либо эксперименты с изолированными кровеносными сосудами, необходимо проверить жизнеспособность изолированных колец, чтобы убедиться, что они соответствуют критериям включения и исключения жизнеспособной и пригодной для использования ткани. Обычно это достигается путем помещения изолированных колец высококонцентрированному раствору K+ (60 мМ KCl). Это приводит к деполяризации гладкомышечной мембраны из-за открытия кальциевых каналов с напряжением (VGCC), что приводит к сокращению гладкой мускулатуры и сужению сосудов аорты. Этот метод используется для проверки жизнеспособности сегментов аорты перед использованием этих сегментов для дальнейших экспериментов.
С другой стороны, сосудорасширяющие агенты, такие как ацетилхолин, могут быть использованы для проверки функциональных свойств эндотелиального слоя. Если слой эндотелия неповрежден и функционален, то субмаксимальная концентрация ацетилхолина может вызвать расслабление в предварительно законтрактованном сегменте кровеносного сосуда17. Величина ацетилхолин-индуцированной релаксации является показателем уровня высвобождения NO из эндотелиального слоя. Любое повреждение эндотелиального слоя (механическое или функциональное) будет оказывать влияние на выработку NO и сосудорасширяющую реакцию сосудов. В этом протоколе предоставленные данные показывают, что ацетилхолин может индуцировать расслабление в предварительно сжатой аорте мыши дозозависимым образом, при этом субмаксимальная релаксация достигается при конечной концентрации 500 нМ (рисунок 6).
В некоторых экспериментах исследователи заинтересованы в измерении прямого ответа гладкой мускулатуры на сосудорасширяющее средство NO. Поскольку основное внимание в таких экспериментах уделяется только функции гладкой мускулатуры, существует протокол, который позволит исследователям обойти вклад эндотелия, удалив (обнажив) слой эндотелия из сегмента кровеносного сосуда. Эндотелий может быть удален различными методами, включая воздух, перекатывание между пальцами или удаление проволокой. В таких экспериментальных условиях оголенный кровеносный сосуд (без эндотелиального слоя) подвергается воздействию NO доноров, таких как нитроглицерин и нитропруссид натрия. Это позволяет определить, является ли гладкомышечный циклический сигнальный путь GMP-протеинкиназы G, который реагирует на NO, неповрежденным и функциональным 7,18. В этой рукописи объяснялось, как удаление эндотелиального слоя в изолированном сегменте аорты полностью блокирует сосудорасширяющие эффекты ацетилхолина, подчеркивая важность высвобождения NO в расслаблении кровеносных сосудов и расширении сосудов (рисунок 8).
В то время как проводные и тензометрические методы миографа имеют широкую полезность в экспериментах по сосудистой биологии, стоит отметить потенциальные ограничения. В частности, тензометрическая система имеет ограничения по размеру ткани (т.е. меньшую сосудистую систему). Кроме того, природа ex vivo этой методики не позволяет манипулировать внутрипросветным давлением и потоком для более точной мимикрии сосудистой функции in vivo и гемодинамических параметров. Установки миографа давления будут, по сути, учитывать эти переменные и имитировать динамику сосудов в режиме реального времени, а также позволяют использовать артерии меньшего сопротивления. Кроме того, эксперименты с проволочным миографом не могут полностью воспроизвести физиологические условия или точно смоделировать взаимодействия между циркулирующей кровью, стенками сосудов и окружающими тканями, которые также играют важную роль в регулировании сосудистой функции в организме.
Независимо от экспериментального протокола, используемого в экспериментах с миографией, или выбранного сосудосуживающего / сосудорасширяющего средства в эксперименте, система миографии малой камеры обеспечивает надежную, воспроизводимую и стабильную полуфизиологическую платформу для измерения реактивности кровеносных сосудов и функциональной целостности. Хотя основное внимание в этом докладе было уделено только базовому измерению функции эндотелия, миографическая система может быть использована для оценки многих других функциональных свойств кровеносного сосуда, таких как соотношение напряжения / деформации, прочность сосудистой стенки, точка разрыва, пассивное и активное сокращение, чтобы назвать несколько. Это подчеркивает ценность системы миографа как надежного инструмента в области сосудистой биологии.
Раскрытие информации
Авторы заявляют, что у них нет конкурирующих финансовых интересов.
Благодарности
Эта работа была поддержана финансированием Национальных институтов здравоохранения (R15HL145646) и Колледжа аспирантуры Университета Среднего Запада.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetylcholine | SigmaAldrich | A6625-100G | |
| CaCl2 | SigmaAldrich | C4901-1KG | |
| Carbogen gas | Matheson | H103847 | |
| Dissecting scissors | FST | 91460-11 | |
| DMT 620 Multi chamber myograph system | DMT | DMT 620 | Multi chamber myograph system |
| Dumont forceps | FST | 91150-20 | |
| EDTA | SigmaAldrich | E5134-10G | |
| Glucose | SigmaAldrich | G8270-1KG | |
| HEPES | SigmaAldrich | H7006-1KG | |
| KCl | SigmaAldrich | P9541-1KG | |
| KH2PO4 | SigmaAldrich | P5655-1KG | |
| LabChart | ADI instruments | Data acquisition software | |
| Light source | Volpi | 14363 | |
| L-Name | Fischer Scientific | 50-200-7725 | |
| MgSO4 | SigmaAldrich | M2643-500G | |
| Microscope | Leica | S6D | stereo zoom microscope |
| NaCl | SigmaAldrich | S5886-5KG | |
| NaHCO3 | SigmaAldrich | S5761-500G | |
| Organ bath system | DMT | 720MO | |
| Phenylephrine | SigmaAldrich | P6126-10G | |
| Pump | Welch | 2546B-01 | |
| Software | ADI instruments | LabChart 8.1.20 | |
| Spring Scissors | FST | 15003-08 | |
| Sylgard 184 Kit | Electron Microscopy Services | 24236-10 | silicone elastomer kit |
| Tank Regulator | Fischer Scientific | 10575147 | |
| Water bath system | Fischer Scientific | 15-462-10 |
Ссылки
- Wenceslau, C. F., et al. Guidelines for the measurement of vascular function and structure in isolated arteries and veins. American Journal of Physiology-Heart and Circulatory Physiology. 321 (1), 77-111 (2021).
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction: Testing and clinical relevance. Circulation. 115 (10), 1285-1295 (2007).
- Lerman, A., Zeiher, A. M. Endothelial function: Cardiac events. Circulation. 111 (3), 363-368 (2005).
- Rajendran, P., et al. The vascular endothelium and human diseases. International Journal of Biological Sciences. 9 (10), 1057-1069 (2013).
- Galley, H. F., Webster, N. R. Physiology of the endothelium. British Journal of Anaesthesia. 93 (1), 105-113 (2004).
- Orita, H., et al. In vitro evaluation of phosphate, bicarbonate, and Hepes buffered storage solutions on hypothermic injury to immature myocytes. Cardiovascular Drugs and Therapy. 8 (6), 851-859 (1994).
- Liu, Y. H., Bian, J. S. Bicarbonate-dependent effect of hydrogen sulfide on vascular contractility in rat aortic rings. American Journal of Physiology. Cell Physiology. 299 (4), 866-872 (2010).
- Griffiths, K., Madhani, M. The use of wire myography to investigate vascular tone and function. Methods in Molecular Biology: Atherosclerosis. 2419, 361-367 (2022).
- Pfeiffer, S., Leopold, E., Schmidt, K., Brunner, F., Mayer, B. Inhibition of nitric oxide synthesis by NG-nitro-L-arginine methyl ester (L-NAME): Requirement for bioactivation to the free acid, NG-nitro-L-arginine. British Journal of Pharmacology. 118 (6), 1433-1440 (1996).
- Bacon, P. A. Endothelial cell dysfunction in systemic vasculitis: New developments and therapeutic prospects. Current Opinion in Rheumatology. 17 (1), 49-55 (2005).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: Current concepts and clinical implications. Frontiers in Medicine. 8, 798958(2021).
- Mikolajczyk, K., et al. The important role of endothelium and extracellular vesicles in the cellular mechanism of aortic aneurysm formation. International Journal of Molecular Sciences. 22 (23), 13157(2021).
- Vallance, P., Hingorani, A. Endothelial nitric oxide in humans in health and disease. International Journal of Experimental Pathology. 80 (6), 291-303 (1999).
- Tousoulis, D., Kampoli, A. M., Tentolouris, C., Papageorgiou, N., Stefanadis, C. The role of nitric oxide on endothelial function. Current Vascular Pharmacology. 10 (1), 4-18 (2012).
- Gibson, C., et al. Mild aerobic exercise blocks elastin fiber fragmentation and aortic dilatation in a mouse model of Marfan syndrome associated aortic aneurysm. Journal of Applied Physiology. 123 (1), 147-160 (2017).
- Xiao, X., Ping, N. N., Li, S., Cao, L., Cao, Y. X. An optimal initial tension for rat basilar artery in wire myography. Microvascular Research. 97, 156-158 (2015).
- Chung, A. W., Yang, H. H., Yeung, K. A., van Breemen, C. Mechanical and pharmacological approaches to investigate the pathogenesis of Marfan syndrome in the abdominal aorta. Journal of Vascular Research. 45 (4), 314-322 (2008).
- Zhong, C., et al. Age impairs soluble guanylyl cyclase function in mouse mesenteric arteries. International Journal of Molecular Sciences. 22 (21), 11412(2021).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены