Method Article
מדידה של כלי דם תלויי אנדותל באבי העורקים החזי של העכבר באמצעות מיוגרפיה של תא נפח קטן טנסומטרי
In This Article
Summary
הפרוטוקול הנוכחי מתאר את המושגים והיישום הטכני של טכניקת המיוגרפיה הטנסומטרית באמצעות מערכת מיוגרף רב-תאית בהערכת ex vivo ניסיונית של תפקוד אנדותל אבי העורקים של עכבר.
Abstract
מיוגרפיה טנסומטרית של תא נפח קטן היא טכניקה נפוצה להערכת התכווצות כלי הדם של כלי דם קטנים וגדולים בחיות מעבדה ובעורקים קטנים המבודדים מרקמה אנושית. הטכניקה מאפשרת לחוקרים לשמור על כלי דם מבודדים בסביבה מבוקרת וסטנדרטית היטב (כמעט פיזיולוגית), עם אפשרות להתאמה לגורמים סביבתיים שונים, תוך קריאת תיגר על כלי הדם המבודדים עם חומרים פרמקולוגיים שונים שיכולים לגרום להתכווצות כלי דם או להרחבת כלי דם. תא המיוגרף מספק גם פלטפורמה למדידת תגובתיות כלי הדם בתגובה להורמונים, מעכבים ואגוניסטים שונים שעשויים להשפיע על תפקוד שכבות השריר החלק והאנדותל בנפרד או בו זמנית. דופן כלי הדם היא מבנה מורכב המורכב משלוש שכבות שונות: האינטימה (שכבת האנדותל), המדיה (שריר חלק וסיבי אלסטין) ואדוונטיטיה (קולגן ורקמות חיבור אחרות). כדי לקבל הבנה ברורה של התכונות הפונקציונליות של כל שכבה, חיוני שתהיה גישה לפלטפורמה ומערכת ניסיונית שתאפשר גישה משולבת לחקר כל שלוש השכבות בו זמנית. גישה כזו דורשת גישה למצב פיזיולוגי למחצה המחקה את סביבת ה- in vivo בסביבה ex vivo . מיוגרפיה טנסומטרית של תאים קטנים סיפקה סביבה אידיאלית להערכת ההשפעה של רמזים סביבתיים, משתנים ניסיוניים או אגוניסטים ואנטגוניסטים פרמקולוגיים על תכונות כלי הדם. במשך שנים רבות, מדענים השתמשו בטכניקת המיוגרפיה הטנסומטרית כדי למדוד את תפקוד האנדותל ואת התכווצות השרירים החלקים בתגובה לגורמים שונים. בדו"ח זה, מערכת מיוגרפיה טנסומטרית של תא נפח קטן משמשת למדידת תפקוד האנדותל באבי העורקים של העכבר המבודד. דו"ח זה מתמקד באופן שבו ניתן להשתמש במיוגרפיה טנסומטרית של תא נפח קטן כדי להעריך את השלמות התפקודית של האנדותל במקטעים קטנים של עורק גדול כגון אבי העורקים החזי.
Introduction
במשך העשורים האחרונים, מערכת המיוגרפיה הקאמרית הקטנה שימשה למדידת התגובה של שכבות שונות של דפנות כלי הדם בתגובה לחומרים פרמקולוגיים שונים ומוליכים עצביים בסביבה ex vivo, בזמן אמת. תגובתיות כלי דם היא מרכיב מרכזי בכלי דם מתפקדים בריאים והיא קריטית לוויסות זרימת הדם וזליפה בכלי הדם ההיקפיים והמוחיים1. בתוך דופן כלי הדם, האינטראקציה בין שכבות האנדותל והשריר החלק היא גורם מכריע בטונוס כלי הדם, אשר מושפע כל הזמן גם משינויים מבניים בשכבת רקמת החיבור המקיפה את דופן כלי הדם (אדוונטיטיה).
שכבת האנדותל שולטת בתנועת כלי הדם על ידי שחרור מספר גורמים מרחיבי כלי דם, כולל תחמוצת החנקן (NO), פרוסטציקלין (PGI2) וגורם היפר-קוטבי שמקורו באנדותל (EDHF), או על ידי ייצור חומרים וזוקונסטרוקטיביים כגון אנדותלין-1 (ET-1) ותרומבוקסאן (TXA2)2,3,4. בין הגורמים הללו, NO נחקר בהרחבה, ותפקידיו הרגולטוריים החשובים בתפקודים תאיים קריטיים אחרים כגון דלקת, נדידה, הישרדות והתפשטות צוטטו רבות בספרות המדעית 2,5.
בתחום הביולוגיה של כלי הדם, מיוגרפיה קאמרית סיפקה לפיזיולוגים של כלי הדם ולפרמקולוגים כלי יקר ואמין למדידת תפקוד האנדותל במערכת סמי-פיזיולוגית מבוקרת היטב1. כיום, ישנן שתי מערכות מיוגרף שונות העומדות לרשות המדענים: מיוגרפיה טנסומטרית (או פין) טנסומטרית (איזומטרית) ומיוגרפיה בלחץ. במערכת מיוגרפיה של חוטים, כלי הדם נמתח בין שני חוטים או פינים, מה שמאפשר מדידה איזומטרית של כוח או התפתחות מתח בדופן כלי הדם, בעוד שמיוגרפיה של לחץ היא פלטפורמה עדיפה למדידות של תגובתיות כלי הדם בעורקי התנגדות קטנים, שבהם שינויים בלחץ הדם נחשבים לגירוי העיקרי לשינויים בטונוס כלי הדם ובתנועת כלי הדם. קיימת הסכמה כללית כי עבור עורקי התנגדות קטנים כגון עורקים מזנטריים ומוחיים, מיוגרפיה בלחץ יוצרת מצב הקרוב יותר לתנאים הפיזיולוגיים בגוף האדם. ניתן להשתמש במיוגרף התא הקטן לכלי דם בקטרים קטנים מאוד (200-500 מיקרומטר) לכלי שיט גדולים בהרבה כמו אבי העורקים.
בעוד שמיוגרף התיל הוא מערכת רבת עוצמה לרישום מתח כלי הדם בתנאים איזומטריים, מיוגרף הלחץ הוא מערכת מתאימה יותר למדידת שינויים בקוטר כלי הדם בתגובה לשינויים בתנאים איזובריים. שינויי הקוטר בכלי הדם בתגובה לשינויים בלחץ או בזרימה גדולים בהרבה בעורק שרירי קטן (עורקי) בהשוואה לעורקים אלסטיים גדולים כמו אבי העורקים. מסיבות אלה, מיוגרף הלחץ נחשב כלי טוב יותר עבור כלי דם קטנים עם vasoreactivity משמעותית1. אחת החוזקות המעשיות האחרות של מיוגרפיה טנסומטרית של תא נפח קטן רב-תאי היא שניתן להבחין בתרומתם של מנגנונים שונים לתגובתיות כלי הדם על ידי לימוד מקטעים מרובים (עד ארבעה) של אותו עורק ומאותו בעל חיים כדי להפחית את השונות ולייצר נתונים חזקים וחד-משמעיים. הוא גם קל יחסית להתקנה ולתחזוקה טכנית. כלי כמעט בכל גודל ניתן ללמוד עם מיוגרף חוט. זהו פתרון חסכוני יותר להערכת תפקוד כלי הדם והוא חלופה טובה למיוגרפיה בלחץ בניסויים שבהם אורך כלי הדם המנותח קצר מדי לפרוטוקול מיוגרף הלחץ.
דו"ח זה מספק פרוטוקול מפורט להערכת תפקוד האנדותל בטבעת אבי העורקים החזה המבודדת של העכבר באמצעות פיני הרכבה בטכניקת המיוגרפיה הטנסומטרית של תא נפח קטן באמצעות מערכת המיוגרפיה הרב-תאית DMT-620 (DMT-USA). פרוטוקול זה משתמש בעכבר C57BL6 זכר בן 6 חודשים עם משקל ממוצע בין 25-35 גרם. למרבה המזל, פרוטוקול זה יכול להיות מיושם על סוגים שונים של בעלי חיים ומשקולות, בהתחשב במגוון הרחב של סוגי כלי שיט וקטרים כי פרוטוקול זה יכול לשמש.
Protocol
כל ההליכים הכירורגיים והטיפול בבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC) של אוניברסיטת מידווסטרן (IACUC# AZ-3006, AZ-2936).
1. הכנת חיץ
הערה: למרות שמאגר תמיסת המלח הפיזיולוגית HEPES (HEPES-PSS) יציב בטמפרטורה של 4 מעלות צלזיוס למשך 7 ימים, מומלץ שכל המאגרים יוצרו זה עתה ביום כל ניסוי. כל הריאגנטים והאגוניסטים האחרים חייבים להיות מוכנים טריים לכל ניסוי. חיץ HEPES-PSS המשמש בפרוטוקול זה הוא חיץ מבוסס היטב למחקרי כלי דם ex vivo שהוכח כמגן ציטולוגי במשך יותר מ -12 שעות תוך שמירה על תגובות כלי הדם של כלי הדם - המוקד העיקרי של פרוטוקול ניסיוני זה 6,7.
- הכן תמיסת HEPES-PSS (pH 7.4) באופן הבא: לערבב 10 mmol / L HEPES, 6 mmol / L גלוקוז, 1.5 mmol / L CaCl 2, 130 mmol / L NaCl, 4 mmol / L KCl, 4 mmol / L NaHCO3, 1.2 mmol / L MgSO 4, 1.2 mmol / L KH2 PO4, ו 0.03 mmol / L EDTA.
- הכן את חיץ ה-K+ הגבוה של HEPES-PSS. תמיסה זו זהה לתמיסת HEPES-PSS, פרט לכך שהיא מכילה 5 מילימול/ל' HEPES, 65 מילימול/ל' NaCl, 10 מילימול/ל' גלוקוז, 1 מילימול/ל' MgCl2, 80 מילימול/ל' KCl ואינה מכילה MgSO4 ו-EDTA.
2. הכנת יחידת מיוגרפיה
- הפעל והגדר את אמבט המים ל -37 מעלות צלזיוס. הקפידו על מפלס מים מתאים.
- הכניסו לאמבט המים שתי כוסות המסומנות כראוי, אחת עם תמיסת HEPES-PSS של 600 מ"ל ואחת עם תמיסת K+ גבוהה של 150 מ"ל.
- אוורור של 300 מ"ל של תמיסת HEPES-PSS עם גז קרבוגן (5% CO 2 ו-95% O2) למשך 10 דקות לפחות.
- הוסף 30 מ"ל של תמיסת HEPES-PSS aerated לצינור צנטריפוגה של 50 מ"ל, תייג כראוי (כלוב חזה, מספר זיהוי עכבר), והנח אותו על קרח. שמור את תמיסת HEPES-PSS הנותרת על הקרח לשימוש במהלך תהליך הדיסקציה של אבי העורקים.
- הפעל את יחידת המיוגרפיה בעלת ארבעת התארים; להוסיף 6 מ"ל של תמיסת HEPES-PSS לכל תא מיוגרף, ולהגדיר את החום ל 37 מעלות צלזיוס. אפשרו לתמיסה בכל תא להיות אוורור (עם תערובת קרבוגן) למשך 30 דקות ובדקו שהתאים הגיעו ל-37 מעלות צלזיוס הרצויות (השתמשו בתקופת המתנה זו כדי לנתח את אבי העורקים של העכבר).
- הפעל את החומרה והמחשב לאיסוף נתוני מיוגרף.
3. בידוד אבי העורקים בעכבר
- הרדמת העכבר הניסיוני בשאיפת איזופלורן בשיעור 5% והמתת חסד על ידי נקע צוואר הרחם (להדגמה זו נעשה שימוש בעכבר C57BL/6J זכר בן 6 חודשים).
- הנח את העכבר על לוח ניתוח במצב שכיבה והצמיד את הנספחים ללוח באמצעות סרט ניתוחי.
- יש לרסס את אזור הבטן ב-70% אלכוהול כך שהפרווה רטובה לחלוטין ושערות רופפות/יבשות אינן נכנסות לחתך. יש לנגב בעדינות את עודפי התמיסה.
- השתמש מלקחיים כדי לאתר ולבודד את עור הבטן רק נחות לתהליך xiphoid של עצם החזה.
- צרו מתח על ידי הרמת העור ישר למעלה. לעשות חתך קהה באמצעות מספריים, ולהסיר את העור השטחי, חושף את חלל החזה.
- הרימו את התהליך הקסיפואידי ובצעו חתכים רוחביים פשוט נחותים מהתהליך לאורך השוליים התת-קוסטליים.
- להאריך את החתכים לרוחב גולגולתי כדי להסיר את החלק הקדמי של בית הצלעות.
- הסר את כלוב החזה על ידי ביצוע חתך קהה דרך עמוד השדרה, מתחת לסרעפת, ובצוואר.
הערה: חוקרים עשויים גם להסיר את אבי העורקים ישירות מהחיה, אך יש להקפיד להגן על כלי הדם ולשטוף את הדם הקרוש מאבי העורקים. פרוטוקול זה משתמש בדוגמה של הסרת כלוב החזה וניקוי קפדני וניתוח אבי העורקים. עם תרגול, שיטה זו יכולה להתבצע במהירות וביעילות והיא מועילה לשימור הרקמה הנוספת למחקרים אחרים כגון אימונוהיסטוכימיה, היסטולוגיה וכתם מערבי. - מעבירים את כלוב החזה לצלחת פטרי שקופה מצופה אלסטומר מסיליקון מלאה בחיץ HEPES-PSS קר כקרח ומצמידים אותו משני הצדדים.
הערה: השתמש בערכת אלסטומר מסיליקון (טבלת חומרים). מערבבים בסיס וחומר ריפוי (10:1 לפי משקל), ואז מוזגים לתוך צלחת פטרי זכוכית, ומאפשרים לרפא במשך 24 שעות ב 25 מעלות צלזיוס. - הניחו את צלחת הפטרי תחת מיקרוסקופ זום סטריאופוני, חתכו בעדינות והוציאו את הלב ואת אבי העורקים המחובר מכלוב הצלעות, והעבירו לצלחת נקייה ושקופה בציפוי אלסטומר מסיליקון (איור 1).
- לאחר מכן, הסר בעדינות שומן ורקמת חיבור וכל דם קרוש מאבי העורקים. בעזרת מספריים קטנים וחדים מנתחים ומבודדים את כל אבי העורקים החל מאזור הקשת ועד לחלק התחתון של אבי העורקים היורד. זכור כי קשת אבי העורקים אינה מתאימה לניסויים במיוגרפיה אך יכולה לשמש למחקרים היסטולוגיים.
- השתמש בתמיסת HEPES-PSS קרה לאורך כל הנתיחה. שנה את הפתרון כל 10 דקות או כאשר הנראות נפגעת, כל מה שבא קודם. מומלץ להרכיב כל טבעת אבי העורקים על תא המיוגרף תוך 20 דקות לאחר הדיסקציה (מקסימום 60 דקות).
4. הרכבה של מקטעי אבי העורקים על תאי המיוגרף
- חותכים את אבי העורקים המנותק לארבעה מקטעים של 2 מ"מ כל אחד באמצעות מספריים כירורגיים קטנים וחדים. השתמש בסרגל הקטן בתוך המנה כהפניה.
- מקם את תא המיוגרף מתחת למיקרוסקופ זום הסטריאו כדי לדמיין בקלות את הפינים ולהגדיר את המיקרומטרים כך שהסיכות כמעט נוגעות ללב (איור 2).
- ודא ששני הפינים המחזיקים רקמות מיושרים כראוי.
- שימו לב והימנעו מצביטה של אבי העורקים בזמן הרכבת המקטעים כדי למנוע נזק לאנדותל.
- בתאים שכבר מכילים 5 מ"ל של חיץ HEPES-PSS מחומם ומאוורר, החליקו בזהירות כל אחד ממקטעי אבי העורקים בקוטר 2 מ"מ על שני פיני ההרכבה באמצעות מלקחיים. היו עדינים מאוד בזמן שאתם מחליקים את מקטעי אבי העורקים מעל הפינים. שכבת האנדותל שברירית מאוד ויורדת בקלות רבה מהצד הלומינלי.
- הזיזו באיטיות את הפינים זה מזה על-ידי סיבוב המיקרומטר נגד כיוון השעון כך שמקטע אבי העורקים לא יחליק מהפינים בעת הנחת התא בחזרה ביחידת המיוגרף (איור 3).
- השתמש בכיסוי העין המכויל בעבר של מיקרוסקופ החיתוך כדי למדוד את האורך האמיתי והמדויק של טבעת אבי העורקים המותקנת על ידי מיקום תחילת הסרגל בקצה אחד של המקטע (מסומן כקצה רקמה α1) ורישום המדידה בקצה השני של מקטע אבי העורקים בחלוקות עיניים (מסומן כקצה רקמה α2)8. ערכים אלה ישמשו במהלך שלבי הנורמליזציה בסעיף 5.
- החזירו כל תא מיוגרף ליחידה, והתחילו לאוורר את התאים בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות.
הערה: ארבעת המקטעים של אבי העורקים יכולים לשמש כשכפילים לאותו טיפול, או שניתן להשתמש בכל מקטע של אבי העורקים בו-זמנית לניסויים שונים.
5. נורמליזציה
הערה: יש צורך בהליך נורמליזציה כדי להבטיח שתנאי הניסוי מתוקננים כראוי והנתונים שנאספו אמינים וניתנים לשחזור. "IC1/IC100", או "גורם הנורמליזציה", מוגדר כיחס בין ההיקף הפנימי של העורק שבו ניתן לרשום את התגובה המרבית ל-vasoconstrictor (למשל, 60 mM KCl) חלקי ההיקף הפנימי שבו נרשם לחץ דופן טרנסמורלי של 100 מ"מ כספית (כלומר, IC100). לכן, על ידי הכפלת IC100 ביחס זה, אנו יכולים לקבוע את ההיקף הפנימי של העורק שבו ניתן לקבוע תגובה אופטימלית (כלומר, IC1).
- הגדר את המיקרומטר כך שהסיכות כמעט נוגעות.
- הגדר כוחות לאפס עבור כל תאי המיוגרף ותן לו שיווי משקל למשך 1-2 דקות נוספות.
- רשום לעצמך את קריאת הקוטר הראשונה מהמיקרומטר. זהו המיקום שבו הפער בין שני פינים נחשב לאפס (דרוש לשלב 5.7.).
- פתח את תוכנת רכישת הנתונים הגדרות נורמליזציה תחת התפריט הנפתח DMT ; מסך חדש ייפתח עם ההגדרות וערכי ברירת המחדל הבאים:
כיול עיניות (מ"מ/div): 0.36
לחץ מטרה (kPa): 13.3
IC1/IC100: 0.9
זמן ממוצע מקוון (ים): 2
זמן השהיה (ים): 60
השמעת צליל עם השלמת ההשהיה (תיבת סימון)
צלילים (עם תפריט בחירה נפתח או פונקציית עיון) - בהתאם למספר המקטעים, בחר את מספר הערוצים הנכון הזמין על המסך והתחל את הקלטת התרשים.
- השתמש בתפריט הנפתח כדי לבחור את ערוץ העניין; מסך הנורמליזציה יופיע.
- הזן את הערכים הקבועים לתוך החלונות כדלקמן: רקמות נקודות קצה α1; רקמות נקודות קצה α2; קוטר סיכה: 40 מיקרומטר; ערך קריאת מיקרומטר מסולם המיקרומטר האנלוגי.
- על מנת לרשום את הנקודה הראשונה (הערך ההתחלתי של X או X0), לחץ על הלחצן הוסף נקודה . לאחר עיכוב של 60 שניות, יוצגו ערכי הכוח והלחץ האפקטיבי (ERTP) המתאימים למיקרומטר זה, והתיבה לקריאת המיקרומטר תהפוך לפעילה וזמינה.
- התחל למתוח את כלי השיט על ידי סיבוב המיקרומטר נגד כיוון השעון. השתמש בתיבת הקריאה של המיקרומטר כדי להזין את הערך ולחץ על הלחצן Add Point (שוב יהיה זמן השהיה של 60 שניות).
- המשך למתוח את כלי השיט והמשך להוסיף ערכי מיקרומטר עד שהערך של Micrometer X1 נראה, שהוא הגדרת המיקרומטר המחושבת המשמשת למתיחת כלי השיט ל- IC1 שלו.
- הגדר את המיקרומטר לערך X1.
הערה: המתח המנורמל (האופטימלי) עבור עכבר C57BL6 בן 6 חודשים הוא 6 mN. - לאחר הנורמליזציה, תן לרקמה לנוח ושיווי משקל במשך 30 דקות. אין צורך לשנות את פתרון HEPES-PSS בתאים בשלב זה.
הערה: כל תא מסוגל להכיל 8 מ"ל של תמיסה. פרוטוקול זה נכתב עם שימוש של 5 מ"ל, אשר מאפשר שקיעה מלאה של כלי השיט ואת פיני הרכבה. - השתמש בזמן המנוחה ושיווי המשקל כדי להכין את הדברים הבאים.
- הכן את מלאי העבודה של דילולים סדרתיים של אצטילכולין במים מזוקקים (מי RO) מהריכוזים הנמוכים ביותר לגבוהים ביותר כדלקמן: 50 ננומטר, 100 ננומטר, 500 ננומטר, 1 מיקרומטר, 5 מיקרומטר, 10 מיקרומטר, 50 מיקרומטר, 500 מיקרומטר, 500 מיקרומטר ו-1 מ"מ. שמור את כל הצינורות על הקרח למשך הניסוי.
- הכינו תמיסת עבודה של 100 mM של N-nitro-L-arginine מתיל אסטר (L-NAME) במים מזוקקים פעמיים ושמרו את התמיסה על הקרח למשך הניסוי.
- הכן את המינון התת-מקסימלי של פנילפרין (10 μM) שנקבע בסדרה נפרדת של ניסויים.
הערה: תקופת שיווי המשקל נחוצה למקטע כלי הדם כדי להסתגל לסביבה החדשה בחדר המיוגרף, לאפס את שיפועי היונים ולהשיג רמה יציבה של מתח פסיבי לפני שהוא נתון לאתגרים פרמקולוגיים ומכניים שונים.
6. מדידה של vasorelax תלוי אנדותל בטבעות אבי העורקים
- בתום תקופת שיווי המשקל בת 30 הדקות, יש לנקז את התאים ולהוסיף לכל תא 5 מ"ל של תמיסת HEPES-PSS טרייה, חמה ומאווררת. מסננים תא אחד בכל פעם כדי למזער את חשיפת הרקמות לאוויר. ניקוז התאים מתבצע באמצעות משאבת ואקום המוגדרת ל -60 ס"מ כספית ושסתומי המיוגרף מוגדרים לעיכוב של 6 שניות כדי להבטיח את הסרת 5 מ"ל התמיסה.
- במידת הצורך, התאימו מחדש את מדידות הכוח כדי לקרוא את המתח האופטימלי של 6 mN. זה מאוד קריטי להתאים מחדש את הכוח למתח אופטימלי במהלך כל תקופת דגירה, כמו גם לפני כל סדרה חדשה של ניסויים. מניחים את הרקמה עוד 15-20 דקות.
- פתח את תוכנת רכישת הנתונים, שנה את מספרי המעקב מ- 50:1 ל- 500:1 ולחץ על התחל. בשלב זה, ניתן לראות את הכוח הרשום עבור כל תא בתוכנה.
- מיד לפני תחילת ניסוי חדש, הקפד להוסיף את התווית המתאימה על תוכנת רכישת הנתונים.
- מסננים את התאים פעם נוספת לפני שמוסיפים 5 מ"ל של תמיסת K+ גבוהה לכל תא. זה מתאים לבדיקת הכדאיות של רקמת אבי העורקים ותקינות תגובת התכווצות השריר החלק לדה-פולריזציה של הממברנה לפני השימוש ברקמה לכל פרוטוקול ניסיוני אחר. זה עוזר לקבוע אם מקטע כלי הדם שמיש לניסויים נוספים.
- מסננים את התאים שוב ברגע שהתגובה המתכווצת לתמיסת K+ הגבוהה מגיעה לרמה של יצירת כוח (איור 4).
הערה: אין להשאיר את תמיסת K+ הגבוהה בתאים למשך יותר מ-3 דקות, מכיוון שהיא תפגע ברקמה. - לשטוף את הרקמה עם תמיסת HEPES-PSS 3x. הוסף 5 מ"ל של תמיסת K+ גבוהה לכל תא. מסננים את התאים ברגע שהתגובה המתכווצת לתמיסת K+ גבוהה מגיעה לרמה ליצירת כוח ושוטפים את הרקמה פי 3 עם HEPES-PSS לפני שמאפשרים לרקמה לנוח עוד 15 דקות.
הערה: במעבדות מסוימות, מקטעי הדם נתונים לתמיסת K+ גבוהה שלוש פעמים רצופות כדי להבטיח את השתנות כלי הדם לפני תחילת ניסויי המיוגרף. בפרוטוקול זה, מקטעי אבי העורקים שבודדו לאחרונה נתונים לתמיסת K+ גבוהה פעמיים לפני שהם משתמשים ברקמה לניסויים נוספים. חשוב לשמור על עקביות בכל הניסויים. - השתמש בממוצע של שני הפסגות הרשומות של התפתחות כוח (כוח כיווץ) בתגובה לתמיסת K+ גבוהה כדי לנרמל את הערכים הרשומים בתגובה לחומרים אחרים של vasoconstrictor ו-vasodilator ששימשו בניסוי.
- לנוח את הרקמה במשך 15-20 דקות.
- התכווצו מראש של מקטעי אבי העורקים עם סוכן vasoconstrictor פנילפרין (PE) במינון תת-מקסימלי שכבר נקבע (ריכוז סופי של 10 μM בתא).
הערה: המינון התת-מקסימלי של פנילפרין (10 μM) נקבע בסדרה נפרדת של ניסויים, שבהם מקטעי אבי העורקים היו נתונים לריכוזים הולכים וגדלים של תמיסת פנילפרין בריכוזים הסופיים של 1 ננומטר, 5 ננומטר, 10 ננומטר, 50 ננומטר, 500 ננומטר, 1 מיקרומטר, 5 מיקרומטר, 10 מיקרומטר ו-50 מיקרומטר. כתוצאה מכך, נקבע כי ריכוז סופי של 10 μM של פנילפרין יכול ליצור את כוח הכיווץ התת-מקסימלי (90% מהכוח המרבי) במקטעים אאורטליים של 2 מ"מ, וזה ממש לפני שכוח הכיווץ מגיע לרמה. הסיבה לשימוש בריכוז התת-מקסימלי של פנילפרין היא כדי למנוע בעיות הקשורות לרוויה של רקמת אבי העורקים או דה-סנסיטיזציה לאגוניסט vasoconstricting. - אפשרו לעקומת הכיווץ הנגרמת על-ידי PE להגיע לרמה של התפתחות מתח (כוח) (איור 5).
- ברמה של התפתחות מתח לפנילפרין, בצע את עקומת המינון-תגובה של אצטילכולין על ידי הוספת 5 μL של מינונים הולכים וגדלים של פתרונות מלאי עבודה של אצטילכולין במרווחים של 3 דקות על מנת לקבוע ריכוזים סופיים של אצטילכולין בתא המיוגרף כדלקמן: 50 pM, 100 pM, 500 pM, 1 nM, 5 nM, 10 nM, 50 nM, 100 ננומטר, 500 ננומטר ו-1 מיקרומטר (איור 6).
הערה: לאחר הוספת כל מנה של אצטילכולין, יש להמתין לפחות 3 דקות (עד שהמתח יגיע לרמה) לפני הוספת המנה הבאה. - בכל שלב, פיפטה את תמיסת מלאי אצטילכולין לתוך החדר לאט מאוד רחוק טבעות אבי העורקים כדי למנוע כל הפרעה ברקמות.
- לאחר השלמת ניסוי המינון-תגובה, יש לנקז את התאים ולשטוף את מקטעי אבי העורקים בתמיסת HEPES-PSS חמה ומאווררת פי 3 כדי להסיר את שאריות התרופה שנותרו.
- הנח את הרקמה במשך 30 דקות לפני תחילת שלבי הניסוי הבאים. הכדאיות של אבי העורקים נבדקת לפני כל שלב ניסיוני באמצעות תמיסת HEPES-PSS גבוהה K+ . אם כל שלבי ההכנה והניסוי מתבצעים כראוי, הכדאיות של רקמת אבי העורקים תישאר זהה למשך הניסוי כולו (4-6 שעות).
7. ההשפעות של מעכבים כלליים של ייצור NO על vasorelax בתיווך אנדותל
- השתמש באותה רקמת אבי העורקים עבור חלק זה של הניסוי לאחר שטיפה בזהירות ומנוחה של המקטעים במשך 30 דקות לפחות.
הערה: השתמש בזמן המנוחה של 30 דקות כדי להכין תמיסה עובדת של 100 mM של N-nitro-L-arginine מתיל אסטר (L-NAME) במים מזוקקים כפולים ולשמור את התמיסה על הקרח למשך הניסוי. - לאחר מנוחה של מקטעי אבי העורקים במשך 30 דקות, מסננים את התאים ומוסיפים תמיסת K+(60 mM KCl) גבוהה וחמה לכל תא.
הערה: חשוב שעבור כל חלק בניסוי, רקמת אבי העורקים תאותגר עם תמיסת K+ גבוהה לפחות פעם אחת. שיא ההתכווצות המתועד ישמש לנרמול הנתונים שנאספו במהלך אותו חלק של הניסוי. - מסננים את התאים שוב ברגע שתגובת ההתכווצות לתמיסת K+ גבוהה מגיעה לרמה ושוטפים את הרקמה בתמיסת HEPES-PSS פי 3.
- על מנת להעריך את התרומה של ייצור NO לדלקת כלי הדם המושרה על ידי אצטילכולין שנצפתה (ראה סעיף 6.), בשלב זה, קדם-דגירה של מקטעי אבי העורקים עם מעכב כללי של ייצור NO (L-NAME) על ידי הוספת 10 μL מתמיסת מלאי העבודה המוכנה של 100 mM של L-NAME לכל תא מיוגרף (המכיל תמיסת חיץ של 5mL) על מנת להשיג ריכוז סופי של 200 μM בכל תא מיוגרף.
הערה: L-NAME הוא מעכב לא סלקטיבי ורב עוצמה של כל האיזופורמים של NOS (אנזים האחראי על NO ייצור), ולכן הוא נחשב כלי יעיל לחסום את הייצור של NO בדופן כלי הדם9. - אפשרו למקטעי אבי העורקים לנוח בזמן שלפני הדגירה עם L-NAME (30 דקות).
- אין לשטוף בשלב זה.
- מבלי להסיר את L-NAME, הוסף את המינון התת-מקסימלי של פנילפרין (ריכוז סופי של 10 μM) לתא כדי לגרום להתכווצות אבי העורקים.
הערה: בשל הפעולה המעכבת של L-NAME על ייצור NO אנדוגני, השיא החדש שנרשם להתכווצות אבי העורקים המושרה על ידי פנילפרין יהיה גבוה בהרבה מהשיא הראשוני שנרשם לפני הדגירה של הרקמה עם L-NAME. זה צפוי בשל ההשפעה של L-NAME על ייצור NO בסיסי בדופן אבי העורקים, מה שמוביל לייצור כוח גבוה יותר (עקב ייצור כוח התכווצות גבוה יותר על ידי השריר החלק). - המתן עד שעקומת הכיווץ הנגרמת על ידי פנילפרין תגיע לרמה להתפתחות מתח (כוח התכווצות).
- בשלב זה, הוסף אצטילכולין לתא המיוגרף כדי להשיג ריכוז סופי של 500 ננומטר (זהו הריכוז התת-מקסימלי של אצטילכולין שנקבע במהלך הניסויים המתוארים בסעיף 5. של הפרוטוקול).
- המתינו מספר דקות כדי לרשום שינויים אפשריים בהתפתחות הכוח עד שהרמה שנוצרה תהיה יציבה (איור 7).
הערה: בשל הפעולה המעכבת של L-NAME על יכולתה של שכבת האנדותל לייצר NO בתגובה לאצטילכולין, היא אינה צפויה לראות שינויים כלשהם בייצור הכוח הרשום בתגובה לפנילפרין, מכיוון שהאנדותל NOS של אבי העורקים (eNOS) אינו מסוגל ליצור NO בתגובה ליישום אצטילכולין. - מסננים את התאים ושוטפים את הרקמה בתמיסת HEPES-PSS חמה ומאווררת פי 3.
8. תרומה של שכבת האנדותל ל vasorelaxation אבי העורקים
- על מנת להדגיש את תפקידה של שכבת האנדותל בוויסותרפיה של אבי העורקים, בדוק את כלי הדם המושרים על ידי אצטילכולין בקטעי אבי העורקים המושרים באנדותל, שבהם מסירים את שכבות האנדותל.
- מקמו את תא המיוגרף מתחת למיקרוסקופ והעבירו בעדינות חוט קטן (אותו חוט המשמש למיוגרפיה של חוטים יכול לשמש כאן) דרך לומן של אבי העורקים. הזז בעדינות את החוט דרך לומן (תנועה מעגלית עדינה) למשך פרק זמן קצר. זה מספיק כדי להסיר את האנדותל או אינטימה.
- חותכים את אבי העורקים לטבעות אבי העורקים בקוטר 2 מ"מ ומרכיבים טבעות אלה על תא המיוגרף כפי שתואר קודם לכן.
- הגדר את המתח האופטימלי ב-6 mN ואפשר לרקמה לנוח במשך 30 דקות במאגר HEPES-PSS חם ואוורירי
- בתום תקופת שיווי המשקל של 30 דקות, מסננים את התאים ומוסיפים 5 מ"ל של תמיסת HEPES-PSS טרייה, חמה ומאווררת לכל תא.
- אפס את הכוח עבור כל תאי המיוגרף על ידי סיבוב המיקרומטר בכיוון נגד כיוון השעון.
- סובב באיטיות את המיקרומטר נגד כיוון השעון כדי להגדיל את המרחק בין הפינים עד שהכוח הרשום יגיע למתח האופטימלי הרצוי עבור אבי העורקים של העכבר (6 mN עבור אבי העורקים של העכבר C57BL/6J). הנח את הרקמה עוד 15-20 דקות במתח האופטימלי (6 mN).
- מסננים את התאים פי 1 יותר לפני הוספת 5 מ"ל של תמיסת K+ גבוהה לכל תא.
- מסננים את התאים שוב ברגע שתגובת ההתכווצות לתמיסת K+ גבוהה מגיעה לרמה ושוטפים את הרקמה בתמיסת HEPES-PSS פי 3. לנוח את הרקמה במשך 15-20 דקות
- התכווצו מראש של מקטעי אבי העורקים עם הסוכן vasoconstrictor פנילפרין (ריכוז סופי של 10 μM בתא).
הערה: עקב הסרת האנדותל, הייצור הבסיסי NO בדופן אבי העורקים פוחת באופן משמעותי; לכן, השיא של התכווצות הנגרמת על ידי פנילפרין (שיא ייצור הכוח) צפוי להיות גבוה יותר ברקמת אבי העורקים ללא שכבת האנדותל. - כאשר הכוח המושרה על ידי פנילפרין מגיע לרמה, הוסף את הריכוז התת-מקסימלי של אצטילכולין לתא המיוגרף כדי להשיג ריכוז סופי של 500 ננומטר.
הערה: אם הסרת שכבת האנדותל נעשית כראוי, לא יהיו שינויים בכוח הרשום המושרה על ידי פנילפרין, שכן ייצור NO המושרה על ידי אצטילכולין על ידי האנדותל יפחת עקב הסרת שכבת האנדותל. העקבות המוקלטות יהיו דומות מאוד לזו שנצפתה בנוכחות L-NAME (סעיף 7.). - המתן 3 דקות כדי לוודא שהרמה הרשומה להתפתחות הכוח המושרה על-ידי פנילפרין אינה משתנה לפני סיום הניסוי (איור 8).
הערה: אם היישום של אצטילכולין גורם לירידה כלשהי בהתכווצות המושרה על ידי פנילפרין בזמן שהוא ברמה, זוהי אינדיקציה לכך ששכבת האנדותל לא הוסרה לחלוטין.
תוצאות
פרוטוקול המיוגרפיה של חדר קטן טנזומטרי המוסבר כאן הוא השיטה הסטנדרטית למדידת תגובתיות כלי דם בעורקים קטנים וגדולים ומאפשר מדידות סימולטניות של תגובתיות כלי הדם בעד ארבעה מקטעי כלי דם מאותה חיית מעבדה קטנה ניסיונית. בדוח הזה אנו משתמשים באופן ספציפי במערכת כדי למדוד את תפקוד האנדותל באבי העורקים של העכבר המבודד (איור 1). בפרוטוקול זה, מקטעי אבי העורקים המבודדים מותקנים על תא איברים קטן (איור 2) בין שני סיכות נירוסטה קטנות (איור 3). תא המיוגרף יכול להכיל עד 8 מ"ל של תמיסת חיץ ולספק סביבה חצי פיזיולוגית לכלי המבודד למשך הניסויים. חשוב מאוד, לפני כל ניסוי, את הכדאיות של כל קטע מבודד נבדק ומאומת. הפרוטוקול הסטנדרטי לביסוס השלמות והכדאיות של כל מקטע כלי מבודד הוא לאתגר את הרקמה עם ריכוז גבוה של אשלגן כלורי כדי לגרום לדה-פולריזציה של קרום השריר החלק. בתרחיש שכלי השיט המבודד בריא ומגיב, נוכל לתעד את ייצור הכוח המתכווץ בתצוגה (איור 4). שיא הכוח המוקלט משמש מאוחר יותר לנרמול ייצור הכוח עבור אותו קטע בתגובה לאגוניסטים המשמשים במהלך הפרוטוקול (למשל, פנילפרין). על מנת למדוד את כלי הדם בתיווך אנדותל, יש צורך לכווץ מראש את רקמת אבי העורקים בריכוז תת-מקסימלי (10 μM) של פנילפרין, הגורם להתכווצות חלקה בתיווך שרירים וליצירת כוח (איור 5). כאשר ההתכווצות המושרה על-ידי פנילפרין מגיעה לרמה מסוימת (איור 6), מינונים הולכים וגדלים של אצטילכולין מיושמים בשלבים מרובים כדי להשיג את הווזו-הרפיה המרבית במקטע המבודד (איור 6). רמת הרפיית כלי הדם היא מדידה עקיפה של ייצור תחמוצת החנקן בתיווך אנדותל. כדי לאשר עוד יותר כי vasorelax המושרה על ידי אצטילכולין בטבעות אבי העורקים נובע מייצור של תחמוצת החנקן, מקטעים אבי העורקים מטופלים מראש עם מעכב כללי של ייצור תחמוצת החנקן (200 μM של L-NAME) במשך 30 דקות לפני יישום פנילפרין. כפי שמוצג באיור 7, L-NAME מסוגל לחסום לחלוטין את כלי הדם הנגרמים על-ידי אצטילכולין באבי העורקים שנדבק מראש, מה שמדגיש את העובדה שאצטילכולין משרה את כלי הדם של אבי העורקים באמצעות הגדלת ייצור תחמוצת החנקן. מצד שני, הסרת שכבת האנדותל ממקטעי אבי העורקים גם חוסמת את כלי הדם הנגרמים על ידי אצטילכולין, ומדגישה את התפקיד שהאנדותל ממלא בהרפיית כלי הדם (איור 8).
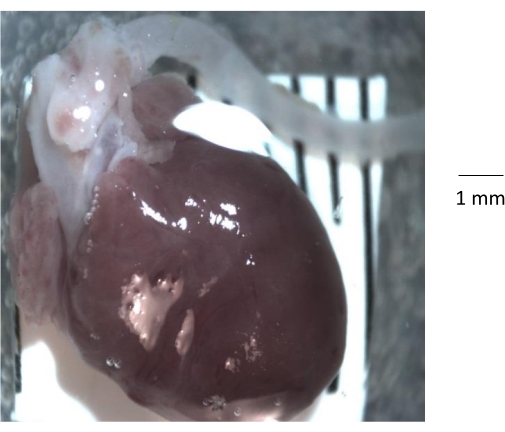
איור 1: מבט אנטומי גס על הלב, שורש אבי העורקים ואבי העורקים היורד שבודד מעכבר בקרה בן 6 חודשים. לאחר הסרת כלוב הצלעות מהעכבר, הלב ואבי העורקים מבודדים מכלוב הצלעות ומועברים לצלחת פטרי נקייה מצופה אלסטומר מסיליקון. לפני בידוד אבי העורקים, חשוב להסיר את כל השומן ורקמת החיבור וכל קריש דם מן לומן של אבי העורקים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 2: תמונה מייצגת של תא של יחידת המיוגרף המציגה את פיני ההרכבה של 200 מיקרומטר. כפי שניתן לראות, שתי הסיכות בתוך תא המיוגרף בקושי נוגעות. לפני השימוש בתא, חשוב לוודא שהפינים מיושרים כראוי. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: עיגון מקטעי אבי העורקים אל תא המיוגרף. מקטע אבי העורקים של עכבר בקוטר 2 מ"מ המבודד מעכבר C57BL/6 בן 6 חודשים מוחזק על ידי שני פינים בתוך תא מיוגרף. זה מושג על ידי החלקה עדינה של אבי העורקים על שני פיני ההרכבה באמצעות מלקחיים. התיבה המנוקדת האדומה מציגה את התמונה המוגדלת של מקטע אבי העורקים בקוטר 2 מ"מ המותקן בין שני פינים בתוך תא המיוגרף. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
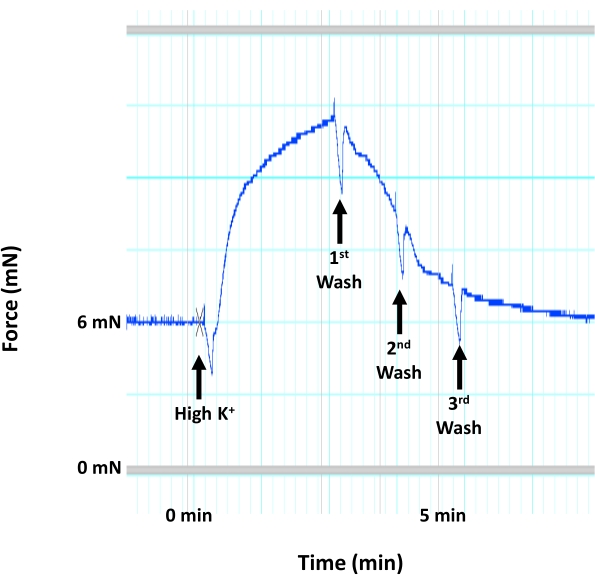
איור 4: התכווצות אבי העורקים עקב דה-פולריזציה של קרום השריר החלק. תמונה מייצגת המציגה את עקבות ההתכווצות אבי העורקים של העכבר (יצירת כוח) בתגובה לריכוז גבוה של K+ (60 mM KCl) שיגרום לדה-פולריזציה והתכווצות של קרום השריר החלק בתוך השכבה המדיאלית של אבי העורקים. היישום של תמיסת K+ גבוהה מלווה מיד בשלוש שטיפות רצופות באמצעות תמיסת HEPES-PSS חמה ומאווררת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
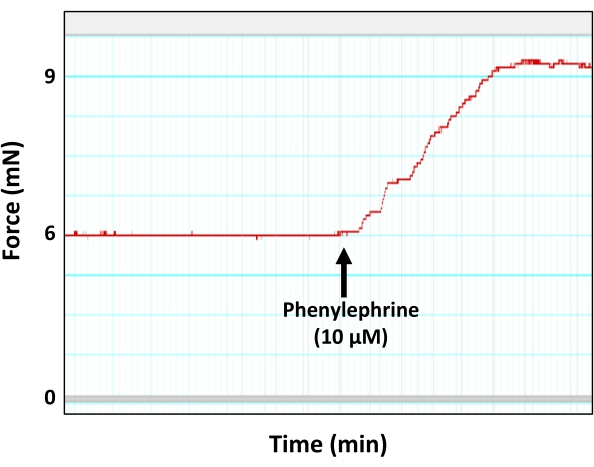
איור 5: התכווצות אבי העורקים בתגובה לחומר הווזוקונסטרינג פנילפרין. עקבות מיוגרף מייצגים המראים יצירת כוח (כיווץ) על ידי טבעת אבי העורקים בתגובה לריכוז תת-מקסימלי של פנילפרין (10 μM). כפי שניתן לראות, שיא ההתכווצות הנגרמת על ידי פנילפרין מגיע בסופו של דבר לרמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
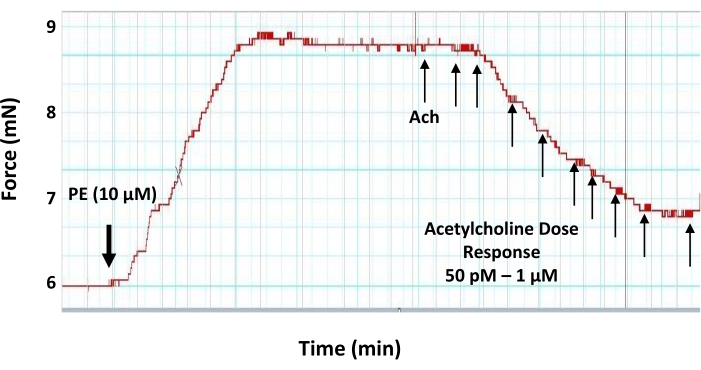
איור 6: השפעות מינון-תגובה של אצטילכולין על טבעת אבי העורקים שנדבקה מראש. עקבות מיוגרף מייצגים המראים את המינון-תגובה (50 pM-1 μM) השפעה מרחיבת כלי דם של המוליך העצבי מרחיב כלי הדם אצטילכולין על טבעת אבי העורקים בקוטר 2 מ"מ שהתכווצה מראש. טבעת אבי העורקים הוא מראש התכווץ עם 10 μM של פנילפרין לפני היישום של אצטילכולין. המנה הראשונה של אצטילכולין מתווספת כאשר המתח המושרה על ידי פנילפרין מגיע לרמה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
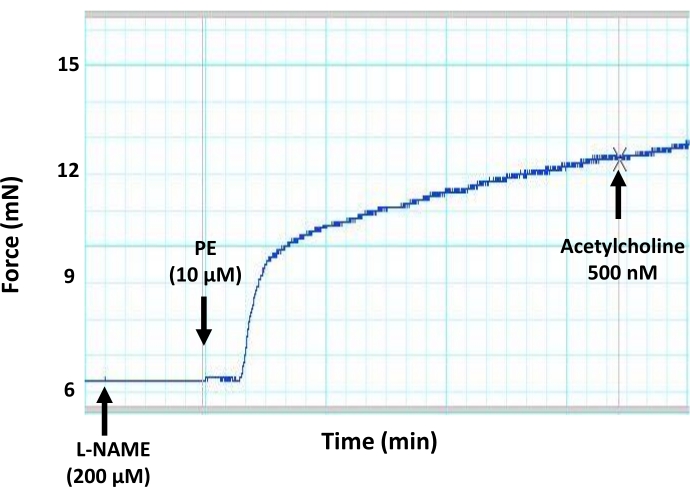
איור 7: ההשפעות של מעכב כללי של ייצור NO (L-NAME) על כלי דם בתיווך אנדותל באבי העורקים של עכברים. עקבות מיוגרף מייצגים מראים כי קדם-אינקובציה של מקטעי אבי העורקים עם מעכב כללי של ייצור NO (L-NAME, ריכוז סופי של 200 μM) חוסמת התרחבות כלי דם המושרה על ידי אצטילכולין בטבעת אבי העורקים שהתכווצה מראש. זאת בשל עיכוב של ייצור NO על ידי האנדותל עקב הפעולה המעכבת של L-NAME על eNOS. אצטילכולין נוסף לקטע אבי העורקים לפני החוזה בריכוז תת-מקסימלי של 500 ננומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
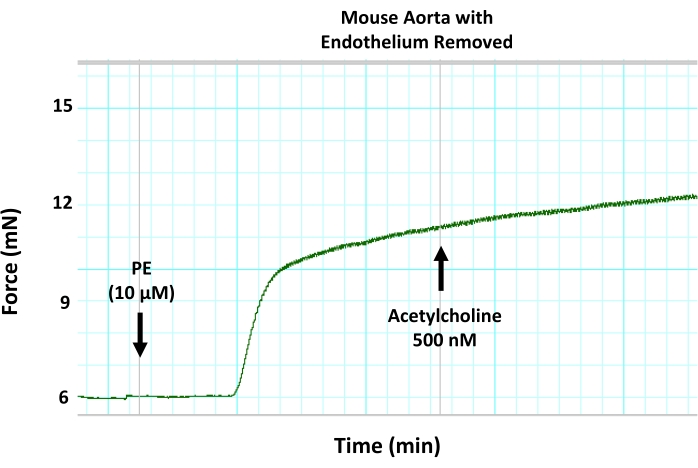
איור 8: ההשפעות של הסרת אנדותל מכני על כלי דם בתיווך אנדותל באבי העורקים של עכברים. עקבות מיוגרף מייצגים מראים כי הסרת האנדותל ממקטעי אבי העורקים באמצעות דנודציה של חוטים חוסמת התרחבות כלי דם המושרה על ידי אצטילכולין בטבעת אבי העורקים שהתכווצה מראש. זאת בשל עיכוב של vasorelax בתיווך אנדותל. אצטילכולין נוסף לקטע אבי העורקים לפני החוזה בריכוז תת-מקסימלי של 500 ננומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
תחום הביולוגיה של כלי הדם מסתמך במידה רבה על כלים המסייעים לחוקרים להעריך את השלמות התפקודית והמבנית של דופן כלי הדם. היא גם דורשת תשומת לב מיוחדת לאינטראקציות הישירות והעקיפות בין שלוש שכבות כלי הדם: האינטימה, המדיה והאדוונטיטיה. בין שלוש השכבות הללו, האינטימה נוצרת על ידי מונולאייר של תאי אנדותל ויש לה תפקיד חשוב מאוד בוויסות בריאות כלי הדם והמוסטזיס.
זה מבוסס היטב כי כל נזק לשכבת האנדותל יכול להשפיע לרעה על יכולתו לשחרר NO וגורמים אחרים vasodilatory, המוביל dysregulation של תפקוד כלי הדם, אשר נצפתה בהפרעות כלי דם שונים כגון טרשת עורקים, מפרצת, ו דלקת כלי הדם10,11,12. על מנת להבין את המנגנונים הבסיסיים השולטים בתפקוד האנדותל התקין ולהעריך את תפקוד כלי הדם ואת שלמות האנדותל בתוך דופן כלי הדם, חובה להשתמש במערכת ניסיונית סטנדרטית המחקה את התנאים הפיזיולוגיים in vivo.
עבור עורקים גדולים, כגון אבי העורקים, המיוגרפיה הטנסומטרית (איזומטרית) של החדר הקטן מוכרת במידה רבה ככלי אמין היוצר את התנאים הכמעט פיזיולוגיים הטובים ביותר הזמינים עבור כלי הדם בסביבה ex vivo . המערכת מאפשרת גם שמירה על כדאיות הרקמה למשך פרק זמן ארוך משמעותית (עד 6-8 שעות) בסביבת המעבדה, מה שהופך את הטכניקה לכלי רב ערך ורב-תכליתי. יתרון נוסף הוא שתא המיוגרף מאפשר לשמור את טבעות כלי הדם ולעשות בהן שימוש חוזר לניסויים שונים גב אל גב, ובכך להפוך אותו לגישה חסכונית תוך הפחתת הצורך במספר גבוה של עכברים ניסיוניים. ניתן לבדוק עד ארבעה מקטעי כלי דם בו זמנית באמצעות מערכת מיוגרפיה בת ארבעה תאים, מה שמגביר את העקביות תוך הפחתת וריאציות בניסויים שונים.
ניתן להשתמש בכלים פרמקולוגיים ומכניים שונים כדי ללמוד את תפקוד שכבת האנדותל בכלי הדם. הסמן העיקרי של אנדותל פונקציונלי הוא הייצור הרגיל של NO, אשר ידוע כסוכן כלי הדם החשוב ביותר המיוצר ומשוחרר על ידי שכבת האנדותל. תפקוד לקוי של האנדותל קשור בעיקר לירידה משמעותית בייצור NO והוכח כמעורב בהתקדמות של הפרעות וסקולריות שונות כגון יתר לחץ דם, פקקת וטרשת עורקים.
בתוך מיטת כלי הדם, ייצור NO נשלט בעיקר על ידי שינויים בזרימת הדם והלחץ, או על ידי אירועים תוך תאיים אחרים שעלולים להוביל לשינויים בריכוז הסידן הציטופלסמי או הפעלת מסלולי איתות בתגובה להורמונים וגורמי גדילה13,14. שינויים בייצור NO נחשבים לאחד הסמנים המוקדמים והאמינים של תפקוד לקוי של האנדותל, והם בדרך כלל ניתנים לזיהוי מוקדם במהלך התקדמות הפרעות לב וכלי דם. ללא קשר למודל המחלה, ביולוגים של כלי הדם מתעניינים מאוד בכלים ובמבחנים המאפשרים למדוד את תפקוד האנדותל. חשוב במיוחד שניתן יהיה להבדיל בין תרומה של שכבות שונות של כלי הדם באמצעות פלטפורמה המחקה את התנאים הפיזיולוגיים.
במיוגרף של תא קטן, חוקרים יכולים להשתמש בכלים פרמקולוגיים ומכניים כדי למדוד את תפקוד האנדותל בסביבה מבוקרת היטב. בתוך חדר המיוגרף נוצרת סביבה מלאכותית שיכולה לתמוך בתפקוד תקין של כלי הדם. בסביבה מלאכותית כזו, מכיוון שמקטעי כלי הדם המבודדים אינם נתמכים על ידי רקמת החיבור הסובבת ואיברים אחרים, חשוב לקבוע את המתח הפסיבי האופטימלי שבו המקטעים המבודדים יכולים ליצור את ההתכווצות המרבית האפשרית בתגובה לווזופרסורים. במתח האופטימלי, ניתן למדוד את התגובה ההתכווצותית המקסימלית הרגילה לחומרים מעוררי כלי דם כגון פנילפרין או נוראדרנלין כדי לבדוק את השלמות המבנית והתפקודית של שכבת השריר החלק של דופן כלי הדם. במעבדה נקבע כי המתח הפסיבי של 6 mN הוא מתח מתאים למקטעי אבי העורקים של עכבר 2 מ"מ15. עם זאת, יש לקבוע את המתח הפסיבי האופטימלי עבור סוגים שונים של עורקים במינים שונים16.
בנוסף, לפני ביצוע ניסויים כלשהם עם כלי דם מבודדים, חובה לבדוק את הכדאיות של טבעות מבודדות כדי לוודא שהן עומדות בקריטריוני ההכללה וההדרה של רקמות בנות קיימא ושמישות. זה מושג בדרך כלל על ידי חשיפת הטבעות המבודדות לתמיסת K+ בריכוז גבוה (60 mM KCl). התוצאה היא דה-פולריזציה של קרום השריר החלק עקב פתיחת תעלות סידן מגודרות מתח (VGCC), מה שמוביל להתכווצות שריר חלק ולכיווץ כלי הדם של אבי העורקים. שיטה זו משמשת לאימות הכדאיות של מקטעי אבי העורקים לפני השימוש במקטעים אלה לניסויים נוספים.
מצד שני, סוכני vasodilating כגון אצטילכולין ניתן להשתמש כדי לבדוק את המאפיינים הפונקציונליים של שכבת האנדותל. אם שכבת האנדותל שלמה ומתפקדת, אז ריכוז תת-מקסימלי של אצטילכולין יכול לגרום להרפיה בקטע כלי דם מכווץ מראש17. גודל של הרפיה המושרה על ידי אצטילכולין הוא אינדיקציה לרמת שחרור NO משכבת האנדותל. כל נזק לשכבת האנדותל (מכני או פונקציונלי) ישפיע על ייצור NO ועל תגובת כלי הדם. בפרוטוקול זה, הנתונים שסופקו מראים כי אצטילכולין יכול לגרום להרפיה באבי העורקים של העכבר שהתכווץ מראש באופן תלוי מינון, עם הרפיה תת-מקסימלית המושגת בריכוז הסופי של 500 ננומטר (איור 6).
בניסויים מסוימים, חוקרים מעוניינים למדוד את התגובה הישירה של השריר החלק למרחיב כלי הדם NO. מכיוון שההתמקדות בניסויים כאלה היא בתפקוד השרירים החלקים בלבד, קיים פרוטוקול שיאפשר לחוקרים לעקוף את תרומת האנדותל על ידי הסרה (דנוידה) של שכבת האנדותל מקטע כלי הדם. ניתן להסיר את האנדותל בשיטות שונות, כולל אוויר, גלגול בין האצבעות או הסרה באמצעות חוט. במסגרות ניסיוניות כאלה, כלי הדם הדחוסים (ללא שכבת אנדותל) אינם נתונים לתורמים כגון ניטרוגליצרין ונתרן ניטרופרוזיד. זה מאפשר לקבוע אם מסלול האיתות המחזורי של שריר חלק GMP-חלבון קינאז G המגיב ל-NO הוא שלם ומתפקד 7,18. כתב היד הזה הסביר כיצד הסרת שכבת האנדותל במקטע אבי העורקים המבודד חוסמת לחלוטין את ההשפעות של מרחיב כלי הדם אצטילכולין, ומדגישה את החשיבות של NO release בהרפיית כלי הדם ובהרחבת כלי הדם (איור 8).
בעוד שלטכניקות החוטים והמיוגרפיה הטנסומטרית יש תועלת רבה בניסויים בביולוגיה של כלי הדם, ראוי לציין את המגבלות הפוטנציאליות. באופן ספציפי, למערכת הטנזומטרית יש מגבלות גודל רקמה (כלומר, כלי דם קטנים יותר). בנוסף, אופי ה- ex vivo של טכניקה זו אינו מאפשר מניפולציה של הלחץ והזרימה התוך-לומינליים לחיקוי מדויק יותר של תפקוד כלי הדם in vivo ופרמטרים המודינמיים. הגדרות מיוגרף לחץ יחשבו, למעשה, במשתנים אלה וידמו דינמיקה של כלי הדם בזמן אמת, תוך מתן אפשרות לשימוש בעורקי התנגדות קטנים יותר. בנוסף, ניסויי מיוגרף חוטים אינם יכולים לשכפל באופן מלא תנאים פיזיולוגיים או למדל במדויק את יחסי הגומלין בין הדם המסתובב, דפנות כלי הדם והרקמות הסובבות אותם, שגם הם ממלאים תפקידים חשובים בוויסות תפקוד כלי הדם בגוף.
ללא קשר לפרוטוקול הניסויי המשמש בניסויי המיוגרפיה או ל-vasoconstrictor/vasodilator שנבחר בניסוי, מערכת המיוגרפיה התאית הקטנה מספקת פלטפורמה סמי-פיזיולוגית אמינה, ניתנת לשחזור ויציבה למדידת תגובתיות כלי הדם ותקינות תפקודית. למרות שהמיקוד של דו"ח זה היה רק על המדידה הבסיסית של תפקוד האנדותל, מערכת המיוגרפיה יכולה לשמש להערכת תכונות תפקודיות רבות אחרות של כלי הדם, כגון יחסי מתח/מתח, חוזק דופן כלי הדם, נקודת קרע והתכווצות פסיבית ואקטיבית אם להזכיר כמה. זה מדגיש את הערך של מערכת myograph ככלי אמין בתחום הביולוגיה של כלי הדם.
Disclosures
המחברים מצהירים כי אין להם אינטרסים כלכליים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מימון מהמכונים הלאומיים לבריאות (R15HL145646) ומהמכללה ללימודים מתקדמים של אוניברסיטת מידווסטרן.
Materials
| Name | Company | Catalog Number | Comments |
| Acetylcholine | SigmaAldrich | A6625-100G | |
| CaCl2 | SigmaAldrich | C4901-1KG | |
| Carbogen gas | Matheson | H103847 | |
| Dissecting scissors | FST | 91460-11 | |
| DMT 620 Multi chamber myograph system | DMT | DMT 620 | Multi chamber myograph system |
| Dumont forceps | FST | 91150-20 | |
| EDTA | SigmaAldrich | E5134-10G | |
| Glucose | SigmaAldrich | G8270-1KG | |
| HEPES | SigmaAldrich | H7006-1KG | |
| KCl | SigmaAldrich | P9541-1KG | |
| KH2PO4 | SigmaAldrich | P5655-1KG | |
| LabChart | ADI instruments | Data acquisition software | |
| Light source | Volpi | 14363 | |
| L-Name | Fischer Scientific | 50-200-7725 | |
| MgSO4 | SigmaAldrich | M2643-500G | |
| Microscope | Leica | S6D | stereo zoom microscope |
| NaCl | SigmaAldrich | S5886-5KG | |
| NaHCO3 | SigmaAldrich | S5761-500G | |
| Organ bath system | DMT | 720MO | |
| Phenylephrine | SigmaAldrich | P6126-10G | |
| Pump | Welch | 2546B-01 | |
| Software | ADI instruments | LabChart 8.1.20 | |
| Spring Scissors | FST | 15003-08 | |
| Sylgard 184 Kit | Electron Microscopy Services | 24236-10 | silicone elastomer kit |
| Tank Regulator | Fischer Scientific | 10575147 | |
| Water bath system | Fischer Scientific | 15-462-10 |
References
- Wenceslau, C. F., et al. Guidelines for the measurement of vascular function and structure in isolated arteries and veins. American Journal of Physiology-Heart and Circulatory Physiology. 321 (1), 77-111 (2021).
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction: Testing and clinical relevance. Circulation. 115 (10), 1285-1295 (2007).
- Lerman, A., Zeiher, A. M. Endothelial function: Cardiac events. Circulation. 111 (3), 363-368 (2005).
- Rajendran, P., et al. The vascular endothelium and human diseases. International Journal of Biological Sciences. 9 (10), 1057-1069 (2013).
- Galley, H. F., Webster, N. R. Physiology of the endothelium. British Journal of Anaesthesia. 93 (1), 105-113 (2004).
- Orita, H., et al. In vitro evaluation of phosphate, bicarbonate, and Hepes buffered storage solutions on hypothermic injury to immature myocytes. Cardiovascular Drugs and Therapy. 8 (6), 851-859 (1994).
- Liu, Y. H., Bian, J. S. Bicarbonate-dependent effect of hydrogen sulfide on vascular contractility in rat aortic rings. American Journal of Physiology. Cell Physiology. 299 (4), 866-872 (2010).
- Griffiths, K., Madhani, M. The use of wire myography to investigate vascular tone and function. Methods in Molecular Biology: Atherosclerosis. 2419, 361-367 (2022).
- Pfeiffer, S., Leopold, E., Schmidt, K., Brunner, F., Mayer, B. Inhibition of nitric oxide synthesis by NG-nitro-L-arginine methyl ester (L-NAME): Requirement for bioactivation to the free acid, NG-nitro-L-arginine. British Journal of Pharmacology. 118 (6), 1433-1440 (1996).
- Bacon, P. A. Endothelial cell dysfunction in systemic vasculitis: New developments and therapeutic prospects. Current Opinion in Rheumatology. 17 (1), 49-55 (2005).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: Current concepts and clinical implications. Frontiers in Medicine. 8, 798958(2021).
- Mikolajczyk, K., et al. The important role of endothelium and extracellular vesicles in the cellular mechanism of aortic aneurysm formation. International Journal of Molecular Sciences. 22 (23), 13157(2021).
- Vallance, P., Hingorani, A. Endothelial nitric oxide in humans in health and disease. International Journal of Experimental Pathology. 80 (6), 291-303 (1999).
- Tousoulis, D., Kampoli, A. M., Tentolouris, C., Papageorgiou, N., Stefanadis, C. The role of nitric oxide on endothelial function. Current Vascular Pharmacology. 10 (1), 4-18 (2012).
- Gibson, C., et al. Mild aerobic exercise blocks elastin fiber fragmentation and aortic dilatation in a mouse model of Marfan syndrome associated aortic aneurysm. Journal of Applied Physiology. 123 (1), 147-160 (2017).
- Xiao, X., Ping, N. N., Li, S., Cao, L., Cao, Y. X. An optimal initial tension for rat basilar artery in wire myography. Microvascular Research. 97, 156-158 (2015).
- Chung, A. W., Yang, H. H., Yeung, K. A., van Breemen, C. Mechanical and pharmacological approaches to investigate the pathogenesis of Marfan syndrome in the abdominal aorta. Journal of Vascular Research. 45 (4), 314-322 (2008).
- Zhong, C., et al. Age impairs soluble guanylyl cyclase function in mouse mesenteric arteries. International Journal of Molecular Sciences. 22 (21), 11412(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved