Method Article
قياس الانحلال الوعائي المعتمد على البطانية في الشريان الأورطي الصدري للفأر باستخدام تصوير عضلي صغير الحجم للغرفة
In This Article
Summary
يصف هذا البروتوكول المفاهيم والتطبيق التقني لتقنية التصوير العضلي التينسومتري باستخدام نظام تصوير عضلي متعدد الغرف في التقييم التجريبي خارج الجسم الحي لوظيفة بطانة الأبهر للفأر.
Abstract
التصوير العضلي التينسومتري للغرفة الصغيرة الحجم هو تقنية شائعة الاستخدام لتقييم انقباض الأوعية الدموية للأوعية الدموية الصغيرة والكبيرة في المختبر والشرايين الصغيرة المعزولة عن الأنسجة البشرية. تسمح هذه التقنية للباحثين بالحفاظ على الأوعية الدموية المعزولة في بيئة موحدة وخاضعة لرقابة مشددة (شبه فسيولوجية) ، مع خيار التكيف مع العوامل البيئية المختلفة ، مع تحدي الأوعية المعزولة بعوامل دوائية مختلفة يمكن أن تحفز تضيق الأوعية أو توسع الأوعية. توفر غرفة التصوير العضلي أيضا منصة لقياس تفاعل الأوعية الدموية استجابة لمختلف الهرمونات والمثبطات والمنبهات التي قد تؤثر على وظيفة العضلات الملساء والطبقات البطانية بشكل منفصل أو في وقت واحد. جدار الأوعية الدموية عبارة عن بنية معقدة تتكون من ثلاث طبقات مختلفة: intima (الطبقة البطانية) ، والوسائط (العضلات الملساء وألياف الإيلاستين) ، و adventitia (الكولاجين والأنسجة الضامة الأخرى). للحصول على فهم واضح للخصائص الوظيفية لكل طبقة ، من الأهمية بمكان الوصول إلى منصة ونظام تجريبي من شأنه أن يسمح بنهج توافقي لدراسة جميع الطبقات الثلاث في وقت واحد. يتطلب مثل هذا النهج الوصول إلى حالة شبه فسيولوجية تحاكي البيئة في الجسم الحي في بيئة خارج الجسم الحي . يوفر التصوير العضلي التينسومتري للغرفة صغيرة الحجم بيئة مثالية لتقييم تأثير الإشارات البيئية أو المتغيرات التجريبية أو المنبهات الدوائية والمناهضات على خصائص الأوعية الدموية. لسنوات عديدة ، استخدم العلماء تقنية التصوير العضلي التينسومتري لقياس وظيفة البطانة وانقباض العضلات الملساء استجابة لعوامل مختلفة. في هذا التقرير ، يتم استخدام نظام تصوير عضلي تينسومتري صغير الحجم لقياس الوظيفة البطانية في الشريان الأورطي للفأر المعزول. يركز هذا التقرير على كيفية استخدام التصوير العضلي التينسومتري للغرفة صغيرة الحجم لتقييم السلامة الوظيفية للبطانة في أجزاء صغيرة من الشريان الكبير مثل الشريان الأورطي الصدري.
Introduction
على مدى العقود القليلة الماضية ، تم استخدام نظام التصوير العضلي للغرفة الصغيرة لقياس تفاعل طبقات مختلفة من جدران الأوعية الدموية استجابة لمختلف العوامل الدوائية والناقلات العصبية في بيئة خارج الجسم الحي في الوقت الفعلي. التفاعل الوعائي هو عنصر رئيسي في الأوعية الدموية الوظيفية الصحية وهو أمر بالغ الأهمية لتنظيم تدفق الدم والتروية في الأوعية الدموية الطرفية والدماغية1. داخل جدار الأوعية الدموية ، يعد التفاعل بين طبقات العضلات البطانية والملساء محددا رئيسيا لنغمة الأوعية الدموية ، والتي تتأثر أيضا باستمرار بالتغيرات الهيكلية في طبقة النسيج الضام المحيطة بجدار الأوعية الدموية (adventitia).
تتحكم الطبقة البطانية في حركة الأوعية عن طريق إطلاق بعض عوامل توسع الأوعية ، بما في ذلك أكسيد النيتريك (NO) ، والبروستاجيلين (PGI2) ، وعامل فرط الاستقطاب المشتق من البطانة (EDHF) ، أو عن طريق إنتاج عوامل مضيقة للأوعية مثل الإندوثيلين -1 (ET-1) والثرموبوكسان (TXA2) 2،3،4. من بين هذه العوامل ، تمت دراسة NO على نطاق واسع ، وقد تم الاستشهاد بأدوارها التنظيمية المهمة في الوظائف الخلوية الحرجة الأخرى مثل الالتهاب والهجرة والبقاء والانتشار بشكل كبير في الأدبيات العلمية 2,5.
في مجال بيولوجيا الأوعية الدموية ، زود التصوير العضلي بالغرفة علماء فسيولوجيا الأوعية الدموية وعلماء الصيدلة بأداة قيمة وموثوقة لقياس وظيفة البطانة في نظام شبه فسيولوجي خاضع لرقابة مشددة1. حاليا ، هناك نوعان مختلفان من أنظمة التصوير العضلي المتاحة للعلماء: العضلي السلكي (أو الدبوس) التنسومتري (متساوي القياس) والتصوير العضلي بالضغط. في نظام تصوير العضل السلكي ، يتم شد الوعاء الدموي بين سلكين أو دبابيس ، مما يسمح بالقياس متساوي القياس للقوة أو تطور التوتر في جدار الوعاء الدموي ، في حين أن التصوير العضلي بالضغط هو منصة مفضلة لقياسات تفاعل الأوعية الدموية في شرايين المقاومة الصغيرة ، حيث تعتبر التغيرات في ضغط الدم الحافز الرئيسي للتغيرات في نغمة الأوعية الدموية وحركة الأوعية. هناك اتفاق عام على أنه بالنسبة لشرايين المقاومة الصغيرة مثل الشرايين المساريقية والدماغية ، فإن التصوير العضلي بالضغط يخلق حالة أقرب إلى الظروف الفسيولوجية في جسم الإنسان. يمكن استخدام مخطط عضل الغرفة الصغيرة للأوعية ذات الأقطار الصغيرة جدا (200-500 ميكرومتر) إلى الأوعية الأكبر بكثير مثل الشريان الأورطي.
في حين أن جهاز التصوير العضلي السلكي هو نظام قوي لتسجيل توتر الأوعية الدموية في ظل ظروف متساوية القياس ، فإن مخطط الضغط هو نظام أكثر ملاءمة لقياس التغيرات في قطر الوعاء استجابة للتغيرات في ظروف متساوي الضغط. تكون تغيرات القطر في الوعاء استجابة للتغيرات في الضغط أو التدفق أكبر بكثير في الشريان العضلي الصغير (الشريان) مقارنة بالشرايين المرنة الكبيرة مثل الشريان الأورطي. لهذه الأسباب ، يعتبر مخطط الضغط العضلي أداة أفضل للأوعية الدموية الصغيرة ذات النشاط الوعائي الكبير1. واحدة من نقاط القوة العملية الأخرى للتصوير العضلي التنسي للغرفة الصغيرة الحجم متعددة الغرف هي أنه يمكن للمرء تمييز مساهمة الآليات المختلفة في تفاعل الأوعية الدموية من خلال دراسة أجزاء متعددة (تصل إلى أربعة) من نفس الشريان ومن نفس الحيوان لتقليل التباين وإنتاج بيانات قوية وقاطعة. كما أنه من السهل نسبيا إعداده وصيانته تقنيا. يمكن دراسة الأوعية من أي حجم تقريبا باستخدام مخطط عضلي سلكي. إنه حل أكثر فعالية من حيث التكلفة لتقييم وظيفة الأوعية الدموية وهو بديل جيد لتخطيط عضل الضغط في التجارب التي يكون فيها طول الوعاء التشريحي قصيرا جدا بالنسبة لبروتوكول مخطط عضل الضغط.
يقدم هذا التقرير بروتوكولا مفصلا لتقييم الوظيفة البطانية في الحلقة الأبهرية الصدرية للفأر المعزولة باستخدام دبابيس التثبيت في تقنية تخطيط العضل العضلي للغرفة صغيرة الحجم باستخدام نظام التصوير العضلي متعدد الغرف DMT-620 (DMT-USA). يستخدم هذا البروتوكول فأرة C57BL6 يبلغ من العمر 6 أشهر بمتوسط وزن يتراوح بين 25-35 جم. لحسن الحظ ، يمكن تطبيق هذا البروتوكول على أنواع وأوزان مختلفة من الحيوانات ، مع الأخذ في الاعتبار النطاق الواسع لأنواع الأوعية والأقطار التي يمكن استخدام هذا البروتوكول من أجلها.
Protocol
تمت الموافقة على جميع الإجراءات الجراحية ورعاية الحيوانات من قبل اللجنة المؤسسية لرعاية واستخدام الحيوانات ورعايتها (IACUC) بجامعة الغرب الأوسط (IACUC # AZ-3006، AZ-2936).
1. إعداد العازلة
ملاحظة: على الرغم من أن محلول الملح الفسيولوجي HEPES (HEPES-PSS) مستقر عند 4 درجات مئوية لمدة 7 أيام ، فمن المستحسن أن يتم تصنيع جميع المخازن المؤقتة حديثا في يوم كل تجربة. يجب تحضير جميع الكواشف والناهضات الأخرى طازجة لكل تجربة. المخزن المؤقت HEPES-PSS المستخدم في هذا البروتوكول هو مخزن مؤقت راسخ لدراسات الأوعية الدموية خارج الجسم الحي والتي ثبت أنها واقية من الخلايا لأكثر من 12 ساعة مع الحفاظ على استجابات توسع الأوعية الدموية للوعاء - التركيز الرئيسي لهذا البروتوكول التجريبي 6,7.
- تحضير محلول HEPES-PSS (الرقم الهيدروجيني 7.4) على النحو التالي: امزج 10 ملليمول/لتر HEPES، 6 ملليمول/لتر جلوكوز، 1.5 ملليمول/لتر CaCl 2، 130 ملليمول/لتر كلوريد الصوديوم، 4 ملليمول/لتر KCl، 4 ملليمول/لتر NaHCO3، 1.2 ملليمول/لتر MgSO 4، 1.2 ملليمول/لتر KH2 PO4، و0.03 ملليمول/لتر EDTA.
- تحضير HEPES-PSS عالية K + العازلة . هذا مطابق لمحلول HEPES-PSS ، باستثناء أنه يحتوي على 5 مليمول / لتر HEPES ، 65 مليمول / لتر كلوريد الصوديوم ، 10 مليمول / لتر جلوكوز ، 1 مليمول / لتر MgCl2 ، 80 مليمول / لتر KCl ولا يحتوي على MgSO4 و EDTA.
2. إعداد وحدة الميوغراف
- قم بتشغيل وضبط الحمام المائي على 37 درجة مئوية. تأكد من مستوى الماء المناسب.
- ضع كأسين ملصقتين بشكل مناسب في الحمام المائي ، أحدهما يحتوي على 600 مل من محلول HEPES-PSS والآخر يحتوي على 150 مل من محلول K + العالي.
- قم بتهوية دورق سعة 300 مل من محلول HEPES-PSS بغاز الكربوجين (5٪ CO 2 و 95٪ O2) لمدة 10 دقائق على الأقل.
- أضف 30 مل من محلول HEPES-PSS الهوائي إلى أنبوب طرد مركزي سعة 50 مل ، وقم بتسميته بشكل مناسب (القفص الصدري ، رقم تعريف الماوس) ، وضعه على الثلج. احتفظ بمحلول HEPES-PSS الهوائي المتبقي على الثلج لاستخدامه أثناء عملية تسلخ الأبهر.
- قم بتشغيل وحدة التصوير العضلي المكونة من أربع غرف ؛ أضف 6 مل من محلول HEPES-PSS إلى كل حجرة تصوير عضلي ، واضبط الحرارة على 37 درجة مئوية. اترك المحلول في كل حجرة يتم تهويته (بمزيج الكاربوجين) لمدة 30 دقيقة وتحقق للتأكد من أن الغرف قد وصلت إلى 37 درجة مئوية المطلوبة (استخدم فترة الانتظار هذه لتشريح الشريان الأورطي للفأر).
- قم بتشغيل أجهزة الحصول على بيانات myograph والكمبيوتر.
3. عزل الشريان الأورطي الفأر
- تخدير الفأر التجريبي باستنشاق الأيزوفلوران بنسبة 5٪ والقتل الرحيم عن طريق خلع عنق الرحم (يتم استخدام فأر C57BL / 6J يبلغ من العمر 6 أشهر لهذا العرض التوضيحي).
- ضع الماوس على لوح جراحي في وضع ضعيف وقم بتأمين الزوائد على اللوحة باستخدام شريط جراحي.
- رش منطقة البطن بنسبة 70٪ كحول حتى يكون الفراء رطبا تماما ولا يدخل أي شعر فضفاض / جاف إلى الشق. امسح المحلول الزائد برفق.
- استخدم الملقط لتحديد موقع وعزل جلد البطن أقل شأنا من عملية الخنجري في القص.
- خلق التوتر عن طريق رفع الجلد بشكل مستقيم. قم بعمل قطع حاد باستخدام المقص ، وقم بإزالة الجلد السطحي ، وفضح التجويف الصدري.
- ارفع عملية الخنجري واجعل الشقوق الجانبية أدنى من العملية على طول الهوامش تحت الوربية.
- قم بتمديد الشقوق الجانبية بشكل قحفي لإزالة الجزء الأمامي من القفص الصدري.
- قم بإزالة القفص الصدري عن طريق إجراء قطع حاد من خلال العمود الفقري ، أسفل الحجاب الحاجز ، وفي الرقبة.
ملاحظة: يمكن للباحثين أيضا إزالة الشريان الأورطي مباشرة من الحيوان ، ولكن يجب توخي الحذر لحماية الوعاء وطرد الدم المتخثر من الشريان الأورطي. يستخدم هذا البروتوكول مثال إزالة القفص الصدري وتنظيف الشريان الأورطي وتشريحه بعناية. مع الممارسة ، يمكن إجراء هذه الطريقة بسرعة وكفاءة وهي مفيدة للحفاظ على الأنسجة الإضافية للدراسات الأخرى مثل الكيمياء المناعية والأنسجة والنشاف الغربي. - انقل القفص الصدري إلى طبق بتري شفاف مطلي بالمطاط الصناعي السيليكوني مملوء بعازل HEPES-PSS الهوائي المثلج وثبته على كلا الجانبين.
ملاحظة: استخدم مجموعة مطاط السيليكون (جدول المواد). اخلطي القاعدة وعامل المعالجة (10: 1 بالوزن) ، ثم اسكبيها في طبق بتري زجاجي ، واتركيها تلتكيف لمدة 24 ساعة عند 25 درجة مئوية. - ضع طبق بتري تحت مجهر تكبير ستيريو ، وقم بقص وإزالة القلب والشريان الأورطي المرفق برفق من القفص الصدري ، وانقله إلى طبق نظيف وشفاف مطلي بالمطاط الصناعي السيليكوني (الشكل 1).
- بعد ذلك ، قم بإزالة الدهون والأنسجة الضامة وأي دم متخثر من الشريان الأورطي برفق. باستخدام مقص حاد وصغير ، قم بتشريح وعزل الشريان الأورطي بالكامل بدءا من منطقة القوس إلى الجزء السفلي من الشريان الأورطي الهابط. تذكر أن قوس الأبهر غير مناسب لتجارب التصوير العضلي ولكن يمكن استخدامه للدراسات النسيجية.
- استخدم محلول HEPES-PSS الهوائي البارد طوال عملية التشريح. قم بتغيير الحل كل 10 دقائق أو عندما تتعرض الرؤية للخطر ، أيا كان ما يأتي أولا. يوصى بتركيب كل حلقة من حلقات الأبهر على حجرة التصوير العضلي في غضون 20 دقيقة بعد التسلخ (بحد أقصى 60 دقيقة).
4. تركيب شرائح الأبهر على غرف التصوير العضلي
- قطع الشريان الأورطي تشريح إلى أربعة أجزاء من 2 مم لكل منها باستخدام مقص جراحي صغير حاد. استخدم المسطرة الصغيرة داخل الطبق كمرجع.
- ضع حجرة التصوير العضلي تحت مجهر التكبير الاستريو لتصور المسامير بسهولة وضبط الميكرومتر بحيث تتلامس المسامير تقريبا (الشكل 2).
- تأكد من محاذاة كلا دبابيس الأنسجة بشكل صحيح.
- انتبه وتجنب قرص الشريان الأورطي أثناء تركيب الأجزاء لمنع تلف البطانة.
- في الغرف التي تحتوي بالفعل على 5 مل من المخزن المؤقت HEPES-PSS الدافئ والتهوية ، حرك بعناية كل جزء من أجزاء الأبهر 2 مم على دبابيس التثبيت باستخدام الملقط. كن لطيفا جدا أثناء تحريك أجزاء الأبهر فوق المسامير. الطبقة البطانية هشة للغاية وتخرج بسهولة شديدة من الجانب اللمني.
- حرك المسامير ببطء عن طريق تدوير الميكرومتر عكس اتجاه عقارب الساعة حتى لا ينزلق الجزء الأبهري عن المسامير عند وضع الحجرة مرة أخرى في وحدة التصوير العضلي (الشكل 3).
- استخدم العدسة العدسة التي تمت معايرتها مسبقا لمجهر التشريح لقياس الطول الحقيقي والدقيق للحلقة الأبهرية المركبة عن طريق وضع بداية المسطرة في أحد طرفي المقطع (تم وضع علامة عليه كنهاية الأنسجة α1) وتدوين القياس في الطرف الآخر من الجزء الأبهري في أقسام العين (تم تمييزها على أنها نهاية الأنسجة α2)8. سيتم استخدام هذه القيم أثناء خطوات التسوية في القسم 5.
- أعد كل حجرة تصوير عضلي إلى الوحدة ، وابدأ في تهوية الغرف عند 37 درجة مئوية لمدة 30 دقيقة.
ملاحظة: يمكن استخدام الأجزاء الأربعة من الشريان الأورطي كنسخ متماثلة لنفس العلاج، أو يمكن استخدام كل جزء من الشريان الأورطي في وقت واحد لتجارب مختلفة.
5. التطبيع
ملاحظة: إجراء التطبيع ضروري لضمان توحيد الظروف التجريبية بشكل صحيح وأن البيانات التي تم جمعها موثوقة وقابلة للتكرار. يعرف "IC1 / IC100" ، أو "عامل التطبيع" ، بأنه نسبة المحيط الداخلي للشريان التي يمكن عندها تسجيل أقصى استجابة لمضيق للأوعية (على سبيل المثال ، 60 mM KCl) مقسوما على المحيط الداخلي الذي يتم عنده تسجيل ضغط جدار عابر يبلغ 100 مم زئبق (أي IC100). لذلك ، بضرب IC100 بهذه النسبة ، يمكننا تحديد المحيط الداخلي للشريان الذي يمكن من خلاله إنشاء استجابة مثالية (أي IC1).
- اضبط الميكرومتر بحيث تتلامس المسامير تقريبا.
- اضبط القوى على الصفر لجميع غرف التصوير العضلي واتركها تتوازن لمدة 1-2 دقيقة أخرى.
- دون قراءة القطر الأول من الميكرومتر. هذا هو الموضع الذي تعتبر فيه الفجوة بين دبابيس صفرا (مطلوب للخطوة 5.7.).
- افتح إعدادات تطبيع برنامج الحصول على البيانات ضمن القائمة المنسدلة DMT ؛ سيتم فتح شاشة جديدة بالإعدادات والقيم الافتراضية التالية:
معايرة العدسة (مم / div): 0.36
الضغط المستهدف (كيلو باسكال): 13.3
IC1 / IC100: 0.9
متوسط الوقت (الأوقات) عبر الإنترنت: 2
وقت التأخير: 60
تشغيل الصوت عند تأخير الإكمال (خانة الاختيار)
الأصوات (مع قائمة التحديد المنسدلة أو وظيفة الاستعراض) - بناء على عدد المقاطع ، اختر العدد الصحيح من القنوات المتاحة على الشاشة وابدأ تسجيل المخطط.
- استخدم القائمة المنسدلة لتحديد قناة الاهتمام ؛ ستظهر شاشة التطبيع.
- أدخل القيم الثابتة في النوافذ على النحو التالي: نقاط نهاية الأنسجة α1 ؛ نقاط نهاية الأنسجة α2 ؛ قطر الدبوس: 40 ميكرومتر ؛ قيمة قراءة ميكرومتر من مقياس ميكرومتر التناظرية.
- لتسجيل النقطة الأولى (القيمة الأولية ل X أو X0) ، انقر فوق الزر "إضافة نقطة ". بعد تأخير 60 ثانية ، سيتم عرض قيم القوة والضغط الفعال (ERTP) المقابلة لهذا الميكرومتر ، ويصبح مربع قراءة الميكرومتر نشطا ومتاحا.
- ابدأ في تمديد الوعاء عن طريق تدوير الميكرومتر في اتجاه عكس اتجاه عقارب الساعة. استخدم مربع قراءة الميكرومتر لإدخال القيمة وانقر فوق الزر "إضافة نقطة " (سيكون هناك وقت تأخير يبلغ 60 ثانية مرة أخرى).
- استمر في تمديد الوعاء واستمر في إضافة قيم ميكرومتر حتى يتم رؤية قيمة الميكرومتر X1 ، وهو إعداد الميكرومتر المحسوب المستخدم لتمديد الوعاء إلى IC1 الخاص به.
- اضبط الميكرومتر على قيمة X1.
ملاحظة: التوتر الطبيعي (الأمثل) لماوس C57BL6 عمره 6 أشهر هو 6 مللي نيوتن. - بعد التطبيع ، دع الأنسجة ترتاح وتتوازن لمدة 30 دقيقة. ليست هناك حاجة لتغيير حل HEPES-PSS في الغرف في هذه المرحلة.
ملاحظة: كل غرفة قادرة على استيعاب 8 مل من المحلول. تمت كتابة هذا البروتوكول باستخدام 5 مل ، مما يسمح بالغمر الكامل للسفينة ودبابيس التثبيت. - استخدم وقت الراحة والتوازن لإعداد ما يلي.
- تحضير المخزون العامل للتخفيفات التسلسلية للأسيتيل كولين في الماء المقطر (ماء RO) من أدنى إلى أعلى تركيزات على النحو التالي: 50 نانومتر ، 100 نانومتر ، 500 نانومتر ، 1 ميكرومتر ، 5 ميكرومتر ، 10 ميكرومتر ، 50 ميكرومتر ، 100 ميكرومتر ، 500 ميكرومتر ، و 1 مللي متر. احتفظ بجميع الأنابيب على الجليد طوال مدة التجربة.
- تحضير محلول عمل 100 mM من N-nitro-L-arginine methyl ester (L-NAME) في ماء مقطر مزدوج والحفاظ على المحلول على الجليد طوال مدة التجربة.
- تحضير الجرعة دون القصوى من فينيليفرين (10 ميكرومتر) المحددة في مجموعة منفصلة من التجارب.
ملاحظة: فترة التوازن ضرورية لجزء الأوعية الدموية للتكيف مع البيئة الجديدة في غرفة التصوير العضلي ، وإعادة ضبط التدرجات الأيونية ، وتحقيق مستوى ثابت من التوتر السلبي قبل التعرض لتحديات دوائية وميكانيكية مختلفة.
6. قياس الانحلال الوعائي المعتمد على البطانة في حلقات الأبهر
- في نهاية فترة التوازن التي تبلغ 30 دقيقة ، قم بتصريف الغرف وإضافة 5 مل من محلول HEPES-PSS الطازج والدافئ والتهوية إلى كل غرفة. استنزاف غرفة واحدة في كل مرة لتقليل تعرض الأنسجة للهواء. يتم إجراء تصريف الغرف باستخدام مضخة تفريغ مضبوطة على 60 سم زئبق وصمامات myograph مضبوطة على تأخير 6 ثوان لضمان إزالة 5 مل من المحلول.
- إذا لزم الأمر ، أعد ضبط قياسات القوة لقراءة التوتر الأمثل البالغ 6 مللي نيوتن. من الأهمية بمكان إعادة ضبط القوة على التوتر الأمثل خلال كل فترة حضانة ، وكذلك قبل كل مجموعة جديدة من التجارب. أرح المنديل لمدة 15-20 دقيقة أخرى.
- افتح برنامج الحصول على البيانات ، وقم بتغيير أرقام التتبع من 50: 1 إلى 500: 1 ، واضغط على ابدأ. في هذه المرحلة ، يمكن رؤية القوة المسجلة لكل غرفة في البرنامج.
- مباشرة قبل بدء تجربة جديدة ، تأكد من إضافة التسمية المناسبة على برنامج الحصول على البيانات.
- قم بتصريف الغرف مرة أخرى قبل إضافة 5 مل من محلول K + العالي إلى كل غرفة. هذا مناسب لاختبار صلاحية أنسجة الأبهر وسلامة استجابة انقباض العضلات الملساء لإزالة الاستقطاب الغشائي قبل استخدام الأنسجة لأي بروتوكول تجريبي آخر. يساعد هذا في تحديد ما إذا كان جزء الأوعية الدموية قابلا للاستخدام لمزيد من التجارب.
- قم بتصريف الغرف مرة أخرى بمجرد وصول الاستجابة المقلصة لمحلول K + العالي إلى هضبة لتوليد القوة (الشكل 4).
ملاحظة: لا تترك محلول K+ العالي في الغرف لأكثر من 3 دقائق ، لأنه قد يتلف الأنسجة. - اغسل المنديل بمحلول HEPES-PSS 3x. أضف 5 مل من محلول K + العالي إلى كل غرفة. قم بتصريف الغرف بمجرد وصول الاستجابة المقلصة لمحلول K + العالي إلى هضبة لتوليد القوة واغسل الأنسجة 3x باستخدام HEPES-PSS قبل السماح للأنسجة بالراحة لمدة 15 دقيقة أخرى.
ملاحظة: في بعض المختبرات ، تخضع شرائح الدم لمحلول K + عالي ثلاث مرات متتالية لضمان تباين الأوعية الدموية قبل بدء تجارب التصوير العضلي. في هذا البروتوكول ، تخضع الأجزاء الأبهرية المعزولة حديثا لمحلول K + عالي مرتين قبل استخدام الأنسجة لإجراء مزيد من التجارب. من المهم الحفاظ على اتساق هذا في جميع التجارب. - استخدم متوسط القمتين المسجلتين لتطور القوة (قوة الانكماش) استجابة لحل K + مرتفع لتطبيع القيم المسجلة استجابة لعوامل مضيق للأوعية وموسعة للأوعية الأخرى المستخدمة في التجربة.
- أرح المنديل لمدة 15-20 دقيقة.
- قبل التعاقد على شرائح الأبهر مع عامل مضيق للأوعية فينيليفرين (PE) بجرعة دون القصوى المحددة بالفعل (تركيز نهائي 10 ميكرومتر في الغرفة).
ملاحظة: تم تحديد الجرعة دون القصوى من فينيليفرين (10 ميكرومتر) في مجموعة منفصلة من التجارب ، حيث تعرضت شرائح الأبهر لتركيزات متزايدة من محلول فينيليفرين بتركيزات نهائية تبلغ 1 نانومتر ، 5 نانومتر ، 10 نانومتر ، 50 نانومتر ، 100 نانومتر ، 500 نانومتر ، 1 ميكرومتر ، 5 ميكرومتر ، 10 ميكرومتر ، و 50 ميكرومتر. نتيجة لذلك ، تم تحديد أن التركيز النهائي البالغ 10 ميكرومتر من فينيليفرين يمكن أن يولد قوة الانكماش دون القصوى (90٪ من القوة القصوى) في شرائح الأبهر 2 مم ، والتي تكون مباشرة قبل أن تصل قوة الانكماش إلى الهضبة. السبب في استخدام الحد الأقصى لتركيز فينيليفرين هو تجنب المشكلات المتعلقة بتشبع أنسجة الأبهر أو إزالة الحساسية لمنبهات تضيق الأوعية. - اسمح لمنحنى الانكماش الناجم عن PE بالوصول إلى هضبة لتطور التوتر (القوة) (الشكل 5).
- عند هضبة تطور التوتر إلى فينيليفرين ، قم بإجراء منحنى استجابة جرعة الأسيتيل كولين بإضافة 5 ميكرولتر من الجرعات المتزايدة من محاليل مخزون عمل الأسيتيل كولين في فترات 3 دقائق من أجل تحديد التركيزات النهائية للأسيتيل كولين في غرفة التصوير العضلي على النحو التالي: 50 pM ، 100 pM ، 500 pM ، 1 nM ، 5 nM ، 10 nM ، 50 nM ، 100 نانومتر و 500 نانومتر و 1 ميكرومتر (الشكل 6).
ملاحظة: بعد إضافة كل جرعة من أستيل كولين، انتظر لمدة 3 دقائق على الأقل (حتى يصل التوتر إلى الهضبة) قبل إضافة الجرعة التالية. - في كل خطوة ، ماصة محلول مخزون الأسيتيل كولين في الغرفة ببطء شديد وبعيدا عن حلقات الأبهر لتجنب أي اضطراب في الأنسجة.
- بعد الانتهاء من تجربة الاستجابة للجرعة ، قم بتصريف الغرف وغسل أجزاء الأبهر بمحلول HEPES-PSS الدافئ والتهوية 3x لإزالة أي بقايا متبقية من الدواء.
- أرح المنديل لمدة 30 دقيقة قبل البدء في خطوات التجربة التالية. يتم فحص صلاحية الشريان الأورطي قبل كل خطوة تجريبية باستخدام محلول HEPES-PSS العالي K + . إذا تم اتباع جميع الخطوات التحضيرية والتجريبية بشكل صحيح ، فستظل صلاحية الأنسجة الأبهرية كما هي طوال مدة التجربة بأكملها (4-6 ساعات).
7. آثار مثبطات عامة لإنتاج NO على استرخاء الأوعية بوساطة البطانة
- استخدم نفس نسيج الأبهر لهذا الجزء من التجربة بعد غسل الأجزاء بعناية وإراحتها لمدة 30 دقيقة على الأقل.
ملاحظة: استخدم 30 دقيقة من وقت الراحة لتحضير محلول عمل 100 مللي متر من N-nitro-L-arginine methyl ester (L-NAME) في ماء مقطر مزدوج واحتفظ بالمحلول على الجليد طوال مدة التجربة. - بعد إراحة أجزاء الأبهر لمدة 30 دقيقة ، صفي الغرف وأضف محلول K + (60 mM KCl) الطازج والدافئ إلى كل غرفة.
ملاحظة: من المهم ، لكل جزء من التجربة ، أن يتم تحدي النسيج الأبهري بمحلول K + مرتفع مرة واحدة على الأقل. سيتم استخدام ذروة الانكماش المسجلة لتطبيع البيانات التي تم جمعها خلال هذا الجزء من التجربة. - قم بتصريف الغرف مرة أخرى بمجرد وصول استجابة الانكماش لمحلول K + العالي إلى هضبة واغسل الأنسجة بمحلول HEPES-PSS 3x.
- من أجل تقييم مساهمة إنتاج NO في الانحلال الوعائي الناجم عن الأسيتيل كولين المرصود (انظر القسم 6.) ، في هذه المرحلة ، قم باحتضان الأجزاء الأبهرية مسبقا بمثبط عام لإنتاج NO (L-NAME) عن طريق إضافة 10 ميكرولتر من محلول مخزون العمل 100 mM المحضر من L-NAME إلى كل غرفة تصوير عضلي (تحتوي على محلول عازل 5 مل) من أجل تحقيق تركيز نهائي قدره 200 ميكرومتر في كل غرفة تصوير عضلي.
ملاحظة: L-NAME هو مثبط غير انتقائي وقوي لجميع أشكال NOS (إنزيم مسؤول عن إنتاج NO) ، وبالتالي ، فهو يعتبر أداة فعالة لمنع إنتاج NO في جدار الأوعية الدموية9. - اسمح لأجزاء الأبهر بالراحة خلال فترة ما قبل الحضانة باستخدام L-NAME (30 دقيقة).
- لا تغسل في هذه المرحلة.
- دون إزالة L-NAME ، أضف الجرعة دون القصوى من فينيليفرين (تركيز نهائي 10 ميكرومتر) إلى الغرفة للحث على تقلص الأبهر.
ملاحظة: بسبب العمل المثبط ل L-NAME على إنتاج NO الداخلي ، فإن الذروة المسجلة حديثا لتقلص الأبهر الناجم عن فينيليفرين ستكون أعلى بكثير من الذروة الأولية التي تم تسجيلها قبل احتضان الأنسجة باستخدام L-NAME. هذا متوقع بسبب تأثير L-NAME على إنتاج NO القاعدي في جدار الأبهر ، مما يؤدي إلى توليد قوة أعلى (بسبب توليد قوة انقباض أعلى بواسطة العضلات الملساء). - انتظر حتى يصل منحنى الانكماش الناجم عن فينيليفرين إلى هضبة لتطور التوتر (قوة الانقباض).
- عند هذه النقطة, إضافة أستيل إلى غرفة myograph لتحقيق تركيز نهائي من 500 نانومتر (وهذا هو تركيز دون الحد الأقصى من أستيل التي تم إنشاؤها خلال التجارب الموضحة في القسم 5. من البروتوكول).
- انتظر بضع دقائق لتسجيل أي تغييرات محتملة في تطوير القوة حتى تستقر الهضبة المشكلة (الشكل 7).
ملاحظة: نظرا للعمل المثبط ل L-NAME على قدرة الطبقة البطانية على إنتاج NO استجابة للأسيتيل كولين ، فمن غير المتوقع أن نرى أي تغييرات في توليد القوة المسجلة استجابة للفينيليفرين ، حيث أن NOS البطانية الأبهرية (eNOS) غير قادرة على توليد NO استجابة لتطبيق الأسيتيل كولين. - استنزاف الغرف وغسل الأنسجة بمحلول HEPES-PSS الدافئ والتهوية 3x.
8. مساهمة الطبقة البطانية في استرخاء الأوعية الأبهرية
- من أجل التأكيد على دور الطبقة البطانية في استرخاء الأوعية الأبهرية ، اختبر استرخاء الأوعية الناجم عن الأسيتيل كولين في أجزاء الأبهر البطانية ، حيث تتم إزالة الطبقات البطانية.
- ضع غرفة التصوير العضلي تحت المجهر ومرر برفق سلكا صغيرا (يمكن استخدام نفس السلك المستخدم في التصوير العضلي السلكي هنا) عبر تجويف الشريان الأورطي. حرك السلك برفق عبر التجويف (حركة دائرية لطيفة) لفترة قصيرة من الزمن. هذا يكفي لإزالة البطانة أو البطانة الداخلية.
- قطع الشريان الأورطي إلى حلقات الأبهر 2 مم وتركيب تلك الحلقات على غرفة myograph كما هو موضح من قبل.
- اضبط الشد الأمثل عند 6 مللي نيوتن واترك الأنسجة ترتاح لمدة 30 دقيقة في مخزن HEPES-PSS الدافئ والتهوية
- في نهاية فترة التوازن البالغة 30 دقيقة ، قم بتصريف الغرف وإضافة 5 مل من محلول HEPES-PSS الطازج والدافئ والتهوية إلى كل غرفة.
- صفر القوة لجميع غرف التصوير العضلي عن طريق تدوير الميكرومتر في اتجاه عكس اتجاه عقارب الساعة.
- قم بتدوير الميكرومتر ببطء عكس اتجاه عقارب الساعة لزيادة المسافة بين المسامير حتى تصل القوة المسجلة إلى الشد الأمثل المطلوب لشريان الأورط الفأر (6 مللي نيوتن لشريان الأورطي C57BL / 6J). أرح الأنسجة لمدة 15-20 دقيقة أخرى عند التوتر الأمثل (6 مللي نيوتن).
- استنزاف الغرف 1x أكثر قبل إضافة 5 مل من محلول K + العالي إلى كل غرفة.
- قم بتصريف الغرف مرة أخرى بمجرد وصول استجابة الانكماش لمحلول K + العالي إلى هضبة واغسل الأنسجة بمحلول HEPES-PSS 3x. أرح المنديل لمدة 15-20 دقيقة
- قبل التعاقد على شرائح الأبهر مع عامل مضيق للأوعية فينيليفرين (تركيز نهائي 10 ميكرومتر في الغرفة).
ملاحظة: بسبب إزالة البطانة ، يتضاءل إنتاج NO القاعدي في جدار الأبهر بشكل كبير. لذلك ، من المتوقع أن تكون ذروة الانكماش الناجم عن فينيليفرين (ذروة توليد القوة) أعلى في أنسجة الأبهر التي تفتقر إلى الطبقة البطانية. - عندما تصل القوة التي يسببها فينيليفرين إلى هضبة ، أضف التركيز دون الحد الأقصى للأسيتيل كولين إلى غرفة التصوير العضلي لتحقيق تركيز نهائي قدره 500 نانومتر.
ملاحظة: إذا تمت إزالة الطبقة البطانية بشكل صحيح ، فلن تكون هناك أي تغييرات في القوة المسجلة التي يسببها فينيليفرين ، حيث أن إنتاج الأسيتيل كولين الناجم عن البطانة سيتضاءل بسبب إزالة الطبقة البطانية. سيكون التتبع المسجل مشابها جدا للأثر الذي لوحظ في وجود L-NAME (القسم 7.). - انتظر لمدة 3 دقائق للتأكد من أن الهضبة المسجلة لتطوير القوة التي يسببها فينيليفرين لا تتغير قبل إنهاء التجربة (الشكل 8).
ملاحظة: إذا تسبب تطبيق الأسيتيل كولين في أي انخفاض في الانكماش الناجم عن فينيليفرين أثناء وجوده في الهضبة ، فهذا مؤشر على أن الطبقة البطانية لم تتم إزالتها بالكامل.
النتائج
بروتوكول تصوير عضلي الغرفة الصغيرة الموضح هنا هو الطريقة القياسية لقياس تفاعل الأوعية الدموية في الشرايين الصغيرة والكبيرة ويسمح بإجراء قياسات متزامنة لتفاعل الأوعية الدموية في ما يصل إلى أربعة أجزاء من الأوعية الدموية من نفس المختبر الصغير التجريبي. في هذا التقرير ، نستخدم النظام على وجه التحديد لقياس الوظيفة البطانية في الشريان الأورطي للفأر المعزول (الشكل 1). في هذا البروتوكول ، يتم تثبيت أجزاء الأبهر المعزولة على غرفة عضو صغيرة (الشكل 2) بين دبابيس صغيرة من الفولاذ المقاوم للصدأ (الشكل 3). يمكن لغرفة التصوير العضلي استيعاب ما يصل إلى 8 مل من المحلول العازل وتوفير بيئة شبه فسيولوجية للأوعية المعزولة طوال مدة التجارب. من المهم جدا ، قبل كل تجربة ، اختبار صلاحية كل جزء معزول والتحقق منها. البروتوكول القياسي لإثبات سلامة وصلاحية كل جزء من الأوعية الدموية المعزولة هو تحدي الأنسجة بتركيز عال من كلوريد البوتاسيوم للحث على إزالة استقطاب غشاء العضلات الملساء. في السيناريو الذي يكون فيه الوعاء المعزول سليما وسريع الاستجابة ، سنكون قادرين على تسجيل توليد قوة انقباض على الشاشة (الشكل 4). يتم استخدام ذروة القوة المسجلة لاحقا لتطبيع توليد القوة لنفس الجزء استجابة للناهضات المستخدمة أثناء البروتوكول (على سبيل المثال ، فينيليفرين). من أجل قياس الانحلال الوعائي بوساطة البطانة ، من الضروري التعاقد المسبق مع النسيج الأبهري بتركيز دون الحد الأقصى (10 ميكرومتر) من فينيليفرين ، مما يسبب تقلصا سلسا بوساطة العضلات وتوليد القوة (الشكل 5). عندما يصل الانكماش الناجم عن فينيليفرين إلى هضبة (الشكل 6) ، يتم تطبيق جرعات متزايدة من الأسيتيل كولين في خطوات متعددة لتحقيق أقصى قدر من الانحلال الوعائي في الجزء المعزول (الشكل 6). مستوى استرخاء الوعاء هو قياس غير مباشر لإنتاج أكسيد النيتريك بوساطة البطانة. لمزيد من التأكيد على أن الانحلال الوعائي الناجم عن الأسيتيل كولين في حلقات الأبهر يرجع إلى إنتاج أكسيد النيتريك ، تتم معالجة شرائح الأبهر مسبقا بمثبط عام لإنتاج أكسيد النيتريك (200 ميكرومتر من L-NAME) لمدة 30 دقيقة قبل تطبيق فينيليفرين. كما هو موضح في الشكل 7 ، فإن L-NAME قادر على منع الانحلال الوعائي الناجم عن الأسيتيل كولين تماما في الشريان الأورطي المتعاقد عليه مسبقا ، مما يسلط الضوء على حقيقة أن الأسيتيل كولين يحفز استرخاء الأوعية الأبهري من خلال زيادة إنتاج أكسيد النيتريك. من ناحية أخرى ، فإن إزالة الطبقة البطانية من الأجزاء الأبهرية تمنع أيضا الانحلال الوعائي الناجم عن الأسيتيل كولين ، مما يؤكد الدور الذي تلعبه البطانة في استرخاء الأوعية الدموية (الشكل 8).
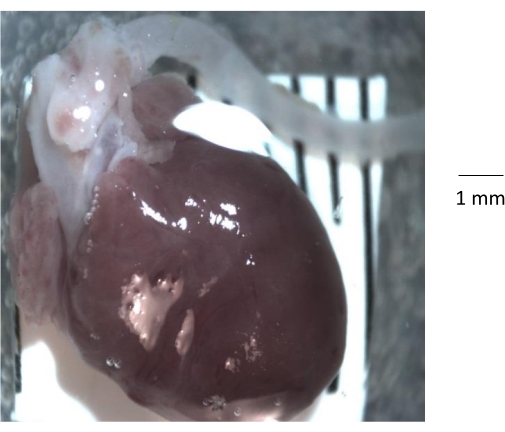
الشكل 1: منظر تشريحي إجمالي للقلب وجذر الأبهر والشريان الأورطي النازل معزولة من فأر تحكم عمره 6 أشهر. بعد إزالة القفص الصدري من الفأر ، يتم عزل القلب والشريان الأورطي من القفص الصدري ونقلهما إلى طبق بتري نظيف مطلي بالمطاط الصناعي السيليكوني. قبل عزل الشريان الأورطي ، من المهم إزالة جميع الدهون والنسيج الضام وأي جلطة دموية من تجويف الشريان الأورطي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 2: صورة تمثيلية لغرفة وحدة التصوير العضلي تظهر دبابيس التثبيت 200 ميكرومتر. كما هو موضح ، فإن الدبابيس الموجودة داخل غرفة التصوير العضلي بالكاد تتلامس. قبل استخدام الغرفة ، من الأهمية بمكان التأكد من محاذاة المسامير بشكل صحيح. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: تثبيت الأجزاء الأبهرية على حجرة التصوير العضلي. يتم تثبيت جزء الأبهر الفأر 2 مم المعزول من ماوس C57BL / 6 يبلغ من العمر 6 أشهر بواسطة دبابيس داخل غرفة التصوير العضلي. يتم تحقيق ذلك عن طريق تحريك الشريان الأورطي برفق على دبابيس التثبيت باستخدام الملقط. يظهر المربع المنقط الأحمر الصورة المكبرة لجزء الأبهر 2 مم المثبت بين دبابيس داخل حجرة التصوير العضلي. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
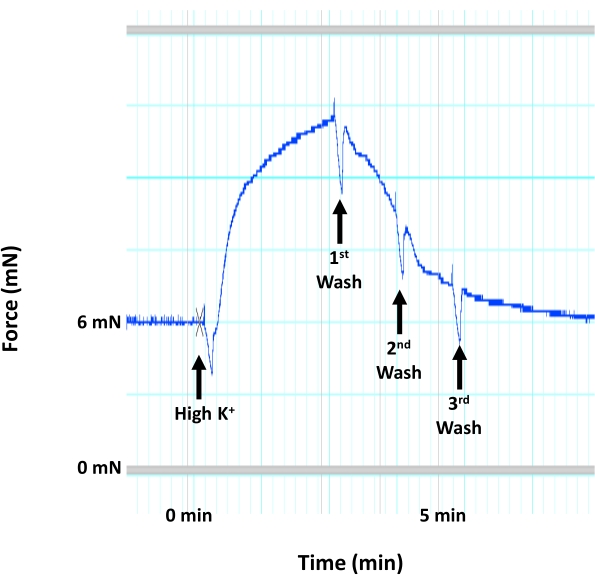
الشكل 4: انقباض الأبهر الناتج عن إزالة استقطاب الغشاء العضلي الملساء. صورة تمثيلية تظهر أثر انقباض الأبهر الفأر (توليد القوة) استجابة لتركيز عال من K+ (60 mM KCl) الذي من شأنه أن يحفز إزالة استقطاب الغشاء العضلي الملساء والانكماش داخل الطبقة الإنسية للشريان الأورطي. يتبع تطبيق محلول K + العالي على الفور ثلاث غسلات متتالية باستخدام محلول HEPES-PSS الدافئ والهوى. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
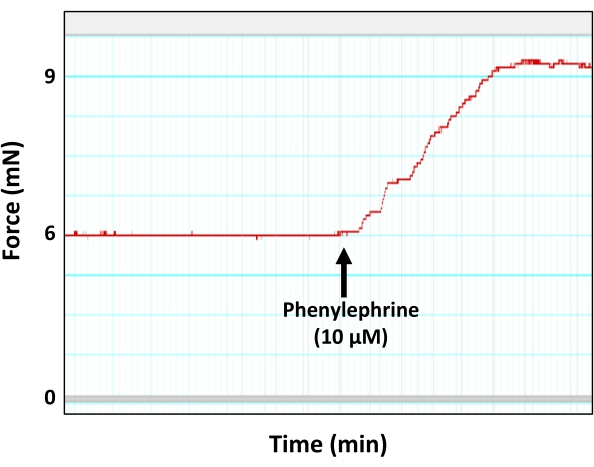
الشكل 5: انقباض الأبهر استجابة لعامل تضيق الأوعية فينيليفرين. يظهر تتبع التصوير العضلي التمثيلي توليد القوة (الانكماش) بواسطة حلقة الأبهر استجابة لتركيز دون الحد الأقصى للفينيليفرين (10 ميكرومتر). كما هو موضح ، تصل ذروة الانقباض الناجم عن فينيليفرين في النهاية إلى هضبة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
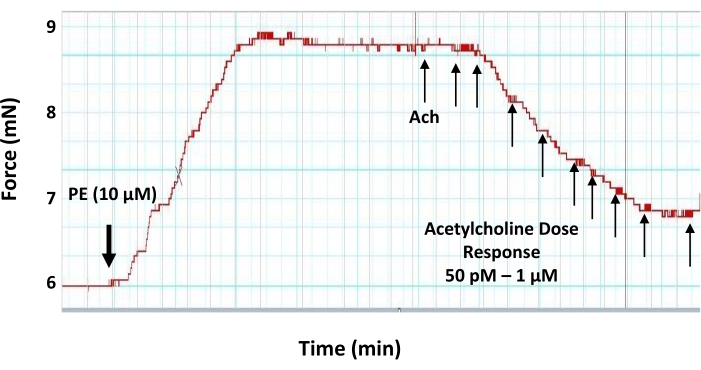
الشكل 6: تأثيرات جرعة استجابة الأسيتيل كولين على الحلقة الأبهرية المتعاقد عليها مسبقا. تتبع مخطط عضلي تمثيلي يوضح تأثير الاستجابة للجرعة (50 pM-1 μM) لتوسيع الأوعية الدموية للناقل العصبي موسع للأوعية أستيل كولين على حلقة الأبهر المتعاقد عليها مسبقا 2 مم. يتم التعاقد مع حلقة الأبهر مسبقا مع 10 ميكرومتر من فينيليفرين قبل تطبيق أستيل كولين. تضاف الجرعة الأولى من الأسيتيل كولين عندما يصل التوتر الناجم عن فينيليفرين إلى هضبة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
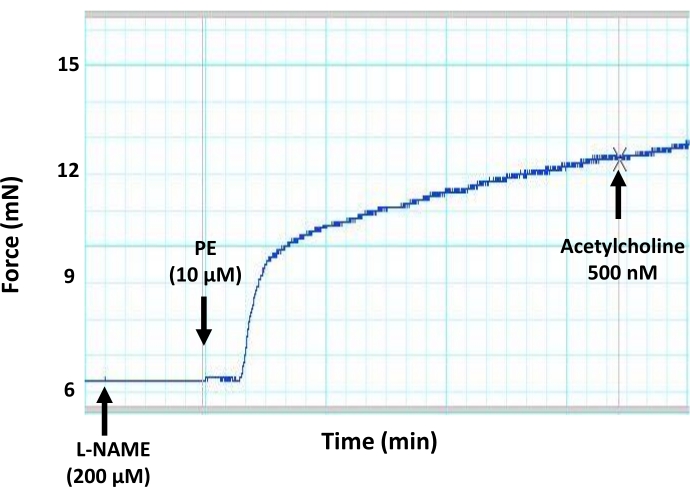
الشكل 7: آثار مثبط عام لإنتاج NO (L-NAME) على استرخاء الأوعية بوساطة البطانة في الشريان الأورطي للفأر. يظهر تتبع مخطط عضلي تمثيلي أن الحضانة المسبقة لأجزاء الأبهر مع مثبط عام لإنتاج NO (L-NAME ، تركيز نهائي 200 ميكرومتر) تمنع توسع الأوعية الناجم عن الأسيتيل كولين في حلقة الأبهر المتعاقد عليها مسبقا. ويرجع ذلك إلى تثبيط إنتاج NO بواسطة البطانة بسبب العمل المثبط ل L-NAME على eNOS. تمت إضافة الأسيتيل كولين إلى الجزء الأبهري المتعاقد عليه مسبقا عند التركيز دون الأقصى البالغ 500 نانومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
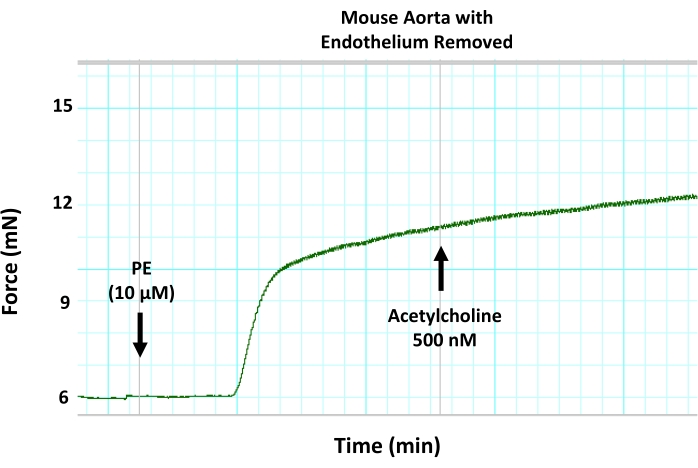
الشكل 8: آثار إزالة البطانة الميكانيكية على استرخاء الأوعية بوساطة البطانة في الشريان الأورطي للفأر. يظهر تتبع مخطط عضلي تمثيلي أن إزالة البطانة من أجزاء الأبهر باستخدام التعرية السلكية تمنع توسع الأوعية الناجم عن الأسيتيل كولين في حلقة الأبهر المتعاقد عليها مسبقا. ويرجع ذلك إلى تثبيط استرخاء الأوعية بوساطة البطانة. تمت إضافة الأسيتيل كولين إلى الجزء الأبهري المتعاقد عليه مسبقا عند التركيز دون الأقصى البالغ 500 نانومتر. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
يعتمد مجال بيولوجيا الأوعية الدموية بشكل كبير على الأدوات التي تساعد الباحثين على تقييم السلامة الوظيفية والهيكلية لجدار الأوعية الدموية. كما يتطلب اهتماما خاصا بالتفاعلات المباشرة وغير المباشرة بين الطبقات الثلاث للأوعية الدموية: البطانة ، والوسائط ، و adventitia. من بين هذه الطبقات الثلاث ، تتكون الطبقة الداخلية من طبقة أحادية من الخلايا البطانية ولها وظيفة مهمة جدا في تنظيم صحة الأوعية الدموية والإرقاء.
من الثابت أن أي ضرر يلحق بالطبقة البطانية يمكن أن يؤثر سلبا على قدرتها على إطلاق NO وعوامل توسع الأوعية الأخرى ، مما يؤدي إلى خلل في وظيفة الأوعية الدموية ، والذي لوحظ في اضطرابات الأوعية الدموية المختلفة مثل تصلب الشرايين وتمدد الأوعية الدموية والتهاب الأوعية الدموية10،11،12. من أجل فهم الآليات الأساسية التي تتحكم في وظيفة البطانة الطبيعية وتقييم وظيفة توسع الأوعية وسلامة البطانة داخل جدار الأوعية الدموية ، من الضروري استخدام نظام تجريبي قياسي يحاكي الظروف الفسيولوجية في الجسم الحي.
بالنسبة للشرايين الكبيرة، مثل الشريان الأورطي، يتم التعرف على تخطيط عضل الغرفة الصغيرة (متساوي القياس) إلى حد كبير كأداة موثوقة تخلق أفضل الظروف المتاحة شبه الفسيولوجية للأوعية الدموية في بيئة خارج الجسم الحي . يسمح النظام أيضا بالحفاظ على صلاحية الأنسجة لفترة طويلة جدا من الزمن (تصل إلى 6-8 ساعات) في بيئة المختبر ، مما يجعل التقنية أداة قيمة ومتعددة الاستخدامات. ميزة أخرى هي أن غرفة التصوير العضلي تسمح بالاحتفاظ بحلقات الأوعية الدموية وإعادة استخدامها لإجراء تجارب مختلفة متتالية ، مما يجعلها نهجا فعالا من حيث التكلفة مع تقليل الحاجة إلى أعداد كبيرة من الفئران التجريبية. يمكن اختبار ما يصل إلى أربعة أجزاء من الأوعية الدموية في وقت واحد باستخدام نظام تصوير عضلي من أربع غرف ، مما يزيد من الاتساق مع تقليل الاختلافات عبر التجارب.
يمكن استخدام أدوات دوائية وميكانيكية مختلفة لدراسة وظيفة الطبقة البطانية في الأوعية الدموية. العلامة الرئيسية للبطانة الوظيفية هي الإنتاج الطبيعي ل NO ، والذي يعرف باسم أهم عامل موسع للأوعية يتم إنتاجه وإطلاقه بواسطة الطبقة البطانية. يرتبط الخلل البطاني بشكل أساسي بانخفاض كبير في إنتاج NO وقد ثبت أنه متورط في تطور اضطرابات الأوعية الدموية المختلفة مثل ارتفاع ضغط الدم والتخثر وتصلب الشرايين.
داخل السرير الوعائي ، لا يتم التحكم في الإنتاج بشكل أساسي عن طريق التغيرات في تدفق الدم والضغط ، أو عن طريق الأحداث الأخرى داخل الخلايا التي قد تؤدي إلى تغيرات في تركيز الكالسيوم السيتوبلازمي أو تنشيط مسارات الإشارات استجابة للهرمونات وعوامل النمو13,14. تعتبر التغييرات في إنتاج NO واحدة من العلامات المبكرة والموثوقة للخلل البطاني ، وعادة ما يمكن اكتشافها مبكرا أثناء تطور اضطرابات القلب والأوعية الدموية. بغض النظر عن نموذج المرض ، يهتم علماء الأحياء الوعائية بشدة بالأدوات والمقايسات التي تسمح بقياس وظيفة البطانة. من المهم بشكل خاص أن يتمكن المرء من التمييز بين مساهمة طبقات مختلفة من الأوعية الدموية باستخدام منصة تحاكي الظروف الفسيولوجية.
في غرفة صغيرة ، يمكن للباحثين استخدام الأدوات الدوائية والميكانيكية لقياس وظيفة البطانة في بيئة خاضعة لرقابة مشددة. داخل غرفة التصوير العضلي ، يتم إنشاء بيئة اصطناعية يمكنها دعم الوظيفة الطبيعية للأوعية الدموية. في مثل هذه البيئة الاصطناعية ، نظرا لأن شرائح الأوعية الدموية المعزولة غير مدعومة بالنسيج الضام المحيط والأعضاء الأخرى ، فمن المهم تحديد التوتر السلبي الأمثل الذي يمكن أن تولد فيه الأجزاء المعزولة أقصى انكماش ممكن استجابة ل vasopressors. عند التوتر الأمثل ، يمكن للمرء قياس الاستجابة القصوى الطبيعية للانقباض لعوامل تضيق الأوعية مثل فينيليفرين أو بافراز لاختبار السلامة الهيكلية والوظيفية لطبقة العضلات الملساء لجدار الأوعية الدموية. في المختبر ، تم تحديد أن التوتر السلبي البالغ 6 مللي نيوتن هو توتر مناسب لشرائح الأبهر 2 مم15. ومع ذلك ، يجب تحديد التوتر السلبي الأمثل لأنواع مختلفة من الشرايين في الأنواع المختلفة16.
بالإضافة إلى ذلك ، قبل إجراء أي تجارب على الأوعية الدموية المعزولة ، من الضروري اختبار صلاحية الحلقات المعزولة للتأكد من أنها تفي بمعايير التضمين والاستبعاد للأنسجة القابلة للحياة والقابلة للاستخدام. يتم تحقيق ذلك عادة عن طريق إخضاع الحلقات المعزولة لمحلول K + عالي التركيز (60 mM KCl). ينتج عن هذا إزالة استقطاب غشاء العضلات الملساء بسبب فتح قنوات الكالسيوم ذات الجهد الكهربائي (VGCC) ، مما يؤدي إلى تقلص العضلات الملساء وتضيق الأوعية الأبهرية. تستخدم هذه الطريقة للتحقق من صلاحية أجزاء الأبهر قبل استخدام تلك الأجزاء لمزيد من التجارب.
من ناحية أخرى ، يمكن استخدام عوامل توسع الأوعية مثل الأسيتيل كولين لاختبار الخصائص الوظيفية للطبقة البطانية. إذا كانت طبقة البطانة سليمة ووظيفية ، فإن التركيز دون الحد الأقصى للأسيتيل كولين يمكن أن يحفز الاسترخاء في جزء الأوعية الدموية المتعاقد عليه مسبقا17. حجم الاسترخاء الناجم عن الأسيتيل كولين هو مؤشر على مستوى عدم الإطلاق من الطبقة البطانية. أي ضرر يلحق بالطبقة البطانية (ميكانيكية أو وظيفية) سيكون له تأثير على عدم الإنتاج واستجابة توسع الأوعية الدموية. في هذا البروتوكول ، تظهر البيانات المقدمة أن الأسيتيل كولين يمكن أن يحفز الاسترخاء في الشريان الأورطي للفأر المتعاقد عليه مسبقا بطريقة تعتمد على الجرعة ، مع تحقيق أقصى استرخاء دون الحد الأقصى عند التركيز النهائي البالغ 500 نانومتر (الشكل 6).
في بعض التجارب ، يهتم الباحثون بقياس استجابة العضلات الملساء المباشرة لموسع الأوعية NO. نظرا لأن تركيز مثل هذه التجارب ينصب على وظيفة العضلات الملساء فقط ، فهناك بروتوكول معمول به يسمح للباحثين بتجاوز مساهمة البطانة عن طريق إزالة (تعري) طبقة البطانة من جزء الأوعية الدموية. يمكن إزالة البطانة من خلال طرق مختلفة ، بما في ذلك الهواء أو التدحرج بين الأصابع أو الإزالة عن طريق الأسلاك. في مثل هذه الظروف التجريبية ، لا يخضع الوعاء الدموي المكشوف (بدون طبقة بطانية) لأي متبرعين مثل النتروجليسرين ونتروبروسيد الصوديوم. يسمح هذا بتحديد ما إذا كان مسار إشارات GMP بروتين كيناز G الدوري للعضلات الملساء الذي يستجيب ل NO سليما وعمليا 7,18. أوضحت هذه المخطوطة كيف أن إزالة الطبقة البطانية في الجزء الأبهري المعزول تمنع تماما تأثيرات توسع الأوعية الأسيتيل كولين ، مما يسلط الضوء على أهمية عدم الإطلاق في استرخاء الأوعية الدموية وتوسع الأوعية (الشكل 8).
في حين أن تقنيات التصوير العضلي للأسلاك والتينسومتري لها فائدة واسعة في تجارب بيولوجيا الأوعية الدموية ، تجدر الإشارة إلى القيود المحتملة. على وجه التحديد ، يحتوي نظام tensometric على قيود على حجم الأنسجة (أي الأوعية الدموية الأصغر). بالإضافة إلى ذلك ، لا تسمح الطبيعة خارج الجسم الحي لهذه التقنية بالتلاعب بالضغط والتدفق داخل اللمعة من أجل تقليد أكثر دقة لوظيفة الأوعية الدموية في الجسم الحي ومعلمات الدورة الدموية. في الواقع ، ستأخذ إعدادات مخطط عضل الضغط في الاعتبار هذه المتغيرات وتحاكي ديناميكيات الأوعية الدموية في الوقت الفعلي مع السماح أيضا باستخدام شرايين مقاومة أصغر. بالإضافة إلى ذلك ، لا يمكن لتجارب التصوير العضلي السلكي تكرار الظروف الفسيولوجية بشكل كامل أو نمذجة التفاعلات بدقة بين الدم المتداول وجدران الأوعية والأنسجة المحيطة ، والتي تلعب أيضا أدوارا مهمة في تنظيم وظيفة الأوعية الدموية في الجسم.
بغض النظر عن البروتوكول التجريبي المستخدم في تجارب التصوير العضلي أو مضيق الأوعية / موسع الأوعية المختار في التجربة ، يوفر نظام تصوير عضل الغرفة الصغيرة منصة شبه فسيولوجية موثوقة وقابلة للتكرار ومستقرة لقياس تفاعل الأوعية الدموية والسلامة الوظيفية. على الرغم من أن تركيز هذا التقرير كان فقط على القياس الأساسي لوظيفة البطانة ، إلا أنه يمكن استخدام نظام التصوير العضلي لتقييم العديد من الخصائص الوظيفية الأخرى للأوعية الدموية ، مثل علاقة الإجهاد / الإجهاد ، وقوة جدار الأوعية الدموية ، ونقطة التمزق ، والانكماش السلبي والنشط على سبيل المثال لا الحصر. هذا يسلط الضوء على قيمة نظام myograph كأداة موثوقة في مجال بيولوجيا الأوعية الدموية.
Disclosures
ويعلن أصحاب البلاغ أنه ليس لديهم مصالح مالية متنافسة.
Acknowledgements
تم دعم هذا العمل بتمويل من المعاهد الوطنية للصحة (R15HL145646) وكلية الدراسات العليا بجامعة الغرب الأوسط.
Materials
| Name | Company | Catalog Number | Comments |
| Acetylcholine | SigmaAldrich | A6625-100G | |
| CaCl2 | SigmaAldrich | C4901-1KG | |
| Carbogen gas | Matheson | H103847 | |
| Dissecting scissors | FST | 91460-11 | |
| DMT 620 Multi chamber myograph system | DMT | DMT 620 | Multi chamber myograph system |
| Dumont forceps | FST | 91150-20 | |
| EDTA | SigmaAldrich | E5134-10G | |
| Glucose | SigmaAldrich | G8270-1KG | |
| HEPES | SigmaAldrich | H7006-1KG | |
| KCl | SigmaAldrich | P9541-1KG | |
| KH2PO4 | SigmaAldrich | P5655-1KG | |
| LabChart | ADI instruments | Data acquisition software | |
| Light source | Volpi | 14363 | |
| L-Name | Fischer Scientific | 50-200-7725 | |
| MgSO4 | SigmaAldrich | M2643-500G | |
| Microscope | Leica | S6D | stereo zoom microscope |
| NaCl | SigmaAldrich | S5886-5KG | |
| NaHCO3 | SigmaAldrich | S5761-500G | |
| Organ bath system | DMT | 720MO | |
| Phenylephrine | SigmaAldrich | P6126-10G | |
| Pump | Welch | 2546B-01 | |
| Software | ADI instruments | LabChart 8.1.20 | |
| Spring Scissors | FST | 15003-08 | |
| Sylgard 184 Kit | Electron Microscopy Services | 24236-10 | silicone elastomer kit |
| Tank Regulator | Fischer Scientific | 10575147 | |
| Water bath system | Fischer Scientific | 15-462-10 |
References
- Wenceslau, C. F., et al. Guidelines for the measurement of vascular function and structure in isolated arteries and veins. American Journal of Physiology-Heart and Circulatory Physiology. 321 (1), 77-111 (2021).
- Deanfield, J. E., Halcox, J. P., Rabelink, T. J. Endothelial function and dysfunction: Testing and clinical relevance. Circulation. 115 (10), 1285-1295 (2007).
- Lerman, A., Zeiher, A. M. Endothelial function: Cardiac events. Circulation. 111 (3), 363-368 (2005).
- Rajendran, P., et al. The vascular endothelium and human diseases. International Journal of Biological Sciences. 9 (10), 1057-1069 (2013).
- Galley, H. F., Webster, N. R. Physiology of the endothelium. British Journal of Anaesthesia. 93 (1), 105-113 (2004).
- Orita, H., et al. In vitro evaluation of phosphate, bicarbonate, and Hepes buffered storage solutions on hypothermic injury to immature myocytes. Cardiovascular Drugs and Therapy. 8 (6), 851-859 (1994).
- Liu, Y. H., Bian, J. S. Bicarbonate-dependent effect of hydrogen sulfide on vascular contractility in rat aortic rings. American Journal of Physiology. Cell Physiology. 299 (4), 866-872 (2010).
- Griffiths, K., Madhani, M. The use of wire myography to investigate vascular tone and function. Methods in Molecular Biology: Atherosclerosis. 2419, 361-367 (2022).
- Pfeiffer, S., Leopold, E., Schmidt, K., Brunner, F., Mayer, B. Inhibition of nitric oxide synthesis by NG-nitro-L-arginine methyl ester (L-NAME): Requirement for bioactivation to the free acid, NG-nitro-L-arginine. British Journal of Pharmacology. 118 (6), 1433-1440 (1996).
- Bacon, P. A. Endothelial cell dysfunction in systemic vasculitis: New developments and therapeutic prospects. Current Opinion in Rheumatology. 17 (1), 49-55 (2005).
- Gallo, G., Volpe, M., Savoia, C. Endothelial dysfunction in hypertension: Current concepts and clinical implications. Frontiers in Medicine. 8, 798958(2021).
- Mikolajczyk, K., et al. The important role of endothelium and extracellular vesicles in the cellular mechanism of aortic aneurysm formation. International Journal of Molecular Sciences. 22 (23), 13157(2021).
- Vallance, P., Hingorani, A. Endothelial nitric oxide in humans in health and disease. International Journal of Experimental Pathology. 80 (6), 291-303 (1999).
- Tousoulis, D., Kampoli, A. M., Tentolouris, C., Papageorgiou, N., Stefanadis, C. The role of nitric oxide on endothelial function. Current Vascular Pharmacology. 10 (1), 4-18 (2012).
- Gibson, C., et al. Mild aerobic exercise blocks elastin fiber fragmentation and aortic dilatation in a mouse model of Marfan syndrome associated aortic aneurysm. Journal of Applied Physiology. 123 (1), 147-160 (2017).
- Xiao, X., Ping, N. N., Li, S., Cao, L., Cao, Y. X. An optimal initial tension for rat basilar artery in wire myography. Microvascular Research. 97, 156-158 (2015).
- Chung, A. W., Yang, H. H., Yeung, K. A., van Breemen, C. Mechanical and pharmacological approaches to investigate the pathogenesis of Marfan syndrome in the abdominal aorta. Journal of Vascular Research. 45 (4), 314-322 (2008).
- Zhong, C., et al. Age impairs soluble guanylyl cyclase function in mouse mesenteric arteries. International Journal of Molecular Sciences. 22 (21), 11412(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved