Method Article
Mutant Metiyonin tRNA Sentetaz Fare Hattı Kullanılarak Hücre Tipi Özgül Protein Saflaştırma ve Kompleks Dokulardan Tanımlama
Bu Makalede
Özet
Bu protokol, mutant L274G-Metiyonin tRNA sentetazı (MetRS*) ifade eden bir fare çizgisi kullanılarak azidonorlösin (ANL) ile hücre tipine özgü protein etiketlemesinin nasıl gerçekleştirileceğini ve etiketli hücre tipine özgü proteinlerin izolasyonu için gerekli adımları açıklar. Canlı farelerde (1) içme suyu ve (2) intraperitoneal enjeksiyonlarla iki olası ANL uygulama yolunu özetliyoruz.
Özet
Protein homeostazını in vivo olarak anlamak, hücrelerin hem fizyolojik hem de hastalık koşullarında nasıl çalıştığını bilmenin anahtarıdır. Mevcut protokol, protein etiketlemesini belirli hücresel popülasyonlara yönlendirmek için tasarlanmış bir fare hattı kullanarak yeni sentezlenmiş proteinlerin in vivo etiketlemesini ve ardından saflaştırılmasını açıklamaktadır. L274G-Metiyonin tRNA sentetazın (MetRS*) Cre rekombinaz ekspresyonu ile indüklenebilir bir çizgidir ve azidonorlösin (ANL) proteinlere dahil olmasını sağlar, aksi takdirde gerçekleşmeyecektir. Burada açıklanan yöntemi kullanarak, in vivo etiketli hücre tipine özgü proteomları saflaştırmak ve numune karmaşıklığının azaltılması nedeniyle protein içeriğindeki ince değişiklikleri tespit etmek mümkündür.
Giriş
Anormal protein homeostazı, protein sentezi ve bozunmasındaki dengesizlikten kaynaklanır. Çeşitli hastalıklar protein homeostazındaki değişikliklerle ilişkilidir. Bazı hastalıkların ayırt edici özelliği, farklı hücre altı yerlerde ve beyin bölgelerinde agregaların varlığıdır. Protein homeostazı sadece hastalıkta önemli değil, aynı zamanda normal organ ve hücresel fonksiyonda da önemli bir rol oynar1. Örneğin, protein sentezi, protein sentezini bloke eden kimyasal inhibitörlerin kullanımı ile belirlenen birçok nöronal plastisite 2,3 formu içingereklidir 4. Bununla birlikte, proteomun hangi hücre tiplerinde öğrenmeyi ve hafızayı desteklemek için değiştirildiği açık değildir, ne de her hücre tipindeki hangi spesifik proteinlerin sentezlerinde veya bozulmalarında arttığı veya azaldığı anlaşılmamıştır. Bu nedenle, protein homeostazının kapsamlı bir çalışması, spesifik hücre tiplerinden gelen proteomları ayırt etme yeteneğini gerektirir. Gerçekten de, çok hücreli bir ortamda meydana gelen hücresel süreçleri incelemek için hücre tipine özgü proteomların tanımlanması, proteomikte önemli bir engel olmuştur. Bu nedenle, hücre tipine özgü proteomları tanımlamak ve saflaştırmak için etkili bir yol olduğu kanıtlanmış biyo-ortogonal yöntemlerle birleştirilmiş MetRS* ekspresyonunu kullanarak bir teknik geliştirdik ve bu boşluğu doldurduk 5,6,7.
Mutant bir MetRS* (MetRS L274G) ekspresyonu, kanonik olmayan metiyonin analog ANL'nin karşılık gelen tRNA 8,9'a yüklenmesine ve daha sonra proteinlere dahil edilmesine izin verir. MetRS* ekspresyonu hücre tipine özgü bir promotör tarafından düzenlendiğinde, kanonik olmayan amino asit, proteinlere hücre seçici bir şekilde dahil edilecektir. ANL proteinlere dahil edildikten sonra, tıklama kimyası ile seçici olarak işlevselleştirilebilir ve daha sonra görüntüleme (FUNCAT) veya Batı İmmünoblot (BONCAT) ile görselleştirilebilir. Alternatif olarak, proteinler seçici olarak saflaştırılabilir ve kütle spektrometresi (MS) ile tanımlanabilir. Bu teknolojiyi kullanarak, Cre rekombinazının kontrolü altında MetRS* proteinini ifade eden bir fare çizgisi oluşturduk. Mevcut Cre-mouse hatlarının sayısının artması göz önüne alındığında, MetRS * sistemi, mevcut bir Cre-line'ın bulunduğu herhangi bir dokudan herhangi bir hücre tipini incelemek için herhangi bir alanda kullanılabilir. ANL ile protein etiketleme in vitro veya in vivo olarak mümkündür ve fare davranışını veya protein bütünlüğünü değiştirmez6. Etiketleme zaman aralığı, yeni sentezlenen proteinleri (daha kısa etiketleme süreleri) veya tüm proteomları (daha uzun etiketleme süreleri) etiketleyerek her araştırmacının bilimsel sorusuna uyarlanabilir. Bu tekniğin kullanımı, araştırmacının çalışmaya istekli olduğu tipteki hücrelerin sayısı ile sınırlıdır; dolayısıyla düşük sayılara veya düşük metabolik hıza sahip hücre tiplerinden protein izolasyonu bu yöntemle mümkün değildir. Sunulan yöntemin amacı, in vivo olarak etiketlenmiş hücre tipine özgü proteinleri / proteomları tanımlamaktır. Bu protokolde, canlı farelerde ANL ile hücre tipine özgü proteomların nasıl etiketleneceğini ve etiketli proteinlerin nasıl saflaştırılacağını açıklıyoruz. Saflaştırmadan sonra, proteinler rutin kütle spektrometresi protokolleri 5,10 ile tanımlanabilir. Bu yöntemde, proteinlerin belirli hücresel popülasyonlardan seçici saflaştırılmasıyla elde edilen numune karmaşıklığının azaltılması, deneycinin, örneğin çevresel değişikliklere yanıt olarak, proteomlardaki ince değişiklikleri tespit etmesini sağlar. Etiketlenmiş proteinlerin saflaştırılması, MS analizi veya etiketleme süresi dahil olmak üzere ~ 10 gün içinde elde edilebilir. Burada, fareleri ifade eden MetRS * 'ye ANL uygulaması için iki yöntem tanımladık: (1) içme suyuna amino asit eklenmesi ve (2) intraperitoneal enjeksiyonlarla ANL'nin tanıtılması. ANL uygulaması için seçilen yöntemden bağımsız olarak, izolasyon ve saflaştırma adımları aynıdır (adım 2'den itibaren).
Protokol
Hayvanlarla yapılan tüm deneyler, Almanya'daki (RP Darmstadt; protokoller: V54-19c20/15-F122/14, V54-19c20/15-F126/1012) veya İspanya'daki (UCM'deki Hayvan Deneyleri Komitesi ve Comunidad de Madrid Çevre Danışmanlığı, protokol numarası: PROEX 005.0/21) yerel yönetim ofislerinin izniyle gerçekleştirilmiştir ve Max Planck Derneği kurallarına ve İspanyol düzenlemelerine uygundur ve hayvan refahı için AB yönergelerine uygundur.
1. ANL ile in vivo metabolik etiketleme
- İçme suyu:
- ANL ve maltozu farelerin düzenli içme suyunda çözün. Önerilen maltoz konsantrasyonu% 0.7'dir (wt / vol). İçme suyuna eklenen maksimum ANL miktarı %1'dir (ağırlık/hacim). Karışım hazır olduğunda, filtrasyon yoluyla sterilize edin ve 4 ° C'de saklayın.
- Adım 1.1'de hazırlanan karışımı farelere sağlayın. Kirlenmeyi önlemek için şişeleri sık sık değiştirin (örneğin, her 3 günde bir) ve olası kontaminasyon veya tıkanmayı aramak için her gün kontrol edin. Farelerin ANL alımını bilmek için günlük olarak içilen su miktarını tartarak izleyin.
NOT: Burada değerlendirilen maksimum etiketleme süresi, içme suyunda% 1'lik bir ANL konsantrasyonu kullanılarak 3 haftadır ve bu da beyinde iyi tespit edilebilir etiketleme ile sonuçlanır. İyi etiketleme 2 hafta içinde de elde edilebilir. Ne daha kısa etiketleme süreleri, ne daha uzun zaman noktaları, ne de diğer ANL miktarları, yukarıdakilerin işe yaramayacağı anlamına gelmeyen bu uygulama yöntemini kullanarak tarafımızca incelenmemiştir. ANL birleşme oranları, çalışılan doku veya hücre tipine bağlı olarak değişebilir. Etiketleme zamanı bilimsel soruya bağlı olarak değişebilir; Örneğin, proteomlar etiketlenecekse, etiketleme süresi, çalışılan dokudaki proteinlerin ortalama yarı ömürlerinin işlevinde hesaplanmalıdır. İlgi sadece yeni sentezlenen proteinleri tanımlamaksa, süreler kısaltılabilir. Etiketleme periyotları ve ANL dozajları, her deneysel durum ve ilgilenilen hücre tipi için ampirik olarak test edilmelidir.
- İntraperitoneal uygulama:
- ANL'yi fizyolojik NaCl çözeltisinde 400 mM, fosfat salin tamponu (PBS) veya suya çözün.
- Çözeltinin ozmolaritesinin fizyolojik aralıkta olduğundan emin olun. Burada, farelere 10 mL / kg vücut ağırlığı ANL çözeltisi uygulanır.
NOT: Beynin uyarıcı nöronlarında iyi etiketleme, 1 hafta boyunca 400 mM ANL ile günlük bir intraperitoneal enjeksiyon (IP) ile başarıyla elde edilir. Bu çalışmada ne daha düşük ANL konsantrasyonları ne de IP enjeksiyonları ile diğer etiketleme periyotları test edilmemiştir, bu da işe yaramayacakları anlamına gelmez. ANL, bazı şirketler tarafından hidroklorür olarak tedarik edilmektedir. Bu durumda, çözeltilerin pH'ı yeterli pH'a ayarlanmalıdır (uygulama yoluna bağlı olarak). ANL, Link ve ark.11 tarafından yayınlanan yöntemi takiben bazı modifikasyonlarla sentezlenebilir5. ANL etiketlemesi, diğer ANL konsantrasyonları, zaman aralıkları ve uygulama yolları kullanılarak gerçekleştirilebilir. Düşük metabolik hızlara sahip dokular / hücre tipleri için, her zaman ANL uygulamasından 1 hafta önce başlayan düşük içerikli bir metiyonin diyeti kullanılabilir. 400 mM ANL kullanıldığında, 4 ° C'de depolanırken çökelebilir; 37 °C'ye kadar ısıtma, ANL'yi çözeltiye geri getirir. Enjeksiyondan önce oda sıcaklığına ulaşmasına izin verin. Çoğu dünya bölgesinde, farelere ANL uygulaması bir hayvan deneyidir ve ilgili makamlar tarafından onaylanması gerekir.
2. Doku toplama, lizis ve protein ekstraksiyonu
- Doku diseksiyonu: İlgilenilen hücre tipini içeren doku alanını diseke edin ve toplanan doku parçasının ağırlığını not edin.
NOT: Numuneler -80 °C'de birkaç ay boyunca saklanabilir (durma noktası). Mevcut protokolde farelerin korteksi ve hipokampusu diseke edildi. - Doku lizisi: Lizis tamponunun dokusunun ıslak ağırlığının 12-15 katı kadar bir hacim ekleyerek dokuyu oda sıcaklığında homojenize edin (PBS pH 7.4, % 1 ağırlık/hacim SDS,% 1 (hacim / hacim) Triton X-100, Benzonaz (1: 1000 hacim / hacim), bir proteaz inhibitörü (PI) (EDTA serbest 1: 4000)). Örneğin, 20 mg'lık bir doku parçası için, 240-300 μL lizis tamponu ekleyin. Homojenize olana kadar dokuyu tritüre edin.
NOT: Numuneler -80 °C'de birkaç ay boyunca saklanabilir (durma noktası). 1,5 mL'lik tüplerde doğrudan homojenizasyon için, özellikle küçük doku parçaları işlendiğinde, elde taşınan, pille çalışan bir homojenizatörün kullanılması önerilir. Daha büyük parçalar için bir Dounce homojenizatörü kullanılabilir. Proteaz inhibitörlerinin (PI) dahil edildiği her tampona, kullanımdan hemen önce eklenmeli, daha önce eklenmemelidir. - Protein denatürasyonu: Homojenatı 15 dakika boyunca 75 °C'ye ısıtın ve 10 °C'de 15 dakika boyunca 17.000 x g'de santrifüj yapın. Süpernatantı yeni bir tüpe aktarın.
- Protein içeriği ölçümü: Her numunenin protein konsantrasyonunu ölçün ve tüm numuneleri aynı protein konsantrasyonuna karşılaştırılacak şekilde ayarlayın; lizis tamponu ekleyerek konsantrasyonu ayarlayın. Optimum konsantrasyon aralığı 2-4 μg / μL arasındadır.
NOT: Numuneler -80 °C'de birkaç ay boyunca saklanabilir (durma noktası). - Alkilasyon
- Homojenize numuneleri PBS (pH 7.8) + PI (EDTA free 1:4000) içinde 2-3 kat seyreltin.
- 20 mM'lik son konsantrasyona (stok çözeltisi 500 mM) iyodoasetamid (IAA) ekleyin.
- Numuneleri karanlıkta 20 °C'de 1-2 saat bekletin. 2.5.2-2.5.3 arasındaki adımları iki kez uygulayın.
NOT: Bazı dokular için, negatif kontroldeki spesifik olmayan tıklama yüksek kalırsa, alkilasyon12'den önce bir azaltma adımı gerçekleştirmek gerekebilir. IAA stoğunu numunelere eklemeden hemen önce taze olarak hazırlayın. Numuneler -80 °C'de birkaç ay boyunca saklanabilir (durma noktası).
- Arabellek değişimi: Tıklama kimyası değişim arabelleğini (PBS pH 7,8, %0,04 (ağırlık/hacim) SDS, %0,08 (hacim/hacim) Triton X-100 ve PI (1:4000)) kullanan denge arabellek değişim sütunları. Üreticinin talimatlarını izleyin. Tüm alkillenmiş numuneleri değiştirin.
NOT: Salınımlı numuneler -80 °C'de birkaç ay boyunca saklanabilir (durma noktası). Bu adımda, IAA elimine edilir ve arabellek tıklama kimyası arabelleği ile değiştirilir. Tampon değişim işlemi sırasında proteinlerin kaybolmadığından emin olmak için tampon değişim adımından sonra protein tekrar ölçülebilir. Tampon değişimi için kullanılan sütunların türüne bağlı olarak, protein büyük ölçüde kaybolabilir. Protein kaybını önlemek için önerilen sütunları kullanın. Numune depolama için, alikotların hazırlanması önerilir. - Deneye ANL katılımını değerlendirmek için reaksiyona tıklayın
- Adım 2.6'da salınan numunelerin 40 μL'sini alın ve 120 μL'lik son hacme PBS (pH 7.8) ekleyin.
- Tıklama kimyası reaksiyonunu ayarlamak için, aşağıdaki reaktifleri verilen sırayla ekleyin ve her eklemeden sonra 20 s için vorteks: 1.5 μL triazol ligand (stok 40 mM), 1.5 μL biyotin alkin (stok 5 mM) ve 1 μL Cu(I) bromür (stok 10 mg / mL, DMSO'da yukarı ve aşağı dikkatli pipetleme ile çözülmüş, vorteks yapmayın). Reaktifleri mümkün olduğunca çabuk ekleyin.
- Numuneleri gece boyunca karanlıkta 4 ° C'de sürekli rotasyonla inkübe edin.
- Numuneleri 4 ° C'de 17.000 x g'da 5 dakika boyunca santrifüj edin. Hafif turkuaz bir pelet görünecektir. Süpernatantı yeni bir tüpe aktarın.
NOT: Bakır oksidasyonunu önlemek için kullanımdan hemen önce Cu (I) bromür stoğunu hazırlayın. Lize numune ile PBS arasındaki hacim oranının numuneler arasında sabit tutulması, her tüpte aynı nihai deterjan konsantrasyonunu sağlamak için çok önemlidir. Klik kimyası reaksiyonunun montajını hızlandırmak için, tüpler için rafları olan bir masa girdabı önerilir. Tıklanan numuneleri birkaç ay boyunca -80 °C'de veya daha fazla işleme (durma noktası) kadar birkaç hafta boyunca -20 °C'de saklayın.
- Deneye ANL katılımını değerlendirmek için Western blot analizi
- Tıklama kimyası reaksiyonundan 20-40 μL süpernatant ile bir SDS-PAGE çalıştırın (adım 2.7). % 12 akrilamid jelleri kullanın,% 1 SDS, 250 mM Tris-HCl, 2 mM glisin içinde çalıştırın. Ön kısım jelden çıkana kadar çalıştırın.
- Proteinleri bir nitroselüloz veya PVDF membranına aktarın13.
- Membranı gece boyunca 4 °C'de GFP antikoru (1:500, GFP proteini MetRS*5 ile birlikte çevrilir) ve biyotine konjuge edilen kliken tespiti için biyotin antikoru (1:1000) ile inkübe edin.
- Birincil antikoru 10 dakika boyunca 2 kez yıkayın ve ikincil antikoru 1.5 saat boyunca ekleyin.
- Sekonder antikoru 10 dakika boyunca 2 kez yıkayın ve tarayın (florofor konjuge antikorlar kullanılıyorsa) veya filmlere maruz bırakın (yaban turpu peroksidaz konjuge antikorları kullanılıyorsa).
- ImageJ veya benzeri bir yazılım kullanarak biyotin sinyalini ölçün, deneyin her bir örneğinin genel etiketlemesini değerlendirin ve olası aykırı değerleri tespit edin. Deneyin sinyal-gürültü oranını (negatif kontrollerden arka plana ANL numune etiketlemesi) değerlendirin ve ANL'yi alamayan / dahil etmeyen olası hayvanları tespit edin.
NOT: Yüksek ANL katılımına sahip numuneler için, ANL birleşmesinin değerlendirilmesi için bu bölümde kullanılana benzer bölünmez alkinler kullanılarak protein saflaştırması teorik olarak mümkündür. Beyin örneklerini kullanarak, bölünmez alkinler kullanılarak protein saflaştırılmasından sonra MS tarafından negatif kontrollerde elde edilen arka plan çok yüksektir14. Bu nedenle, ilk genel numune ve deney değerlendirmesi için sadece kullanımı kolay, bölünemeyen alkinler kullanılmıştır. Protein saflaştırması için amaçlanan alkinin türünden bağımsız olarak, aşağıdaki bölümde açıklanan alkin dozaj optimizasyonu için adımların uygulanması tavsiye edilir (adım 2.9).
- Bölünebilir alkinler dozaj optimizasyonu için reaksiyona tıklayın
- 40 μL'lik bir temsili numune içeren dört tüp hazırlayın (adım 2.6'da elde edilir ve adım 2.8'de değerlendirilir) ve 120 μL'lik bir son hacme PBS (pH 7.8) ekleyin.
- Adım 2.7'de açıklandığı gibi tıklama kimyası reaksiyonunu ayarlayın, ancak bu sefer dört farklı miktarda DST-alkin'i ekleyin. Söz konusu alkin için 5 μM, 15 μM, 30 μM ve 60 μM test edilmesi önerilir.
- İncelenen spesifik deneysel soru için hangisinin en uygun alkin dozu olduğuna karar vermek için, en düşük arka plan sinyaline sahip en yüksek etiketleme verimliliğine dayanarak adım 2.8'i tekrarlayın.
NOT: Kalan numuneleri bir tıklama reaksiyonuna tabi tutmadan önce, herhangi bir alkinin optimal miktarının belirlenmesi gerekir. Ticari olarak temin edilebilen alkinlerin kullanılabilecek çeşitli seçenekleri vardır. Bölünme şeklinde farklılık gösterirler (örneğin, hafif veya indirgeyici ajanlar). Suş destekli reaktifler (örneğin, DBCO reaktifleri) kullanılarak bakırsız tıklama kimyası da mümkündür. Alkinlerin veya DBCO reaktiflerinin miktarındaki küçük değişiklikler genellikle negatif kontroldeki (arka plandaki) sinyali önemli ölçüde artırır. Burada, indirgeyici ajanlar (Disülfit biyotin alkinin veya DST-alkin15) ile parçalanabilen bir disülfit köprüsüne sahip bir alkin kullanılarak protein saflaştırılması açıklanmaktadır. DST-alkin'i kullanırken, SDS-PAGE'i çalıştırmak için (adım 8.1), alkinin bölünmesini önlemek için DTT veya β-Merkaptoetanol gibi güçlü indirgeyici ajanlarla tamponları yüklemekten kaçının. Bu çalışmada, yükleme tamponunda 5 mM N-etilmaleimid (NEM) kullanılarak 72 °C'de, 5 dakika boyunca ısıtma, DST-alkinin stabilitesini etkilemez. Adım 2.9.2 tekrarlanabilir, gözlemlenen en iyi aralıkta daha ince taneli dozajlar test edilebilir.
- Protein saflaştırma için preparatif tıklama reaksiyonu
- Adım 2.6'da elde edilen tüm örneklere, adım 2.9'da belirlenen optimal alkinler dozu ile tıklayın ve SDS-PAGE ve Western blot ile bir fraksiyonu analiz edin (adım 2.8).
NOT: Numune yükseltme doğruluğundan emin olmak için pipetlerin uygun şekilde kalibre edildiğinden emin olun. Tıklanan numuneler birkaç ay boyunca -80 °C'de saklanabilir (durma noktası).
- Adım 2.6'da elde edilen tüm örneklere, adım 2.9'da belirlenen optimal alkinler dozu ile tıklayın ve SDS-PAGE ve Western blot ile bir fraksiyonu analiz edin (adım 2.8).
3. Protein saflaştırma
- Arabellek değişimi
- Tıklanan tüm numuneleri adım 2.6'da açıklandığı gibi bir tampon değiştirme prosedürüne tabi tutun, ancak dengeleme tamponu olarak Neutravidin bağlayıcı tamponu kullanın (PBS pH 7.4, %0.15 (ağırlık/hacim) SDS, %1 (hacim/hacim) Triton X-100 ve PI (1:2000)).
NOT: Salınımlı numuneler -80 °C'de birkaç ay boyunca saklanabilir (durma noktası). Bu adımda, klikasyonsuz serbest alkin elimine edilir ve tampon Neutravidin bağlayıcı tampon ile değiştirilir.
- Tıklanan tüm numuneleri adım 2.6'da açıklandığı gibi bir tampon değiştirme prosedürüne tabi tutun, ancak dengeleme tamponu olarak Neutravidin bağlayıcı tamponu kullanın (PBS pH 7.4, %0.15 (ağırlık/hacim) SDS, %1 (hacim/hacim) Triton X-100 ve PI (1:2000)).
- Neutravidin boncuklarına bağlanma
- Neutravidin yüksek kapasiteli boncukları Neutravidin bağlayıcı tampon ile yıkayın (bkz. adım 3.1); boncukları tamponla karıştırın ve karışımı 3000 x g'de 5 dakika boyunca santrifüj edin ve süpernatanı atın. Üç kez tekrarlayın.
- Aynı hacimde kuru boncuk ve Neutravidin bağlayıcı tampon ekleyerek 1: 1 bulamaç Neutravidin boncukları hazırlayın.
- Her numunenin 20-40 μL'sini önceden saflaştırılmış lizat olarak bir kenara koyun ve -20 ° C'de saklayın.
- Protein konsantrasyonunu ölçün (bkz. adım 2.4) ve 100 μg proteini, adım 3.2.2'de elde edilen boncuk bulamacının 4 μL'si ile karıştırın.
- Karışımı sürekli rotasyonla 4 ° C'de gece boyunca inkübe ederek etiketli proteinlerin boncuklara bağlanmasını sağlayın.
NOT: Tıklama kimyası reaksiyonuna gelince, adım 3.2.4'te açıklanan temel afinite saflaştırma reaksiyonu yükseltilebilir. Örneğin, hipokampusun uyarıcı nöronlarından proteinlerin saflaştırılması için, 1 mg protein lizatı 40 μL Neutravidin boncukları (1: 1 bulamaç) ile karıştırılır. Neutravidin boncuklarının miktarı, seçilen hücre tipine ve etiketleme süresine bağlı olacak ve ampirik olarak belirlenmesi gereken toplam protein mg başına etiketlenmiş protein miktarına göre yukarı veya aşağı ölçeklendirilebilir.
- Neutravidin boncukları yıkar ve protein elüsyonu
- Süpernatantları santrifüjleme ile toplayın (bkz. adım 3.2.1). Daha sonraki analizler için her bir süpernatantın 20-40 μl'lik bir alikotunu bir kenara koyun ve geri kalanını -80 ° C'de dondurun.
- Boncukları soğutulmuş Neutravidin yıkama tamponu 1 (PBS pH 7.4, %0.2 (ağırlık/hacim) SDS, %1 (hacim/hacim) Triton X-100 ve PI (1:2000)) ile tamponu ekleyerek, boncukları çökelterek ve süpernatanı atarak yıkayın. Bu adımı üç kez yineleyin.
- Daha sonra, aynı tamponu ekleyin ve süpernatanı atmadan önce boncukları 4 ° C'de sürekli dönüş altında 10 dakika boyunca inkübe edin. Bu adımı üç kez yineleyin.
- Boncukları 3.3.2-3.3.3 adımlarında açıklandığı gibi, ancak Neutravidin yıkama tamponu 2 (1x PBS, pH 7.4 ve PI 1:2000) kullanarak yıkayın.
- Boncukları 3.3.2-3.3.3 adımında açıklandığı gibi, ancak Neutravidin yıkama tamponu 3 (50 mM amonyum bikarbonat ve PI 1:2000) kullanarak yıkayın.
- Kullanılan kuru boncukların bir hacmine karşılık gelen Neutravidin elüsyon tamponu (% 5 (hacim / hacim) β-merkaptoetanol ve% 0.03 (wt / hacim) SDS) ile 20 ° C'de boncukları 30 dakika boyunca inkübe ederek tıklanan proteinleri süzün.
- Bir termoblok çalkalayıcıda sürekli çalkalama (1000 rpm) ile elüsyon sırasında boncukları süspansiyonda tutun. İki kez elute edin ve her iki elüatı birleştirin.
NOT: Adım 3.2.1'de açıklandığı gibi, bulamacın katı fraksiyonunun (boncuklar) ve sulu fazın (süpernatant) ayrılması için kurulan santrifüjleme, adım 3.3.1-3.3.7 için geçerlidir. Protein elüsyonu tamamlanmamışsa SDS miktarı arttırılabilir. Bununla birlikte, SDS'nin% 0.08 -% 0.1'inin üzerindeki miktarlarda, boncuklara spesifik olarak bağlı olmayan proteinler salınmaya başlar. β-merkaptoetanol uçucu ve toksiktir; 3.3.6-3.3.7 adımları için bir başlık kullanılması tavsiye edilir. Adım 3.2.3 ve 3.3.1'de toplanan örnekler SDS-PAGE tarafından çalıştırılmalı ve afinite saflaştırmasının verimliliğini değerlendirmek için Western blot (bkz. adım 2.8) ile değerlendirilmelidir (adım 3.3).
- Salınımlı proteinlerin değerlendirilmesi
- Salınan numunelerin 1/3'ünü bir SDS-PAGE'e yükleyin (bkz. adım 2.8.1).
- Gümüş boyama veya floresan yöntemi gibi yüksek hassasiyetli bir yöntem kullanarak proteinleri görselleştirmek için jeli lekeleyin.
- Numuneler beklenen kaliteye sahipse, yani ANL etiketli numunelerde negatif kontrole kıyasla 3-4 kat daha fazla protein varsa, salınan proteinler referans5'te açıklananlar gibi rutin kütle spektrometrisi yöntemleriyle tanımlanabilir.
Sonuçlar
Tanımlanan protokolü takiben (Şekil 1'de özetlenmiştir), ANL farelere 7 gün boyunca günlük intraperitoneal enjeksiyonlarla (400 mM ANL 10 mL / kg, Nex-Cre::MetRS*) veya 21 gün boyunca içme suyu (% 0.7 Maltoz,% 1 ANL, CamkII-Cre: : MetRS *) yoluyla uygulandı. Etiketlemeden sonra, karşılık gelen beyin bölgeleri disseke edildi, lize edildi, alkillendi ve tıklandı. Tıklama reaksiyonları SDS-PAGE ve Western Immunoblot ile analiz edildi. Deneylerin temsili görüntüleri, IP enjeksiyonu ile ANL uygulaması için Şekil 2'de ve içme suyu yoluyla ANL uygulaması için Şekil 3'te gösterilmiştir. Şekillerin amacının, her iki etiketleme protokolünün de çalıştığını göstermek olduğunu, bunları karşılaştırmak olmadığını unutmayın. Karşılaştırma mümkün değildir, çünkü gösterilen iki deneyde farklı nöronal popülasyonlar etiketlenmiştir (hipokampus ve korteksin uyarıcı nöronları ve beyinciğin Purkinje nöronları).
Başka bir deney, optimal DST-bölünebilir alkin konsantrasyonunun belirlenmesi için bir örnek sunmaktadır (Şekil 4). Bu örnekte, etiketli numune ile kontrol arasındaki kıvrım değişimi, 14 μM'lik bir alkin konsantrasyonunda en yüksektir. Bu alkin konsantrasyonu daha sonra tüm numunelere uygulanır. Deneydeki her bir numunenin seçilen alkin miktarı ile etiketlenmesinin doğrulanmasından sonra, tüm numuneler ANL etiketli / biyotin tıklanmış proteinlerin Neutravidin boncukları kullanılarak afinite bağlanması ile saflaştırılmasına tabi tutulmuştur (Şekil 5). Bu adımda, proteinler boncuklara bağlanır, yıkanır ve daha sonra DST-alkinde bulunan disülfit köprüsü azaltılarak salınır. Bu son adımdan sonra, biyotin ve alkinin bir kısmı boncuklara bağlı kalır. ANL içeren proteinler (alkinin geri kalanına bağlı) elüsyon tamponunda geri kazanılır. Elüsyon adımının verimliliğini değerlendirmek için, elüat hacminin üçte biri bir SDS-PAGE jeline yüklenir ve hassas bir toplam protein boyama yöntemi kullanılarak görselleştirilir. Kütle spektrometrisi ile yorumlanabilir sonuçlar elde etmek için negatif kontroller ve ANL etiketli numuneler arasındaki toplam protein boyasının en az 3 kat yoğunluk farkı gözlenmelidir. Bu protokolde açıklanan tüm adımların tamamlanmasını, MS numune hazırlama, edinme ve analiz5 izleyecektir. MS için özel bir gereklilik olmamasına rağmen (her laboratuvar rutin MS protokolü 5,10'u kullanabilir), saflaştırılmış proteinlerin miktarının genellikle düşük olacağı akılda tutulmalıdır (nanogram sırasına göre). Şekil 6, ANL etiketli numunede kontrole kıyasla net bir zenginleştirme ile MS sonuçlarının bir örneğini sunmaktadır (Şekil 6A). Bu fark, Şekil 5'te gösterilen toplam protein lekesinde zaten görülebiliyordu. Peptit yoğunluğundaki değişikliklerin yanı sıra, her iki örnekte de bulunan benzersiz proteinler vardır (Şekil 6B).
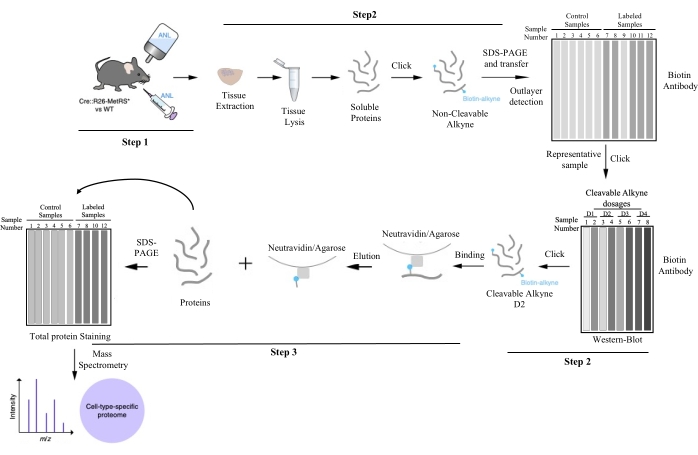
Şekil 1: BONCAT tarafından hücre tipine özgü protein saflaştırması için çalışma boru hattı. ANL ile protein etiketlemesini takiben, ilgilenilen doku diseke edilir ve lize edilir, tıklama kimyası ile biyotin ile etiketlenir ve her numune için etiketleme miktarı BONCAT tarafından değerlendirilir. Aykırı değerler (ANL'yi içeremeyen) ve temsili örnekler bu adımda ayırt edilebilir. Temsili örneklerden biri, sonraki protein saflaştırması için optimize edilmiş bölünebilir alkin dozajını bulmak için tekrar tıklanır. En iyi sinyal-gürültü oranını elde eden alkinin dozajı, her biyolojik replikasyona uygulanır. Hücre tipine özgü proteinler, afinite saflaştırması ile elde edilir. Saflaştırılmış numuneler kütle spektrometrisi ile incelenir ve proteinler tanımlanır. Bu rakam Alvarez-Castelao et al. (2017)6'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
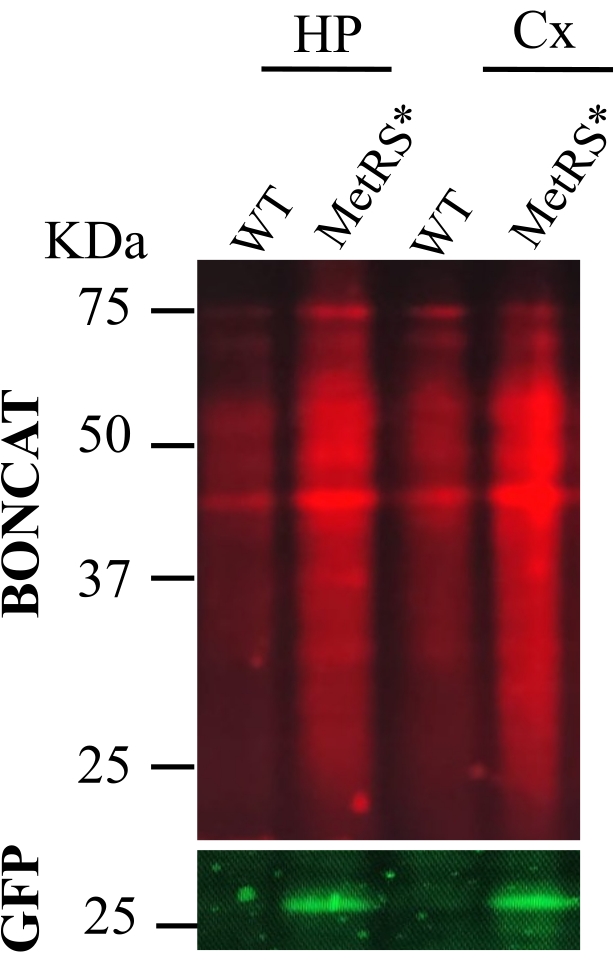
Şekil 2: İntraperitoneal enjeksiyonlarla ANL uygulaması (IP). BONCAT, 7 gün boyunca günlük IP enjeksiyonları ile ANL ile proteinlerin metabolik olarak etiketlenmesini takiben hipokampus (HP) ve kortekste (CX) protein etiketlemesini değerlendirmek için yapıldı. Negatif kontrol (wt) olarak vahşi tip fare örnekleri, etiketli örneklere (MetRS*) paralel olarak tıklandı. Etiketli proteinler, bir Nex-Cre::MetRS* hattı16 kullanan uyarıcı nöronlardandır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Resim 3: İçme suyu ile ANL uygulaması. BONCAT, ANL'nin 21 gün boyunca içme suyu yoluyla GAD-Cre::MetRS* farelere uygulanmasından sonra beyinciğin Purkinje nöronlarında protein etiketlemesini değerlendirmek için yapıldı. Şekilde, negatif bir kontrol (wt) ve paralel olarak lize edilmiş ve tıklanmış etiketli bir örnek (MetRS*) gösterilmektedir. Bu rakam Alvarez-Castelao et al. (2017)6'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 4: DST-alkin-dozaj titrasyon. Deney başına bir biyolojik replika, optimal alkin konsantrasyonunu titre etmek için temsili bir örnek olarak seçilir. Alkinin üç konsantrasyonu (14, 28 ve 56 μM) burada BONCAT için tıklama reaksiyonunda test edilmiştir. ANL etiketli numune (MetRS*) ile negatif kontrol (wt) arasındaki etiketleme oranı, sinyal-gürültü oranını belirler (grafikte gösterilmiştir). 14 μM, bu deneyde elde edilen en iyi alkin konsantrasyonudur. Bu deney için ANL etiketli Nex::MetRS* fare hattından korteks dokusu kullanıldı. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: Saflaştırılmış proteinler. Purkinje nöronlarından gelen etiketli proteinler, SYPRO Ruby kullanılarak saflaştırıldı ve boyandı. Bu rakam Alvarez-Castelao et al. (2017)6'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 6: Protein tanımlama ve nicelleştirme. Purkinje hücre proteomu, başlangıç malzemesi olarak bir GAD-Cre::MetRS* fare hattından beyincik kullanılarak kütle spektrometresi ile elde edildi. (A) ANL etiketli örneklerde tanımlanan proteinlerin bolluğunun (peptid yoğunluğu) vahşi tip (wt) farelere kıyasla arttığını gösterir. (B) Purkinje proteom, A'daki ANL etiketli örneklerde zenginleştirilmiş proteinlerin (MetRS * farelerde wt'ye kıyasla >3 kat yoğunluklarla tanımlanır) ve MetRS * eksprese eden farelerde bulunan benzersiz proteinlerin bir araya getirilmesiyle elde edildi. Bu rakam Alvarez-Castelao et al. (2017)6'dan değiştirilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Protokolün kritik yönleri şunlardır; negatif kontrollerin dahil edilmesi, yeterli biyolojik replikasyona sahip olması, ANL uygulama yolu, miktarı ve süresi, numunelerin alkilasyonu, alkin konsantrasyonu ve DST-alkinen kullanıldığında β-merkaptoetanol eliminasyonu.
Cre sürücüsü olmayan ANL etiketli hayvanlardan gelen negatif kontrol örneklerini dahil etmek önemlidir ve bu nedenle MetRS* ifadesi yoktur. Bu numuneler, ANL etiketli Cre-indüklenmiş MetRS* farelerden alınan numunelere paralel olarak protokolde açıklanan her adıma tabi tutulmalıdır. Tıklatılmayan örnekler geçerli denetimler değildir, çünkü yalnızca bu denetim kullanılarak elde edilen sonuçlar belirli olmayan tıklatmalardan kaynaklanıyor olabilir. MetRS* genini ifade etmeyen hücrelerde ANL'nin dahil olduğunu veya Cre'si olmayan hücrelerde MetRS* ekspresyonunu gözlemlemedik; Böylece, ANL ile etiketlenmiş wt hayvanları negatif kontrol olarak kullanılabilir.
Burada açıklanan protokolün numunelerin kaybolabileceği birçok adımdan oluştuğu göz önüne alındığında, teknik arıza göz önünde bulundurularak biyolojik replikaların hesaplanması önerilir. Beyin örnekleri için yaklaşık% 30 replikasyon kaybı vardır.
Burada iki ANL yönetim rotası ve süresi açıklıyoruz. Bu, diğer yönetim yollarının (örneğin, gıdaya ANL eklenmesi) eşit derecede iyi çalıştığını dışlamaz. Uygulanan ANL miktarı ile ilgili olarak, burada gösterilen deneyler nispeten yüksek miktarlarda ANL kullanılarak gerçekleştirilmiştir. Deney kurulumuna bağlı olarak daha düşük miktarlarla etiketleme de mümkündür. Bu protokolde bildirilen ANL etiketlemesinin en kısa süresi 1 hafta ve en uzun 21 gündür. Daha kısa veya daha uzun etiketleme süreleri uygulanabilir, ancak bunu belirlemedik. Araştırmacılar, incelenen spesifik deneysel soru için yeterli ANL uygulama yolunu, ANL dozajını ve ANL etiketleme süresini, dokunun metabolik özelliklerini, ilgilenilen hücre tipini ve incelenen deneysel soruyu göz önünde bulundurarak belirlemelidir.
Kapaklama olarak da bilinen örnek alkilasyon, arka plan tıklamasını önlemek için önemli bir adımdır17. Alkilasyon düzgün bir şekilde yapıldığında, kontrol numuneleri tarafından izlenen spesifik olmayan tıklama azalır ve negatif kontrol ile ANL etiketli numuneler arasındaki fark daha büyük olur. Alkilasyon sonrası serbest IAA'nın ortadan kaldırılması da önemli bir adımdır. Tıklama reaksiyonu sırasında az miktarda IAA'nın varlığı, verimliliğini sınırlayacaktır. Bazen, IAA'yı da ortadan kaldıran tuzdan arındırma adımı (adım 2.6), IAA'nın düzgün bir şekilde çıkarılmasını sağlamak için tekrarlanmalıdır.
Çeşitli şirketlerden ticari olarak temin edilebilen birkaç biyotin-alkinler ve -DBCO reaktifleri vardır. Aralarındaki temel farklar, polietilenglikol (PEG) bağlayıcı zincir uzunluğu ve bölünebilir grupların yokluğu, varlığı ve tipi ile ilgilidir. Kullanılan tipten bağımsız olarak, aşırı miktarda alkin, sadece doğal amino asitleri taşıyan proteinlere spesifik olmayan tıklamalara yol açar. Bu, alkin miktarının hassas ve dikkatli bir şekilde titrasyonuyla kolayca önlenebilir. Açıklandığı gibi, bunu başarmanın en iyi yolu, sonraki protein saflaştırma adımlarında (adım 2.6) ve kütle spektrometrisi analizinde kullanılacak gerçek lize ve alkillenmiş numuneleri kullanmaktır.
Tıklama reaksiyonunda DST-alkinler kullanıldığında, β-merkaptoetanol disülfit köprüsünü azaltır ve etiketli proteinleri elüsyon adımındaki boncuklardan ayırır (adım 3.3). β-merkaptoetanol, MS için gerekli enzimatik sindirime izin vermek için numunelerden çıkarılmalıdır. Bunu yapmanın birkaç yolu vardır (örneğin, liyofilizasyon18, bir jel19'dan eksizyon veya S-Trap kolonları20 kullanılarak temizleme) ve seçim, numuneleri işleyen MS laboratuvarı tarafından yapılmalıdır.
Yöntemdeki değişiklikler ve sorun giderme, protokolde belirtilen kritik adımları optimize etmek için yönlendirilmelidir. Örneğin, çok fazla değişkenlik varsa, daha fazla biyolojik kopya ekleyin; etiketleme çok düşükse, ANL konsantrasyonunu artırın, daha uzun etiketleme süreleri kullanın veya çalışılan doku için daha verimli olabilecek diğer ANL uygulama yollarını test edin. Protein alkilasyonu için, IAA ilavesine önceki bir azaltma adımı uygulanabilir.
Yöntemin ana sınırlaması, küçük bir doku alanı diseke edilse bile küçük hücre popülasyonlarından kaynaklanan proteomların saflaştırılmasıdır. Bununla birlikte, daha büyük doku alanlarına yayılmış olan daha fazla sayıda hücre popülasyonunun proteomlarına erişmek de zordur. Bununla birlikte, burada açıklanan in vivo etiketleme tekniği, sevk edilen hücre tiplerini görüntüleme yoluyla değerlendirmek için hala uygulanabilir (örneğin, FUNCAT veya FUNCAT-PLA21 ile).
Bu yöntem şu anda tam uzunluktaki proteinlere dayanan hücre tipine özgü proteomların in vivo çalışması ve hücre tipine özgü tam proteinlerin yerinde görselleştirilmesi için mevcut tek yöntemdir. Azidohomoalanin (AHA) gibi diğer kanonik olmayan amino asitler de proteomların in vivo protein etiketlemesi ve saflaştırılması için kullanılabilir, ancak hücre hücresi tipi özgüllüğünden yoksundur22,23. Puromisin gibi diğer yaklaşımlar, protein sentezi24,25'in sabit bir resmini sağlamak için uygundur. Bununla birlikte, kanonik olmayan amino asitlerin daha uzun süre etiketleme için kullanılması, ayrıca protein bozulmasını yansıtan ve daha doğru bir hücresel proteom gösteren mümkündür. BioID tabanlı yöntemler, sentez anlarına/yerlerine bakılmaksızın belirli hücre altı bölgelerdeki proteinleri tanımlamak için kullanılır26.
Kurduğumuz fare çizgisinde (Jackson Lab, stok no. 028071'den temin edilebilir), ANL'nin hücrelere dahil edilmesine izin veren mutant metiyonin tRNA sentetaz (MetRS*) Cre'ye bağımlı bir şekilde ifade edilir. Bu fare çizgisini bir araç olarak, MetRS*'i yalnızca Cre-driver hatlarının kullanılabildiği hücre türlerinde ifade etmek mümkündür. Bu düzenleme, yönteme önemli ölçüde çok yönlülük kazandırmakta ve biyomedikal araştırmanın hemen hemen her alanında yararlı olmasını sağlamaktadır.
Açıklamalar
Yazarlar rakip finansal çıkarlar olmadığını beyan ederler.
Teşekkürler
B.A-C, İspanya Bilim ve İnovasyon Bakanlığı (Ramón y Cajal-RYC2018-024435-I), Madrid Özerk Topluluğu (Atracción de Talento-2019T1 / BMD-14057) ve MICINN (PID2020-113270RA-I00) hibeleri tarafından finanse edilmektedir. R.A-P, Madrid Özerk Topluluğu (Atracción de Talento-2019T1/BMD-14057) tarafından finanse edilmektedir. E.M.S., Avrupa Araştırma Konseyi'nden (hibe 743216) bir İleri Araştırmacı ödülü olan Max Planck Society tarafından finanse edilmektedir, DFG CRC 1080: Nöral Homeostazın Moleküler ve Hücresel Mekanizmaları ve DFG CRC 902: RNA Tabanlı Düzenlemenin Moleküler İlkeleri. D.C Dieterich ve P. Landgraf'a teknik tavsiyeleri ve DST-Alkyne'nin sentezi için teşekkür ederiz. E. Northrup, S. Zeissler, S. Gil Mast ve MPI for Brain Research'ün hayvan tesisine mükemmel destekleri için teşekkür ederiz. Nex-Cre fare serisini paylaştığı için Sandra Goebbels'e teşekkür ederiz. Antonio G. Carroggio'ya İngilizce düzenleme konusundaki yardımları için teşekkür ederiz. B.A-C. deneyler tasarladı, yürüttü ve analiz etti. B.N-A, D.O.C, R.A-P, C. E. ve S. t. D. deneyler yaptı ve analiz etti. B.A-C ve E.M.S. deneyler tasarladı ve projeyi denetledi, B.A-C makaleyi yazdı. Tüm yazarlar makaleyi düzenledi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12% Acrylamide gels | GenScript | SurePAGE, Bis-Tris, 10 x 8, 12% | |
| β-Mercaptoethanol | Sigma | M6250 | Toxic; use a lab coat, gloves and a fume hood. |
| Ammonium bicarbonate | Sigma | 9830 | Toxic; use a lab coat, gloves and a fume hood |
| ANL | Synthesized as described previously for AHA (see references 5 and 11) | ||
| ANL-HCl | IrishBotech | HAA1625.0500 | |
| Benzonase | Sigma | E1014 | |
| Biotin alkyne | Thermo, | B10185 | |
| Chicken antibody anti-GFP | Aves | 1020 | |
| Complete EDTA-free protease inhibitor | Roche | 4693132001 | Toxic; use a lab coat and gloves. |
| Copper (I) bromide | Sigma | 254185 | 99.999% (wt/wt) |
| Disulfide tag (DST)-alkyne | Synthesized as reported in reference number 15, in which it is referred to as probe 20 | ||
| DMSO | Sigma | 276855 | |
| Filters | Merk | SCGP00525 | |
| Iodo acetamide (IAA) | Sigma | I1149 | |
| IR anti chicken 800 | LI-COR | IRDye 800CW | Donkey anti-Chicken Secondary Antibody |
| IR anti rabit 680 | LI-COR | IRDye 680RD | Goat anti-Rabbit IgG Secondary Antibody |
| Maltose | Sigma | M9171 | |
| Manual Mixer | BioSpec Products | 1083 | |
| NaCl | Sigma | S9888 | |
| N-ethylmaleimide | Sigma | 4259 | Toxic; use a lab coat, gloves and a fume hood. |
| NeutrAvidin beads | Pierce | 29200 | |
| Nitrocellulose membrane | Bio-rad | 1620112 | |
| PBS 1X | Thermo | J62036.K2 | |
| PBS 1X pH 7.8 | Preparation described in reference number 5 | ||
| PD SpinTrap G-25 columns | GE Healthcare | Buffer exchange | |
| Pierce BCA Protein Assay Kit | Thermo, | 23225 | Reagents in the Pierce BCA Protein Assay Kit are toxic to aquatic life. |
| Polyclonal rabbit anti-biotin antibody | Cell Signaling | 5597 | |
| PVDF membrane | Millipore | IPVH00010 | |
| SDS 10% | Sigma | 71736 | |
| SDS-PAGE Running buffer MOPS | GenScript | M00138 | |
| SYPRO Ruby stain | Sigma | S4942 | |
| Table automatic Vortexer | Eppendorf | Mixmate | |
| Triazole ligand | Sigma | 678937 | |
| Triton X-100 | Sigma | T9284 | |
| Water | Sigma | W4502 | Molecular biology grade |
Referanslar
- Alvarez-Castelao, B., Schuman, E. M. The regulation of synaptic protein turnover. Journal of Biological Chemistry. 290 (48), 28623-28630 (2015).
- Sutton, M. A., Schuman, E. M. Dendritic protein synthesis, synaptic plasticity, and memory. Cell. 127 (1), 49-58 (2006).
- Dorrbaum, A. R., Alvarez-Castelao, B., Nassim-Assir, B., Langer, J. D., Schuman, E. M. Proteome dynamics during homeostatic scaling in cultured neurons. Elife. 9, 52939(2020).
- Flexner, J. B., Flexner, L. B., Stellar, E. Memory in mice as affected by intracerebral puromycin. Science. 141 (3575), 57-59 (1963).
- Alvarez-Castelao, B., Schanzenbacher, C. T., Langer, J. D., Schuman, E. M. Cell-type-specific metabolic labeling, detection and identification of nascent proteomes in vivo. Nature Protocols. 14 (2), 556-575 (2019).
- Alvarez-Castelao, B., et al. Cell-type-specific metabolic labeling of nascent proteomes in vivo. Nature Biotechnology. 35 (12), 1196-1201 (2017).
- Ngo, J. T., et al. Cell-selective metabolic labeling of proteins. Nature Chemical Biology. 5 (10), 715-717 (2009).
- Mahdavi, A., et al. Engineered aminoacyl-tRNA synthetase for cell-selective analysis of mammalian protein synthesis. Journal of the American Chemical Society. 138 (13), 4278-4281 (2016).
- Yuet, K. P., et al. Cell-specific proteomic analysis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 112 (9), 2705-2710 (2015).
- Patel, V. J., et al. A comparison of labeling and label-free mass spectrometry-based proteomics approaches. Journal of Proteome Research. 8 (7), 3752-3759 (2009).
- Link, A. J., Vink, M. K., Tirrell, D. A. Preparation of the functionalizable methionine surrogate azidohomoalanine via copper-catalyzed diazo transfer. Nature Protocols. 2 (8), 1879-1883 (2007).
- Landgraf, P., Antileo, E. R., Schuman, E. M., Dieterich, D. C. BONCAT: Metabolic labeling, click chemistry, and affinity purification of newly synthesized proteomes. Methods in Molecular Biology. 1266, Clifton, N.J. 199-215 (2015).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Analysis of proteins by immunoblotting. Cold Spring Harbor Protocols. 2021 (12), (2021).
- Mellacheruvu, D., et al. The CRAPome: a contaminant repository for affinity purification-mass spectrometry data. Nature Methods. 10 (8), 730-736 (2013).
- Szychowski, J., et al. Cleavable biotin probes for labeling of biomolecules via azide-alkyne cycloaddition. Journal of the American Chemical Society. 132 (51), 18351-18360 (2010).
- Goebbels, S., et al. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44 (12), 611-621 (2006).
- van Geel, R., Pruijn, G. J., van Delft, F. L., Boelens, W. C. Preventing thiol-yne addition improves the specificity of strain-promoted azide-alkyne cycloaddition. Bioconjugate Chemistry. 23 (3), 392-398 (2012).
- O'Fagain, C. Lyophilization of proteins. Methods in Molecular Biology. 244, Clifton, N.J. 309-321 (2004).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nature Protocols. 1 (6), 2856-2860 (2006).
- Elinger, D., Gabashvili, A., Levin, Y. Suspension trapping (S-Trap) is compatible with typical protein extraction buffers and detergents for bottom-up proteomics. Journal of Proteome Research. 18 (3), 1441-1445 (2019).
- tom Dieck, S., et al. Direct visualization of newly synthesized target proteins in situ. Nature Methods. 12 (5), 411-414 (2015).
- McShane, E., et al. Kinetic analysis of protein stability reveals age-dependent degradation. Cell. 167 (3), 803-815 (2016).
- Calve, S., Witten, A. J., Ocken, A. R., Kinzer-Ursem, T. L. Incorporation of non-canonical amino acids into the developing murine proteome. Scientific Reports. 6, 32377(2016).
- David, A., et al. Nuclear translation visualized by ribosome-bound nascent chain puromycylation. Journal of Cell Biology. 197 (1), 45-57 (2012).
- Schmidt, E. K., Clavarino, G., Ceppi, M., Pierre, P. SUnSET, a nonradioactive method to monitor protein synthesis. Nature Methods. 6 (4), 275-277 (2009).
- Roux, K. J., Kim, D. I., Burke, B., May, D. G. BioID: A screen for protein-protein interactions. Current Protocols in Protein Science. 91, 11-15 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır