Method Article
تنقية البروتين المحدد من نوع الخلية والتعرف عليه من الأنسجة المعقدة باستخدام خط ماوس الميثيونين tRNA Synthetase الطافر
In This Article
Summary
يصف هذا البروتوكول كيفية إجراء وضع العلامات على البروتين الخاص بنوع الخلية باستخدام أزيدونونورليوسين (ANL) باستخدام خط ماوس يعبر عن سينثيتاز L274G-Methionine tRNA المتحور (MetRS *) والخطوات اللازمة لعزل البروتينات الخاصة بنوع الخلية الموصوفة. نحدد طريقين محتملين لإدارة ANL في الفئران الحية عن طريق (1) مياه الشرب و (2) الحقن داخل الصفاق.
Abstract
يعد فهم الاتزان الداخلي للبروتين في الجسم الحي أمرا أساسيا لمعرفة كيفية عمل الخلايا في كل من الظروف الفسيولوجية والمرضية على حد سواء. يصف البروتوكول الحالي وضع العلامات في الجسم الحي والتنقية اللاحقة للبروتينات المركبة حديثا باستخدام خط فأر مهندس لتوجيه وضع العلامات على البروتين إلى مجموعات خلوية محددة. وهو خط قابل للتحريض عن طريق تعبير Cre recombinase ل L274G-Methionine tRNA synthetase (MetRS *) ، مما يتيح دمج أزيدونونورليوسين (ANL) في البروتينات ، والتي لن تحدث بخلاف ذلك. باستخدام الطريقة الموضحة هنا ، من الممكن تنقية البروتينات الخاصة بنوع الخلية المصنفة في الجسم الحي واكتشاف التغيرات الطفيفة في محتوى البروتين بسبب تقليل تعقيد العينة.
Introduction
يحدث توازن البروتين الشاذ بسبب اختلال التوازن في تخليق البروتين وتدهوره. ترتبط العديد من الأمراض بالتغيرات في توازن البروتين. السمة المميزة لبعض الأمراض هي وجود مجاميع في مواقع تحت خلوية مختلفة ومناطق الدماغ. الاتزان الداخلي للبروتين ليس مهما في المرض فحسب ، بل يلعب أيضا دورا مهما في الوظيفة الطبيعية للعضو والخلية1. على سبيل المثال ، تخليق البروتين ضروري للعديد من أشكال اللدونة العصبية 2,3 ، على النحو الذي يحدده استخدام مثبطات كيميائية تمنع تخليق البروتين4. ومع ذلك ، ليس من الواضح في أي أنواع الخلايا يتم تغيير البروتين لدعم التعلم والذاكرة ، ولا يفهم أي بروتينات معينة في كل نوع من أنواع الخلايا تزيد أو تنقص في تخليقها أو تدهورها. وبالتالي ، فإن الدراسة الشاملة لتوازن البروتين تتطلب القدرة على التمييز بين البروتينات القادمة من أنواع معينة من الخلايا. في الواقع ، كان تحديد البروتينات الخاصة بنوع الخلية لدراسة العمليات الخلوية التي تحدث في بيئة متعددة الخلايا عقبة مهمة في البروتيوميات. لهذا السبب ، قمنا بتطوير تقنية باستخدام تعبير MetRS * جنبا إلى جنب مع طرق التعامد الحيوي التي أثبتت أنها طريقة فعالة لتحديد وتنقية البروتينات المحددة من نوع الخلية ، وسد هذه الفجوة5،6،7.
يسمح التعبير عن MetRS * الطافر (MetRS L274G) بتحميل ANL التناظري للميثيونين غير الكنسي في tRNA 8,9 المقابل ودمجه لاحقا في البروتينات. عندما يتم تنظيم تعبير MetRS * بواسطة محفز خاص بنوع الخلية ، سيتم دمج الحمض الأميني غير المتعارف عليه في البروتينات بطريقة انتقائية للخلايا. بمجرد دمج ANL في البروتينات ، يمكن تشغيله بشكل انتقائي عن طريق كيمياء النقر وبعد ذلك إما عن طريق التصوير (FUNCAT) أو عن طريق Western Immunoblot (BONCAT). بدلا من ذلك ، يمكن تنقية البروتينات بشكل انتقائي وتحديدها بواسطة قياس الطيف الكتلي (MS). باستخدام هذه التقنية ، أنشأنا خط ماوس يعبر عن بروتين MetRS * تحت سيطرة Cre recombinase. بالنظر إلى العدد المتزايد من خطوط Cre-mouse المتاحة ، يمكن استخدام نظام MetRS * في أي مجال لدراسة أي نوع من الخلايا من أي نسيج يوجد له خط Cre-line موجود. يمكن وضع العلامات على البروتين باستخدام ANL في المختبر أو في الجسم الحي ، ولا يغير سلوك الماوس أو سلامة البروتين6. يمكن تكييف الفترة الزمنية لوضع العلامات مع السؤال العلمي لكل باحث ، ووضع العلامات على البروتينات المركبة حديثا (أوقات وضع العلامات الأقصر) أو البروتينات بأكملها (أوقات وضع العلامات الأطول). يقتصر استخدام هذه التقنية على عدد الخلايا من النوع الذي يرغب الباحث في دراسته ؛ ومن ثم فإن عزل البروتين عن أنواع الخلايا ذات الأعداد المنخفضة أو معدلات الأيض المنخفضة غير ممكن بهذه الطريقة. الهدف من الطريقة المقدمة هو تحديد البروتينات / البروتينات الخاصة بنوع الخلية المصنفة في الجسم الحي. في هذا البروتوكول ، نصف كيفية تسمية البروتينات الخاصة بنوع الخلية باستخدام ANL في الفئران الحية وتنقية البروتينات المصنفة. بعد التنقية ، يمكن تحديد البروتينات من خلال بروتوكولات قياس الطيف الكتلي الروتينية 5,10. يسمح الحد من تعقيد العينة الذي تم تحقيقه في هذه الطريقة عن طريق التنقية الانتقائية للبروتينات من مجموعات خلوية محددة للمجرب باكتشاف التغيرات الطفيفة في البروتينات ، على سبيل المثال ، استجابة للتغيرات البيئية. يمكن تحقيق تنقية البروتينات الموسومة في ~ 10 أيام ، ولا تشمل تحليل MS أو فترة وضع العلامات. هنا ، نصف طريقتين لإدارة ANL للفئران المعبرة عن MetRS * ، وهما (1) إضافة الأحماض الأمينية في مياه الشرب ، و (2) إدخال ANL عن طريق الحقن داخل الصفاق. بغض النظر عن الطريقة المختارة لإدارة ANL ، فإن خطوات العزل والتنقية هي نفسها (من الخطوة 2 فصاعدا).
Protocol
تم إجراء جميع التجارب على الحيوانات بإذن من مكاتب الحكومة المحلية في ألمانيا (RP Darmstadt ؛ البروتوكولات: V54-19c20 / 15-F122 / 14 ، V54-19c20 / 15-F126 / 1012) أو إسبانيا (لجنة التجارب على الحيوانات في UCM والاستشارات البيئية في Comunidad de Madrid ، رقم البروتوكول: PROEX 005.0 / 21) ومتوافقة مع قواعد جمعية ماكس بلانك واللوائح الإسبانية وتتبع إرشادات الاتحاد الأوروبي لرعاية الحيوان.
1. وضع العلامات الأيضية في الجسم الحي مع ANL
- مياه الشرب:
- حل ANL والمالتوز في مياه الشرب العادية للفئران. تركيز المالتوز الموصى به هو 0.7٪ (بالوزن / المجلد). الحد الأقصى لكمية ANL المضافة إلى مياه الشرب هو 1٪ (بالوزن / المجلد). بمجرد أن يصبح الخليط جاهزا ، قم بتعقيمه عن طريق الترشيح وتخزينه في درجة حرارة 4 درجات مئوية.
- قدم الخليط المحضر في الخطوة 1.1 للفئران. قم بتغيير الزجاجات بشكل متكرر (على سبيل المثال ، كل 3 أيام) لتجنب التلوث ، وافحصها كل يوم للبحث عن التلوث أو الانسداد المحتمل. راقب كمية الماء في حالة سكر يوميا عن طريق وزنه ، لمعرفة كمية ANL التي تتناولها الفئران.
ملاحظة: الحد الأقصى لفترة وضع العلامات التي تم تقييمها هنا هو 3 أسابيع باستخدام تركيز ANL بنسبة 1٪ في مياه الشرب ، مما أدى إلى وضع علامات يمكن اكتشافها جيدا في الدماغ. ويمكن أيضا أن يتحقق وضع العلامات الجيدة في 2 أسابيع. لم يتم دراسة أوقات وضع العلامات الأقصر ، ولا النقاط الزمنية الأطول ، ولا كميات ANL الأخرى من قبلنا باستخدام طريقة الإدارة هذه ، والتي لا تعني أن ما سبق لن ينجح. يمكن أن تختلف معدلات دمج ANL اعتمادا على الأنسجة المدروسة أو نوع الخلية. يمكن أن يختلف وقت وضع العلامات اعتمادا على السؤال العلمي ؛ على سبيل المثال ، إذا تم تسمية البروتينات ، فيجب حساب وقت وضع العلامات في وظيفة متوسط عمر النصف للبروتينات في الأنسجة المدروسة. إذا كان الاهتمام هو فقط لتحديد البروتينات المركبة حديثا ، يمكن تقصير الأوقات. يجب اختبار فترات وضع العلامات وجرعات ANL تجريبيا لكل حالة تجريبية ونوع الخلية ذات الأهمية.
- الإدارة داخل الصفاق:
- قم بإذابة ANL في محلول كلوريد الصوديوم الفسيولوجي إلى 400 mM أو محلول ملحي فوسفات (PBS) أو ماء.
- تأكد من أن الأسمولية من الحل ضمن النطاق الفسيولوجي. هنا ، يتم إعطاء 10 مل / كجم من وزن الجسم من محلول ANL للفئران.
ملاحظة: يتم الحصول على وضع العلامات الجيدة في الخلايا العصبية المثيرة للدماغ بنجاح عن طريق حقنة واحدة داخل الصفاق يوميا (IP) مع 400 mM ANL لمدة 1 أسبوع. لم يتم اختبار تركيزات ANL المنخفضة ولا فترات وضع العلامات الأخرى عن طريق حقن IP في هذه الدراسة ، مما لا يعني أنها لن تعمل. يتم توفير ANL كهيدروكلوريد من قبل بعض الشركات. في هذه الحالة ، يجب ضبط الرقم الهيدروجيني للحلول على الرقم الهيدروجيني المناسب (اعتمادا على مسار الإدارة). يمكن أيضا تصنيع ANL باتباع الطريقة التي نشرها Link et al.11 مع بعض التعديلات5. يمكن إجراء وضع العلامات على ANL باستخدام تركيزات ANL الأخرى والفترات الزمنية وطرق الإدارة. بالنسبة للأنسجة / أنواع الخلايا ذات معدلات الأيض المنخفضة ، يمكن استخدام نظام غذائي منخفض المحتوى ميثيونين ، بدءا دائما من 1 أسبوع قبل إدارة ANL. عند استخدام 400 mM ANL ، يمكن أن يترسب أثناء تخزينه عند 4 درجات مئوية ؛ تسخين ما يصل إلى 37 درجة مئوية يعيد ANL إلى المحلول. دعه يصل إلى درجة حرارة الغرفة قبل الحقن. في معظم مناطق العالم ، يعد إعطاء ANL للفئران تجربة على الحيوانات ويحتاج إلى موافقة السلطات المختصة.
2. حصاد الأنسجة ، تحلل ، واستخراج البروتين
- تشريح الأنسجة: تشريح منطقة الأنسجة التي تحتوي على نوع الخلية محل الاهتمام ولاحظ وزن قطعة الأنسجة التي تم جمعها.
ملاحظة: يمكن تخزين العينات في -80 درجة مئوية لعدة أشهر (نقطة توقف). في البروتوكول الحالي ، تم تشريح قشرة الفئران والحصين. - تحلل الأنسجة: تجانس الأنسجة في درجة حرارة الغرفة عن طريق إضافة حجم 12-15 ضعف الوزن الرطب لأنسجة مخزن التحلل (PBS pH 7.4 ، 1٪ بالوزن / المجلد SDS ، 1٪ (حجم / حجم) Triton X-100 ، Benzonase (1: 1000 vol / vol) ، مثبط الأنزيم البروتيني (PI) (EDTA free 1: 4000)). على سبيل المثال ، بالنسبة لقطعة نسيج 20 ملغ ، أضف 240-300 ميكرولتر من محلول التحلل. نسج الأنسجة حتى يتم تجانسها.
ملاحظة: يمكن تخزين العينات في -80 درجة مئوية لعدة أشهر (نقطة توقف). للتجانس المباشر في أنابيب سعة 1.5 مل ، يوصى باستخدام خالط محمول باليد يعمل بالبطارية ، خاصة عند معالجة قطع صغيرة من الأنسجة. بالنسبة للقطع الأكبر حجما ، يمكن استخدام الخالط Dounce. إلى كل مخزن مؤقت يتم فيه تضمين مثبطات الأنزيم البروتيني (PI) ، يجب إضافتها مباشرة قبل الاستخدام وليس قبل ذلك. - تمسخ البروتين: سخني التجانس إلى 75 درجة مئوية لمدة 15 دقيقة وأجهزة الطرد المركزي عند 17000 × جم لمدة 15 دقيقة عند 10 درجات مئوية. نقل الطافت إلى أنبوب جديد.
- قياس محتوى البروتين: قياس تركيز البروتين لكل عينة ، وضبط جميع العينات لمقارنتها بنفس تركيز البروتين ؛ اضبط التركيز عن طريق إضافة محلول التحلل. يتراوح نطاق التركيز الأمثل بين 2-4 ميكروغرام / ميكرولتر.
ملاحظة: يمكن تخزين العينات في -80 درجة مئوية لعدة أشهر (نقطة توقف). - الألكلة
- قم بتخفيف العينات المتجانسة بمقدار 2-3 مرات في PBS (درجة الحموضة 7.8) + PI (خالية من EDTA 1: 4000).
- أضف يودوأسيتاميد (IAA) إلى تركيز نهائي مقداره 20 mM (محلول مخزون 500 mM).
- اترك العينات لمدة 1-2 ساعة عند 20 درجة مئوية في الظلام. قم بالخطوات 2.5.2-2.5.3 مرتين.
ملاحظة: بالنسبة لبعض الأنسجة ، إذا ظلت النقرة غير المحددة في عنصر التحكم السلبي مرتفعة ، فقد يكون من الضروري إجراء خطوة اختزال قبل الألكلة12. قم بإعداد مخزون إندول حمض الأسيتيك طازجا قبل إضافته إلى العينات. يمكن تخزين العينات في -80 درجة مئوية لعدة أشهر (نقطة توقف).
- تبادل المخزن المؤقت: موازنة أعمدة تبادل المخزن المؤقت باستخدام المخزن المؤقت لتبادل كيمياء النقر (PBS pH 7.8 ، 0.04٪ (بالوزن / المجلد) SDS ، 0.08٪ (حجم / حجم) Triton X-100 و PI (1: 4000)). اتبع تعليمات الشركة المصنعة. تبادل جميع العينات الألكيلية.
ملاحظة: يمكن تخزين العينات المغطاة عند -80 درجة مئوية لعدة أشهر (نقطة توقف). في هذه الخطوة ، يتم التخلص من IAA ، ويتم تبادل المخزن المؤقت بواسطة المخزن المؤقت لكيمياء النقر. يمكن قياس البروتين مرة أخرى بعد خطوة التبادل المؤقت للتأكد من عدم فقد البروتينات أثناء عملية التبادل المؤقت. اعتمادا على نوع الأعمدة المستخدمة للتبادل المؤقت ، يمكن فقد البروتين بشكل كبير. استخدم الأعمدة الموصى بها لتجنب فقدان البروتين. لتخزين العينات ، يوصى بإعداد القسمة الألي. - انقر فوق رد الفعل لتقييم دمج ANL في التجربة
- خذ 40 ميكرولتر من العينات المستخلصة في الخطوة 2.6 وأضف PBS (الرقم الهيدروجيني 7.8) إلى الحجم النهائي 120 ميكرولتر.
- لإعداد تفاعل كيمياء النقر، أضف الكواشف الآتية بالترتيب المعطى ودوامة لمدة 20 ثانية بعد كل إضافة: 1.5 ميكرولتر من ليجند تريازول (مخزون 40 مللي مول)، 1.5 ميكرولتر من ألكاين البيوتين (مخزون 5 مللي مول) و1 ميكرولتر من بروميد النحاس (I) (مخزون 10 ملغم/مل، مذاب في DMSO عن طريق سحب بعناية لأعلى ولأسفل، لا دوامة). أضف الكواشف في أسرع وقت ممكن.
- احتضان العينات طوال الليل في الظلام عند 4 درجات مئوية مع الدوران المستمر.
- أجهزة الطرد المركزي للعينات عند 4 درجات مئوية لمدة 5 دقائق عند 17000 × جم. ستكون بيليه الفيروز قليلا مرئية. نقل الطافت إلى أنبوب جديد.
ملاحظة: قم بإعداد مخزون بروميد النحاس (I) مباشرة قبل الاستخدام لتجنب أكسدة النحاس. يعد الحفاظ على نسبة الأحجام بين العينة المحللة و PBS ثابتة بين العينات أمرا ضروريا لضمان نفس تركيز المنظف النهائي في كل أنبوب. لتسريع تجميع تفاعل كيمياء النقر ، يوصى باستخدام دوامة طاولة مع رفوف للأنابيب. قم بتخزين العينات التي تم النقر عليها عند -80 درجة مئوية لعدة أشهر ، أو عند -20 درجة مئوية لبضعة أسابيع حتى مزيد من المعالجة (نقطة التوقف).
- تحليل اللطخة الغربية لتقييم دمج ANL في التجربة
- قم بتشغيل SDS-PAGE مع 20-40 ميكرولتر من الطافي من تفاعل كيمياء النقر (الخطوة 2.7). استخدم 12٪ جل أكريلاميد ، يعمل في 1٪ SDS ، 250 مللي مول Tris-HCl ، 2 مللي مول جليكاين. اركض حتى يخرج الجزء الأمامي من الجل.
- نقل البروتينات إلى غشاء النيتروسليلوز أو PVDF13.
- احتضان الغشاء طوال الليل عند 4 درجات مئوية باستخدام الجسم المضاد GFP (1: 500 ، يتم ترجمة بروتين GFP بالاشتراك مع MetRS * 5) ، والجسم المضاد للبيوتين (1: 1000) للكشف عن الألكين المنقر ، والذي يقترن بالبيوتين.
- اغسل الجسم المضاد الأساسي مرتين لمدة 10 دقائق وأضف الجسم المضاد الثانوي لمدة 1.5 ساعة.
- اغسل الجسم المضاد الثانوي 2 مرات لمدة 10 دقائق وامسحه ضوئيا (في حالة استخدام الأجسام المضادة المترافقة بالفلوروفور) أو تعرضه للأفلام (في حالة استخدام الأجسام المضادة المترافقة ببيروكسيديز الفجل).
- قم بتحديد إشارة البيوتين باستخدام ImageJ أو برنامج مشابه ، وقم بتقييم العلامات العامة لكل عينة من التجربة ، واكتشف القيم المتطرفة المحتملة. تقييم نسبة الإشارة إلى الضوضاء (وضع علامات عينة ANL على الخلفية من الضوابط السلبية) للتجربة واكتشاف الحيوانات المحتملة التي فشلت في تناول / دمج ANL.
ملاحظة: بالنسبة للعينات ذات الدمج العالي ل ANL ، فإن تنقية البروتين ممكنة نظريا باستخدام الألكينات غير القابلة للانقسام مثل تلك المستخدمة في هذا القسم لتقييم دمج ANL. باستخدام عينات الدماغ ، فإن الخلفية التي تم الحصول عليها في الضوابط السلبية بواسطة مرض التصلب العصبي المتعدد بعد تنقية البروتين باستخدام الألكينات غير القابلة للانقسام مرتفعة للغاية14. لذلك ، تم استخدام الألكاينات الأسهل في التعامل معها وغير القابلة للانقسام فقط في أول عينة عامة وتقييم التجربة. بغض النظر عن نوع الألكاين المخصص لتنقية البروتين ، فمن المستحسن تنفيذ خطوات تحسين جرعة الألكين الموضحة في القسم التالي (الخطوة 2.9).
- انقر فوق التفاعل لتحسين جرعة الألكاين القابلة للانقسام
- تحضير أربعة أنابيب مع 40 ميكرولتر من عينة تمثيلية واحدة (تم الحصول عليها في الخطوة 2.6 وتقييمها في الخطوة 2.8) وإضافة PBS (الرقم الهيدروجيني 7.8) إلى الحجم النهائي 120 ميكرولتر.
- قم بإعداد تفاعل كيمياء النقر كما هو موضح في الخطوة 2.7 ولكن هذه المرة ، أضف أربع كميات مختلفة من DST-alkyne. بالنسبة للألكاين المذكور ، يوصى باختبار 5 ميكرومتر و 15 ميكرومتر و 30 ميكرومتر و 60 ميكرومتر.
- كرر الخطوة 2.8 لتحديد جرعة الألكاين الأنسب للسؤال التجريبي المحدد قيد الدراسة ، بناء على أعلى كفاءة لوضع العلامات مع أدنى إشارة خلفية.
ملاحظة: قبل إخضاع العينات المتبقية لتفاعل النقر ، يجب تحديد الكمية المثلى لأي ألكاين. هناك العديد من خيارات الألكاينات المتاحة تجاريا والتي يمكن استخدامها. وهي تختلف في طريقة الانقسام (على سبيل المثال ، عوامل الضوء أو الاختزال). من الممكن أيضا كيمياء النقر الخالية من النحاس باستخدام الكواشف المعززة بالإجهاد (على سبيل المثال ، كواشف DBCO). غالبا ما تؤدي التغييرات الطفيفة في كمية الكاينات أو كواشف DBCO إلى زيادة الإشارة في التحكم السلبي (الخلفية) بشكل كبير. هنا ، يتم وصف تنقية البروتين باستخدام ألكين مع جسر ثاني كبريتيد قابل للانقسام عن طريق تقليل العوامل (ثاني كبريتيد ألكين البيوتين أو DST-alkyne15). عند استخدام DST-alkyne ، لتشغيل SDS-PAGE (الخطوة 8.1) ، تجنب تحميل المخازن المؤقتة بعوامل اختزال قوية مثل DTT أو β-Mercaptoethanol لمنع انقسام الألكين. في هذه الدراسة ، لا يؤثر التسخين عند 72 درجة مئوية ، لمدة 5 دقائق ، باستخدام 5 مللي متر من N-ethylmaleimide (NEM) في مخزن التحميل المؤقت على استقرار DST-alkyne. يمكن تكرار الخطوة 2.9.2 ، واختبار جرعات أكثر دقة في نطاق أفضل جرعة لوحظت.
- تفاعل النقر التحضيري لتنقية البروتين
- انقر فوق جميع العينات التي تم الحصول عليها في الخطوة 2.6 مع جرعة الألكاين المثلى المحددة في الخطوة 2.9 وتحليل جزء بواسطة SDS-PAGE واللطخة الغربية (الخطوة 2.8).
ملاحظة: تأكد من معايرة الماصات بشكل صحيح لضمان دقة ترقية العينة. يمكن تخزين العينات التي تم النقر عليها عند -80 درجة مئوية لعدة أشهر (نقطة توقف).
- انقر فوق جميع العينات التي تم الحصول عليها في الخطوة 2.6 مع جرعة الألكاين المثلى المحددة في الخطوة 2.9 وتحليل جزء بواسطة SDS-PAGE واللطخة الغربية (الخطوة 2.8).
3. تنقية البروتين
- تبادل العازلة
- قم بإخضاع جميع العينات التي تم النقر عليها لإجراء تبادل المخزن المؤقت كما هو موضح في الخطوة 2.6 ، ولكن استخدم المخزن المؤقت لربط النيوترافيدين كمخزن مؤقت للتوازن (PBS pH 7.4 ، 0.15٪ (بالوزن / المجلد) SDS ، 1٪ (المجلد / المجلد) Triton X-100 و PI (1: 2000)).
ملاحظة: يمكن تخزين العينات المغطاة عند -80 درجة مئوية لعدة أشهر (نقطة توقف). في هذه الخطوة ، يتم التخلص من الألكاين الحر غير المنقر عليه ، ويتم تبادل المخزن المؤقت بواسطة المخزن المؤقت لربط النيوترافيدين.
- قم بإخضاع جميع العينات التي تم النقر عليها لإجراء تبادل المخزن المؤقت كما هو موضح في الخطوة 2.6 ، ولكن استخدم المخزن المؤقت لربط النيوترافيدين كمخزن مؤقت للتوازن (PBS pH 7.4 ، 0.15٪ (بالوزن / المجلد) SDS ، 1٪ (المجلد / المجلد) Triton X-100 و PI (1: 2000)).
- ملزمة لخرز النيوترافيدين
- اغسل حبات نيوترافيدين عالية السعة باستخدام مخزن ربط نيوترافيدين (انظر الخطوة 3.1) ؛ امزج الخرز مع المخزن المؤقت وجهاز الطرد المركزي الخليط لمدة 5 دقائق عند 3000 × جم ، وتخلص من المادة الطافية. كرر ثلاث مرات.
- قم بإعداد ملاط 1: 1 من حبات النيوترافيدين عن طريق إضافة نفس الحجم من الخرز الجاف ومخزن ربط النيوترافيدين.
- توضع جانبا 20-40 ميكرولتر من كل عينة كمحلول منقى مسبقا وتخزنه في -20 درجة مئوية.
- قم بقياس تركيز البروتين (انظر الخطوة 2.4) ، وامزج 100 ميكروغرام من البروتين مع 4 ميكرولتر من ملاط الخرز الذي تم الحصول عليه في الخطوة 3.2.2.
- احتضان الخليط طوال الليل عند 4 درجات مئوية مع الدوران المستمر ، مما يمكن البروتينات الموسومة من الارتباط بالخرز.
ملاحظة: بالنسبة لتفاعل كيمياء النقر ، يمكن ترقية تفاعل تنقية التقارب الأساسي الموصوف في الخطوة 3.2.4. على سبيل المثال ، لتنقية البروتينات من الخلايا العصبية المثيرة للحصين ، يتم خلط 1 ملغ من تحلل البروتين مع 40 ميكرولتر من حبات النيوترافيدين (1: 1 ملاط). يمكن زيادة كمية حبات النيوترافيدين أو تقليلها وفقا لكمية البروتينات المصنفة لكل ملغ من البروتين الكلي ، والتي ستعتمد على نوع الخلية المختار وفترة وضع العلامات ويجب تحديدها تجريبيا.
- يغسل حبات النيوترافيدين وشطف البروتين
- اجمع المواد الطافية عن طريق الطرد المركزي (انظر الخطوة 3.2.1). ضع حصة 20-40 ميكرولتر من كل مادة طافية جانبا لتحليلها لاحقا وقم بتجميد الباقي عند -80 درجة مئوية.
- اغسل الخرز باستخدام محلول غسيل نيوترافيدين المبرد 1 (PBS pH 7.4 ، 0.2٪ (بالوزن / المجلد) SDS ، 1٪ (المجلد / المجلد) Triton X-100 و PI (1: 2000)) عن طريق إضافة المخزن المؤقت ، وترسيب الخرز ، والتخلص من المادة الطافية. كرر هذه الخطوة ثلاث مرات.
- ثم أضف نفس المخزن المؤقت واحتضن الخرز لمدة 10 دقائق تحت الدوران المستمر عند 4 درجات مئوية قبل التخلص من المادة الطافية. كرر هذه الخطوة ثلاث مرات.
- اغسل الخرز كما هو موضح في الخطوات 3.3.2-3.3.3 ولكن باستخدام محلول غسيل نيوترافيدين 2 (1x PBS و pH 7.4 و PI 1: 2000).
- اغسل الخرز كما هو موضح في الخطوة 3.3.2-3.3.3 ولكن باستخدام محلول غسيل نيوترافيدين 3 (50 مللي متر بيكربونات الأمونيوم و PI 1: 2000).
- قم بالتخلص من البروتينات التي تم النقر عليها عن طريق احتضان الخرز لمدة 30 دقيقة عند 20 درجة مئوية مع حجم محلول شطف النيوترافيدين (5٪ (حجم / حجم) β-mercaptoethanol و 0.03٪ (بالوزن / المجلد) SDS) المقابلة لحجم واحد من الخرز الجاف المستخدم.
- حافظ على الخرز معلقا أثناء الشطف عن طريق التقليب المستمر (1000 دورة في الدقيقة) في شاكر حراري. يذب مرتين ويمزج بين كل من الشطء.
ملاحظة: ينطبق الطرد المركزي الذي تم إعداده لفصل الجزء الصلب من الملاط (الخرز) والطور المائي (الطاف)، كما هو موضح في الخطوة 3.2.1، على الخطوات 3.3.1-3.3.7. يمكن زيادة كمية SDS إذا لم يكتمل شطف البروتين. ومع ذلك ، مع كميات أعلى من 0.08٪ -0.1٪ من SDS ، تبدأ البروتينات غير المرتبطة على وجه التحديد بالخرز. β-mercaptoethanol متقلب وسام. ينصح باستخدام غطاء محرك السيارة للخطوات 3.3.6-3.3.7. يجب تشغيل العينات التي تم جمعها في الخطوتين 3.2.3 و 3.3.1 بواسطة SDS-PAGE وتقييمها بواسطة Western Blot (انظر الخطوة 2.8) لتقييم كفاءة تنقية التقارب (الخطوة 3.3).
- تقييم البروتينات المستخلصة
- قم بتحميل 1/3 من العينات المستخلصة إلى SDS-PAGE (انظر الخطوة 2.8.1).
- قم بتلطيخ الجل لتصور البروتينات باستخدام طريقة عالية الحساسية ، مثل تلطيخ الفضة أو طريقة الفلورسنت.
- إذا كانت العينات تتمتع بالجودة المتوقعة ، مما يعني أن هناك 3-4 أضعاف البروتين في العينات المصنفة ANL مقارنة بالتحكم السلبي ، يمكن تحديد البروتينات المستخلصة من خلال طرق قياس الطيف الكتلي الروتينية مثل تلك الموضحة في المرجع5.
النتائج
باتباع البروتوكول الموصوف (الملخص في الشكل 1) ، تم إعطاء ANL للفئران إما عن طريق الحقن داخل الصفاق يوميا (400 mM ANL 10 مل / كجم ، Nex-Cre :: MetRS *) لمدة 7 أيام ، أو عن طريق مياه الشرب (0.7٪ مالتوز ، 1٪ ANL ، CamkII-Cre::MetRS *) لمدة 21 يوما. بعد وضع العلامات ، تم تشريح مناطق الدماغ المقابلة ، وتحليلها ، وألكلتها ، والنقر عليها. تم تحليل تفاعلات النقر بواسطة SDS-PAGE و Western Immunoblot. يتم عرض صور تمثيلية للتجارب في الشكل 2 لإدارة ANL عن طريق حقن IP وفي الشكل 3 لإدارة ANL عن طريق مياه الشرب. لاحظ أن الهدف من الأرقام هو إظهار أن كلا بروتوكولي وضع العلامات يعملان ، وليس مقارنتهما. المقارنة غير ممكنة لأن مجموعات الخلايا العصبية المختلفة مصنفة في التجربتين المعروضتين (الخلايا العصبية المثيرة للحصين والقشرة ، والخلايا العصبية Purkinje في المخيخ).
تقدم تجربة أخرى مثالا لتحديد تركيز الألكاين الأمثل القابل للانقسام في التوقيت الصيفي (الشكل 4). في هذا المثال، يكون التغير في الطي بين العينة المصنفة والمجموعة الضابطة أعلى عند تركيز ألكاين مقداره 14 μM. ثم يطبق تركيز الألكاين هذا على جميع العينات. بعد التحقق من وضع العلامات على كل عينة في التجربة بكمية الألكاين المختارة ، خضعت جميع العينات لتنقية البروتينات الموسومة ANL / نقر البيوتين عن طريق ربط التقارب باستخدام حبات النيوترافيدين (الشكل 5). في هذه الخطوة ، ترتبط البروتينات بالخرز ، وتغسل ، ثم تستخلص لاحقا عن طريق تقليل جسر ثاني كبريتيد الموجود في DST-alkyne. بعد هذه الخطوة الأخيرة ، يظل البيوتين وجزء من الألكاين مرتبطين بالخرز. يتم استرداد البروتينات المحتوية على ANL (المرتبطة ببقية الألكين) في المخزن المؤقت للشطف. لتقييم كفاءة خطوة الشطف ، يتم تحميل ثلث حجم الشطف على هلام SDS-PAGE ويتم تصوره باستخدام طريقة صبغ البروتين الكلي الحساسة. يجب ملاحظة فرق شدة 3 أضعاف على الأقل من إجمالي صبغة البروتين بين الضوابط السلبية والعينات التي تحمل علامة ANL لتحقيق نتائج قابلة للتفسير باستخدام قياس الطيف الكتلي. سيتبع إكمال جميع الخطوات الموضحة في هذا البروتوكول إعداد عينة MS والحصول عليها وتحليلها5. على الرغم من عدم وجود متطلبات خاصة لمرض التصلب العصبي المتعدد (قد يستخدم كل مختبر بروتوكول MSالروتيني 5،10) ، يجب أن يوضع في الاعتبار أن كمية البروتينات المنقاة ستكون منخفضة بشكل عام (في ترتيب النانوجرامات). يقدم الشكل 6 مثالا على نتائج MS مع إثراء واضح في العينة الموسومة ANL مقارنة بالمجموعة الضابطة (الشكل 6 أ). كان هذا الاختلاف واضحا بالفعل في إجمالي صبغة البروتين الموضحة في الشكل 5. إلى جانب التغيرات في شدة الببتيد ، هناك أيضا بروتينات فريدة موجودة في كلتا العينتين (الشكل 6 ب).
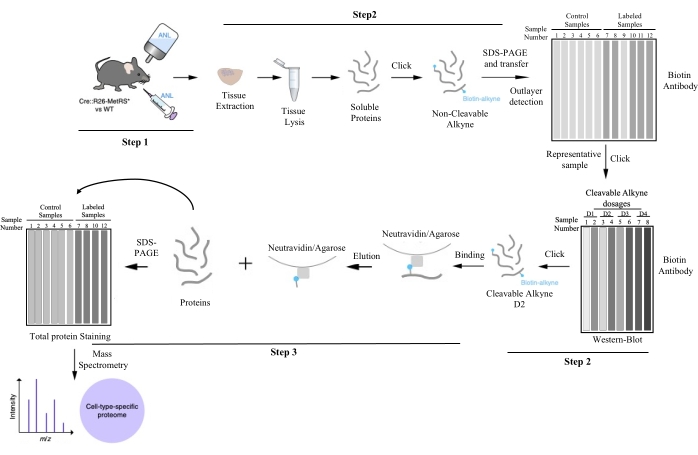
الشكل 1: خط أنابيب العمل لتنقية البروتين الخاص بنوع الخلية بواسطة BONCAT. بعد وضع العلامات على البروتين باستخدام ANL ، يتم تشريح الأنسجة ذات الاهتمام وتحليلها ، ووضع علامة عليها باستخدام البيوتين عن طريق كيمياء النقر ، ويتم تقييم كمية الملصقات لكل عينة بواسطة BONCAT. يمكن التمييز بين القيم المتطرفة (التي فشلت في دمج ANL) والعينات التمثيلية في هذه الخطوة. يتم النقر فوق إحدى العينات التمثيلية مرة أخرى للعثور على جرعة الألكاين المحسنة القابلة للانقسام لتنقية البروتين اللاحقة. يتم تطبيق جرعة الألكاين التي تحقق أفضل نسبة إشارة إلى ضوضاء على كل نسخة بيولوجية. يتم الحصول على البروتينات الخاصة بنوع الخلية عن طريق تنقية التقارب. تتم دراسة العينات النقية عن طريق قياس الطيف الكتلي ، ويتم تحديد البروتينات. تم تعديل هذا الرقم من Alvarez-Castelao et al. (2017) 6. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
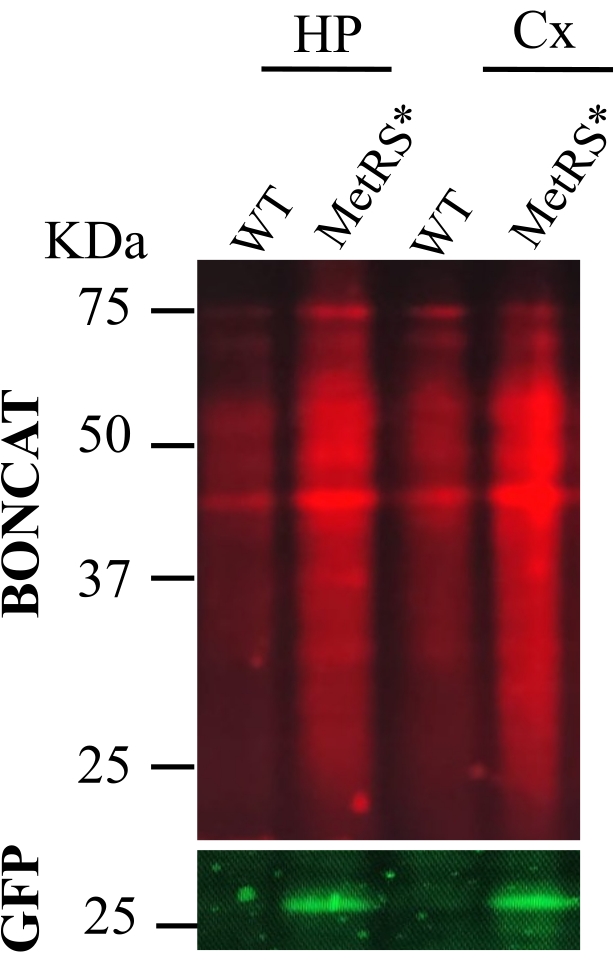
الشكل 2: إعطاء ANL عن طريق الحقن داخل الصفاق (IP). تم إجراء BONCAT لتقييم وضع العلامات على البروتين في الحصين (HP) والقشرة (CX) بعد وضع العلامات الأيضية للبروتينات مع ANL عن طريق حقن IP اليومية لمدة 7 أيام. تم النقر على عينات الفئران من النوع البري كعنصر تحكم سلبي (بالوزن) بالتوازي مع العينات الموسومة (MetRS *). البروتينات المصنفة هي من الخلايا العصبية المثيرة باستخدام خط Nex-Cre::MetRS *16. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 3: إعطاء ANL عن طريق مياه الشرب. تم إجراء BONCAT لتقييم وضع العلامات على البروتين في الخلايا العصبية Purkinje في المخيخ بعد إعطاء ANL إلى GAD-Cre :: MetRS * الفئران عن طريق مياه الشرب لمدة 21 يوما. يوضح الشكل عنصر تحكم سلبي (بالوزن) وعينة مصنفة (MetRS *) محللة ونقر عليها بالتوازي. تم تعديل هذا الرقم من Alvarez-Castelao et al. (2017) 6. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 4: معايرة جرعة ألكاين التوقيت الصيفي. يتم اختيار تضاعف حيوي واحد لكل تجربة كعينة تمثيلية لمعايرة تركيز الألكاين الأمثل. تم اختبار ثلاثة تركيزات (14 و 28 و 56 ميكرومتر) من الألكاين هنا في تفاعل النقر ل BONCAT. تحدد نسبة وضع العلامات بين العينة الموسومة ب ANL (MetRS *) والتحكم السلبي (بالوزن) نسبة الإشارة إلى الضوضاء (الموضحة في الرسم البياني). 14 μM هو أفضل تركيز ألكاين تم الحصول عليه في هذه التجربة. تم استخدام أنسجة القشرة من خط الماوس المسمى ANL Nex::MetRS * لهذه التجربة. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 5: البروتينات النقية. تم تنقية البروتينات المصنفة من الخلايا العصبية Purkinje وتلطيخها باستخدام SYPRO Ruby. تم تعديل هذا الرقم من Alvarez-Castelao et al. (2017) 6. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.

الشكل 6: تحديد البروتين وقياسه كميا. تم الحصول على بروتين خلية Purkinje عن طريق قياس الطيف الكتلي باستخدام المخيخ من خط الماوس GAD-Cre::MetRS * كمادة أولية. (A) زيادة في وفرة (كثافة الببتيد) للبروتينات المحددة في العينات الموسومة ANL مقارنة بالفئران من النوع البري (WT). (ب) تم الحصول على بروتين Purkinje عن طريق تجميع البروتينات المخصبة في العينات الموسومة ANL في A (المحددة بكثافة >3 أضعاف في الفئران MetRS * مقارنة بالوزن) ، والبروتينات الفريدة الموجودة في الفئران المعبرة عن MetRS *. تم تعديل هذا الرقم من Alvarez-Castelao et al. (2017) 6. الرجاء الضغط هنا لعرض نسخة أكبر من هذا الشكل.
Discussion
الجوانب الحاسمة للبروتوكول هي ؛ إدراج الضوابط السلبية ، وجود ما يكفي من التكرارات البيولوجية ، ومسار إدارة ANL ، والكمية ، والمدة ، وألكلة العينات ، وتركيز الألكين ، والقضاء على β-mercaptoethanol عند استخدام DST-alkyne.
من المهم تضمين عينات التحكم السلبية الناتجة عن الحيوانات التي تحمل علامة ANL بدون سائق Cre وبالتالي لا يوجد تعبير MetRS *. يجب إخضاع هذه العينات لكل خطوة موصوفة في البروتوكول بالتوازي مع العينات المأخوذة من فئران MetRS * التي تحمل علامة ANL. العينات التي لم يتم النقر فوقها ليست عناصر تحكم صالحة، حيث أن أي نتائج يتم تحقيقها باستخدام عنصر التحكم هذا فقط قد تكون بسبب نقرة غير محددة. لم نلاحظ دمج ANL في الخلايا التي لا تعبر عن جين MetRS * ، ولا تعبير MetRS * في الخلايا التي لا تحتوي على Cre. وبالتالي ، يمكن استخدام الوزن المسمى ANL كعنصر تحكم سلبي.
بالنظر إلى أن البروتوكول الموصوف هنا يتكون من العديد من الخطوات التي يمكن أن تفقد فيها العينات ، يوصى بحساب النسخ المتماثلة البيولوجية مع مراعاة الفشل الفني. بالنسبة لعينات الدماغ ، هناك ما يقرب من 30٪ من الخسارة المتكررة.
وصفنا هنا طريقين ومدد إدارة ANL. هذا لا يستبعد أن طرق الإدارة الأخرى (على سبيل المثال ، إضافة ANL إلى الطعام) ، تعمل بشكل جيد على قدم المساواة. فيما يتعلق بكمية ANL المدارة ، تم إجراء التجارب الموضحة هنا باستخدام كميات عالية نسبيا من ANL. من الممكن أيضا وضع العلامات بكميات أقل اعتمادا على الإعداد التجريبي. أقصر فترة زمنية لوضع العلامات ANL المبلغ عنها في هذا البروتوكول هي 1 أسبوع ، وأطول 21 يوما. يمكن تطبيق فترات وضع العلامات الأقصر أو الأطول ، لكننا لم نحددها. يجب على الباحثين تحديد مسار إدارة ANL ، وجرعة ANL ، وفترة وضع العلامات ANL المناسبة للسؤال التجريبي المحدد قيد الدراسة من خلال النظر في الخصائص الأيضية للأنسجة ، ونوع الخلية محل الاهتمام ، والسؤال التجريبي قيد الدراسة.
تعد عينة الألكلة ، والمعروفة أيضا باسم السد ، خطوة مهمة لتجنب النقرفي الخلفية 17. عندما يتم إجراء الألكلة بشكل صحيح ، يتم تقليل النقرة غير المحددة كما تراقبها عينات التحكم ، ويكون الفرق بين عينات التحكم السلبية والعينات الموسومة ANL أكبر. القضاء على إندول حمض الأسيتيك الحر بعد الألكلة هو أيضا خطوة رئيسية. إن وجود كميات صغيرة من إندول حمض الأسيتيك أثناء تفاعل النقر سيحد من كفاءته. في بعض الأحيان ، يجب تكرار خطوة التحلية التي تلغي أيضا إندول حمض الأسيتيك (الخطوة 2.6) ، لضمان الإزالة الصحيحة ل IAA.
هناك العديد من كواشف البيوتين الألكاين و -DBCO المتاحة تجاريا من مجموعة متنوعة من الشركات. الاختلافات الرئيسية فيما بينها تتعلق بطول سلسلة رابط البولي إيثيلين جليكول (PEG) وغياب ووجود ونوع المجموعات القابلة للانقسام. بغض النظر عن النوع المستخدم ، تؤدي الكميات الزائدة من الألكاين إلى نقرة غير محددة للبروتينات التي تحمل الأحماض الأمينية الطبيعية فقط. يمكن منع ذلك بسهولة عن طريق المعايرة الدقيقة والدقيقة لكمية الألكاين. كما هو موضح ، فإن أفضل طريقة لتحقيق ذلك هي استخدام العينات المحللة والألكيلية الفعلية لاستخدامها في خطوات تنقية البروتين اللاحقة (الخطوة 2.6) وتحليل قياس الطيف الكتلي.
عند استخدام DST-alkynes في تفاعل النقر ، يقلل β-mercaptoethanol من جسر ثاني كبريتيد ويفصل البروتينات المصنفة عن الخرز في خطوة الشطف (الخطوة 3.3). يجب إزالة β-mercaptoethanol من العينات للسماح بالهضم الأنزيمي اللازم لمرض التصلب العصبي المتعدد. هناك عدة طرق للقيام بذلك (على سبيل المثال ، التجفيد18 ، الاستئصال من هلام19 ، أو التنظيف باستخدام أعمدة S-Trap20) ، ويجب أن يتم الاختيار من قبل مختبر MS الذي يعالج العينات.
يجب توجيه التعديلات واستكشاف الأخطاء وإصلاحها للطريقة لتحسين الخطوات الحرجة المذكورة في البروتوكول. على سبيل المثال ، إذا كان هناك الكثير من التباين ، أضف المزيد من التكرارات البيولوجية ؛ إذا كان وضع العلامات منخفضا جدا ، فقم بزيادة تركيز ANL ، أو استخدم فترات زمنية أطول لوضع العلامات ، أو اختبر طرق إدارة ANL الأخرى التي يمكن أن تكون أكثر كفاءة للأنسجة المدروسة. بالنسبة إلى ألكلة البروتين، يمكن تنفيذ خطوة اختزال سابقة لإضافة إندول حمض الأسيتيك (IAA).
القيد الرئيسي لهذه الطريقة هو تنقية البروتينات الناشئة عن مجموعات الخلايا الصغيرة حتى لو تم تشريح منطقة الأنسجة الصغيرة. ومع ذلك ، يصعب أيضا الوصول إلى البروتينات المكونة من مجموعات الخلايا العديدة المنتشرة على مناطق الأنسجة الأكبر. ومع ذلك ، لا يزال من الممكن تطبيق تقنية وضع العلامات في الجسم الحي الموصوفة هنا لتقييم أنواع الخلايا المشار إليها عن طريق التصوير (على سبيل المثال ، مع FUNCAT أو FUNCAT-PLA21).
هذه الطريقة هي حاليا الطريقة الوحيدة المتاحة للدراسة في الجسم الحي للبروتينات الخاصة بنوع الخلية بناء على البروتينات كاملة الطول وللتصور في الموقع للبروتينات الكاملة الخاصة بنوع الخلية. يمكن أيضا استخدام الأحماض الأمينية غير المتعارف عليها الأخرى مثل azidohomoalanine (AHA) لوضع العلامات على البروتين في الجسم الحي وتنقية البروتينات ، ولكنها تفتقر إلى خصوصية نوع الخلية22,23. الأساليب الأخرى مثل puromycin مناسبة لتوفير صورة ثابتة لتخليق البروتين24,25. ومع ذلك ، من الممكن استخدام الأحماض الأمينية غير المتعارف عليها لفترات أطول من وضع العلامات ، مما يعكس أيضا تدهور البروتين ويظهر بروتينا خلويا أكثر دقة. تستخدم الطرق القائمة على BioID لتحديد البروتينات في مناطق تحت خلوية محددة ، بغض النظر عن لحظة / مكان تخليقها26.
في خط الماوس الذي أنشأناه (متوفر من مختبر جاكسون ، المخزون رقم 028071) ، يتم التعبير عن سينثيتاز الميثيونين tRNA الطافر (MetRS *) الذي يسمح بدمج ANL في الخلايا بطريقة تعتمد على Cre. باستخدام خط الماوس هذا كأداة ، من الممكن التعبير حصريا عن MetRS * في أنواع الخلايا التي تتوفر لها خطوط Cre-driver. يمنح هذا الترتيب الطريقة تنوعا كبيرا ، مما يجعلها مفيدة في كل مجال من مجالات البحوث الطبية الحيوية تقريبا.
Disclosures
يعلن المؤلفون عدم وجود مصالح مالية متنافسة.
Acknowledgements
يتم تمويل B.A-C من قبل وزارة العلوم والابتكار الإسبانية (Ramón y Cajal-RYC2018-024435-I) ، من قبل مجتمع مدريد المتمتع بالحكم الذاتي (Atracción de Talento-2019T1 / BMD-14057) ، ومنح MICINN (PID2020-113270RA-I00). يتم تمويل R. A-P من قبل مجتمع مدريد المستقل (Atracción de Talento-2019T1 / BMD-14057). يتم تمويل E.M.S. من قبل جمعية ماكس بلانك ، وهي جائزة الباحث المتقدم من مجلس البحوث الأوروبي (منحة 743216) ، DFG CRC 1080: الآليات الجزيئية والخلوية للتوازن العصبي ، و DFG CRC 902: المبادئ الجزيئية للتنظيم القائم على الحمض النووي الريبي. نشكر DC Dieterich و P. Landgraf على نصائحهم الفنية وتوليف DST-Alkyne. نشكر E. Northrup و S. Zeissler و S. Gil Mast ومرفق الحيوانات في MPI لأبحاث الدماغ على دعمهم الممتاز. نشكر ساندرا جوبلز على مشاركة خط الماوس Nex-Cre. نشكر أنطونيو جي كاروجيو على مساعدته في تحرير اللغة الإنجليزية. بكالوريوس - ج. تصميم التجارب وإجرائها وتحليلها. B.N-A ، D.O.C ، R.A-P ، C. E. ، و S. T. د. إجراء التجارب وتحليلها. B.A-C و E.M.S. صممت التجارب ، وأشرفت على المشروع ، كتب B.A-C الورقة. قام جميع المؤلفين بتحرير الورقة.
Materials
| Name | Company | Catalog Number | Comments |
| 12% Acrylamide gels | GenScript | SurePAGE, Bis-Tris, 10 x 8, 12% | |
| β-Mercaptoethanol | Sigma | M6250 | Toxic; use a lab coat, gloves and a fume hood. |
| Ammonium bicarbonate | Sigma | 9830 | Toxic; use a lab coat, gloves and a fume hood |
| ANL | Synthesized as described previously for AHA (see references 5 and 11) | ||
| ANL-HCl | IrishBotech | HAA1625.0500 | |
| Benzonase | Sigma | E1014 | |
| Biotin alkyne | Thermo, | B10185 | |
| Chicken antibody anti-GFP | Aves | 1020 | |
| Complete EDTA-free protease inhibitor | Roche | 4693132001 | Toxic; use a lab coat and gloves. |
| Copper (I) bromide | Sigma | 254185 | 99.999% (wt/wt) |
| Disulfide tag (DST)-alkyne | Synthesized as reported in reference number 15, in which it is referred to as probe 20 | ||
| DMSO | Sigma | 276855 | |
| Filters | Merk | SCGP00525 | |
| Iodo acetamide (IAA) | Sigma | I1149 | |
| IR anti chicken 800 | LI-COR | IRDye 800CW | Donkey anti-Chicken Secondary Antibody |
| IR anti rabit 680 | LI-COR | IRDye 680RD | Goat anti-Rabbit IgG Secondary Antibody |
| Maltose | Sigma | M9171 | |
| Manual Mixer | BioSpec Products | 1083 | |
| NaCl | Sigma | S9888 | |
| N-ethylmaleimide | Sigma | 4259 | Toxic; use a lab coat, gloves and a fume hood. |
| NeutrAvidin beads | Pierce | 29200 | |
| Nitrocellulose membrane | Bio-rad | 1620112 | |
| PBS 1X | Thermo | J62036.K2 | |
| PBS 1X pH 7.8 | Preparation described in reference number 5 | ||
| PD SpinTrap G-25 columns | GE Healthcare | Buffer exchange | |
| Pierce BCA Protein Assay Kit | Thermo, | 23225 | Reagents in the Pierce BCA Protein Assay Kit are toxic to aquatic life. |
| Polyclonal rabbit anti-biotin antibody | Cell Signaling | 5597 | |
| PVDF membrane | Millipore | IPVH00010 | |
| SDS 10% | Sigma | 71736 | |
| SDS-PAGE Running buffer MOPS | GenScript | M00138 | |
| SYPRO Ruby stain | Sigma | S4942 | |
| Table automatic Vortexer | Eppendorf | Mixmate | |
| Triazole ligand | Sigma | 678937 | |
| Triton X-100 | Sigma | T9284 | |
| Water | Sigma | W4502 | Molecular biology grade |
References
- Alvarez-Castelao, B., Schuman, E. M. The regulation of synaptic protein turnover. Journal of Biological Chemistry. 290 (48), 28623-28630 (2015).
- Sutton, M. A., Schuman, E. M. Dendritic protein synthesis, synaptic plasticity, and memory. Cell. 127 (1), 49-58 (2006).
- Dorrbaum, A. R., Alvarez-Castelao, B., Nassim-Assir, B., Langer, J. D., Schuman, E. M. Proteome dynamics during homeostatic scaling in cultured neurons. Elife. 9, 52939(2020).
- Flexner, J. B., Flexner, L. B., Stellar, E. Memory in mice as affected by intracerebral puromycin. Science. 141 (3575), 57-59 (1963).
- Alvarez-Castelao, B., Schanzenbacher, C. T., Langer, J. D., Schuman, E. M. Cell-type-specific metabolic labeling, detection and identification of nascent proteomes in vivo. Nature Protocols. 14 (2), 556-575 (2019).
- Alvarez-Castelao, B., et al. Cell-type-specific metabolic labeling of nascent proteomes in vivo. Nature Biotechnology. 35 (12), 1196-1201 (2017).
- Ngo, J. T., et al. Cell-selective metabolic labeling of proteins. Nature Chemical Biology. 5 (10), 715-717 (2009).
- Mahdavi, A., et al. Engineered aminoacyl-tRNA synthetase for cell-selective analysis of mammalian protein synthesis. Journal of the American Chemical Society. 138 (13), 4278-4281 (2016).
- Yuet, K. P., et al. Cell-specific proteomic analysis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 112 (9), 2705-2710 (2015).
- Patel, V. J., et al. A comparison of labeling and label-free mass spectrometry-based proteomics approaches. Journal of Proteome Research. 8 (7), 3752-3759 (2009).
- Link, A. J., Vink, M. K., Tirrell, D. A. Preparation of the functionalizable methionine surrogate azidohomoalanine via copper-catalyzed diazo transfer. Nature Protocols. 2 (8), 1879-1883 (2007).
- Landgraf, P., Antileo, E. R., Schuman, E. M., Dieterich, D. C. BONCAT: Metabolic labeling, click chemistry, and affinity purification of newly synthesized proteomes. Methods in Molecular Biology. 1266, Clifton, N.J. 199-215 (2015).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Analysis of proteins by immunoblotting. Cold Spring Harbor Protocols. 2021 (12), (2021).
- Mellacheruvu, D., et al. The CRAPome: a contaminant repository for affinity purification-mass spectrometry data. Nature Methods. 10 (8), 730-736 (2013).
- Szychowski, J., et al. Cleavable biotin probes for labeling of biomolecules via azide-alkyne cycloaddition. Journal of the American Chemical Society. 132 (51), 18351-18360 (2010).
- Goebbels, S., et al. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44 (12), 611-621 (2006).
- van Geel, R., Pruijn, G. J., van Delft, F. L., Boelens, W. C. Preventing thiol-yne addition improves the specificity of strain-promoted azide-alkyne cycloaddition. Bioconjugate Chemistry. 23 (3), 392-398 (2012).
- O'Fagain, C. Lyophilization of proteins. Methods in Molecular Biology. 244, Clifton, N.J. 309-321 (2004).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nature Protocols. 1 (6), 2856-2860 (2006).
- Elinger, D., Gabashvili, A., Levin, Y. Suspension trapping (S-Trap) is compatible with typical protein extraction buffers and detergents for bottom-up proteomics. Journal of Proteome Research. 18 (3), 1441-1445 (2019).
- tom Dieck, S., et al. Direct visualization of newly synthesized target proteins in situ. Nature Methods. 12 (5), 411-414 (2015).
- McShane, E., et al. Kinetic analysis of protein stability reveals age-dependent degradation. Cell. 167 (3), 803-815 (2016).
- Calve, S., Witten, A. J., Ocken, A. R., Kinzer-Ursem, T. L. Incorporation of non-canonical amino acids into the developing murine proteome. Scientific Reports. 6, 32377(2016).
- David, A., et al. Nuclear translation visualized by ribosome-bound nascent chain puromycylation. Journal of Cell Biology. 197 (1), 45-57 (2012).
- Schmidt, E. K., Clavarino, G., Ceppi, M., Pierre, P. SUnSET, a nonradioactive method to monitor protein synthesis. Nature Methods. 6 (4), 275-277 (2009).
- Roux, K. J., Kim, D. I., Burke, B., May, D. G. BioID: A screen for protein-protein interactions. Current Protocols in Protein Science. 91, 11-15 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved