Method Article
טיהור וזיהוי חלבונים ספציפיים מסוג תא מרקמות מורכבות באמצעות קו עכברים מוטנטי מתיונין tRNA Synthetase
In This Article
Summary
פרוטוקול זה מתאר כיצד לבצע תיוג חלבונים ספציפיים לסוג התא עם אזידונורלאוצין (ANL) באמצעות קו עכבר המבטא מוטציה L274G-מתיונין tRNA synthetase (MetRS*) ואת השלבים הדרושים לבידוד חלבונים ספציפיים לסוג התא המסומנים. אנו מתארים שני מסלולי מתן ANL אפשריים בעכברים חיים על ידי (1) מי שתייה ו-(2) זריקות תוך-צפקיות.
Abstract
הבנת הומאוסטזיס של חלבונים in vivo היא המפתח לדעת כיצד התאים פועלים הן במצב פיזיולוגי והן במצב של מחלה. הפרוטוקול הנוכחי מתאר תיוג in vivo וטיהור לאחר מכן של חלבונים מסונתזים חדשים באמצעות קו עכברים מהונדס כדי לכוון את תיוג החלבונים לאוכלוסיות תאיות ספציפיות. זהו קו אינדוקטיבי על ידי ביטוי Cre recombinase של L274G-מתיונין tRNA synthetase (MetRS*), המאפשר שילוב אזידונורלאוצין (ANL) לחלבונים, אשר אחרת לא יתרחש. באמצעות השיטה המתוארת כאן, ניתן לטהר פרוטאומים ספציפיים לסוג התא המסומנים in vivo ולזהות שינויים עדינים בתכולת החלבון עקב הפחתת מורכבות הדגימה.
Introduction
הומאוסטזיס של חלבון Aberrant נגרמת על ידי חוסר איזון בסינתזת חלבונים והשפלה. מספר מחלות קשורות לשינויים בהומאוסטזיס חלבונים. סימן ההיכר של מחלות מסוימות הוא נוכחות של אגרגטים במקומות תת-תאיים שונים ובאזורי מוח. הומאוסטזיס של חלבונים לא רק חשוב במחלות, אלא גם ממלא תפקיד מכריע בתפקוד תקין של איברים ותאים1. לדוגמה, סינתזת חלבונים נחוצה לצורות רבות של פלסטיות עצבית2,3, כפי שנקבע על ידי שימוש במעכבים כימיים החוסמים את סינתזת החלבון4. עם זאת, לא ברור באילו סוגי תאים הפרוטאום משתנה כדי לתמוך בלמידה ובזיכרון, וגם לא מובן אילו חלבונים ספציפיים בכל סוג תא מגבירים או יורדים בסינתזה או בהתפרקות שלהם. לפיכך, מחקר מקיף של הומאוסטזיס חלבונים דורש את היכולת להבדיל פרוטאומים המגיעים מסוגי תאים ספציפיים. ואכן, זיהוי פרוטאומים ספציפיים לסוג התא כדי לחקור תהליכים תאיים המתרחשים בסביבה רב-תאית היה מכשול חשוב בפרוטאומיקה. מסיבה זו, פיתחנו טכניקה המשתמשת בביטוי MetRS* בשילוב עם שיטות ביו-אורתוגונליות שהוכחה כדרך יעילה לזהות ולטהר פרוטאומים ספציפיים מסוג תא, ולמלא את הפער הזה 5,6,7.
הביטוי של MetRS* מוטנטי (MetRS L274G) מאפשר טעינה של ה-ANL האנלוגי הלא-קנוני מתיונין לתוך ה-tRNA 8,9 המתאים ושילובו לאחר מכן בחלבונים. כאשר ביטוי MetRS* מווסת על ידי מקדם ספציפי לסוג התא, חומצת האמינו הלא-קנונית תשולב בחלבונים באופן סלקטיבי של התא. ברגע ש-ANL משולב בחלבונים, הוא יכול לתפקד באופן סלקטיבי על ידי כימיה של קליקים ולאחר מכן על ידי הדמיה (FUNCAT) או על ידי Western Immunoblot (BONCAT). לחלופין, חלבונים יכולים להיות מטוהרים באופן סלקטיבי ומזוהים על ידי ספקטרומטריית מסה (MS). באמצעות טכנולוגיה זו, יצרנו קו עכבר המבטא את החלבון MetRS* תחת שליטה של רקומבינאז Cre. בהתחשב במספר ההולך וגדל של קווי Cre-mouse הזמינים, ניתן להשתמש במערכת MetRS* בכל תחום כדי לחקור כל סוג תא מכל רקמה שעבורה קיים קו Cre. תיוג חלבונים עם ANL אפשרי במבחנה או in vivo, ואינו משנה את התנהגות העכבר או את שלמות החלבון6. ניתן להתאים את זמן התיוג לשאלה המדעית של כל חוקר, לתייג חלבונים מסונתזים חדשים (זמני תיוג קצרים יותר) או פרוטאומים שלמים (זמני תיוג ארוכים יותר). השימוש בטכניקה זו מוגבל על ידי מספר התאים מהסוג שהחוקר מוכן ללמוד; מכאן שבידוד חלבונים מסוגי תאים עם מספרים נמוכים או קצבי חילוף חומרים נמוכים אינו אפשרי בשיטה זו. מטרת השיטה המוצגת היא לזהות חלבונים/פרוטאומים ספציפיים לסוג התא המסומנים in vivo. בפרוטוקול זה אנו מתארים כיצד לתייג פרוטאומים ספציפיים לתאים עם ANL בעכברים חיים ולטהר את החלבונים המסומנים. לאחר הטיהור, ניתן לזהות חלבונים על ידי פרוטוקולים שגרתיים של ספקטרומטריית מסה 5,10. הפחתת מורכבות הדגימה המושגת בשיטה זו על ידי טיהור סלקטיבי של חלבונים מאוכלוסיות תאים ספציפיות מאפשרת לנסיין לזהות שינויים עדינים בפרוטאומים, למשל, בתגובה לשינויים סביבתיים. טיהור החלבונים המסומנים יכול להיות מושג תוך ~ 10 ימים, לא כולל ניתוח הטרשת הנפוצה או תקופת התיוג. במאמר זה נתאר שתי שיטות למתן ANL ל-MetRS* המבטאות עכברים, כלומר (1) הוספת חומצת האמינו במי השתייה, ו-(2) החדרת ANL באמצעות זריקות תוך-צפקיות. ללא קשר לשיטה שנבחרה לניהול NAL, שלבי הבידוד והטיהור זהים (משלב 2 ואילך).
Protocol
כל הניסויים בבעלי חיים בוצעו באישור משרדי הממשלה המקומיים בגרמניה (RP Darmstadt; פרוטוקולים: V54-19c20/15-F122/14, V54-19c20/15-F126/1012) או ספרד (הוועדה לניסויים בבעלי חיים ב- UCM וייעוץ סביבתי של Comunidad de Madrid, מספר פרוטוקול: PROEX 005.0/21) והם תואמים לכללי אגודת מקס פלנק ולתקנות הספרדיות ופועלים לפי הנחיות האיחוד האירופי לרווחת בעלי חיים.
1. תיוג מטבולי in vivo עם ANL
- שתייה:
- ממיסים ANL ומלטוז במי השתייה הרגילים של העכברים. ריכוז המלטוז המומלץ הוא 0.7% (wt/vol). הכמות המרבית של ANL שמוסיפים למי השתייה היא 1% (wt/vol). לאחר שהתערובת מוכנה, עקרו אותה על ידי סינון ואחסנו אותה בטמפרטורה של 4 מעלות צלזיוס.
- ספק את התערובת שהוכנה בשלב 1.1 לעכברים. החליפו בקבוקים לעתים קרובות (למשל, כל 3 ימים) כדי למנוע זיהומים, ובדקו אותם מדי יום כדי לחפש זיהום או סתימה אפשריים. עקוב אחר כמות המים השיכורים מדי יום על ידי שקילתם, כדי לדעת את צריכת ה- ANL של העכברים.
הערה: תקופת הסימון המקסימלית המוערכת כאן היא 3 שבועות באמצעות ריכוז ANL של 1% במי השתייה, מה שהביא לתיוג הניתן לזיהוי היטב במוח. תיוג טוב יכול להיות מושגת גם בתוך 2 שבועות. לא זמני תיוג קצרים יותר, לא נקודות זמן ארוכות יותר, ולא כמויות ANL אחרות נחקרו על ידינו באמצעות שיטת ניהול זו, אשר אינו אומר כי האמור לעיל לא יעבוד. שיעורי השילוב של ANL עשויים להשתנות בהתאם לרקמה הנחקרת או לסוג התא. זמן התיוג יכול להשתנות בהתאם לשאלה המדעית; לדוגמה, אם יש לסמן פרוטאומים, יש לחשב את זמן התיוג בפונקציה של זמן מחצית החיים הממוצע של החלבונים ברקמה הנחקרת. אם האינטרס הוא רק לזהות חלבונים מסונתזים חדשים, ניתן לקצר את הזמנים. תקופות התיוג ומינוני ה-ANL צריכים להיבדק אמפירית עבור כל מצב ניסיוני וסוג תא של עניין.
- ניהול תוך-צפקי:
- יש להמיס ANL בתמיסת NaCl פיזיולוגית ל-400 מ"מ, חיץ מלח פוספט (PBS) או מים.
- ודא כי האוסמולריות של התמיסה נמצאת בטווח הפיזיולוגי. כאן, 10 מ"ל / ק"ג משקל גוף של תמיסת ANL מנוהל לעכברים.
הערה: תיוג טוב בנוירונים המעוררים של המוח מתקבל בהצלחה על ידי זריקה תוך-צפקית יומית אחת (IP) עם 400 mM ANL למשך שבוע אחד. לא ריכוזי ANL נמוכים יותר ולא תקופות תיוג אחרות על ידי זריקות IP נבדקו במחקר זה, מה שלא אומר שהם לא יעבדו. ANL מסופק כמו הידרוכלוריד על ידי כמה חברות. במקרה זה, יש להתאים את ה- pH של הפתרונות ל- pH המתאים (בהתאם למסלול הניהול). ANL יכול גם להיות מסונתז בעקבות השיטה שפורסמה על ידי Link et al.11 עם כמה שינויים5. ניתן לבצע תיוג ANL באמצעות ריכוזי ANL אחרים, לוחות זמנים ונתיבי ניהול. עבור רקמות/סוגי תאים עם קצב חילוף חומרים נמוך, ניתן להשתמש בדיאטת מתיונין בעלת תוכן נמוך, תמיד החל משבוע אחד לפני מתן ANL. כאשר 400 mM ANL משמש, זה יכול לזרז בזמן מאוחסן ב 4 °C (60 °F); חימום של עד 37 מעלות צלזיוס מחזיר את ANL לתמיסה. תנו לו להגיע לטמפרטורת החדר לפני ההזרקה. ברוב אזורי העולם, מתן ANL לעכברים הוא ניסוי בבעלי חיים וצריך להיות מאושר על ידי הרשויות הרלוונטיות.
2. קצירת רקמות, תזה ומיצוי חלבונים
- דיסקציה של רקמה: נתחו את אזור הרקמה המכיל את סוג התא המעניין ושימו לב למשקל של פיסת הרקמה שנאספה.
הערה: ניתן לאחסן דגימות בטמפרטורה של -80°C למשך מספר חודשים (נקודת עצירה). בפרוטוקול הנוכחי נותחו קליפת המוח של העכברים וההיפוקמפוס. - תזה של רקמות: הומוגניזציה של הרקמה בטמפרטורת החדר על ידי הוספת נפח של פי 12-15 מהמשקל הרטוב של הרקמה של מאגר הליזיס (PBS pH 7.4, 1% wt/vol SDS, 1% (vol/vol) Triton X-100, Benzonase (1:1000 vol/vol), מעכב פרוטאז (PI) (EDTA חינם 1:4000)). לדוגמה, עבור חתיכת רקמה 20 מ"ג, להוסיף 240-300 μL של מאגר ליזה. Triturate את הרקמה עד שהוא הומוגני.
הערה: ניתן לאחסן דגימות בטמפרטורה של -80°C למשך מספר חודשים (נקודת עצירה). עבור הומוגניזציה ישירה בצינורות 1.5 מ"ל, מומלץ להשתמש בהומוגנייזר כף יד, המופעל באמצעות סוללה, במיוחד כאשר מעובדים פיסות רקמה קטנות. עבור חתיכות גדולות יותר, ניתן להשתמש בהומוגנייזר של Dounce. לכל מאגר שבו כלולים מעכבי פרוטאז (PI), יש להוסיף אותם מיד לפני השימוש ולא קודם לכן. - דנטורציה של חלבונים: מחממים את ההומוגנט ל-75°C למשך 15 דקות וצנטריפוגה ב-17,000 x g למשך 15 דקות ב-10°C. מעבירים את הסופר-נטנט לצינור חדש.
- מדידת תכולת חלבון: מדוד את ריכוז החלבון של כל דגימה, והתאם את כל הדגימות כך שיושוו לאותו ריכוז חלבון; התאם את הריכוז על-ידי הוספת מאגר תזה. טווח ריכוז אופטימלי הוא בין 2-4 מיקרוגרם/μL.
הערה: ניתן לאחסן דגימות בטמפרטורה של -80°C למשך מספר חודשים (נקודת עצירה). - אלקילציה
- דלל את הדגימות ההומוגניות פי 2-3 ב- PBS (pH 7.8) + PI (EDTA חינם 1:4000).
- הוסף יודואצטמיד (IAA) לריכוז סופי של 20 mM (תמיסת מלאי 500 mM).
- השאירו את הדגימות למשך 1-2 שעות ב-20 מעלות צלזיוס בחושך. בצע את שלבים 2.5.2-2.5.3 פעמיים.
הערה: עבור רקמות מסוימות, אם הקליק הלא ספציפי בבקרה השלילית נשאר גבוה, ייתכן שיהיה צורך לבצע שלב הפחתה לפני אלקילציה12. הכינו את מלאי רשות העתיקות טרי רגע לפני הוספתו לדוגמאות. דגימות ניתן לאחסן ב -80 מעלות צלזיוס במשך מספר חודשים (נקודת עצירה).
- חילופי מאגרים: המרת עמודות חילופי מאגר שיווי משקל באמצעות מאגר חילופי הכימיה של הלחיצה (PBS pH 7.8, 0.04% (wt/vol) SDS, 0.08% (vol/vol) Triton X-100 ו- PI (1:4000)). בצע את הוראות היצרן. החלף את כל הדוגמאות האלקיליות.
הערה: ניתן לאחסן דגימות מוגבהות בטמפרטורה של -80°C למשך מספר חודשים (נקודת עצירה). בשלב זה, רשות העתיקות מתבטלת, והמאגר מוחלף על ידי מאגר הכימיה של הלחיצה. ניתן למדוד חלבון שוב לאחר שלב החלפת המאגרים כדי לוודא שהחלבונים לא אבדו במהלך תהליך החלפת המאגר. בהתאם לסוג העמודות המשמשות להחלפת חיץ, חלבון יכול ללכת לאיבוד באופן מסיבי. השתמש בעמודות המומלצות כדי למנוע אובדן חלבון. עבור אחסון מדגם, מומלץ להכין aliquots. - לחץ על התגובה כדי להעריך את שילוב ANL בניסוי
- קח 40 μL של דגימות eluted בשלב 2.6 והוסף PBS (pH 7.8) לנפח סופי של 120 μL.
- כדי להגדיר את תגובת הכימיה של הלחיצה, הוסף את הריאגנטים הבאים בסדר הנתון ובמערבולת במשך 20 שניות לאחר כל תוספת: 1.5 μL של ליגנד טריאזול (מלאי 40 mM), 1.5 μL של ביוטין אלקין (מלאי 5 mM) ו-1 μL של Cu(I) ברומיד (מלאי 10 מ"ג/מ"ל, מומס ב-DMSO על ידי צנרת זהירה למעלה ולמטה, אל תערבבו). הוסף את הריאגנטים מהר ככל האפשר.
- דגירה של הדגימות למשך הלילה בחושך ב-4 מעלות צלזיוס עם סיבוב רציף.
- צנטריפוגה את הדגימות ב 4 מעלות צלזיוס במשך 5 דקות ב 17,000 x גרם. כדור מעט טורקיז יהיה גלוי. מעבירים את הסופר-נטנט לצינור חדש.
הערה: יש להכין ציר ברומיד של Cu (I) מיד לפני השימוש כדי למנוע חמצון נחושת. שמירה על יחס נפחים בין הדגימה המוזנחת לבין PBS קבוע בין דגימות היא חיונית כדי להבטיח את אותו ריכוז דטרגנט סופי בכל צינור. כדי להאיץ את ההרכבה של תגובת הכימיה של הלחיצה, מומלץ מערבולת שולחן עם מדפים לצינורות. אחסן את הדגימות שנלחצו ב- -80 °C למשך מספר חודשים, או ב- -20 °C למשך מספר שבועות עד לעיבוד נוסף (נקודת עצירה).
- ניתוח כתמים מערביים להערכת שילוב ANL בניסוי
- הפעל SDS-PAGE עם 20-40 μL של הסופרנטנט מתגובת הכימיה של הלחיצה (שלב 2.7). יש להשתמש ב-12% ג'לים לאקרילאמיד, להפעיל ב-1% SDS, 250 mM Tris-HCl, 2 mM גליצין. רוצו עד שהחזית יוצאת מהג'ל.
- מעבירים את החלבונים לממברנת ניטרוצלולוז או PVDF13.
- דגירה של הממברנה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס עם נוגדן GFP (1:500, חלבון GFP מתורגם במשותף עם MetRS*5), ונוגדן ביוטין (1:1000) לזיהוי אלקין בלחיצה, אשר מצומד לביוטין.
- יש לשטוף את הנוגדן הראשוני פעמיים למשך 10 דקות ולהוסיף את הנוגדן המשני למשך שעה וחצי.
- יש לשטוף את הנוגדן המשני פעמיים למשך 10 דקות ולסרוק (אם משתמשים בנוגדנים מצומדים לפלואורופור) או לחשוף לסרטים (אם משתמשים בנוגדנים מצומדים של פרוקסידאז חזרת).
- לכמת את אות הביוטין באמצעות ImageJ או תוכנה דומה, להעריך את התיוג הכללי של כל דגימה של הניסוי, ולזהות חריגות אפשריות. להעריך את יחס האות לרעש (תיוג דגימת ANL לרקע מהבקרות השליליות) של הניסוי ולזהות בעלי חיים אפשריים שלא הצליחו לקלוט/לשלב ANL.
הערה: עבור דגימות עם שילוב ANL גבוה, טיהור חלבונים אפשרי באופן תיאורטי באמצעות אלקינים שאינם ניתנים לביקוע כמו זה המשמש בסעיף זה להערכת שילוב ANL. באמצעות דגימות מוח, הרקע המתקבל בבקרות השליליות על ידי טרשת נפוצה לאחר טיהור חלבונים באמצעות אלקינים שאינם ניתנים לביקוע הוא גבוה מדי14. לכן, רק האלקינים הקלים יותר לטיפול, שאינם ניתנים לביקוע, שימשו לדגימה כללית ראשונה ולהערכת ניסוי. ללא קשר לסוג האלקין המיועד לטיהור חלבון, מומלץ לבצע את השלבים לאופטימיזציה של מינון אלקין המתוארים בסעיף הבא (שלב 2.9).
- תגובת קליק לאופטימיזציה של מינון אלקין הניתן למחשוף
- הכן ארבע שפופרות עם 40 μL של מדגם מייצג אחד (המתקבל בשלב 2.6 ומוערך בשלב 2.8) והוסף PBS (pH 7.8) לנפח סופי של 120 μL.
- הגדר את תגובת הכימיה של הלחיצה כפי שמוסבר בשלב 2.7 אך הפעם, הוסף ארבע כמויות שונות של DST-alkyne. עבור אלקיין האמור, מומלץ לבדוק 5 μM, 15 μM, 30 μM ו- 60 μM.
- חזור על שלב 2.8 כדי להחליט מהו מינון האלקין המתאים ביותר לשאלה הניסויית הספציפית הנחקרת, בהתבסס על יעילות הסימון הגבוהה ביותר עם אות הרקע הנמוך ביותר.
הערה: לפני חשיפת הדגימות הנותרות לתגובת קליק, יש לקבוע את הכמות האופטימלית של כל אלקין. ישנן מספר אפשרויות של אלקינים זמינים מסחרית שניתן להשתמש בהם. הם נבדלים זה מזה בדרך של מחשוף (למשל, אור או חומרים מחזרים). כימיה של קליקים ללא נחושת באמצעות ריאגנטים המקודמים על ידי זן (למשל, ריאגנטים DBCO) אפשרית גם כן. שינויים זעירים בכמות הריאגנטים של אלקינים או DBCO מגדילים לעתים קרובות את האות בבקרה השלילית (רקע) באופן משמעותי. כאן מתואר טיהור החלבון באמצעות אלקין עם גשר דיסולפיד הניתן לביקוע על ידי חומרים מחזרים (דיסולפיד ביוטין אלקיין או DST-אלקין15). בעת שימוש ב- DST-alkyne, להפעלת ה- SDS-PAGE (שלב 8.1), הימנע מטעינת מאגרים עם חומרי חיזוי חזקים כגון DTT או β-Mercaptoethanol כדי למנוע ביקוע אלקין. במחקר זה, חימום ב-72 מעלות צלזיוס, למשך 5 דקות, באמצעות 5 mM של N-ethylmaleimide (NEM) במאגר הטעינה אינו משפיע על יציבות שעון הקיץ-אלקיין. שלב 2.9.2 יכול לחזור על עצמו, לבדוק מינונים עדינים יותר בטווח של הטוב ביותר שנצפה.
- תגובת קליק מכינה לטיהור חלבונים
- לחץ על כל הדגימות שהתקבלו בשלב 2.6 עם מינון האלקין האופטימלי שנקבע בשלב 2.9 ונתח שבר על ידי SDS-PAGE וכתם מערבי (שלב 2.8).
הערה: ודא שהפיפטות מכוילות כראוי כדי להבטיח דיוק של שדרוג הדגימה. דגימות שנלחצו ניתן לאחסן ב -80 °C במשך מספר חודשים (נקודת עצירה).
- לחץ על כל הדגימות שהתקבלו בשלב 2.6 עם מינון האלקין האופטימלי שנקבע בשלב 2.9 ונתח שבר על ידי SDS-PAGE וכתם מערבי (שלב 2.8).
3. טיהור חלבון
- החלפת מאגרים
- הכפיף את כל הדגימות שנלחצו להליך חילופי מאגרים כמתואר בשלב 2.6, אך השתמש במאגר איגוד Neutravidin כמאגר שיווי משקל (PBS pH 7.4, 0.15% (wt/vol) SDS, 1% (vol/vol) Triton X-100 ו- PI (1:2000)).
הערה: ניתן לאחסן דגימות מוגבהות בטמפרטורה של -80°C למשך מספר חודשים (נקודת עצירה). בשלב זה, אלקין חינם ללא לחיצה הוא בוטל, ואת המאגר מוחלף על ידי מאגר מחייב Neutravidin.
- הכפיף את כל הדגימות שנלחצו להליך חילופי מאגרים כמתואר בשלב 2.6, אך השתמש במאגר איגוד Neutravidin כמאגר שיווי משקל (PBS pH 7.4, 0.15% (wt/vol) SDS, 1% (vol/vol) Triton X-100 ו- PI (1:2000)).
- כריכה לחרוזי נויטרווידין
- לשטוף את החרוזים בעלי הקיבולת הגבוהה של Neutravidin עם מאגר הקשירה של Neutravidin (ראה שלב 3.1); מערבבים את החרוזים עם החיץ ומפעילים צנטריפוגה במשך 5 דקות ב-3000 x גרם, ומשליכים את הסופרנט. חזרו על הפעולה שלוש פעמים.
- הכינו 1:1 של חרוזי נויטרווידין על ידי הוספת אותו נפח של חרוזים יבשים ומאגר קשירה של נויטרווידין.
- מניחים בצד 20-40 μL מכל דגימה כמו ליזאט מטוהר מראש ולאחסן אותו ב -20 מעלות צלזיוס.
- מדדו את ריכוז החלבון (ראו שלב 2.4), וערבבו 100 מיקרוגרם חלבון עם 4 מיקרון של חרוזי החרוזים שהתקבלו בשלב 3.2.2.
- דגירה של התערובת למשך הלילה בטמפרטורה של 4 מעלות צלזיוס עם סיבוב רציף, המאפשרת לחלבונים המסומנים להיקשר לחרוזים.
הערה: באשר לתגובת הכימיה של הלחיצה, ניתן לשדרג את תגובת טיהור הזיקה הבסיסית המתוארת בשלב 3.2.4. לדוגמה, עבור טיהור של חלבונים מן הנוירונים המעוררים של ההיפוקמפוס, 1 מ"ג של חלבון ליזאט מעורבב עם 40 μL של חרוזי Neutravidin (1:1 slurry). ניתן להגדיל או להקטין את כמות חרוזי Neutravidin בהתאם לכמות החלבונים המסומנים למ"ג של סך החלבון, אשר תהיה תלויה בסוג התא הנבחר ובתקופת הסימון ויש לקבוע אותה באופן אמפירי.
- חרוזי נויטרווידין שוטפים וחלבון
- אסוף את הסופרנאטנטים על ידי צנטריפוגה (ראה שלב 3.2.1). מניחים 20-40 μl aliquot של כל supernatant בצד לניתוח מאוחר יותר ולהקפיא את השאר ב -80 מעלות צלזיוס.
- שטפו את החרוזים עם מאגר כביסה צונן Neutravidin 1 (PBS pH 7.4, 0.2% (wt/vol) SDS, 1% (vol/vol) Triton X-100 ו-PI (1:2000)) על ידי הוספת המאגר, שקיעת החרוזים והשלכת הסופר-נטנט. חזור על שלב זה שלוש פעמים.
- לאחר מכן, הוסיפו את אותו חיץ ודגרו את החרוזים במשך 10 דקות תחת סיבוב רציף ב-4 מעלות צלזיוס לפני השלכת הסופר-נטנט. חזור על שלב זה שלוש פעמים.
- שטפו את החרוזים כפי שמוסבר בשלבים 3.3.2-3.3.3 אך השתמשו במאגר הכביסה של Neutravidin 2 (1x PBS, pH 7.4 ו-PI 1:2000).
- לשטוף את החרוזים כפי שהוסבר בשלב 3.3.2-3.3.3 אבל באמצעות חיץ כביסה Neutravidin 3 (50 mM אמוניום ביקרבונט ו PI 1:2000).
- אלוקים את החלבונים שנלחצו על ידי דגירה של החרוזים במשך 30 דקות בטמפרטורה של 20 מעלות צלזיוס עם נפח של מאגר אלוטיון Neutravidin (5% (vol/vol) β-mercaptoethanol ו-0.03% (wt/vol) SDS) המתאים לנפח אחד של החרוזים היבשים שבהם נעשה שימוש.
- שמרו על החרוזים במתלים במהלך התסיסה המתמשכת (1000 סל"ד) בשייקר תרמובלוק. אלוטה פעמיים ומשלבת את שני האלואטים.
הערה: הצנטריפוגה המוגדרת להפרדת החלק המוצק של הסלורי (חרוזים) והפאזה המימית (סופרנטנט), כפי שמוסבר בשלב 3.2.1, חלה על שלבים 3.3.1-3.3.7. ניתן להגדיל את כמות ה-SDS אם החלבון לא הושלם. עם זאת, עם כמויות מעל 0.08%-0.1% של SDS, חלבונים שאינם קשורים באופן ספציפי לחרוזים מתחילים להיות eluted. β-מרקפטואתנול הוא נדיף ורעיל; מומלץ להשתמש במכסה המנוע לשלבים 3.3.6-3.3.7. הדגימות שנאספו בשלבים 3.2.3 ו- 3.3.1 צריכות להיות מופעלות על ידי SDS-PAGE ולהעריך אותן על ידי כתם מערבי (ראה שלב 2.8) להערכת היעילות של טיהור הזיקה (שלב 3.3).
- הערכה של חלבונים אלוטים
- טען 1/3 מהדגימות המועלות ל- SDS-PAGE (ראה שלב 2.8.1).
- הכתימו את הג'ל כדי לדמיין חלבונים בשיטה בעלת רגישות גבוהה, כגון צביעת כסף או שיטה פלואורסצנטית.
- אם לדגימות יש את האיכות הצפויה, כלומר יש פי 3-4 יותר חלבון בדגימות המסומנות ב-ANL בהשוואה לבקרה השלילית, ניתן לזהות את החלבונים האלוטים על ידי שיטות ספקטרומטריית מסות שגרתיות כמו זו שהוסברה בהתייחסות5.
תוצאות
בעקבות הפרוטוקול המתואר (המסוכם באיור 1), ANL ניתן לעכברים על ידי זריקות תוך-צפקיות יומיות (400 mM ANL 10 mL/kg, Nex-Cre::MetRS*) במשך 7 ימים, או באמצעות מי שתייה (0.7% מלטוז, 1% ANL, CamkII-Cre::MetRS*) במשך 21 יום. לאחר התיוג, אזורי המוח המתאימים נותחו, שכבו, הושאלו ונלחצו. תגובות הקליק נותחו על ידי SDS-PAGE ו-Western Immunoblot. תמונות מייצגות של הניסויים מוצגות באיור 2 עבור ניהול ANL באמצעות הזרקת IP ובאיור 3 עבור מתן ANL באמצעות מי שתייה. שימו לב שמטרת הנתונים היא להראות ששני פרוטוקולי התיוג עובדים, ולא להשוות ביניהם. השוואה אינה אפשרית מכיוון שאוכלוסיות נוירונים שונות מסומנות בשני הניסויים שהוצגו (נוירונים מעוררים של ההיפוקמפוס וקליפת המוח, ונוירוני Purkinje של המוח הקטן).
ניסוי נוסף מספק דוגמה לקביעת ריכוז האלקין האופטימלי הניתן לבקיעת שעון הקיץ (איור 4). בדוגמה זו, שינוי הקיפול בין דגימה מסומנת לבקרה הוא הגבוה ביותר בריכוז אלקין של 14 μM. ריכוז אלקין זה מוחל לאחר מכן על כל הדגימות. לאחר אימות התיוג של כל דגימה בניסוי עם כמות האלקין שנבחרה, כל הדגימות היו נתונות לטיהור של חלבונים המסומנים ב-ANL/בלחיצת ביוטין על-ידי קשירת זיקה באמצעות חרוזי Neutravidin (איור 5). בשלב זה, חלבונים נקשרים לחרוזים, נשטפים, ולאחר מכן מנוצלים על ידי הפחתת הגשר הדיסולפידי הקיים בשעון הקיץ-אלקין. לאחר שלב אחרון זה, הביוטין וחלק מהאלקיין נשארים קשורים לחרוזים. החלבונים המכילים ANL (הקשורים לשאר האלקין) משוחזרים במאגר האלוציה. כדי להעריך את היעילות של שלב ה-elution, שליש מנפח ה-eluate נטען על ג'ל SDS-PAGE וממחיש אותו בשיטת כתם חלבון כוללת רגישה. יש לראות לפחות הפרש עוצמה של פי 3 של כתם חלבון כולל בין בקרות שליליות לבין דגימות המסומנות ב- ANL כדי להשיג תוצאות הניתנות לפענוח עם ספקטרומטריית מסה. השלמת כל השלבים המתוארים בפרוטוקול זה תלווה בהכנת דגימות MS, רכישה וניתוח5. למרות שאין דרישות מיוחדות לטרשת נפוצה (כל מעבדה רשאית להשתמש בפרוטוקול MS השגרתי שלה 5,10), יש לזכור שכמותהחלבונים המטוהרים תהיה בדרך כלל נמוכה (בסדר גודל הננוגרם). איור 6 מספק דוגמה לתוצאות של טרשת נפוצה עם העשרה ברורה בדגימה המסומנת ב-ANL בהשוואה לבקרה (איור 6A). ההבדל הזה כבר נראה בכתם החלבון הכולל שמוצג באיור 5. מלבד שינויים בעוצמת הפפטידים, ישנם גם חלבונים ייחודיים שנמצאים בשתי הדגימות (איור 6B).
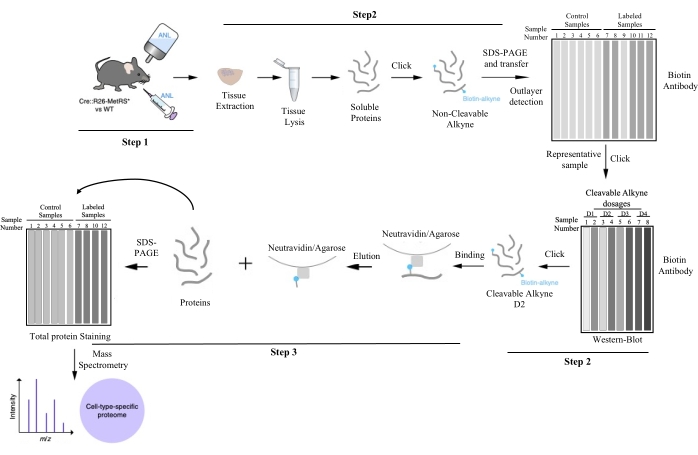
איור 1: צינור עבודה לטיהור חלבונים ספציפיים לסוג התא על-ידי BONCAT. לאחר תיוג חלבונים עם ANL, הרקמה המעניינת עוברת ניתוח ושכיבה, מתויגת עם ביוטין על ידי כימיה של קליקים, וכמות הסימון עבור כל דגימה מוערכת על ידי BONCAT. ניתן להבחין בין חריגים (שלא הצליחו לשלב ANL) ומדגמים מייצגים בשלב זה. אחת הדגימות המייצגות נלחצת שוב כדי למצוא את מינון האלקין המחשוף האופטימלי לטיהור החלבון הבא. מינון האלקין המשיג את יחס האות לרעש הטוב ביותר מוחל על כל שכפול ביולוגי. חלבונים ספציפיים לסוג התא מתקבלים על ידי טיהור זיקה. דגימות מטוהרות נחקרות על ידי ספקטרומטריית מסות, וחלבונים מזוהים. נתון זה שונה מ- Alvarez-Castelao et al. (2017)6. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
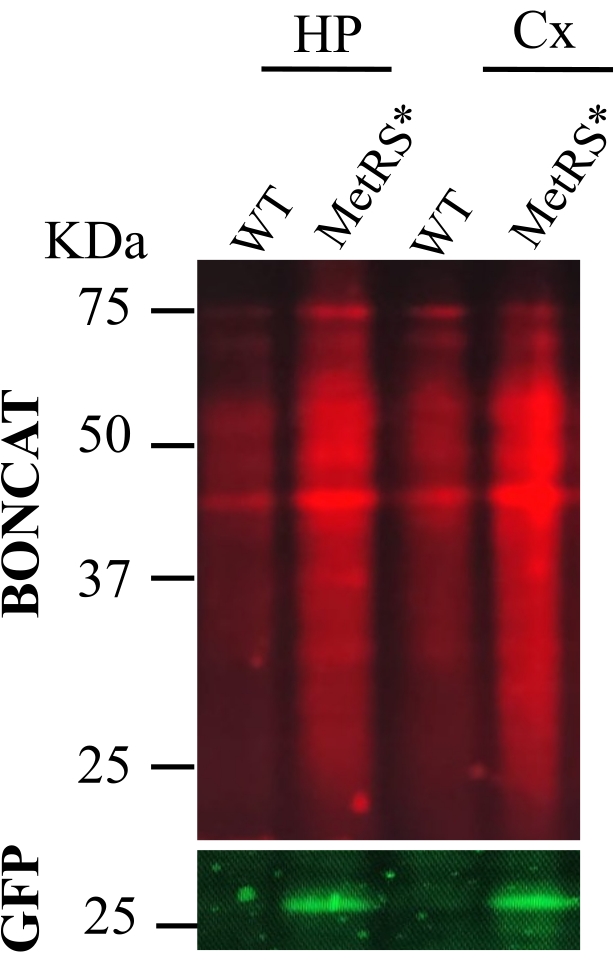
איור 2: מתן ANL על-ידי זריקות תוך-צפקיות (IP). BONCAT בוצע כדי להעריך תיוג חלבונים בהיפוקמפוס (HP) ובקליפת המוח (CX) לאחר תיוג מטבולי של חלבונים עם ANL על ידי זריקות IP יומיות במשך 7 ימים. דגימות עכברים מסוג פראי כבקרה שלילית (wt) נלחצו במקביל לדגימות המסומנות (MetRS*). החלבונים המסומנים הם מהנוירונים המעוררים באמצעות קו Nex-Cre::MetRS*16. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: מתן ANL על-ידי מי שתייה. BONCAT בוצע כדי להעריך תיוג חלבונים בתאי העצב של Purkinje במוח הקטן לאחר מתן ANL לעכברי GAD-Cre::MetRS* באמצעות מי שתייה במשך 21 יום. האיור מציג פקד שלילי (wt) ומדגם עם תווית (MetRS*) שמונחים ולוחצים במקביל. נתון זה שונה מ- Alvarez-Castelao et al. (2017)6. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 4: טיטרציה של מינון שעון הקיץ-אלקין. שכפול ביולוגי אחד לכל ניסוי נבחר כמדגם מייצג כדי לטשטש את ריכוז האלקין האופטימלי. שלושה ריכוזים (14, 28 ו-56 מיקרומטר) של האלקין נבדקו כאן בתגובת הלחיצה על BONCAT. יחס הסימון בין הדגימה המסומנת ב-ANL (MetRS*) לבין הבקרה השלילית (wt) קובע את יחס האות לרעש (מוצג בגרף). 14 μM הוא ריכוז האלקין הטוב ביותר המתקבל בניסוי זה. רקמת קורטקס מקו העכבר Nex::MetRS* שכותרתו ANL שימשה לניסוי זה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: חלבונים מטוהרים. חלבונים מסומנים מנוירונים של Purkinje טוהרו והוכתמו באמצעות SYPRO Ruby. נתון זה שונה מ- Alvarez-Castelao et al. (2017)6. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 6: זיהוי וכימות חלבונים. פרוטאום תאי פורקינייה הושג על ידי ספקטרומטריית מסה באמצעות המוח הקטן מקו עכבר GAD-Cre::MetRS* כחומר מוצא. (A) מראה שפע מוגבר (עוצמת פפטידים) של החלבונים שזוהו בדגימות המסומנות ב-ANL בהשוואה לעכברים מסוג בר (wt). (B) פרוטאום Purkinje הושג על ידי איגום חלבונים מועשרים בדגימות המסומנות ב-ANL ב-A (המוגדרות >על ידי עוצמות פי 3 בעכברי MetRS*, בהשוואה ל-wt), וחלבונים ייחודיים שנמצאו בעכברים המבטאים MetRS*. נתון זה שונה מ- Alvarez-Castelao et al. (2017)6. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
Discussion
ההיבטים הקריטיים של הפרוטוקול הם; הכללת בקרות שליליות, שיש מספיק שכפולים ביולוגיים, מסלול ניהול ANL, כמות ומשך, אלקילציה של הדגימות, ריכוז אלקין, וחיסול β-מרקפטואתנול בעת שימוש ב- DST-alkyne.
המפתח הוא לכלול דגימות בקרה שליליות הנובעות מבעלי חיים המסומנים ב-ANL ללא נהג Cre ולכן ללא ביטוי MetRS*. דגימות אלה חייבות להיות כפופות לכל שלב המתואר בפרוטוקול במקביל לדגימות מעכברי MetRS* המושרים על-ידי CRL עם תווית CLE. דוגמאות שלא נלחצו אינן פקדים חוקיים, מכיוון שכל תוצאה שהושגה באמצעות פקד זה בלבד עשויה לנבוע מלחיצה לא ספציפית. לא ראינו שילוב של ANL בתאים שאינם מבטאים את הגן MetRS*, וגם לא ביטוי של MetRS* בתאים ללא Cre; לפיכך, בעלי חיים wt המסומנים ב- ANL יכולים לשמש כבקרה שלילית.
בהתחשב בכך שהפרוטוקול המתואר בזאת מורכב משלבים רבים שבהם ניתן לאבד דגימות, מומלץ לחשב שכפולים ביולוגיים הנושאים בחשבון כשל טכני. עבור דגימות מוח, יש כ 30% אובדן לשכפל.
אנו מתארים כאן שני מסלולי ניהול ANL ומשכי זמן. זה לא שולל כי נתיבי ניהול אחרים (למשל, הוספת ANL למזון), לעבוד באותה מידה. ביחס לכמות ה-ANL שניתנה, הניסויים המוצגים כאן בוצעו תוך שימוש בכמויות גבוהות יחסית של ANL. תיוג עם כמויות נמוכות יותר אפשרי גם בהתאם למערך הניסוי. טווח הזמן הקצר ביותר של תיוג ANL המדווח בפרוטוקול זה הוא שבוע אחד, ו-21 הימים הארוכים ביותר. ניתן להחיל תקופות תיוג קצרות או ארוכות יותר, אך לא קבענו זאת. החוקרים צריכים לקבוע את מסלול מתן ה-ARL, מינון ה-ANL ותקופת הסימון של ANL המתאימים לשאלה הניסויית הספציפית הנחקרת על ידי התחשבות בתכונות המטבוליות של הרקמה, סוג התא המעניין ושאלת הניסוי הנחקרת.
אלקילציה לדוגמה, הידועה גם בשם capping, היא צעד חשוב כדי למנוע לחיצה ברקע17. כאשר אלקילציה מתבצעת כראוי, הלחיצה הלא ספציפית כפי שהיא מנוטרת על ידי דגימות הבקרה מצטמצמת, וההבדל בין הבקרה השלילית לבין דגימות המסומנות ב- ANL גדול יותר. חיסול רשות העתיקות החופשית לאחר אלקילציה הוא גם צעד מפתח. נוכחות של כמויות קטנות של IAA במהלך תגובת הלחיצה תגביל את יעילותה. לעיתים, יש לחזור על שלב ההתפלה שגם מבטל את רשות העתיקות (שלב 2.6) כדי להבטיח הסרה נכונה של רשות העתיקות.
ישנם מספר ריאגנטים ביוטין-אלקינים ו-DBCO הזמינים מסחרית ממגוון חברות. ההבדלים העיקריים ביניהם מתייחסים לאורך שרשרת הקישורים של פוליאתילנגליקול (PEG) ולהיעדר, נוכחות וסוג של קבוצות הניתנות למחשוף. ללא קשר לסוג שבו נעשה שימוש, כמויות עודפות של אלקין מובילות לקליק לא ספציפי לחלבונים הנושאים חומצות אמינו טבעיות בלבד. ניתן למנוע זאת בקלות על ידי טיטרציה מדויקת וזהירה של כמות האלקין. כפי שתואר, הדרך הטובה ביותר להשיג זאת היא באמצעות דגימות lysed ו alkylated בפועל כדי לשמש בשלבי טיהור חלבונים הבאים (שלב 2.6) וניתוח ספקטרומטריית מסה.
כאשר משתמשים ב-DST-alkynes בתגובת הלחיצה, β-מרקפטואתנול מפחית את הגשר הדיסולפידים ומנתק את החלבונים המסומנים מהחרוזים בשלב האלוציה (שלב 3.3). יש להסיר β-מרקפטואתנול מהדגימות כדי לאפשר את העיכול האנזימטי הדרוש לטרשת נפוצה. ישנן מספר דרכים לעשות זאת (למשל, ליופיליזציה18, כריתה מג'ל19, או ניקוי באמצעות עמודי S-Trap20), והבחירה צריכה להיעשות על ידי מעבדת MS המעבדת את הדגימות.
שינויים ופתרון בעיות של השיטה צריכים להיות מכוונים כדי לייעל את השלבים הקריטיים המוזכרים בפרוטוקול. לדוגמה, אם יש שונות רבה מדי, הוסף עוד שכפולים ביולוגיים; אם הסימון נמוך מדי, הגדל את ריכוז ה-ARL, השתמש בטווחי זמן ארוכים יותר של התוויה, או בדוק נתיבי מתן ANL אחרים שיכולים להיות יעילים יותר עבור הרקמה הנחקרת. עבור אלקילציה של חלבונים, ניתן ליישם צעד הפחתה קודם לתוספת של IAA.
המגבלה העיקרית של השיטה היא טיהור של פרוטאומים הנובעים מאוכלוסיות תאים קטנים גם אם אזור רקמה קטן הוא גזור. פרוטאומים של אוכלוסיות תאים רבות יותר, עם זאת, המפוזרים על פני אזורי רקמה גדולים יותר קשים גם הם לגישה. עם זאת, עדיין ניתן ליישם את טכניקת הסימון in vivo המתוארת כאן כדי להעריך את סוגי התאים המופנים על ידי הדמיה (למשל, עם FUNCAT או FUNCAT-PLA21).
שיטה זו היא כיום השיטה היחידה הזמינה למחקר in vivo של פרוטאומים ספציפיים לסוג התא המבוססים על חלבונים באורך מלא ולהדמיית in situ של חלבונים שלמים ספציפיים לסוג התא. חומצות אמינו אחרות שאינן קנוניות, כגון אזידוהומואלנין (AHA), יכולות לשמש גם לתיוג חלבונים in vivo ולטיהור פרוטאומים, אך חסרות ספציפיות של תאי התא22,23. גישות אחרות כגון פורומיצין מתאימות למתן תמונה קבועה של סינתזת חלבונים24,25. עם זאת, שימוש בחומצות אמינו לא קנוניות לתקופות ארוכות יותר של תיוג אפשרי, גם משקף את פירוק החלבון ומראה פרוטאום תאי מדויק יותר. שיטות מבוססות BioID משמשות לזיהוי חלבונים באזורים תת-תאיים ספציפיים, ללא קשר לרגע / מקום הסינתזהשלהם 26.
בקו העכבר שהקמנו (זמין ממעבדת ג'קסון, מלאי מס' 028071), המוטציה מתיונין tRNA synthetase (MetRS*) המאפשרת שילוב של ANL בתאים מתבטאת באופן תלוי Cre. עם קו עכבר זה ככלי, ניתן לבטא באופן בלעדי את ה- MetRS* בסוגי תאים שעבורם זמינים קווי מנהל התקן Cre. סידור זה מעניק לשיטה רבגוניות רבה, מה שהופך אותה לשימושית כמעט בכל תחום של מחקר ביו-רפואי.
Disclosures
המחברים מצהירים כי אין אינטרסים כלכליים מתחרים.
Acknowledgements
B.A-C ממומן על ידי מענקי משרד המדע והחדשנות הספרדי (Ramón y Cajal-RYC2018-024435-I), על ידי הקהילה האוטונומית של מדריד (Atracción de Talento-2019T1/BMD-14057), ומענקי MICINN (PID2020-113270RA-I00). R. A-P ממומן על ידי הקהילה האוטונומית של מדריד (Atracción de Talento-2019T1/BMD-14057). E.M.S. ממומן על ידי אגודת מקס פלנק, פרס חוקר מתקדם מטעם המועצה האירופית למחקר (מענק 743216), DFG CRC 1080: מנגנונים מולקולריים ותאיים של הומאוסטזיס עצבי, ו- DFG CRC 902: עקרונות מולקולריים של ויסות מבוסס RNA. אנו מודים ל- D.C Dieterich ו- P. Landgraf על הייעוץ הטכני שלהם ועל הסינתזה של שעון הקיץ-אלקין. אנו מודים ל- E. Northrup, S. Zeissler, S. Gil Mast, ולמתקן החיות של MPI לחקר המוח על תמיכתם המצוינת. אנו מודים לסנדרה גבלס על שיתוף קו העכבר Nex-Cre. אנו מודים לאנטוניו ג 'קרוג'יו על עזרתו בעריכה באנגלית. B.A-C. תכננו, ערכו ונותחו ניסויים. B.N-A, D.O.C, R.A-P, C. E., ו- S. t. ד. ערך וניתח ניסויים. B.A-C ו-E.M.S. תכננו ניסויים, ופיקחו על הפרויקט, B.A-C כתבו את המאמר. כל המחברים ערכו את המאמר.
Materials
| Name | Company | Catalog Number | Comments |
| 12% Acrylamide gels | GenScript | SurePAGE, Bis-Tris, 10 x 8, 12% | |
| β-Mercaptoethanol | Sigma | M6250 | Toxic; use a lab coat, gloves and a fume hood. |
| Ammonium bicarbonate | Sigma | 9830 | Toxic; use a lab coat, gloves and a fume hood |
| ANL | Synthesized as described previously for AHA (see references 5 and 11) | ||
| ANL-HCl | IrishBotech | HAA1625.0500 | |
| Benzonase | Sigma | E1014 | |
| Biotin alkyne | Thermo, | B10185 | |
| Chicken antibody anti-GFP | Aves | 1020 | |
| Complete EDTA-free protease inhibitor | Roche | 4693132001 | Toxic; use a lab coat and gloves. |
| Copper (I) bromide | Sigma | 254185 | 99.999% (wt/wt) |
| Disulfide tag (DST)-alkyne | Synthesized as reported in reference number 15, in which it is referred to as probe 20 | ||
| DMSO | Sigma | 276855 | |
| Filters | Merk | SCGP00525 | |
| Iodo acetamide (IAA) | Sigma | I1149 | |
| IR anti chicken 800 | LI-COR | IRDye 800CW | Donkey anti-Chicken Secondary Antibody |
| IR anti rabit 680 | LI-COR | IRDye 680RD | Goat anti-Rabbit IgG Secondary Antibody |
| Maltose | Sigma | M9171 | |
| Manual Mixer | BioSpec Products | 1083 | |
| NaCl | Sigma | S9888 | |
| N-ethylmaleimide | Sigma | 4259 | Toxic; use a lab coat, gloves and a fume hood. |
| NeutrAvidin beads | Pierce | 29200 | |
| Nitrocellulose membrane | Bio-rad | 1620112 | |
| PBS 1X | Thermo | J62036.K2 | |
| PBS 1X pH 7.8 | Preparation described in reference number 5 | ||
| PD SpinTrap G-25 columns | GE Healthcare | Buffer exchange | |
| Pierce BCA Protein Assay Kit | Thermo, | 23225 | Reagents in the Pierce BCA Protein Assay Kit are toxic to aquatic life. |
| Polyclonal rabbit anti-biotin antibody | Cell Signaling | 5597 | |
| PVDF membrane | Millipore | IPVH00010 | |
| SDS 10% | Sigma | 71736 | |
| SDS-PAGE Running buffer MOPS | GenScript | M00138 | |
| SYPRO Ruby stain | Sigma | S4942 | |
| Table automatic Vortexer | Eppendorf | Mixmate | |
| Triazole ligand | Sigma | 678937 | |
| Triton X-100 | Sigma | T9284 | |
| Water | Sigma | W4502 | Molecular biology grade |
References
- Alvarez-Castelao, B., Schuman, E. M. The regulation of synaptic protein turnover. Journal of Biological Chemistry. 290 (48), 28623-28630 (2015).
- Sutton, M. A., Schuman, E. M. Dendritic protein synthesis, synaptic plasticity, and memory. Cell. 127 (1), 49-58 (2006).
- Dorrbaum, A. R., Alvarez-Castelao, B., Nassim-Assir, B., Langer, J. D., Schuman, E. M. Proteome dynamics during homeostatic scaling in cultured neurons. Elife. 9, 52939(2020).
- Flexner, J. B., Flexner, L. B., Stellar, E. Memory in mice as affected by intracerebral puromycin. Science. 141 (3575), 57-59 (1963).
- Alvarez-Castelao, B., Schanzenbacher, C. T., Langer, J. D., Schuman, E. M. Cell-type-specific metabolic labeling, detection and identification of nascent proteomes in vivo. Nature Protocols. 14 (2), 556-575 (2019).
- Alvarez-Castelao, B., et al. Cell-type-specific metabolic labeling of nascent proteomes in vivo. Nature Biotechnology. 35 (12), 1196-1201 (2017).
- Ngo, J. T., et al. Cell-selective metabolic labeling of proteins. Nature Chemical Biology. 5 (10), 715-717 (2009).
- Mahdavi, A., et al. Engineered aminoacyl-tRNA synthetase for cell-selective analysis of mammalian protein synthesis. Journal of the American Chemical Society. 138 (13), 4278-4281 (2016).
- Yuet, K. P., et al. Cell-specific proteomic analysis in Caenorhabditis elegans. Proceedings of the National Academy of Sciences of the United States of America. 112 (9), 2705-2710 (2015).
- Patel, V. J., et al. A comparison of labeling and label-free mass spectrometry-based proteomics approaches. Journal of Proteome Research. 8 (7), 3752-3759 (2009).
- Link, A. J., Vink, M. K., Tirrell, D. A. Preparation of the functionalizable methionine surrogate azidohomoalanine via copper-catalyzed diazo transfer. Nature Protocols. 2 (8), 1879-1883 (2007).
- Landgraf, P., Antileo, E. R., Schuman, E. M., Dieterich, D. C. BONCAT: Metabolic labeling, click chemistry, and affinity purification of newly synthesized proteomes. Methods in Molecular Biology. 1266, Clifton, N.J. 199-215 (2015).
- Kielkopf, C. L., Bauer, W., Urbatsch, I. L. Analysis of proteins by immunoblotting. Cold Spring Harbor Protocols. 2021 (12), (2021).
- Mellacheruvu, D., et al. The CRAPome: a contaminant repository for affinity purification-mass spectrometry data. Nature Methods. 10 (8), 730-736 (2013).
- Szychowski, J., et al. Cleavable biotin probes for labeling of biomolecules via azide-alkyne cycloaddition. Journal of the American Chemical Society. 132 (51), 18351-18360 (2010).
- Goebbels, S., et al. Genetic targeting of principal neurons in neocortex and hippocampus of NEX-Cre mice. Genesis. 44 (12), 611-621 (2006).
- van Geel, R., Pruijn, G. J., van Delft, F. L., Boelens, W. C. Preventing thiol-yne addition improves the specificity of strain-promoted azide-alkyne cycloaddition. Bioconjugate Chemistry. 23 (3), 392-398 (2012).
- O'Fagain, C. Lyophilization of proteins. Methods in Molecular Biology. 244, Clifton, N.J. 309-321 (2004).
- Shevchenko, A., Tomas, H., Havlis, J., Olsen, J. V., Mann, M. In-gel digestion for mass spectrometric characterization of proteins and proteomes. Nature Protocols. 1 (6), 2856-2860 (2006).
- Elinger, D., Gabashvili, A., Levin, Y. Suspension trapping (S-Trap) is compatible with typical protein extraction buffers and detergents for bottom-up proteomics. Journal of Proteome Research. 18 (3), 1441-1445 (2019).
- tom Dieck, S., et al. Direct visualization of newly synthesized target proteins in situ. Nature Methods. 12 (5), 411-414 (2015).
- McShane, E., et al. Kinetic analysis of protein stability reveals age-dependent degradation. Cell. 167 (3), 803-815 (2016).
- Calve, S., Witten, A. J., Ocken, A. R., Kinzer-Ursem, T. L. Incorporation of non-canonical amino acids into the developing murine proteome. Scientific Reports. 6, 32377(2016).
- David, A., et al. Nuclear translation visualized by ribosome-bound nascent chain puromycylation. Journal of Cell Biology. 197 (1), 45-57 (2012).
- Schmidt, E. K., Clavarino, G., Ceppi, M., Pierre, P. SUnSET, a nonradioactive method to monitor protein synthesis. Nature Methods. 6 (4), 275-277 (2009).
- Roux, K. J., Kim, D. I., Burke, B., May, D. G. BioID: A screen for protein-protein interactions. Current Protocols in Protein Science. 91, 11-15 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved