Method Article
İnsan Dişinden Organoidlerin Mekanik Araştırma ve Rejeneratif Terapiye Doğru Güçlü Bir Araç Olarak Kurulması
Bu Makalede
Özet
İnsan dişinden başlayarak epitelyal organoid kültürlerin geliştirilmesi için bir protokol sunuyoruz. Organoidler sağlam bir şekilde genişletilebilir ve ameloblast farklılaşma kapasiteleri de dahil olmak üzere dişin epitel kök hücrelerini özetler. Eşsiz organoid model, insan diş (kök hücre) biyolojisini diş rejeneratif yaklaşımlar için perspektiflerle incelemek için umut verici bir araç sağlar.
Özet
Dişler hayatta sadece gıda çiğnemesi ve konuşma için değil, aynı zamanda psikolojik iyi oluş için de kilit öneme sahiptir. İnsan diş gelişimi ve biyolojisi hakkında bilgi azdır. Özellikle, dişin epitel kök hücreleri ve işlevleri hakkında fazla bir şey bilinmemektedir. İnsan diş dokusundan (yani, çıkarılan bilgelik dişlerinden izole edilmiş diş folikülü) başlayan yeni bir organoid model geliştirmeyi başardık. Organoidler sağlam ve uzun süreli genişletilebilir olup, önerilen insan dişi epitel kök hücre bölmesini belirteç ekspresyonu ve fonksiyonel aktivite açısından özetler. Özellikle, organoidler, amelogenez sırasında in vivo olarak meydana gelen bir ameloblast farklılaşma sürecini ortaya çıkarabilir. Bu eşsiz organoid model, sadece insan diş gelişimini değil, aynı zamanda diş patolojisini de incelemek için güçlü bir araç sağlayacak ve diş rejeneratif tedavisine giden yolu açabilir. Kayıp dişlerin bu yeni organoid modele dayanan biyolojik bir dişle değiştirilmesi, sentetik malzemelerin mevcut standart implantasyonuna çekici bir alternatif olabilir.
Giriş
Dişlerin gıda çiğneme, konuşma ve psikolojik iyi oluşta (benlik imajı) önemli rolleri vardır. İnsan dişi, değişen yoğunluk ve sertlikte yüksek mineralize dokulardan oluşur1. Diş kronunun ana bileşeni olan diş minesi, insan vücudundaki en yüksek mineralize dokudur. Emaye oluşumu sırasında (amelogenez), dişler geliştiğinde, diş epitel kök hücreleri (DESC'ler) emaye oluşturan hücrelere (ameloblastlar) farklılaşır. Bir kez oluştuktan sonra, diş erüpsiyonunun başlangıcında ameloblastların apoptotik kaybı nedeniyle emaye nadiren onarılır veya yenilenir1. Travma veya bakteriyel hastalığın neden olduğu hasarlı emaye dokusunun restorasyonu şu anda sentetik malzemeler kullanılarak gerçekleştirilmektedir; ancak bunlar mikrokaçak, inferior osseointegrasyon ve ankraj, sonlu ömür ve tam fonksiyonel onarım eksikliği gibi önemli eksikliklerle uğraşmaktadır2. Bu nedenle, ameloblast üretme kapasitesine ve mineralize doku üretme potansiyeline sahip sağlam ve güvenilir bir insan DESC kültürü, dental rejeneratif alanda ileriye doğru atılmış önemli bir adım olacaktır.
İnsan DESC fenotipi ve biyolojik fonksiyonu hakkında bilgi azdır 3,4,5. İlginçtir ki, insan dişlerinin DESC'lerinin, Malassez'in Epitel Hücre Dayanaklarında (ERM), diş folikülünde (DF) bulunan ve diş patladığında kök çevresindeki periodontal ligamentte mevcut olan hücre kümelerinde var olduğu öne sürülmüştür1. Diş pulpası ile birlikte kültürlenmiş ERM hücrelerinin ameloblast benzeri hücrelere farklılaştığı ve mine benzeri doku ürettiği bulunmuştur6. Bununla birlikte, ERM hücrelerinin emaye (yeniden) üretimindeki spesifik rolüne ilişkin derin çalışmalar, güvenilir çalışma modellerinin eksikliği nedeniyle sınırlandırılmıştır7. Mevcut ERM in vitro kültür sistemleri, standart olarak kullanılan 8,9,10,11,12 2D koşullarında sınırlı kullanım ömrü ve hızlı fenotip kaybı nedeniyle engellenmektedir. Bu nedenle, insan DESC'lerini sadık bir şekilde genişletmek, incelemek ve ayırt etmek için izlenebilir bir in vitro sisteme şiddetle ihtiyaç vardır.
Son on yılda, in vitro epitel kök hücrelerini büyütmek için güçlü bir teknik, biyolojilerini ve hastalık13,14,15,16'yı incelemek için çeşitli (insan) epitel dokularına başarıyla uygulanmıştır. Bu teknoloji, doku epitel kök hücrelerinin, hücre dışı bir matrise (ECM) tohumlandığında, hücre dışı bir matrise (ECM) tohumlandığında (tipik olarak, Matrigel) ve dokunun kök hücre niş sinyalini ve / veya embriyogenezini kopyalayan tanımlanmış bir ortamda kültürlendiğinde 3D hücre yapılarına (yani organoidlere) kendi kendine gelişmesini sağlar. Organoid gelişim için gerekli tipik büyüme faktörleri epidermal büyüme faktörü (EGF) ve kanatsız tip MMTV entegrasyon bölgesi (WNT) aktivatörleri 14,15,16'dır. Ortaya çıkan organoidler, dokunun orijinal epitel kök hücrelerini taklit etmede kalıcı sadakatin yanı sıra, fenotip ve fonksiyonel özelliklerini korurken yüksek genişletilebilirlik ile karakterize edilir, böylece klinikten elde edilen sıklıkla sınırlı birincil insan dokusu mevcudiyetinin üstesinden gelir. Organoidleri oluşturmak için, epitel kök hücrelerinin kültürlemeden önce heterojen dokudan (yani, mezenkimal hücreler gibi diğer hücre tiplerini içeren) izolasyonu gerekli değildir, çünkü mezenkimal hücreler ECM'ye bağlanmaz veya gelişmez, sonuçta tamamen epitel organoidleriile sonuçlanır 13,16,17,18,19 . Bu umut verici ve çok yönlü teknoloji, çeşitli insan epitel dokularından manifold organoid modellerinin geliştirilmesine yol açmıştır. Bununla birlikte, diş gelişimi, rejenerasyonu ve hastalığının derinlemesine incelenmesi için değerli olan insan dişi kaynaklı organoidler henüz kurulmamıştır20,21. Son zamanlarda, ergen hastalardan çıkarılan üçüncü azı dişlerinden (bilgelik dişleri) DF dokusundan başlayarak böyle yeni bir organoid model geliştirmeyi başardık19.
Burada, yetişkin insan dişinden (yani, üçüncü azı dişlerinin DF'sinden) epitel organoid kültürleri geliştirme protokolünü açıklıyoruz (Şekil 1A). Ortaya çıkan organoidler, ERM ile ilişkili sap belirteçlerini eksprese ederken, uzun süreli genişletilebilir. İlginçtir ki, diğer organoid modellerin çoğunun aksine, tipik olarak ihtiyaç duyulan EGF, sağlam organoid gelişimi ve büyümesi için gereksizdir. İlginç bir şekilde, saplılık organoidleri ameloblast farklılaşma özellikleri gösterir, böylece ERM / DESC özelliklerini ve in vivo olarak meydana gelen süreçleri taklit eder. Burada açıklanan yeni ve benzersiz organoid model, DESC biyolojisini, plastisitesini ve farklılaşma kapasitesini keşfetmeye izin verir ve diş rejeneratif yaklaşımlara doğru ilk adımları atmak için kapıyı açar.
Protokol
Burada açıklanan tüm yöntemler Etik Kurul Araştırma UZ/KU Leuven (13/0104U) tarafından onaylanmıştır. Çekilen üçüncü azı dişleri (yirmilik dişler) hastaların bilgilendirilmiş onamından sonra elde edildi.
1. Hazırlıklar
- 48 delikli bir kültür plakasını, 37 ° C'de% 1.9'luk bir CO2 inkübatöründe 15-20 saat boyunca önceden ısıtın.
- Bir Matrigel aliquot'u sıvılaştırın (büyüme faktörü azaltılmış; fenol kırmızısız; ayrıca bazal membran matrisi olarak adlandırılır; BMM) adım 2.1'den önce en az 2 saat boyunca buz üzerinde (4 ° C).
NOT: BMM'nin donma/çözülme döngülerinden kaçının. BMM'yi buz üzerinde 15-20 saat sıvılaştırın ve mikrosantrifüj tüplerinde 1 mL'de aliquot ve -20 ° C'de saklayın. - Santrifüjü 4 °C'ye soğutun.
- Medya hazırlayın ve çözeltiyi 0,22 μm'lik bir filtreden filtreleyin. Aşağıdaki ciltler, DF'lerin tipik olarak aynı anda ayıklanan dört üçüncü azı dişinin tümünden toplanmasına dayanmaktadır.
- 20 mL DF toplama ortamı hazırlayın (Tablo 1): % 10 fetal sığır serumu (FBS),% 0.5 Amfoterisin B ve% 1 penisilin-streptomisin içeren minimum esansiyel orta kartal (αMEM). 4 mL DF toplama ortamını 15 mL'lik bir tüpe aktarın ve tüpleri buz üzerine aktarın.
NOT: Numune toplama için hasta başına bir adet 15 mL tüp yeterlidir (yani, dört üçüncü azı dişi için). - 20 mL diş organoid ortamı yapın (ayrıca TOM olarak adlandırılır; Tablo 2) serum içermeyen tanımlı ortam (SFDM; Tablo 3). TOM'u en fazla 2 hafta boyunca 4 °C'de saklayın.
- 8 mL ayrışma ortamı (Tablo 4), yani kollajenaz VI (3 mg / mL) ve dispaz II (4 mg / mL) içeren fosfat tamponlu salin (PBS) hazırlayın. Ayrışma ortamını 37 ° C'lik bir su banyosunda kullanımdan önce en az 10 dakika önceden ısıtın ve dört DF dokusunu ayırmak için iki adet 15 mL tüpe (tüp başına 4 mL) aktarın.
- İçeren bir yıkama plakası (12 kuyulu) hazırlayın: % 70 EtOH ile üç kuyu, PBS'li üç kuyu ve DF toplama ortamına sahip üç kuyu.
- Numune başına 15 mL orta A yapın (yani, hasta başına iki DF başına 5 mL; Tablo 5).
NOT: Aşağıdaki adımlar steril koşullar altında gerçekleştirilmelidir.
- 20 mL DF toplama ortamı hazırlayın (Tablo 1): % 10 fetal sığır serumu (FBS),% 0.5 Amfoterisin B ve% 1 penisilin-streptomisin içeren minimum esansiyel orta kartal (αMEM). 4 mL DF toplama ortamını 15 mL'lik bir tüpe aktarın ve tüpleri buz üzerine aktarın.
2. Diş folikülü ayrışması
- İlişkili DF'lere sahip üçüncü azı dişleri toplama ortamında (buz üzerinde) toplandıktan sonra, tüplerin içeriğini bir Petri kabına aktarın.
- Dişi bir cımbızla tutun ve DF'yi cerrahi bir bıçak kullanarak dikkatlice izole edin.
NOT: Bu adım pratik gerektirir; bıçağa dikkat edin. - Kalan kanı DF'lerden yıkamak için, DF dokularını kısaca% 70 EtOH'nin (yıkama plakası) ilk kuyucuğuna 20 sn boyunca yerleştirin ve daha sonra 20 sn için bir sonraki EtOH kuyusuna ve ayrıca üçüncü EtOH kuyusuna aktarın (toplamda% 70 EtOH'de maksimum 1 dakika; daha uzun inkübasyon süresi hücre canlılığının azalmasına neden olacaktır).
- Ardından, üç PBS kuyucuğunda durulamaya devam edin (toplamda en fazla 2 dakika).
- DF'leri kalan üç DF toplama ortamı kuyusunda durulayın (toplamda en fazla 20 dakikaya kadar).
- Durulanmış DF'leri yeni bir Petri kabına aktarın.
- Paraformaldehit (PFA) fiksasyonu için DF'lerden birinin (~ 5mm2) küçük bir parçasını kesin (bkz. bölüm 7) ve PFA fiksasyonuna kadar 500 μL DF toplama ortamı içeren bir mikrosantrifüj tüpünde buz üzerinde (maksimum 6 saat boyunca) saklayın.
- DF'lerin geri kalanını küçük parçalar halinde (~ 1 mm2) doğrayın.
NOT: Yeni izole edilmiş DF dokularının, kriyokorunmuş dokudan başlamak yerine, optimal organoid oluşumu ve büyüme verimliliği için derhal işlenmesi önerilir, bu da daha düşük verimle sonuçlanır. Bununla birlikte, primer DF dokusunu bu aşamada kriyoprotekte etmek mümkündür (bkz. kriyoprezervasyon ortamı ve bölüm 5'teki protokol). - Kıyılmış DF'leri 4 mL önceden ısıtılmış ayrışma ortamı içeren 15 mL'lik bir tüpe aktarın ve 2 saat boyunca 37 ° C'lik bir su banyosunda inkübe edin.
NOT: Optimum ayrışmayı sağlamak için 4 mL önceden ısıtılmış ayrışma ortamı (bir tüp) başına iki DF ekleyin. - Her 15 dakikada bir, doku parçalanmasını hızlandırmak için bir cam Pasteur pipet kullanarak DF-ayrışma ortamını pipet yukarı ve aşağı karıştırın. DF parçaları artık gözlenmediğinde (genellikle 1 saat sonra), daraltılmış bir ateş cilalı Pasteur pipet kullanarak DF ayrışmasına devam edin.
NOT: Optimum DF ayrışması için, en geç 1 saatlik DF izolasyonu olmadan ateş parlatma ile daraltılmış bir Pasteur pipete geçin.- Bu arada, 50 μL DNaz (0.2 mg / mL; Tablo 5).
- Ayrışmış DF'li her tüpe 5 mL orta A (DNaz içeren) ekleyin ve oda sıcaklığında (RT) 1 dakika inkübe edin.
- Kalan büyük parçaları ve (çoğunu) fibröz dokuyu çıkarmak için hücre süspansiyonunu (tek hücreler ve küçük hücre kümeleri içeren) 40 μm'lik bir hücre süzgecinden süzün.
- Bu adımda birkaç tüpü bir hastadan ayrışmış DF ile birleştirin.
- Filtreyi 1 mL orta A ile durulayın. filtrelenmiş hücre süspansiyonunu 200 x g'de 4 ° C'de 10 dakika boyunca santrifüj edin.
- Süpernatanı çıkarın, peleti 1 mL SFDM'de yeniden askıya alın (Tablo 3) ve hücre süspansiyonunu 1,5 mL'lik bir mikrosantrifüj tüpüne aktarın.
- Otomatik bir hücre sayacı kullanarak hücre konsantrasyonunu hesaplayın. Kalan hücre kümelerini ihmal edin.
- 4 °C'de 5 dakika boyunca 200 x g'de santrifüj.
3. Diş organoid kültürünün oluşturulması (Şekil 1A ve Şekil 2A)
- Elde edilen hücre sayısına dayanarak, tohumlanabilecek kuyu sayısını hesaplayın. Bir 20 μL damlacık 20.000 hücre içermelidir. Son karışım, 30:70 oranında hücre süspansiyonu ve BMM'den oluşur.
- Uygun miktarda süpernatantı çıkarın ve 70:30 oranında BMM elde etmek için buz gibi soğuk BMM'de yeniden askıya alın: kaplama için hücre süspansiyonu. Örneğin, 200.000 hücre elde edildiğinde, 20 μL'lik 10 damlacık plakalayın. Böylece, hücre süspansiyonunun 60 μL'si kalana kadar süpernatantı çıkarın, 140 μL buz gibi soğuk BMM ekleyin ve yeniden askıya alın.
- Hava kabarcığı oluşumunu önlemek için yavaşça askıya alın. BMM'de yeniden askıya alındıktan sonra, mikrosantrifüj tüpünü buz üzerinde tutun.
NOT: Mikrosantrifüj tüpünü buz üzerinde tutmak, BMM katılaşmasını önlemek için çok önemlidir.
- Hava kabarcığı oluşumunu önlemek için yavaşça askıya alın. BMM'de yeniden askıya alındıktan sonra, mikrosantrifüj tüpünü buz üzerinde tutun.
- Pipet 20 μL BMM damlacıklarının ortasındaki kuyucukların ortasındaki önceden ısıtılmış 48 delikli kültür plakasıdır.
- Plakayı baş aşağı çevirin,% 1,9'luk bir CO 2 inkübatörüne (SFDM tamponuna göre % CO2) koyun ve 37 ° C'de en az 20 dakika katılaşmasını sağlayın.
- TOM'a ROCK inhibitörü (RI; 10 μM) ve Amfoterisin B (% 0.1) ekleyin ve ortamı 37 ° C'lik bir su banyosunda önceden ısıtın.
NOT: Amfoterisin B ışığa duyarlıdır. - 48 delikli plakayı inkübatörden alın, dik yerleştirin ve hazırlanan önceden ısıtılmış ortamın 250 μL'sini BMM damlacık / hücreleri ile her bir oyuğa ekleyin ve% 1.9 CO2 inkübatörüne geri koyun.
- Ortamı yenilemek için (tercihen her 2-3 günde bir), 48 delikli plakayı 45° açıyla eğin, BMM damlacığına dokunmaktan kaçınırken önceki ortamı yavaşça çıkarın ve 250 μL yeni önceden ısıtılmış TOM ortamı ekleyin.
NOT: Temel besin maddelerinin ve büyüme faktörlerinin tükenmesini önlemek için haftada en az üç kez yenilenmeniz önerilir. RI'nın TOM'a sadece ilk tohumlamada ve her pasajın ilk günlerinde (bkz. bölüm 4) anoikis tarafından hücre ölümünü önlemek ve organoid büyümesini arttırmak için eklenmesi gerekir. Amfoterisin B, olası mantar kontaminasyonunu engellemek için sadece 0 (P0) geçişi sırasında ortama eklenir.
4. Diş organoid kültürünün amplifikasyonu ve geçişi (Şekil 1B ve Şekil 2B)
- Organoidleri 10 ila 14 günlük kültür arasında geçirin.
NOT: Uzun süreli kültür organoid yeniden büyümesini ve pasajını sınırlayabileceğinden daha uzun süre kültürlenmekten kaçının. Sadece ilk gelişimde (P0) organoidler, büyüme hızlarına bağlı olarak 20 güne kadar kültürlenebilir (çapı maksimum ±200 μm'ye ulaşana kadar). - Ortamı, geçirilmesi gereken organoidlerle kuyucuklardan çıkarın. Bir kültür koşulu içinde, dört adede kadar birleşik kuyuyu bir araya getirin (bkz. Şekil 2C).
- Organoidleri toplamak için, kuyucuk başına 400 μL buz gibi soğuk SFDM'yi doğrudan BMM damlacığının üzerine ekleyin ve tüm BMM damlacığı yerinden çıkana kadar ortamı tekrar tekrar yukarı ve aşağı pipetleyin.
- Kuyuların havuzlanması durumunda, havuzlanması gereken tüm kuyuların organoid içeren BMM damlacıklarını yerinden çıkarmak için 400 μL'yi ilk kuyudan diğerine (ve benzeri) aktarın.
- Yerinden çıkmış BMM-organoid tertibatı 1,5 mL'lik bir mikrosantrifüj tüpüne aktarın ve tüm organoid yapılar kuyucuklardan toplanana kadar adım 4.3'ü tekrarlayın.
- 4 °C'de 5 dakika boyunca 200 x g'de santrifüj.
- 37 ° C'lik bir su banyosunda TrypLE Express'in (5 μM'de RI ile desteklenmiş) bir aliquot'unu önceden ısıtın. Organoidlerin mikrosantrifüj tüpü başına, 400 μL TripLE Express hacmine ihtiyaç vardır.
- Santrifüjlemeden sonra, süpernatantı çıkarın ve peleti 400 μL TrypLE içinde yeniden askıya alın. Süspansiyonu 37 °C'lik bir su banyosunda 12 dakika boyunca inkübe edin.
- Enzimi inaktive etmek için 400 μL buz gibi soğuk SFDM ekleyin ve 4 ° C'de 5 dakika boyunca 200 x g'de santrifüj yapın. Süper natantı çıkarın.
- Bir ucu buz gibi soğuk SFDM ile önceden kaplayın (hacim için aşağıya bakınız) ve organoid peleti yeniden askıya alın.
- Organoid kaybını önlemek için, steriliteyi tehlikeye atmadan aynı (önceden kaplanmış) ucu mümkün olduğunca tekrar kullanın.
NOT: Peletin yeniden askıya alınması için gereken SFDM hacmi, elde edilen organoid yapıların sayısına ve mevcut geçiş numarasına bağlıdır. - Genel bir kural olarak, pasajlar için, P0 ila P2-3 (genellikle hala düşük sayıda organoid yetiştiren) 200 μL SFDM'lik bir hacim kullanır. Pasajlardan, P3-4 veya daha yüksek (genellikle daha fazla sayıda organoid verir) 700 μL'lik bir SFDM hacmi kullanır.
NOT: Her iki prosedür de sırasıyla 'düşük geçiş' ve 'yüksek geçiş' yöntemleri olarak adlandırılır (bkz. adım 4.10 ve 4.11). Farklı yöntemlerin doğru uygulanması, organoidlerin verimli bir şekilde geçirilmesi için çok önemlidir. Daha yüksek pasaj yöntemiyle, organoidler daha kolay kaybolur ve düşük sayıda organoidlere (yani P0 ila P2-3'te) uygulanmamalıdır. Bununla birlikte, daha büyük miktarlarda organoidleri verimli bir şekilde ayırmak için daha yüksek geçiş yöntemine ihtiyaç vardır.
- Organoid kaybını önlemek için, steriliteyi tehlikeye atmadan aynı (önceden kaplanmış) ucu mümkün olduğunca tekrar kullanın.
- Düşük geçiş yöntemi: Peletin 200 μL buz gibi soğuk SFDM'de yeniden askıya alınması. Tamamen boşaltılmış pipet ucunu, çapını azaltmak için mikrosantrifüj tüpünün tabanına doğru itin. Çapın yeterince küçük olup olmadığını kontrol edin (daha yavaş aspirasyon, akış çarpık ancak tıkanmamış). Organoidleri mekanik olarak bozmak için 5 dakika boyunca yukarı ve aşağı pipetleyin.
- Daha yüksek geçiş yöntemi: Pelet, P1000 ucu ile 700 μL buz gibi soğuk SFDM'de yeniden askıya alın. Bu P1000 ucun üzerine bir P200 uç (filtresiz) ekleyin ve buz gibi soğuk SFDM ile ön kat yapın. Orta hacmin en az% 90'ını (organoidlerle) aspire etmek için pipetin ses ayarını ayarlayarak hava kabarcığı oluşumunu önleyin. Organoidleri mekanik olarak bozmak için 5 dakika boyunca yukarı ve aşağı pipetleyin.
- Işık mikroskobu altında (4x büyütmede) esas olarak (sadece) birkaç dağılmamış yapıya sahip tek hücrelerin elde edilip edilmediğini kontrol edin.
- Mikrosantrifüj tüpüne 500 μL buz gibi soğuk SFDM ekleyin ve ayrışmış hücre karışımını pipetle taze SFDM ile yavaşça karıştırın.
- Mikrosantrifüj tüpünü buzun üzerine dikey olarak yerleştirerek büyük dağılmamış yapıların 10 dakika boyunca tortu oluşturmasına izin verin.
NOT: Dağılmamış yapıların çıkarılması gerekir, çünkü organoid pasajını olumsuz yönde etkilerler. Organoid başlatma (P0) için, bu çökeltme adımına gerek yoktur. - Tek hücreler ve küçük hücre kümeleri içeren süpernatantı (pasaj yöntemine bağlı olarak ~ 500-1.000 μL) toplayın; Yeni bir mikrosantrifüj tüpüne aktarın ve 4 ° C'de 10 dakika boyunca 190 x g'de santrifüj yapın.
- Otomatik bir hücre sayacı kullanarak hücre konsantrasyonunu hesaplayın. Kalan hücre kümelerini ihmal edin.
- Kaç kuyunun tohumlanabileceğini sayın ve yukarıda açıklandığı gibi uygun hücre süspansiyonu / BMM oranını hesaplayın (bölüm 3).
- BMM'nin% 70'ini hücre peletine ekleyin ve mikrosantrifüj tüpünü buz üzerinde tutun.
NOT: BMM katılaşmasını önlemek için mikrosantrifüj tüpünü buz üzerinde tutmak çok önemlidir. - Adım 3.3'ten 3.7'ye kadar devam edin ve kültürün 10. günü ile 14. günü arasında tekrar geçin.
5. Diş organoidlerinin kriyoprezervasyonu
- Pasaj için yukarıda belirtildiği gibi organoidleri toplayın ve ayırın (adım 4). Hücre süspansiyonunu 4 ° C'de 5 dakika boyunca 200 x g'de santrifüj yapın.
- Süpernatantı atın ve peleti SFDM (% 70), FBS (% 20) ve DMSO (% 10) içeren 1 mL kriyoprezervasyon ortamında yeniden askıya alın.
- Süspansiyonu bir kriyovyal içine aktarın ve buz üzerine koyun. Kriyovyalleri bir kriyo kutusuna yerleştirin ve -80 ° C'ye (en az 4 saat boyunca) aktarın.
- 1 ay içinde, dondurulmuş numuneleri uzun süreli (>12 ay) depolama için sıvı nitrojene aktarın.
6. Kriyokorunmuş diş organoidlerinin çözülmesi
- Çözme prosedürüne başlamadan önce,% 20 FBS ile 10 mL SFDM içeren buz üzerine kriyov başına bir adet 15 mL tüp yerleştirin.
- Kriyovyali sıvı azottan çıkarın ve buzun üzerine koyun.
NOT: Aşağıdaki adımları mümkün olduğunca hızlı bir şekilde uygulayın ve çok uzun çözülme süresinden (>5 dakika) ve adımlar arasında çok uzun aralıklardan (>5 dakika) kaçının, çünkü bu uzatma hücre sağkalımını azaltacaktır. - Kriyovyali çözülene kadar (~ 1-2 dakika) ılık su banyosuna (37 ° C) yerleştirin.
- Kriyovalin içeriğini derhal buz gibi soğuk 15 mL tüpe aktarın ve 4 ° C'de 5 dakika boyunca 200 x g'de santrifüj yapın.
- Süpernatantın 9 mL'sini çıkarın ve kalan 1 mL'yi 200 x g'de 4 ° C'de 5 dakika boyunca santrifüj edin. Süpernatantı çıkarın ve peleti 1 mL buz gibi soğuk SFDM ile yıkayın.
- Hücre süspansiyonunu 1,5 mL'lik bir mikrosantrifüj tüpüne aktarın ve otomatik bir hücre sayacı kullanarak hücreleri sayın.
- Kaç kuyunun tohumlanabileceğini sayın ve yukarıda açıklandığı gibi uygun hücre süspansiyonu / BMM oranını hesaplayın (bölüm 3).
- 4 °C'de 5 dakika boyunca 200 x g'de santrifüj. Peleti 70:30 BMM:TOM oranında yeniden askıya alın ve buzda tutun.
- 3.3'ten 3.7'ye kadar olan adımla devam edin ve kültürün 10. günü ile 14. günü arasında geçiş yapın.
7. Diş organoidlerinin fiksasyonu ve parafin gömülmesi
NOT: Bu prosedür (bölüm 8 ve 9 dahil) birincil DF dokusuna da uygulanabilir.
- PFA'da diş organoidlerinin sabitlenmesi
- Ortamı adım 4.2'de olduğu gibi her bir kuyucuktan çıkarın.
- BMM damlacığını yerinden çıkararak organoidleri toplayın (adım 4.3). BMM-organoid karışımını 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın.
- 4 °C'de 5 dakika boyunca 200 x g'de santrifüj.
- Süpernatantı çıkarın ve 500 μL% 4 PFA ekleyin ve yörüngesel bir çalkalayıcı üzerinde nazik bir karıştırma ile RT'de en az 30 dakika (maksimum 1 saat) inkübe edin.
DİKKAT: PFA ile çalışırken kimyasal başlığı kullanın. - 4 °C'de 5 dakika boyunca 200 x g'de santrifüj. Süpernatantı çıkarın ve organoid peleti PBS ile RT'de 10 dakika boyunca hafifçe sallayarak durulayın.
- Organoid peleti (adım 7.1.5) iki kez daha yıkayın. Sabit organoidleri 4 ° C'de 5 dakika boyunca 200 x g'de döndürün.
- Peleti 500 μL% 70 EtOH (deiyonize suda) içinde yeniden askıya alın. Organoidleri 4 °C'de %70 EtOH'de 1 aya kadar saklayın.
- Diş organoidlerinin agaroz ve parafin gömülmesi
NOT: Organoidleri parafine verimli bir şekilde gömmek için, agaroza gömmenin ek bir adımına ihtiyaç vardır.- PFA ile sabitlenmiş organoidleri 4 °C'de 5 dakika boyunca 200 x g'de %70 EtOH içinde santrifüj yapın. Süper natantı çıkarın.
- Bir cam şişede 30 mL PBS içinde% 2'lik bir agaroz çözeltisi hazırlayın. Agaroz-PBS karışımını jel benzeri bir yapı gözlenene kadar mikrodalgada ısıtın (600 W'ta yaklaşık 2,5 dakika).
- Paralel olarak, başka bir cam şişeye 30 mL PBS ekleyin ve mikrodalgada ısıtın (600 W'ta yaklaşık 2,5 dakika). Agaroz çözeltisini 1 dakika soğumaya bırakın.
- Agaroz çözeltisiyle hassas bir şekilde çalışmaya izin vermek ve hava kabarcıklarını önlemek için P200 ucunun ucunu kesin.
- P200 ucunu sıcak PBS'de birkaç kez yukarı ve aşağı pipetle çekerek önceden ısıtın.
- Organoid peletine 150 μL önceden ısıtılmış agaroz çözeltisi ekleyin ve hava kabarcıklarından kaçınırken organoid-agaroz karışımını (minimum süspansiyonla) hafifçe pipetleyin.
NOT: Minimum süspansiyon, organoidler daha sonra birbirlerine daha yakın olduklarından, mikrotom kesitlemesinde agaroz jelindeki organoidlerin daha iyi konumlandırılmasını sağlayacaktır. - Organoid-agaroz karışımını derhal aynı mikrosantrifüj tüp kapağına aktarın, tüpü yatay olarak yerleştirin ve agarozun katılaşmasına izin verin (RT'de ~ 20 dakika). Bu arada, kasetleri etiketleyin.
- Katılaştıktan sonra, agaroz jelini bir cımbız kullanarak mikrosantrifüj kapağından çıkarın ve etiketli bir kasete aktarın.
- Agaroz içeren kaseti deiyonize suda %50 EtOH içeren bir behere aktarın. EtOH'nin buharlaşmasını önlemek için beheri parafilm ile örtün.
NOT: Beherin hacmi, kaset sayısına bağlıdır. - Numuneleri gece boyunca bir doku işlemcisinde işleyin.
NOT: Parafin RT'de katılaştığından, aşağıdaki adımlar hızlı bir şekilde gerçekleştirilmelidir. - Gömme iş istasyonundaki bir ısıtma bloğunu 15 dakika boyunca önceden ısıtın.
- Kasetin içindeki organoid içeren agaroz jelini çıkarın ve önceden ısıtılmış ısıtma bloğuna yerleştirin. Kapağı kasetten çıkarın ve daha sonra kullanmak üzere bir kenara koyun.
- Kalan ısıtma bloğunu parafin ile doldurun.
NOT: Organoid içeren agaroz jelinin hala ısıtma bloğunun dibinde bulunup bulunmadığını bir cımbızla kontrol edin. Hafifliği nedeniyle, yüzmeye başlayabilir ve numune kaybına neden olabilir. - Kaset kapağını ısıtma bloğunun üzerine yerleştirin. Soğuk bir tabakta 30 dakika boyunca katılaşmasına izin verin. Isıtma bloğunu çıkarın ve parafin bloklarını 4 ° C'de saklayın.
8. Diş organoidlerinin mikrotom kesitlenmesi ve boyanması (Şekil 2B ve Şekil 3A-C)
- Organoid içeren parafin bloklarının mikrotom kesitlenmesi
- Parafin bloklarındaki diş organoidlerinin 5 μm kesitlerini bir mikrotom kullanarak dilimleyin.
- Parafin dilimlerini mikroskop cam slaytının üzerine yerleştirin. Mikroskop cam kızağını 37 ° C'de ılık bir plakaya yerleştirin ve bir Pasteur pipet kullanarak deiyonize suyla örtün.
- Mikroskop camının gece boyunca kurumasına izin verin.
- Diş organoid kesitlerinin boyanması
- Organoid bölümleri (mikroskop cam slaytında) bir fırında 58 ° C'de 1 saat boyunca deparafinize edin.
- Organoid bölümleri (mikroskop cam slaytı üzerinde) kimyasal davlumbazın içindeki EtOH serisini aşağıdaki sırayla azaltarak yeniden sulandırın:
Her biri 3 dakika için ksilen 2x
Her biri 3 dakika için %100 EtOH 2x
Her biri 3 dakika için %95 EtOH 2x
Her biri 3 dakika için %90 EtOH 2x
Her biri 3 dakika için %70 EtOH 3x
DİKKAT: Ksilen ile çalışırken kimyasal başlığı kullanın. - Mikroskop camı kaydırağını musluk suyunda RT'de 5 dakika durulayın. Ardından, RT'de 5 dakika PBS'de durulayın.
- Organoid bölümleri (mikroskop cam slaydında) önceden ısıtılmış sitrat tamponuna (pH 6 ile deiyonize suda 10 mM sitrik asit; plastik bir kapta; 95 ° C'lik bir su banyosunda 10 dakika önceden ısıtılmış) 95 ° C'lik bir su banyosunda 30 dakika boyunca yerleştirerek antijen alımını gerçekleştirin.
- Mikroskop camı slaytını RT'de 5 dakika PBS'de ve daha sonra RT'de 5 dakika boyunca% 0.1 Triton-X (PBT) içeren PBS'de durulayın.
- Her slaytın sınırlarında hidrofobik bir bariyer oluşturmak için bir işaretleme kalemi kullanın.
- RT'de bloke edici tamponda (PBT'de çözünmüş 1.5 mg / mL glisin, 2 mg / mL albümin sığır serumu (BSA) içeren) artı% 10 eşek serumu içeren minimum 1 saat boyunca bloke edin.
NOT: Tipik olarak, mikroskop cam slayt başına 300 μL bloke tampon artı %10 eşek serumu gereklidir. - Mikroskop cam slaytını nemli bir odaya yerleştirin. Tüm slaytların sığdığı hava geçirmez bir kutu kullanın ve kutunun altına yerleştirmek için birkaç kağıt mendili suyla ıslatın. Bu, sonraki boyama adımları sırasında slaytların kurumasını önleyecektir.
- Bloke edici tamponu çıkarın, bloke edici tamponda hazırlanan birincil antikoru (Tablo 6) artı %1 eşek serumunu ekleyin ve antikor çözeltisi ile kaplı slaytı 4 °C'de nemli odada gece boyunca inkübe edin. Gerekirse kalem kenarlığını işaretleme işlemini yeniden yapın.
- Mikroskop camı slaytını RT'de PBT'de üç kez 10 dakika boyunca yörüngesel çalkalayıcı (75-150 rpm) üzerinde nazik bir karıştırma ile yıkayın.
- Bloke edici tampon artı %1 eşek serumunda hazırlanan sekonder antikoru (Tablo 6) ekleyin ve RT'deki nemli odada 1 saat boyunca inkübe edin.
- Bloke edici tamponu çıkarın ve mikroskop camı slaytını RT'de PBT'de üç kez yörüngesel bir çalkalayıcı üzerinde nazik bir karıştırma ile 10 dakika boyunca yıkayın.
- Bir cam kapak kapağına DAPI (1 ila 3 damlacık) ile antifade montaj ortamı ekleyin ve bunu organoid bölümlerin üzerine (mikroskop cam slaytına) monte edin. Görüntülemeye devam edin; slaytları 4 °C'de en fazla 1 hafta saklayın.
9. Diş organoidlerinin RNA Ekstraksiyonu ve RT-qPCR'si (Şekil 2B ve Şekil 3D)
- Diş organoidlerinin RNA ekstraksiyonu
- Ortamı her bir kuyucuktan çıkarın (adım 4.2).
- BMM damlacığını yerinden oynatarak organoidleri toplayın (adım 4.3), BMM-organoid karışımını 1.5 mL'lik bir mikrosantrifüj tüpüne aktarın ve 4 ° C'de 5 dakika boyunca 200 x g'de santrifüj yapın.
- Süpernatanı çıkarın, lizis tamponunda çözünmüş 350 μL'lik %1'lik β-merkaptoetanolde kuvvetlice askıya alın (Malzeme Tablosu) ve buz üzerine koyun.
DİKKAT: Tüm adımları kimyasal bir başlıkta β-merkaptoetanol ile gerçekleştirin.
NOT: Numuneler bu adımda -80 °C'de 1 aya kadar saklanabilir. Adım 9.1.4'e geçmeden önce örnekleri buz üzerinde çözün. - Artık hiçbir organoid yapı gözlenmeyene kadar örnekleri vorteksleyin.
- Üreticinin talimatlarına göre RNA ekstraksiyon kitini (Malzeme Tablosu) kullanarak RNA ekstraksiyonuna devam edin.
- Diş organoidlerinin RT-qPCR'si (Tablo 7)
- Üreticinin talimatlarına göre ters transkripsiyon kitini (Malzeme Tablosu) kullanarak RNA19'u ters transkripte edin (RT).
- Elde edilen cDNA örneklerini SYBR Yeşil tabanlı kantitatif PCR (qPCR)19 ile Gerçek Zamanlı PCR Sistemi (Malzeme Tablosu) kullanarak analiz edin.
Sonuçlar
Diş organoid gelişimi
Bilgelik diş çekimini takiben edinilen insan DF dokusundan organoid kültürler oluşturmak için ayrıntılı bir protokol sunuyoruz (Şekil 1A). İzole DF enzimatik ve mekanik olarak ayrışır. Elde edilen hücreler, optimal organoid gelişim ve büyüme için ampirik olarak tanımlanmış ortamlarda BMM içinde kültürlenir (diş organoid ortamı; TOM)19.
Organoidler tipik olarak DF hücre tohumlamasından sonraki 2 hafta içinde gelişir (P0; Şekil 2A). Organoidler uzun süreli genişletilebilir (şimdiye kadar 11 pasaja kadar) (Şekil 2B, P4'te gösterilmiştir). BMM damlacığı başına yaklaşık 20.000 hücrenin tohumlanması (hem P0 hem de diğer pasajlarda) optimal bir organoid yoğunluğu (Şekil 2C) verirken, daha yüksek hücre sayılarının tohumlanması, büyümek için yeterli alan olmadığı için optimal olmayan organoid büyümesine (yani, çok yüksek yoğunlukta daha küçük organoidler) yol açar (Şekil 2D). Sonunda optimize edilmiş kültür koşulları, DF numunelerinden organoidlerin %100 verimlilikle geliştirilmesine izin verir19.
Diş organoid karakterizasyonu ve validasyonu
Geliştirilen organoidler yoğun bir görünüm gösterir ve ERM hücreleri7'de benzer şekilde gözlendiği gibi yüksek nükleo-sitoplazmik oran gösteren hücreler içerir (Şekil 3A). Dahası ve daha ileri analojide, organoidler ERM belirteci sitokeratin 14'ü (CK14) 22 eksprese eder, böylece epitel kökenlerini (Şekil 3B) ve diğer önerilen ERM belirteçlerini (P63, CD44 ve ITGα612,22,23 (Şekil 3B) doğrular. Dahası, organoidler farelerde iyi bilinen bir DESC belirteci olan SOX2'yi eksprese eder ve ayrıca gelişmekte olan insan dişlerinin epitelinde bulunur (Şekil 3B)1. İlginç bir şekilde, organoidlerde de eksprese edilen emaye matrisinin ana bileşeni olan amelogenin (AMELX), ERM24'te de tespit edilmiştir (Şekil 3C). Hala diğer ERM / saplılık belirteçlerinin ekspresyonu son çalışmamızda19'da tanımlanmıştır ve elde edilen organoidleri daha fazla sertifikalandırmak için kullanılabilir. Ayrıca, organoidler pasaj sırasında ERM / kök hücre fenotiplerini korurlar, diğerleri arasında ERM / kök hücre belirteçlerinin kararlı ekspresyonu ile gösterilmiştir (Şekil 3D). Son olarak, diş kaynaklı organoidler, elde edilen organoid kültürleri doğrulamak için de uygulanabilen ameloblast (-benzeri) hücrelere farklılaşma kapasitesi gösterir ve farklılaşma ortamına aktarıldıktan sonra odontojenik-ameloblast ile ilişkili protein (ODAM) ve amelotin (AMTN) gibi olgun ameloblast belirteçlerinin ekspresyonunu gösterir (bkz.19).

Şekil 1: Diş organoid gelişimi, karakterizasyonu ve uygulamalarının şematik iş akışı. (A) Patlamamış üçüncü azı dişlerinden izole edilen diş folikülü (DF) dokusundan diş organoid gelişimi. (B) Diş organoidlerinin amplifikasyonu, karakterizasyonu ve uygulama potansiyeli. d, gün; P, pasaj. BioRender.com ile oluşturuldu. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
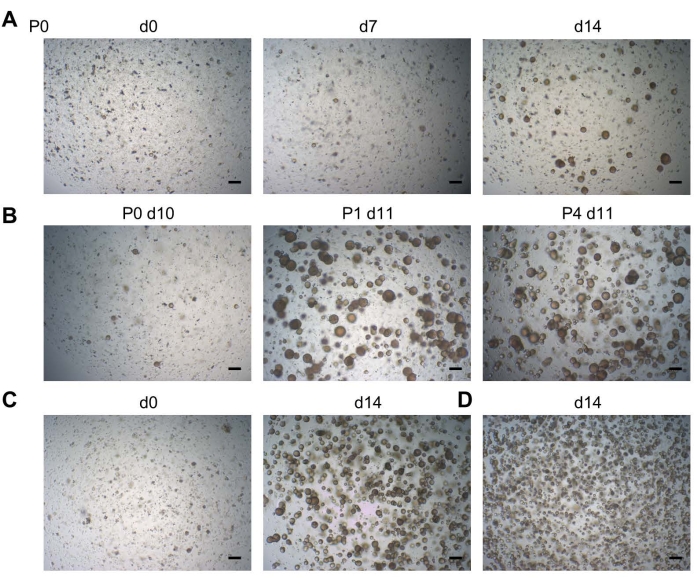
Şekil 2: Diş organoid gelişimi. (A) DF dokusundan organoid gelişim. Tohumlamadan sonra farklı günlerde (d) gösterilen temsili parlak alan görüntüleri (P0; P, pasaj; 2.5x). (B) Bir diş organoid çizgisinin sağlam pasajını gösteren parlak alan görüntüleri (2.5x). (C) Pasajda hemen bir diş organoid çizgisini gösteren parlak alan görüntüleri (d0; sol; 2.5x) kuyu başına 20.000 hücre yoğunluğunda tohumlanmış ve bunun sonucunda ortaya çıkan akan organoid kültürü geçmeye hazır (d14; sağ; 2.5x). (D) 20.000 > hücre yoğunluğunda tohumlanmış ve d14'te (2.5x) çok yüksek yoğunlukta daha küçük organoidlere yol açan bir diş organoid çizgisini gösteren parlak alan görüntüleri. Ölçek çubukları: 200 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 3: Diş organoid karakterizasyonu. (A) TOM'da 14 günde gelişen yoğun yapıları gösteren DF türevi organoid kültürlerin farklı büyütmelerdeki parlak alan görüntüleri (P4; 5-20x)). Bir organoidin hematoksilin ve eozin boyanması (P1, gün 11). Kutu büyütüldü. Oklar, yüksek nükleo-sitoplazmik orana sahip hücreleri gösterir. (B) TOM tarafından yetiştirilen organoidlerde epitelyal/ERM/sap belirteçleri için immünofloresan boyama (20x). (C) Tom tarafından yetiştirilen organoidde (20x) amelogenin (AMELX) için immünofloresan boyama. Çekirdekleri etiketlemek için DAPI (mavi) kullanıldı. (D) Kültürün 14. gününde P1 ve P5 Tom tarafından yetiştirilen organoidlerdeki ERM / stemlik belirteçlerinin gen ekspresyon seviyeleri ( GAPDH'ye göre) (ortalama ± SEM; n = 3 biyolojik replikasyon). Ölçek çubukları: Aksi belirtilmedikçe 50 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Diş folikülü (DF) toplama ortamı | |
| Ad | Konsantrasyon |
| Minimum esansiyel orta kartal (αMEM) | |
| Fetal sığır serumu (FBS) | 10% |
| Amfoterisin B | 0.5% |
| Penisilin-streptomisin (Pen/Strep) | 1% |
Tablo 1: Dental folikül (DF) toplama ortamı. Tabloda, DF toplama ortamının bileşenleri listelenmektedir.
| Diş organoid ortamı (TOM) | |
| Ad | Konsantrasyon |
| Serumsuz tanımlı ortam (SFDM) | Kompozisyon için Tablo 3'e bakınız |
| A83-01 | 0,5 μM |
| B27 (A vitamini olmadan) | 2% |
| Kolera Toksini | 100 ng/mL |
| FGF2 (= temel FGF) | 20 ng/mL |
| FGF8 Serisi | 200 ng/mL |
| FGF10 Serisi | 100 ng/mL |
| L-Glutamin | 2 mM |
| IGF-1 | 100 ng/mL |
| N2 | 1% |
| N-asetil L-sistein | 1,25 mM |
| Nikotinamid | 10 mM |
| Kafa | 100 ng/mL |
| RSPO1 | 200 ng/mL |
| SB202190 (p38i) | 10 μM |
| Şşş | 100 ng/mL |
| WNT3a | 200 ng/mL |
Tablo 2: Diş organoid besiyeri (TOM). Tablo, diş organoid ortamını hazırlamak için gereken bileşenleri ve ilgili konsantrasyonlarını listeler.
| Serumsuz tanımlı ortam (SFDM) (pH 7,3) | |
| Ad | Konsantrasyon |
| Steril H2O | |
| DMEM 1:1 Fe olmadan F12 | 16,8 gr/l |
| Transferrin | 5 mg/L |
| Sığır pankreasından insülin | 5 mg/L |
| Penisilin G sodyum tuzu | 35 mg/L |
| Streptomisin sülfat tuzu | 50 mg/L |
| Etanol mutlak, ≥% 99.8 (EtOH) | 600 μL/L |
| Sığır karaciğerinden katalaz | 50 μL/L |
| Sodyum Hidrojen Karbonat (NaHCO3) | 1 g/L |
| Albümin Sığır (hücre kültürü sınıfı) | 5 g/L |
Tablo 3: Serumsuz tanımlı ortam (SFDM) (pH 7.3). Tablo, serumsuz tanımlanmış ortamın bileşimini listeler.
| Ayrışma ortamı | |
| Ad | Konsantrasyon |
| Fosfat tamponlu salin (PBS) | |
| Kollajenaz IV | 3 mg/mL |
| Dispase II | 4 mg/mL |
Tablo 4: Ayrışma ortamı. Ayrışma ortamını hazırlamak için bileşenlerin ve gerekli konsantrasyonlarının listesi.
| Orta A (pH 7.3) | |
| Ad | Konsantrasyon |
| Steril H2O | |
| DMEM tozu yüksek glikoz | 13,38 gr/l |
| HEPES | 5.958 gr/l |
| Sodyum-piruvat (C 3 H 3NaO3) | 110 mg/L |
| Penisilin G sodyum tuzu | 35 mg/L |
| Streptomisin sülfat tuzu | 50 mg/L |
| Sodyum Klorür (NaCl) | 0,5 g/L |
| Sodyum Hidrojen Karbonat (NaHCO3) | 1 g/L |
| Albümin Sığır (hücre kültürü sınıfı) | 3 g/L |
| Dnase* | 0.2 mg/mL |
| *bahsedildiğinde ekle |
Tablo 5: Orta A (pH 7.3). Tablo, Orta A'yı hazırlamak için kullanılan bileşenlerin konsantrasyonunu listeler.
| Primer Antikorlar | ||
| Ad | Ev sahibi | Konsantrasyon |
| AMELX | fare | 1:100 |
| CD44 | fare | 1:200 |
| CK14 | fare | 1:200 |
| ITGA6 | tavşan | 1:200 |
| P63 Serisi | tavşan | 1:1000 |
| SOX2 Serisi | tavşan | 1:2000 |
| Gizli Antikorlar | ||
| Ad | Ev sahibi | Konsantrasyon |
| fare IgG (Alexa 555) | eşek | 1:1000 |
| tavşan IgG (Alexa 488) | eşek | 1:1000 |
Tablo 6: Antikorların ve seyreltmelerinin listesi. Tablo, bu çalışmada kullanılan antikorları ve ilgili dilüsyonlarını listeler.
| Astar | ||
| Gen | İleri astar | Ters astar |
| GAPDH | GGTATCGTGGAAGGACTCATGAC | ATGCCAGTGAGCTTCCCGTTCAG |
| P63 Serisi | CAACGCAGTAGACACCATTTCC | CCCAAAACCTTCTCGCTTGTT |
| ITGA6 | GGCGGTGTTATGTCCTGAGTC | AATCGCCCATCACAAAAGCTC |
| SOX2 Serisi | GCTGGGACATGTGAAGTCTG | CCCTGTGGTTACCTCTTCCT |
| PITX2 Serisi | CAGCGGACTCACTTTACCAG | ATTCTTGAACCAAACCCGGAC |
Tablo 7: Astarların listesi. Tablo, bu çalışmada kullanılan GAPDH, P63, ITGA6, SOX2 ve PITX2 primerlerini listeler.
Tartışmalar
Bu protokol, insan dişinden başlayarak organoidlerin verimli ve tekrarlanabilir oluşumunu tanımlar. Bildiğimiz kadarıyla bu, insan diş dokusundan başlayarak akım kavramı (epitelyal) organoidlerin kurulması için ilk metodolojidir. Organoidler uzun süreli genişletilebilir ve daha önce DF7'nin ERM bölmesinde bildirilen DESC'leri çoğaltan bir diş epitelyal sap fenotipi gösterir. Ayrıca, organoidler, bir ameloblast farklılaşma sürecinin ortaya çıkması da dahil olmak üzere fonksiyonel DESC / ERM özelliklerini çoğaltır 7,25,26. Bağımsız hasta organoid hatları19 ile karşılaştırılabilir sonuçlar bulunduğundan bulgular sağlamdır.
Bu diş organoid protokolünü uygularken, birkaç kritik noktanın dikkate alınması gerekir. İlk olarak, ilk tohumlamada ve her geçişten hemen sonra Rho ile ilişkili kinaz (ROCK) inhibitörü Y-27632'nin eklenmesi, tek hücrelerin anoikis27'ye maruz kalmasını önlemek için gereklidir. Ek olarak, Amfoterisin B, P0 sırasındaki tüm medya içeceklerinde, (oral) mantar büyümesini önlemek için gereklidir. İkincisi, kriyokorunmuş dokudan başlamak yerine, optimal organoid oluşumu ve büyüme verimliliği için taze izole edilmiş DF dokularının derhal işlenmesi tavsiye edilir, bu da daha düşük verimle sonuçlanır. Üçüncüsü, kriyokorunmuş bir organoid hattını kültürleme için çözerken, adımları mümkün olduğunca hızlı bir şekilde gerçekleştirin ve çok uzun çözülme süresinden ve zaman uzaması hücre sağkalımını azalttığından, adımlar arasında çok uzun aralıklardan kaçının. Dördüncüsü, erken geçişte (P0-P3) organoid sayısının sınırlı kalabileceğine dikkat edilmelidir, çünkü spesifik izole DF doku örneklerinde sadece sınırlı sayıda ERM (kök) hücresi bulunabilir. Bu nedenle, erken geçişteki organoid kültürler dikkatli ve dikkatli bir şekilde ele alınmalıdır. Bu nedenle, (i) organoid kültürün hızlı genişlemesinden kaçınılması önerilir (yani, P3-4'ten başlayarak sadece 1: 3 veya daha fazla bölünmeye başlayın ve 1: 0.5 veya 1: 1'den önce); (ii) açıklandığı gibi uygun bölme yöntemini (düşük pasaj - yüksek pasaj) kullanmak. Bu bağlamda genç ergen hastaların (15-19 yaş) ERM hücrelerinin diş gelişimi ve28 yaş ile birlikte sayıca azalması nedeniyle patlamamış yirmilik dişlerinin toplanması önerilmektedir. Beşincisi, hücre süspansiyonundaki DF dokusundan dağılmamış sert doku fragmanlarının kalması (filtrelemeden sonra bile), BMM damlasının daha az kararlı olmasına ve kültür sırasında yerinden çıkma olasılığının daha yüksek olmasına neden olur. Ayrışmış DF hücre süspansiyonunda birden fazla dağılmamış sert doku fragmanı gözlenirse, BMM'nin daha yüksek bir yüzdesi (% 80 gibi) önerilir. Altıncısı, organoidlerin kültürün 10. günü ile 14. günü arasında geçmesi şiddetle tavsiye edilir, çünkü daha uzun kültür, daha az optimal ayrışma nedeniyle organoid genişletilebilirliğini olumsuz yönde etkileyecektir. Bir veya başka bir nedenden ötürü, organoidler 14 günden daha uzun süre kültürlenirse, organoid ayrışması için TryplE Express miktarı ve kuluçka süresi, etkili ayrışma için uzatılabilir, ancak 15 dakikalık enzimatik maruziyet aşılmamalıdır. Aynı bağlamda, besin ve büyüme faktörü tükenmesini önlemek için kültür ortamının her 2-3 günde bir yenilenmesi gerekir. Organoidlerin düzgün bir şekilde genişlememesi durumunda, yukarıda belirtilen kritik noktalardan bağımsız olarak, buz üzerinde geçiş sırasında kullanılan tüm aletleri (BMM, ön kaplama ucu için buz gibi soğuk SFDM, mikrosantrifüj tüpleri) tutmaya odaklanılmalıdır. Ek olarak, organoidlerin verimli bir şekilde pasajlanması için farklı pasaj yöntemlerinin (düşük pasaj ve yüksek pasaj yöntemi) doğru bir şekilde uygulanması çok önemlidir.
Daha önce, diğer gruplar primer insan DESC / ERM dokusunun in vitro büyümesini bildirmiştir 8,9,10,11,12,21. Bununla birlikte, kültürler esas olarak 2D (monokatmanlar) idi ve bu organoid model gibi 3D değildi, ayrıca sadece kısa süreli büyüme ve fenotip retansiyonu gösteriyordu. Alternatif olarak, sıklıkla (kendiliğinden) ölümsüzleştirilmiş hücreler kullanılmıştır, ancak bunlar fizyolojik değildir ve menşe doku veya hücrelere sadece sınırlı benzerlik gösterir. Dahası, bu hücre hatları embriyonik dokudan ve / veya hayvanlardan türetilmiştir. Ayrıca, ameloblast farklılaşması ya tanımlanmamıştır ya da sadece sınırlı olarak belgelenmiştir. Bu nedenle, burada sunulan organoid model, (i) menşe dokusunun / hücrelerinin sadık bir şekilde özetlenmesi, (ii) uzun süreli genişletilebilir, (iii) in vivo konfigürasyonu daha yakından temsil eden 3D olarak kültürlenmiş, (iv) insan kökenli ve doğum sonrası yaş ve (v) olgun diş hücrelerine (ameloblast hücre tipi) farklılaşabilen çeşitli avantajlar sunmaktadır (bkz.19).
Böylece, daha önce rapor edilmemiş, birkaç ilginç uygulama içeren değerli bir araştırma aracı oluşturduk (Şekil 1B). Organoidler, insan DESC / ERM sapını ve plastisitesini incelemek için uygulanabilir. İmmünofloresan, gen ekspresyonu ve (tek hücreli) transkriptomik analizler yoluyla hala esrarengiz ERM hücre popülasyonunun biyolojisi hakkında daha fazla bilgi edinme fırsatı sunar. Ek olarak, organoidler özellikle patogenetik mekanizmaları deşifre etmek, (yeni) terapötik hedefleri tanımlamak ve ilaç keşif ve tarama araçları üretmek için insan hastalığı modellemesi için uygundur29. Daha spesifik olarak, bu model, sağlıklı diş kaynaklı organoidlerle karşılaştırılabilen odontojenik kistlere (güvenilir bir araştırma modelinin bulunmadığı) uygulanabilir. Ek olarak, bu diş organoid yaklaşımı, bakterilerin etkisinden diş anomalileriyle ilişkili genetik mutasyonlara (CRISPR-Cas gibi en yeni gen düzenleme yöntemleri kullanılarak tanıtılabilecek P63'teki mutasyonlar gibi) kadar değişen diş hastalıklarını modellemek ve incelemek için kullanılabilir30, sonunda potansiyel ve yeni, terapötik hedeflere ve tedavilere yol açar. Diş organoid protokolünün diğer uygulamaları, manifoldlu kişilerden ve hastalıklardan organoid hatları toplamak için biyobankacılığı (şu anda Future Health Biobank gibi diş pulpası için zaten mevcut)31'i içerebilir (örneğin, ilaç taraması gibi temel ve translasyonel araştırmalar için). Ayrıca, sadece epitel değil, aynı zamanda orijin dokusunun diğer hücre tiplerini de içeren kompozit organoid modeller hakkında çeşitli raporlar yakın zamanda yayınlanmıştır32,33. Diş kompozisyonu oldukça karmaşık olduğundan, mezenkimal ve immün ve endotel hücrelerini barındırdığından, bu epitelyal organoid modelini, in vivo muadillerini daha ayrıntılı olarak temsil etmek için bu hücre tipleriyle kombinasyon halinde uygulamak çekici bir bakış açısıdır. Ayrıca, bu sistem insan dişindeki amelogenezi keşfetmeye izin verir, şu anda sadece tam olarak anlaşılamamıştır, ancak kesinlikle epitel-mezenkimal etkileşimlere dayanmaktadır. Ameloblast gelişiminin deşifre edilmesinin, diş bilimsel ve klinik dünyasında ileriye doğru önemli bir sıçramayı temsil etmesi beklenmektedir, çünkü dişlerimizin en önemli bileşeni olan emaye üretimi, diş dokusu onarımında oldukça kovalanan bir hedeftir. Ayrıca, bu çalışmada detaylandırılan organoid modelleme, in vitro mineralize dokuların oluşumuna doğru başlangıcı ifade edebilir ve replasman tedavisi için biyomühendislik ürünü bir diş (veya en azından parçalar) geliştirmenin yolunu açabilir.
Organoid modelin sınırlamalarından biri, yalnızca dokunun epitel bileşenini temsil etmesidir. Bununla birlikte, yukarıda ayrıntılı olarak açıklandığı gibi, bu eksiklik, diş mezenkimi19 gibi diğer hücre / doku tiplerinin eklenmesiyle çözülebilir. Bir sınırlama olarak kabul edilebilecek bir başka husus, burada kullanılan BMM'nin kökenidir (Matrigel). Bu BMM, bir farenin sarkomundan (Engelbrecht-Holm-Swarm) türetilmiştir ve bu nedenle organoid yaklaşımı kliniğe çevirmeden önce değiştirilmelidir. Son zamanlarda, Matrigel'i sentetik hidrojeller34,35 ile değiştirmek için çeşitli çabalar sarf edilmiştir. Bununla birlikte, bu tür doğal olmayan jellerde organoidleri başarılı bir şekilde büyütmek için daha fazla araştırmaya ihtiyaç vardır. Organoid teknolojisi, gelecekteki dental rejeneratif tedavi için ilginç bir yaklaşım sunsa da - örneğin, biyomühendislik ürünü bir dişin geliştirilmesi - hücre donörlerinin mahremiyeti ve bunlardan türetilen insan organoidlerinin ve dokularının ticarileştirilmesi ile ilgili etik sorular ortaya atılmalıdır. Şimdiye kadar, rejeneratif amaçlar için organoid ticarileştirme ile ilgili hiçbir sonuca varılmamıştır36. Diş pulpası biyobankaları31 artışın yanı sıra, ilaç taraması amacıyla başta kanserli dokular olmak üzere birkaç organoid biyobankadan gelmektedir. Organoidlerin hücreler, gametler, dokular veya organlar olarak kategorize edilemeyeceği göz önüne alındığında (hepsi yasalarla düzenlenir), klinik, bilimsel veya ticari ortamlarda kullanımı için yasal statüsünü tasvir etmek için acil bir ihtiyaç vardır. Organoidlerin deri altından in vivo19 nakledildiğinde mineralize doku biriktirdiği gösterilmiş olsa da, doğal bir insan dişininkine benzer emaye biriktirme potansiyellerini analiz etmek için daha ileri çalışmalara ihtiyaç vardır.
Toplamda, geliştirilen yeni organoid model, insan dişi (kök hücre) biyolojisini ve amelogenezini incelemek için umut verici, değerli bir araç sunmaktadır, her ikisi de şu anda sadece zayıf bir şekilde araştırılmıştır, diş hastalığı modellemesine ve rejeneratif tedavilere yönelik gelecekteki perspektiflerle.
Açıklamalar
Sorumlu yazar, tüm yazarların her türlü çıkar çatışmasını açıklamış olmasını sağlar.
Teşekkürler
UZ Leuven'in Ağız Diş ve Çene Cerrahisi (MKA) personeline ve hastalara, taze çıkarılmış üçüncü azı dişlerinin toplanmasındaki paha biçilmez yardımları için minnettarız. Ayrıca örnek toplama konusundaki yardımları için Dr. Reinhilde Jacobs ve Dr. Elisabeth Tijskens'e teşekkür ederiz. Bu çalışma KU Leuven (BOF) ve FWO-Flanders (G061819N) tarafından sağlanan hibelerle desteklenmiştir. L.H. FWO Ph.D. Fellow'dur (1S84718N).
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Eppendorf | 30120.086 | |
| 15 mL Centrifuge tube | Corning | 430052 | |
| 2-Mercaptoethanol | Sigma-Aldrich | M-6250 | |
| 48-well flat bottom plates | Corning | 3548 | |
| 50 mL Centrifuge tube | Corning | 430290 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Agarose | Lonza | 50004 | |
| Albumin Bovine (cell culture grade) | Serva | 47330.03 | |
| AMELX antibody | Santa Cruz | sc-365284 | |
| Amphotericin B | Gibco | 15200018 | |
| B27 (without vitamin A) | Gibco | 12587-010 | |
| Cassette | VWR | 7202191 | |
| Catalase from bovine liver | Sigma-Aldrich | C100 | |
| CD44 antibody | Abcam | ab34485 | |
| Cell strainer, 40 µm | Falcon | 352340 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Citric acid | Sigma-Aldrich | C0759 | |
| CK14 antibody | Thermo Fisher Scientific | MA5-11599 | |
| Collagenase IV | Gibco | 17104-019 | |
| Cover glass | VWR | 6310146 | |
| Cryobox | Thermo Scientific | 5100-0001 | |
| Cryovial | Thermo Fisher Scientific | 375353 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dispase II | Sigma-Aldrich | D4693 | |
| DMEM 1:1 F12 without Fe | Invitrogen | 074-90715A | |
| DMEM powder high glucose | Gibco | 52100039 | |
| Dnase | Sigma-Aldrich | D5025-15KU | |
| Donkey serum | Sigma-Aldrich | D9663 - 10ML | |
| Embedding workstation, 220 to 240 Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol absolute, ≥99.8% (EtOH) | Fisher Chemical | E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| FGF10 | Peprotech | 100-26 | |
| FGF2 (= basic FGF) | R&D Systems | 234-FSE-025 | |
| FGF8 | Peprotech | AF-100-25 | |
| GenElute Mammaliam Total RNA Miniprep Kit | Sigma-Aldrich | RTN350-1KT | Includes 1% β-mercaptoethanol dissolved in lysis buffer |
| Glass Pasteur pipette | Niko Mechanisms | 170-40050 | |
| Glycine | VWR | 101194M | |
| HEPES | Sigma-Aldrich | H4034 | |
| IGF-1 | PeproTech | 100-11 | |
| InSolution Y-27632 (ROCK inhibitor, RI) | Sigma-Aldrich | 688001 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| ITGA6 antibody | Sigma-Aldrich | HPA012696 | |
| L-Glutamine | Gibco | 25030024 | |
| Matrigel (growth factor-reduced; phenol red-free) | Corning | 15505739 | |
| Microscope slide | Thermo Fisher Scientific | J1800AMNZ | |
| Millex-GV Syringe Filter Unit, 0.22 μm | Millipore | SLGV033R | |
| Minimum essential medium eagle (αMEM) | Sigma-Aldrich | M4526 | |
| mouse IgG (Alexa 555) secondary antibody | Thermo Fisher Scientific | A-31570 | |
| N2 | Gibco | 17502-048 | |
| N-acetyl L-cysteine | Sigma-Aldrich | A7250 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Noggin | PeproTech | 120-10C | |
| P63 antibody | Abcam | ab124762 | |
| Pap Pen | Sigma-Aldrich | Z377821-1EA | Marking pen |
| Paraformaldehyde (PFA), 16% | Merck | 8.18715 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-streptomycin (Pen/Strep) | Gibco | 15140-122 | |
| Petri dish | Corning | 353002 | |
| Phosphate buffered saline (PBS) | Gibco | 10010-015 | |
| Pipette (P20, P200, P1000) | Eppendorf or others | 2231300006 | |
| Plastic transfer pipette (3.5 mL) | Sarstedt | 86.1171.001 | |
| Rabbit IgG (Alexa 488) secondary antibody | Thermo Fisher Scientific | A21206 | |
| RSPO1 | PeproTech | 120-38 | |
| SB202190 (p38i) | Biotechne (Tocris) | 1264 | |
| Scalpel (surgical blade) | Swann-Morton | 207 | |
| SHH | R&D Systems | 464-SH-200 | |
| Silicone molds (Heating block) | VWR | 720-1918 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-pyruvate (C3H3NaO3) | Sigma-Aldrich | P-5280 | |
| SOX2 antibody | Abcam | ab92494 | |
| StepOnePlus | Thermo Fisher Scientific | Real-Time PCR System | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile 1000 μL pipette tips with filter | Greiner | 740288 | |
| Sterile 20 μL pipette tips with filter | Greiner | 774288 | |
| Sterile 200 μL pipette tips with and without filter | Greiner | 739288 | |
| Sterile H2O | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Superscript III first-strand synthesis supermix | Invitrogen | 11752-050 | Reverse transcription kit |
| Tissue processor | Thermo Scientific | 12505356 | |
| Transferrin | Serva | 36760.01 | |
| Triton X-100 | Sigma | T8787-50ML | |
| TrypLE express | Gibco | 12605-010 | |
| Vectashield mounting medium+DAPI | Labconsult NV | H-1200 | Antifade mounting medium with DAPI |
| WNT3a | Biotechne (Tocris) | 5036-WN-500 | |
| Xylenes, 99%, for biochemistry and histology | VWR | 2,89,75,325 |
Referanslar
- Yu, T., Klein, O. D. Molecular and cellular mechanisms of tooth development, homeostasis and repair. Development (Cambridge). 147 (2), (2020).
- Arrow, P. Dental enamel defects, caries experience and oral health-related quality of life: a cohort study. Australian Dental Journal. 62 (2), 165-172 (2017).
- Mitsiadis, T. A., Orsini, G., Jimenez-Rojo, L. Dental Stem Cells for Tooth Regeneration. Dental Stem Cells: Regenerative Potential. Stem Cell Biology and Regenerative Potential. Stem Cell Biology and Regenerative Medicine. Zavan, B., Bressan, E. , Humana Press. Cham. (2016).
- Mitsiadis, T. A., Orsini, G. Editorial: a new era in dentistry: stem cell-based approaches for tooth and periodontal tissue regeneration. Frontiers in Physiology. 7, 357(2016).
- Miran, S., Mitsiadis, T. A., Pagella, P. Innovative dental stem cell-based research approaches: the future of dentistry. Stem Cells International. 2016, 7231038(2016).
- Shinmura, Y., Tsuchiya, S., Hata, K. I., Honda, M. J. Quiescent epithelial cell rests of malassez can differentiate into ameloblast-like cells. Journal of Cellular Physiology. 217 (3), 728-738 (2008).
- Davis, E. M. A review of the epithelial cell rests of Malassez on the bicentennial of their description. Journal of Veterinary Dentistry. 35 (4), 290-298 (2018).
- Athanassiou-Papaefthymiou, M., Papagerakis, P., Papagerakis, S. Isolation and characterization of human adult epithelial stem cells from the periodontal ligament. Journal of Dental Research. 94 (11), 1591-1600 (2015).
- Kim, G. -H., et al. Differentiation and establishment of dental epithelial-like stem cells derived from human ESCs and iPSCs. International Journal of Molecular Sciences. 21 (12), 1-16 (2020).
- Nam, H., et al. Establishment of Hertwig's epithelial root sheath/ epithelial rests of malassez cell line from human periodontium. Molecules and Cells. 37 (7), 562-567 (2014).
- Nam, H., et al. Expression profile of the stem cell markers in human hertwig's epithelial root sheath/Epithelial rests of Malassez cells. Molecules and Cells. 31 (4), 355-360 (2011).
- Tsunematsu, T., et al. Human odontogenic epithelial cells derived from epithelial rests of Malassez possess stem cell properties. Laboratory Investigation; A Journal of Technical Methods and Pathology. 96 (10), 1063-1075 (2016).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Cox, B., et al. Organoids from pituitary as a novel research model toward pituitary stem cell exploration. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development (Cambridge). 144 (10), 1775-1786 (2017).
- Schutgens, F., Clevers, H. Human organoids: tools for understanding biology and treating diseases). Annual Review of Pathology. 15, 211-234 (2020).
- Hemeryck, L., et al. Organoids from human tooth showing epithelial stemness phenotype and differentiation potential. Cellular and Molecular Life Sciences. 79 (3), 153(2022).
- Gao, X., Wu, Y., Liao, L., Tian, W. Oral organoids: progress and challenges. Journal of Dental Research. 100 (5), 454-463 (2021).
- Binder, M., et al. Novel strategies for expansion of tooth epithelial stem cells and ameloblast generation. Scientific Reports. 10 (1), 4963(2020).
- Xiong, J., Mrozik, K., Gronthos, S., Bartold, P. M. Epithelial cell rests of malassez contain unique stem cell populations capable of undergoing epithelial-mesenchymal transition. Stem Cells and Development. 21 (11), 2012-2025 (2012).
- Luan, X., Ito, Y., Diekwisch, T. G. H. Evolution and development of Hertwig's epithelial root sheath. Developmental Dynamics. 235 (5), 1167-1180 (2006).
- Fukumoto, S., et al. New insights into the functions of enamel matrices in calcified tissues. Japanese Dental Science Review. 50 (2), 47-54 (2014).
- Consolaro, A., Consolaro, M. F. M. O. ERM functions, EGF and orthodontic movement or Why doesn't orthodontic movement cause alveolodental ankylosis. Dental Press Journal of Orthodontics. 15 (2), 24-32 (2010).
- Guajardo, G., et al. Immunohistochemical localization of epidermal growth factor in cat paradental tissues during tooth movement. American Journal of Orthodontics and Dentofacial Orthopedics. 118 (2), 210-219 (2000).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gonçalves, J., Sasso-Cerri, E., Cerri, P. Cell death and quantitative reduction of rests of Malassez according to age. Journal of Periodontal Research. 43 (4), 478-481 (2008).
- Kim, J., Koo, B. -K., Knoblich, J. A. Human organoids: Model systems for human biology and medicine. Nature Reviews. Molecular Cell Biology. 21 (10), 571-584 (2020).
- Razmi, M. T., Narang, T., Handa, S. ADULT (acro-dermato-ungual-lacrimal-tooth) syndrome: a case report from India. Indian Dermatology Online Journal. 9 (3), 194(2018).
- Future Health Biobank. , Available from: https://futurehealthbiobank.com/ch-en/ (2022).
- Schreurs, R. R. C. E., Baumdick, M. E., Drewniak, A., Bunders, M. J. In vitro co-culture of human intestinal organoids and lamina propria-derived CD4+ T cells. STAR Protocols. 2 (2), 100519(2021).
- Fiorini, E., Veghini, L., Corbo, V. Modeling cell communication in cancer with organoids: Making the complex simple. Frontiers in Cell and Developmental Biology. 8, 166(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Zhang, Y., et al. Polyisocyanide hydrogels as a tunable platform for mammary gland organoid formation. Advanced Science. 7 (18), 2001797(2020).
- Mollaki, V. Ethical challenges in organoid use. BioTech. 10 (3), 12(2021).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır