Method Article
ביסוס אורגנואידים מהשן האנושית ככלי רב עוצמה לקראת מחקר מכניסטי וטיפול רגנרטיבי
In This Article
Summary
אנו מציגים פרוטוקול לפיתוח תרביות אורגנואידים אפיתליאליות החל מהשן האנושית. האורגנואידים ניתנים להרחבה חזקה ומשקמים מחדש את תאי הגזע האפיתליאליים של השן, כולל יכולת התמיינות האמלובלסט שלהם. המודל האורגנואידי הייחודי מספק כלי מבטיח לחקר הביולוגיה הדנטלית האנושית (תאי גזע) עם פרספקטיבות לגישות התחדשות שיניים.
Abstract
שיניים הן בעלות חשיבות מרכזית בחיים לא רק עבור מסטיק מזון ודיבור אלא גם עבור רווחה פסיכולוגית. הידע על התפתחות השיניים והביולוגיה האנושית הוא נדיר. בפרט, לא הרבה ידוע על תאי הגזע האפיתליאליים של השן ותפקודם. הצלחנו לפתח מודל אורגנואידי חדשני המתחיל מרקמת השן האנושית (כלומר, זקיק שיניים, מבודד משיני בינה שנלקחו). האורגנואידים ניתנים להרחבה באופן חזק וארוך טווח ומשחזרים את תא תאי הגזע המוצעים של אפיתל השיניים האנושיות במונחים של ביטוי סמנים כמו גם פעילות תפקודית. בפרט, האורגנואידים מסוגלים לפרוש תהליך התמיינות אמלובלסט כפי שמתרחש in vivo במהלך אמלוגנזה. מודל אורגנואידי ייחודי זה יספק כלי רב עוצמה לחקר לא רק התפתחות השיניים האנושיות אלא גם פתולוגיה דנטלית, ועשוי לסלול את הדרך לטיפול בשיניים רגנרטיביות. החלפת שיניים אבודות בשן ביולוגית המבוססת על מודל אורגנואידי חדש זה עשויה להיות חלופה מושכת להשתלה הסטנדרטית הנוכחית של חומרים סינתטיים.
Introduction
לשיניים יש תפקידים חיוניים במזון, בדיבור וברווחה הפסיכולוגית (דימוי עצמי). השן האנושית מורכבת מרקמות שעברו מינרליזציה גבוהה בצפיפות ובקשיות שונות1. אמייל דנטלי, המרכיב העיקרי של כתר השן, הוא הרקמה המינרלית הגבוהה ביותר בגוף האדם. במהלך היווצרות אמייל (amelogenesis), כאשר השיניים מתפתחות, תאי גזע אפיתליאליים דנטליים (DESCs) מתמיינים לתאים יוצרי אמייל (ameloblasts). לאחר שנוצר, האמייל הוא רק לעתים רחוקות מתוקן או מתחדש עקב אובדן apoptotic של ameloblasts בתחילת התפרצות השן1. שחזור של רקמת אמייל פגומה, כפי שנגרם על ידי טראומה או מחלה חיידקית, נעשה כיום באמצעות חומרים סינתטיים; עם זאת, אלה מוטרדים מחסרונות חשובים כגון microleakage, osseointegration נחות ומעגן, אורך חיים סופי, והיעדר תיקון פונקציונלי מלא2. לפיכך, תרבית חזקה ואמינה של DESCs אנושיים עם היכולת ליצור אמלובסטים והפוטנציאל לייצר רקמה מינרלית תהיה צעד גדול קדימה בתחום ההתחדשות הדנטלית.
הידע על פנוטיפ DESC אנושי ותפקוד ביולוגי הם נדירים 3,4,5. באופן מעניין, DESCs של שיני אדם הוצעו להתקיים במשענות תאי האפיתל של מלאסז (ERM), אשכולות תאים הנמצאים בתוך זקיק השיניים (DF), המקיף שיניים לא משוננות, ונשארים נוכחים ברצועת החניכיים סביב השורש ברגע שהשן מתפרצת1. נמצא כי תאי ERM בתרבית משותפת עם עיסת שיניים מתמיינים לתאים דמויי אמלובסט ומייצרים רקמה דמוית אמייל6. עם זאת, מחקרים מעמיקים על התפקיד הספציפי של תאי ERM ביצירת אמייל (re-) היו מוגבלים בשל היעדר מודלים מחקריים אמינים7. מערכות התרביות החוץ-גופיות הנוכחיות של ERM נפגעות על ידי אורך חיים מוגבל ואובדן מהיר של פנוטיפ בתנאים הדו-ממדיים הנמצאים בשימוש סטנדרטישל 8,9,10,11,12. לפיכך, יש צורך רב במערכת חוץ גופית הניתנת להרחבה, למידה והבחנה נאמנה של DESCs אנושיים.
במהלך העשור האחרון, טכניקה רבת עוצמה לגידול תאי גזע אפיתליאליים במבחנה יושמה בהצלחה בכמה סוגים של רקמות אפיתל (אנושיות) כדי לחקור את הביולוגיה שלהן, כמו גם מחלה 13,14,15,16. טכנולוגיה זו מאפשרת לתאי הגזע של אפיתל הרקמה להתפתח בעצמם למבנים תלת-ממדיים של תאים (כלומר, אורגנואידים) כאשר הם נזרעים לתוך מטריצה חוץ-תאית (ECM) המחקה פיגום (בדרך כלל, Matrigel) ותרבית במדיום מוגדר המשחזר את האיתות ו/או את ה-embryogenesis של נישת תאי הגזע של הרקמה ו/או את ה-embryogenesis. גורמי גדילה אופייניים הדרושים להתפתחות אורגנואידים כוללים גורם גדילה אפידרמלי (EGF) ומפעילי אתר אינטגרציה מסוג MMTV ללא כנפיים (WNT) 14,15,16. האורגנואידים המתקבלים מאופיינים בנאמנות מתמשכת בחיקוי תאי הגזע האפיתליאליים המקוריים של הרקמה, כמו גם ביכולת הרחבה גבוהה תוך שמירה על הפנוטיפ והתכונות התפקודיות שלהם, ובכך להתגבר על זמינות הרקמות האנושיות הראשוניות המוגבלות לעתים קרובות כפי שנרכשו מהמרפאה. כדי לבסס אורגנואידים, אין צורך בבידוד תאי הגזע האפיתליאליים מהרקמה ההטרוגנית (כלומר, המורכבת מסוגי תאים אחרים כגון תאים מזנכימליים) לפני התרבות, שכן תאים מזנכימליים אינם מתחברים ל-ECM או משגשגים בו, וכתוצאה מכך בסופו של דבר האורגנואידים האפיתליאלייםגרידא 13,16,17,18,19 . טכנולוגיה מבטיחה ורב-תכליתית זו הובילה לפיתוח מודלים אורגנואידיים מניפולטיביים מרקמות אפיתל אנושיות שונות. עם זאת, אורגנואידים שמקורם בשיניים אנושיות, בעלי ערך למחקר מעמיק של התפתחות שיניים, התחדשות ומחלות, עדיין לא הוקמו20,21. לאחרונה הצלחנו לפתח מודל אורגנואידי חדש כזה המתחיל מרקמת DF מטוחנות שלישיות (שיני בינה) המופקות מחולים מתבגרים19.
כאן אנו מתארים את הפרוטוקול לפיתוח תרביות אורגנואידיות אפיתליאליות מהשן האנושית הבוגרת (כלומר, מה-DF של הטוחנות השלישיות) (איור 1A). האורגנואידים המתקבלים מבטאים סמני גבעול הקשורים ל-ERM תוך שהם ניתנים להרחבה לטווח ארוך. באופן מסקרן, בניגוד לרוב המודלים האורגנואידיים האחרים, ה-EGF הנחוץ בדרך כלל מיותר להתפתחות וצמיחה אורגנואידית חזקה. באופן מעניין, האורגנואידים של הגבעול מראים תכונות התמיינות של אמלובלסט, ובכך מחקים תכונות ותהליכים של ERM/DESC המתרחשים ב-vivo. המודל האורגנואידי החדש והייחודי המתואר כאן מאפשר לחקור ביולוגיה של DESC, פלסטיות ויכולת הבחנה ופותח את הדלת לנקיטת הצעדים הראשונים לקראת גישות להתחדשות שיניים.
Protocol
כל השיטות המתוארות כאן אושרו על ידי ועדת האתיקה למחקר UZ/KU Leuven (13/0104U). טוחנות שלישיות שחולצו (שיני בינה) התקבלו לאחר הסכמה מדעת של המטופלים.
1. הכנות
- חימום מראש של צלחת תרבית של 48 בארות למשך 15-20 שעות בחממת CO2 של 1.9% בטמפרטורה של 37 מעלות צלזיוס.
- Liquefy a Matrigel aliquot (מופחת גורם גדילה; ללא פנול אדום; מכונה גם מטריצת ממברנת מרתף; BMM) על קרח (4 מעלות צלזיוס) למשך 2 שעות לפחות לפני שלב 2.1.
הערה: הימנע ממחזורי הקפאה/הפשרה של ה-BMM. לנזול את BMM במשך 15-20 שעות על קרח ו aliquot ב 1 מ"ל בצינורות microcentrifuge ולאחסן ב -20 מעלות צלזיוס. - מצננים את הצנטריפוגה ל-4 מעלות צלזיוס.
- הכן מדיה וסנן את הפתרון באמצעות מסנן 0.22 מיקרומטר. הכרכים הבאים מבוססים על איסוף ה-DFs מכל ארבע הטוחנות השלישיות שבדרך כלל מופקות בו זמנית.
- הכינו 20 מ"ל של מדיום איסוף DF (טבלה 1): עיט בינוני חיוני מינימלי (αMEM) המכיל 10% סרום בקר עוברי (FBS), 0.5% אמפוטריצין B ו-1% פניצילין-סטרפטומיצין. מעבירים 4 מ"ל של מדיום איסוף DF לצינור 15 מ"ל ומעבירים את הצינורות על קרח.
הערה: צינור אחד של 15 מ"ל מספיק לכל מטופל לאיסוף דגימה (כלומר, עבור ארבע טוחנות שלישיות). - הפוך 20 מ"ל של תווך אורגנואידי שן (המכונה גם TOM; טבלה 2) שימוש במדיום מוגדר ללא סרום (SFDM; טבלה 3). אחסן TOM בטמפרטורה של 4 °C (66 °F) למשך שבועיים לכל היותר.
- מכינים 8 מ"ל של מדיום דיסוציאציה (טבלה 4), כלומר, מי מלח בחסימת פוספט (PBS) המכילים קולגן VI (3 מ"ג/מ"ל) ודיספאזה II (4 מ"ג/מ"ל). מחממים מראש את מדיום הדיסוציאציה באמבט מים של 37 מעלות צלזיוס למשך 10 דקות לפחות לפני השימוש ומעבירים אותו לשני צינורות של 15 מ"ל (4 מ"ל לכל צינור) כדי לנתק ארבע רקמות DF.
- הכינו צלחת כביסה (12 בארות) המכילה: שלוש בארות עם 70% EtOH, שלוש בארות עם PBS ושלוש בארות עם מדיום איסוף DF.
- הכינו 15 מ"ל של A בינונית לכל דגימה (כלומר, 5 מ"ל לכל שני DFs לכל מטופל; טבלה 5).
הערה: הצעדים הבאים צריכים להתבצע בתנאים סטריליים.
- הכינו 20 מ"ל של מדיום איסוף DF (טבלה 1): עיט בינוני חיוני מינימלי (αMEM) המכיל 10% סרום בקר עוברי (FBS), 0.5% אמפוטריצין B ו-1% פניצילין-סטרפטומיצין. מעבירים 4 מ"ל של מדיום איסוף DF לצינור 15 מ"ל ומעבירים את הצינורות על קרח.
2. דיסוציאציה של זקיק דנטלי
- ברגע שהטוחנות השלישיות עם DFs הקשורים נאספות במדיום האיסוף (על קרח), מעבירות את תכולת הצינורות לצלחת פטרי.
- החזק את השן עם פינצטה ובודד בזהירות את ה- DF באמצעות להב כירורגי.
הערה: שלב זה דורש תרגול; היזהר עם הלהב. - כדי לשטוף את הדם הנותר מה-DFs, הניחו את רקמות ה-DF לזמן קצר בבאר הראשונה של 70% EtOH (צלחת כביסה) במשך 20 שניות, ולאחר מכן העבירו לבאר ה-EtOH הבאה במשך 20 שניות, ובהמשך לבאר ה-EtOH השלישית (מקסימום דקה אחת ב-70% EtOH בסך הכל; זמן דגירה ארוך יותר יגרום לירידה בכדאיות התאים).
- לאחר מכן, המשך לשטוף בשלוש בארות PBS (מקסימום 2 דקות בסך הכל).
- יש לשטוף את ה-DFs בשלוש הבארות הבינוניות הנותרות לאיסוף DF (עד ל-20 דקות בסך הכל לכל היותר).
- העבירו את ה-DFs השטופים לצלחת פטרי חדשה.
- חותכים חתיכה קטנה של אחד ה-DFs (כ-5 מ"מ2) לקיבוע פרפורמלדהיד (PFA) (ראו סעיף 7) ומאחסנים אותה על קרח (למשך 6 שעות לכל היותר) בצינור microcentrifuge המכיל 500 μL של מדיום איסוף DF עד לקיבוע PFA.
- טחנו את שאר ה-DFs בחתיכות קטנות (~1 מ"מ2).
הערה: מומלץ לעבד באופן מיידי את רקמות ה-DF שזה עתה בודדו לצורך היווצרות האורגנואידים האופטימלית ויעילות הגדילה, ולא להתחיל מרקמה בהקפאה, מה שמביא ליעילות נמוכה יותר. עם זאת, ניתן לשמור בהקפאה של רקמת DF ראשונית בשלב זה (ראו מדיום שימור בהקפאה ופרוטוקול בסעיף 5). - מעבירים את ה-DFs הטחונים לצינור של 15 מ"ל המכיל 4 מ"ל של מדיום דיסוציאציה מתוכנן מראש ודגירה באמבט מים של 37 מעלות צלזיוס למשך שעתיים.
הערה: הוסף שני DFs לכל 4 מ"ל מדיום דיסוציאציה מוכן מראש (צינור אחד) כדי להבטיח דיסוציאציה אופטימלית. - כל 15 דקות, פיפטו את תערובת מדיום הדיסוציאציה של DF למעלה ולמטה באמצעות צינור פסטר זכוכית כדי להאיץ את התפוררות הרקמה. כאשר חתיכות DF אינן נצפות עוד (בדרך כלל לאחר שעה אחת), המשך בדיסוציאציה של DF באמצעות צינור פסטר מלוטש אש צר.
הערה: לדיסוציאציה אופטימלית של DF, עברו לצינור פסטר שהצטמצם על ידי ליטוש אש לא יאוחר משעה אחת של בידוד DF.- בינתיים, להכין 10 מ"ל של A בינוני המכיל 50 μL של DNase (0.2 מ"ג / מ"ל; טבלה 5).
- מוסיפים 5 מ"ל של A בינוני (המכיל את ה-DNase) לכל צינור עם DF מנותק, ודגירה למשך דקה אחת בטמפרטורת החדר (RT).
- סנן את תרחיף התא (המכיל תאים בודדים וגושים של תאים קטנים) דרך מסננת תאים של 40 מיקרומטר כדי להסיר את השברים הגדולים הנותרים ואת (רוב) הרקמה הסיבית.
- שלב את מספר הצינורות עם DF מנותק ממטופל אחד בשלב זה.
- שטפו את המסנן ב-1 מ"ל של A בינוני. צנטריפוגה של מתלה התא המסונן ב-200 x גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- הסר את ה-supernatant, השתמש שוב בכדור ב-1 מ"ל של SFDM (טבלה 3), והעביר את תרחיף התא לצינור מיקרו-סנטריפוג' של 1.5 מ"ל.
- חשב את ריכוז התא באמצעות מונה תאים אוטומטי. הזניחו את גושי התאים שנותרו.
- צנטריפוגה ב 200 x g במשך 5 דקות ב 4 ° C.
3. ביסוס תרבית האורגנואידים של השן (איור 1A ואיור 2A)
- בהתבסס על מספר התא המתקבל, חשב את מספר הבארות שניתן לזרוע. טיפה אחת של 20 μL צריכה להכיל 20,000 תאים. התערובת הסופית מורכבת מהשעיית תאים ו-BMM ביחס של 30:70.
- הסר את הכמות המתאימה של supernatant ו resuspend ב BMM קר כקרח כדי לקבל יחס של 70:30 של BMM: תרחיף התא לציפוי. לדוגמה, כאשר מתקבלים 200,000 תאים, צלחת 10 טיפות של 20 μL. לכן, הסר את הסופרנאטנט עד שנותר 60 μL של תרחיף התא, הוסף 140 μL של BMM קר כקרח והחזרת.
- בצעו החייאה איטית כדי למנוע היווצרות בועות אוויר. לאחר ההחייאה ב-BMM, שמרו על צינור המיקרו-סנטריפוג' על הקרח.
הערה: שמירה על צינור microcentrifuge על קרח היא חיונית כדי למנוע התמצקות BMM.
- בצעו החייאה איטית כדי למנוע היווצרות בועות אוויר. לאחר ההחייאה ב-BMM, שמרו על צינור המיקרו-סנטריפוג' על הקרח.
- פיפטו את טיפות ה-BMM של 20 μL במרכז הבארות של צלחת התרבית של 48 הבארות שחוממה מראש.
- הפכו את הצלחת במהופך, הכניסו אותה לחממה של 1.9% CO2 (% CO2 לפי מאגר SFDM), ותנו לה להתמצק למשך 20 דקות לפחות ב-37 מעלות צלזיוס.
- הוסיפו את מעכב ROCK (RI; 10 μM) ואמפוטריצין B (0.1%) ל-TOM וחממו את המדיום באמבט מים של 37 מעלות צלזיוס.
הערה: אמפוטריצין B רגיש לאור. - קח את צלחת 48 הבאר מהאינקובטור, מניח זקוף ומוסיף 250 μL של המדיום המוכן מראש לכל באר עם טיפות / תאים BMM והחזיר את הצלחת לחממת 1.9% CO2 .
- כדי לרענן את המדיום (רצוי כל 2-3 ימים), הטו את צלחת ה-48 בזווית של 45°, הסירו בעדינות את המדיום הקודם תוך הימנעות מלגעת בטיפת ה-BMM, והוסיפו 250 μL של מדיום TOM חדש שעבר חימום מראש.
הערה: מומלץ לרענן לפחות שלוש פעמים בשבוע כדי למנוע דלדול של חומרי מזון מרכזיים וגורמי גדילה. יש להוסיף RI ל-TOM רק בזריעה הראשונית ובימים הראשונים של כל מעבר (ראה סעיף 4) כדי למנוע מוות של תאים על ידי אנויקיס ולשפר את צמיחת האורגנואידים. אמפוטריצין B מתווסף למדיום רק במהלך מעבר 0 (P0) כדי לחסום זיהום פטרייתי אפשרי.
4. הגברה ומעבר של תרבית האורגנואידים של השן (איור 1B ואיור 2B)
- מעבירים את האורגנואידים בין 10 ל-14 ימים של תרבות.
הערה: הימנעו מחקלאות לתקופה ארוכה יותר מכיוון שתרבית ממושכת עלולה להגביל את הצמיחה מחדש של האורגנואידים ואת יכולת המעבר. רק בפיתוח הראשוני (P0) ניתן לתרבת אורגנואידים בתרבית עד 20 יום בהתאם לקצב הגדילה שלהם (עד שיגיעו לקוטרם המרבי ±200 מיקרומטר). - הסר את המדיום מהבארות עם אורגנואידים שיש להעביר. בתוך מצב תרבות אחד, יש לאסוף עד ארבע בארות מפגש (ראו איור 2C).
- כדי לאסוף את האורגנואידים, הוסיפו 400 μL של SFDM קר כקרח לכל באר ישירות על טיפות ה-BMM וטפטפו שוב ושוב את המדיום למעלה ולמטה עד שכל טיפת ה-BMM תפורק.
- במקרה של איגום בארות, העבירו את ה-400 μL מהבאר הראשונה לבאר הבאה (וכן הלאה) כדי לעקור את טיפות ה-BMM המכילות אורגנואידים של כל הבארות שיש לאגד.
- מעבירים את מכלול ה-BMM-אורגנואידי המנותק לצינור מיקרו-צנטריפוג' בגודל 1.5 מ"ל וחוזרים על שלב 4.3 שוב עד שכל המבנים האורגנואידיים נאספים מהבארות.
- צנטריפוגה ב 200 x g במשך 5 דקות ב 4 ° C.
- לפני המלחמה אליקווט של TrypLE Express (בתוספת RI ב-5 מיקרומטר) באמבט מים של 37 מעלות צלזיוס. לכל צינור microcentrifuge של אורגנואידים, יש צורך בנפח של 400 μL TrypLE Express.
- לאחר צנטריפוגה, הסר את הסופרנטנט והחזיר את הכדור ב-400 μL של TrypLE. דגירה של המתלים באמבט מים של 37 מעלות צלזיוס למשך 12 דקות.
- הוסף 400 μL של SFDM קר כקרח כדי להשבית את האנזים ואת הצנטריפוגה ב 200 x g במשך 5 דקות ב 4 °C (64 °F). הסר את ה-supernatant.
- מצפים מראש קצה (לנפח ראו בהמשך) ב-SFDM קר כקרח ומחזירים את הכדור האורגנואידי.
- כדי למנוע אובדן אורגנואידים, השתמשו שוב באותו קצה (מצופה מראש) ככל האפשר מבלי לסכן את העקרות.
הערה: נפח ה- SFDM הנדרש להחייאה של הכדור תלוי במספר המבנים האורגנואידיים המתקבלים ובמספר המעבר הנוכחי. - ככלל אצבע, עבור מעברים, P0 עד P2-3 (בדרך כלל עדיין גדל מספר נמוך של אורגנואידים) להשתמש בנפח של 200 μL SFDM. מתוך קטעים, P3-4 ומעלה (בדרך כלל מניב מספר גדול יותר של אורגנואידים) להשתמש בנפח של 700 μL של SFDM.
הערה: שני ההליכים מכונים שיטות 'מעבר נמוך' ו'מעבר גבוה יותר', בהתאמה (ראו שלבים 4.10 ו-4.11). יישום נכון של השיטות המובחנות הוא חיוני למעבר יעיל של האורגנואידים. בשיטת המעבר הגבוהה יותר, אורגנואידים הולכים לאיבוד בקלות רבה יותר ואין להחילם על מספר נמוך של אורגנואידים (כלומר, ב-P0 עד P2-3). עם זאת, יש צורך בשיטת המעבר הגבוהה יותר כדי לנתק ביעילות כמויות גדולות יותר של אורגנואידים.
- כדי למנוע אובדן אורגנואידים, השתמשו שוב באותו קצה (מצופה מראש) ככל האפשר מבלי לסכן את העקרות.
- שיטת מעבר נמוכה: החייאת הכדור ב-200 μL של SFDM קר כקרח. דחפו את קצה הפיפטה שהתרוקן לחלוטין לתחתית צינור המיקרוצנטריפוגה כדי להקטין את קוטרו. בדוק אם הקוטר קטן מספיק (שאיפה איטית יותר, הזרימה מוטה אך לא חסומה). פיפט למעלה ולמטה במשך 5 דקות כדי לשבש באופן מכני את האורגנואידים.
- שיטת מעבר גבוהה יותר: החייאת הכדור ב-700 μL של SFDM קר כקרח עם קצה P1000. הוסיפו קצה P200 (ללא מסנן) על גבי קצה P1000 זה וציפוי מראש עם SFDM קר כקרח. מנע היווצרות בועות אוויר על ידי התאמת הגדרת הנפח של הפיפטה על מנת לשאוף לפחות 90% מהנפח הבינוני (עם אורגנואידים). פיפט למעלה ולמטה במשך 5 דקות כדי לשבש באופן מכני את האורגנואידים.
- בדוק תחת מיקרוסקופ האור (בהגדלה של פי 4) אם מתקבלים בעיקר תאים בודדים עם (רק) כמה מבנים לא מוסתרים.
- הוסיפו 500 μL של SFDM קר כקרח לצינור microcentrifuge וערבבו בעדינות את תערובת התאים המנותקים עם ה-SFDM הטרי על ידי צנרת.
- תן למבנים גדולים שלא הוסתרו לשקוע במשך 10 דקות על ידי הצבת אנכית של שפופרת המיקרו-סנטריפוג' על קרח.
הערה: יש צורך להסיר את המבנים undispersed כי הם משפיעים לרעה על המעבר האורגנואידי. עבור חניכה אורגנואידית (P0), אין צורך בשלב שקיעה זה. - לאסוף את הסופרנאטל (~500-1,000 μL בהתאם לשיטת המעבר) המכיל תאים בודדים ואשכולות תאים קטנים; העברה לתוך צינור microcentrifuge חדש, וצנטריפוגה ב 190 x g במשך 10 דקות ב 4 ° C.
- חשב את ריכוז התא באמצעות מונה תאים אוטומטי. הזניחו את גושי התאים שנותרו.
- ספרו כמה בארות ניתן לזרוע וחשבו את יחס ההשעיה/BMM המתאים בין התאים כפי שתואר לעיל (סעיף 3).
- הוסיפו 70% מה-BMM לכדור התא ושמרו על צינור המיקרו-צנטריפוגה על הקרח.
הערה: חיוני לשמור את צינור המיקרו-סנטריפוג' על הקרח כדי למנוע התמצקות BMM. - המשך עם שלב 3.3 עד 3.7 ומעבר שוב בין יום 10 ליום 14 של התרבות.
5. שימור בהקפאה של אורגנואידים בשיניים
- לאסוף ולנתק את האורגנואידים כאמור לעיל לצורך מעבר (שלב 4). צנטריפוגה את מתלה התא ב 200 x g למשך 5 דקות ב 4 °C (64 °F).
- יש להשליך את ה-supernatant ולהחזיר את הכדור ב-1 מ"ל של מדיום שימור בהקפאה המכיל SFDM (70%), FBS (20%) ו-DMSO (10%).
- מעבירים את המתלים לתוך קריוביאל ומניחים אותו על קרח. מניחים את הקריוביציאלים בתיבת קריו ומעבירים ל-80 מעלות צלזיוס בלבד (לפחות 4 שעות).
- תוך חודש אחד, העבירו את הדגימות הקפואות לחנקן נוזלי לאחסון ארוך טווח (>12 חודשים).
6. הפשרה של אורגנואידים בשיניים בהקפאה
- לפני תחילת הליך ההפשרה, הניחו צינור אחד של 15 מ"ל לכל קריוביאל על קרח המכיל 10 מ"ל של SFDM עם 20% FBS.
- מוציאים את הקריוביה מהחנקן הנוזלי ושמים אותו על הקרח.
הערה: בצע את השלבים הבאים במהירות האפשרית והימנע מזמן הפשרה ארוך מדי (>5 דקות) כמו גם מרווחים ארוכים מדי בין הצעדים (>5 דקות), שכן הארכה כזו תפחית את הישרדות התא. - מניחים את הקריוביט באמבט מים חמים (37 מעלות צלזיוס) עד להפשרה (~ 1-2 דקות).
- מיד להעביר את התוכן של cryovial לצינור קר כקרח 15 מ"ל צנטריפוגה ב 200 x g במשך 5 דקות ב 4 ° C.
- הסר 9 מ"ל של supernatant וצנטריפוגה הנותרים 1 מ"ל ב 200 x g במשך 5 דקות ב 4 °C (64 °F). הסר את ה-supernatant ושטף את הכדור עם 1 מ"ל SFDM קר כקרח.
- העבר את תרחיף התא לצינור מיקרו-צנטריפוגה בגודל 1.5 מ"ל וספור את התאים באמצעות מונה תאים אוטומטי.
- ספרו כמה בארות ניתן לזרוע וחשבו את יחס ההשעיה/BMM המתאים בין התאים כפי שתואר לעיל (סעיף 3).
- צנטריפוגה ב 200 x g במשך 5 דקות ב 4 ° C. בצעו החייאה של הכדור ביחס של 70:30 של BMM:TOM והמשיכו על הקרח.
- המשך עם שלב 3.3 עד 3.7 ומעבר בין יום 10 ליום 14 של התרבות.
7. קיבוע והטבעת פרפין של אורגנואידים בשיניים
הערה: ניתן להחיל הליך זה (כולל סעיפים 8 ו-9) גם על רקמת ה-DF הראשית.
- קיבוע של אורגנואידים בשיניים ב-PFA
- הסר את המדיום מכל באר כמו בשלב 4.2.
- לאסוף את האורגנואידים על ידי פריקה של טיפת BMM (שלב 4.3). העבר את תערובת ה-BMM-אורגנואידית לצינור מיקרו-צנטריפוגה של 1.5 מ"ל.
- צנטריפוגה ב 200 x g במשך 5 דקות ב 4 ° C.
- הסר את הסופרנטנט והוסף 500 μL של 4% PFA ודגירה למשך 30 דקות לפחות (מקסימום 1 שעה) ב- RT עם ערבוב עדין על שייקר מסלול.
אזהרה: השתמש במכסה המנוע הכימי בעת עבודה עם PFA. - צנטריפוגה ב 200 x g במשך 5 דקות ב 4 ° C. מוציאים את ה-supernatant ושוטפים את הכדור האורגנואידי עם PBS למשך 10 דקות ב-RT עם טלטולים עדינים.
- לשטוף את הכדור האורגנואידי (שלב 7.1.5) פעמיים נוספות. סובב את האורגנואידים הקבועים כלפי מטה ב-200 x גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- בצעו החייאה של הכדור ב-500 μL של 70% EtOH (במים שעברו דה-יוניזציה). אחסן את האורגנואידים למשך עד חודש אחד ב-70% EtOH ב-4 °C (64 °F).
- הטבעת אגרוז ופרפין של אורגנואידים בשיניים
הערה: כדי להטמיע ביעילות אורגנואידים בפרפין, יש צורך בשלב נוסף של הטבעה באגרוז.- צנטריפוגה האורגנואידים הקבועים ב-PFA ב-70% EtOH ב-200 x g למשך 5 דקות ב-4 מעלות צלזיוס. הסר את ה-supernatant.
- הכינו תמיסת אגרוז של 2% ב-30 מ"ל PBS בבקבוק זכוכית. מחממים את תערובת האגרוז-PBS במיקרוגל עד שנצפה מבנה דמוי ג'ל (כ-2.5 דקות ב-600 ואט).
- במקביל, הוסיפו 30 מ"ל של PBS לבקבוק זכוכית אחר והתחממו במיקרוגל (כ-2.5 דקות ב-600 ואט). תנו לתמיסת האגרוס להתקרר למשך דקה אחת.
- חותכים את הקצה של קצה P200 כדי לאפשר עבודה מדויקת עם תמיסת האגרוס ולהימנע מבועות אוויר.
- חממו מראש את קצה ה-P200 ב-PBS החם על ידי צניחה למעלה ולמטה כמה פעמים.
- הוסיפו 150 μL של תמיסת אגרוז מתוכננת מראש לכדור האורגנואידי וטפטפו בעדינות את תערובת האורגנואידים-אגרוז (עם החייאה מינימלית) תוך הימנעות מבועות אוויר.
הערה: ההחייאה המינימלית תאפשר איתור טוב יותר של האורגנואידים בג'ל האגרוז בחתך מיקרוטום מכיוון שהאורגנואידים קרובים יותר זה לזה. - העבירו מיד את תערובת האורגנואידים-אגרוזים לאותו מכסה צינור מיקרוצנטריפוג' (microcentrifuge tube), הניחו את הצינור אופקית ותנו לאגרוז להתמצק (כ-20 דקות ב-RT). בינתיים, תייג את הקלטות.
- לאחר התמצקות, הסירו את הג'ל האגרוז ממכסה המיקרוצנטריפוגה באמצעות פינצטה והעבירו אותו לקלטת מסומנת.
- העבירו את הקלטת המכילה אגרוז לכוס המכילה 50% EtOH במים שעברו דה-יוניזציה. כסו את הכוס בפרפילם כדי למנוע אידוי של ה-EtOH.
הערה: עוצמת הקול של הכוס תלויה במספר הקסטות. - לעבד את הדגימות במעבד רקמות בן לילה.
הערה: כאשר פרפין מתמצק ב- RT, יש לבצע את השלבים הבאים במהירות. - חימום מראש של בלוק חימום בתחנת העבודה להטבעה למשך 15 דקות.
- מוציאים את ג'ל האגרוז המכיל אורגנואידים הסגור בקלטת ומניחים אותו בגוש החימום המחומם מראש. הסר את המכסה מהקלטת והניח אותה בצד לשימוש מאוחר יותר.
- מלאו את גוש החימום הנותר בפרפין.
הערה: בדוק עם פינצטה אם ג'ל האגרוז המכיל אורגנואידים עדיין ממוקם בתחתית גוש החימום. בשל משקלו הקל, הוא עלול להתחיל לצוף, וכתוצאה מכך לגרום לאובדן דגימה. - הניחו את מכסה הקלטת על גבי גוש החימום. תנו לו להתמצק במשך 30 דקות על צלחת קרה. הסר את בלוק החימום ואחסן את בלוקי הפרפין בטמפרטורה של 4 מעלות צלזיוס.
8. חתך מיקרוטום והכתמת אורגנואידים של שיניים (איור 2B ואיור 3A-C)
- חתך מיקרוטום של גושי פרפין המכילים אורגנואידים
- פרוסים 5 מיקרומטר מקטעים של אורגנואידי השן בבלוקים של פרפין באמצעות מיקרוטום.
- הניחו את פרוסות הפרפין על גבי שקופית זכוכית מיקרוסקופית. מניחים את מגלשת הזכוכית של המיקרוסקופ על צלחת חמה בטמפרטורה של 37 מעלות צלזיוס ומכסים אותה במים שעברו דה-יוניזציה באמצעות צינור פסטר.
- תנו לזכוכית המיקרוסקופ להחליק יבשה בן לילה.
- צביעה של מקטעי אורגנואידים בשיניים
- מחרפרפים את החלקים האורגנואידיים (על מגלשת הזכוכית של המיקרוסקופ) בתנור למשך שעה אחת בטמפרטורה של 58 מעלות צלזיוס.
- לייבש מחדש את החלקים האורגנואידים (על שקופית הזכוכית של המיקרוסקופ) בהפחתת סדרת EtOH בתוך מכסה המנוע הכימי בסדר הבא:
קסילן 2x למשך 3 דקות כל אחד
100% EtOH 2x למשך 3 דקות כל אחד
95% EtOH 2x למשך 3 דקות כל אחד
90% EtOH 2x למשך 3 דקות כל אחד
70% EtOH 3x למשך 3 דקות כל אחד
אזהרה: השתמש במכסה המנוע הכימי בעת עבודה עם קסילן. - שטפו את מגלשת הזכוכית של המיקרוסקופ במי ברז למשך 5 דקות ב-RT. לאחר מכן, שטפו אותו ב-PBS למשך 5 דקות ב-RT.
- בצע שליפת אנטיגן על ידי הצבת החלקים האורגנואידים (על מגלשת זכוכית המיקרוסקופ) בחיץ ציטראט מחומם מראש (10 mM של חומצת לימון במים שעברו דה-יוניזציה עם pH 6; במיכל פלסטיק; מתוכנן מראש במשך 10 דקות באמבט מים של 95 מעלות צלזיוס) במשך 30 דקות באמבט מים של 95 מעלות צלזיוס.
- תנו לזכוכית המיקרוסקופ להחליק להתקרר למשך 20 דקות ב-RT. שטפו את החלקת הזכוכית של המיקרוסקופ ב-PBS למשך 5 דקות ב-RT, ולאחר מכן ב-PBS המכילה 0.1% Triton-X (PBT) למשך 5 דקות ב-RT.
- השתמש בעט סימון כדי ליצור מחסום הידרופובי בגבולות כל שקופית.
- יש לחסום למשך שעה לפחות ב-RT במאגר חסימה (המכיל 1.5 מ"ג/מ"ל גליצין, סרום בקר של 2 מ"ג/מ"ל אלבומין (BSA) המומס ב-PBT) בתוספת 10% סרום חמורים.
הערה: בדרך כלל, יש צורך ב-300 μL של מאגר חוסם בתוספת 10% סרום חמור לכל שקופית זכוכית מיקרוסקופית. - מניחים את מגלשת הזכוכית של המיקרוסקופ בתא לח. השתמשו בקופסה אטומה שבה כל המגלשות מתאימות והרטיבו כמה רקמות נייר עם מים כדי להניח בתחתית הקופסה. פעולה זו תמנע מהמגלשות להתייבש במהלך שלבי ההכתמה הבאים.
- הסר את מאגר החסימה, הוסף את הנוגדן העיקרי (טבלה 6) שהוכן במאגר חוסם בתוספת 1% סרום חמור ודגירה של המגלשה המכוסה בתמיסת נוגדנים למשך הלילה בתא הלח בטמפרטורה של 4 מעלות צלזיוס. בצע שוב את גבול עט הסימון במידת הצורך.
- שטפו את מגלשת הזכוכית של המיקרוסקופ שלוש פעמים ב-PBT ב-RT למשך 10 דקות עם ערבוב עדין על שייקר מסלולי (75-150 סל"ד).
- הוסיפו את הנוגדן המשני (טבלה 6), שהוכן במאגר חוסם בתוספת 1% סרום חמורים, ודגרו במשך שעה אחת בתא הלח ב-RT.
- הסר את מאגר החסימה ושטף את שקופית זכוכית המיקרוסקופ שלוש פעמים ב- PBT ב- RT למשך 10 דקות עם ערבוב עדין על שייקר מסלול.
- הוסיפו את מדיום ההרכבה של אנטיפאדה עם DAPI (1 עד 3 טיפות) על מכסה זכוכית והרכיבו אותו על גבי החלקים האורגנואידיים (על מגלשת הזכוכית של המיקרוסקופ). המשך בהדמיה; שקופיות החנות למשך שבוע לכל היותר בטמפרטורה של 4 מעלות צלזיוס.
9. מיצוי RNA ו-RT-qPCR של אורגנואידים של שיניים (איור 2B ואיור 3D)
- מיצוי RNA של אורגנואידים בשיניים
- הסר את המדיום מכל באר (שלב 4.2).
- לאסוף את האורגנואידים על ידי פריקה של טיפות BMM (שלב 4.3), להעביר את תערובת BMM-אורגנואידים לצינור מיקרוצנטריפוגה של 1.5 מ"ל, וצנטריפוגה ב-200 x גרם למשך 5 דקות ב-4 מעלות צלזיוס.
- מסירים את הסופרנאטנט, מוציאים את הסוס במרץ ב-350 מיקרול' של 1% β-מרקפטואתנול מומס ב-lysis buffer (טבלת חומרים), ומניחים על קרח.
אזהרה: בצע את כל השלבים עם β-mercaptoethanol במכסה מנוע כימי.
הערה: ניתן לאחסן דוגמאות בשלב זה למשך עד חודש אחד בטמפרטורה של -80 °C (80 °C). להפשיר את הדגימות על הקרח לפני שתמשיך עם שלב 9.1.4. - מערבולת את הדגימות עד שלא נצפו עוד מבנים אורגנואידיים.
- המשך עם מיצוי RNA באמצעות ערכת מיצוי RNA (טבלת חומרים) על פי הוראות היצרן.
- RT-qPCR של אורגנואידים בשיניים (טבלה 7)
- תעתיק הפוך (RT) את ה- RNA19 באמצעות ערכת התמלול ההפוכה (טבלת החומרים) על פי הוראות היצרן.
- נתח את דגימות ה-cDNA המתקבלות באמצעות PCR כמותי מבוסס-ירוק של SYBR (qPCR)19 באמצעות מערכת PCR בזמן אמת (טבלת חומרים).
תוצאות
התפתחות אורגנואידית בשיניים
אנו מספקים פרוטוקול מפורט לביסוס תרביות אורגנואידיות מרקמת DF אנושית שנרכשו בעקבות עקירת שן בינה (איור 1A). DF מבודד מנותק באופן אנזימטי ומכני. התאים המתקבלים מתורבתים בתרבית בתוך BMM במדיה שהוגדרה אמפירית להתפתחות וצמיחה אופטימלית של אורגנואידים (תווך אורגנואידי שן; טום)19.
האורגנואידים מתפתחים בדרך כלל תוך שבועיים לאחר זריעת תאי DF (P0; איור 2א). האורגנואידים ניתנים להרחבה לטווח ארוך (עד 11 מעברים עד כה) (איור 2B, מוצג ב-P4). זריעה של כ-20,000 תאים לכל טיפת BMM (גם ב-P0 וגם במעברים נוספים) מניבה צפיפות אופטימלית של אורגנואידים (איור 2C), בעוד שזריעה של מספרי תאים גבוהים יותר מובילה לצמיחה תת-אופטימלית של אורגנואידים (כלומר, אורגנואידים קטנים יותר בצפיפות גבוהה מדי) מכיוון שאין מספיק מקום לגדול (איור 2D). תנאי התרבית הממוטבים בסופו של דבר מאפשרים פיתוח של אורגנואידים מדגימות DF ביעילות של 100%19.
אפיון ואימות אורגנואידים של שיניים
האורגנואידים שפותחו מראים מראה צפוף ומכילים תאים המציגים יחס נוקליאו-ציטופלסמי גבוה, כפי שנצפה באופן דומה בתאי ERM7 (איור 3A). יתר על כן, ובאנלוגיה נוספת, האורגנואידים מבטאים את סמן ה-ERM ציטוקרטין 14 (CK14)22, ובכך מאשרים את מקור האפיתל שלהם (איור 3B), כמו גם סמני ERM מוצעים אחרים (כגון P63, CD44 ו-ITGα6 12,22,23 (איור 3B). יתר על כן, אורגנואידים מבטאים SOX2, סמן DESC ידוע בעכברים ונוכח גם באפיתל של שיני אדם מתפתחות (איור 3B)1. באופן מעניין, אמלוגנין (AMELX), המרכיב העיקרי של מטריצת האמייל, שנמצא גם הוא מבוטא באורגנואידים, מזוהה גם ב-ERM24 (איור 3C). ביטוי של סמני ERM/stemness אחרים מתואר במחקר האחרון שלנו19 וניתן להשתמש בו כדי לאשר עוד יותר את האורגנואידים שהתקבלו. יתר על כן, האורגנואידים שומרים על פנוטיפ ה-ERM/stemness שלהם במהלך המעבר, בין היתר על-ידי ביטוי יציב של סמני ERM/תאי גזע (איור 3D). לבסוף, האורגנואידים שמקורם בשיניים מראים יכולת התמיינות לתאי אמלובלסט(דמויי) אמלובלסט, אשר ניתן ליישם גם כדי לאמת את תרביות האורגנואידים המתקבלות, תוך הצגת ביטוי של סמני אמלובלסט בוגרים כגון חלבון הקשור לאדונטוגני-אמלובסט (ODAM) ואמלוטין (AMTN) לאחר העברה למדיום התמיינות (ראו19).

איור 1: זרימת עבודה סכמטית של התפתחות, אפיון ויישומים של אורגנואידים בשיניים. (B) הגברה, אפיון ופוטנציאל יישום של אורגנואידים בשיניים. ד, יום; P, מעבר. נוצר עם BioRender.com. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
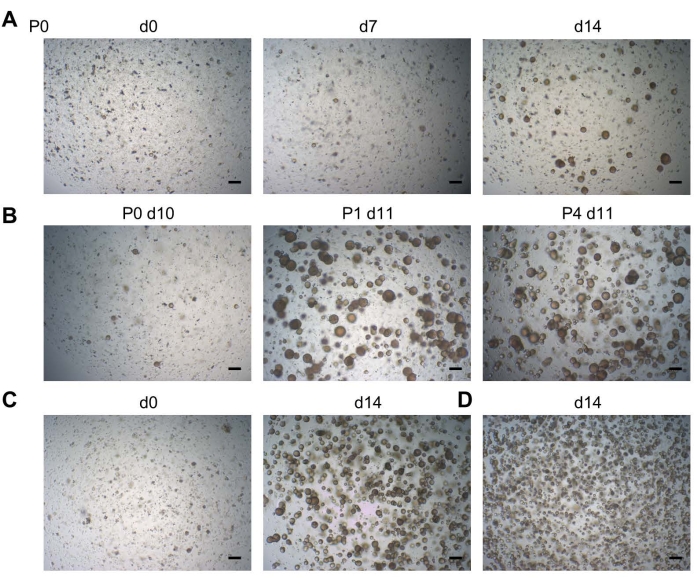
איור 2: התפתחות אורגנואידית של שן. (A) התפתחות אורגנואידית מרקמת DF. תמונות ברייטפילד מייצגות המוצגות בימים שונים (ד) לאחר הזריעה (P0; P, מעבר; 2.5x). (B) תמונות ברייטפילד מראות יכולת מעבר חזקה של קו אורגנואידי שן (2.5x). (C) תמונות ברייטפילד המציגות קו אורגנואידי של שן מיד בפס"ד (d0; שמאל; 2.5x) הנזרע בצפיפות של 20,000 תאים לבאר, ואת תרבית האורגנואידים הקונפלואנטית המתקבלת מוכנה למעבר (d14; מימין; 2.5x). (D) תמונות ברייטפילד מראות קו אורגנואידי של שן, שנזרע בצפיפות של >20,000 תאים, מה שהוביל לאורגנואידים קטנים יותר בצפיפות גבוהה מדי ב-d14 (2.5x). סרגלי קנה מידה: 200 μm. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 3: אפיון אורגנואידי שן. (A) תמונות ברייטפילד של תרביות אורגנואידיות שמקורן ב-DF בהגדלות שונות המציגות מבנים צפופים שפותחו ב-14 יום ב-TOM (P4; 5-20x)). המטוקסילין וכתם אאוזין של אורגנואיד (P1, יום 11). התיבה מוגדלת. חצים מציינים תאים עם יחס נוקליאו-ציטופלסמי גבוה. (B) כתמים אימונופלואורסצנטיים עבור סמני אפיתל/ERM/גבעול באורגנואידים הגדלים ב-TOM (פי 20). (C) צביעה אימונופלואורסצנטית לאמלוגנין (AMELX) באורגנואידים שגודלו על ידי TOM (פי 20). DAPI (כחול) שימש לתיוג גרעינים. (D) רמות ביטוי גנים (יחסית ל-GAPDH) של סמני ERM/stemness באורגנואידים שגודלו ב-P1 וב-P5 TOM ביום ה-14 של התרבית (ממוצע ±-SEM; n = 3 שכפולים ביולוגיים). סרגלי קנה מידה: 50 מיקרומטר, אלא אם כן צוין אחרת. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| מדיום איסוף זקיקים דנטליים (DF) | |
| שם | ריכוז |
| נשר בינוני חיוני מינימלי (αMEM) | |
| סרום בקר עוברי (FBS) | 10% |
| אמפוטריצין ב' | 0.5% |
| פניצילין-סטרפטומיצין (עט/סטרפ) | 1% |
טבלה 1: מדיום איסוף זקיקים דנטליים (DF). הטבלה מפרטת את המרכיבים של מדיום איסוף DF.
| מדיום אורגנואידי שן (TOM) | |
| שם | ריכוז |
| מדיום מוגדר ללא סרום (SFDM) | ראו טבלה 3 להרכב |
| A83-01 | 0.5 מיקרומטר |
| B27 (ללא ויטמין A) | 2% |
| רעלן כולרה | 100 ננוגרם/מ"ל |
| FGF2 (= FGF בסיסי) | 20 ננוגרם/מ"ל |
| FGF8 | 200 ננוגרם/מ"ל |
| FGF10 | 100 ננוגרם/מ"ל |
| L-גלוטמין | 2 מ"מ |
| IGF-1 | 100 ננוגרם/מ"ל |
| N2 | 1% |
| N-אצטיל L-ציסטאין | 1.25 מ"מ |
| ניקוטינמיד | 10 mM |
| נוג'ין | 100 ננוגרם/מ"ל |
| RSPO1 | 200 ננוגרם/מ"ל |
| SB202190 (עמ' 38i) | 10 מיקרומטר |
| ששש | 100 ננוגרם/מ"ל |
| WNT3a | 200 ננוגרם/מ"ל |
טבלה 2: תווך אורגנואידי שן (TOM). הטבלה מפרטת את המרכיבים ואת הריכוזים הנדרשים כדי להכין את התווך האורגנואידי של השן.
| מדיום מוגדר ללא סרום (SFDM) (pH 7.3) | |
| שם | ריכוז |
| סטרילי H2O | |
| DMEM 1:1 F12 ללא Fe | 16.8 גרם לליטר |
| טרנספרין | 5 מ"ג/ל' |
| אינסולין מלבלב בקר | 5 מ"ג/ל' |
| פניצילין G מלח נתרן | 35 מ"ג/ל' |
| מלח סטרפטומיצין סולפט | 50 מ"ג/ל' |
| אתנול מוחלט, ≥99.8% (EtoH) | 600 μL/L |
| קטלאז מכבד בקר | 50 μL/L |
| נתרן מימן קרבונט (NaHCO3) | 1 גרם/ל' |
| אלבומין בקר (דרגת תרבית תאים) | 5 גרם/ליטר |
טבלה 3: מדיום מוגדר ללא סרום (SFDM) (pH 7.3). הטבלה מפרטת את הרכב המדיום המוגדר ללא סרום.
| מדיום דיסוציאציה | |
| שם | ריכוז |
| מלח מחוזק פוספט (PBS) | |
| קולגןאז IV | 3 מ"ג/מ"ל |
| דיספנס II | 4 מ"ג/מ"ל |
טבלה 4: מדיום דיסוציאציה. רשימת המרכיבים והריכוזים הנדרשים להכנת מדיום הדיסוציאציה.
| בינוני A (עמ' 7.3) | |
| שם | ריכוז |
| סטרילי H2O | |
| אבקת DMEM עתירת גלוקוז | 13.38 גרם לליטר |
| HEPES | 5.958 גרם לליטר |
| נתרן-פירובט (C3H3Nao3) | 110 מ"ג/ל' |
| פניצילין G מלח נתרן | 35 מ"ג/ל' |
| מלח סטרפטומיצין סולפט | 50 מ"ג/ל' |
| נתרן כלורי (NaCl) | 0.5 גרם/ל' |
| נתרן מימן קרבונט (NaHCO3) | 1 גרם/ל' |
| אלבומין בקר (דרגת תרבית תאים) | 3 גרם/ליטר |
| דנאז* | 0.2 מ"ג/מ"ל |
| *להוסיף כאשר מוזכר |
טבלה 5: בינוני A (עמ' 7.3). הטבלה מפרטת את ריכוז המרכיבים ששימשו להכנת מדיום A.
| נוגדנים ראשוניים | ||
| שם | מארח | ריכוז |
| אמלקס | עכבר | 1:100 |
| CD44 | עכבר | 1:200 |
| CK14 | עכבר | 1:200 |
| ITGA6 | ארנב | 1:200 |
| עמ' 63 | ארנב | 1:1000 |
| SOX2 | ארנב | 1:2000 |
| נוגדנים סקונדריים | ||
| שם | מארח | ריכוז |
| עכבר IgG (אלקסה 555) | חמור | 1:1000 |
| ארנב IgG (אלכסה 488) | חמור | 1:1000 |
טבלה 6: רשימת נוגדנים ודילוליהם. הטבלה מפרטת את הנוגדנים ואת הדילולים שלהם ששימשו במחקר זה.
| פריימרים | ||
| גן | פריימר קדמי | פריימר הפוך |
| GAPDH | GGTATCGTGGAAGGACTCATGAC | ATGCCAGTGAGCTTCCCGTTCAG |
| עמ' 63 | CAACGCAGTAGACACCATTTCC | CCCAAAACCTCTCTCGCTTGTT |
| ITGA6 | GGCGGTGTTATGTCCTGAGTC | AATCGCCCATCACAAAAGCTC |
| SOX2 | GCTGGGACATGTGAAGTCTG | CCCTGTGGTTACCTCTTCCT |
| פיטקס2 | CAGCGGACTCACTTTACCAG | ATTCTTGAACCAAACCCGGAC |
טבלה 7: רשימת פריימרים. הטבלה מפרטת את הפריימרים של GAPDH, P63, ITGA6, SOX2 ו-PITX2 ששימשו במחקר זה.
Discussion
פרוטוקול זה מתאר את הדור היעיל והניתן לשחזור של אורגנואידים החל מהשן האנושית. למיטב ידיעתנו, זוהי המתודולוגיה הראשונה לביסוס אורגנואידים בעלי מושג נוכחי (אפיתל) החל מרקמת השיניים האנושית. האורגנואידים ניתנים להרחבה לטווח ארוך ומציגים פנוטיפ של גבעול אפיתל השן, תוך שכפול DESCs שדווחו בעבר בתא ה-ERM של ה-DF7. יתר על כן, האורגנואידים משכפלים מאפייני DESC/ERM פונקציונליים, כולל התגלגלות של תהליך התמיינות אמלובלסט 7,25,26. הממצאים חזקים מכיוון שנמצאו תוצאות דומות עם קווים אורגנואידים בלתי תלויים של מטופלים19.
בעת ביצוע פרוטוקול אורגנואיד השן הזה, יש לקחת בחשבון מספר נקודות קריטיות. ראשית, התוספת של מעכב קינאז הקשור ל-Rho (ROCK) Y-27632 בזריעה הראשונית ומיד לאחר כל מעבר היא חיונית כדי למנוע מהתאים הבודדים לעבור אנויקיס27. בנוסף, אמפוטריצין B נדרש בכל כיבוד המדיה במהלך P0 כדי למנוע צמיחה פטרייתית (אוראלית). שנית, מומלץ לעבד באופן מיידי את רקמות ה-DF שזה עתה בודדו לצורך היווצרות האורגנואידים האופטימלית ויעילות הגדילה, ולא להתחיל מרקמה בהקפאה, מה שמביא ליעילות נמוכה יותר. שלישית, בעת הפשרת קו אורגנואידי בהקפאה לצורך התרבות, בצע צעדים במהירות האפשרית והימנע מזמן הפשרה ארוך מדי, כמו גם מרווחים ארוכים מדי בין הצעדים ככל שהארכת הזמן מפחיתה את הישרדות התאים. רביעית, יש לציין כי מספר האורגנואידים במעבר המוקדם (P0-P3) עשוי להישאר מוגבל, גם משום שרק מספר מוגבל של תאי ERM (גזע) עשויים להימצא בדגימות רקמת DF המבודדות הספציפיות. לפיכך, יש לטפל בתרביות האורגנואידיות במעבר המוקדם בזהירות ובהתחשבות. לכן, מומלץ (1) להימנע מהתפשטות מהירה של תרבית האורגנואידים (כלומר, להתחיל להתפצל רק בשעה 1:3 או יותר החל מ-P3-4, ולפני כן בשעה 1:0.5 או 1:1); (2) להשתמש בשיטת הפיצול המתאימה (מעבר נמוך - מעבר גבוה יותר) כמתואר. בהקשר זה, מומלץ לאסוף שיני בינה לא מעוותות של מטופלים מתבגרים צעירים (בני 15 עד 19) מכיוון שתאי ERM פוחתים במספרם עם התפתחות השןוגילם 28. חמישית, שברי רקמות קשות שנותרו ללא הפרעה מרקמת ה-DF בתרחיף התא (גם לאחר הסינון) גורמים לירידת ה-BMM להיות פחות יציבה וסביר יותר להתפרק במהלך התרבית. אחוז גבוה יותר של BMM (כגון 80%) מומלץ אם נצפים מספר שברי רקמה קשה שלא הוסתרו בהשעיית תאי DF מנותקים. שישית, מומלץ מאוד להעביר את האורגנואידים בין היום ה-10 ליום ה-14 של התרבות, שכן תרבות ארוכה יותר תשפיע לרעה על יכולת ההרחבה האורגנואידית בגלל דיסוציאציה פחות אופטימלית. אם מסיבה זו או אחרת, אורגנואידים מתורבתים יותר מ -14 יום, ניתן היה להאריך את כמות TriplE Express ואת זמן הדגירה לדיסוציאציה אורגנואידית לדיסוציאציה יעילה, אם כי אין להתעלות על 15 דקות של חשיפה אנזימטית. באותו הקשר, יש לרענן את מדיום התרבית כל 2-3 ימים כדי למנוע תשישות של חומרים מזינים וגורמי גדילה. במקרה שאורגנואידים אינם מתרחבים כראוי, ללא קשר לנקודות הקריטיות שהוזכרו לעיל, יש להתמקד בשמירה על כל הכלים (BMM, SFDM קר כקרח לקצה טרום ציפוי, צינורות מיקרוצנטריפוגה) המשמשים במהלך העברת הקרח. בנוסף, חיוני ליישם נכונה את שיטות המעבר המובהקות (מעבר נמוך ושיטת מעבר גבוהה יותר) למעבר יעיל של האורגנואידים.
בעבר, קבוצות אחרות דיווחו על צמיחה במבחנה של רקמת DESC/ERM אנושית ראשונית 8,9,10,11,12,21. עם זאת, תרבויות היו בעיקר דו-ממדיות (חד-שכבתיות) ולא תלת-ממדיות, כמו המודל האורגנואידי הזה, יתר על כן, מה שמראה רק צמיחה לטווח קצר ושימור פנוטיפים. לחלופין, לעתים קרובות (באופן ספונטני) נעשה שימוש בתאים מונצחים, אשר, עם זאת, אינם פיזיולוגיים ומראים רק דמיון מוגבל לרקמה או לתאי המוצא. יתר על כן, קווי תאים אלה הופקו מרקמה עוברית ו/או מבעלי חיים. יתר על כן, התמיינות אמלובסט אינה מתוארת או מתועדת רק באופן מוגבל. לפיכך, המודל האורגנואידי המוצג כאן מציע מספר יתרונות, בהיותו (1) שחזור נאמן של הרקמה/תאים של המקור, (ii) לטווח ארוך הניתן להרחבה, (iii) תרבית בתלת-ממד המייצגת באופן הדוק יותר את תצורת in vivo, (iv) של מוצא האדם וגיל לאחר הלידה, ו-(v) מסוגל להתמיינות לתאי שיניים בוגרים (סוג תא אמלובלסט) (ראו19).
לפיכך, יצרנו כלי מחקר רב ערך, שלא דווח עליו קודם לכן, ובו מספר יישומים מעניינים (איור 1B). ניתן ליישם את האורגנואידים כדי לחקור את הגבעול והפלסטיות האנושית של DESC/ERM. הוא מספק את ההזדמנות לקבל תובנה נוספת על הביולוגיה של אוכלוסיית תאי ה-ERM החידתיים עדיין באמצעות ניתוחים אימונופלואורסצנטיים, ביטוי גנים ותעתיק (חד-תאי). בנוסף, אורגנואידים מתאימים במיוחד למידול מחלות אנושיות כדי לפענח מנגנונים פתוגנטיים, לזהות מטרות טיפוליות (חדשות) וליצור כלי גילוי וסינון תרופות29. באופן ספציפי יותר, מודל זה יכול להיות מיושם על ציסטות odontogenic (אשר אין מודל מחקר אמין זמין), אשר ניתן להשוות אורגנואידים בריאים שמקורם בשיניים. בנוסף, ניתן לרתום את הגישה האורגנואידית הזו של השן כדי למדל ולחקור מחלות שיניים, החל מהשפעת חיידקים וכלה במוטציות גנטיות הקשורות לאנומליות שיניים (כגון מוטציות ב-P63, שניתן להציגן באמצעות שיטות חדשניות לעריכת גנים כגון CRISPR-Cas)30, מה שיוביל בסופו של דבר למטרות טיפוליות פוטנציאליות וחדשניות ולטיפולים. יישומים אחרים של פרוטוקול אורגנואיד השן עשויים לכלול ביו-בנקינג (כיום כבר זמין עבור עיסת שיניים, כגון Future Health Biobank)31 כדי לאסוף קווים אורגנואידים מאנשים ומחלות מניפולטיביות (למשל, למחקר בסיסי ותרגום כגון בדיקת תרופות). יתר על כן, מספר דיווחים על מודלים אורגנואידיים מרוכבים המכילים לא רק אפיתל אלא גם סוגי תאים אחרים של רקמת המקור פורסמו לאחרונה 32,33. מכיוון שהרכב השן הוא מורכב למדי, ומאכלס תאים מזנכימליים, חיסוניים ואנדותליאליים, יישום מודל אורגנואיד אפיתל זה בשילוב עם סוגי תאים אלה כדי לייצג בפירוט רב יותר את מקבילם in vivo הוא פרספקטיבה מושכת. כמו כן, מערכת זו מאפשרת לחקור אמלוגנזה בשן האנושית, כיום רק לא מובנת היטב, אך בהחלט מסתמכת על אינטראקציות אפיתל-מזנכימליות. פענוח התפתחות האמלובלסט צפוי להוות קפיצת מדרגה חשובה בעולם המדעי והקליני הדנטלי, שכן ייצור האמייל, המרכיב המובהק של שינינו, הוא מטרה נרדפת מאוד בתיקון רקמות דנטליות. יתר על כן, המודלים האורגנואידיים המפורטים במחקר זה עשויים לסמל את ההתחלה לקראת היווצרות רקמות שעברו מינרליזציה במבחנה ולסלול את הדרך לפיתוח שן מהונדסת ביולוגית (או לפחות חלקים) לטיפול חלופי.
אחת המגבלות של המודל האורגנואידי היא שהוא מייצג אך ורק את מרכיב האפיתל של הרקמה. עם זאת, כפי שתואר בפירוט לעיל, ניתן לפתור חסרון זה על ידי הוספת סוגי תאים/רקמות אחרים, כגון המזנכים הדנטליים19. היבט נוסף שעשוי להיות מוכר כמגבלה הוא מקורו של ה- BMM המשמש כאן (Matrigel). BMM זה נגזר מסרקומה (אנגלברכט-הולם-נחיל) של עכבר ולכן יש להחליף אותו לפני תרגום הגישה האורגנואידית למרפאה. לאחרונה נעשו מספר מאמצים להחליף את מטריגל בהידרוג'לים סינתטיים 34,35. עם זאת, יש צורך במחקר נוסף כדי לגדל בהצלחה אורגנואידים בג'לים לא טבעיים כאלה. למרות שטכנולוגיית האורגנואידים מספקת גישה מעניינת לטיפול רגנרטיבי דנטלי עתידי - למשל, פיתוח שן מהונדסת ביולוגית - יש להעלות שאלות אתיות לגבי פרטיותם של תורמי התאים, כמו גם מסחור האורגנואידים והרקמות האנושיות הנגזרות מהם. עד כה לא הושגו מסקנות לגבי מסחור אורגנואידי למטרות רגנרטיביות36. ביו-בנקים של עיסת שיניים נמצאים בעלייהשל 31, כמו גם ביו-בנקים אורגנואידים מכמה, בעיקר רקמות סרטניות, למטרות בדיקת תרופות. בהתחשב בכך שלא ניתן לסווג אורגנואידים כתאים, גמטות, רקמות או איברים (שכולם מוסדרים על פי חוק), יש צורך דחוף בתיאור מעמדם המשפטי לשימוש במסגרות קליניות, מדעיות או מסחריות. אף על פי שהאורגנואידים הראו שהם מפקידים רקמה מינרלית כאשר הם מושתלים באופן תת עורי ב-vivo19, נדרשים מחקרים נוספים כדי לנתח את הפוטנציאל שלהם להפקיד אמייל בדומה לזה של שן אנושית טבעית.
בסך הכל, המודל האורגנואידי החדש שפותח מציג כלי מבטיח ובעל ערך לחקר הביולוגיה של השן האנושית (תאי גזע) ואמלוגנזה, שניהם כיום נחקרים רק בצורה גרועה, עם פרספקטיבות עתידיות על מודלים של מחלות שיניים וטיפולים רגנרטיביים.
Disclosures
המחבר המתאים מבטיח שכל המחברים חשפו את כל ניגודי העניינים.
Acknowledgements
אנו מודים לכל אנשי הצוות של כירורגיית הפה והסתות (MKA) של UZ Leuven, כמו גם למטופלים, על עזרתם שלא תסולא בפז באיסוף טוחנות שלישיות שזה עתה הוצאו. ברצוננו להודות גם לד"ר ריינהילדה ג'ייקובס ולד"ר אליזבת טייסקנס על עזרתם באיסוף הדגימות. עבודה זו נתמכה על ידי מענקים מ- KU Leuven (BOF) ו- FWO-Flanders (G061819N). ל.ה. הוא עמית דוקטורט ב-FWO (1S84718N).
Materials
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Eppendorf | 30120.086 | |
| 15 mL Centrifuge tube | Corning | 430052 | |
| 2-Mercaptoethanol | Sigma-Aldrich | M-6250 | |
| 48-well flat bottom plates | Corning | 3548 | |
| 50 mL Centrifuge tube | Corning | 430290 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Agarose | Lonza | 50004 | |
| Albumin Bovine (cell culture grade) | Serva | 47330.03 | |
| AMELX antibody | Santa Cruz | sc-365284 | |
| Amphotericin B | Gibco | 15200018 | |
| B27 (without vitamin A) | Gibco | 12587-010 | |
| Cassette | VWR | 7202191 | |
| Catalase from bovine liver | Sigma-Aldrich | C100 | |
| CD44 antibody | Abcam | ab34485 | |
| Cell strainer, 40 µm | Falcon | 352340 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Citric acid | Sigma-Aldrich | C0759 | |
| CK14 antibody | Thermo Fisher Scientific | MA5-11599 | |
| Collagenase IV | Gibco | 17104-019 | |
| Cover glass | VWR | 6310146 | |
| Cryobox | Thermo Scientific | 5100-0001 | |
| Cryovial | Thermo Fisher Scientific | 375353 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dispase II | Sigma-Aldrich | D4693 | |
| DMEM 1:1 F12 without Fe | Invitrogen | 074-90715A | |
| DMEM powder high glucose | Gibco | 52100039 | |
| Dnase | Sigma-Aldrich | D5025-15KU | |
| Donkey serum | Sigma-Aldrich | D9663 - 10ML | |
| Embedding workstation, 220 to 240 Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol absolute, ≥99.8% (EtOH) | Fisher Chemical | E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| FGF10 | Peprotech | 100-26 | |
| FGF2 (= basic FGF) | R&D Systems | 234-FSE-025 | |
| FGF8 | Peprotech | AF-100-25 | |
| GenElute Mammaliam Total RNA Miniprep Kit | Sigma-Aldrich | RTN350-1KT | Includes 1% β-mercaptoethanol dissolved in lysis buffer |
| Glass Pasteur pipette | Niko Mechanisms | 170-40050 | |
| Glycine | VWR | 101194M | |
| HEPES | Sigma-Aldrich | H4034 | |
| IGF-1 | PeproTech | 100-11 | |
| InSolution Y-27632 (ROCK inhibitor, RI) | Sigma-Aldrich | 688001 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| ITGA6 antibody | Sigma-Aldrich | HPA012696 | |
| L-Glutamine | Gibco | 25030024 | |
| Matrigel (growth factor-reduced; phenol red-free) | Corning | 15505739 | |
| Microscope slide | Thermo Fisher Scientific | J1800AMNZ | |
| Millex-GV Syringe Filter Unit, 0.22 μm | Millipore | SLGV033R | |
| Minimum essential medium eagle (αMEM) | Sigma-Aldrich | M4526 | |
| mouse IgG (Alexa 555) secondary antibody | Thermo Fisher Scientific | A-31570 | |
| N2 | Gibco | 17502-048 | |
| N-acetyl L-cysteine | Sigma-Aldrich | A7250 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Noggin | PeproTech | 120-10C | |
| P63 antibody | Abcam | ab124762 | |
| Pap Pen | Sigma-Aldrich | Z377821-1EA | Marking pen |
| Paraformaldehyde (PFA), 16% | Merck | 8.18715 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-streptomycin (Pen/Strep) | Gibco | 15140-122 | |
| Petri dish | Corning | 353002 | |
| Phosphate buffered saline (PBS) | Gibco | 10010-015 | |
| Pipette (P20, P200, P1000) | Eppendorf or others | 2231300006 | |
| Plastic transfer pipette (3.5 mL) | Sarstedt | 86.1171.001 | |
| Rabbit IgG (Alexa 488) secondary antibody | Thermo Fisher Scientific | A21206 | |
| RSPO1 | PeproTech | 120-38 | |
| SB202190 (p38i) | Biotechne (Tocris) | 1264 | |
| Scalpel (surgical blade) | Swann-Morton | 207 | |
| SHH | R&D Systems | 464-SH-200 | |
| Silicone molds (Heating block) | VWR | 720-1918 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-pyruvate (C3H3NaO3) | Sigma-Aldrich | P-5280 | |
| SOX2 antibody | Abcam | ab92494 | |
| StepOnePlus | Thermo Fisher Scientific | Real-Time PCR System | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile 1000 μL pipette tips with filter | Greiner | 740288 | |
| Sterile 20 μL pipette tips with filter | Greiner | 774288 | |
| Sterile 200 μL pipette tips with and without filter | Greiner | 739288 | |
| Sterile H2O | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Superscript III first-strand synthesis supermix | Invitrogen | 11752-050 | Reverse transcription kit |
| Tissue processor | Thermo Scientific | 12505356 | |
| Transferrin | Serva | 36760.01 | |
| Triton X-100 | Sigma | T8787-50ML | |
| TrypLE express | Gibco | 12605-010 | |
| Vectashield mounting medium+DAPI | Labconsult NV | H-1200 | Antifade mounting medium with DAPI |
| WNT3a | Biotechne (Tocris) | 5036-WN-500 | |
| Xylenes, 99%, for biochemistry and histology | VWR | 2,89,75,325 |
References
- Yu, T., Klein, O. D. Molecular and cellular mechanisms of tooth development, homeostasis and repair. Development (Cambridge). 147 (2), (2020).
- Arrow, P. Dental enamel defects, caries experience and oral health-related quality of life: a cohort study. Australian Dental Journal. 62 (2), 165-172 (2017).
- Mitsiadis, T. A., Orsini, G., Jimenez-Rojo, L. Dental Stem Cells for Tooth Regeneration. Dental Stem Cells: Regenerative Potential. Stem Cell Biology and Regenerative Potential. Stem Cell Biology and Regenerative Medicine. Zavan, B., Bressan, E. , Humana Press. Cham. (2016).
- Mitsiadis, T. A., Orsini, G. Editorial: a new era in dentistry: stem cell-based approaches for tooth and periodontal tissue regeneration. Frontiers in Physiology. 7, 357(2016).
- Miran, S., Mitsiadis, T. A., Pagella, P. Innovative dental stem cell-based research approaches: the future of dentistry. Stem Cells International. 2016, 7231038(2016).
- Shinmura, Y., Tsuchiya, S., Hata, K. I., Honda, M. J. Quiescent epithelial cell rests of malassez can differentiate into ameloblast-like cells. Journal of Cellular Physiology. 217 (3), 728-738 (2008).
- Davis, E. M. A review of the epithelial cell rests of Malassez on the bicentennial of their description. Journal of Veterinary Dentistry. 35 (4), 290-298 (2018).
- Athanassiou-Papaefthymiou, M., Papagerakis, P., Papagerakis, S. Isolation and characterization of human adult epithelial stem cells from the periodontal ligament. Journal of Dental Research. 94 (11), 1591-1600 (2015).
- Kim, G. -H., et al. Differentiation and establishment of dental epithelial-like stem cells derived from human ESCs and iPSCs. International Journal of Molecular Sciences. 21 (12), 1-16 (2020).
- Nam, H., et al. Establishment of Hertwig's epithelial root sheath/ epithelial rests of malassez cell line from human periodontium. Molecules and Cells. 37 (7), 562-567 (2014).
- Nam, H., et al. Expression profile of the stem cell markers in human hertwig's epithelial root sheath/Epithelial rests of Malassez cells. Molecules and Cells. 31 (4), 355-360 (2011).
- Tsunematsu, T., et al. Human odontogenic epithelial cells derived from epithelial rests of Malassez possess stem cell properties. Laboratory Investigation; A Journal of Technical Methods and Pathology. 96 (10), 1063-1075 (2016).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Cox, B., et al. Organoids from pituitary as a novel research model toward pituitary stem cell exploration. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development (Cambridge). 144 (10), 1775-1786 (2017).
- Schutgens, F., Clevers, H. Human organoids: tools for understanding biology and treating diseases). Annual Review of Pathology. 15, 211-234 (2020).
- Hemeryck, L., et al. Organoids from human tooth showing epithelial stemness phenotype and differentiation potential. Cellular and Molecular Life Sciences. 79 (3), 153(2022).
- Gao, X., Wu, Y., Liao, L., Tian, W. Oral organoids: progress and challenges. Journal of Dental Research. 100 (5), 454-463 (2021).
- Binder, M., et al. Novel strategies for expansion of tooth epithelial stem cells and ameloblast generation. Scientific Reports. 10 (1), 4963(2020).
- Xiong, J., Mrozik, K., Gronthos, S., Bartold, P. M. Epithelial cell rests of malassez contain unique stem cell populations capable of undergoing epithelial-mesenchymal transition. Stem Cells and Development. 21 (11), 2012-2025 (2012).
- Luan, X., Ito, Y., Diekwisch, T. G. H. Evolution and development of Hertwig's epithelial root sheath. Developmental Dynamics. 235 (5), 1167-1180 (2006).
- Fukumoto, S., et al. New insights into the functions of enamel matrices in calcified tissues. Japanese Dental Science Review. 50 (2), 47-54 (2014).
- Consolaro, A., Consolaro, M. F. M. O. ERM functions, EGF and orthodontic movement or Why doesn't orthodontic movement cause alveolodental ankylosis. Dental Press Journal of Orthodontics. 15 (2), 24-32 (2010).
- Guajardo, G., et al. Immunohistochemical localization of epidermal growth factor in cat paradental tissues during tooth movement. American Journal of Orthodontics and Dentofacial Orthopedics. 118 (2), 210-219 (2000).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gonçalves, J., Sasso-Cerri, E., Cerri, P. Cell death and quantitative reduction of rests of Malassez according to age. Journal of Periodontal Research. 43 (4), 478-481 (2008).
- Kim, J., Koo, B. -K., Knoblich, J. A. Human organoids: Model systems for human biology and medicine. Nature Reviews. Molecular Cell Biology. 21 (10), 571-584 (2020).
- Razmi, M. T., Narang, T., Handa, S. ADULT (acro-dermato-ungual-lacrimal-tooth) syndrome: a case report from India. Indian Dermatology Online Journal. 9 (3), 194(2018).
- Future Health Biobank. , Available from: https://futurehealthbiobank.com/ch-en/ (2022).
- Schreurs, R. R. C. E., Baumdick, M. E., Drewniak, A., Bunders, M. J. In vitro co-culture of human intestinal organoids and lamina propria-derived CD4+ T cells. STAR Protocols. 2 (2), 100519(2021).
- Fiorini, E., Veghini, L., Corbo, V. Modeling cell communication in cancer with organoids: Making the complex simple. Frontiers in Cell and Developmental Biology. 8, 166(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Zhang, Y., et al. Polyisocyanide hydrogels as a tunable platform for mammary gland organoid formation. Advanced Science. 7 (18), 2001797(2020).
- Mollaki, V. Ethical challenges in organoid use. BioTech. 10 (3), 12(2021).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved