Method Article
Establecer organoides a partir de dientes humanos como una herramienta poderosa hacia la investigación mecanicista y la terapia regenerativa
En este artículo
Resumen
Presentamos un protocolo para desarrollar cultivos de organoides epiteliales a partir de dientes humanos. Los organoides son robustamente expandibles y recapitulan las células madre epiteliales del diente, incluida su capacidad de diferenciación de ameloblastos. El modelo organoide único proporciona una herramienta prometedora para estudiar la biología dental humana (células madre) con perspectivas para enfoques regenerativos de dientes.
Resumen
Los dientes son de importancia clave en la vida no solo para la masticación de los alimentos y el habla, sino también para el bienestar psicológico. El conocimiento sobre el desarrollo de los dientes humanos y la biología es escaso. En particular, no se sabe mucho sobre las células madre epiteliales del diente y su función. Logramos desarrollar un nuevo modelo organoide a partir de tejido dental humano (es decir, folículo dental, aislado de muelas del juicio extraídas). Los organoides son expandibles de forma robusta y a largo plazo y recapitulan el compartimento de células madre epiteliales del diente humano propuesto en términos de expresión de marcadores, así como de actividad funcional. En particular, los organoides son capaces de desplegar un proceso de diferenciación de ameloblastos como ocurre in vivo durante la amelogénesis. Este modelo organoide único proporcionará una herramienta poderosa para estudiar no solo el desarrollo de los dientes humanos, sino también la patología dental, y puede allanar el camino hacia la terapia regenerativa dental. Reemplazar los dientes perdidos con un diente biológico basado en este nuevo modelo de organoides podría ser una alternativa atractiva a la implantación estándar actual de materiales sintéticos.
Introducción
Los dientes tienen funciones esenciales en la masticación de los alimentos, el habla y el bienestar psicológico (autoimagen). El diente humano consiste en tejidos altamente mineralizados de densidad y dureza variables1. El esmalte dental, el componente principal de la corona dental, es el tejido mineralizado más alto del cuerpo humano. Durante la formación del esmalte (amelogénesis), cuando se desarrollan los dientes, las células madre epiteliales dentales (DESC) se diferencian en células formadoras de esmalte (ameloblastos). Una vez formado, el esmalte rara vez se repara o renueva debido a la pérdida apoptótica de los ameloblastos al inicio de la erupción dental1. La restauración del tejido del esmalte dañado, causado por un traumatismo o enfermedad bacteriana, se realiza actualmente utilizando materiales sintéticos; sin embargo, estos están preocupados por deficiencias importantes como la microcongestión, la osteointegración y el anclaje inferiores, la vida útil finita y la falta de reparación completamente funcional2. Por lo tanto, un cultivo robusto y confiable de DESC humanos con la capacidad de generar ameloblastos y el potencial de producir tejido mineralizado sería un gran paso adelante en el campo de la regeneración dental.
El conocimiento sobre el fenotipo DELSC humano y la función biológica son escasos 3,4,5. Curiosamente, se ha propuesto que los DESC de los dientes humanos existen en los restos de células epiteliales de Malassez (ERM), grupos celulares presentes dentro del folículo dental (DF), que rodea los dientes no erupcionados y permanece presente en el ligamento periodontal alrededor de la raíz una vez que el diente entra en erupción1. Se ha encontrado que las células ERM cocultivadas con pulpa dental se diferencian en células similares a los ameloblastos y generan tejido similar al esmalte6. Sin embargo, los estudios profundos sobre el papel específico de las células ERM en la (re)generación de esmalte han sido limitados debido a la falta de modelos de estudio confiables7. Los sistemas actuales de cultivo in vitro ERM se ven obstaculizados por la vida útil limitada y la rápida pérdida de fenotipo en las condiciones 2D utilizadas estándarmente 8,9,10,11,12. Por lo tanto, se necesita un sistema in vitro manejable para expandir, estudiar y diferenciar fielmente los DESC humanos.
Durante la última década, una poderosa técnica para cultivar células madre epiteliales in vitro se ha aplicado con éxito a varios tipos de tejidos epiteliales (humanos) para estudiar su biología, así como la enfermedad 13,14,15,16. Esta tecnología permite que las células madre epiteliales tisulares se desarrollen automáticamente en construcciones de células 3D (es decir, organoides) cuando se siembran en un andamio que imita la matriz extracelular (ECM) (típicamente, Matrigel) y se cultivan en un medio definido que replica la señalización del nicho de células madre del tejido y / o la embriogénesis. Los factores de crecimiento típicos necesarios para el desarrollo de organoides incluyen el factor de crecimiento epidérmico (EGF) y los activadores del sitio de integración MMTV (WNT) de tipo sin alas 14,15,16. Los organoides resultantes se caracterizan por una fidelidad duradera en la imitación de las células madre epiteliales originales del tejido, así como una alta capacidad de expansión al tiempo que conservan su fenotipo y propiedades funcionales, superando así la disponibilidad de tejido humano primario a menudo limitada adquirida en la clínica. Para establecer organoides, no se requiere el aislamiento de las células madre epiteliales del tejido heterogéneo (es decir, que comprende otros tipos de células, como las células mesenquimales) antes del cultivo, ya que las células mesenquimales no se adhieren o prosperan en la ECM, lo que eventualmente resulta en organoides puramente epiteliales 13,16,17,18,19 . Esta tecnología prometedora y versátil ha llevado al desarrollo de múltiples modelos organoides a partir de diversos tejidos epiteliales humanos. Sin embargo, los organoides derivados de dientes humanos, valiosos para el estudio profundo del desarrollo, la regeneración y la enfermedad de los dientes, aún no se han establecido20,21. Recientemente logramos desarrollar un nuevo modelo organoide a partir de tejido DF a partir de terceros molares (muelas del juicio) extraídos de pacientes adolescentes19.
Aquí, describimos el protocolo para desarrollar cultivos de organoides epiteliales a partir del diente humano adulto (es decir, a partir del DF de terceros molares) (Figura 1A). Los organoides resultantes expresan marcadores de tallo asociados a ERM mientras que son expandibles a largo plazo. Curiosamente, a diferencia de la mayoría de los otros modelos de organoides, el EGF típicamente necesario es redundante para el desarrollo y crecimiento de organoides robustos. Curiosamente, los organoides del tallo muestran propiedades de diferenciación de ameloblastos, imitando así las características y procesos de ERM / DESC que ocurren in vivo. El nuevo y único modelo organoide descrito aquí permite explorar la biología, la plasticidad y la capacidad de diferenciación de DESC y abre la puerta para dar los primeros pasos hacia enfoques regenerativos de los dientes.
Protocolo
Todos los métodos descritos aquí han sido aprobados por el Comité de Ética de Investigación UZ/KU Leuven (13/0104U). Los terceros molares extraídos (muelas del juicio) se obtuvieron después del consentimiento informado de los pacientes.
1. Preparativos
- Precalentar una placa de cultivo de 48 pocillos durante 15-20 h en una incubadora de CO2 al 1,9% a 37 °C.
- Licuar una alícuota de Matrigel (factor de crecimiento reducido; libre de rojo de fenol; también conocido como matriz de membrana basal; BMM) sobre hielo (4 °C) durante un mínimo de 2 h antes del paso 2.1.
NOTA: Evite los ciclos de congelación/descongelación del BMM. Licuar el BMM durante 15-20 h sobre hielo y alícuota a 1 ml en tubos de microcentrífuga y almacenar a -20 °C. - Enfríe la centrífuga a 4 °C.
- Prepare el medio y filtre la solución a través de un filtro de 0,22 μm. Los siguientes volúmenes se basan en la colección de los TF de los cuatro terceros molares típicamente extraídos simultáneamente.
- Preparar 20 mL de medio de recolección de DF (Tabla 1): águila mediana esencial mínima (αMEM) que contenga 10% de suero fetal bovino (FBS), 0,5% de anfotericina B y 1% de penicilina-estreptomicina. Transfiera 4 ml de medio de recolección de DF a un tubo de 15 ml y transfiera los tubos en hielo.
NOTA: Un tubo de 15 ml es suficiente por paciente para la recolección de muestras (es decir, para cuatro terceros molares). - Hacer 20 ml de medio organoide dental (también conocido como TOM; Tabla 2) uso de medio definido sin suero (SFDM; Tabla 3). Conservar TOM a 4 °C durante un máximo de 2 semanas.
- Preparar 8 ml de medio de disociación (Tabla 4), es decir, solución salina tamponada con fosfato (PBS) que contenga colagenasa VI (3 mg/ml) y dispasa II (4 mg/ml). Precalentar el medio de disociación en un baño de agua de 37 °C durante al menos 10 min antes de su uso y transferirlo a dos tubos de 15 ml (4 ml por tubo) para disociar cuatro tejidos de DF.
- Prepare una placa de lavado (12 pocillos) que contenga: tres pozos con 70% de EtOH, tres pozos con PBS y tres pozos con medio de recolección de DF.
- Hacer 15 ml de medio A por muestra (es decir, 5 ml por dos TF por paciente; Tabla 5).
NOTA: Los siguientes pasos deben realizarse en condiciones estériles.
- Preparar 20 mL de medio de recolección de DF (Tabla 1): águila mediana esencial mínima (αMEM) que contenga 10% de suero fetal bovino (FBS), 0,5% de anfotericina B y 1% de penicilina-estreptomicina. Transfiera 4 ml de medio de recolección de DF a un tubo de 15 ml y transfiera los tubos en hielo.
2. Disociación del folículo dental
- Una vez que los terceros molares con TF asociados se recogen en el medio de recolección (en hielo), transfiera el contenido de los tubos a una placa de Petri.
- Sostenga el diente con una pinza y aísle cuidadosamente el DF con una cuchilla quirúrgica.
NOTA: Este paso requiere práctica; ten cuidado con la cuchilla. - Para lavar la sangre restante de los DF, coloque los tejidos de DF brevemente en el primer pocillo de EtOH (placa de lavado) al 70% durante 20 s, y luego transfiéralos al siguiente pozo de EtOH durante 20 s, y más allá del tercer pozo de EtOH (máximo 1 min en 70% de EtOH en total; un tiempo de incubación más largo dará como resultado una viabilidad celular reducida).
- A continuación, continúe enjuagando en los tres pozos de PBS (máximo 2 minutos en total).
- Enjuague los SF en los tres pozos medios de recolección de DF restantes (hasta un máximo de 20 minutos en total).
- Transfiera los TF enjuagados a una nueva placa de Petri.
- Cortar un trozo pequeño de uno de los TF (~5 mm2) para la fijación de paraformaldehído (PFA) (ver sección 7) y almacenarlo en hielo (durante un máximo de 6 h) en un tubo de microcentrífuga que contenga 500 μL de medio de recolección de DF hasta la fijación de PFA.
- Picar el resto de los DFs en trozos pequeños (~1 mm2).
NOTA: Se recomienda procesar inmediatamente los tejidos DF recién aislados para la formación óptima de organoides y la eficiencia del crecimiento, en lugar de comenzar a partir de tejido criopreservado, lo que resulta en una menor eficiencia. Sin embargo, es posible criopreservar tejido primario de DF en este paso (ver medio de criopreservación y protocolo en la sección 5). - Transfiera los TF picados a un tubo de 15 ml que contenga 4 ml de medio de disociación precalentado e incube en un baño de agua a 37 °C durante 2 h.
NOTA: Agregue dos DF por medio de disociación precalentado de 4 ml (un tubo) para asegurar una disociación óptima. - Cada 15 minutos, pipetee la mezcla del medio de disociación DF hacia arriba y hacia abajo utilizando una pipeta Pasteur de vidrio para acelerar la desintegración del tejido. Cuando las piezas de DF ya no se observen (generalmente después de 1 h), proceda con la disociación de DF utilizando una pipeta Pasteur pulida al fuego estrechada.
NOTA: Para una disociación óptima de DF, cambie a una pipeta Pasteur estrechada por pulido al fuego a más tardar 1 h de aislamiento de DF.- Mientras tanto, preparar 10 ml de medio A que contenga 50 μL de DNasa (0,2 mg/ml; Tabla 5).
- Añadir 5 ml de medio A (que contenga la DNasa) a cada tubo con DF disociado e incubar durante 1 min a temperatura ambiente (RT).
- Filtre la suspensión celular (que contiene células individuales y grupos de células pequeñas) a través de un colador de células de 40 μm para eliminar los fragmentos grandes restantes y (la mayoría de) el tejido fibroso.
- Combine los varios tubos con DF disociada de un paciente en este paso.
- Enjuague el filtro con 1 ml de A medio. Centrífique la suspensión de la celda filtrada a 200 x g durante 10 min a 4 °C.
- Retire el sobrenadante, vuelva a suspender el pellet en 1 ml de SFDM (Tabla 3) y transfiera la suspensión celular a un tubo de microcentrífuga de 1,5 ml.
- Calcule la concentración de células utilizando un contador de células automatizado. Descuide los grupos celulares que quedan.
- Centrifugar a 200 x g durante 5 min a 4 °C.
3. Establecimiento del cultivo de organoides dentales (Figura 1A y Figura 2A)
- Con base en el número de celdas obtenido, calcule el número de pozos que se pueden sembrar. Una gota de 20 μL debe contener 20.000 células. La mezcla final se compone de suspensión celular y BMM en una proporción de 30:70.
- Retire la cantidad adecuada de sobrenadante y resuspenda en BMM helado para obtener una proporción de 70:30 de BMM: suspensión celular para chapado. Por ejemplo, cuando se obtienen 200.000 células, placa 10 gotas de 20 μL. Por lo tanto, retire el sobrenadante hasta que queden 60 μL de la suspensión celular, agregue 140 μL de BMM helado y resuspenda.
- Resuspenda lentamente para evitar la formación de burbujas de aire. Una vez resuspendido en BMM, mantenga el tubo de la microcentrífuga en hielo.
NOTA: Mantener el tubo de la microcentrífuga en hielo es crucial para evitar la solidificación de BMM.
- Resuspenda lentamente para evitar la formación de burbujas de aire. Una vez resuspendido en BMM, mantenga el tubo de la microcentrífuga en hielo.
- Pipetear las gotas de BMM de 20 μL en el centro de los pozos de la placa de cultivo precalentada de 48 pocillos.
- Voltee la placa boca abajo, colóquela en una incubadora de CO2 al 1,9% (% de CO2 según el tampón SFDM) y deje que se solidifique durante al menos 20 minutos a 37 ° C.
- Añadir el inhibidor de ROCK (RI; 10 μM) y la anfotericina B (0,1%) a TOM y precalentar el medio en un baño de agua a 37 °C.
NOTA: La anfotericina B es sensible a la luz. - Tome la placa de 48 pocillos de la incubadora, colóquela en posición vertical y agregue 250 μL del medio preparado precalentado a cada pozo con gotas / células BMM y devuelva la placa a la incubadora de CO2 al 1.9%.
- Para refrescar el medio (preferiblemente cada 2-3 días), incline la placa de 48 pocillos en un ángulo de 45°, retire suavemente el medio anterior mientras evita tocar la gota de BMM y agregue 250 μL de nuevo medio TOM precalentado.
NOTA: Se recomienda refrescar al menos tres veces a la semana para evitar el agotamiento de nutrientes clave y factores de crecimiento. La RI solo debe añadirse a TOM en la siembra inicial y en los primeros días de cada paso (ver sección 4) para prevenir la muerte celular por anoikis y mejorar el crecimiento organoide. La anfotericina B solo se agrega al medio durante el paso 0 (P0) para bloquear la posible contaminación por hongos.
4. Amplificación y paso a través del cultivo de organoides dentales (Figura 1B y Figura 2B)
- Paso de los organoides entre 10 y 14 días de cultivo.
NOTA: Evite el cultivo durante un período más largo, ya que el cultivo prolongado puede limitar el recrecimiento y la transitabilidad de los organoides. Solo en el desarrollo inicial (P0) los organoides pueden cultivarse durante un máximo de 20 días, dependiendo de su tasa de crecimiento (hasta que se alcance el máximo ±200 μm de diámetro). - Retire el medio de los pocillos con organoides que necesitan ser pasados. Dentro de una condición de cultivo, agrupe hasta cuatro pozos confluentes (ver Figura 2C).
- Para recolectar los organoides, agregue 400 μL de SFDM helado por pozo directamente sobre la gota de BMM y pipetee repetidamente el medio hacia arriba y hacia abajo hasta que se desaloje toda la gota de BMM.
- En caso de que se estén agrupando pozos, transfiera los 400 μL del primer pozo al siguiente (y así sucesivamente) para desalojar las gotas de BMM que contienen organoides de todos los pozos que deben agruparse.
- Transfiera el conjunto de organoides BMM desalojado a un tubo de microcentrífuga de 1,5 ml y repita el paso 4,3 nuevamente hasta que todas las estructuras organoides se recojan de los pozos.
- Centrifugar a 200 x g durante 5 min a 4 °C.
- Precalentar una alícuota de TrypLE Express (suplementado con RI a 5 μM) en un baño de agua a 37 °C. Por tubo de microcentrífuga de organoides, se necesita un volumen de 400 μL TrypLE Express.
- Después de la centrifugación, retire el sobrenadante y vuelva a suspender el pellet en 400 μL de TrypLE. Incubar la suspensión en un baño de agua a 37 °C durante 12 min.
- Añadir 400 μL de SFDM helado para inactivar la enzima y centrifugar a 200 x g durante 5 min a 4 °C. Retire el sobrenadante.
- Cubra previamente una punta (para ver el volumen, consulte a continuación) con SFDM helado y vuelva a suspender el gránulo organoide.
- Para evitar la pérdida de organoides, reutilice la misma punta (pre-recubierta) tanto como sea posible sin poner en peligro la esterilidad.
NOTA: El volumen de SFDM requerido para la resuspscripción del pellet depende del número de estructuras organoides obtenidas y del número de paso actual. - Como regla general, para los pasajes, P0 a P2-3 (generalmente todavía creciendo un bajo número de organoides) utilizan un volumen de 200 μL SFDM. A partir de pasajes, P3-4 o superior (generalmente produciendo un mayor número de organoides) utiliza un volumen de 700 μL de SFDM.
NOTA: Ambos procedimientos se denominan métodos de "paso bajo" y "paso superior", respectivamente (véanse los pasos 4.10 y 4.11). La aplicación correcta de los distintos métodos es crucial para el paso eficiente de los organoides. Con el método de paso más alto, los organoides se pierden más fácilmente y no deben aplicarse a un bajo número de organoides (es decir, en P0 a P2-3). Sin embargo, el método de paso más alto es necesario para disociar eficientemente grandes cantidades de organoides.
- Para evitar la pérdida de organoides, reutilice la misma punta (pre-recubierta) tanto como sea posible sin poner en peligro la esterilidad.
- Método de paso bajo: Resuspendir el pellet en 200 μL de SFDM helado. Empuje la punta de la pipeta completamente vacía contra la parte inferior del tubo de la microcentrífuga para reducir su diámetro. Compruebe si el diámetro es lo suficientemente pequeño (aspiración más lenta, el flujo está sesgado pero no bloqueado). Pipetee hacia arriba y hacia abajo durante 5 minutos para interrumpir mecánicamente los organoides.
- Método de paso superior: Resuspend el pellet en 700 μL de SFDM helado con una punta P1000. Agregue una punta P200 (sin filtro) encima de esta punta P1000 y cubra previamente con SFDM helado. Evite la formación de burbujas de aire ajustando el ajuste de volumen de la pipeta para aspirar al menos al 90% del volumen medio (con organoides). Pipetee hacia arriba y hacia abajo durante 5 minutos para interrumpir mecánicamente los organoides.
- Compruebe bajo el microscopio de luz (a un aumento de 4x) si se obtienen principalmente células individuales con (sólo) unas pocas estructuras no dispersas.
- Agregue 500 μL de SFDM helado al tubo de la microcentrífuga y mezcle suavemente la mezcla de células disociadas con el SFDM fresco mediante pipeteo.
- Deje sedimentar grandes estructuras sin perturbar durante 10 minutos colocando verticalmente el tubo de la microcentrífuga sobre hielo.
NOTA: Es necesario eliminar las estructuras no perturbadas porque influyen negativamente en la transitabilidad de los organoides. Para la iniciación organoide (P0), este paso de sedimentación no es necesario. - Recoger el sobrenadante (~500-1.000 μL dependiendo del método de paso) que contiene células individuales y grupos de células pequeñas; transferir a un nuevo tubo de microcentrífuga y centrifugar a 190 x g durante 10 min a 4 °C.
- Calcule la concentración de células utilizando un contador de células automatizado. Descuide los grupos celulares que quedan.
- Cuente cuántos pozos se pueden sembrar y calcule la relación de suspensión celular/BMM apropiada como se describió anteriormente (sección 3).
- Agregue el 70% de BMM al pellet celular y mantenga el tubo de la microcentrífuga en hielo.
NOTA: Es crucial mantener el tubo de la microcentrífuga en hielo para evitar la solidificación de BMM. - Continúe con el paso 3.3 hasta el 3.7 y pase nuevamente entre el día 10 y el día 14 de la cultura.
5. Criopreservación de organoides dentales
- Recoja y disocie los organoides como se mencionó anteriormente para el paso (paso 4). Centrifugar la suspensión celular a 200 x g durante 5 min a 4 °C.
- Deseche el sobrenadante y vuelva a suspender el pellet en 1 ml de medio de criopreservación que contenga SFDM (70%), FBS (20%) y DMSO (10%).
- Transfiera la suspensión a un criovial y póngala en hielo. Coloque los crioviales en una caja criogénica y transfiéralos a -80 °C (durante al menos 4 h).
- Dentro de 1 mes, transfiera las muestras congeladas a nitrógeno líquido para su almacenamiento a largo plazo (>12 meses).
6. Descongelación de organoides dentales criopreservados
- Antes de comenzar el procedimiento de descongelación, coloque un tubo de 15 ml por criovial sobre hielo que contenga 10 ml de SFDM con 20% de FBS.
- Retire el criovial del nitrógeno líquido y póngalo en hielo.
NOTA: Realice los siguientes pasos lo más rápido posible y evite el tiempo de descongelación demasiado largo (>5 min), así como los intervalos demasiado largos entre los pasos (>5 min), ya que dicha prolongación disminuirá la supervivencia celular. - Coloque el criovial en un baño de agua tibia (37 °C) hasta que se descongele (~1-2 min).
- Transfiera inmediatamente el contenido del criovial al tubo helado de 15 ml y a la centrífuga a 200 x g durante 5 min a 4 °C.
- Retire 9 ml del sobrenadante y centrífuga los 1 ml restantes a 200 x g durante 5 min a 4 °C. Retire el sobrenadante y lave el pellet con 1 ml de SFDM helado.
- Transfiera la suspensión celular a un tubo de microcentrífuga de 1,5 ml y cuente las células utilizando un contador de células automatizado.
- Cuente cuántos pozos se pueden sembrar y calcule la relación de suspensión celular/BMM apropiada como se describió anteriormente (sección 3).
- Centrifugar a 200 x g durante 5 min a 4 °C. Resuspenda el pellet en una proporción de 70:30 de BMM:TOM y manténgalo en hielo.
- Continúe con el paso 3.3 hasta el 3.7 y pase entre el día 10 y el día 14 de la cultura.
7. Fijación e incrustación de parafina de organoides dentales
NOTA: Este procedimiento (incluidas las secciones 8 y 9) también se puede aplicar al tejido primario de DF.
- Fijación de organoides dentales en PFA
- Retire el medio de cada pozo como en el paso 4.2.
- Recoge los organoides desalojando la gota de BMM (paso 4.3). Transfiera la mezcla de BMM-organoide a un tubo de microcentrífuga de 1,5 ml.
- Centrifugar a 200 x g durante 5 min a 4 °C.
- Retire el sobrenadante y agregue 500 μL de PFA al 4% e incube durante un mínimo de 30 min (máximo 1 h) a RT con una mezcla suave en un agitador orbital.
PRECAUCIÓN: Use la campana química cuando trabaje con PFA. - Centrifugar a 200 x g durante 5 min a 4 °C. Retire el sobrenadante y enjuague el gránulo organoide con PBS durante 10 minutos en RT con un suave agitación.
- Lave el gránulo organoide (paso 7.1.5) dos veces más. Gire los organoides fijos hacia abajo a 200 x g durante 5 min a 4 °C.
- Resuspendir el pellet en 500 μL de 70% EtOH (en agua desionizada). Almacene los organoides durante un máximo de 1 mes en EtOH al 70% a 4 °C.
- Incrustación de agarosa y parafina de organoides dentales
NOTA: Para incrustar organoides de manera eficiente en la parafina, se necesita un paso adicional de incrustación en la agarosa.- Centrifugar los organoides fijados con PFA en 70% EtOH a 200 x g durante 5 min a 4 °C. Retire el sobrenadante.
- Prepare una solución de agarosa al 2% en 30 ml de PBS en una botella de vidrio. Calentar la mezcla de agarosa-PBS en un microondas hasta que se observe una estructura similar a un gel (aproximadamente 2,5 min a 600 W).
- En paralelo, agregue 30 ml de PBS a otra botella de vidrio y caliéntelo en el microondas (aproximadamente 2,5 min a 600 W). Deje que la solución de agarosa se enfríe durante 1 min.
- Cortar el extremo de una punta P200 para permitir trabajar con la solución de agarosa con precisión y evitar burbujas de aire.
- Precaliente la punta P200 en el PBS caliente mediante el pipeteo hacia arriba y hacia abajo varias veces.
- Agregue 150 μL de solución de agarosa precalentada al gránulo organoide y pipetee suavemente la mezcla organoide-agarosa (con una resuspensión mínima) mientras evita las burbujas de aire.
NOTA: La resuspensión mínima permitirá ubicar mejor los organoides en el gel de agarosa en la sección del microtomo, ya que los organoides están más cerca unos de otros. - Transfiera inmediatamente la mezcla de organoide-agarosa a la misma tapa del tubo de la microcentrífuga, coloque el tubo horizontalmente y deje que la agarosa se solidifique (~ 20 min en RT). Mientras tanto, etiquete los casetes.
- Una vez solidificado, retire el gel de agarosa de la tapa de la microcentrífuga con una pinza y transfiéralo a un casete etiquetado.
- Transfiera el casete que contiene agarosa a un vaso de precipitados que contenga 50% de EtOH en agua desionizada. Cubra el vaso de precipitados con parafilm para evitar la evaporación del EtOH.
NOTA: El volumen del vaso de precipitados depende del número de casetes. - Procese las muestras en un procesador de tejidos durante la noche.
NOTA: Como la parafina se solidifica en RT, los siguientes pasos deben realizarse rápidamente. - Precalentar un bloque calefactor en la estación de trabajo de incrustación durante 15 minutos.
- Retire el gel de agarosa que contiene organoides encerrado en el cassette y colóquelo en el bloque de calentamiento precalentado. Retire la tapa del cassette y déjela a un lado para su uso posterior.
- Llene el bloque de calefacción restante con parafina.
NOTA: Verifique con una pinza si el gel de agarosa que contiene organoides todavía se encuentra en la parte inferior del bloque de calentamiento. Debido a su peso ligero, podría comenzar a flotar, lo que resulta en la pérdida de muestras. - Coloque la tapa del cassette en la parte superior del bloque de calefacción. Deja que se solidifique durante 30 min en un plato frío. Retire el bloque calefactor y guarde los bloques de parafina a 4 °C.
8. Seccionamiento y tinción del microtomo de organoides dentales (Figura 2B y Figura 3A-C)
- Seccionamiento microtomático de bloques de parafina que contienen organoides
- Cortar secciones de 5 μm de los organoides dentales en los bloques de parafina usando un microtomo.
- Coloque las rodajas de parafina sobre un portaobjetos de vidrio para microscopio. Coloque el portaobjetos de vidrio del microscopio sobre una placa caliente a 37 °C y cúbralo con agua desionizada con una pipeta Pasteur.
- Deje que el vaso del microscopio se seque durante la noche.
- Tinción de secciones organoides dentales
- Desparafinar las secciones organoides (en el portaobjetos de vidrio del microscopio) en un horno durante 1 h a 58 °C.
- Rehidrate las secciones organoides (en el portaobjetos de vidrio del microscopio) en la serie EtOH decreciente dentro de la campana química en el siguiente orden:
Xileno 2x durante 3 min cada uno
100% EtOH 2x durante 3 min cada uno
95% EtOH 2x durante 3 min cada uno
90% EtOH 2x durante 3 min cada uno
70% EtOH 3x durante 3 min cada uno
PRECAUCIÓN: Use la campana química cuando trabaje con xileno. - Enjuague el portaobjetos de vidrio del microscopio en agua del grifo durante 5 minutos en RT. Luego, enjuáguelo en PBS durante 5 minutos en RT.
- Realice la recuperación de antígenos colocando las secciones organoides (en el portaobjetos de vidrio del microscopio) en tampón de citrato precalentado (10 mM de ácido cítrico en agua desionizada con pH 6; en un recipiente de plástico; precalentado durante 10 min en un baño de agua de 95 °C) durante 30 min en un baño de agua de 95 °C.
- Deje que el portaobjetos de vidrio del microscopio se enfríe durante 20 minutos en RT. Enjuague el portaobjetos de vidrio del microscopio en PBS durante 5 minutos en RT, y luego en PBS que contenga 0.1% de Tritón-X (PBT) durante 5 minutos en RT.
- Utilice una pluma de marcado para crear una barrera hidrofóbica en los bordes de cada diapositiva.
- Bloqueo durante un mínimo de 1 h a RT en tampón de bloqueo (que contiene 1,5 mg/ml de glicina, 2 mg/ml de suero bovino de albúmina (BSA) disuelto en PBT) más suero de burro al 10%.
NOTA: Por lo general, se necesitan 300 μL de tampón de bloqueo más un 10% de suero de burro por portaobjetos de vidrio del microscopio. - Coloque el portaobjetos de vidrio del microscopio en una cámara húmeda. Use una caja hermética donde quepan todos los portaobjetos y moje algunos pañuelos de papel con agua para colocarlos en la parte inferior de la caja. Esto evitará que las diapositivas se sequen durante los pasos de tinción posteriores.
- Retire el tampón de bloqueo, agregue el anticuerpo primario (Tabla 6) preparado en tampón de bloqueo más suero de burro al 1% e incube el portaobjetos cubierto con solución de anticuerpos durante la noche en la cámara húmeda a 4 ° C. Vuelva a hacer el borde de la pluma de marcado si es necesario.
- Lave el portaobjetos de vidrio del microscopio tres veces en PBT a RT durante 10 minutos con una mezcla suave en un agitador orbital (75-150 rpm).
- Añadir el anticuerpo secundario (Tabla 6), preparado en tampón de bloqueo más suero de burro al 1%, e incubar durante 1 h en la cámara húmeda a RT.
- Retire el tampón de bloqueo y lave el portaobjetos de vidrio del microscopio tres veces en PBT a RT durante 10 minutos con una mezcla suave en un agitador orbital.
- Agregue el medio de montaje antifade con DAPI (1 a 3 gotas) en una cubierta de vidrio y monte esto en la parte superior de las secciones organoides (en el portaobjetos de vidrio del microscopio). Proceda con la toma de imágenes; conservar los portaobjetos durante un máximo de 1 semana a 4 °C.
9. Extracción de ARN y RT-qPCR de organoides dentales (Figura 2B y Figura 3D)
- Extracción de ARN de organoides dentales
- Retire el medio de cada pocillo (paso 4.2).
- Recoger los organoides desalojando la gota de BMM (paso 4.3), transferir la mezcla BMM-organoide a un tubo de microcentrífuga de 1,5 ml y centrifugar a 200 x g durante 5 min a 4 °C.
- Retire el sobrenadante, resuspenda vigorosamente en 350 μL de β-mercaptoetanol al 1% disuelto en tampón de lisis (Tabla de Materiales), y póngalo en hielo.
PRECAUCIÓN: Realice todos los pasos con β-mercaptoetanol en una campana química.
NOTA: Las muestras se pueden almacenar en este paso durante un máximo de 1 mes a -80 °C. Descongele las muestras en hielo antes de continuar con el paso 9.1.4. - Vórtice las muestras hasta que ya no se observen estructuras organoides.
- Proceda con la extracción de ARN utilizando el kit de extracción de ARN (Tabla de Materiales) de acuerdo con las instrucciones del fabricante.
- RT-qPCR de organoides dentales (Tabla 7)
- Transcribir inversamente (RT) el ARN19 utilizando el kit de transcripción inversa (Tabla de Materiales) de acuerdo con las instrucciones del fabricante.
- Analizar las muestras de ADNc resultantes con PCR cuantitativa (qPCR) basada en SYBR Green19 utilizando un Sistema de PCR en Tiempo Real (Tabla de Materiales).
Resultados
Desarrollo de organoides dentales
Proporcionamos un protocolo detallado para establecer cultivos de organoides a partir de tejido DF humano adquirido después de la extracción de muelas del juicio (Figura 1A). La DF aislada se disocia enzimática y mecánicamente. Las células obtenidas se cultivan dentro de BMM en medios que se definieron empíricamente para el desarrollo y crecimiento óptimo de organoides (medio organoide dental; TOM)19.
Los organoides generalmente se desarrollan dentro de las 2 semanas posteriores a la siembra de células DF (P0; Figura 2A). Los organoides son expandibles a largo plazo (hasta 11 pasajes hasta ahora) (Figura 2B, que se muestra en P4). La siembra de alrededor de 20,000 células por gota de BMM (tanto en P0 como en pasajes posteriores) produce una densidad óptima de organoides (Figura 2C), mientras que la siembra de un mayor número de células conduce a un crecimiento organoide subóptimo (es decir, organoides más pequeños a una densidad demasiado alta) ya que no hay espacio suficiente para crecer (Figura 2D). Las condiciones de cultivo eventualmente optimizadas permiten el desarrollo de organoides a partir de muestras de DF con una eficiencia del 100%19.
Caracterización y validación de organoides dentales
Los organoides desarrollados muestran una apariencia densa y contienen células que muestran una alta relación nucleo-citoplasmática, como se observa de manera similar en las células ERM7 (Figura 3A). Además, y en una analogía adicional, los organoides expresan el marcador ERM citoqueratina 14 (CK14)22, confirmando así su origen epitelial (Figura 3B), así como otros marcadores ERM propuestos (como P63, CD44 e ITGα6 12,22,23 (Figura 3B). Además, los organoides expresan SOX2, un conocido marcador DESC en ratones y también presente en el epitelio de los dientes humanos en desarrollo (Figura 3B)1. Curiosamente, la amelogenina (AMELX), el componente principal de la matriz del esmalte, que también se encuentra expresado en los organoides, también se detecta en el ERM24 (Figura 3C). La expresión de otros marcadores de ERM/stemness se describe en nuestro estudio reciente19 y se puede utilizar para certificar aún más los organoides obtenidos. Además, los organoides conservan su fenotipo ERM/stemness durante el pasaje, entre otros mostrados por la expresión estable de marcadores ERM/células madre (Figura 3D). Finalmente, los organoides derivados de dientes muestran capacidad de diferenciación a las células ameloblastos(-like), que también se pueden aplicar para validar los cultivos organoides obtenidos, mostrando expresión de marcadores maduros de ameloblastos como la proteína asociada a ameloblastos odontogénicos (ODAM) y la amelotina (AMTN) después de la transferencia al medio de diferenciación (ver19).

Figura 1: Flujo de trabajo esquemático del desarrollo, caracterización y aplicaciones de organoides dentales. (A) Desarrollo de organoides dentales a partir de tejido de folículo dental (DF) aislado de terceros molares no erupcionados. (B) Amplificación, caracterización y potencial de aplicación de organoides dentales. d, día; P, pasaje. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
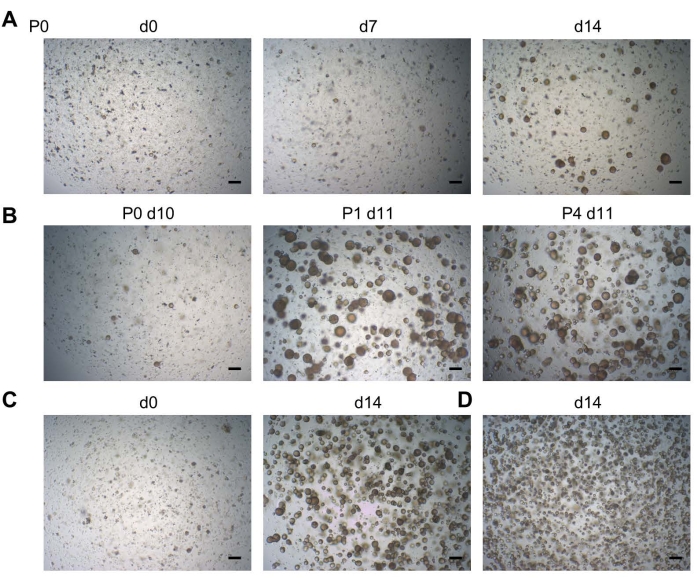
Figura 2: Desarrollo de organoides dentales. (A) Desarrollo de organoides a partir de tejido DF. Imágenes representativas de campos brillantes mostradas en diferentes días (d) después de la siembra (P0; P, pasaje; 2.5x). (B) Imágenes de Campo Brillante que muestran una pasabilidad robusta de una línea organoide dental (2.5x). (C) Imágenes de campo brillante que muestran una línea organoide dental inmediatamente al pasar (d0; izquierda; 2.5x) sembrada a una densidad de 20,000 células por pozo, y el cultivo organoide confluente resultante listo para ser pasado (d14; derecha; 2.5x). (D) Imágenes de campo brillante que muestran una línea organoide dental, que había sido sembrada a una densidad de >20,000 células, lo que lleva a organoides más pequeños a una densidad demasiado alta a d14 (2.5x). Barras de escala: 200 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Caracterización de organoides dentales. (A) Imágenes de campo brillante de cultivos organoides derivados de DF a diferentes aumentos que muestran estructuras densas desarrolladas a los 14 días en TOM (P4; 5-20x)). Tinción de hematoxilina y eosina de un organoide (P1, día 11). La caja se amplía. Las flechas indican células con una alta relación nucleo-citoplasmática. (B) Tinción inmunofluorescente para marcadores epiteliales/ERM/stemness en organoides cultivados con TOM (20x). (C) Tinción inmunofluorescente para amelogenina (AMELX) en organoides cultivados con TOM (20x). Se utilizó DAPI (azul) para etiquetar núcleos. (D) Niveles de expresión génica (en relación con GAPDH) de marcadores ERM/stemness en organoides cultivados con P1 y P5 TOM en el día 14 del cultivo (media ± SEM; n = 3 réplicas biológicas). Barras de escala: 50 μm, a menos que se indique lo contrario. Haga clic aquí para ver una versión más grande de esta figura.
| Medio de recolección de folículos dentales (DF) | |
| Nombre | Concentración |
| Águila media esencial mínima (αMEM) | |
| Suero fetal bovino (FBS) | 10% |
| Anfotericina B | 0.5% |
| Penicilina-estreptomicina (Pen/Strep) | 1% |
Tabla 1: Medio de recolección de folículos dentales (DF). La tabla enumera los componentes del medio de recolección DF.
| Medio organoide dental (TOM) | |
| Nombre | Concentración |
| Medio definido sin suero (SFDM) | Véase la composición en el cuadro 3 |
| A83-01 | 0,5 μM |
| B27 (sin vitamina A) | 2% |
| Toxina del cólera | 100 ng/ml |
| FGF2 (= FGF básico) | 20 ng/ml |
| FGF8 | 200 ng/ml |
| FGF10 | 100 ng/ml |
| L-glutamina | 2 mM |
| IGF-1 | 100 ng/ml |
| N2 | 1% |
| N-acetil L-cisteína | 1,25 mM |
| Nicotinamida | 10 mM |
| Cabeza | 100 ng/ml |
| RSPO1 | 200 ng/ml |
| SB202190 (p38i) | 10 μM |
| Chito | 100 ng/ml |
| WNT3a | 200 ng/ml |
Tabla 2: Medio organoide dental (TOM). La tabla enumera los componentes y sus respectivas concentraciones requeridas para preparar el medio organoide dental.
| Medio definido sin suero (SFDM) (pH 7.3) | |
| Nombre | Concentración |
| Estéril H2O | |
| DMEM 1:1 F12 sin Fe | 16,8 g/L |
| Transferrina | 5 mg/L |
| Insulina del páncreas bovino | 5 mg/L |
| Sal sódica de penicilina G | 35 mg/L |
| Sal de sulfato de estreptomicina | 50 mg/L |
| Etanol absoluto, ≥99,8% (EtOH) | 600 μL/L |
| Catalasa del hígado bovino | 50 μL/L |
| Carbonato de hidrógeno sódico (NaHCO3) | 1 g/L |
| Albúmina bovina (grado de cultivo celular) | 5 g/L |
Tabla 3: Medio definido sin suero (SFDM) (pH 7.3). La tabla enumera la composición del medio definido sin suero.
| Medio de disociación | |
| Nombre | Concentración |
| Solución salina tamponada con fosfato (PBS) | |
| Colagenasa IV | 3 mg/ml |
| Dispasa II | 4 mg/ml |
Tabla 4: Medio de disociación. Lista de componentes y sus concentraciones requeridas para preparar el medio de disociación.
| Medio A (pH 7.3) | |
| Nombre | Concentración |
| Estéril H2O | |
| DMEM polvo alto glucosa | 13,38 g/L |
| HEPES | 5,958 g/L |
| Piruvato de sodio (C3H3NaO3) | 110 mg/L |
| Sal sódica de penicilina G | 35 mg/L |
| Sal de sulfato de estreptomicina | 50 mg/L |
| Cloruro de sodio (NaCl) | 0,5 g/L |
| Carbonato de hidrógeno sódico (NaHCO3) | 1 g/L |
| Albúmina bovina (grado de cultivo celular) | 3 g/L |
| Dnase* | 0,2 mg/ml |
| *añadir cuando se menciona |
Tabla 5: Medio A (pH 7.3). La tabla enumera la concentración de los componentes utilizados para preparar el Medio A.
| Anticuerpos primarios | ||
| Nombre | Anfitrión | Concentración |
| AMELX | ratón | 1:100 |
| CD44 | ratón | 1:200 |
| CK14 | ratón | 1:200 |
| ITGA6 | conejo | 1:200 |
| P63 | conejo | 1:1000 |
| SOX2 | conejo | 1:2000 |
| Anticuerpos secundarios | ||
| Nombre | Anfitrión | Concentración |
| ratón IgG (Alexa 555) | burro | 1:1000 |
| conejo IgG (Alexa 488) | burro | 1:1000 |
Tabla 6: Lista de anticuerpos y sus diluciones. La tabla enumera los anticuerpos y sus respectivas diluciones utilizadas en este estudio.
| Imprimaciones | ||
| Gen | Imprimación delantera | Imprimación inversa |
| GAPDH | GGTATCGTGGAAGGACTCATGAC | ATGCCAGTGAGCTTCCCGTTCAG |
| P63 | CAACGCAGTAGACACCATTTCC | CCCAAAACCTTCTCGCTTGTT |
| ITGA6 | GGCGGTGTTATGTCCTGAGTC | AATCGCCCATCACAAAAGCTC |
| SOX2 | GCTGGGACATGTGAAGTCTG | CCCTGTGGTTACCTCTTCCT |
| PITX2 | CAGCGGACTCACTTTACCAG | ATTCTTGAACCAAACCCGGAC |
Tabla 7: Lista de cebadores. La tabla enumera los cebadores de GAPDH, P63, ITGA6, SOX2 y PITX2 utilizados en este estudio.
Discusión
Este protocolo describe la generación eficiente y reproducible de organoides a partir del diente humano. Hasta donde sabemos, esta es la primera metodología para establecer organoides de concepto actual (epitelial) a partir de tejido dental humano. Los organoides son expandibles a largo plazo y muestran un fenotipo de tallo epitelial dental, duplicando los DESC previamente reportados en el compartimiento ERM del DF7. Además, los organoides replican las características funcionales de DESC/ERM, incluyendo el despliegue de un proceso de diferenciación de ameloblastos 7,25,26. Los hallazgos son sólidos ya que se encontraron resultados comparables con líneas organoides de pacientes independientes19.
Al ejecutar este protocolo de organoides dentales, se deben tener en cuenta varios puntos críticos. En primer lugar, la adición del inhibidor de la quinasa asociada a Rho (ROCK) Y-27632 en la siembra inicial e inmediatamente después de cada pasaje es esencial para evitar que las células individuales se sometan a anoikis27. Además, se requiere anfotericina B en todos los refrescos de medios durante P0 para evitar el crecimiento fúngico (oral). En segundo lugar, se recomienda procesar inmediatamente los tejidos DF recién aislados para la formación óptima de organoides y la eficiencia del crecimiento, en lugar de comenzar a partir del tejido criopreservado, lo que resulta en una menor eficiencia. En tercer lugar, al descongelar una línea organoide criopreservada para el cultivo, realice los pasos lo más rápido posible y evite el tiempo de descongelación demasiado largo, así como los intervalos demasiado largos entre los pasos, ya que la prolongación del tiempo disminuye la supervivencia celular. En cuarto lugar, debe tenerse en cuenta que el número de organoides en el paso temprano (P0-P3) puede seguir siendo limitado, también porque solo un número limitado de células ERM (madre) pueden estar presentes en las muestras específicas aisladas de tejido DF. Por lo tanto, los cultivos de organoides en el paso temprano deben manejarse con cuidado y consideración. Por lo tanto, se recomienda (i) evitar la expansión rápida del cultivo de organoides (es decir, solo comenzar a dividirse a 1: 3 o más a partir de P3-4, y antes a 1: 0.5 o 1: 1); (ii) utilizar el método de división apropiado (paso bajo - pasaje más alto) como se describe. En este contexto, se aconseja recolectar muelas del juicio no erupcionadas de pacientes adolescentes jóvenes (15 a 19 años) ya que las células ERM disminuyen en número con el desarrollo de los dientes y la edadde 28 años. En quinto lugar, los fragmentos de tejido duro no dispersos restantes del tejido DF en la suspensión celular (incluso después del filtrado) hacen que la caída de BMM sea menos estable y más probable que se desaloje durante el cultivo. Se recomienda un mayor porcentaje de BMM (como el 80%) si se observan múltiples fragmentos de tejido duro no dispersos en la suspensión disociada de células DF. En sexto lugar, se recomienda encarecidamente pasar los organoides entre el día 10 y el día 14 de cultivo, ya que un cultivo más largo afectará negativamente la capacidad de expansión de los organoides debido a una disociación menos óptima. Si por una u otra razón, los organoides se cultivan más de 14 días, la cantidad de TryplE Express y el tiempo de incubación para la disociación organoide podrían extenderse para una disociación eficiente, aunque no se deben superar los 15 minutos de exposición enzimática. Dentro del mismo contexto, el medio de cultivo debe actualizarse cada 2-3 días para evitar el agotamiento de nutrientes y factores de crecimiento. En caso de que los organoides no se expandan adecuadamente, independientemente de los puntos críticos mencionados anteriormente, uno debe centrarse en mantener todas las herramientas (BMM, SFDM helado para la punta de pre-recubrimiento, tubos de microcentrífuga) utilizadas durante el paso en hielo. Además, es crucial aplicar correctamente los distintos métodos de paso (paso bajo y método de paso más alto) para un paso eficiente de los organoides.
Antes, otros grupos han reportado crecimiento in vitro de tejido PRIMARIO humano DESC/ERM 8,9,10,11,12,21. Sin embargo, los cultivos fueron principalmente 2D (monocapas) y no 3D, como este modelo organoide, además solo mostrando crecimiento a corto plazo y retención de fenotipos. Alternativamente, a menudo (espontáneamente) se utilizaron células inmortalizadas, que, sin embargo, no son fisiológicas y muestran solo un parecido limitado con el tejido o las células de origen. Además, estas líneas celulares se derivaron de tejido embrionario y/o de animales. Además, la diferenciación de ameloblastos no se describe o solo se documenta de manera limitada. Así, el modelo organoide aquí presentado ofrece varias ventajas, siendo (i) recapitulación fiel del tejido/células de origen, (ii) expandible a largo plazo, (iii) cultivado en 3D representando más de cerca la configuración in vivo, (iv) de origen humano y edad postnatal, y (v) capaz de diferenciarse en células dentales maduras (tipo de célula ameloblasto) (ver19).
Así, generamos una valiosa herramienta de investigación, no reportada antes, con varias aplicaciones interesantes (Figura 1B). Los organoides se pueden aplicar para estudiar el tallo y la plasticidad del DESC / ERM humano. Brinda la oportunidad de obtener más información sobre la biología de la aún enigmática población de células ERM por medio de análisis inmunofluorescentes, de expresión génica y transcriptómicos (de una sola célula). Además, los organoides son particularmente adecuados para el modelado de enfermedades humanas para descifrar mecanismos patogénicos, identificar (nuevas) dianas terapéuticas y generar herramientas de descubrimiento y detección de fármacos29. Más específicamente, este modelo se puede aplicar a quistes odontogénicos (para los cuales no se dispone de un modelo de investigación confiable), que se puede comparar con organoides derivados de dientes sanos. Además, este enfoque organoide dental puede aprovecharse para modelar y estudiar enfermedades dentales que van desde el impacto de las bacterias hasta las mutaciones genéticas asociadas con anomalías dentales (como las mutaciones en P63, que podrían introducirse utilizando métodos de edición de genes de vanguardia como CRISPR-Cas)30, lo que eventualmente conducirá a objetivos terapéuticos y tratamientos potenciales y novedosos. Otras aplicaciones del protocolo de organoides dentales pueden incluir biobancos (actualmente ya disponibles para la pulpa dental, como el Future Health Biobank)31 para recolectar líneas organoides de múltiples personas y enfermedades (por ejemplo, para investigación básica y traslacional, como la detección de drogas). Además, recientemente se han publicado varios informes sobre modelos organoides compuestos que contienen no solo epiteliales sino también otros tipos celulares del tejido de origen32,33. Como la composición dental es bastante compleja, acomodando células mesenquimales, inmunes y endoteliales, aplicar este modelo organoide epitelial en combinación con estos tipos de células para representar más detalladamente su contraparte in vivo es una perspectiva atractiva. Además, este sistema permite explorar la amelogénesis en el diente humano, en la actualidad solo poco conocida, pero ciertamente confiando en las interacciones epitelial-mesenquimal. Se espera que descifrar el desarrollo de ameloblastos represente un importante salto adelante en el mundo científico y clínico dental, ya que la producción de esmalte, el componente por excelencia de nuestros dientes, es un objetivo muy perseguido en la reparación del tejido dental. Además, el modelado de organoides detallado en este estudio puede significar el comienzo hacia la formación de tejidos mineralizados in vitro y allanar el camino hacia el desarrollo de un diente de bioingeniería (o al menos partes) para la terapia de reemplazo.
Una de las limitaciones del modelo organoide es que representa únicamente el componente epitelial del tejido. Sin embargo, como se describió en detalle anteriormente, esta deficiencia podría resolverse mediante la adición de otros tipos de células / tejidos, como el mesénquima dental19. Otro aspecto que puede reconocerse como una limitación es el origen del BMM utilizado aquí (Matrigel). Este BMM se deriva de un sarcoma (Engelbrecht-Holm-Swarm) de un ratón y, por lo tanto, debe reemplazarse antes de traducir el enfoque organoide a la clínica. Recientemente, se han realizado varios esfuerzos para reemplazar Matrigel con hidrogeles sintéticos34,35. Sin embargo, se necesita más investigación para cultivar con éxito organoides en tales geles no naturales. Aunque la tecnología de organoides proporciona un enfoque interesante para la futura terapia regenerativa dental, por ejemplo, el desarrollo de un diente de bioingeniería, se deben plantear preguntas éticas con respecto a la privacidad de los donantes de células, así como la comercialización de organoides humanos y tejidos derivados de los mismos. Hasta el momento, no se han llegado a conclusiones sobre la comercialización de organoides con fines regenerativos36. Los biobancos de pulpa dental han ido en aumento31, así como los biobancos de organoides de varios tejidos, principalmente cancerosos, con fines de detección de drogas. Dado que los organoides no se pueden clasificar como células, gametos, tejidos u órganos (que todos están regulados por la ley), existe una necesidad urgente de representar su estado jurídico para su uso en entornos clínicos, científicos o comerciales. A pesar de que los organoides han demostrado depositar tejido mineralizado cuando se trasplantan por vía subcutánea in vivo19, se requieren más estudios para analizar su potencial para depositar esmalte similar al de un diente humano natural.
En conjunto, el nuevo modelo organoide desarrollado presenta una herramienta prometedora y valiosa para estudiar la biología de los dientes humanos (células madre) y la amelogénesis, ambas en la actualidad poco exploradas, con perspectivas futuras hacia el modelado de enfermedades dentales y las terapias regenerativas.
Divulgaciones
El autor correspondiente se asegura de que todos los autores hayan revelado todos y cada uno de los conflictos de intereses.
Agradecimientos
Agradecemos a todos los miembros del personal de Cirugía Oral y Maxilofacial (MKA) de UZ Leuven, así como a los pacientes, por su inestimable ayuda en la recolección de terceros molares recién extraídos. También nos gustaría agradecer a la Dra. Reinhilde Jacobs y a la Dra. Elisabeth Tijskens por su ayuda con la recolección de muestras. Este trabajo fue apoyado por subvenciones de KU Leuven (BOF) y FWO-Flanders (G061819N). L.H. es un FWO Ph.D. Fellow (1S84718N).
Materiales
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Eppendorf | 30120.086 | |
| 15 mL Centrifuge tube | Corning | 430052 | |
| 2-Mercaptoethanol | Sigma-Aldrich | M-6250 | |
| 48-well flat bottom plates | Corning | 3548 | |
| 50 mL Centrifuge tube | Corning | 430290 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Agarose | Lonza | 50004 | |
| Albumin Bovine (cell culture grade) | Serva | 47330.03 | |
| AMELX antibody | Santa Cruz | sc-365284 | |
| Amphotericin B | Gibco | 15200018 | |
| B27 (without vitamin A) | Gibco | 12587-010 | |
| Cassette | VWR | 7202191 | |
| Catalase from bovine liver | Sigma-Aldrich | C100 | |
| CD44 antibody | Abcam | ab34485 | |
| Cell strainer, 40 µm | Falcon | 352340 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Citric acid | Sigma-Aldrich | C0759 | |
| CK14 antibody | Thermo Fisher Scientific | MA5-11599 | |
| Collagenase IV | Gibco | 17104-019 | |
| Cover glass | VWR | 6310146 | |
| Cryobox | Thermo Scientific | 5100-0001 | |
| Cryovial | Thermo Fisher Scientific | 375353 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dispase II | Sigma-Aldrich | D4693 | |
| DMEM 1:1 F12 without Fe | Invitrogen | 074-90715A | |
| DMEM powder high glucose | Gibco | 52100039 | |
| Dnase | Sigma-Aldrich | D5025-15KU | |
| Donkey serum | Sigma-Aldrich | D9663 - 10ML | |
| Embedding workstation, 220 to 240 Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol absolute, ≥99.8% (EtOH) | Fisher Chemical | E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| FGF10 | Peprotech | 100-26 | |
| FGF2 (= basic FGF) | R&D Systems | 234-FSE-025 | |
| FGF8 | Peprotech | AF-100-25 | |
| GenElute Mammaliam Total RNA Miniprep Kit | Sigma-Aldrich | RTN350-1KT | Includes 1% β-mercaptoethanol dissolved in lysis buffer |
| Glass Pasteur pipette | Niko Mechanisms | 170-40050 | |
| Glycine | VWR | 101194M | |
| HEPES | Sigma-Aldrich | H4034 | |
| IGF-1 | PeproTech | 100-11 | |
| InSolution Y-27632 (ROCK inhibitor, RI) | Sigma-Aldrich | 688001 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| ITGA6 antibody | Sigma-Aldrich | HPA012696 | |
| L-Glutamine | Gibco | 25030024 | |
| Matrigel (growth factor-reduced; phenol red-free) | Corning | 15505739 | |
| Microscope slide | Thermo Fisher Scientific | J1800AMNZ | |
| Millex-GV Syringe Filter Unit, 0.22 μm | Millipore | SLGV033R | |
| Minimum essential medium eagle (αMEM) | Sigma-Aldrich | M4526 | |
| mouse IgG (Alexa 555) secondary antibody | Thermo Fisher Scientific | A-31570 | |
| N2 | Gibco | 17502-048 | |
| N-acetyl L-cysteine | Sigma-Aldrich | A7250 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Noggin | PeproTech | 120-10C | |
| P63 antibody | Abcam | ab124762 | |
| Pap Pen | Sigma-Aldrich | Z377821-1EA | Marking pen |
| Paraformaldehyde (PFA), 16% | Merck | 8.18715 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-streptomycin (Pen/Strep) | Gibco | 15140-122 | |
| Petri dish | Corning | 353002 | |
| Phosphate buffered saline (PBS) | Gibco | 10010-015 | |
| Pipette (P20, P200, P1000) | Eppendorf or others | 2231300006 | |
| Plastic transfer pipette (3.5 mL) | Sarstedt | 86.1171.001 | |
| Rabbit IgG (Alexa 488) secondary antibody | Thermo Fisher Scientific | A21206 | |
| RSPO1 | PeproTech | 120-38 | |
| SB202190 (p38i) | Biotechne (Tocris) | 1264 | |
| Scalpel (surgical blade) | Swann-Morton | 207 | |
| SHH | R&D Systems | 464-SH-200 | |
| Silicone molds (Heating block) | VWR | 720-1918 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-pyruvate (C3H3NaO3) | Sigma-Aldrich | P-5280 | |
| SOX2 antibody | Abcam | ab92494 | |
| StepOnePlus | Thermo Fisher Scientific | Real-Time PCR System | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile 1000 μL pipette tips with filter | Greiner | 740288 | |
| Sterile 20 μL pipette tips with filter | Greiner | 774288 | |
| Sterile 200 μL pipette tips with and without filter | Greiner | 739288 | |
| Sterile H2O | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Superscript III first-strand synthesis supermix | Invitrogen | 11752-050 | Reverse transcription kit |
| Tissue processor | Thermo Scientific | 12505356 | |
| Transferrin | Serva | 36760.01 | |
| Triton X-100 | Sigma | T8787-50ML | |
| TrypLE express | Gibco | 12605-010 | |
| Vectashield mounting medium+DAPI | Labconsult NV | H-1200 | Antifade mounting medium with DAPI |
| WNT3a | Biotechne (Tocris) | 5036-WN-500 | |
| Xylenes, 99%, for biochemistry and histology | VWR | 2,89,75,325 |
Referencias
- Yu, T., Klein, O. D. Molecular and cellular mechanisms of tooth development, homeostasis and repair. Development (Cambridge). 147 (2), (2020).
- Arrow, P. Dental enamel defects, caries experience and oral health-related quality of life: a cohort study. Australian Dental Journal. 62 (2), 165-172 (2017).
- Mitsiadis, T. A., Orsini, G., Jimenez-Rojo, L. Dental Stem Cells for Tooth Regeneration. Dental Stem Cells: Regenerative Potential. Stem Cell Biology and Regenerative Potential. Stem Cell Biology and Regenerative Medicine. Zavan, B., Bressan, E. , Humana Press. Cham. (2016).
- Mitsiadis, T. A., Orsini, G. Editorial: a new era in dentistry: stem cell-based approaches for tooth and periodontal tissue regeneration. Frontiers in Physiology. 7, 357(2016).
- Miran, S., Mitsiadis, T. A., Pagella, P. Innovative dental stem cell-based research approaches: the future of dentistry. Stem Cells International. 2016, 7231038(2016).
- Shinmura, Y., Tsuchiya, S., Hata, K. I., Honda, M. J. Quiescent epithelial cell rests of malassez can differentiate into ameloblast-like cells. Journal of Cellular Physiology. 217 (3), 728-738 (2008).
- Davis, E. M. A review of the epithelial cell rests of Malassez on the bicentennial of their description. Journal of Veterinary Dentistry. 35 (4), 290-298 (2018).
- Athanassiou-Papaefthymiou, M., Papagerakis, P., Papagerakis, S. Isolation and characterization of human adult epithelial stem cells from the periodontal ligament. Journal of Dental Research. 94 (11), 1591-1600 (2015).
- Kim, G. -H., et al. Differentiation and establishment of dental epithelial-like stem cells derived from human ESCs and iPSCs. International Journal of Molecular Sciences. 21 (12), 1-16 (2020).
- Nam, H., et al. Establishment of Hertwig's epithelial root sheath/ epithelial rests of malassez cell line from human periodontium. Molecules and Cells. 37 (7), 562-567 (2014).
- Nam, H., et al. Expression profile of the stem cell markers in human hertwig's epithelial root sheath/Epithelial rests of Malassez cells. Molecules and Cells. 31 (4), 355-360 (2011).
- Tsunematsu, T., et al. Human odontogenic epithelial cells derived from epithelial rests of Malassez possess stem cell properties. Laboratory Investigation; A Journal of Technical Methods and Pathology. 96 (10), 1063-1075 (2016).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Cox, B., et al. Organoids from pituitary as a novel research model toward pituitary stem cell exploration. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development (Cambridge). 144 (10), 1775-1786 (2017).
- Schutgens, F., Clevers, H. Human organoids: tools for understanding biology and treating diseases). Annual Review of Pathology. 15, 211-234 (2020).
- Hemeryck, L., et al. Organoids from human tooth showing epithelial stemness phenotype and differentiation potential. Cellular and Molecular Life Sciences. 79 (3), 153(2022).
- Gao, X., Wu, Y., Liao, L., Tian, W. Oral organoids: progress and challenges. Journal of Dental Research. 100 (5), 454-463 (2021).
- Binder, M., et al. Novel strategies for expansion of tooth epithelial stem cells and ameloblast generation. Scientific Reports. 10 (1), 4963(2020).
- Xiong, J., Mrozik, K., Gronthos, S., Bartold, P. M. Epithelial cell rests of malassez contain unique stem cell populations capable of undergoing epithelial-mesenchymal transition. Stem Cells and Development. 21 (11), 2012-2025 (2012).
- Luan, X., Ito, Y., Diekwisch, T. G. H. Evolution and development of Hertwig's epithelial root sheath. Developmental Dynamics. 235 (5), 1167-1180 (2006).
- Fukumoto, S., et al. New insights into the functions of enamel matrices in calcified tissues. Japanese Dental Science Review. 50 (2), 47-54 (2014).
- Consolaro, A., Consolaro, M. F. M. O. ERM functions, EGF and orthodontic movement or Why doesn't orthodontic movement cause alveolodental ankylosis. Dental Press Journal of Orthodontics. 15 (2), 24-32 (2010).
- Guajardo, G., et al. Immunohistochemical localization of epidermal growth factor in cat paradental tissues during tooth movement. American Journal of Orthodontics and Dentofacial Orthopedics. 118 (2), 210-219 (2000).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gonçalves, J., Sasso-Cerri, E., Cerri, P. Cell death and quantitative reduction of rests of Malassez according to age. Journal of Periodontal Research. 43 (4), 478-481 (2008).
- Kim, J., Koo, B. -K., Knoblich, J. A. Human organoids: Model systems for human biology and medicine. Nature Reviews. Molecular Cell Biology. 21 (10), 571-584 (2020).
- Razmi, M. T., Narang, T., Handa, S. ADULT (acro-dermato-ungual-lacrimal-tooth) syndrome: a case report from India. Indian Dermatology Online Journal. 9 (3), 194(2018).
- Future Health Biobank. , Available from: https://futurehealthbiobank.com/ch-en/ (2022).
- Schreurs, R. R. C. E., Baumdick, M. E., Drewniak, A., Bunders, M. J. In vitro co-culture of human intestinal organoids and lamina propria-derived CD4+ T cells. STAR Protocols. 2 (2), 100519(2021).
- Fiorini, E., Veghini, L., Corbo, V. Modeling cell communication in cancer with organoids: Making the complex simple. Frontiers in Cell and Developmental Biology. 8, 166(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Zhang, Y., et al. Polyisocyanide hydrogels as a tunable platform for mammary gland organoid formation. Advanced Science. 7 (18), 2001797(2020).
- Mollaki, V. Ethical challenges in organoid use. BioTech. 10 (3), 12(2021).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados