Method Article
기계론적 연구 및 재생 요법을 향한 강력한 도구로 인간의 치아에서 오가노이드를 확립
요약
우리는 인간의 치아에서 시작하여 상피 오가노이드 문화를 개발하기위한 프로토콜을 제시합니다. 오가노이드는 견고하게 확장 가능하며 아멜로아세포 분화 능력을 포함하여 치아의 상피 줄기 세포를 재생산합니다. 독특한 오가노이드 모델은 치아 재생 접근법에 대한 관점으로 인간 치과 (줄기 세포) 생물학을 연구 할 수있는 유망한 도구를 제공합니다.
초록
치아는 음식 매스틱 화와 연설뿐만 아니라 심리적 안녕을 위해 삶에서 매우 중요합니다. 인간의 치아 발달과 생물학에 대한 지식은 부족합니다. 특히, 치아의 상피 줄기 세포와 그 기능에 대해서는 많이 알려져 있지 않다. 우리는 인간의 치아 조직 (즉, 추출 된 사랑니에서 분리 된 치과 모낭)에서 시작하여 새로운 오가노이드 모델을 개발하는 데 성공했습니다. 오가노이드는 견고하고 장기간 확장 가능하며 기능적 활성뿐만 아니라 마커 발현 측면에서 제안 된 인간 치아 상피 줄기 세포 구획을 재구성합니다. 특히, 오가노이드는 아멜로제닉 동안 생체내에서 발생하는 것으로서 아멜로아세포 분화 과정을 전개할 수 있다. 이 독특한 오가노이드 모델은 인간의 치아 발달뿐만 아니라 치과 병리학을 연구 할 수있는 강력한 도구를 제공 할 것이며 치아 재생 요법으로 나아갈 길을 열어 줄 수 있습니다. 이 새로운 오가노이드 모델을 기반으로 잃어버린 치아를 생물학적 치아로 대체하는 것은 합성 물질의 현재 표준 이식에 대한 매력적인 대안이 될 수 있습니다.
서문
치아는 음식 매스틱화, 연설 및 심리적 웰빙 (자기 이미지)에 필수적인 역할을합니다. 인간의 치아는 다양한 밀도와 경도의 고도로 미네랄화 된 조직으로 구성됩니다1. 치아 크라운의 주요 구성 요소 인 치과 에나멜은 인체에서 가장 높은 미네랄 화 된 조직입니다. 에나멜 형성 (amelogenesis) 동안, 치아가 발달 할 때, 치과 상피 줄기 세포 (DESCs)는 에나멜 형성 세포 (아멜로 아세포)로 분화됩니다. 일단 형성되면, 에나멜은 치아 분출 시작시 아멜로 아멜 세포의 사멸 적 손실로 인해 거의 수리되거나 갱신되지 않습니다1. 외상이나 박테리아 질환으로 인한 손상된 에나멜 조직의 복원은 현재 합성 물질을 사용하여 수행됩니다. 그러나 이들은 미세 누출, 열등한 골유착 및 앵커리지, 유한 수명 및 완전한 기능 수리 부족과 같은 중요한 단점으로 인해 어려움을 겪고 있습니다2. 따라서 아멜로아세포를 생성할 수 있는 능력과 미네랄화된 조직을 생산할 수 있는 잠재력을 갖춘 인간 DESC의 견고하고 신뢰할 수 있는 문화는 치과 재생 분야에서 중요한 진전이 될 것입니다.
인간 DESC 표현형과 생물학적 기능에 대한 지식은 3,4,5 부족하다. 흥미롭게도, 인간 치아의 DESCs는 말라세즈의 상피 세포 휴식 (ERM), 분출되지 않은 치아를 둘러싸고있는 치과 모낭 (DF) 내에 존재하는 세포 클러스터에 존재하는 것으로 제안되었으며, 치아가 분출되면 뿌리 주변의 치주 인대에 남아 있습니다1. 치과용 펄프와 공동 배양된 ERM 세포는 아멜로아세포형 세포로 분화하여 에나멜 유사 조직을 생성하는 것으로 밝혀졌다(6). 그러나, 에나멜(재)생성에서 ERM 세포의 특정 역할에 대한 심오한 연구는 신뢰할 수 있는 연구 모델7의 부족으로 인해 제한되었다. 현재의 ERM 시험관내 배양 시스템은 표준적으로 사용되는2D 조건에서 제한된 수명과 표현형의 빠른 손실로 인해 방해를 받고 있습니다 8,9,10,11,12. 따라서 인간 DESC를 충실하게 확장, 연구 및 차별화하기위한 견인 가능한 시험관 내 시스템이 강력하게 필요합니다.
지난 십 년 동안, 시험관 내에서 상피 줄기 세포를 성장시키는 강력한 기술은 그들의 생물학뿐만 아니라 질병13,14,15,16을 연구하기 위해 여러 유형의 (인간) 상피 조직에 성공적으로 적용되었습니다. 이 기술은 조직 상피 줄기 세포가 세포외 매트릭스 (ECM)에 시딩될 때 3D 세포 구조 (즉, 오가노이드)로 자체 발달 할 수있게 해줍니다 - 스캐폴드 (전형적으로, Matrigel)를 모방하고 조직의 줄기 세포 틈새 신호 전달 및 / 또는 배아 발생을 복제하는 정의 된 배지에서 배양됩니다. 오가노이드 발달에 필요한 전형적인 성장 인자는 표피 성장 인자 (EGF) 및 날개 없는 유형 MMTV 통합 부위 (WNT) 활성화제14,15,16을 포함한다. 생성 된 오가노이드는 조직의 원래 상피 줄기 세포를 모방하는 데 지속적인 충실성뿐만 아니라 표현형 및 기능적 특성을 유지하면서 높은 확장성을 특징으로하므로 클리닉에서 획득 한 것처럼 종종 제한된 일차 인간 조직 가용성을 극복합니다. 오가노이드를 확립하기 위해, 배양하기 전에 이종 조직으로부터 상피 줄기 세포의 단리(즉, 중간엽 세포와 같은 다른 세포 유형을 포함함)는 중간엽 세포가 ECM에 부착되거나 번성하지 않기 때문에 필요하지 않으며, 결국 순전히 상피 오가노이드13,16,17,18,19를 초래한다. . 이 유망하고 다재다능한 기술은 다양한 인간 상피 조직에서 다양한 오가노이드 모델을 개발하도록 이끌었습니다. 그러나 치아 발달, 재생 및 질병에 대한 심층적 인 연구에 가치있는 인간 치아 유래 오가노이드는 아직20,21 개가 확립되지 않았습니다. 우리는 최근에 청소년 환자19에서 추출한 세 번째 어금니(사랑니)로부터 DF 조직으로부터 출발하여 이러한 새로운 오가노이드 모델을 개발하는 데 성공했다.
여기에서, 우리는 성인 인간 치아로부터 (즉, 세 번째 어금니의 DF로부터) 상피 오가노이드 배양물을 개발하는 프로토콜을 설명한다 (도 1A). 생성된 오가노이드는 ERM 관련 줄기 마커를 발현하면서 장기간 확장 가능하다. 흥미롭게도, 대부분의 다른 오가노이드 모델과는 반대로, 전형적으로 필요한 EGF는 강력한 오가노이드 발달 및 성장을 위해 중복된다. 흥미롭게도, 줄기 오가노이드는 아멜로아세포 분화 특성을 보여주며, 따라서 생체내에서 발생하는 ERM/DESC 특징과 과정을 모방한다. 여기에 설명 된 새롭고 독특한 오가노이드 모델을 통해 DESC 생물학, 가소성 및 분화 능력을 탐구 할 수 있으며 치아 재생 접근법을 향한 첫 걸음을 내딛을 수있는 문을 열어줍니다.
프로토콜
여기에 설명 된 모든 방법은 윤리위원회 연구 UZ / KU 루벤 (13/0104U)의 승인을 받았습니다. 추출된 세 번째 어금니(사랑니)는 환자의 정보에 입각한 동의 후에 얻어졌다.
1. 준비
- 48-웰 배양 플레이트를 37°C에서 1.9%CO2 인큐베이터에서 15-20 h 동안 예열한다.
- 액화된 마트리겔 분취량 (성장 인자-환원; 페놀 적색-무함유; 추가로 기저막 매트릭스로 지칭됨; BMM) 단계 2.1 이전에 최소 2시간 동안 얼음(4°C) 상에서.
참고: BMM의 동결/해동 사이클을 피하십시오. BMM을 마이크로원심분리 튜브에서 1 mL의 얼음 및 분취량에 15-20 h 동안 액화시키고 -20°C에서 보관한다. - 원심분리기를 4°C로 냉각시킨다.
- 매체를 준비하고 0.22 μm 필터를 통해 용액을 여과하십시오. 다음 볼륨은 일반적으로 동시에 추출되는 네 개의 세 번째 어금니로부터의 DF의 수집을 기반으로 합니다.
- 20 mL의 DF 수집 배지를 준비한다(표 1): 10% 소 태아 혈청(FBS), 0.5% 암포테리신 B 및 1% 페니실린-스트렙토마이신을 함유하는 최소 필수 배지 이글(αMEM). DF 수집 배지 4 mL를 15 mL 튜브로 옮기고 튜브를 얼음 위에 옮깁니다.
참고: 15mL 튜브 한 개로 환자 당 샘플 수집에 충분합니다(즉, 네 번째 어금니의 경우). - 치아 오가노이드 배지 20 mL를 만든다 (TOM이라고도 함; 표 2) 무혈청 정의 배지 사용 (SFDM; 표 3). TOM을 최대 2주 동안 4°C에서 보관합니다.
- 8 mL의 해리 배지 (표 4), 즉 콜라게나제 VI (3 mg/mL) 및 디스파제 II (4 mg/mL)를 함유하는 포스페이트 완충 식염수 (PBS)를 준비한다. 해리 배지를 사용 전에 적어도 10분 동안 37°C 수조에서 예열하고, 이를 두 개의 15 mL 튜브(튜브당 4 mL)로 옮겨 4개의 DF 조직을 해리시킨다.
- 70% EtOH를 갖는 세 개의 웰, PBS를 갖는 세 개의 웰, 및 DF 수집 배지를 갖는 세 개의 웰을 함유하는 세척 플레이트(12-웰)를 준비한다.
- 샘플 당 배지 A의 15 mL를 만든다 (즉, 환자 당 두 개의 DF 당 5 mL; 표 5).
참고: 다음 단계는 멸균 조건에서 수행해야 합니다.
- 20 mL의 DF 수집 배지를 준비한다(표 1): 10% 소 태아 혈청(FBS), 0.5% 암포테리신 B 및 1% 페니실린-스트렙토마이신을 함유하는 최소 필수 배지 이글(αMEM). DF 수집 배지 4 mL를 15 mL 튜브로 옮기고 튜브를 얼음 위에 옮깁니다.
2. 치과 여포 해리
- 관련 DF를 가진 세 번째 어금니가 수집 배지 (얼음 위)에 수집되면 튜브의 내용물을 페트리 접시로 옮깁니다.
- 핀셋으로 치아를 잡고 수술용 블레이드를 사용하여 DF를 조심스럽게 분리하십시오.
참고: 이 단계를 수행하려면 연습이 필요합니다. 칼날에주의하십시오. - DFs로부터 남은 혈액을 세척하기 위해, DF 조직을 20초 동안 70% EtOH(세척 플레이트)의 첫 번째 웰에 잠깐 놓고, 이어서 20초 동안 다음 EtOH 웰로 옮기고, 더 나아가 세 번째 EtOH 웰로 옮긴다(총 70% EtOH에서 최대 1분; 더 긴 인큐베이션 시간은 감소된 세포 생존율을 초래할 것이다).
- 다음에, 세 개의 PBS 웰에서 헹굼을 계속한다(총 최대 2분).
- 나머지 세 개의 DF 수집 배지 웰에서 DF를 헹구십시오(총 최대 20분).
- 헹군 DF를 새로운 페트리 접시로 옮깁니다.
- 파라포름알데히드(PFA) 고정을 위해 DF(∼5mm2) 중 하나의 작은 조각을 절단하고(섹션 7 참조), PFA가 고정될 때까지 500 μL의 DF 수집 배지를 함유하는 마이크로원심분리 튜브에 얼음 상에(최대 6시간 동안) 보관한다.
- 나머지 DF를 작은 조각(~1mm 2)으로 축소합니다.
참고: 냉동 보존 조직에서 시작하는 대신 최적의 오가노이드 형성 및 성장 효율을 위해 새로 분리된 DF 조직을 즉시 처리하는 것이 좋으며, 이로 인해 효율성이 낮아집니다. 그럼에도 불구하고, 이 단계에서 일차 DF 조직을 동결보존할 수 있다(섹션 5의 동결보존 배지 및 프로토콜 참조). - 다진 DFs를 4 mL의 예열 해리 배지가 들어있는 15 mL 튜브로 옮기고 37°C 수조에서 2시간 동안 인큐베이션한다.
참고: 최적의 해리를 보장하기 위해 4mL 예열 해리 매질(튜브 하나)당 두 개의 DF를 추가합니다. - 매 15분마다, DF-해리 매질을 유리 파스퇴르 피펫을 사용하여 위아래로 혼합하여 조직 붕해의 속도를 높인다. DF 조각이 더 이상 관찰되지 않으면 (보통 1 시간 후), 좁아진 화재 연마 파스퇴르 피펫을 사용하여 DF 해리를 진행하십시오.
참고: 최적의 DF 해리를 위해 DF 분리 시 1시간 이내에 화재 연마로 좁혀진 파스퇴르 피펫으로 전환하십시오.- 그 동안 50 μL의 DNase를 함유하는 배지 A 10 mL를 준비하십시오 (0.2 mg / mL; 표 5).
- 5 mL의 배지 A (DNase 함유)를 해리된 DF가 있는 각 튜브에 첨가하고, 실온 (RT)에서 1분 동안 인큐베이션한다.
- 세포 현탁액 (단일 세포 및 작은 세포 덩어리 포함)을 40 μm 세포 스트레이너를 통해 필터링하여 나머지 큰 단편 및 (대부분의) 섬유질 조직을 제거한다.
- 이 단계에서 한 환자로부터 해리된 DF와 여러 튜브를 결합하십시오.
- 필터를 배지 A. 1 mL로 헹구고 여과된 세포 현탁액을 4°C에서 10분 동안 200 x g 에서 원심분리한다.
- 상청액을 제거하고, 펠렛을 1 mL의 SFDM에 재현탁시키고(표 3), 세포 현탁액을 1.5 mL 마이크로원심분리 튜브로 옮긴다.
- 자동화된 셀 카운터를 사용하여 세포 농도를 계산합니다. 남아있는 세포 덩어리를 무시하십시오.
- 4°C에서 5분 동안 200 x g 에서 원심분리한다.
3. 치아 오가노이드 배양의 확립 (그림 1A 및 그림 2A)
- 획득된 세포 수에 기초하여, 시딩될 수 있는 웰의 수를 계산한다. 하나의 20 μL 액적에는 20,000 개의 세포가 포함되어야합니다. 최종 혼합은 30:70의 비율로 세포 현탁액 및 BMM으로 구성된다.
- 적절한 양의 상청액을 제거하고 빙냉 BMM에 재현탁시켜 도금을 위한 BMM:세포 현탁액의 70:30 비를 얻었다. 예를 들어, 200,000개의 세포가 수득될 때, 20 μL의 10개의 액적을 플레이트화한다. 따라서, 60 μL의 세포 현탁액이 남을 때까지 상청액을 제거하고, 140 μL의 빙냉 BMM을 첨가하고, 재현탁시켰다.
- 기포 형성을 피하기 위해 천천히 재현탁하십시오. 일단 BMM에 재현탁되면, 마이크로원심분리 튜브를 얼음 위에 보관하십시오.
참고: 마이크로 원심분리 튜브를 얼음 위에 보관하는 것은 BMM 응고를 피하는 데 매우 중요합니다.
- 기포 형성을 피하기 위해 천천히 재현탁하십시오. 일단 BMM에 재현탁되면, 마이크로원심분리 튜브를 얼음 위에 보관하십시오.
- 20 μL BMM 액적을 예열된 48-웰 배양 플레이트의 웰 중앙에 피펫팅한다.
- 플레이트를 거꾸로 뒤집고, 이를 1.9% CO2 인큐베이터(SFDM 버퍼에 따른 %CO2)에 넣고, 37°C에서 적어도 20분 동안 응고시키게 한다.
- ROCK 억제제 (RI; 10 μM) 및 암포테리신 B (0.1%)를 TOM에 첨가하고, 배지를 37°C 수조에서 예열한다.
참고: 암포테리신 B는 빛에 민감합니다. - 인큐베이터에서 48웰 플레이트를 취하여 똑바로 놓고 준비된 미리 준비된 배지 250μL를 BMM 액적/세포로 각 웰에 첨가하고 플레이트를 1.9%CO2 인큐베이터로 되돌립니다.
- 배지를 새로 고치려면(바람직하게는 2-3일마다), 48웰 플레이트를 45° 각도로 기울이고, BMM 액적을 만지지 않도록 이전 배지를 부드럽게 제거하고, 250μL의 새로운 예열 TOM 배지를 첨가합니다.
참고 : 주요 영양소와 성장 인자가 고갈되지 않도록 일주일에 적어도 세 번 새로 고치는 것이 좋습니다. RI는 초기 시딩과 각 패시징의 첫날(섹션 4 참조)에만 TOM에 추가하면 아노이키스에 의한 세포 사멸을 방지하고 오가노이드 증식을 강화할 수 있습니다. 암포테리신 B는 가능한 진균 오염을 차단하기 위해 통로 0(P0) 동안 배지에만 첨가된다.
4. 치아 오가노이드 배양의 증폭 및 계대 배양(도 1B 및 도 2B)
- 문화의 10 일에서 14 일 사이에 오가노이드를 통과하십시오.
참고: 장기간 배양하면 오가노이드 재성장과 통과성이 제한될 수 있으므로 장기간 배양하지 마십시오. 초기 발달 (P0)시에만 오가노이드는 그들의 성장 속도에 따라 최대 20 일 동안 배양 될 수있다 (직경이 최대 ±200 μm에 도달 할 때까지). - 통과해야 할 오가노이드로 우물에서 배지를 제거하십시오. 하나의 배양 조건 내에서 최대 네 개의 합류 웰을 풀링합니다( 그림 2C 참조).
- 오가노이드를 수집하려면 웰당 400μL의 얼음처럼 차가운 SFDM을 BMM 액적에 직접 첨가하고 전체 BMM 액적이 빠질 때까지 배지를 위아래로 반복적으로 피펫팅합니다.
- 웰이 풀링되는 경우, 400 μL를 첫 번째 웰에서 다음 웰로 (등) 이송하여 풀링해야 하는 모든 웰의 오가노이드 함유 BMM 액적을 제거한다.
- 탈락된 BMM-오가노이드 어셈블리를 1.5 mL 마이크로원심분리 튜브로 옮기고 모든 오가노이드 구조가 웰로부터 수집될 때까지 다시 단계 4.3을 반복한다.
- 4°C에서 5분 동안 200 x g 에서 원심분리한다.
- TrypLE Express (5 μM에서 RI로 보충됨)의 분취량을 37°C 수조에서 미리 예열합니다. 오가노이드의 미세원심분리 튜브 당, 400 μL 트립LE 익스프레스의 부피가 필요하다.
- 원심분리 후, 상청액을 제거하고 펠렛을 400 μL의 TrypLE에 재현탁시켰다. 현탁액을 37°C 수조에서 12분 동안 인큐베이션한다.
- 400 μL의 빙냉 SFDM을 첨가하여 효소를 불활성화시키고 4°C에서 5분 동안 200 x g 에서 원심분리한다. 상층액을 제거하십시오.
- 얼음처럼 차가운 SFDM으로 팁(부피 참조)을 미리 코팅하고 오가노이드 펠릿을 재현탁합니다.
- 오가노이드 손실을 피하려면 멸균성을 위태롭게하지 않고 가능한 한 동일한 (사전 코팅된) 팁을 다시 사용하십시오.
참고: 펠릿을 재현탁하는 데 필요한 SFDM의 부피는 얻어진 오가노이드 구조의 수와 현재 통과 번호에 따라 달라집니다. - 엄지 손가락의 규칙으로서, 통로를 위해, P0 내지 P2-3 (일반적으로 여전히 낮은 수의 오가노이드를 성장시킴)은 200 μL SFDM의 부피를 사용한다. 계대로부터, P3-4 이상(일반적으로 더 많은 수의 오가노이드를 산출함)은 700 μL의 SFDM의 부피를 사용한다.
참고: 두 절차 모두 각각 '낮은 통과' 및 '상위 통과' 방법이라고 합니다(4.10 및 4.11 단계 참조). 뚜렷한 방법을 올바르게 적용하는 것은 오가노이드의 효율적인 통과를 위해 중요합니다. 더 높은 통과 방법을 사용하면 오가노이드가 더 쉽게 손실되며 낮은 수의 오가노이드 (즉, P0에서 P2-3까지)에 적용해서는 안됩니다. 그러나 더 많은 양의 오가노이드를 효율적으로 해리시키기 위해서는 더 높은 통과 방법이 필요합니다.
- 오가노이드 손실을 피하려면 멸균성을 위태롭게하지 않고 가능한 한 동일한 (사전 코팅된) 팁을 다시 사용하십시오.
- 낮은 통과 방법: 펠렛을 200μL의 빙냉 SFDM에 재현탁시킨다. 완전히 비워진 피펫 팁을 마이크로 원심분리 튜브의 바닥에 밀어 직경을 줄입니다. 직경이 충분히 작은지 확인하십시오 (느린 흡인, 흐름이 왜곡되었지만 차단되지 않음). 오가노이드를 기계적으로 파괴하기 위해 5 분 동안 위아래로 피펫하십시오.
- 더 높은 통과 방법: 펠렛을 P1000 팁으로 700μL의 빙냉 SFDM에 재현탁합니다. 이 P1000 팁 위에 P200 팁(필터 없음)을 추가하고 얼음처럼 차가운 SFDM이 있는 프리코트를 추가합니다. 중간 부피의 90 % 이상을 열망하기 위해 피펫의 부피 설정을 조정하여 기포 형성을 방지하십시오 (오가노이드 포함). 오가노이드를 기계적으로 파괴하기 위해 5 분 동안 위아래로 피펫하십시오.
- 주로 몇 개의 분산되지 않은 구조가 얻어지는 경우 (만) 단일 세포가 얻어지는지 (4x 배율에서) 광학 현미경 하에서 확인하십시오.
- 500 μL의 빙냉 SFDM을 마이크로원심분리 튜브에 첨가하고, 해리된 세포 혼합물을 피펫팅에 의해 신선한 SFDM과 부드럽게 혼합한다.
- 큰 분산되지 않은 구조물을 얼음 위에 수직으로 미세 원심분리 튜브를 배치하여 10 분 동안 퇴적하게하십시오.
참고 : 분산되지 않은 구조는 오가노이드 통과 가능성에 부정적인 영향을 미치기 때문에 제거해야합니다. 오가노이드 개시(P0)를 위해, 이러한 침강 단계는 필요하지 않다. - 단일 세포 및 소세포 클러스터를 포함하는 상등액(통행법에 따라 ∼500-1,000 μL)을 수집하는 단계; 새로운 마이크로원심분리 튜브 내로 옮기고, 4°C에서 10분 동안 190 x g 에서 원심분리한다.
- 자동화된 셀 카운터를 사용하여 세포 농도를 계산합니다. 남아있는 세포 덩어리를 무시하십시오.
- 시딩할 수 있는 웰의 수를 계산하고 위에서 설명한 대로 적절한 세포 현탁액/BMM 비율을 계산합니다(섹션 3).
- BMM의 70%를 세포 펠릿에 첨가하고 미세원심분리 튜브를 얼음 위에 유지한다.
참고 : BMM 응고를 피하기 위해 마이크로 원심 분리기 튜브를 얼음 위에 보관하는 것이 중요합니다. - 단계 3.3을 3.7까지 진행하고 배양의 10일째와 14일째 사이에 다시 통과시킨다.
5. 치아 오가노이드의 동결 보존
- 패시징을 위해 위에서 언급한 바와 같이 오가노이드를 수집하고 해리시킨다(단계 4). 세포 현탁액을 4°C에서 5분 동안 200 x g 에서 원심분리한다.
- 상청액을 버리고 펠렛을 SFDM (70%), FBS (20%), 및 DMSO (10%)를 함유하는 냉동 보존 배지 1 mL에 재현탁시킨다.
- 서스펜션을 냉동 상태로 옮기고 얼음 위에 올려 놓으십시오. 냉동 장치를 냉동 상자에 넣고 -80°C로 옮깁니다(최소 4시간 동안).
- 1개월 이내에 냉동 샘플을 액체 질소로 옮겨 장기간(>12개월) 보관합니다.
6. 냉동 보존 치아 오가노이드의 해동
- 해동 절차를 시작하기 전에 20% FBS가 있는 SFDM 10mL가 들어있는 얼음 위에 냉동 튜브 당 15mL 튜브 1개를 놓습니다.
- 액체 질소에서 냉동 장치를 제거하고 얼음 위에 올려 놓으십시오.
참고: 가능한 한 빨리 다음 단계를 수행하고 너무 긴 해동 시간(>5분)과 단계 사이의 간격이 너무 길어짐(>5분)을 피하십시오. - 냉동 장치를 해동(∼1-2분)될 때까지 따뜻한 수조(37°C)에 놓는다.
- 즉시 동결의 함량을 빙냉 15 mL 튜브로 옮기고 4°C에서 5분 동안 200 x g 에서 원심분리한다.
- 9 mL의 상층액을 제거하고 나머지 1 mL를 4°C에서 5분 동안 200 x g 에서 원심분리하였다. 상청액을 제거하고 펠렛을 빙냉 SFDM 1 mL로 세척하였다.
- 세포 현탁액을 1.5 mL 마이크로원심분리 튜브로 옮기고 자동화된 셀 카운터를 사용하여 세포를 계수한다.
- 시딩할 수 있는 웰의 수를 계산하고 위에서 설명한 대로 적절한 세포 현탁액/BMM 비율을 계산합니다(섹션 3).
- 4°C에서 5분 동안 200 x g 에서 원심분리한다. 펠렛을 BMM:TOM의 70:30 비율로 재현탁하고 얼음 위에 보관하십시오.
- 단계 3.3부터 3.7까지 진행하고 배양의 10일째와 14일째 사이에 경과한다.
7. 치아 오가노이드의 고정 및 파라핀 임베딩
참고: 이 절차(섹션 8 및 9 포함)는 일차 DF 조직에도 적용할 수 있습니다.
- PFA에서 치아 오가노이드의 고정
- 단계 4.2에서와 같이 각 웰에서 배지를 제거한다.
- BMM 액적을 분산시켜 오가노이드를 수집한다(단계 4.3). BMM-오가노이드 혼합물을 1.5 mL 마이크로원심분리 튜브로 옮긴다.
- 4°C에서 5분 동안 200 x g 에서 원심분리한다.
- 상청액을 제거하고, 500 μL의 4% PFA를 첨가하고, 오비탈 진탕기 상에서 온화한 혼합으로 RT에서 최소 30분(최대 1시간) 동안 인큐베이션한다.
주의: PFA로 작업할 때는 화학 후드를 사용하십시오. - 4°C에서 5분 동안 200 x g 에서 원심분리한다. 상청액을 제거하고, 오르가노이드 펠릿을 PBS로 헹구고 RT에서 10분 동안 부드럽게 진탕시켰다.
- 오가노이드 펠릿을 추가로 두 번 세척한다(단계 7.1.5). 고정된 오가노이드를 4°C에서 5분 동안 200 x g 에서 아래로 회전시킨다.
- 펠렛을 70% EtOH 중 500 μL(탈이온수 중)에 재현탁시킨다. 오가노이드를 4°C에서 70% EtOH에 최대 1개월 동안 보관한다.
- 치아 오가노이드의 아가로스 및 파라핀 임베딩
참고 : 파라핀에 오가노이드를 효율적으로 내장하려면 아가로스에 임베딩하는 추가 단계가 필요합니다.- PFA 고정된 오가노이드를 4°C에서 5분 동안 200 x g 에서 70% EtOH로 원심분리한다. 상층액을 제거하십시오.
- 유리 병에 PBS 30 mL 중의 2% 아가로스 용액을 제조하였다. 겔상 구조가 관찰될 때까지 마이크로파에서 아가로스-PBS 혼합물을 예열한다(600 W에서 약 2.5분).
- 병행하여 PBS 30mL를 다른 유리 병에 넣고 전자레인지에서 예열합니다(600W에서 약 2.5분). 아가로스 용액을 1 분 동안 식히십시오.
- P200 팁의 끝을 잘라 아가로스 용액으로 정확하게 작업하고 기포를 피하십시오.
- P200 팁을 따뜻한 PBS에서 몇 번 위아래로 피펫팅하여 미리 따뜻하게 합니다.
- 150 μL의 예열 된 아가로스 용액을 오가노이드 펠릿에 첨가하고 기포를 피하면서 오가노이드 - 아가로스 혼합물 (최소 재현탁 사용)을 부드럽게 피펫 업하십시오.
참고 : 최소한의 재현탁은 오가노이드가 서로 더 가깝기 때문에 마이크로 톰 절편에서 아가로스 겔의 오가노이드를 더 잘 찾을 수있게합니다. - 즉시 오가노이드-아가로스 혼합물을 동일한 마이크로 원심분리 튜브 캡으로 옮기고, 튜브를 수평으로 넣고, 아가로스를 응고시키십시오 (RT에서 ~ 20 분). 그 동안 카세트에 라벨을 붙이십시오.
- 일단 고형화되면, 핀셋을 사용하여 마이크로원심분리 캡으로부터 아가로스 겔을 제거하고 표지된 카세트로 옮긴다.
- 아가로스 함유 카세트를 탈이온수에 50% EtOH를 함유하는 비이커로 옮긴다. EtOH의 증발을 피하기 위해 비커를 파라필름으로 덮으십시오.
참고: 비커의 부피는 카세트 수에 따라 다릅니다. - 샘플을 조직 프로세서에서 밤새 처리하십시오.
참고: 파라핀이 RT에서 고형화되기 때문에 다음 단계를 빠르게 수행해야 합니다. - 임베딩 워크스테이션에서 가열 블록을 15분 동안 예열합니다.
- 카세트에 둘러싸인 오가노이드 함유 아가로스 겔을 제거하고 예열 가열 블록에 놓습니다. 카세트에서 뚜껑을 꺼내어 나중에 사용할 수 있도록 따로 두십시오.
- 나머지 가열 블록을 파라핀으로 채 웁니다.
참고 : 오가노이드 함유 아가로스 겔이 여전히 가열 블록의 바닥에 있는지 핀셋으로 확인하십시오. 가볍기 때문에 부유하기 시작하여 샘플 손실이 발생할 수 있습니다. - 카세트 캡을 가열 블록 위에 놓습니다. 차가운 접시에 30 분 동안 굳어지게하십시오. 가열 블록을 제거하고 파라핀 블록을 4°C에서 저장한다.
8. 치아 오가노이드의 마이크로톰 절편화 및 염색 (도 2B 및 도 3A-C)
- 오가노이드 함유 파라핀 블록의 마이크로톰 절편화
- 마이크로톰을 사용하여 파라핀 블록에서 치아 오가노이드의 5 μm 절편을 슬라이스한다.
- 파라핀 조각을 현미경 유리 슬라이드 위에 놓습니다. 현미경 유리 슬라이드를 37°C의 따뜻한 플레이트 위에 놓고 파스퇴르 피펫을 사용하여 탈이온수로 덮는다.
- 현미경 유리가 하룻밤 동안 미끄러지게하십시오.
- 치아 오가노이드 절편의 염색
- 오가노이드 절편(현미경 유리 슬라이드 상에서)을 58°C에서 1시간 동안 오븐에서 분리한다.
- 화학 후드 내부의 EtOH 시리즈를 줄이기 위해 오가노이드 섹션 (현미경 유리 슬라이드)을 다음 순서로 재수화하십시오.
각각 3분 동안 자일렌 2x
각각 3분 동안 100% EtOH 2x
각각 3분 동안 95% EtOH 2x
각각 3분 동안 90% EtOH 2x
각각 3분 동안 70% EtOH 3x
주의: Xylene으로 작업할 때는 화학 후드를 사용하십시오. - 현미경 유리 슬라이드를 RT에서 5 분 동안 수돗물에 헹구십시오. 이어서, RT에서 5분 동안 PBS로 헹구었다.
- 오가노이드 절편(현미경 유리 슬라이드 상)을 미리 가온된 시트레이트 완충액(pH 6의 탈이온수 중 시트르산 10 mM; 플라스틱 용기 내, 95°C 수조에서 10분 동안 예열)에 95°C 수조에서 30분 동안 배치하여 항원 검색을 수행한다.
- 현미경 유리 슬라이드를 RT에서 20분 동안 식히십시오. 현미경 유리 슬라이드를 RT에서 5분 동안 PBS로 헹구고, RT에서 5분 동안 0.1% 트리톤-X(PBT)를 함유하는 PBS에서 헹구십시오.
- 마킹 펜을 사용하여 각 슬라이드의 경계에 소수성 장벽을 만듭니다.
- RT에서 블로킹 버퍼(PBT에 용해된 1.5mg/mL 글리신, 2mg/mL 알부민 소 혈청(BSA) 포함)와 10% 당나귀 혈청에서 최소 1시간 동안 차단합니다.
참고: 일반적으로 현미경 유리 슬라이드당 300μL의 블로킹 버퍼와 10% 당나귀 혈청이 필요합니다. - 현미경 유리 슬라이드를 습한 챔버에 놓습니다. 모든 슬라이드가 맞는 밀폐 상자를 사용하고 몇 개의 종이 티슈를 물로 적셔 상자 하단에 놓습니다. 이것은 후속 염색 단계 동안 슬라이드가 건조되는 것을 방지할 것이다.
- 블로킹 버퍼를 제거하고, 블로킹 버퍼 플러스 1% 당나귀 혈청에서 제조된 1차 항체(표 6)를 첨가하고, 항체 용액으로 덮인 슬라이드를 4°C의 습한 챔버에서 하룻밤 동안 인큐베이션한다. 필요한 경우 표시된 펜 테두리를 다시 실행합니다.
- 현미경 유리 슬라이드를 RT에서 PBT로 세 번 10분 동안 오비탈 쉐이커(75-150 rpm) 상에서 부드럽게 혼합하여 세척한다.
- 이차 항체 (표 6)를 첨가하고, 블로킹 완충액 플러스 1% 당나귀 혈청에서 제조하고, RT에서 습한 챔버 내에서 1 h 동안 인큐베이션한다.
- 블로킹 버퍼를 제거하고 현미경 유리 슬라이드를 RT에서 PBT로 세 번 세척하고 오비탈 쉐이커 상에서 부드럽게 혼합하면서 10분 동안 세척하였다.
- DAPI(1~3개의 물방울)가 있는 페이드 방지 장착 매체를 유리 커버슬립에 추가하고 이를 오가노이드 섹션 상단(현미경 유리 슬라이드)에 장착합니다. 이미징을 진행하십시오. 슬라이드를 4°C에서 최대 1주일 동안 보관합니다.
9. 치아 오가노이드의 RNA 추출 및 RT-qPCR (도 2B 및 도 3D)
- 치아 오가노이드의 RNA 추출
- 각 웰에서 배지를 분리한다(단계 4.2).
- BMM 액적을 분산시켜 오가노이드를 수집하고(단계 4.3), BMM-오가노이드 혼합물을 1.5 mL 마이크로원심분리 튜브로 옮기고, 4°C에서 5분 동안 200 x g 에서 원심분리한다.
- 상층액을 제거하고, 용해 완충액(표 재료)에 용해된 350 μL의 1% β-메르캅토에탄올에 격렬하게 재현탁시키고, 얼음 위에 놓는다.
주의: 화학 후드에 β-메르캅토에탄올로 모든 단계를 수행하십시오.
참고: 샘플은 이 단계에서 -80°C에서 최대 1개월 동안 보관할 수 있습니다. 단계 9.1.4로 진행하기 전에 얼음 위에서 샘플을 해동시킨다. - 더 이상 오가노이드 구조가 관찰되지 않을 때까지 샘플을 소용돌이치십시오.
- 제조업체의 지침에 따라 RNA 추출 키트 (물질 표)를 사용하여 RNA 추출을 진행하십시오.
- 치아 오가노이드의 RT-qPCR (표 7)
- 역전사(RT)를 제조자의 지시에 따라 역전사 키트(Table of Materials)를 사용하여 RNA19를 전사한다.
- 생성된 cDNA 샘플을 실시간 PCR 시스템을 사용하여 SYBR 그린 기반 정량적 PCR(qPCR)19 로 분석한다(표 오브 머티리얼).
결과
치아 오가노이드 발달
우리는 사랑니 추출 후 획득 한 인간 DF 조직에서 오가노이드 배양을 확립하기위한 상세한 프로토콜을 제공합니다 (그림 1A). 단리된 DF는 효소적으로 및 기계적으로 해리된다. 수득된 세포는 최적의 오가노이드 발달 및 성장을 위해 경험적으로 정의되었던 배지에서 BMM 내에서 배양된다 (치아 오가노이드 배지; 톰)19.
오가노이드는 전형적으로 DF 세포 시딩 후 2주 이내에 발달한다(P0; 도 2A). 오가노이드는 장기간 확장 가능(지금까지 최대 11개 통로)입니다(그림 2B, P4 참조). BMM 액적 당 약 20,000 개의 세포를 시딩하는 것은 (P0 및 추가 계대 모두에서) 오가노이드의 최적 밀도를 산출하는 반면(그림 2C), 더 높은 세포 수를 시딩하면 성장할 공간이 부족하기 때문에 차선책의 오가노이드 성장(즉, 너무 높은 밀도에서 더 작은 오가노이드)이 생깁니다(그림 2D). 최종적으로 최적화된 배양 조건은 100% 효율로 DF 샘플로부터의 오가노이드의 개발을 허용한다19.
치아 오가노이드 특성화 및 검증
개발된 오가노이드는 조밀한 외관을 보여주고, ERM 세포7에서 유사하게 관찰된 바와 같이 높은 핵-세포질 비율을 나타내는 세포를 함유한다(도 3A). 더욱이, 추가의 유사하게, 오가노이드는 ERM 마커 사이토케라틴 14 (CK14)22를 발현하며, 이로써 이들의 상피 기원을 확인하고(도 3B), 뿐만 아니라 다른 제안된 ERM 마커 (예를 들어 P63, CD44 및 ITGα612,22,23 (도 3B)를 확인시킨다. 더욱이, 오가노이드는 마우스에서 잘 알려진 DESC 마커인 SOX2를 발현하고 또한 발달하는 인간 치아의 상피에도 존재한다(도 3B)1. 흥미롭게도, 에나멜 매트릭스의 주성분인 아멜로게닌(AMELX)도 오가노이드에서 발현되는 것으로 밝혀졌으며, ERM24에서도 검출된다(도 3C). 또 다른 ERM/줄기 마커의 발현은 우리의 최근 연구19에 기술되어 있으며, 획득된 오가노이드를 추가로 인증하는데 사용될 수 있다. 또한, 오가노이드는 통과 중에 ERM/줄기 표현형을 유지하며, 그 중에서도 ERM/줄기 세포 마커의 안정적인 발현으로 나타납니다(그림 3D). 마지막으로, 치아 유래 오가노이드는 아멜로아세포(-like) 세포에 대한 분화 능력을 보여주며, 이는 또한 수득된 오가노이드 배양물을 검증하기 위해 적용될 수 있으며, 분화 배지로 전달된 후 odontogenic-ameloblast associated protein(ODAM) 및 amelotin(AMTN)과 같은 성숙한 아멜로아세포 마커의 발현을 나타낸다(19 참조).

그림 1: 치아 오가노이드 발달, 특성화 및 응용의 개략적인 워크플로우. (A) 분출되지 않은 세 번째 어금니로부터 분리된 치과 모낭(DF) 조직으로부터의 치아 오가노이드 발달. (B) 치아 오가노이드의 증폭, 특성화 및 적용 가능성. d, 일; P, 통로. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
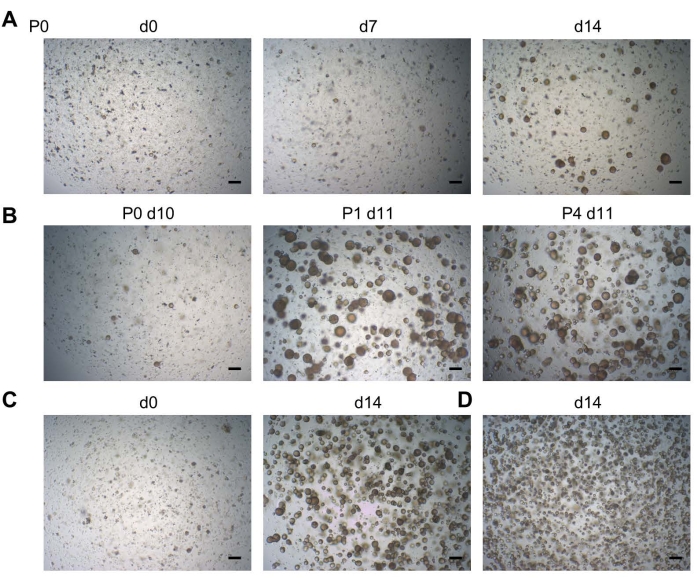
그림 2: 치아 오가노이드 발달. (A) DF 조직으로부터의 오가노이드 발달. 시딩 후 다른 날(d)에 나타낸 대표적인 브라이트필드 이미지(P0; P, 통로; 2.5x). (B) 치아 오가노이드 라인(2.5x)의 견고한 통과성을 보여주는 브라이트필드 이미지. (c) 웰 당 20,000 세포의 밀도로 시딩된 계대에서 즉시 치아 오가노이드 라인을 보여주는 브라이트필드 이미지(d0; 왼쪽; 2.5x)와, 생성된 컨플루언트 오가노이드 배양물을 계대 준비가 완료(d14; 오른쪽; 2.5x). (D) >20,000 세포의 밀도로 시딩되어 d14 (2.5x)에서 너무 높은 밀도로 더 작은 오가노이드로 이어지는 치아 오가노이드 라인을 보여주는 브라이트 필드 이미지. 스케일 바: 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 치아 오가노이드 특성화. (A) TOM(P4; 5-20x)에서 14일에 발달된 치밀한 구조를 보여주는 상이한 배율에서의 DF 유래 오가노이드 배양물의 브라이트필드 이미지). 헤마톡실린 및 오가노이드의 에오신 염색(P1, 11일째). 상자가 확대됩니다. 화살표는 높은 핵-세포질 비율을 갖는 세포를 나타낸다. (B) TOM에서 상피/ERM/줄기 마커에 대한 면역형광 염색(20x). (c) TOM에서 아멜로게닌(AMELX)에 대한 면역형광 염색(20x). DAPI (파란색)를 핵을 표지하기 위해 사용하였다. (d) 배양 14일째에 P1 및 P5 TOM에서 성장한 오가노이드의 ERM/줄기 마커의 유전자 발현 수준(GAPDH에 비해)(평균 ± SEM; n=3 생물학적 반복실험). 스케일 바: 달리 명시되지 않는 한 50 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 치과 여포 (DF) 수집 매체 | |
| 이름 | 농도 |
| 최소 필수 미디엄 이글(αMEM) | |
| 태아 소 혈청 (FBS) | 10% |
| 암포테리신 B | 0.5% |
| 페니실린-스트렙토마이신 (펜/스트렙) | 1% |
표 1: 치과용 모낭(DF) 수집 배지. 이 표에는 DF 수집 매체의 구성 요소가 나열되어 있습니다.
| 치아 오가노이드 배지 (TOM) | |
| 이름 | 농도 |
| 무혈청 정의 배지 (SFDM) | 조성에 대해서는 표 3을 참조하십시오. |
| A83-01 | 0.5 μM |
| B27 (비타민 A 제외) | 2% |
| 콜레라 독소 | 100 ng/mL |
| FGF2 (= 기본 FGF) | 20 ng/mL |
| FGF8 | 200 ng/mL |
| FGF10 | 100 ng/mL |
| L- 글루타민 | 2 밀리지미터 |
| IGF-1 | 100 ng/mL |
| N2 | 1% |
| N-아세틸 L-시스테인 | 1.25 밀리지미터 |
| 니코틴아미드 | 10 밀리지미터 |
| 머리 | 100 ng/mL |
| RSPO1 | 200 ng/mL |
| SB202190 (p38i) | 10 μM |
| 쉿 | 100 ng/mL |
| WNT3a | 200 ng/mL |
표 2: 치아 오가노이드 배지(TOM). 표에는 치아 오가노이드 배지를 준비하는 데 필요한 구성 요소와 각각의 농도가 나열되어 있습니다.
| 무혈청 정의 배지 (SFDM) (pH 7.3) | |
| 이름 | 농도 |
| 멸균H2O | |
| DMEM 1:1 F12(Fe 제외) | 16.8 g / L |
| 트랜스페린 | 5 밀리그램/L |
| 소 췌장의 인슐린 | 5 밀리그램/L |
| 페니실린 G 나트륨 염 | 35 밀리그램/L |
| 스트렙토마이신 설페이트 염 | 50 밀리그램/L |
| 에탄올 절대, ≥99.8% (EtOH) | 600 μL/L |
| 소 간에서 카탈라아제 | 50 μL/L |
| 탄산수소나트륨 (NaHCO3) | 1 g / L |
| 알부민 소 (세포 배양 등급) | 5 g / L |
표 3: 무혈청 정의 배지 (SFDM) (pH 7.3). 상기 표는 무혈청 정의된 배지의 조성을 열거한다.
| 해리 매체 | |
| 이름 | 농도 |
| 인산염 완충 식염수 (PBS) | |
| 콜라게나제 IV | 3 밀리그램/mL |
| 디스파아제 II | 4 밀리그램/mL |
표 4: 해리 매질. 해리 매질을 준비하기 위한 구성성분 및 이들의 필수 농도의 목록.
| 배지 A (pH 7.3) | |
| 이름 | 농도 |
| 멸균H2O | |
| DMEM 분말 높은 포도당 | 13.38 g / L |
| 헤페스 | 5.958 g / L |
| 나트륨 피루베이트 (C3H3NaO3) | 110 밀리그램/L |
| 페니실린 G 나트륨 염 | 35 밀리그램/L |
| 스트렙토마이신 설페이트 염 | 50 밀리그램/L |
| 염화나트륨 (NaCl) | 0.5 g / L |
| 탄산수소나트륨 (NaHCO3) | 1 g / L |
| 알부민 소 (세포 배양 등급) | 3 g / L |
| 드나제* | 0.2 밀리그램/mL |
| * 언급 할 때 추가 |
표 5: 배지 A (pH 7.3). 표에는 배지 A를 준비하는 데 사용되는 구성 요소의 농도가 나열되어 있습니다.
| 일차 항체 | ||
| 이름 | 호스트 | 농도 |
| 아멜렉스 | 마우스 | 1:100 |
| CD44 | 마우스 | 1:200 |
| CK14 | 마우스 | 1:200 |
| ITGA6 | 토끼 | 1:200 |
| P63 | 토끼 | 1:1000 |
| SOX2 | 토끼 | 1:2000 |
| 종파적 항체 | ||
| 이름 | 호스트 | 농도 |
| 마우스 IgG (알렉사 555) | 당나귀 | 1:1000 |
| 토끼 IgG (알렉사 488) | 당나귀 | 1:1000 |
표 6: 항체 및 그의 희석물의 목록. 표는 본 연구에 사용된 항체 및 이들의 각각의 희석물을 열거한다.
| 뇌관 | ||
| 유전자 | 정방향 프라이머 | 역방향 프라이머 |
| 갭드 | GGTATCGTGGAAGGACTCATGAC | ATGCCAGTGAGCTTCCCGTTCAG |
| P63 | CAACGCAGTAGACACCATTTCC | CCCAAAACCTTCTCGCTTGTT |
| ITGA6 | GGCGGTGTGTTATGTCCTGAGTC | AATCGCCCATCAAAAGCTC |
| SOX2 | GCTGGGACATGTGAAGTCTG | CCCTGTGGTTACCTCTTCCT |
| PITX2 | CAGCGGACTCACTTTACCAG | ATTCTTGAACCAAACCCGGAC |
표 7: 프라이머 목록. 표에는 본 연구에 사용된 GAPDH, P63, ITGA6, SOX2 및 PITX2의 프라이머가 나열되어 있다.
토론
이 프로토콜은 인간 치아에서 시작하는 오가노이드의 효율적이고 재현 가능한 생성을 설명합니다. 우리의 지식에 따르면, 이것은 인간의 치과 조직에서 시작하여 현재 개념 (상피) 오가노이드를 확립하기위한 첫 번째 방법론입니다. 오가노이드는 장기간 팽창이 가능하며 치아 상피 줄기 표현형을 나타내며, DF7의 ERM 구획에서 이전에 보고된 DESC를 복제한다. 더욱이, 오가노이드는 아멜로아세포 분화 과정 7,25,26의 전개를 포함하는 기능적 DESC/ERM 특성을 복제한다. 연구 결과는 독립적 인 환자 오가노이드 라인19에서 유사한 결과가 발견되었으므로 강력합니다.
이 치아 오가노이드 프로토콜을 실행할 때 몇 가지 중요한 사항을 고려해야합니다. 첫째, 초기 시딩 및 각 패시징 직후에 Rho-associated kinase (ROCK) 억제제 Y-27632를 첨가하는 것은 단일 세포가 anoikis27을 겪는 것을 방지하기 위해 필수적입니다. 또한, 암포테리신 B는 (구강) 진균 증식을 피하기 위해 P0 동안 모든 미디어 다과에서 요구된다. 둘째, 냉동 보존 된 조직으로부터 출발하기보다는 최적의 오가노이드 형성 및 성장 효율을 위해 신선하게 분리 된 DF 조직을 즉시 처리하는 것이 좋으며, 이는 효율성을 낮춘다. 셋째, 배양을 위해 동결보존된 오가노이드 라인을 해동할 때, 가능한 한 빨리 단계를 수행하고 시간 연장이 세포 생존을 감소시키면서 단계 사이에 너무 긴 해동 시간뿐만 아니라 너무 긴 간격을 피한다. 넷째, 조기 계대에서의 오가노이드(P0-P3)의 수는 제한적으로 남아있을 수 있으며, 또한 제한된 수의 ERM(줄기) 세포만이 특이적 단리된 DF 조직 샘플에 존재할 수 있기 때문에 주목해야 한다. 따라서 초기 통과시 오가노이드 문화는 신중하고 신중하게 다루어야합니다. 따라서, (i) 오가노이드 배양의 급속한 팽창을 피하는 것이 좋습니다 (즉, P3-4에서 시작하여 1:0.5 또는 1:1 이전에 1:3 이상에서만 분할을 시작함); (ii) 기재된 바와 같이 적절한 분할 방법(낮은 통로 - 더 높은 통로)을 사용한다. 이러한 맥락에서, ERM 세포가 치아 발달과28 세에 따라 숫자가 감소하기 때문에 젊은 청소년 환자 (15 세에서 19 세)의 분출되지 않은 사랑니를 수집하는 것이 좋습니다. 다섯째, DF 조직으로부터 세포 현탁액 내에 남아있는 분산되지 않은 경조직 단편은 (여과 후에도) BMM 드롭이 덜 안정하고 배양 동안 탈락할 가능성이 더 커지게 한다. 해리된 DF 세포 현탁액에서 여러 개의 분산되지 않은 경조직 단편이 관찰되는 경우 BMM의 더 높은 백분율(예: 80%)이 권장됩니다. 여섯째, 문화의 10 일째와 14 일 사이에 오가노이드를 통과시키는 것이 좋습니다.왜냐하면 더 긴 문화는 최적의 해리가 적기 때문에 오가노이드 확장성에 부정적인 영향을 미치기 때문입니다. 하나 또는 다른 이유로 오가노이드가 14 일 이상 배양되는 경우, TryplE Express 양 및 오가노이드 해리를위한 배양 시간은 효율적인 해리를 위해 연장 될 수 있지만 효소 노출의 15 분을 능가해서는 안됩니다. 동일한 맥락에서, 배양 배지는 영양소 및 성장 인자 고갈을 방지하기 위해 2-3 일마다 새로 고쳐야합니다. 위에서 언급 한 임계 점에 관계없이 오가노이드가 제대로 팽창하지 않는 경우 얼음 위에서 통과 할 때 사용되는 모든 도구 (BMM, 사전 코팅 팁을위한 빙냉 SFDM, 마이크로 원심 분리기 튜브)를 유지하는 데 집중해야합니다. 또한, 오가노이드의 효율적인 통과를 위해 뚜렷한 통과 방법 (낮은 통과 및 높은 통과 방법)을 올바르게 적용하는 것이 중요합니다.
이전에, 다른 그룹들은 일차 인간 DESC/ERM 조직 8,9,10,11,12,21 의 시험관내 성장을 보고하였다. 그러나, 배양물은 주로 2D(단층)가 아니고 이러한 오가노이드 모델과 같은 3D가 아니었으며, 더욱이 단기간의 성장 및 표현형 유지만을 보여주기만 하였다. 대안적으로, 종종 (자발적으로) 불멸화된 세포가 사용되었는데, 이는 그러나, 생리학적이지 않으며 기원의 조직 또는 세포와 제한된 유사성만을 나타낸다. 더욱이, 이들 세포주는 배아 조직 및/또는 동물로부터 유래되었다. 또한, 아멜로아세포 분화는 기술되지 않거나 단지 제한적으로 문서화되어 있다. 따라서, 여기에 제시된 오가노이드 모델은 (i) 기원의 조직/세포의 충실한 재요약, (ii) 장기간 확장 가능, (iii) 생체내 구성을 보다 밀접하게 나타내는 3D로 배양됨, (iv) 인간 기원 및 산후 연령, (v) 성숙한 치과 세포(아멜로아세포 유형)로 분화할 수 있는 몇 가지 이점을 제공한다(19 참조).
따라서 우리는 몇 가지 흥미로운 응용 프로그램을 보유하고있는 이전에보고되지 않은 귀중한 연구 도구를 생성했습니다 (그림 1B). 오가노이드는 인간 DESC/ERM 줄기 및 가소성을 연구하는 데 적용할 수 있습니다. 그것은 면역 형광, 유전자 발현 및 (단일 세포) 전사 분석을 통해 여전히 수수께끼 같은 ERM 세포 집단의 생물학에 대한 더 많은 통찰력을 얻을 수있는 기회를 제공합니다. 또한, 오가노이드는 병원성 메카니즘을 해독하고, (새로운) 치료 표적을 확인하고, 약물 발견 및 스크리닝 도구(29)를 생성하기 위한 인간 질병 모델링에 특히 적합하다. 보다 구체적으로,이 모델은 건강한 치아 유래 오가노이드와 비교할 수있는 odontogenic 낭종 (신뢰할 수있는 연구 모델이 없음)에 적용될 수 있습니다. 또한, 이러한 치아 오가노이드 접근법은 박테리아의 영향에서부터 치아 이상과 관련된 유전적 돌연변이(예: CRISPR-Cas와 같은 최첨단 유전자 편집 방법을 사용하여 도입될 수 있는 P63의 돌연변이)30에 이르는 치아 질환을 모델링하고 연구하기 위해 활용될 수 있으며, 결국 잠재적, 그리고 신규한, 치료 표적 및 치료로 이어진다. 치아 오가노이드 프로토콜의 다른 응용은 다양한 사람 및 질병으로부터 오가노이드 라인을 수집하기 위한 바이오뱅킹(현재 치과용 펄프, 예컨대 퓨처 헬스 바이오뱅크(Future Health Biobank)31)을 포함할 수 있다(예를 들어, 약물 스크리닝과 같은 기초 및 번역 연구를 위해). 또한, 상피뿐만 아니라 기원 조직의 다른 세포 유형도 포함하는 복합 오가노이드 모델에 대한 몇 가지 보고서가 최근 발표되었습니다32,33. 치아 조성물이 다소 복잡하고, 중간엽, 면역, 및 내피 세포를 수용함에 따라, 이러한 세포 유형과 조합된 이러한 상피 오가노이드 모델을 적용하여 이들의 생체내 대응물을 보다 상세하게 표현하는 것은 매력적인 관점이다. 또한,이 시스템은 인간 치아에서 amelogenesis를 탐구 할 수 있으며, 현재는 잘 이해되지 않지만 상피 - 중간엽 상호 작용에 확실히 의존합니다. 아멜로아세포 해독 개발은 치아의 전형적인 구성 요소 인 에나멜의 생산이 치과 조직 복구에서 매우 쫓기는 목표이기 때문에 치과 과학 및 임상 세계에서 중요한 도약을 나타낼 것으로 예상됩니다. 또한,이 연구에 자세히 설명 된 오가노이드 모델링은 시험관 내에서 미네랄 화 된 조직의 형성을 향한 시작을 의미하고 대체 요법을위한 생체 공학 치아 (또는 적어도 부분)를 개발하는 길을 닦을 수 있습니다.
오가노이드 모델의 한계 중 하나는 조직의 상피 성분을 전적으로 나타낸다는 것입니다. 그러나, 위에서 상세히 설명된 바와 같이, 이러한 단점은 치과용 중간엽(19)과 같은 다른 세포/조직 유형의 첨가에 의해 해결될 수 있다. 제한으로 인식될 수 있는 또 다른 양태는 여기에 사용된 BMM(Matrigel)의 기원이다. 이 BMM은 마우스의 육종 (Engelbrecht-Holm-Swarm)에서 파생되므로 오가노이드 접근법을 클리닉으로 번역하기 전에 대체해야합니다. 최근에는 마트리겔을 합성 하이드로젤34,35로 대체하기 위한 몇 가지 노력이 이루어지고 있다. 그러나 이러한 비 천연 젤에서 오가노이드를 성공적으로 성장시키기 위해서는 더 많은 연구가 필요합니다. 오가노이드 기술이 미래의 치과 재생 요법에 대한 흥미로운 접근법을 제공하지만, 예를 들어, 생체 공학 치아의 개발 - 세포 기증자의 프라이버시뿐만 아니라 인간 오가노이드 및 그 유래 조직의 상업화에 관한 윤리적 질문이 제기되어야합니다. 지금까지 재생 목적을위한 오가노이드 상용화에 관한 결론은36에 도달하지 못했습니다. 치과용 펄프 바이오뱅크는 약물 스크리닝 목적으로 여러 조직, 주로 암 조직으로부터 오가노이드 바이오뱅크뿐만 아니라31 상승세를 보이고 있다. 오가노이드가 세포, 게이머, 조직 또는 장기 (모두 법에 의해 규제되는)로 분류 될 수 없다는 점을 감안할 때, 임상, 과학 또는 상업적 환경에서 사용하기 위해 법적 지위를 묘사 할 긴급한 필요성이 있습니다. 비록 오가노이드가 생체 내19에서 피하 이식 될 때 미네랄 화 된 조직을 침착시키는 것으로 밝혀졌지만, 자연 인간 치아와 유사한 에나멜을 침착시킬 가능성을 분석하기 위해서는 추가 연구가 필요합니다.
전체적으로 개발 된 새로운 오가노이드 모델은 인간 치아 (줄기 세포) 생물학 및 amelogenesis를 연구 할 수있는 유망하고 가치있는 도구를 제시하며, 현재 치아 질환 모델링 및 재생 요법에 대한 미래의 관점과 함께 제대로 탐구되지 않았습니다.
공개
해당 저자는 모든 저자가 모든 이해 상충을 공개했는지 확인합니다.
감사의 말
우리는 UZ Leuven의 구강 및 악안면 수술 (MKA)의 모든 직원과 환자들에게 갓 추출 된 세 번째 어금니를 수집하는 데 귀중한 도움을 주신 것에 감사드립니다. 우리는 또한 샘플 수집에 도움을 주신 Reinhilde Jacobs 박사와 Elisabeth Tijskens 박사에게 감사드립니다. 이 작품은 KU Leuven (BOF)과 FWO-Flanders (G061819N)의 보조금으로 지원되었습니다. L.H.는 FWO Ph.D. 펠로우(1S84718N)입니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.5 mL Microcentrifuge tube | Eppendorf | 30120.086 | |
| 15 mL Centrifuge tube | Corning | 430052 | |
| 2-Mercaptoethanol | Sigma-Aldrich | M-6250 | |
| 48-well flat bottom plates | Corning | 3548 | |
| 50 mL Centrifuge tube | Corning | 430290 | |
| A83-01 | Sigma-Aldrich | SML0788 | |
| Agarose | Lonza | 50004 | |
| Albumin Bovine (cell culture grade) | Serva | 47330.03 | |
| AMELX antibody | Santa Cruz | sc-365284 | |
| Amphotericin B | Gibco | 15200018 | |
| B27 (without vitamin A) | Gibco | 12587-010 | |
| Cassette | VWR | 7202191 | |
| Catalase from bovine liver | Sigma-Aldrich | C100 | |
| CD44 antibody | Abcam | ab34485 | |
| Cell strainer, 40 µm | Falcon | 352340 | |
| Cholera Toxin | Sigma-Aldrich | C8052 | |
| Citric acid | Sigma-Aldrich | C0759 | |
| CK14 antibody | Thermo Fisher Scientific | MA5-11599 | |
| Collagenase IV | Gibco | 17104-019 | |
| Cover glass | VWR | 6310146 | |
| Cryobox | Thermo Scientific | 5100-0001 | |
| Cryovial | Thermo Fisher Scientific | 375353 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D2650 | |
| Dispase II | Sigma-Aldrich | D4693 | |
| DMEM 1:1 F12 without Fe | Invitrogen | 074-90715A | |
| DMEM powder high glucose | Gibco | 52100039 | |
| Dnase | Sigma-Aldrich | D5025-15KU | |
| Donkey serum | Sigma-Aldrich | D9663 - 10ML | |
| Embedding workstation, 220 to 240 Vac | Thermo Fisher Scientific | 12587976 | |
| Ethanol absolute, ≥99.8% (EtOH) | Fisher Chemical | E/0650DF/15 | |
| Fetal bovine serum (FBS) | Sigma-Aldrich | F7524 | |
| FGF10 | Peprotech | 100-26 | |
| FGF2 (= basic FGF) | R&D Systems | 234-FSE-025 | |
| FGF8 | Peprotech | AF-100-25 | |
| GenElute Mammaliam Total RNA Miniprep Kit | Sigma-Aldrich | RTN350-1KT | Includes 1% β-mercaptoethanol dissolved in lysis buffer |
| Glass Pasteur pipette | Niko Mechanisms | 170-40050 | |
| Glycine | VWR | 101194M | |
| HEPES | Sigma-Aldrich | H4034 | |
| IGF-1 | PeproTech | 100-11 | |
| InSolution Y-27632 (ROCK inhibitor, RI) | Sigma-Aldrich | 688001 | |
| Insulin from bovine pancreas | Sigma-Aldrich | I6634 | |
| ITGA6 antibody | Sigma-Aldrich | HPA012696 | |
| L-Glutamine | Gibco | 25030024 | |
| Matrigel (growth factor-reduced; phenol red-free) | Corning | 15505739 | |
| Microscope slide | Thermo Fisher Scientific | J1800AMNZ | |
| Millex-GV Syringe Filter Unit, 0.22 μm | Millipore | SLGV033R | |
| Minimum essential medium eagle (αMEM) | Sigma-Aldrich | M4526 | |
| mouse IgG (Alexa 555) secondary antibody | Thermo Fisher Scientific | A-31570 | |
| N2 | Gibco | 17502-048 | |
| N-acetyl L-cysteine | Sigma-Aldrich | A7250 | |
| Nicotinamide | Sigma-Aldrich | N0636 | |
| Noggin | PeproTech | 120-10C | |
| P63 antibody | Abcam | ab124762 | |
| Pap Pen | Sigma-Aldrich | Z377821-1EA | Marking pen |
| Paraformaldehyde (PFA), 16% | Merck | 8.18715 | |
| Penicillin G sodium salt | Sigma-Aldrich | P3032 | |
| Penicillin-streptomycin (Pen/Strep) | Gibco | 15140-122 | |
| Petri dish | Corning | 353002 | |
| Phosphate buffered saline (PBS) | Gibco | 10010-015 | |
| Pipette (P20, P200, P1000) | Eppendorf or others | 2231300006 | |
| Plastic transfer pipette (3.5 mL) | Sarstedt | 86.1171.001 | |
| Rabbit IgG (Alexa 488) secondary antibody | Thermo Fisher Scientific | A21206 | |
| RSPO1 | PeproTech | 120-38 | |
| SB202190 (p38i) | Biotechne (Tocris) | 1264 | |
| Scalpel (surgical blade) | Swann-Morton | 207 | |
| SHH | R&D Systems | 464-SH-200 | |
| Silicone molds (Heating block) | VWR | 720-1918 | |
| Sodium Chloride (NaCl) | BDH | 102415K | |
| Sodium Hydrogen Carbonate (NaHCO3) | Merck | 106329 | |
| Sodium-pyruvate (C3H3NaO3) | Sigma-Aldrich | P-5280 | |
| SOX2 antibody | Abcam | ab92494 | |
| StepOnePlus | Thermo Fisher Scientific | Real-Time PCR System | |
| Stericup-GP, 0.22 µm | Millipore | SCGPU02RE | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit, 0.22 μm | Millipore | SCGP00525 | |
| Sterile 1000 μL pipette tips with filter | Greiner | 740288 | |
| Sterile 20 μL pipette tips with filter | Greiner | 774288 | |
| Sterile 200 μL pipette tips with and without filter | Greiner | 739288 | |
| Sterile H2O | Fresenius | B230531 | |
| Streptomycin sulfate salt | Sigma-Aldrich | S6501 | |
| Superscript III first-strand synthesis supermix | Invitrogen | 11752-050 | Reverse transcription kit |
| Tissue processor | Thermo Scientific | 12505356 | |
| Transferrin | Serva | 36760.01 | |
| Triton X-100 | Sigma | T8787-50ML | |
| TrypLE express | Gibco | 12605-010 | |
| Vectashield mounting medium+DAPI | Labconsult NV | H-1200 | Antifade mounting medium with DAPI |
| WNT3a | Biotechne (Tocris) | 5036-WN-500 | |
| Xylenes, 99%, for biochemistry and histology | VWR | 2,89,75,325 |
참고문헌
- Yu, T., Klein, O. D. Molecular and cellular mechanisms of tooth development, homeostasis and repair. Development (Cambridge). 147 (2), (2020).
- Arrow, P. Dental enamel defects, caries experience and oral health-related quality of life: a cohort study. Australian Dental Journal. 62 (2), 165-172 (2017).
- Mitsiadis, T. A., Orsini, G., Jimenez-Rojo, L. Dental Stem Cells for Tooth Regeneration. Dental Stem Cells: Regenerative Potential. Stem Cell Biology and Regenerative Potential. Stem Cell Biology and Regenerative Medicine. Zavan, B., Bressan, E. , Humana Press. Cham. (2016).
- Mitsiadis, T. A., Orsini, G. Editorial: a new era in dentistry: stem cell-based approaches for tooth and periodontal tissue regeneration. Frontiers in Physiology. 7, 357(2016).
- Miran, S., Mitsiadis, T. A., Pagella, P. Innovative dental stem cell-based research approaches: the future of dentistry. Stem Cells International. 2016, 7231038(2016).
- Shinmura, Y., Tsuchiya, S., Hata, K. I., Honda, M. J. Quiescent epithelial cell rests of malassez can differentiate into ameloblast-like cells. Journal of Cellular Physiology. 217 (3), 728-738 (2008).
- Davis, E. M. A review of the epithelial cell rests of Malassez on the bicentennial of their description. Journal of Veterinary Dentistry. 35 (4), 290-298 (2018).
- Athanassiou-Papaefthymiou, M., Papagerakis, P., Papagerakis, S. Isolation and characterization of human adult epithelial stem cells from the periodontal ligament. Journal of Dental Research. 94 (11), 1591-1600 (2015).
- Kim, G. -H., et al. Differentiation and establishment of dental epithelial-like stem cells derived from human ESCs and iPSCs. International Journal of Molecular Sciences. 21 (12), 1-16 (2020).
- Nam, H., et al. Establishment of Hertwig's epithelial root sheath/ epithelial rests of malassez cell line from human periodontium. Molecules and Cells. 37 (7), 562-567 (2014).
- Nam, H., et al. Expression profile of the stem cell markers in human hertwig's epithelial root sheath/Epithelial rests of Malassez cells. Molecules and Cells. 31 (4), 355-360 (2011).
- Tsunematsu, T., et al. Human odontogenic epithelial cells derived from epithelial rests of Malassez possess stem cell properties. Laboratory Investigation; A Journal of Technical Methods and Pathology. 96 (10), 1063-1075 (2016).
- Artegiani, B., Clevers, H. Use and application of 3D-organoid technology. Human Molecular Genetics. 27 (2), 99-107 (2018).
- Boretto, M., et al. Patient-derived organoids from endometrial disease capture clinical heterogeneity and are amenable to drug screening. Nature Cell Biology. 21 (8), 1041-1051 (2019).
- Cox, B., et al. Organoids from pituitary as a novel research model toward pituitary stem cell exploration. Journal of Endocrinology. 240 (2), 287-308 (2019).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Boretto, M., et al. Development of organoids from mouse and human endometrium showing endometrial epithelium physiology and long-term expandability. Development (Cambridge). 144 (10), 1775-1786 (2017).
- Schutgens, F., Clevers, H. Human organoids: tools for understanding biology and treating diseases). Annual Review of Pathology. 15, 211-234 (2020).
- Hemeryck, L., et al. Organoids from human tooth showing epithelial stemness phenotype and differentiation potential. Cellular and Molecular Life Sciences. 79 (3), 153(2022).
- Gao, X., Wu, Y., Liao, L., Tian, W. Oral organoids: progress and challenges. Journal of Dental Research. 100 (5), 454-463 (2021).
- Binder, M., et al. Novel strategies for expansion of tooth epithelial stem cells and ameloblast generation. Scientific Reports. 10 (1), 4963(2020).
- Xiong, J., Mrozik, K., Gronthos, S., Bartold, P. M. Epithelial cell rests of malassez contain unique stem cell populations capable of undergoing epithelial-mesenchymal transition. Stem Cells and Development. 21 (11), 2012-2025 (2012).
- Luan, X., Ito, Y., Diekwisch, T. G. H. Evolution and development of Hertwig's epithelial root sheath. Developmental Dynamics. 235 (5), 1167-1180 (2006).
- Fukumoto, S., et al. New insights into the functions of enamel matrices in calcified tissues. Japanese Dental Science Review. 50 (2), 47-54 (2014).
- Consolaro, A., Consolaro, M. F. M. O. ERM functions, EGF and orthodontic movement or Why doesn't orthodontic movement cause alveolodental ankylosis. Dental Press Journal of Orthodontics. 15 (2), 24-32 (2010).
- Guajardo, G., et al. Immunohistochemical localization of epidermal growth factor in cat paradental tissues during tooth movement. American Journal of Orthodontics and Dentofacial Orthopedics. 118 (2), 210-219 (2000).
- Watanabe, K., et al. A ROCK inhibitor permits survival of dissociated human embryonic stem cells. Nature Biotechnology. 25 (6), 681-686 (2007).
- Gonçalves, J., Sasso-Cerri, E., Cerri, P. Cell death and quantitative reduction of rests of Malassez according to age. Journal of Periodontal Research. 43 (4), 478-481 (2008).
- Kim, J., Koo, B. -K., Knoblich, J. A. Human organoids: Model systems for human biology and medicine. Nature Reviews. Molecular Cell Biology. 21 (10), 571-584 (2020).
- Razmi, M. T., Narang, T., Handa, S. ADULT (acro-dermato-ungual-lacrimal-tooth) syndrome: a case report from India. Indian Dermatology Online Journal. 9 (3), 194(2018).
- Future Health Biobank. , Available from: https://futurehealthbiobank.com/ch-en/ (2022).
- Schreurs, R. R. C. E., Baumdick, M. E., Drewniak, A., Bunders, M. J. In vitro co-culture of human intestinal organoids and lamina propria-derived CD4+ T cells. STAR Protocols. 2 (2), 100519(2021).
- Fiorini, E., Veghini, L., Corbo, V. Modeling cell communication in cancer with organoids: Making the complex simple. Frontiers in Cell and Developmental Biology. 8, 166(2020).
- Gjorevski, N., et al. Designer matrices for intestinal stem cell and organoid culture. Nature. 539 (7630), 560-564 (2016).
- Zhang, Y., et al. Polyisocyanide hydrogels as a tunable platform for mammary gland organoid formation. Advanced Science. 7 (18), 2001797(2020).
- Mollaki, V. Ethical challenges in organoid use. BioTech. 10 (3), 12(2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유