Method Article
Siyanobakterilerde Bozulmamış Fitoidinin İzolasyonu ve Karakterizasyonu
Bu Makalede
Özet
Mevcut protokol, filobobizomların siyanobakterilerden santrifüjleme ile süreksiz bir sakkaroz yoğunluk gradyanı ile izolasyonunu detaylandırıyor. Sağlam fitoidürlerin fraksiyonları 77K floresan emisyon spektrumu ve SDS-PAGE analizi ile doğrulanır. Ortaya çıkan fitobilizom fraksiyonları TEM ve kütle spektrometresi analizinin negatif boyanması için uygundur.
Özet
Siyanobakterilerde fitobilizom, ışığı toplayan ve fotokimya için fotosistem I ve II'ye enerji aktaran hayati bir anten protein kompleksidir. Fitofilizomun yapısını ve bileşimini incelemek bilim adamları tarafından büyük ilgi çekicidir, çünkü siyanobakterilerdeki fotosentezin evrimini ve ayrışmasını ortaya koymaktadır. Bu protokol, siyanobakteri hücrelerini bir boncuk çırpıcı tarafından düşük maliyetle verimli bir şekilde kırmak için ayrıntılı ve optimize edilmiş bir yöntem sağlar. Bozulmamış fitobilizom daha sonra sakkaroz gradyan ultracentrifugation ile hücre özünden izole edilebilir. Bu yöntem farklı hücre tiplerine sahip hem model hem de model dışı siyanobakteriler için uygun olduğunu göstermiştir. Çinko sülfat ve Coomassie Blue ile boyanmış 77K floresan spektroskopisi ve SDS-PAGE ile fitobiliproteinlerin bütünlüğünü ve özelliğini doğrulamak için adım adım bir prosedür de sağlanmaktadır. İzole fitoidom ayrıca daha fazla yapısal ve bileşimsel analize tabi tutulabilir. Genel olarak, bu protokol, siyanobakterilere aşina olmayan araştırmacıların bozulmamış fitobilizomları hızlı bir şekilde izole etmelerini ve karakterize etmelerini sağlayan yararlı bir başlangıç kılavuzu sağlar.
Giriş
Fitobilizom (PBS), siyanobakterilerin timlakoid zarlarındaki fotostemlerin sitoplazmik tarafına bağlanan suda çözünür pigment-protein kompleksidir1. PBS öncelikle renkli fitobiliproteinler ve renksiz bağlayıcı proteinlerden oluşur1,2. Fitobiliproteinler dört ana gruba ayrılabilir: fitoerythrin, phycoerythrocyanin, phycocyanin ve allophycocyanin3. Dört ana grup, klorofillerin verimsiz olarak emdiği 490-650 nm aralığında farklı ışık enerjisi dalga boylarını emer3. PBS, ışık enerjisi toplamak ve Fotosistem II ve I4'e teslim etmek için ışık hasat anteni olarak hizmet edebilir.
PBS'nin yapısı ve bileşimi türlerden türlere değişir. Toplu olarak, farklı siyanobakteri türlerinde üç fitoidom şekli (hemidiscodial, demet şeklinde ve çubuk şeklinde) tanımlanmıştır5. Aynı türlerde bile, PBS'nin bileşimi, ışık kalitesi ve besin tükenmesi6,7,8,9,10,11 gibi çevreye yanıt olarak değişir. Bu nedenle, PBS'yi siyanobakterilerden izole etmek için deneysel prosedür PBS12'nin incelenmesinde etkili olmuştur. Birkaç on yıl içinde, birçok farklı protokol PBS'yi izole etti ve yapısını, bileşimini ve işlevini analiz etti6,7,8,12,13,14,15,16,17. PBS izolasyonu için çok çeşitli yöntemler, kompleksi farklı türlerde farklı reaktifler ve aletlerle izole etme esnekliği sağlar. Bununla birlikte, siyanobakteriler ve PBS'ye aşina olmayan bilim adamları için uygun bir protokol seçmeyi de zorlaştırır. Bu nedenle, pbs izolasyonu siyanobakterilerden başlamak isteyenler için bu çalışmada genelleştirilmiş ve basit bir protokol geliştirilmiştir.
PBS'yi önceki yayınlardan izole etme yöntemleri burada özetlenmiştir. PBS suda çözünen bir protein kompleksi olduğundan ve kolayca ayrıştığından, ekstraksiyon sırasında PBS'yi stabilize etmek için yüksek iyonik mukavemetli fosfat tamponu gereklidir18. Geçmişte PBS'nin siyanobakteryumdan izolasyonu için yöntemleri açıklayan çeşitli araştırma makaleleri yayınlanmıştır. Yöntemlerin çoğu yüksek konsantrasyonda fosfat tamponu gerektirir8,14,15,18,19. Bununla birlikte, hücrelerin mekanik olarak bozulmasına yönelik prosedürler, cam boncuk destekli ekstraksiyon, sonication20 ve Fransız presi6,8,14 gibi değişir. Farklı fitobiliproteinler amonyum sülfat20 ile çökeltme ile elde edilebilir ve HPLC21 veya kromatografik bir sütun22 ile saflaştırılabilir. Öte yandan, sağlam PBS sakkaroz yoğunluğu gradyan ultracentrifugation6,8,15 ile kolayca izole edilebilir.
Bu protokolde PBS izolasyonu için malzeme olarak bir model siyanobakteri ve bir model dışı siyanobakteryum kullanılmıştır. Bunlar sırasıyla model tek hücreli glikoz-hoşgörülü Synechocystis sp. PCC 6803 (bundan böyle Syn6803) ve model dışı filamentli Leptolyngbya sp. JSC-1 (bundan böyle JSC-1), sırasıyla 7,23,24'tür. Protokol, yüksek iyonik mukavemetli fosfat tamponunda tek hücreli ve filamentli siyanobakterilerin bozulmasıyla başlar. Lizozdan sonra, süpernatantlar santrifüjleme ile toplanır ve daha sonra timlakoid membranlardan suda çözünen proteinleri yatıştırmak için noyonik bir deterjan (Triton X-100) ile muamele edilir. Toplam suda çözünen proteinler, PBS'yi fraksiyone etmek için süreksiz bir sakkaroz yoğunluk gradyanine uygulanır. Bu protokoldeki süreksiz sakkaroz gradyanı dört sakkaroz çözeltisi oluşur ve bozulmamış PBS'yi sakkaroz tabakasının en düşük fraksiyonlarında bölümler25. PBS'nin bütünlüğü SDS-PAGE, çinko boyama ve 77K floresan spektroskopisi6,7,8,26 ile analiz edilebilir. Bu yöntem, bozulmamış PBS'yi siyanobakterilerden izole etmeyi ve spektral, yapısal ve bileşimsel özelliklerini incelemeyi amaçlayan bilim adamları için uygundur.
Bu protokolün birkaç avantajı vardır. (1) Bu yöntem standartlaştırılmıştır ve bozulmamış PBS'yi hem tek hücreli hem de filamentli siyanobakterilerden izole etmek için kullanılabilir. Makalelerin çoğu, bir tür siyanobakteri4,7,8,12,13,14,16,18'de uygulanan yöntemi açıklar. (2) PBS düşük sıcaklıkta ayrıştığı için bu yöntem oda sıcaklığında gerçekleştirilir19,27. (3) Bu yöntem, hücreleri bozmak için boncuk çırpıcı kullanmayı açıklar; bu nedenle, yüksek basınçlı Fransız basınından ve diğer yöntemlerde sonicator'dan olası işitme hasarından daha ucuz ve güvenlidir8,13,14,20. (4) Bu yöntem, sakkaroz gradyan ultra santrifüjleme ile bozulmamış PBS'yi izole eder. Bu şekilde, farklı boyutlarda ve kısmen ayrışmış PBS'ye sahip bozulmamış PBS, sakkaroz konsantrasyonuna göre ayrılabilir.
Protokol
Synechocystis sp. PCC 6803 modeli glikoz-hoşgörülü suş, Dr. Chu, Hsiu-An Academia Sinica, Tayvan'dan elde edildi. Leptolyngbya sp. JSC-1, model olmayan filamentli, ABD Pennsylvania Eyalet Üniversitesi'nden Dr. Donald A. Bryant'tan alındı.
1. Hücre kültürü ve hasat
- Syn6803 veya JSC-1 hücrelerini metalik bir aşılama döngüsü kullanarak 50 mL B-HEPES medium28 içeren 100 mL konik şişeye aşıla. 50 μmol foton altında 30 °C'deki hücreleri kültür, m-2 s-1 (beyaz ışık LED'i) %1 (v/v) CO2'de, kültür orta-üstel büyüme evresine ulaşana kadar manyetik karıştırıcı (120 rpm) ile sürekli karıştırarak kültür (OD750 = 0,6-0,8).
NOT: Kültürün 750 nm (OD750) optik yoğunluğu 0,6-0,8'e ulaştığında yeni bir şişeye aktararak hücre kültürünü hasat edin. Optik yoğunluk, sıvı kültürlerinde mikrobiyal hücre yoğunluğunu tahmin etmek için rutin olarak kullanılmıştır29. 720-750 nm'lik dalga boyları siyanobakteriyal büyümenin ölçülmesi için çeşitli çalışmalarda kullanıldı30,31,32. Bu protokolde, OD750 kullanılır, çünkü JSC-1 uzak kırmızı ışığı emen pigmentler üretebilir7. Alternatif olarak, siyanobakterilerin büyümesini ölçmek için klorofil konsantrasyonu da kullanılmıştır33. - Hücre kültürünü (OD750 ~0.8) 1L konik bir şişeye aktarın ve 500 mL B-HEPES ortamında OD750 = 0.2'ye seyreltin. Kültürü yukarıda belirtilen durumda (adım 1.1) geç üstel büyüme aşamasına (OD750 = 0.8-1.0) kadar büyütün ve ardından kültürü santrifüjleme ile hasat edin.
- Oda sıcaklığında 20 dakika boyunca kültürü 10.000 x g'da santrifüj edin ve süpernatantı tamamen atın.
NOT: Hücre peletleri -80 °C'de 6 aya kadar saklanabilir.
2. Hücre lizisi
- Hücre peletlerini askıya alın ve 0,75 M K-fosfat tamponu, pH 7 ile iki kez yıkayın.
NOT: pH 7'de 0,75 M K-fosfat tamponu yapmak için ayrı ayrı 1,5 M K2HPO4 ve 1,5 M KH2PO4 hazırlayın. pH 7'de 1,5 M K-fosfat tamponu elde etmek için 615 mL 1,5 M K2HPO4 ve 385 ml 1,5M KH2PO4 karıştırın. pH 7'de 0,75 M K-fosfat tamponu yapmak için aynı miktarda ddH2O ile seyreltin. - 50 mL santrifüj tüplerindeki hücreleri oda sıcaklığında 20 dakika boyunca 10.000 x g'da santrifüjleme ile peletlayın. Üstnatant atın ve hücreleri 0,75 M K-fosfat tamponu ile yeniden biriktirin. Peletin ıslak ağırlığını elektronik bir terazi ile ölçün ve peletin 1 g ıslak ağırlığını tamponun 5 mL'sinde yeniden harcayın.
NOT: Bir peletin ıslak ağırlığı, boş bir santrifüj tüpünün ağırlığını hücre peletini içeren santrifüj tüpünün ağırlığından çıkarılarak ölçüldü. - 2 mL vidalı kapak şişesine 1 mL hücre süspansiyonu ve 0,4-0,6 g 0,1 mm cam boncuk ekleyin ( bkz. Malzeme Tablosu).
- 30 sn'lik hücreleri boncuk çırpıcı ile kırın (bkz. Malzeme Tablosu). Tüplerin oda sıcaklığındaki su banyosunda 2 dakika soğumasını bekleyin ve kırılma döngüsünü 5 kez tekrarlayın.
- Lizizden sonra, şişeleri oda sıcaklığında 10 s için 500 x g'da santrifüj edin. Bir pipet ile süpernatantı 15 mL santrifüj tüpüne toplayın. Boncukları bir kez 0,75 M K-fosfat tamponunun 0,5 mL'si ile yıkayın, ardından aynı santrifüj tüpüne aktarın.
- Lisli hücre süspansiyonuna Triton X-100 (%2 w/v, son konsantrasyon) ekleyin ve çözelti homojen hale gelene kadar oda sıcaklığında sallanan bir çalkalayıcıya (40 rpm) kuluçkaya yatırın (~20 dk).
- Sağlam hücreleri ve büyük hücre kalıntılarını gidermek için tüpleri 20 dakika boyunca 17.210 g'da santrifüj edin. Üst Triton misel tabakası olmadan süpernatantı oda sıcaklığında 1 saate kadar saklayın.
NOT: Üstnatant iki ayrı katman içerir. Üst hidrofobik Triton X tabakası klorofil bağlayıcı proteinler ve hidrofobik çubuk şeklinde fitobilizomlar içerir6. Alt sulu tabaka suda çözünür PBS içerir.
3. Sakkaroz gradyan tamponlarının hazırlanması ve PBS izolasyonu
- pH 7'de 0,75 M K-fosfat tamponunda dört konsantrasyon sakkaroz (2,0 M, 1,0 M, 0,75 M ve 0,5 M) yapın.
NOT: Sakkaroz gradyanını hazırlamak için pH 7'de 1,5 M K-fosfat tamponu kullanılması önerilir, çünkü sakkaroz eklemek K-fosfat tamponunun konsantrasyonu seyreltir. Sakkaroz tamamen çözüldükten sonra, konsantrasyonu 0,75 M, pH 7'ye ayarlamak için ddH2O ekleyin. - 40 mL santrifüj tüpünün altına 2,8 mL 2,0 M sakkaroz tamponu yerleştirin ve üç kat sakkaroz çözeltisi (8 mL 1,0 M; 40 mL santrifüj tüpü için 0,75 M'nin 12 mL'si ve 0,5 M'nin 11 mL'si ve son olarak PBS içeren süpernatan fraksiyon (3,0 mL) (Şekil 1A).
NOT: Sakkaroz çözeltisini dikkatlice ekleyin ve sakkarozun tüpün içine çok yavaş düşmesini sağlar. Çözeltiyi yüklerken pipet ucunu borudaki çözeltinin yüzeyinin hemen üzerinde tutun. Sakkaroz katmanları yavaşça katmanlandığında gözlemlenebilir. - Elde edilen degradeleri 25 °C'de ~16h-20 saat için 125.800 x g'da santrifüj edin.NOT: Bu adım için ultracentrifuge (bkz. Malzeme Tablosu) gereklidir.
- Ultra santrifüjleme üzerine, kesirli PBS ve fitobiliproteinleri katmanlar arasında yoğunlaştırın. Arayüzlerde Syn6803'teki mavi bantlar (JSC-1'de mor bantlar gösterildi) gözlendi (Şekil 1D).
- Kesirleri sakkaroz gradyanlarının üstünden bir pipetle yavaşça toplayın. Sakkarozu tekrar tekrar konsantre ederek (20 dakika için 3.500 x g ) ve fraksiyonları membran santrifüj filtre ünitelerinde 0,75 M K-fosfat tamponu ile seyrelterek çıkarın (10 K moleküler ağırlık kesme, bkz. Malzeme Tablosu).
4. 77K'da PBS floresan ölçümü
NOT: 77K'da floresan spektrumunu ölçmek için sıvı azot kabı ile donatılmış bir florometre (bkz. Malzeme Tablosu) kullanılır.
- Konsantre PBS örneğini 0,75 M K-fosfat tamponu ile seyrelterek en az 500 μL kazanın.
NOT: Örneklerin fitokyanin konsantrasyonları formüle göre ~4.2 μg mL-1'dir : (OD615 0.474 x OD652)/5.34 [mg/mL]34. - Şeffaf bir cam tüpe 500 μL PBS numunesi ekleyin ve tüpü tamamen donana kadar sıvı nitrojen içinde dondurun. Donmuş tüpü sıvı nitrojenle önceden doldurulmuş şeffaf bir Dewar kabına (bkz. Malzeme Tablosu) taşıyın.
NOT: Bu protokolde cam tüpün iç çapı 3 mm'dir. Numunedeki kısa dalga boyu emisyonunun yeniden emilimini en aza indirmek için ince cam tüpler kullanılmıştır. - Fitoerythrin ve phycocyanin için ekscitasyon dalga boylarını sırasıyla 550 nm ve 580 nm olacak şekilde seçin.
NOT: Floresan emisyonları 560-800 nm (550 nm heyecan için) veya 600-800 nm (580 nm heyecan için) kaydedildi.
5. PBS'nin SDS-PAGE analizi
- Tampon değişimi konsantre PBS numuneleri 0,75 M K-fosfat içinde 50 mM Tris tamponu (pH 8.0) membran santrifüj filtre ünitelerinde (3K moleküler ağırlık kesme, bkz. Malzeme Tablosu).
- 50 μL PBS çözeltisinin 10 μL 6x SDS yükleme tamponu ile karıştırılması [300 mM Tris pH 6,8, %12 (w/v) Sodyum dodecyl sülfat, %0,06 (w/v) Bromsenol mavisi, %50 (v/v) Gliserol, %6 (v/v) β-Mercaptoethanol] (bkz. Malzeme Tablosu) bir mikrosantrifüj tüpünde ve 95 °C'de ısı bloğunda 10 dakika kuluçkaya yatır.
- Protein örneklerini SDS-PAGE (%8-%20 (w/v) poliakrilamid jel) ile ayırın ve çinko ve Coomassie boyama ile devam edin. Ayrıntılı yordam Reference8'de açıklanmıştır.
- Çinko boyama için, jeli oda sıcaklığında 10 dakika boyunca 50 mM ZnSO4 çözeltisinde kuluçkaya yatırın, jeli damıtılmış suyla yıkayın ve UV ışınlama (312 nm) altında çinko kaynaklı floresan görselleştirin.
- Coomassie mavisi boyama için, coomassie mavi boyama tamponunda jeli kuluçkaya yatırın [0.25% (w/v) Coomassie R-250, % 10 (v/ v) Asetik asit, 50% (v / v) Metanol , bkz. Artık boyama tamponu çıkarmak için jeli iki kez damıtılmış suyla yıkayın ve jeli bir gecede oda sıcaklığında sallanan bir çalkalayıcıda [% 10 (v/ v) Asetik asit,% 30 (v / v) Metanol] destaining tamponu ile kuluçkaya bırakın. Tamamen destained jel bir dijital kamera veya tarayıcı ile görselleştirin.
Sonuçlar
Syn6803 ve JSC-1 hücreleri, %1 (v/v) CO2 ile dolu bir büyüme odasında LED beyaz ışık (50 μmol foton m-2s-1) altında, 30 °C'de B-HEPES ortamında sürekli karıştırılarak konik şişelerde yetiştirildi. Üstel büyüme aşamasında (OD750 = ~0.5), hücreler son optik yoğunluklu OD750 = ~0.2 ile taze ortama alt kültüre edildi. Geç üstel büyüme aşamasına ulaştıktan sonra (OD750 = 0.6-0.8), kültürler toplandı ve santrifüjlendi (20 dakika boyunca oda sıcaklığında 10.000 x g). Üstnatan atıldı ve hücre peletleri bir sonraki adıma kadar -80 ° C'de depolandı.
Hücreleri kırmak için, hücreler önce oda sıcaklığında çözüldü. Hücreler, 0.75 M K-fosfat tamponu içinde 0.1 mm cam boncuk ile boncuk dövülerek bozuldu. Komple hücre lizisi, santrifüjlemeden önce süpernatantı koyu mavi-yeşil renkte gösterir (Şekil 1B). Triton X-100 tarafından çözünür hale getirilmesi ve çözünmeyen zarları ve hücre kalıntılarını gidermek için santrifüjlemeden sonra, süpernatant sakkaroz gradyan çözeltisinin üstüne 40 mL santrifüj tüpünde yüklendi (Şekil 1C). 18 saatlik santrifüjlemeden sonra, sağlam PBS Syn6803 için açık mavi bir bant ve JSC-1 için mor bir bant olarak degradenin merkezine taşındı. Renklerindeki fark, Syn6803 ve JSC-1'deki PBS'nin farklı kompozisyonlarından kaynaklanır. Syn6803'ün PBS'si phycocyanin35 taşırken, JSC-1'in PBS'si fitokyanin ve fitoerythrin7 taşır. İzole PBS'nin sakkaroz yoğunluk degrade ayrımının sonucu, ayrışmış fitobiliproteinlerin birkaç fraksiyonunu gösterir ve en düşük kesir bozulmamış PBS'yi temsil eder (Şekil 1D).
JSC-1 ve Syn6803'ten izole edilen PBS'nin farklı fraksiyonlarının emilim spektrumu Şekil 2A'da karşılaştırılmıştır. Emilim spektrumunun ayrıntılı prosedürü makalelerde açıklanmıştır7,8. JSC-1 ve Syn6803'ün ayrışmış PBS ve bozulmamış PBS'sinden emilim spektrumu, phycocyanin'e karşılık gelen 622 nm'de aynı tepeye sahiptir. Ve 571 nm'deki fitoerythrin emilim zirvesi hem ayrışmış PBS'de hem de JSC-1'in bozulmamış PBS'sinde bulunur. Allophycocyanin, JSC-1 ve Syn6803'ün sağlam PBS fraksiyonlarında 670 nm omuz ile küçük bir tepe gösterir. Spektral farklılıklar, phycobiliproteinlerin spektral özellikleri daha önce belirlendiğinden, çubuk (phycocyanin) ile çekirdek (allophycocyanin) oranının ayrışmış PBS'de bozulmamış PBS fraksiyonundakinden daha yüksek olduğunu göstermektedir5. Ayrışmış PBS ve bozulmamış PBS fraksiyonları oda sıcaklığında benzer emilim spektrumu ve floresan emisyon özellikleri gösterdiğinden, sakkaroz gradyanından izole edilen farklı fraksiyonları analiz etmek için 77K floresan spektroskopisi kullanılmıştır. Ayrışmış PBS'nin 77K floresan emisyon spektrumu ve sağlam PBS fraksiyonları 580 nm ile heyecanlandı. Ayrışmış PBS'nin emisyon spektrumu, phycocyanin emisyonunu temsil eden Syn6803 ve JSC-1'de ~650 nm'de güçlü bir tepeye sahiptir (Şekil 2B). Sağlam PBS'nin floresan emisyon spektrumu iki floresan emisyon maksimal zirvesi göstermektedir: zayıf olan 651 nm'de ve güçlü olan 684 nm'de, fitokyanin tarafından hasat edilen enerjinin çekirdek9'daki allophycocyanin ve terminal yayıcılarına (ApcD ve ApcE) verimli bir şekilde aktarıldığını ortaya koyan (Şekil 2C). Bu özellikler, sakkaroz degradeslerindeki en düşük kesirlerin bozulmamış PBS içerdiğini gösterir.
Ayrışmış PBS ve sağlam PBS, SDS-PAGE ile %8-%20 (w/v) SDS poliakrilamid doğrusal gradyan jel üzerinde ayrıldı. Jel üzerinde lekeleme olmadan fikokyanin ve allofikobinin α ve β alt birikintileri görülebilirdi (Şekil 3A). Jel daha sonra 10 dakika boyunca 10 mM ZnSO4 ile boyandı. Kromofor içeren fitobiliproteinler UV ışınlaması sırasında çinko lekelenmesi ile gözlendi8. Fitobiliprotein alt ünlemleri (14-21 kDa) güçlü bir şekilde floresandır ve ApcE (ok) zayıf floresan göstermiştir (Şekil 3B). Ayrıca, Coomassie Blue boyama, ayrışmış PBS fraksiyonları ile bozulmamış PBS fraksiyonları arasındaki farklı protein bileşimini gösterir (Şekil 3C). Üst fraksiyonlar, pbs olmayan suda çözünür diğer proteinleri içerir, çünkü bozulmamış PBS fraksiyonlarından daha fazla protein lekelenir. Syn6803'teki bozulmamış PBS, ayrışmış PBS kesirlerinde (Şekil 3C) eksik olan belirgin bir ApcE bandını (ok) gösterir.
PBS özü ve sakkaroz gradyanı arasındaki hacim oranı, ultracentrifugation sonrası sakkaroz gradyanında keskin bantlar elde etmek için kritik öneme sahiptir. Çözünür PBS özlerinin sakkaroz gradyan çözeltisine önerilen oranı 1:10'dur. Önceki deneyime dayanarak, 40 mL santrifüj tüplerinde sakkaroz gradyanı yapmak, 13 mL tüplerde yapılan sakkaroz gradyanından daha yüksek bir çözünürlük gösterir. Süreksiz sakkaroz gradyanı, tezgah üzerindeki titreşim nedeniyle zamanla yayılır. Bu nedenle, 13 mL santrifüj tüpü aynı anda birçok numuneyi işlemek için iyi bir seçim olabilir. Bunu göstermek için, 13 mL santrifüj tüplerindeki sakkaroz gradyanları 1:3 ve 1:10 oranlarında Syn6803 veya JSC-1'in ham özleri arasında sakkaroz gradyan çözeltisine hazırlanmıştır (Şekil 4A). Ultrasantrifüjlemeden sonra, 1:3 oranında hazırlanan sakkaroz gradyanı, 1:10 oranında yapılan degradeden daha geniş bantlar görüntüler (Şekil 4B). Her degradenin en düşük fraksiyonları, 77K floresan emisyon spektroskopisi ile onaylanan bozulmamış PBS içerir.

Şekil 1: Syn6803 ve JSC-1 hücrelerinin bozulması ve sakkaroz gradyan ultrasantrifüjasyonu. (A) Durdurulan sakkaroz gradyanını 40 mL santrifüj tüpünde hazırlamanın şematik illüstrasyonu. (B) Vidalı kapak şişeleri 0,4 g cam boncuk ve Syn6803 veya JSC-1 hücre süspansiyonu ile dolduruldu ve daha sonra hücreler boncuk çırpıcı ile yutturulmuştu. (C) Triton X-100 çözünür ekstresinin üst kısmı sakkaroz yoğunluk gradyanının üstüne katlandı. (D) 18 saat santrifüjlemeden sonra, PBS fraksiyonları Syn6803'teki degradede açık mavi bantlar ve JSC-1'de mor bantlar olarak görselleştirildi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
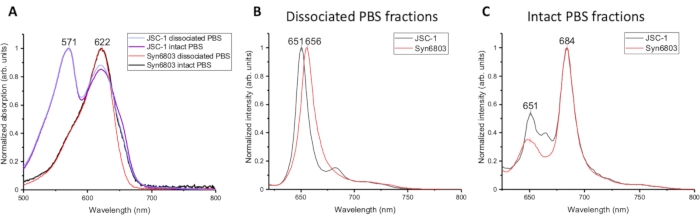
Şekil 2: Sakkaroz gradyanlarının farklı fraksiyonlarının spektroskopik karakterizasyonu. (A) JSC-1 ve Syn6803'ten ayrışmış PBS ve bozulmamış PBS fraksiyonlarının emilim spektrumu. Floresan emisyon spektrumu, (B) ayrışmış PBS fraksiyonları ve (C) Syn6803 ve JSC-1'in bozulmamış PBS fraksiyonları için 580 nm'deki uyarı dalga boyu kullanılarak 77 K olarak ölçüldü. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
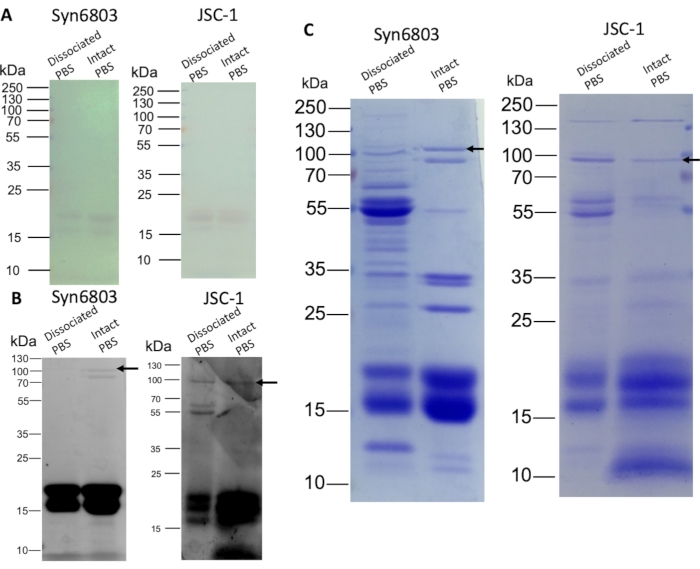
Şekil 3: Sakkaroz gradyanlarından izole edilmiş PBS'nin SDS-PAGE analizi. Ayrışmış ve bozulmamış PBS fraksiyonları ölçülmüş (şerit başına 20 μg protein) ve %8-%20 (w/v) gradyan poliakrilamid jel üzerine yüklenmiştir. Jel elektroforezi sonrası jel çinko lekeleme ve Coomassie Blue boyama ile görselleştirildi. (A) Fitobiliproteinlerin rengi jel üzerinde lekeleme olmadan görülebilir. (B) Çinko lekeli jel fitobiliproteinlerin floresanını gösterir. (C) Coomassie Blue ile boyanmış jel fitobiliproteinler ve diğer proteinleri gösterir. Oklar ApcE'nin konumlarını gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
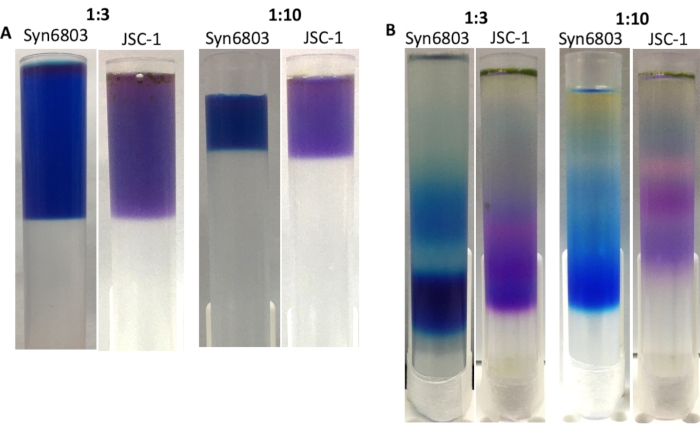
Şekil 4: 13 mL santrifüj tüplerde yapılan sakkaroz gradyanı. Ham özü ve sakkaroz gradyan çözeltisi arasındaki oranlar görüntülerin üstünde işaretlenir. (A) Syn6803 ve JSC-1'in Triton X-100 çözünülmüş özlerinin süpernatantı, solübilize özlerin sakkaroz gradyan çözeltisine farklı oranlarıyla sakkaroz yoğunluk gradyanları üzerine katmanlandı. (B) 18 saat santrifüjlemeden sonra, sakkaroz gradyanlarında Syn6803 ve JSC-1'deki PBS fraksiyonları gözlendi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu protokol, iki tür siyanobakteri, tek hücreli model Syn6803 ve filamentli model dışı JSC-1'de bozulmamış PBS'yi yalıtmaya yönelik basit ve standart bir yöntemi açıklar. Protokolün kritik adımları hücre homojenizasyonu ve sakkarozun süreksiz yoğunluk gradyanı üzerinde ultrasantrifüjlemedir. Genellikle, filamentli hücrelerin bozulması tek hücreli olanlardan daha karmaşıktır. Başlangıç malzemesinin miktarının (hücre peletinin ıslak ağırlığı) artırılması ve boncuk çırpma tekrarının tekrarlanması, filamentli siyanobakteri hücrelerinden PBS verimini artırmaya yardımcı oldu. Filamentli siyanobakteri için JSC-1, tek hücreli olan Syn6803'ten üç kat daha fazla hücre kullanıldı. Ek olarak, filamentli siyanobakteriyi tamamen kırmak için, ekstraksiyon tamponundaki koyu mavimsi-mor rengi gözlemlemek için tek hücreli siyanobakterilerden daha fazla boncuk dövmesi gerekir.
Boncuk çırpma döngüsünün her sırasında numuneler ısıtıldığından, boncuk dövme süresinin 30 s'yi aşması önerilmemektedir. Sağlam PBS düşük sıcaklıkta kolayca ayrıştığundan, tüplerin her döngü arasında bir bankta (veya su banyosunda) oda sıcaklığında soğuması önerilir25. Bu nedenle, bu protokoldeki her prosedürün oda sıcaklığında yapılması önerilir. Birçok araştırma makalesi, yüksek basınçlı homojenizatör (French-Press) veya sonicator6,8,20 dahil olmak üzere farklı hücre bozulması yöntemlerini tanımlamıştır. Boncuk değirmeni homojenizatör, daha ucuz, daha güvenli, kullanımı daha kolay, daha hızlı, daha erişilebilir ve aynı anda birden fazla numunenin işlenmesinde daha verimli olduğu için önerilir.
Fitosbilizomlar hemidiscoidal, demet şeklinde ve çubuk şeklinde5 olmak üzere üç farklı şekil gösterir. Şekil 2'de izole edilen bozulmamış fitoidizomlar, önceki yayınlarda tartışıldığı gibi hemidiscoidal şekle aittir7,13,36. Ancak, ayrışmış PBS'yi temsil eden üst kesir çubuk şeklinde PBS de içerebilir. Syn6803 ve JSC-1, hemidiscoidal PBS6,37'ye ek olarak çubuk şeklinde PBS'nin varlığını öneren belirli bir çubuk çekirdekli bağlayıcı CpcL'yi kodlar. Çubuk şeklindeki PBS doğrudan Syn6803'te tanımlanmıştır, ancak JSC-17,13,37'de tanımlanmadı. Öte yandan JSC-1, yeşil/kırmızı ışıkta tip III kromatik iklimlendirme ve kırmızı/uzak-kırmızı ışıkta uzak-kırmızı ışık fotoaklimasyonu gerçekleştirerek PBS'sini yeniden şekillendirir6,7. Tüm bu çeşitlilikler, en düşük sağlam hemidiscoidal PBS fraksiyonuna ek olarak sakkaroz gradyanlarında başka PBS türleri olabileceğini göstermektedir. Örneğin, Synechococcus sp. PCC 7335 ve JSC-1 uzak kırmızı ışığa alıştığında aynı anda iki tür PBS bulunur8,13. PBS'yi karakteristik olmayan siyanobakteriyal bir suştan izole eden kişinin, olası PBS türlerini tanımlamak için sakkaroz gradyanındaki her kesiri analiz etmede daha dikkatli olması önerilir.
Genel olarak, bu protokol hücre bozulması için ucuz, basit ve hızlı bir yöntem sağlar. Bu yöntemin PBS'yi farklı hücre tipleri ve PBS bileşimleri ile farklı siyanobakterilerden izole etmek için güvenilir olduğu da gösterilmiştir.
Açıklamalar
Yazarlar rakip ilgiyi beyan etmeseler.
Teşekkürler
Yazarlar, ultracentrifuge'un rahat kullanımı için Technology Commons, College of Life Science, National Taiwan University'ye teşekkür ediyor. Siyanobakteri suşları Synechocystis sp. PCC 6803 ve Leptolyngbya sp. JSC-1 sırasıyla Dr. Chu, Tayvan Academia Sinica'daki Hsiu-An ve ABD Pennsylvania Eyalet Üniversitesi'nden Dr. Donald A. Bryant tarafından hediye edildi. Bu çalışma Bilim ve Teknoloji Bakanlığı (Tayvan) (109-2636-B-002-013- ve 110-2628-B-002-065-) ve Eğitim Bakanlığı (Tayvan) Yushan Genç Bilgin Programı (109V1102 ve 110V1102) tarafından finanse edildi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.1 mm glass beads | BioSpec | 11079101 | for PBS extraction |
| 13 mL centrifugation tube | Hitachi | 13PA | ultracentrifugation |
| 40 mL centrifugation tube | Hitachi | 40PA | ultracentrifugation |
| Acetic acid | Merck | 8.1875.2500 | for Coomassie Blue staining |
| B-HEPES medium | A modified cyanobacterial medium from BG-11 medium | ||
| Brilliant Blue R-250 | Sigma | B-0149 | for Coomassie Blue staining |
| Bromophenol blue | Wako pure chemical industries | 2-291 | protein loading buffer |
| Electronic balance | Radwag | WLC 2/A2/C/2 | for the wet weight measurement of cell pellets |
| Fluorescence spectrophotometer | Hitachi | F-7000 | Spectrophotometer |
| Glycerol | BioShop | Gly001.500 | protein loading buffer |
| High-Speed refrigerated centrifuge | Hitachi | CR22N | for buffer exchange |
| Leptolyngbya sp. JSC-1 | from Dr. Donald A. Bryant at Pennsylvania State University, USA. | ||
| Low temperature measurement accessory | Hitachi | 5J0-0112 | The accessory includes a transparent Dewar container for 77K fluorescence spectra |
| Methanol | Merck | 1.07018,2511 | for Coomassie Blue staining |
| Microcentrifuge | Thermo Fisher | Pico 21 | for PBS extraction |
| Mini-Beadbeater-16 | BioSpec | Model 607 | for PBS extraction |
| Potassium phosphate dibasic | PanReac AppliChem | 121512.121 | for PBS extraction |
| Potassium phosphate monobasic | PanReac AppliChem | 141509.121 | for PBS extraction |
| Screw cap vial | BioSpec | 10832 | for PBS extraction |
| SmartView Pro Imager | Major Science | UVCI-2300 | for Znic staining signal detection |
| Sodium dodecyl sulfate | Zymeset | BSD101 | protein loading buffer |
| Sucrose | Zymeset | BSU101 | for PBS isolation |
| Synechocystis sp. PCC 6803 | glucose-tolerant strain from Dr. Chu, Hsiu-An at Academia Sinica, Taiwan | ||
| Tris | BioShop | TRS 011.1 | protein loading buffer |
| Triton X-100 | BioShop | TRX 506.500 | for PBS extraction |
| Ultra 10 K membrane centrifugal filter | Millipore | UFC901024 | for buffer exchange |
| Ultra 3 K membrane centrifugal filter | Millipore | UFC500324 | for buffer exchange |
| Ultracentrifuge | Hitachi | CP80WX | ultracentrifugation |
| UV/Vis spectrophotometer | Agilent | Cary 60 | Spectrophotometer |
| Zinc sulfate | PanReac AppliChem | 131787.121 | for Znic staining |
| β-Mercaptoethanol | BioBasic | MB0338 | protein loading buffer |
Referanslar
- Bryant, D. A., Guglielmi, G., de Marsac, N. T., Castets, A. M., Cohen-Bazire, G. The structure of cyanobacterial phycobilisomes: A model. Archives of Microbiology. 123 (2), 113-127 (1979).
- Glazer, A. N. Phycobilisomes: Structure and dynamics. Annual Review of Microbiology. 36, 173-198 (1982).
- Glazer, A. N. Light harvesting by phycobilisomes. Annual Review of Biophysics and Biophysical Chemistry. 14 (1), 47-77 (1985).
- Liu, H., et al. Phycobilisomes supply excitations to both photosystems in a megacomplex in cyanobacteria. Science. 342 (6162), 1104 (2013).
- Bryant, D. A., Canniffe, D. P. How nature designs light-harvesting antenna systems: Design principles and functional realization in chlorophototrophic prokaryotes. Journal of Physics B: Atomic, Molecular and Optical Physics. 51 (3), 033001 (2018).
- Hirose, Y., et al. Diverse chromatic acclimation processes regulating phycoerythrocyanin and rod-shaped phycobilisome in cyanobacteria. Molecular Plant. 12 (5), 715-725 (2019).
- Gan, F., et al. Extensive remodeling of a cyanobacterial photosynthetic apparatus in far-red light. Science. 345 (6202), 1312-1317 (2014).
- Ho, M. Y., Gan, F., Shen, G., Bryant, D. A. Far-red light photoacclimation (FaRLiP) in Synechococcus sp. PCC 7335. II. Characterization of phycobiliproteins produced during acclimation to far-red light. Photosynthesis Research. 131 (2), 187-202 (2017).
- Ho, M. Y., et al. Extensive remodeling of the photosynthetic apparatus alters energy transfer among photosynthetic complexes when cyanobacteria acclimate to far-red light. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1861 (4), 148064 (2020).
- Sanfilippo, J. E., Garczarek, L., Partensky, F., Kehoe, D. M. Chromatic Acclimation in Cyanobacteria: A diverse and widespread process for optimizing photosynthesis. Annual Review of Microbiology. 73, 407-433 (2019).
- Grossman, A. R., Schaefer, M. R., Chiang, G. G., Collier, J. L. The phycobilisome, a light-harvesting complex responsive to environmental conditions. Microbiological Reviews. 57 (3), 725-749 (1993).
- Bryant, D. A., Glazer, A. N., Eiserling, F. A. Characterization and structural properties of the major biliproteins of Anabaena sp. Archives of Microbiology. 110 (1), 61-75 (1976).
- Soulier, N., Laremore, T. N., Bryant, D. A. Characterization of cyanobacterial allophycocyanins absorbing far-red light. Photosynthesis Research. 145 (3), 189-207 (2020).
- Guglielmi, G., Cohen-Bazire, G., Bryant, D. A. The structure of Gloeobacter violaceus and its phycobilisomes. Archives of Microbiology. 129 (3), 181-189 (1981).
- Zhang, J., et al. Structure of phycobilisome from the red alga Griffithsia pacifica. Nature. 551 (7678), 57-63 (2017).
- Li, Y., et al. Characterization of red-shifted phycobilisomes isolated from the chlorophyll f-containing cyanobacterium Halomicronema hongdechloris. Biochimica et Biophysica Acta. 1857 (1), 107-114 (2016).
- Herrera-Salgado, P., Leyva-Castillo, L. E., Rios-Castro, E., Gomez-Lojero, C. Complementary chromatic and far-red photoacclimations in Synechococcus ATCC 29403 (PCC 7335). I: The phycobilisomes, a proteomic approach. Photosynthesis Research. 138 (1), 39-56 (2018).
- Yamanaka, G., Glazer, A. N., Williams, R. C. Cyanobacterial phycobilisomes. Characterization of the phycobilisomes of Synechococcus sp. 6301. Journal of Biological Chemistry. 253 (22), 8303-8310 (1978).
- Gantt, E., Lipschultz, C. A., Grabowski, J., Zimmerman, B. K. Phycobilisomes from blue-green and red algae: Isolation criteria and dissociation characteristics. Plant Physiology. 63 (4), 615-620 (1979).
- Patel, A., Mishra, S., Pawar, R., Ghosh, P. K. Purification and characterization of C-Phycocyanin from cyanobacterial species of marine and freshwater habitat. Protein Expression and Purification. 40 (2), 248-255 (2005).
- Zolla, L., Bianchetti, M. High-performance liquid chromatography coupled on-line with electrospray ionization mass spectrometry for the simultaneous separation and identification of the Synechocystis PCC 6803 phycobilisome proteins. Journal of Chromatography A. 912 (2), 269-279 (2001).
- Soni, B., Kalavadia, B., Trivedi, U., Madamwar, D. Extraction, purification and characterization of phycocyanin from Oscillatoria quadripunctulata-Isolated from the rocky shores of Bet-Dwarka, Gujarat, India. Process Biochemistry. 41 (9), 2017-2023 (2006).
- Williams, J. G. K. . Methods in Enzymology. , 766-778 (1988).
- Brown Igor, I., et al. Polyphasic characterization of a thermotolerant siderophilic filamentous cyanobacterium that produces intracellular iron deposits. Applied and Environmental Microbiology. 76 (19), 6664-6672 (2010).
- Wang, L., et al. Isolation, purification and properties of an R-phycocyanin from the phycobilisomes of a marine red macroalga Polysiphonia urceolata. PLoS One. 9 (2), 87833 (2014).
- Berkelman, T. R., Lagarias, J. C. Visualization of bilin-linked peptides and proteins in polyacrylamide gels. Analytical Biochemistry. 156 (1), 194-201 (1986).
- Rigbi, M., Rosinski, J., Siegelman, H. W., Sutherland, J. C. Cyanobacterial phycobilisomes: Selective dissociation monitored by fluorescence and circular dichroism. Proceedings of the National Academy of Sciences. 77 (4), 1961-1965 (1980).
- Dubbs, J. M., Bryant, D. A. Molecular cloning and transcriptional analysis of the cpeBA operon of the cyanobacterium Pseudanabaena species PCC 7409. Molecular Microbiology. 5 (12), 3073-3085 (1991).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Zhang, S., Shen, G., Li, Z., Golbeck, J. H., Bryant, D. A. Vipp1 is essential for the biogenesis of Photosystem I but not thylakoid membranes in Synechococcus sp. PCC 7002. Journal Biological Chemistry. 289 (23), 15904-15914 (2014).
- Zhang, S., Bryant, D. A. Biochemical validation of the glyoxylate cycle in the cyanobacterium Chlorogloeopsis fritschii Strain PCC 9212. Journal Biological Chemistry. 290 (22), 14019-14030 (2015).
- Huang, J. Y., et al. Mutations of cytochrome b559 and Psbj on and near the QC site in photosystem II influence the regulation of short-term light response and photosynthetic growth of the cyanobacterium Synechocystis sp. PCC 6803. Biochemistry. 55 (15), 2214-2226 (2016).
- Li, Y., Lin, Y., Loughlin, P., Chen, M. Optimization and effects of different culture conditions on growth of Halomicronema hongdechloris - A filamentous cyanobacterium containing chlorophyll f. Frontiers in Plant Science. 5, 67 (2014).
- Bennett, A., Bogorad, L. Complementary chromatic adaptation in a filamentous blue-green alga. Journal of Cell Biology. 58 (2), 419-435 (1973).
- Su, X., Fraenkel, P. G., Bogorad, L. Excitation energy transfer from phycocyanin to chlorophyll in an apcA-defective mutant of Synechocystis sp. PCC 6803. Journal of Biological Chemistry. 267 (32), 22944-22950 (1992).
- Arteni, A. A., Ajlani, G., Boekema, E. J. Structural organisation of phycobilisomes from Synechocystis sp. strain PCC6803 and their interaction with the membrane. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1787 (4), 272-279 (2009).
- Kondo, K., Ochiai, Y., Katayama, M., Ikeuchi, M. The Membrane-associated CpcG2-phycobilisome in Synechocystis: A new photosystem I antenna. Plant Physiology. 144 (2), 1200-1210 (2007).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır