Method Article
בידוד ואפיון של פיקוביליזום שלם בציאנובקטריה
In This Article
Summary
הפרוטוקול הנוכחי מפרט את הבידוד של phycobililisomes מציאנובקטריה על ידי צנטריפוגציה באמצעות שיפוע צפיפות סוכרוז בלתי פוסק. השברים של phycobilisomes שלמים מאושרים על ידי ספקטרום פליטה פלואורסצנטי 77K וניתוח SDS-PAGE. שברי הפיזיקוביליוזום המתקבלים מתאימים להכתמה שלילית של TEM וניתוח ספקטרומטריית מסה.
Abstract
ב ציאנובקטריה, phycobilisome הוא קומפלקס חלבון אנטנה חיוני אשר קוצר אור ומעביר אנרגיה למערכות פוטו-מערכת I ו- II עבור פוטוכימיה. לימוד המבנה וההרכב של phycobilisome הוא עניין רב למדענים כי זה חושף את האבולוציה ואת הסטייה של פוטוסינתזה ציאנובקטריה. פרוטוקול זה מספק שיטה מפורטת וממוטבת לשבירת תאים ציאנובקטריאליים בעלות נמוכה על ידי מקצף חרוזים ביעילות. לאחר מכן ניתן לבודד את הפיזיקוביליוזום השלם מתמצית התא על ידי אולטרה-צנטריפוגציה הדרגתית של סוכרוז. שיטה זו הוכיחה שהיא מתאימה הן לדגם והן לציאנובקטריה שאינה מודל עם סוגי תאים שונים. הליך שלב אחר שלב מסופק גם כדי לאשר את השלמות והרכוש של phycobiliproteins על ידי ספקטרוסקופיית פלואורסצנטיות 77K ו- SDS-PAGE מוכתם על ידי אבץ גופרתי וכחול קומאסי. phycobilisome מבודד יכול גם להיות נתון ניתוחים מבניים נוספים קומפוזיציה. בסך הכל, פרוטוקול זה מספק מדריך התחלה מועיל המאפשר לחוקרים שאינם מכירים ציאנובקטריה לבודד ולאפיין במהירות פיקוביליזום שלם.
Introduction
Phycobilisome (PBS) הוא קומפלקס ענק של חלבון פיגמנט מסיס במים המתחבר לצד הציטופלסמי של מערכות הפוטו-מערכות בממברנות התילקואידיות של ציאנובקטריה1. PBS מורכב בעיקר מפיקוביליפרוטאינים צבעוניים וחלבוני מקשר חסרי צבע1,2. את phycobiliproteins ניתן לחלק לארבע קבוצות עיקריות: phycoeryththrin, phycoerythrocyanin, phycocyanin, ו allophycocyanin3. ארבע הקבוצות העיקריות סופגות אורכי גל שונים של אנרגיית אור בטווח של 490-650 ננומטר, אשר כלורופילים ספגו בצורה לא יעילה3. ה-PBS יכול לשמש כאנטנה לקצירת אור לאיסוף אנרגיית אור ולהעברתה ל-Photosystem II ו-I4.
המבנה וההרכב של PBS משתנים ממינים למינים. באופן קולקטיבי, שלוש צורות של phycobilisome (hemididial, בצורת צרור, בצורת מוט) זוהו במינים ציאנובקטריאליים שונים5. אפילו באותם מינים, הרכב ה-PBS משתנה בתגובה לסביבה, כגון איכות האור והדלדול התזונתי6,7,8,9,10,10,11. לכן, ההליך הניסיוני לבודד PBS מציאנובקטריה היה אינסטרומנטלי בחקר PBS12. במשך כמה עשורים, פרוטוקולים רבים ושונים בודדו את PBS וניתחו את המבנה, ההרכב והתפקוד שלו6,7,8,12,13,14,15,16,17. המגוון הרחב של שיטות לבידוד PBS אכן מספק גמישות בבידוד המתחם במינים שונים עם ריאגנטים ומכשירים שונים. עם זאת, זה גם עושה בחירת פרוטוקול מתאים קשה יותר עבור מדענים שאינם מכירים עם ציאנובקטריה ו- PBS. לכן, פרוטוקול כללי ופשוט מפותח בעבודה זו עבור אלה המעוניינים להתחיל בידוד PBS מן ציאנובקטריה.
השיטות לבידוד PBS מפרסומים קודמים מסוכמות כאן. מאז PBS הוא קומפלקס חלבון מסיס במים והוא מנותק בקלות, מאגר פוספט כוח יוני גבוה נדרש כדי לייצב PBS במהלך החילוץ18. מספר מאמרי מחקר המתארים שיטות לבידוד PBS מציאנובקטריום פורסמו בעבר. רוב השיטות דורשות ריכוז גבוה של מאגר פוספט8,14,15,18,19. עם זאת, ההליכים לשיבוש מכני של התאים משתנים, כגון מיצוי בסיוע חרוזי זכוכית, sonication20, ועיתונות צרפתית 6,8,14. phycobiliproteins שונים ניתן להשיג על ידי משקעים עם אמוניום סולפט20 ומטוהר על ידי HPLC21 או טור כרומטוגרפי22. מצד שני, PBS שלם יכול להיות מבודד בקלות על ידי צפיפות סוכרוז שיפוע ultracentrifugation6,8,15.
בפרוטוקול זה, ציאנובקטריום מודל אחד וציאנובקטריום אחד שאינו מודל שימשו כחומרים לבידוד PBS. הם מודל חד תאי גלוקוז סובלני Synechocystis sp. PCC 6803 (להלן Syn6803) ולא מודל חוט Leptolyngbya sp. JSC-1 (להלן JSC-1), בהתאמה 7,23,24. הפרוטוקול מתחיל על ידי שיבוש של ציאנובקטריה חד-תאית ונימה במאגר פוספט בעל חוזק יוני גבוה. לאחר תמוגה, supernatants נאספים על ידי צנטריפוגה ולאחר מכן מטופלים עם חומר ניקוי לא יוני (טריטון X-100) כדי solubilize חלבונים מסיסים במים מן הקרומים thylakoid. סך החלבונים המסיסים במים מוחלים על שיפוע צפיפות סוכרוז בלתי פוסק כדי לחלק את ה- PBS. שיפוע הסוכרוז הבלתי פוסק בפרוטוקול זה מורכב מארבעה פתרונות סוכרוז ומחיצות PBS שלם בשברים הנמוכים ביותר של שכבת סוכרוז25. ניתן לנתח את השלמות של PBS על ידי SDS-PAGE, כתמי אבץ, ספקטרוסקופיה פלואורסצנטית 77K6,7,8,26. שיטה זו מתאימה למדענים שמטרתם לבודד PBS שלם מציאנובקטריה ולחקור את תכונותיו הספקטרליות, המבניות וההרכביות.
ישנם מספר יתרונות של פרוטוקול זה. (1) שיטה זו מתוקננת וניתן להשתמש בה לבידוד PBS שלם הן מציאנובקטריה חד-תאית והן מציאנובקטריה נימית. רוב המאמרים מתארים את השיטה שחלה בכל סוג אחד של ציאנובקטריה4,7,8,12,13,14,16,18. (2) שיטה זו מבוצעת בטמפרטורת החדר, כאשר PBS מתנתק בטמפרטורה נמוכה19,27. (3) שיטה זו מתארת שימוש במקצף חרוזים כדי לשבש את התאים; לכן, זה זול ובטוח יותר מאשר עיתונות צרפתית בלחץ גבוה ונזק שמיעה אפשרי מ sonicator בשיטות אחרות8,13,14,20. (4) שיטה זו מבודדת PBS שלם על ידי צנטריפוגה אולטרה-צנטריפוגה הדרגתית סוכרוז. בדרך זו, PBS שלם עם גדלים שונים PBS מנותק חלקית ניתן להפריד בהתבסס על ריכוז סוכרוז.
Protocol
Synechocystis sp. PCC 6803, זן עמיד לגלוקוז מודל, הושג מד"ר צ'ו, סיו-אן באקדמיה סיניקה, טייוואן. Leptolyngbya sp. JSC-1, חוט שאינו מודל, הושג מד"ר דונלד א בראיינט באוניברסיטת פנסילבניה סטייט, ארה"ב.
1. תרבית תאים וקציר
- לחסן תאי Syn6803 או JSC-1 באמצעות לולאת חיסון מתכתית לתוך בקבוק חרוט 100 מ"ל המכיל 50 מ"ל של B-HEPES medium28. תרבית את התאים ב 30 °C תחת 50 μmol פוטונים m-2 s-1 (LED אור לבן) ב 1% (v /v) CO2 עם ערבוב מתמיד על ידי מערבל מגנטי (120 סל"ד) עד התרבות מגיעה לשלב צמיחה באמצע מעריכי (OD750 = 0.6-0.8).
הערה: לקצור את תרבית התא כאשר הצפיפות האופטית של התרבות ב 750 ננומטר (OD750) מגיע 0.6-0.8 על ידי העברה בקבוקון חדש. צפיפות אופטית שימשה באופן שגרתי להערכת צפיפות תאים מיקרוביאלית בתרביות נוזליות29. אורכי הגל מ 720-750 ננומטר שימשו במחקרים שונים למדידת צמיחה ציאנובקטריאלית30,31,32. בפרוטוקול זה, OD750 משמש כי JSC-1 יכול לייצר פיגמנטים לספוג אור אדום רחוק7. לחלופין, ריכוז כלורופיל שימש גם כדי למדוד את הצמיחה של ציאנובקטריה33. - העבר את תרבית התא (OD750 ~ 0.8) לבקבוק חרוט 1L ודלל אותו OD750 = 0.2 ב 500 מ"ל של מדיום B-HEPES. הגדל את התרבות עד לשלב הצמיחה המעריכי המאוחר (OD750 = 0.8-1.0) באותו מצב שהוזכר לעיל (שלב 1.1) ולאחר מכן לקצור את התרבות על ידי צנטריפוגה.
- צנטריפוגה התרבות ב 10,000 x g במשך 20 דקות בטמפרטורת החדר לחלוטין להשליך את supernatant.
הערה: ניתן לאחסן את כדורי התאים בטמפרטורה של -80 °C (80 °F) למשך עד 6 חודשים.
2. תמוגת תאים
- להשעות את כדורי התא ולשטוף פעמיים עם 0.75 M K-פוספט חוצץ, pH 7.
הערה: כדי ליצור מאגר K-פוספט של 0.75 M ב- pH 7, הכן 1.5 M של K2HPO4 ו- 1.5 M של KH2PO4 בנפרד. יש לערבב 615 מ"ל של 1.5 מ"ל K2HPO4 ו-385 מ"ל של 1.5 מיליון KH2PO4 כדי לקבל חיץ K-פוספט ב-1.5 מ' K-פוספט ב-pH 7. כל שעליך לעשות הוא לדלל אותו עם אותה כמות של ddH2O כדי להפוך 0.75 M K-פוספט חוצץ ב pH 7. - גלולה את התאים בצינורות צנטריפוגה 50 מ"ל על ידי צנטריפוגה ב 10,000 x g במשך 20 דקות בטמפרטורת החדר. השלך את supernatant ו resuspened התאים עם 0.75 M K-פוספט חוצץ. למדוד את המשקל הרטוב של הכדור על ידי איזון אלקטרוני resuspend 1 גרם משקל רטוב של הכדור ב 5 מ"ל של המאגר.
הערה: משקל רטוב של גלולה נמדד על ידי הפחתה במשקל של צינור צנטריפוגה ריק ממשקל צינור הצנטריפוגה המכיל את גלולה התא. - הוסף 1 מ"ל של השעיית תאים ו 0.4-0.6 גרם של חרוזי זכוכית 0.1 מ"מ (ראה טבלת חומרים) לתוך בקבוקון כובע בורג 2 מ"ל.
- לשבור את התאים עבור 30 s על ידי מקצף חרוזים (ראה טבלת חומרים). אפשר את הצינורות להתקרר באמבט מים בטמפרטורת החדר במשך 2 דקות ולחזור על מחזור שבירה 5 פעמים.
- לאחר תמוגה, צנטריפוגה הבקבוקונים ב 500 x g עבור 10 s בטמפרטורת החדר. לאסוף את supernatant עם פיפטה לתוך צינור צנטריפוגה 15 מ"ל. לשטוף את החרוזים עם 0.5 מ"ל של 0.75 M K-פוספט חוצץ פעם אחת, ולאחר מכן להעביר לאותו צינור צנטריפוגה.
- הוסף טריטון X-100 (2% w / v, ריכוז סופי) למתלה התא lysed ודגר על שייקר נדנדה (40 סל"ד) בטמפרטורת החדר עד הפתרון הופך הומוגני (~ 20 דקות).
- צנטריפוגה הצינורות ב 17,210 גרם במשך 20 דקות כדי להסיר את התאים שלמים ופסולת תאים גדולים. יש לאחסן את הסופר-נרטיב ללא שכבת המיצלה העליונה של טריטון בטמפרטורת החדר למשך עד שעה אחת.
הערה: הסופר-נרטיב מכיל שתי שכבות מופרדות. שכבת הטריטון X ההידרופובית העליונה מכילה חלבונים מחייבי כלורופיל ופיקוביליוזומים בצורת מוט הידרופובי6. השכבה המימית התחתונה מכילה PBS מסיס במים.
3. הכנת מאגרי שיפוע סוכרוז ובידוד PBS
- הפוך ארבעה ריכוזים של סוכרוז (2.0 M, 1.0 M, 0.75 M ו 0.5 M) ב 0.75 M K-פוספט חוצץ ב pH 7.
הערה: מומלץ להשתמש 1.5 M K-פוספט חוצץ ב pH 7 כדי להכין את שיפוע סוכרוז כי הוספת סוכרוז מדלל את הריכוז של מאגר K-פוספט. לאחר סוכרוז הוא מומס לחלוטין, להוסיף ddH2O כדי להתאים את הריכוז ל 0.75 M, pH 7. - מניחים 2.8 מ"ל של 2.0 מ"ל של סוכרוז בתחתית צינור הצנטריפוגה של 40 מ"ל ושכבת-על עם שלוש שכבות של פתרונות סוכרוז (8 מ"ל של 1.0 מ"ל; 12 מ"ל של 0.75 מ"ל ו-11 מ"ל של 0.5 מ"ל עבור צינור צנטריפוגה של 40 מ"ל), ולבסוף PBS המכיל את השבר העל-טבעי (3.0 מ"ל) (איור 1A).
הערה: בזהירות להוסיף את פתרון סוכרוז ולאפשר סוכרוז לרדת לאט מאוד בתוך הצינור. החזק את קצה פיפטה ממש מעל פני השטח של הפתרון בצינור בעת טעינת הפתרון. שכבות סוכרוז ניתן לראות כאשר הם שכבות לאט. - צנטריפוגה שיפועים וכתוצאה מכך ב 125,800 x g עבור ~ 16h-20 שעות ב 25 °C.NOTE: ultracentrifuge (ראה טבלת חומרים) נדרש עבור שלב זה.
- עם אולטרה צנטריפוגה, לדחוס את PBS מחולק ו phycobiliproteins בין השכבות. להקות כחולות ב-Syn6803 (רצועות סגולות שהוצגו ב-JSC-1) נצפו בממשקים (איור 1D).
- לאט לאט לאסוף את השברים עם פיפטה מהחלק העליון של שיפועי סוכרוז. הסר את הסוכרזה על ידי ריכוז חוזר ונשנה (3,500 x גרם במשך 20 דקות) ודילול השברים עם חיץ K-פוספט 0.75 M K-פוספט ביחידות סינון צנטריפוגליות ממברנה (10 K משקל מולקולרי לחתוך, ראה טבלת חומרים).
4. מדידת פלואורסצנטיות PBS ב 77K
הערה: פלואורימטר המצויד במיכל חנקן נוזלי (ראה טבלת חומרים) משמש למדידת ספקטרום פלואורסצנטיות ב-77K.
- לדלל את מדגם PBS מרוכז עם 0.75 M K-פוספט חוצץ כדי להשיג לפחות 500 μL.
הערה: הריכוזים של phycocyanin של דגימות היו ~ 4.2 מיקרוגרם mL-1 בהתבסס על הנוסחה: (OD615 0.474 x OD652)/5.34 [מ"ג / מ"ל]34. - מוסיפים 500 μL של דגימת PBS לצינור זכוכית שקוף ולהקפיא את הצינור בחנקן נוזלי עד שהוא קפוא לחלוטין. העבירו את הצינור הקפוא למיכל דיואר שקוף (ראו טבלת חומרים) שמולא מראש בחנקן נוזלי.
הערה: הקוטר הפנימי של צינור הזכוכית הוא 3 מ"מ בפרוטוקול זה. צינורות זכוכית דקים שימשו כדי למזער את הספיגה מחדש של פליטת אורך גל קצר במדגם. - בחר את אורכי הגל עירור עבור phycoerythrin ו phycocyanin להיות 550 ננומטר ו 580 ננומטר, בהתאמה.
הערה: פליטות פלואורסצנטיות נרשמו מ 560-800 ננומטר (עבור עירור 550 ננומטר) או 600-800 ננומטר (עבור עירור 580 ננומטר).
5. ניתוח דף SDS של PBS
- חוצץ להחליף את דגימות PBS מרוכז ב 0.75 M של K-פוספט עם 50 מ"מ של חיץ Tris (pH 8.0) ביחידות סינון צנטריפוגלי ממברנה (3K משקל מולקולרי לחתוך, ראה טבלת חומרים).
- ערבבו 50 μL של פתרון PBS עם 10 μL של 6x SDS מאגר טעינה [300 mM Tris pH 6.8, 12% (w/v) נתרן דודציל סולפט, 0.06% (w/v) כחול ברומפנול, 50% (v/v) גליצרול, 6% (v/v) β-Mercaptoethanol] (ראה טבלת חומרים) בצינור microcentrifuge ודגרה ב 95 °C (95 °C ( 10 דקות בבלוק חום.
- להפריד את דגימות החלבון על ידי SDS-PAGE (8%-20% (w / v) ג'ל פוליאקרילאמיד) ולהמשיך עם אבץ וכתמי Coomassie. ההליך המפורט תואר בהפניה8.
- להכתמת אבץ, יש לדגור על הג'ל בתמיסת ZnSO4 בגודל 50 מ"מ למשך 10 דקות בטמפרטורת החדר, לשטוף את הג'ל במים מזוקקים ולדמיין פלואורסצנטיות הנגרמת על ידי אבץ תחת הקרנת UV (312 ננומטר).
- עבור כתמים כחולים של Coomassie, דגירה על הג'ל במאגר הכתמים הכחול Coomassie [0.25% (w/v) של Coomassie R-250, 10% (v/v) של חומצה אצטית, 50% (v/v) של מתנול, ראה טבלת חומרים] למשך שעה אחת בטמפרטורת החדר. שטפו את הג'ל במים מזוקקים פעמיים כדי להסיר את מאגר הכתמים השיורי ודגרו את הג'ל עם חיץ destaining [10% (v/v) חומצה אצטית, 30% (v/v) מתנול] על שייקר נדנדה (40 סל"ד) בטמפרטורת החדר במהלך הלילה. דמיינו את הג'ל המוכתם במלואו באמצעות מצלמה דיגיטלית או סורק.
תוצאות
תאי Syn6803 ו- JSC-1 טופחו בבקבוקונים חרוטיים עם ערבוב מתמיד במדיום B-HEPES בטמפרטורה של 30 °C (תחת אור לבן LED (50 מיקרומול פוטונים m-2s-1) בתא צמיחה מלא 1% (v / v) CO2. בשלב הצמיחה המעריכית (OD750 = ~ 0.5), התאים היו תת-תרבותיים למדיום טרי עם OD750 צפיפות אופטית סופית = ~ 0.2. לאחר שהגיעו לשלב הצמיחה המעריכית המאוחרת (OD750 = 0.6-0.8), התרבויות נאספו וצנטריפוגות (10,000 x גרם בטמפרטורת החדר במשך 20 דקות). הסופר-ננט הושלך, וכדורי התא אוחסנו בטמפרטורה של מינוס 80 מעלות צלזיוס עד שהשלב הבא היה זמין.
כדי לשבור את התאים, התאים הופשרו תחילה בטמפרטורת החדר. התאים שובשו על ידי מכות חרוזים עם חרוזי זכוכית 0.1 מ"מ בתוך חיץ K-פוספט 0.75 M. תמוגת תאים מלאה מציגה את הסופר-נרטיב בצבע כחול-ירוק כהה לפני צנטריפוגה (איור 1B). לאחר solubilization על ידי טריטון X-100 וצנטריפוגה כדי להסיר את הממברנות הבלתי מסיסות ואת פסולת התאים, supernatant היה טעון על גבי פתרון שיפוע סוכרוז בצינור צנטריפוגה 40 מ"ל (איור 1C). לאחר 18 שעות של צנטריפוגה, PBS שלם עבר למרכז השיפוע כלהקה כחולה ברורה עבור Syn6803 ופס סגול עבור JSC-1. ההבדל בצבע שלהם נובע מהקומפוזיציות השונות של PBS ב- Syn6803 ו- JSC-1. PBS מ Syn6803 נושא phycocyanin35, ואילו PBS של JSC-1 נושאת phycocyanin ו phycoerythrin7. התוצאה של הפרדת שיפוע צפיפות סוכרוז של PBS מבודדת מראה כמה שברים של phycobiliproteins מנותק, ואת השבר הנמוך ביותר מייצג את PBS שלם (איור 1D).
ספקטרום הספיגה של השברים השונים של PBS המבודדים מ-JSC-1 ו-Syn6803 מושווה באיור 2A. ההליך המפורט של ספקטרום הקליטה תואר במאמרים7,8. ספקטרום הספיגה מ PBS מנותק ו PBS שלם של JSC-1 ו Syn6803 יש את אותו שיא ב 622 ננומטר, המקביל פיטוציאנין. ואת שיא ספיגת phycoerythrin ב 571 ננומטר נמצא הן PBS מנותק ו PBS שלם של JSC-1. Allophycocyanin מראה שיא קטין עם כתף ב 670 ננומטר בשברירי PBS שלמים של JSC-1 ו Syn6803. ההבדלים הספקטרליים מצביעים על כך שהמוט (phycocyanin) לליבה (allophycocyanin) יחס גבוה יותר ב- PBS מנותק מאשר בשבר PBS שלם, שכן התכונות הספקטרליות של phycobiliproteins נקבעו בעבר5. מאז PBS מנותק שברי PBS שלמים להראות ספקטרום ספיגה דומה ותכונות פליטה פלואורסצנטית בטמפרטורת החדר, ספקטרוסקופיה פלואורסצנטית 77K שימש אז כדי לנתח את השברים השונים מבודדים מן שיפוע סוכרוז. ספקטרום פליטה פלואורסצנטית 77K של PBS מנותק ושברים PBS שלמים התרגשו על ידי 580 ננומטר. לספקטרום הפליטה של ה-PBS המנותק יש שיא אחד חזק ב-650 ננומטר בסין6803 וב-JSC-1, המייצגים את הפליטה מפיקוקיאנין (איור 2B). ספקטרום הפליטה הפלואורסצנטי של ה-PBS השלם מראה שתי פסגות מקסימליות של פליטת פלואורסצנטית: החלשה ב-651 ננומטר והחזקה ב-684 ננומטר, החושפת את האנרגיה שנקטפה על ידי פיטוקיאנין הועברה ביעילות לאלופיקוציאנין ופולטים סופניים (ApcD ו-ApcE) בליבה9 (איור 2C). תכונות אלה ממחישות כי השברים הנמוכים ביותר במעבר הצבע סוכרוז מכילים PBS שלם.
PBS מנותק ו PBS שלם הופרדו על ידי SDS-PAGE על 8%-20% (w/v) SDS פוליאקרילמיד ג'ל הדרגתי ליניארי. α β תת-היחידות של פיטוציאנין ואלופיקוציאנין נראו על הג'ל ללא כתמים (איור 3A). הג'ל היה מוכתם לאחר מכן עם 10 מ"מ ZnSO4 במשך 10 דקות. phycobiliproteins המכילים כרומופור נצפו על ידי כתמי אבץ במהלך הקרנת UV8. יחידות משנה של Phycobiliprotein (14-21 kDa) הן פלואורסצנטיות מאוד, וה-ApcE (חץ) הראה פלואורסצנטיות חלשה (איור 3B). יתר על כן, כתמי Coomassie Blue מציגים את הרכב החלבון השונה בין שברי ה-PBS המנותקים לבין שברי ה-PBS השלמים (איור 3C). השברים העליונים מכילים חלבונים אחרים שאינם מסיסים במים PBS מכיוון שיותר חלבונים מוכתמים מאשר בשברים של PBS שלמים. PBS שלם ב-Syn6803 מציג רצועת ApcE (חץ) בולטת שחסרה בשברירי PBS המנותקים (איור 3C).
יחס עוצמת הקול בין תמצית PBS לבין שיפוע הסוכרוז הוא קריטי להשגת רצועות חדות בשיפוע סוכרוז לאחר ultracentrifugation. היחס המוצע של תמציות PBS solubilized לפתרון שיפוע סוכרוז הוא 1:10. בהתבסס על ניסיון קודם, ביצוע שיפוע סוכרוז בצינורות צנטריפוגה 40 מ"ל מראה רזולוציה גבוהה יותר מאשר שיפוע סוכרוז שנעשה בצינורות 13 מ"ל. שיפוע הסוכרוז הבלתי פוסק מתפזר עם הזמן בגלל רטט על הספסל. לכן, צינור צנטריפוגה 13 מ"ל יכול להיות בחירה טובה לטיפול הרבה דגימות בו זמנית. כדי להדגים זאת, שיפועי הסוכרוז בצינורות צנטריפוגה של 13 מ"ל ביחסים של 1:3 ו-1:10 הוכנו בין התמציות הגסות של Syn6803 או JSC-1 לפתרון שיפוע הסוכרוז (איור 4A). לאחר אולטרה-מרכזיזציה, שיפוע הסוכרוז שהוכן ביחס של 1:3 מציג רצועות רחבות יותר מאשר מעבר הצבע שנעשה ביחס של 1:10 (איור 4B). השברים הנמוכים ביותר של כל שיפוע מכילים PBS שלם, שאושר על ידי ספקטרוסקופיית פליטת פלואורסצנט 77K.

איור 1: שיבושים בתאי Syn6803 ו- JSC-1 ו- ultracentrifugation אולטרה-מרכזי הדרגתי של סוכרוז. (A) המחשה סכמטית של הכנת שיפוע הסוכרוז שהופסק בצינור צנטריפוגה של 40 מ"ל. (B) בקבוקוני כובע הבורג היו מלאים 0.4 גרם של חרוזי זכוכית 1 מ"ל של השעיית תא של Syn6803 או JSC-1, ולאחר מכן התאים היו lysed על ידי מקצף חרוזים. (C) העל-טבעי של תמצית סולוביליזציה של טריטון X-100 היה בשכבות בחלק העליון של שיפוע צפיפות סוכרוז. (D) לאחר צנטריפוגה למשך 18 שעות, שברי PBS הוצגו כפסים כחולים ברורים בשיפוע ב- Syn6803 וכפסים סגולים ב- JSC-1. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
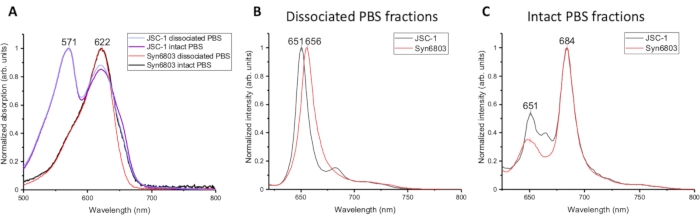
איור 2: אפיון ספקטרוסקופי של שברים שונים של שיפועי סוכרוז. (A) ספקטרום ספיגה של PBS מנותק ושברי PBS שלמים מ- JSC-1 ו- Syn6803. ספקטרום פליטת פלואורסצנטיות נמדד ב- 77 K באמצעות אורך הגל של עירור ב- 580 ננומטר עבור (B) שברי PBS מנותקים ו- (C) שברי PBS שלמים של Syn6803 ו- JSC-1. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
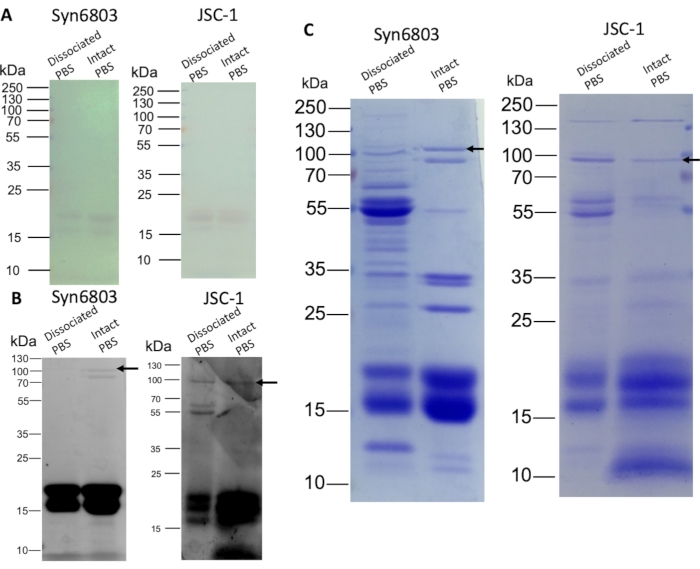
איור 3: ניתוח SDS-PAGE של PBS מבודד משיפועי סוכרוז. שברי ה-PBS המנותקים והשלמים היו מכומתים (20 מיקרוגרם חלבון לנתיב) ונטענו על ג'ל פוליאקרילמיד הדרגתי של 8%-20% (w/v). לאחר אלקטרופורזה ג'ל, הג'ל היה לדמיין על ידי כתמי אבץ וכתמים כחול Coomassie, לאחר מכן. (A) צבע הפיקוביליפרוטאינים נראה על הג'ל ללא כתמים. (B) ג'ל מוכתם באבץ מראה את הפלואורסצנטיות של phycobiliproteins. (ג) הג'ל המוכתם ב-Coomassie Blue מציג פיקוביליפרוטאינים וחלבונים אחרים. החצים מציינים את מיקומי ה- ApcE. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
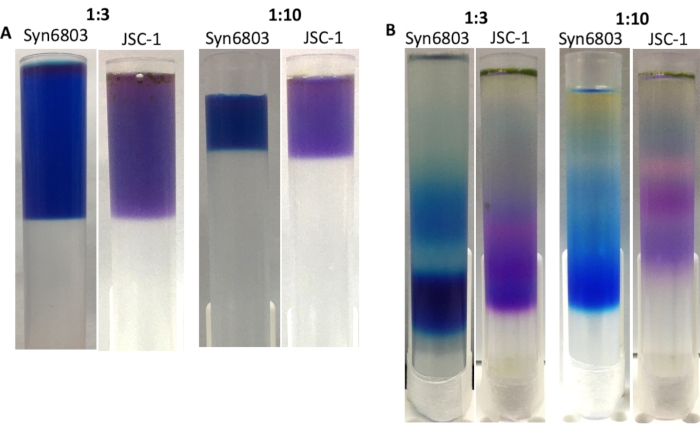
איור 4: שיפוע הסוכרוז המיוצר בצינורות צנטריפוגה של 13 מ"ל. היחסים בין התמצית הגולמית לבין פתרון שיפוע הסוכרוז מסומנים בחלק העליון של התמונות. (A) העל-טבעי של תמציות סולוביליזציה של טריטון X-100 של Syn6803 ו- JSC-1 היה בשכבות על פני שיפועים של צפיפות סוכרוז עם יחסים שונים של תמציות solubilized לפתרון שיפוע סוכרוז. (B) לאחר צנטריפוגה במשך 18 שעות, שברי PBS ב- Syn6803 ו- JSC-1 נצפו בשיפועי הסוכרוז. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
פרוטוקול זה מתאר שיטה פשוטה וסטנדרטית לבידוד PBS שלם בשני סוגים של ציאנובקטריה, דגם חד-תאי Syn6803, ו- JSC-1 שאינו דגם סיב. השלבים הקריטיים של הפרוטוקול הם הומוגניזציה של תאים ו ultracentrifugation על שיפוע צפיפות רציפה של סוכרוז. בדרך כלל, ההפרעה של תאים נימיים היא מסובכת יותר מאשר אלה חד תאיים. הגדלת כמות החומר ההתחלתי (המשקל הרטוב של גלולה התא) ואת החזרה של מכות חרוזים היו מועילים כדי להגדיל את התשואה של PBS מתאי ציאנובקטריאליים נימים. עבור ציאנובקטריום נימי, JSC-1, שלוש פעמים יותר תאים שימשו מאשר אחד חד תאי, Syn6803. בנוסף, כדי לשבור לחלוטין את ציאנובקטריום נימה, זה דורש חרוזים להכות יותר פעמים מאשר ציאנובקטריה חד תאית להתבונן בצבע כחלחל-סגול כהה במאגר החילוץ.
משך ההכאה חרוזים אינו מוצע יעלה על 30 s מאז הדגימות מחוממות במהלך כל מחזור מכות חרוזים. הצינורות מומלץ להתקרר בטמפרטורת החדר על ספסל (או באמבט מים) בין כל מחזור, כמו PBS שלם הוא מנותק בקלות בטמפרטורה נמוכה25. לכן, כל הליך בפרוטוקול זה מוצע להתבצע בטמפרטורת החדר. מאמרי מחקר רבים תיארו שיטות שונות לשיבוש תאים, כולל הומוגניזר בלחץ גבוה (צרפתית-עיתונות) או sonicator6,8,20. homogenizer טחנת חרוזים מוצע כי זה זול יותר, בטוח יותר, קל יותר לטיפול, מהיר יותר, נגיש יותר, ויעיל יותר בעיבוד דגימות מרובות בו זמנית.
Phycobilisomes להראות שלוש צורות שונות, hemidiscoidal, בצורת צרור, בצורת מוט5. הפיזיקוביליוזומים השלמים המבודדים באיור 2 שייכים לצורה ההמידיקלית כפי שנידונה בפרסומים קודמים7,13,36. עם זאת, השבר העליון המייצג PBS מנותק יכול להכיל גם PBS בצורת מוט. Syn6803 ו- JSC-1 מקודדים מקשר מוט ספציפי CpcL, אשר מציע את נוכחותו של PBS בצורת מוט בנוסף PBS6,37 hemidiscoidal hemidiscoidal. PBS בצורת רוד זוהה ישירות ב- Syn6803 אך לא ב- JSC-17,13,37. מצד שני, JSC-1 משפצת את ה-PBS שלה על ידי ביצוע התאקלמות כרומטית מסוג III באור ירוק/אדום ופוטוקלציה של אור אדום רחוק באור אדום/אדום 6,7. כל הגיוון הזה מצביע על כך שייתכן שיש סוגים אחרים של PBS בשיפועי סוכרוז, בנוסף לשבר PBS ההמידיקלי השלם הנמוך ביותר. לדוגמה, שני סוגים של PBS קיימים בו-זמנית כאשר Synechococcus sp. PCC 7335 ו- JSC-1 מסתגלים לאור אדום רחוק8,13. הוא הציע כי האדם מבודד PBS מזן ציאנובקטריאלי לא אופייני צריך להיות זהיר יותר בניתוח כל שבר בשיפוע סוכרוז כדי לזהות כל סוגים אפשריים של PBS.
בסך הכל, פרוטוקול זה מספק שיטה זולה, פשוטה ומהירה לשיבוש תאים. כמו כן הוכח כי שיטה זו אמינה לבודד PBS מציאנובקטריה שונה עם סוגי תאים שונים והרכבי PBS שונים.
Disclosures
המחברים מצהירים שאין עניין מתחרה.
Acknowledgements
המחברים מודים לטכנולוגיה קומונס, המכללה למדעי החיים, אוניברסיטת טייוואן הלאומית על השימוש הנוח של ultracentrifuge. הזנים הציאנובקטריאליים Synechocystis sp. PCC 6803 ו Leptolyngbya sp. JSC-1 היה מחונן ד"ר צ'ו, סיו-אן באקדמיה סיניקה, טייוואן, וד"ר דונלד א בראיינט באוניברסיטת מדינת פנסילבניה, ארה"ב, בהתאמה. עבודה זו מומנה על ידי משרד המדע והטכנולוגיה (טייוואן) (109-2636-B-002-013- ו-110-2628-B-002-065-) ומשרד החינוך (טייוואן) תוכנית המחקר הצעיר של יושן (109V1102 ו-110V1102).
Materials
| Name | Company | Catalog Number | Comments |
| 0.1 mm glass beads | BioSpec | 11079101 | for PBS extraction |
| 13 mL centrifugation tube | Hitachi | 13PA | ultracentrifugation |
| 40 mL centrifugation tube | Hitachi | 40PA | ultracentrifugation |
| Acetic acid | Merck | 8.1875.2500 | for Coomassie Blue staining |
| B-HEPES medium | A modified cyanobacterial medium from BG-11 medium | ||
| Brilliant Blue R-250 | Sigma | B-0149 | for Coomassie Blue staining |
| Bromophenol blue | Wako pure chemical industries | 2-291 | protein loading buffer |
| Electronic balance | Radwag | WLC 2/A2/C/2 | for the wet weight measurement of cell pellets |
| Fluorescence spectrophotometer | Hitachi | F-7000 | Spectrophotometer |
| Glycerol | BioShop | Gly001.500 | protein loading buffer |
| High-Speed refrigerated centrifuge | Hitachi | CR22N | for buffer exchange |
| Leptolyngbya sp. JSC-1 | from Dr. Donald A. Bryant at Pennsylvania State University, USA. | ||
| Low temperature measurement accessory | Hitachi | 5J0-0112 | The accessory includes a transparent Dewar container for 77K fluorescence spectra |
| Methanol | Merck | 1.07018,2511 | for Coomassie Blue staining |
| Microcentrifuge | Thermo Fisher | Pico 21 | for PBS extraction |
| Mini-Beadbeater-16 | BioSpec | Model 607 | for PBS extraction |
| Potassium phosphate dibasic | PanReac AppliChem | 121512.121 | for PBS extraction |
| Potassium phosphate monobasic | PanReac AppliChem | 141509.121 | for PBS extraction |
| Screw cap vial | BioSpec | 10832 | for PBS extraction |
| SmartView Pro Imager | Major Science | UVCI-2300 | for Znic staining signal detection |
| Sodium dodecyl sulfate | Zymeset | BSD101 | protein loading buffer |
| Sucrose | Zymeset | BSU101 | for PBS isolation |
| Synechocystis sp. PCC 6803 | glucose-tolerant strain from Dr. Chu, Hsiu-An at Academia Sinica, Taiwan | ||
| Tris | BioShop | TRS 011.1 | protein loading buffer |
| Triton X-100 | BioShop | TRX 506.500 | for PBS extraction |
| Ultra 10 K membrane centrifugal filter | Millipore | UFC901024 | for buffer exchange |
| Ultra 3 K membrane centrifugal filter | Millipore | UFC500324 | for buffer exchange |
| Ultracentrifuge | Hitachi | CP80WX | ultracentrifugation |
| UV/Vis spectrophotometer | Agilent | Cary 60 | Spectrophotometer |
| Zinc sulfate | PanReac AppliChem | 131787.121 | for Znic staining |
| β-Mercaptoethanol | BioBasic | MB0338 | protein loading buffer |
References
- Bryant, D. A., Guglielmi, G., de Marsac, N. T., Castets, A. M., Cohen-Bazire, G. The structure of cyanobacterial phycobilisomes: A model. Archives of Microbiology. 123 (2), 113-127 (1979).
- Glazer, A. N. Phycobilisomes: Structure and dynamics. Annual Review of Microbiology. 36, 173-198 (1982).
- Glazer, A. N. Light harvesting by phycobilisomes. Annual Review of Biophysics and Biophysical Chemistry. 14 (1), 47-77 (1985).
- Liu, H., et al. Phycobilisomes supply excitations to both photosystems in a megacomplex in cyanobacteria. Science. 342 (6162), 1104 (2013).
- Bryant, D. A., Canniffe, D. P. How nature designs light-harvesting antenna systems: Design principles and functional realization in chlorophototrophic prokaryotes. Journal of Physics B: Atomic, Molecular and Optical Physics. 51 (3), 033001 (2018).
- Hirose, Y., et al. Diverse chromatic acclimation processes regulating phycoerythrocyanin and rod-shaped phycobilisome in cyanobacteria. Molecular Plant. 12 (5), 715-725 (2019).
- Gan, F., et al. Extensive remodeling of a cyanobacterial photosynthetic apparatus in far-red light. Science. 345 (6202), 1312-1317 (2014).
- Ho, M. Y., Gan, F., Shen, G., Bryant, D. A. Far-red light photoacclimation (FaRLiP) in Synechococcus sp. PCC 7335. II. Characterization of phycobiliproteins produced during acclimation to far-red light. Photosynthesis Research. 131 (2), 187-202 (2017).
- Ho, M. Y., et al. Extensive remodeling of the photosynthetic apparatus alters energy transfer among photosynthetic complexes when cyanobacteria acclimate to far-red light. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1861 (4), 148064 (2020).
- Sanfilippo, J. E., Garczarek, L., Partensky, F., Kehoe, D. M. Chromatic Acclimation in Cyanobacteria: A diverse and widespread process for optimizing photosynthesis. Annual Review of Microbiology. 73, 407-433 (2019).
- Grossman, A. R., Schaefer, M. R., Chiang, G. G., Collier, J. L. The phycobilisome, a light-harvesting complex responsive to environmental conditions. Microbiological Reviews. 57 (3), 725-749 (1993).
- Bryant, D. A., Glazer, A. N., Eiserling, F. A. Characterization and structural properties of the major biliproteins of Anabaena sp. Archives of Microbiology. 110 (1), 61-75 (1976).
- Soulier, N., Laremore, T. N., Bryant, D. A. Characterization of cyanobacterial allophycocyanins absorbing far-red light. Photosynthesis Research. 145 (3), 189-207 (2020).
- Guglielmi, G., Cohen-Bazire, G., Bryant, D. A. The structure of Gloeobacter violaceus and its phycobilisomes. Archives of Microbiology. 129 (3), 181-189 (1981).
- Zhang, J., et al. Structure of phycobilisome from the red alga Griffithsia pacifica. Nature. 551 (7678), 57-63 (2017).
- Li, Y., et al. Characterization of red-shifted phycobilisomes isolated from the chlorophyll f-containing cyanobacterium Halomicronema hongdechloris. Biochimica et Biophysica Acta. 1857 (1), 107-114 (2016).
- Herrera-Salgado, P., Leyva-Castillo, L. E., Rios-Castro, E., Gomez-Lojero, C. Complementary chromatic and far-red photoacclimations in Synechococcus ATCC 29403 (PCC 7335). I: The phycobilisomes, a proteomic approach. Photosynthesis Research. 138 (1), 39-56 (2018).
- Yamanaka, G., Glazer, A. N., Williams, R. C. Cyanobacterial phycobilisomes. Characterization of the phycobilisomes of Synechococcus sp. 6301. Journal of Biological Chemistry. 253 (22), 8303-8310 (1978).
- Gantt, E., Lipschultz, C. A., Grabowski, J., Zimmerman, B. K. Phycobilisomes from blue-green and red algae: Isolation criteria and dissociation characteristics. Plant Physiology. 63 (4), 615-620 (1979).
- Patel, A., Mishra, S., Pawar, R., Ghosh, P. K. Purification and characterization of C-Phycocyanin from cyanobacterial species of marine and freshwater habitat. Protein Expression and Purification. 40 (2), 248-255 (2005).
- Zolla, L., Bianchetti, M. High-performance liquid chromatography coupled on-line with electrospray ionization mass spectrometry for the simultaneous separation and identification of the Synechocystis PCC 6803 phycobilisome proteins. Journal of Chromatography A. 912 (2), 269-279 (2001).
- Soni, B., Kalavadia, B., Trivedi, U., Madamwar, D. Extraction, purification and characterization of phycocyanin from Oscillatoria quadripunctulata-Isolated from the rocky shores of Bet-Dwarka, Gujarat, India. Process Biochemistry. 41 (9), 2017-2023 (2006).
- Williams, J. G. K. . Methods in Enzymology. , 766-778 (1988).
- Brown Igor, I., et al. Polyphasic characterization of a thermotolerant siderophilic filamentous cyanobacterium that produces intracellular iron deposits. Applied and Environmental Microbiology. 76 (19), 6664-6672 (2010).
- Wang, L., et al. Isolation, purification and properties of an R-phycocyanin from the phycobilisomes of a marine red macroalga Polysiphonia urceolata. PLoS One. 9 (2), 87833 (2014).
- Berkelman, T. R., Lagarias, J. C. Visualization of bilin-linked peptides and proteins in polyacrylamide gels. Analytical Biochemistry. 156 (1), 194-201 (1986).
- Rigbi, M., Rosinski, J., Siegelman, H. W., Sutherland, J. C. Cyanobacterial phycobilisomes: Selective dissociation monitored by fluorescence and circular dichroism. Proceedings of the National Academy of Sciences. 77 (4), 1961-1965 (1980).
- Dubbs, J. M., Bryant, D. A. Molecular cloning and transcriptional analysis of the cpeBA operon of the cyanobacterium Pseudanabaena species PCC 7409. Molecular Microbiology. 5 (12), 3073-3085 (1991).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Zhang, S., Shen, G., Li, Z., Golbeck, J. H., Bryant, D. A. Vipp1 is essential for the biogenesis of Photosystem I but not thylakoid membranes in Synechococcus sp. PCC 7002. Journal Biological Chemistry. 289 (23), 15904-15914 (2014).
- Zhang, S., Bryant, D. A. Biochemical validation of the glyoxylate cycle in the cyanobacterium Chlorogloeopsis fritschii Strain PCC 9212. Journal Biological Chemistry. 290 (22), 14019-14030 (2015).
- Huang, J. Y., et al. Mutations of cytochrome b559 and Psbj on and near the QC site in photosystem II influence the regulation of short-term light response and photosynthetic growth of the cyanobacterium Synechocystis sp. PCC 6803. Biochemistry. 55 (15), 2214-2226 (2016).
- Li, Y., Lin, Y., Loughlin, P., Chen, M. Optimization and effects of different culture conditions on growth of Halomicronema hongdechloris - A filamentous cyanobacterium containing chlorophyll f. Frontiers in Plant Science. 5, 67 (2014).
- Bennett, A., Bogorad, L. Complementary chromatic adaptation in a filamentous blue-green alga. Journal of Cell Biology. 58 (2), 419-435 (1973).
- Su, X., Fraenkel, P. G., Bogorad, L. Excitation energy transfer from phycocyanin to chlorophyll in an apcA-defective mutant of Synechocystis sp. PCC 6803. Journal of Biological Chemistry. 267 (32), 22944-22950 (1992).
- Arteni, A. A., Ajlani, G., Boekema, E. J. Structural organisation of phycobilisomes from Synechocystis sp. strain PCC6803 and their interaction with the membrane. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1787 (4), 272-279 (2009).
- Kondo, K., Ochiai, Y., Katayama, M., Ikeuchi, M. The Membrane-associated CpcG2-phycobilisome in Synechocystis: A new photosystem I antenna. Plant Physiology. 144 (2), 1200-1210 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved