Method Article
シアノバクテリアにおけるインタクトフィコビリソームの分離と特徴付け
要約
現在のプロトコルは、不連続なスクロース密度勾配を介して遠心分離によってシアノバクテリアからのフィコビリソームの分離を詳述する。77K蛍光発光スペクトルとSDS-PAGE分析により、インタクトなフィコビリソームの画分が確認されます。得られたフィコビリソーム画分は、TEMの陰性染色および質量分析分析に適しています。
要約
シアノバクテリアでは、フィコビリソームは光を収穫し、光化学のために光システムIとIIにエネルギーを伝達する重要なアンテナタンパク質複合体です。系統の構造と組成を研究することは、シアノバクテリアにおける光合成の進化と発散を明らかにするため、科学者にとって大きな関心事です。このプロトコルは、ビードビーターによって効率的にシアノバクテリア細胞を低コストで破壊する詳細かつ最適化された方法を提供します。その後、無傷のフィコビリソームを、ショ糖勾配超遠心分離によって細胞抽出物から分離することができる。この方法は、異なる細胞タイプのモデルおよび非モデルシアノバクテリアの両方に適している実証されている。77K蛍光分光法と硫酸亜鉛とクマシーブルー染色SDS-PAGEによるフィコビリタンパク質の完全性と性質を確認するためのステップバイステップの手順も提供されています。分離されたフィコビリソームは、さらなる構造解析および組成解析を行うこともできます。全体として、このプロトコルは、シアノバクテリアに精通していない研究者が無傷のフィコビリソームを迅速に単離し、特徴付けることを可能にする有用な開始ガイドを提供する。
概要
フィコビリソーム(PBS)は、シアノバクテリア1のチラコイド膜中の光系の細胞質側に付着する巨大な水溶性色素タンパク質複合体です。PBSは主に、着色されたフィコビリタンパク質と無色リンカータンパク質1,2で構成されています。フィコビリタンパク質は、フィコエリスリン、フィコエリコシアニン、フィコシアニン、アロフィコシアニン3の4つの主要なグループに分けることができます。4つの主要なグループは、クロロフィルが非効率的に吸収した490〜650nmの範囲で光エネルギーの異なる波長を吸収する3。PBSは光エネルギーを集め、それを光システムIIおよびI4に渡すライトハーベニングアンテナとして役立つことができる。
PBSの構造と組成は種によって異なります。総称して、異なるシアノバクテリア種5において、フィコビリソーム(ヘミディスコジアル、束状、および棒状)の3つの形状が同定されている。同種においても、PBSの組成は、光質や栄養枯渇などの環境に応じて変化する6,7,8,9,10,11。そこで、シアノバクテリアからPBSを単離する実験手順は、PBS12の研究に役立っています。数十年にわたり、多くの異なるプロトコルがPBSを分離し、その構造、組成、および機能6,7,8,12,13,14,15,16,17を分析してきました。PBSの分離のための多種多様な方法は確かに異なる試薬および器械と異なった種の複合体を単離する柔軟性を提供する。しかし、それはまた、シアノバクテリアやPBSに慣れていない科学者にとって、適切なプロトコルを選択することがより困難になります。したがって、チアノバクテリアからのPBS分離を開始することに興味がある人のために、この研究では一般化された簡単なプロトコルが開発されています。
前の出版物からPBSを分離する方法をここに要約します。PBSは水溶性タンパク質複合体であり容易に解約されるため、抽出時にPBSを安定化させるために高いイオン強度リン酸緩衝液が必要となる。チアノバクテリウムからのPBSの分離方法を記述したいくつかの研究記事が過去に公開されています。.ほとんどの方法は、高濃度のリン酸緩衝液8,14,15,18,19を必要とする。しかし、細胞の機械的破壊のための手順は、例えば、ガラスビーズ支援抽出、超音波20、およびフランスの圧知6、8,14など、様々です。異なるフィコビリタンパク質は、硫酸アンモニウム20で沈殿し、HPLC21またはクロマトグラフィーカラム22で精製することによって得ることができる。一方、無傷のPBSは、スクロース密度勾配超遠心分離6,8,15によって容易に単離することができる。
このプロトコルでは、1つのモデルシアノバクテリウムと1つの非モデルシアノバクテリウムがPBS分離の材料として使用されました。これらは、モデル単細胞グルコース耐性シネクロシスティスsp.PCC 6803(以下Syn6803)および非モデル糸状レプトレングビヤsp.JSC-1(以下JSC-1)、それぞれ7,23,24である。このプロトコルは、高イオン強度リン酸緩衝液中の単細胞および糸状シアノバクテリアの破壊によって始まります。溶解後、上清を遠心分離によって回収し、非イオン性洗剤(Triton X-100)で処理し、チラコイド膜から水溶性タンパク質を可溶化する。全水溶性タンパク質は、不連続なスクロース密度勾配に適用され、PBSを分画する。このプロトコルの不連続なスクロース勾配は、4つのスクロース溶液で構成され、スクロース層25の最下端に無傷のPBSを仕分ける。PBSの完全性はSDS-PAGE、亜鉛染色、および77K蛍光分光法6、7、8、26によって分析することができる。この方法は、シアノバクテリアから無傷のPBSを分離し、そのスペクトル、構造、および組成特性を研究することを目指す科学者に適しています。
このプロトコルには、いくつかの利点があります。(1)この方法は標準化されており、単細胞および糸状シアノバクテリアの両方から無傷のPBSを単離するために使用することができます。ほとんどの記事は、いずれかのタイプのシアノバクテリア4、7,8,12,13,14,16,18に適用される方法を記載しています。(2)この方法は室温で行い、PBSが低温19,27で解化するようにする。(3) この方法は、ビーズビーターを使用して細胞を破壊する方法を説明します。したがって、それは高圧フランスのプレスよりも安価で安全であり、他の方法で超音波処理器からの損傷を聞く可能性8、13、14、20。(4)この方法は、スクロース勾配超遠心分離により、そのままPBSを分離する。このようにして、異なるサイズおよび部分的に解離したPBSを有する無傷のPBSは、スクロース濃度に基づいて分離することができる。
プロトコル
シネコシスティスsp. PCC 6803は、モデルグルコース耐性株を、台湾のアカデミア・シニカのチュウ・シュアン博士から得た。非モデルフィラメントであるレプトロンビー sp. JSC-1 は、米国ペンシルベニア州立大学のドナルド・A・ブライアント博士から入手しました。
1. 細胞培養と収穫
- 金属接種ループを用いてSyn6803またはJSC-1細胞を50mLのB-HEPES培地28を含む100 mL円錐形フラスコに接種します。30°C下で30°C50 μmol光子m-2 s-1 (白色光LED)で細胞を1%(v/v)CO2 で培養し、磁気スターラー(120rpm)で一定の攪拌を行い、培養が中指数成長期(OD750 = 0.6-0.8)に達するまで培養します。
注:新しいフラスコに移すことによって、750 nm(OD750)で培養した光学密度が0.6-0.8に達した場合に細胞培養を収穫します。光学密度は、液体培養液中の微生物細胞密度を推定するために日常的に使用された29。720〜750nmの波長をシアノバクテリアの増殖を測定するための様々な研究に使用しました30,31,32。このプロトコルでは、JSC-1が遠赤色光7を吸収する顔料を生成できるため、OD750が使用されます。あるいは、シアノバクテリア33の増殖を測定するためにクロロフィル濃度も使用された。 - 細胞培養物(OD750 ~0.8)を1L円錐形フラスコに移し、500mLのB-HEPES培地中でOD750 =0.2に希釈します。上記と同じ条件(ステップ1.1)で後期指数成長期(OD750 =0.8-1.0)まで培養を成長させ、遠心分離によって培養物を収穫する。
- 室温で20分間10,000xg で培養を遠心し、上清を完全に捨てます。
注:細胞ペレットは、6ヶ月まで-80 °Cで保存することができます。
2. 細胞のライシス
- 細胞ペレットを懸濁し、0.75 M K-リン酸バッファー pH 7 で 2 回洗浄します。
注:pH 7で0.75 M Kリン酸バッファーを作るために、K2HPO4の1.5 MおよびKH2PO4の1.5 Mを別々に準備して下さい。1.5 M K2HPO4の615 mLと1.5M KH2PO4の385 mlを混合して、pH 7で1.5 M Kリン酸バッファーを得る。同量のddH2Oで希釈するだけで、pH7で0.75M K-リン酸バッファーを作ります。 - ペレットは、室温で20分間10,000 x g で遠心分離することにより50 mL遠心分離管で細胞をペレット化します。上清を捨て、0.75 M K-リン酸バッファーで細胞を再懸濁します。電子バランスでペレットの湿重量を測定し、バッファーの5mLにペレットの1gの湿潤重量を再懸濁する。
注:ペレットの湿式重量は、細胞ペレットを含む遠心管の重量から空の遠心管の重量を差し引くことによって測定した。 - セルサスペンション1mL、0.1mmガラスビーズ( 材料表参照)を2mLスクリューキャップバイアルに加えます。
- ビーズビーターで30 sのセルを分割します( 材料表を参照)。チューブを室温の水浴で2分間冷却し、破断サイクルを5回繰り返します。
- リシス後、バイアルを室温で10sの場合は500xgで遠心する。 15 mL遠心チューブにピペットで上清を収集します。0.5 mLの0.75 M K-リン酸バッファーでビーズを1回洗い、同じ遠心管に移します。
- Lysed細胞懸濁液にTriton X-100(2%w/v、最終濃度)を加え、溶液が均質になるまで室温(40rpm)でロッキングシェーカー(40rpm)でインキュベートします(〜20分)。
- チューブを17,210gで20分間遠心分離し、無傷の細胞と大きな細胞の破片を除去します。上トリトンミセル層を含まない上清を室温で1時間保存します。
注: 上清には 2 つの分離されたレイヤーが含まれています。上の疎水性トリトンX層は、クロロフィル結合タンパク質および疎水性棒状のフィコビリソーム6を含む。下層水層は水溶性PBSを含む。
3. スクロースの勾配バッファーとPBS分離の調製
- pH 7で4つの濃度のショ糖(2.0 M、1.0 M、0.75 Mおよび0.5 M)を0.75 M K-リン酸緩衝液で作ります。
注:スクロースを添加するとK-リン酸緩衝液の濃度が希薄化するため、pH 7で1.5M K-リン酸バッファーを使用してスクロース勾配を調製することが推奨されます。スクロースを完全に溶解させた後、ddH2Oを加えて濃度を0.75M、pH7に調整します。 - 2.0 Mショ糖バッファーの 2.8 mL を 40 mL 遠心分離管の下部に配置し、3 層のショ糖溶液(1.0 M の 8 mL、0.75 M の 12 mL、0.5 M の 11 mL を 40 mL 遠心分離管)に重ね合わせ、最後に PBS 含有の超遠分率 (図 1)) を配置します。
注:慎重にスクロース溶液を追加し、スクロースがチューブの内部に非常にゆっくりと落とすようにします。ピペットチップをチューブ内の溶液表面のすぐ上に持ち、溶液をロードします。スクロース層は、ゆっくりと層化すると観察できる。 - 25°Cで〜16h-20 hの125,800 x g で得られた勾配の遠心分離:このステップには超遠心分離機( 材料表を参照)が必要です。
- 超遠心分離時に、画層間の分画されたPBSとフィコビリタンパク質を凝縮する。インターフェースでは、Syn6803の青色帯(JSC-1に示された紫色のバンド)が観察されました(図1D)。
- ショ糖勾配の上からピペットで分数をゆっくりと収集します。繰り返し濃縮(3,500 x g 20分間)、膜遠心フィルター単位で0.75 M K-リン酸バッファーで分画を希釈することにより、スクロースを除去します(10 K分子量カットオフ、 材料表を参照)。
4. 77KでのPBS蛍光測定
注:液体窒素容器を搭載した蛍光計( 材料表参照)を用いて、77Kで蛍光スペクトルを測定します。
- 濃縮したPBSサンプルを0.75 M K-リン酸バッファーで希釈し、少なくとも 500 μL を得ます。
注:サンプルのフィコシアニン濃度は、式に基づいて〜4.2 μg mL-1 であった:(OD615 0.474 x OD652)/5.34[mg/mL]34。 - 透明なガラスチューブにPBSサンプル500μLを加え、完全に凍結するまで液体窒素でチューブを凍結します。液体窒素であらかじめ充填された透明なデュワーコンテナ( 材料表を参照)に凍結チューブを移動します。
注:ガラス管の内径は、このプロトコルでは3mmです。薄いガラス管を用いて、試料中の短波長発光の再吸収を最小限に抑えた。 - フィコエリスリンとフィコシアニンの励起波長をそれぞれ550 nmと580 nmに選択します。
注:蛍光放出は560-800 nm(550 nm励起用)または600-800 nm(580 nm励起用)から記録されました。
5. PBSのSDS-ページ分析
- バッファー交換は、膜遠心フィルター単位でトリスバッファー(pH 8.0)の50 mMとK-リン酸の0.75 Mで濃縮PBSサンプルを交換します (3K分子量カットオフ, 材料表参照)。
- 6x SDSローディングバッファの10 μLでPBS溶液50 μLを混合する[300 mM Tris pH 6.8、 12%(w/v)ドデシル硫酸ナトリウム、0.06%(w/v)ブロフェンノールブルー、50%(v/v)グリセロール、6%(v/v)βメルカプトエタノール]マイクロ遠心チューブ( 材料表を参照)、95°Cで95°Cで熱ブロックで10分間インキュベートします。
- タンパク質サンプルをSDS-PAGE(8%-20%(w/v)ポリアクリルアミドゲル)で分離し、亜鉛とクマシー染色を継続します。詳細な手順については、Reference8 で説明されています。
- 亜鉛染色の場合、ゲルを室温で10分間50 mM ZnSO4 溶液でインキュベートし、蒸留水でゲルを洗浄し、UV照射(312nm)下で亜鉛誘導蛍光を可視化します。
- クマシーブルー染色の場合、クーマシーブルー染色バッファー[0.25%(w/v)のクーマッシーR-250、酢酸の10%(v/v)、メタノールの50%(v/v)、室温で1時間の 材料表を参照してください。蒸留水でゲルを2回洗浄して残留染色バッファーを除去し、ゲルを脱染色バッファー[10%(v/v)酢酸、30%(v/v)メタノール)を室温でロッキング シェーカー(40 rpm)でインキュベートします。デジタルカメラまたはスキャナで完全にデステインゲルを可視化します。
結果
Syn6803およびJSC-1細胞は、1%(v/v)CO2で満たされた成長室で、B-HEPES培地で一定の攪拌を行い、LED白色光(50μmol光子m-2s-1)下で円錐形フラスコで培養した。指数成長期(OD750=〜0.5)において、細胞を最終光学密度OD750=〜0.2で新鮮な培地にサブ培養した。後期指数成長相(OD750 = 0.6-0.8)に達した後、培養物を回収し、遠心分離(20分間室温で10,000 x g)した。上清を廃棄し、次の工程が利用可能になるまで細胞ペレットを−80°Cで保存した。
細胞を破壊するために、細胞は室温で最初に解凍した。細胞は0.75 M K-リン酸緩衝液の中で0.1 mmガラスビーズとビードビートによって破壊された。完全な細胞のリシスは、遠心分離前に濃い青色・緑色の上清を示す(図1B)。トリトンX-100と不溶性膜および細胞デブリを除去する遠心分離による可溶化後、上清を40mL遠心管内のスクロース勾配溶液の上部に積み込んだ(図1C)。18時間の遠心分離の後、無傷のPBSは、Syn6803用の透明な青いバンドとJSC-1の紫色のバンドとしてグラデーションの中心に移動しました。その色の違いは、Syn6803 と JSC-1 の PBS の異なる組成物から生じます。Syn6803のPBSはフィコシアニン35を運び、JSC-1のPBSはフィコシアニンとフィコエリスリン7を運ぶ。単離されたPBSのショ糖密度と勾配分離の結果は、解離されたフィコビリタンパク質の数画を示し、最も低い分数は無傷のPBSを表す(図1D)。
JSC-1およびSyn6803から分離されたPBSの異なる画分の吸収スペクトルを図2Aで比較した。吸収スペクトルの詳細な手順は、記事7,8に記載されている。JSC-1およびSyn6803の解離されたPBSと無傷のPBSからの吸収スペクトルは、フィコシアニンに相当する622 nmで同じピークを有する。571 nmのフィコエリスリン吸収ピークは、JSC-1の解解化されたPBSと無傷のPBSの両方に見られる。アロフィコシアニンは、JSC-1およびSyn6803の無傷のPBS画分において670 nmの肩を有するマイナーピークを示す。スペクトルの違いは、フィコビリタンパク質のスペクトル特性が以前に決定されていたように、ロッド(フィコシアニン)コア(同種フィコシアニン)比が、完全なPBS画分よりも解心したPBSにおいてより高いことを示す。解離したPBSと無傷のPBS画分は、室温で同様の吸収スペクトルと蛍光発光特徴を示すため、77K蛍光分光法を用いて、ショ糖勾配から分離された異なる画分を分析した。解約されたPBSの77K蛍光発光スペクトルと無傷のPBS画分は580nmで励起した。解離されたPBSの発光スペクトルは、Syn6803およびJSC-1において〜650nmで1つの強いピークを有し、フィコシアニンからの放出を表す(図2B)。インタクトPBSの蛍光発光スペクトルは、651nmの弱い蛍光発光ピークを示し、684nmでフィコシアニンによって収穫されたエネルギーをコア9のアロフィコシアニンおよび末端エミッタ(ApcDおよびApcE)に効率的に移したことを明らかにする(図2C)。これらの特徴は、スクロース勾配の最も低い分数に無傷のPBSが含まれていることを示す。
解離されたPBSと無傷のPBSを、SDS-PAGEで8%-20%(w/v)SDSポリアクリルアミド線形勾配ゲルで分離した。フィコシアニンおよびアロフィコシアニンのαおよびβサブユニットは、染色せずにゲルに見えた(図3A)。その後、ゲルを10 mM ZnSO4で10分間染色した。この染色体含有フィコビリタンパク質は、UV照射時の亜鉛染色により観察された8。フィコビリタンパク質サブユニット(14-21 kDa)は強く蛍光であり、ApcE(矢印)は弱い蛍光を示した(図3B)。また、クマシーブルー染色は、解離したPBS画分と無傷のPBS画分との間の異なるタンパク質組成を示す(図3C)。上部の画分は、無傷のPBS画分よりも多くのタンパク質が染色されるため、他の非PBS水溶性タンパク質を含む。Syn6803の無傷のPBSは、解約されたPBS画分に欠けている顕著なApcEバンド(矢印)を示す(図3C)。
PBS抽出物とスクロース勾配の体積比は、超遠心後のスクロース勾配で鋭いバンドを得るために重要である。スクロースの勾配溶液に対する可溶化したPBS抽出物の推奨比率は1:10である。これまでの経験に基づいて、40 mL遠心分離管でスクロース勾配を作ることは、13 mLチューブで作られたスクロース勾配よりも高い解像度を示しています。不連続なスクロース勾配はベンチの振動のために時間の経過とともに拡散する。したがって、13 mL遠心分離管は、多数のサンプルを同時に取り扱う場合に適しています。これを実証するために、1:3および1:10の比率で13mL遠心管のショ糖勾配が、スクロース勾配溶液にSyn6803またはJSC-1の粗抽出物との間に調製された(図4A)。超遠心分離後、比率1:3で調製したショ糖勾配は、比率1:10で作られた勾配よりも広いバンドを表示する(図4B)。各勾配の最も低い画分は、77K蛍光発光分光法によって確認された無傷のPBSを含む。

図1:Syn6803およびJSC-1細胞の破壊およびショ糖勾配超遠心分離. (A)40 mL遠心管で中止されたショ糖勾配を調製する模式的な図。(B)スクリューキャップバイアルは、0.4gのガラスビーズと1mLのセル懸濁液をSyn6803またはJSC-1で満たし、次いでビーズビーターによって細胞を取り付けた。(C)トリトンX-100の上清を、ショ糖濃度勾配の上に重畳した。(D) 18時間の遠心分離後、PBS画分は、Syn6803の勾配では透明な青いバンド、JSC-1では紫色のバンドとして可視化された。 この図の大きなバージョンを表示するには、ここをクリックしてください。
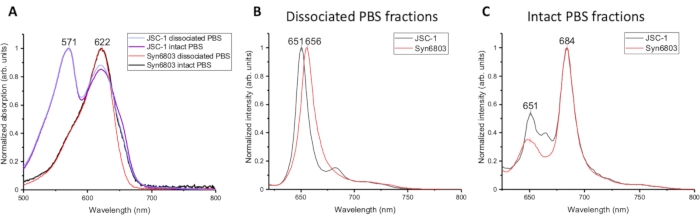
図2:スクロース勾配の異なる画分の分光学的特徴分析. (A)JSC-1およびSyn6803からの解離されたPBSおよび無傷のPBS画分の吸収スペクトル。蛍光発光スペクトルは、(B)解像されたPBS画分と(C)Syn6803およびJSC-1の無傷のPBS画分に対して580nmの励起波長を用いて77Kで測定した。 この図の大きなバージョンを表示するには、ここをクリックしてください。
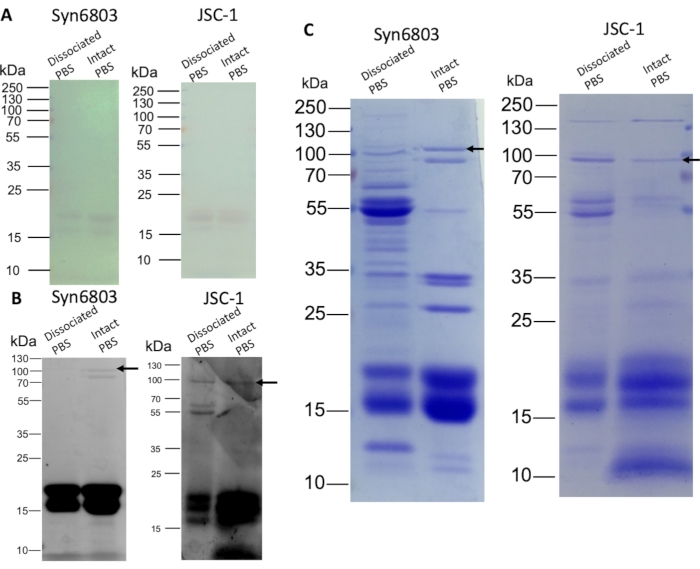
図3:スクロース勾配から分離されたPBSのSDS-PAGE分析 解約および無傷のPBS画分を定量化し(1レーン当たり20μgのタンパク質)、8%-20%(w/v)勾配ポリアクリルアミドゲルにロードした。ゲル電気泳動後、亜鉛染色とクマシーブルー染色によりゲルを可視化し、その後に染色した。(A)フィコビリタンパク質の色は染色せずにゲルに見える。(B)亜鉛染色ゲルは、フィコビリタンパク質の蛍光を示す。(C)クマシーブルーで染色されたゲルは、フィコビリタンパク質および他のタンパク質を示す。矢印はApcEの位置を示します。 この図の大きなバージョンを表示するには、ここをクリックしてください。
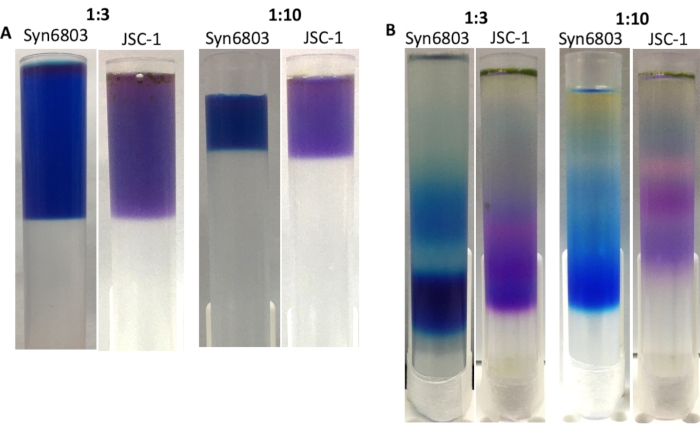
図4:13 mL遠心分離管で作られたスクロース勾配。 粗抽出物とスクロース勾配溶液の比率は、画像の上部にマークされています。(A)Syn6803およびJSC-1のTriton X-100可溶化抽出物の上清を、ショ糖勾配溶液に対する可溶化抽出物の比率が異なるショ糖密度勾配に重ね合わせていた。(B)18時間の遠心分離後、Sucrose勾配においてSyn6803およびJSC-1におけるPBS画分が観察された。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
このプロトコルは、シアノバクテリア、単細胞モデルSyn6803、および糸状非モデルJSC-1で無傷のPBSを単離するための簡単で標準的な方法を説明しています。プロトコルの重要なステップは、セルの均質化とスクロースの不連続な密度勾配の超遠心化です。一般的に、糸状細胞の破壊は単細胞細胞よりも複雑である。出発物質の量(細胞ペレットの湿重量)およびビーズ叩きの繰り返し量を増加させることは、糸状シアノバクテリア細胞からのPBSの収率を高めるのに役立った。糸状シアノバクテリウムについては、JSC-1、単細胞1よりも3倍多くの細胞を使用した、Syn6803。さらに、糸状シアノバクテリウムを完全に破壊するには、抽出バッファー内の濃い青紫色を観察するために、単細胞シアノバクテリアよりもビードビートを多く必要とする。
ビーズの叩きサイクルの間にサンプルが加熱されるため、ビーズの打ち負かしの持続時間は30 sを超えることは示唆されていない。チューブは、各サイクルの間のベンチ(または水浴中)の室温で冷却することをお勧めします。したがって、このプロトコルのすべての手順は、室温で実行することが示唆されています。多くの研究記事は、高圧ホモジナイザー(フレンチプレス)またはソニカレーター6,8,20を含む異なる細胞破壊法を説明しています。ビーズミルホモジナイザーは、複数のサンプルを同時に処理する方が安価で安全で、取り扱いが簡単で、より高速で、アクセスしやすく、効率的であるため、推奨されます。
フィコビリソームは、半球状、束型、および棒状の3つの異なる形状を示す5。図2で分離された無傷のフィコビリソームは、以前の出版物7,13,36で説明したように、片分裂形状に属する。しかし、解き分けされたPBSを表す上端分は、棒状のPBSを含むこともできる。Syn6803およびJSC-1は、ヘミスディスコドPBS6,37に加えて棒状PBSの存在を示唆する特定のロッドコアリンカーCpcLをコードする。ロッド型のPBSはSyn6803で直接同定されていますが、JSC-17,13,37では同定されていません。一方、JSC-1は、緑色/赤色光でIII型色度順応を行い、赤/遠赤色光6,7で遠赤色光順化することでPBSを改造します。これらすべての相違は、最も低い無傷の半分裂性PBS画分に加えて、スクロース勾配に他のタイプのPBSがある可能性があることを示している。例えば、2種類のPBSが同時に存在するのは、SYNechococcus sp. PCC 7335とJSC-1が極赤色の光8,13に順応する時である。特徴のないシアノプター菌株からPBSを単離する人は、スクロース勾配の各画分を分析してPBSの可能なタイプを特定する際に、より慎重であるべきであることが示唆される。
全体的に見て、このプロトコルは、セルの中断のための安価でシンプルで高速な方法を提供します。また、この方法は、異なる細胞タイプおよびPBS組成物を有する異なるシアノバクテリアからPBSを分離する信頼性が高いことが実証されている。
開示事項
著者らは競合する関心を宣言しない。
謝辞
著者らは、超遠心分離機の便利な使用のために、国立台湾大学ライフサイエンス大学テクノロジー・コモンズに感謝している。シアノバクテリア株 シネコシスティス sp.PCC 6803と レプトリンビヤ sp.JSC-1は、米国ペンシルベニア州立大学のアカデミア・シニカのチュウ博士、シーウアン、ドナルド・A・ブライアント博士からそれぞれ贈られました。この研究は、理工省(台湾)(109-2636-B-002-013-および110-2628-B-002-065-)と文部省(台湾)の湯山若手学者プログラム(109V11102および110V1102)によって資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 0.1 mm glass beads | BioSpec | 11079101 | for PBS extraction |
| 13 mL centrifugation tube | Hitachi | 13PA | ultracentrifugation |
| 40 mL centrifugation tube | Hitachi | 40PA | ultracentrifugation |
| Acetic acid | Merck | 8.1875.2500 | for Coomassie Blue staining |
| B-HEPES medium | A modified cyanobacterial medium from BG-11 medium | ||
| Brilliant Blue R-250 | Sigma | B-0149 | for Coomassie Blue staining |
| Bromophenol blue | Wako pure chemical industries | 2-291 | protein loading buffer |
| Electronic balance | Radwag | WLC 2/A2/C/2 | for the wet weight measurement of cell pellets |
| Fluorescence spectrophotometer | Hitachi | F-7000 | Spectrophotometer |
| Glycerol | BioShop | Gly001.500 | protein loading buffer |
| High-Speed refrigerated centrifuge | Hitachi | CR22N | for buffer exchange |
| Leptolyngbya sp. JSC-1 | from Dr. Donald A. Bryant at Pennsylvania State University, USA. | ||
| Low temperature measurement accessory | Hitachi | 5J0-0112 | The accessory includes a transparent Dewar container for 77K fluorescence spectra |
| Methanol | Merck | 1.07018,2511 | for Coomassie Blue staining |
| Microcentrifuge | Thermo Fisher | Pico 21 | for PBS extraction |
| Mini-Beadbeater-16 | BioSpec | Model 607 | for PBS extraction |
| Potassium phosphate dibasic | PanReac AppliChem | 121512.121 | for PBS extraction |
| Potassium phosphate monobasic | PanReac AppliChem | 141509.121 | for PBS extraction |
| Screw cap vial | BioSpec | 10832 | for PBS extraction |
| SmartView Pro Imager | Major Science | UVCI-2300 | for Znic staining signal detection |
| Sodium dodecyl sulfate | Zymeset | BSD101 | protein loading buffer |
| Sucrose | Zymeset | BSU101 | for PBS isolation |
| Synechocystis sp. PCC 6803 | glucose-tolerant strain from Dr. Chu, Hsiu-An at Academia Sinica, Taiwan | ||
| Tris | BioShop | TRS 011.1 | protein loading buffer |
| Triton X-100 | BioShop | TRX 506.500 | for PBS extraction |
| Ultra 10 K membrane centrifugal filter | Millipore | UFC901024 | for buffer exchange |
| Ultra 3 K membrane centrifugal filter | Millipore | UFC500324 | for buffer exchange |
| Ultracentrifuge | Hitachi | CP80WX | ultracentrifugation |
| UV/Vis spectrophotometer | Agilent | Cary 60 | Spectrophotometer |
| Zinc sulfate | PanReac AppliChem | 131787.121 | for Znic staining |
| β-Mercaptoethanol | BioBasic | MB0338 | protein loading buffer |
参考文献
- Bryant, D. A., Guglielmi, G., de Marsac, N. T., Castets, A. M., Cohen-Bazire, G. The structure of cyanobacterial phycobilisomes: A model. Archives of Microbiology. 123 (2), 113-127 (1979).
- Glazer, A. N. Phycobilisomes: Structure and dynamics. Annual Review of Microbiology. 36, 173-198 (1982).
- Glazer, A. N. Light harvesting by phycobilisomes. Annual Review of Biophysics and Biophysical Chemistry. 14 (1), 47-77 (1985).
- Liu, H., et al. Phycobilisomes supply excitations to both photosystems in a megacomplex in cyanobacteria. Science. 342 (6162), 1104 (2013).
- Bryant, D. A., Canniffe, D. P. How nature designs light-harvesting antenna systems: Design principles and functional realization in chlorophototrophic prokaryotes. Journal of Physics B: Atomic, Molecular and Optical Physics. 51 (3), 033001 (2018).
- Hirose, Y., et al. Diverse chromatic acclimation processes regulating phycoerythrocyanin and rod-shaped phycobilisome in cyanobacteria. Molecular Plant. 12 (5), 715-725 (2019).
- Gan, F., et al. Extensive remodeling of a cyanobacterial photosynthetic apparatus in far-red light. Science. 345 (6202), 1312-1317 (2014).
- Ho, M. Y., Gan, F., Shen, G., Bryant, D. A. Far-red light photoacclimation (FaRLiP) in Synechococcus sp. PCC 7335. II. Characterization of phycobiliproteins produced during acclimation to far-red light. Photosynthesis Research. 131 (2), 187-202 (2017).
- Ho, M. Y., et al. Extensive remodeling of the photosynthetic apparatus alters energy transfer among photosynthetic complexes when cyanobacteria acclimate to far-red light. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1861 (4), 148064 (2020).
- Sanfilippo, J. E., Garczarek, L., Partensky, F., Kehoe, D. M. Chromatic Acclimation in Cyanobacteria: A diverse and widespread process for optimizing photosynthesis. Annual Review of Microbiology. 73, 407-433 (2019).
- Grossman, A. R., Schaefer, M. R., Chiang, G. G., Collier, J. L. The phycobilisome, a light-harvesting complex responsive to environmental conditions. Microbiological Reviews. 57 (3), 725-749 (1993).
- Bryant, D. A., Glazer, A. N., Eiserling, F. A. Characterization and structural properties of the major biliproteins of Anabaena sp. Archives of Microbiology. 110 (1), 61-75 (1976).
- Soulier, N., Laremore, T. N., Bryant, D. A. Characterization of cyanobacterial allophycocyanins absorbing far-red light. Photosynthesis Research. 145 (3), 189-207 (2020).
- Guglielmi, G., Cohen-Bazire, G., Bryant, D. A. The structure of Gloeobacter violaceus and its phycobilisomes. Archives of Microbiology. 129 (3), 181-189 (1981).
- Zhang, J., et al. Structure of phycobilisome from the red alga Griffithsia pacifica. Nature. 551 (7678), 57-63 (2017).
- Li, Y., et al. Characterization of red-shifted phycobilisomes isolated from the chlorophyll f-containing cyanobacterium Halomicronema hongdechloris. Biochimica et Biophysica Acta. 1857 (1), 107-114 (2016).
- Herrera-Salgado, P., Leyva-Castillo, L. E., Rios-Castro, E., Gomez-Lojero, C. Complementary chromatic and far-red photoacclimations in Synechococcus ATCC 29403 (PCC 7335). I: The phycobilisomes, a proteomic approach. Photosynthesis Research. 138 (1), 39-56 (2018).
- Yamanaka, G., Glazer, A. N., Williams, R. C. Cyanobacterial phycobilisomes. Characterization of the phycobilisomes of Synechococcus sp. 6301. Journal of Biological Chemistry. 253 (22), 8303-8310 (1978).
- Gantt, E., Lipschultz, C. A., Grabowski, J., Zimmerman, B. K. Phycobilisomes from blue-green and red algae: Isolation criteria and dissociation characteristics. Plant Physiology. 63 (4), 615-620 (1979).
- Patel, A., Mishra, S., Pawar, R., Ghosh, P. K. Purification and characterization of C-Phycocyanin from cyanobacterial species of marine and freshwater habitat. Protein Expression and Purification. 40 (2), 248-255 (2005).
- Zolla, L., Bianchetti, M. High-performance liquid chromatography coupled on-line with electrospray ionization mass spectrometry for the simultaneous separation and identification of the Synechocystis PCC 6803 phycobilisome proteins. Journal of Chromatography A. 912 (2), 269-279 (2001).
- Soni, B., Kalavadia, B., Trivedi, U., Madamwar, D. Extraction, purification and characterization of phycocyanin from Oscillatoria quadripunctulata-Isolated from the rocky shores of Bet-Dwarka, Gujarat, India. Process Biochemistry. 41 (9), 2017-2023 (2006).
- Williams, J. G. K. . Methods in Enzymology. , 766-778 (1988).
- Brown Igor, I., et al. Polyphasic characterization of a thermotolerant siderophilic filamentous cyanobacterium that produces intracellular iron deposits. Applied and Environmental Microbiology. 76 (19), 6664-6672 (2010).
- Wang, L., et al. Isolation, purification and properties of an R-phycocyanin from the phycobilisomes of a marine red macroalga Polysiphonia urceolata. PLoS One. 9 (2), 87833 (2014).
- Berkelman, T. R., Lagarias, J. C. Visualization of bilin-linked peptides and proteins in polyacrylamide gels. Analytical Biochemistry. 156 (1), 194-201 (1986).
- Rigbi, M., Rosinski, J., Siegelman, H. W., Sutherland, J. C. Cyanobacterial phycobilisomes: Selective dissociation monitored by fluorescence and circular dichroism. Proceedings of the National Academy of Sciences. 77 (4), 1961-1965 (1980).
- Dubbs, J. M., Bryant, D. A. Molecular cloning and transcriptional analysis of the cpeBA operon of the cyanobacterium Pseudanabaena species PCC 7409. Molecular Microbiology. 5 (12), 3073-3085 (1991).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Zhang, S., Shen, G., Li, Z., Golbeck, J. H., Bryant, D. A. Vipp1 is essential for the biogenesis of Photosystem I but not thylakoid membranes in Synechococcus sp. PCC 7002. Journal Biological Chemistry. 289 (23), 15904-15914 (2014).
- Zhang, S., Bryant, D. A. Biochemical validation of the glyoxylate cycle in the cyanobacterium Chlorogloeopsis fritschii Strain PCC 9212. Journal Biological Chemistry. 290 (22), 14019-14030 (2015).
- Huang, J. Y., et al. Mutations of cytochrome b559 and Psbj on and near the QC site in photosystem II influence the regulation of short-term light response and photosynthetic growth of the cyanobacterium Synechocystis sp. PCC 6803. Biochemistry. 55 (15), 2214-2226 (2016).
- Li, Y., Lin, Y., Loughlin, P., Chen, M. Optimization and effects of different culture conditions on growth of Halomicronema hongdechloris - A filamentous cyanobacterium containing chlorophyll f. Frontiers in Plant Science. 5, 67 (2014).
- Bennett, A., Bogorad, L. Complementary chromatic adaptation in a filamentous blue-green alga. Journal of Cell Biology. 58 (2), 419-435 (1973).
- Su, X., Fraenkel, P. G., Bogorad, L. Excitation energy transfer from phycocyanin to chlorophyll in an apcA-defective mutant of Synechocystis sp. PCC 6803. Journal of Biological Chemistry. 267 (32), 22944-22950 (1992).
- Arteni, A. A., Ajlani, G., Boekema, E. J. Structural organisation of phycobilisomes from Synechocystis sp. strain PCC6803 and their interaction with the membrane. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1787 (4), 272-279 (2009).
- Kondo, K., Ochiai, Y., Katayama, M., Ikeuchi, M. The Membrane-associated CpcG2-phycobilisome in Synechocystis: A new photosystem I antenna. Plant Physiology. 144 (2), 1200-1210 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved