Method Article
Isolement et caractérisation du phycobilisome intact chez les cyanobactéries
Dans cet article
Résumé
Le protocole actuel détaille l’isolement des phycobilisomes des cyanobactéries par centrifugation à travers un gradient de densité de saccharose discontinu. Les fractions de phycobilisomes intacts sont confirmées par le spectre d’émission fluorescent 77K et l’analyse SDS-PAGE. Les fractions phycobilisomes résultantes conviennent à la coloration négative de la TEM et à l’analyse par spectrométrie de masse.
Résumé
Chez les cyanobactéries, le phycobilisome est un complexe protéique d’antenne vital qui récolte la lumière et transfère de l’énergie aux photosystèmes I et II pour la photochimie. L’étude de la structure et de la composition du phycobilisome est d’un grand intérêt pour les scientifiques car elle révèle l’évolution et la divergence de la photosynthèse chez les cyanobactéries. Ce protocole fournit une méthode détaillée et optimisée pour casser efficacement les cellules cyanobactériennes par un batteur de perles. Le phycobilisome intact peut ensuite être isolé de l’extrait cellulaire par ultracentrifugation par gradient de saccharose. Cette méthode s’est avérée adaptée aux cyanobactéries modèles et non modèles avec différents types de cellules. Une procédure étape par étape est également fournie pour confirmer l’intégrité et la propriété des phycobiliprotéines par spectroscopie de fluorescence 77K et SDS-PAGE coloré par sulfate de zinc et bleu de Coomassie. Le phycobilisome isolé peut également être soumis à d’autres analyses structurelles et compositionnelles. Dans l’ensemble, ce protocole fournit un guide de départ utile qui permet aux chercheurs qui ne connaissent pas les cyanobactéries d’isoler et de caractériser rapidement les phycobilisomes intacts.
Introduction
Le phycobilisome (PBS) est un énorme complexe pigment-protéine soluble dans l’eau qui se fixe au côté cytoplasmique des photosystèmes dans les membranes thylakoïdes des cyanobactéries1. Le PBS est principalement composé de phycobiliprotéines colorées et de protéines linker incolores1,2. Les phycobiliprotéines peuvent être divisées en quatre grands groupes : la phycoérythrine, la phycoérythricyanine, la phycocyanine et l’allophycocyanine3. Les quatre grands groupes absorbent différentes longueurs d’onde d’énergie lumineuse dans la gamme de 490 à 650 nm, que les chlorophylles absorbent de manière inefficace3. Le PBS peut servir d’antenne de collecte de lumière pour collecter l’énergie lumineuse et la fournir aux photosystèmes II et I4.
La structure et la composition du PBS varient d’une espèce à l’autre. Collectivement, trois formes de phycobilisomes (hémidiscodiales, en forme de faisceau et en forme de bâtonnet) ont été identifiées chez différentes espèces de cyanobactéries5. Même chez la même espèce, la composition du PBS change en fonction de l’environnement, comme la qualité de la lumière et l’épuisement des nutriments6,7,8,9,10,11. Par conséquent, la procédure expérimentale visant à isoler le PBS des cyanobactéries a joué un rôle déterminant dans l’étude du PBS12. Pendant plusieurs décennies, de nombreux protocoles différents ont isolé le PBS et analysé sa structure, sa composition et sa fonction6,7,8,12,13,14,15,16,17. La grande variété de méthodes d’isolement pbs offre en effet une flexibilité dans l’isolation du complexe chez différentes espèces avec différents réactifs et instruments. Cependant, cela rend également le choix d’un protocole approprié plus difficile pour les scientifiques peu familiers avec les cyanobactéries et le PBS. Par conséquent, un protocole généralisé et simple est développé dans ce travail pour ceux qui s’intéressent à commencer l’isolement PBS des cyanobactéries.
Les méthodes d’isolement du PBS des publications précédentes sont résumées ici. Étant donné que le PBS est un complexe protéique soluble dans l’eau et qu’il est facilement dissocié, un tampon phosphate à haute résistance ionique est nécessaire pour stabiliser le PBS pendant l’extraction18. Plusieurs articles de recherche décrivant des méthodes d’isolement du PBS à partir de cyanobactéries ont été publiés dans le passé. La plupart des méthodes nécessitent une forte concentration de tampon phosphate8,14,15,18,19. Cependant, les procédures de perturbation mécanique des cellules varient, telles que l’extraction assistée par billes de verre, la sonication20 et la presse Français 6,8,14. Différentes phycobiliprotéines peuvent être obtenues par précipitation avec du sulfate d’ammonium20 et purifiées par CLHP21 ou une colonne chromatographique22. D’autre part, le PBS intact peut être facilement isolé par ultracentrifugation par gradient de densité de saccharose6,8,15.
Dans ce protocole, une cyanobactérie modèle et une cyanobactérie non modèle ont été utilisées comme matériaux pour l’isolation PBS. Il s’agit de Synechocystis sp. PCC 6803 (ci-après Syn6803) et de Leptolyngbya sp. JSC-1 filamenteux non modèle, tolérant au glucose, et de Leptolyngbya sp. JSC-1 (ci-après JSC-1), respectivement7,23,24. Le protocole commence par la perturbation des cyanobactéries unicellulaires et filamenteuses dans un tampon phosphate à haute résistance ionique. Après lyse, les surnageants sont collectés par centrifugation puis traités avec un détergent non ionique (Triton X-100) pour solubiliser les protéines hydrosolubles des membranes thylakoïdes. Les protéines totales solubles dans l’eau sont appliquées sur un gradient de densité de saccharose discontinu pour fractionner le PBS. Le gradient de saccharose discontinu dans ce protocole se compose de quatre solutions de saccharose et divise le PBS intact dans les fractions les plus faibles de la couche de saccharose25. L’intégrité du PBS peut être analysée par SDS-PAGE, coloration au zinc et spectroscopie de fluorescence 77K6,7,8,26. Cette méthode convient aux scientifiques qui visent à isoler le PBS intact des cyanobactéries et à étudier ses propriétés spectrales, structurelles et compositionnelles.
Il y a plusieurs avantages de ce protocole. (1) Cette méthode est normalisée et peut être utilisée pour isoler le PBS intact des cyanobactéries unicellulaires et filamenteuses. La plupart des articles décrivent la méthode qui s’appliquait à l’un ou l’autre type de cyanobactéries4,7,8,12,13,14,16,18. (2) Cette méthode est réalisée à température ambiante, car le PBS se dissocie à basse température19,27. (3) Cette méthode décrit l’utilisation d’un batteur de perles pour perturber les cellules; par conséquent, il est moins cher et plus sûr que la presse à Français à haute pression et les dommages auditifs possibles du sonicator dans d’autres méthodes8,13,14,20. (4) Cette méthode isole le PBS intact par ultracentrifugation par gradient de saccharose. De cette façon, le PBS intact avec différentes tailles et le PBS partiellement dissocié peuvent être séparés en fonction de la concentration en saccharose.
Protocole
La Synechocystis sp. PCC 6803, la souche modèle tolérante au glucose, a été obtenue auprès du Dr Chu, Hsiu-An à l’Academia Sinica, Taiwan. Leptolyngbya sp. JSC-1, le filamenteux non modèle, a été obtenu auprès du Dr Donald A. Bryant à la Pennsylvania State University, aux États-Unis.
1. Culture cellulaire et récolte
- Inoculez des cellules Syn6803 ou JSC-1 à l’aide d’une boucle d’inoculation métallique dans une fiole conique de 100 mL contenant 50 mL de milieu B-HEPES28. Cultiver les cellules à 30 °C sous 50 μmol photons m-2 s-1 (LED à lumière blanche) dans 1% (v/v) de CO2 sous agitation constante par un agitateur magnétique (120 tr/min) jusqu’à ce que la culture atteigne une phase de croissance moyenne exponentielle (OD750 = 0,6-0,8).
REMARQUE: Récoltez la culture cellulaire lorsque la densité optique de la culture à 750 nm (OD750) atteint 0,6-0,8 en transférant dans une nouvelle fiole. La densité optique a été couramment utilisée pour estimer la densité des cellules microbiennes dans les cultures liquides29. Les longueurs d’onde de 720 à 750 nm ont été utilisées dans diverses études pour mesurer la croissance des cyanobactéries30,31,32. Dans ce protocole, OD750 est utilisé parce que JSC-1 peut produire des pigments qui absorbent la lumière rouge lointaine7. Alternativement, la concentration de chlorophylle a également été utilisée pour mesurer la croissance des cyanobactéries33. - Transférer la culture cellulaire (OD750 ~ 0,8) dans une fiole conique de 1 L et la diluer dans OD750 = 0,2 dans 500 mL de milieu B-HEPES. Cultiver la culture jusqu’à la phase de croissance exponentielle tardive (OD750 = 0,8-1,0) dans le même état mentionné ci-dessus (étape 1.1) puis récolter la culture par centrifugation.
- Centrifuger la culture à 10 000 x g pendant 20 min à température ambiante et éliminer complètement le surnageant.
REMARQUE: Les granulés de cellules peuvent être conservés à -80 ° C jusqu’à 6 mois.
2. Lyse des cellules
- Suspendez les granulés de la cellule et lavez deux fois avec un tampon K-phosphate de 0,75 M, pH 7.
REMARQUE: Pour faire un tampon de K-phosphate de 0,75 M à pH 7, préparer 1,5 M de K2HPO4 et 1,5 M de KH2PO4 séparément. Mélanger 615 mL de 1,5 M K2HPO4 et 385 ml de 1,5 M KH2PO4 pour obtenir un tampon K-phosphate de 1,5 M à pH 7. Il suffit de le diluer avec la même quantité de ddH2O pour obtenir un tampon K-phosphate de 0,75 M à pH 7. - Pelleter les cellules dans des tubes centrifuges de 50 mL par centrifugation à 10 000 x g pendant 20 min à température ambiante. Jeter le surnageant et remettre en suspension les cellules avec un tampon K-phosphate de 0,75 M. Mesurer le poids humide de la pastille à l’aide d’une balance électronique et remettre en suspension 1 g de poids humide de la pastille dans 5 mL du tampon.
REMARQUE: Le poids humide d’une pastille a été mesuré en soustrayant le poids d’un tube de centrifugeuse vide du poids du tube de centrifugeuse contenant la pastille de cellule. - Ajouter 1 mL de suspension cellulaire et 0,4 à 0,6 g de billes de verre de 0,1 mm (voir tableau des matériaux) dans un flacon à bouchon à vis de 2 mL.
- Casser les cellules pendant 30 s à l’aide d’un batteur de perles (voir Tableau des matériaux). Laissez les tubes refroidir dans un bain-marie à température ambiante pendant 2 min et répétez le cycle de rupture 5 fois.
- Après lyse, centrifuger les flacons à 500 x g pendant 10 s à température ambiante. Recueillir le surnageant à l’aide d’une pipette dans un tube de centrifugeuse de 15 mL. Lavez les billes avec 0,5 mL de tampon K-phosphate de 0,75 M une fois, puis transférez-les dans le même tube de centrifugeuse.
- Ajouter Triton X-100 (2 % p/v, concentration finale) à la suspension à cellules lysées et incuber sur un agitateur à bascule (40 tr/min) à température ambiante jusqu’à ce que la solution devienne homogène (~20 min).
- Centrifuger les tubes à 17 210 g pendant 20 min pour éliminer les cellules intactes et les gros débris cellulaires. Conservez le surnageant sans la couche supérieure de triton micelle à température ambiante jusqu’à 1 h.
REMARQUE : Le surnageant contient deux couches séparées. La couche hydrophobe supérieure de Triton X contient des protéines de liaison à la chlorophylle et des phycobilisomes hydrophobes en forme de bâtonnet6. La couche aqueuse inférieure contient du PBS soluble dans l’eau.
3. Préparation des tampons de gradient de saccharose et isolation PBS
- Faire quatre concentrations de saccharose (2,0 M, 1,0 M, 0,75 M et 0,5 M) dans un tampon K-phosphate de 0,75 M à pH 7.
REMARQUE: Il est suggéré d’utiliser un tampon K-phosphate de 1,5 M à pH 7 pour préparer le gradient de saccharose, car l’ajout de saccharose dilue la concentration de tampon K-phosphate. Une fois le saccharose complètement dissous, ajouter du ddH2O pour ajuster la concentration à 0,75 M, pH 7. - Placer 2,8 mL de tampon de saccharose de 2,0 M au fond du tube de centrifugeuse de 40 mL et superposer avec trois couches de solutions de saccharose (8 mL de 1,0 M; 12 mL de 0,75 M et 11 mL de 0,5 M pour tube centrifuge de 40 mL), et enfin PBS contenant la fraction surnageante (3,0 mL) (Figure 1A).
REMARQUE: Ajoutez soigneusement la solution de saccharose et laissez le saccharose tomber très lentement à l’intérieur du tube. Tenez l’embout de la pipette juste au-dessus de la surface de la solution dans le tube pendant le chargement de la solution. Les couches de saccharose peuvent être observées lorsqu’elles sont stratifiées lentement. - Centrifuger les gradients résultants à 125 800 x g pendant ~16h-20 h à 25 °C.NOTE: Une ultracentrifugeuse (voir tableau des matériaux) est nécessaire pour cette étape.
- Lors de l’ultra-centrifugation, condenser le PBS fractionné et les phycobiliprotéines entre les couches. Des bandes bleues dans Syn6803 (bandes violettes montrées dans JSC-1) ont été observées dans les interfaces (Figure 1D).
- Collectez lentement les fractions avec une pipette à partir du haut des gradients de saccharose. Éliminer le saccharose en concentrant à plusieurs reprises (3 500 x g pendant 20 min) et en diluant les fractions avec un tampon K-phosphate de 0,75 M dans des unités de filtration centrifuge à membrane (seuil de poids moléculaire de 10 K, voir tableau des matériaux).
4. Mesure de la fluorescence PBS à 77K
REMARQUE: Un fluorimètre équipé d’un récipient d’azote liquide (voir tableau des matériaux) est utilisé pour mesurer les spectres de fluorescence à 77K.
- Diluer l’échantillon concentré de PBS avec un tampon K-phosphate de 0,75 M pour obtenir au moins 500 μL.
REMARQUE : Les concentrations de phycocyanine des échantillons étaient d’environ 4,2 μg mL-1 selon la formule suivante : (OD615 0,474 x OD652)/5,34 [mg/mL]34. - Ajouter 500 μL de l’échantillon de PBS dans un tube en verre transparent et congeler le tube dans de l’azote liquide jusqu’à ce qu’il soit complètement congelé. Déplacez le tube congelé dans un récipient Dewar transparent (voir tableau des matériaux) prérempli d’azote liquide.
REMARQUE: Le diamètre intérieur du tube de verre est de 3 mm dans ce protocole. Des tubes de verre minces ont été utilisés pour minimiser la réabsorption de l’émission de courte longueur d’onde dans l’échantillon. - Choisissez les longueurs d’onde d’excitation de la phycoérythrine et de la phycocyanine à 550 nm et 580 nm, respectivement.
REMARQUE: Les émissions de fluorescence ont été enregistrées de 560 à 800 nm (pour une excitation de 550 nm) ou de 600 à 800 nm (pour une excitation de 580 nm).
5. Analyse SDS-PAGE du PBS
- Échange tampon des échantillons concentrés de PBS dans 0,75 M de K-phosphate avec 50 mM de tampon Tris (pH 8,0) dans des unités de filtration centrifuge à membrane (seuil de poids moléculaire 3K, voir Tableau des matériaux).
- Mélanger 50 μL de solution de PBS avec 10 μL de tampon de chargement SDS 6x [300 mM Tris pH 6,8, 12 % (p/v) de dodécylsulfate de sodium, 0,06 % (p/v) de bleu de bromphénol, 50 % (v/v) de glycérol, 6 % (v/v) β-mercaptoéthanol] (voir tableau des matériaux) dans un tube de microcentrifuge et incuber à 95 °C pendant 10 min dans un bloc thermique.
- Séparez les échantillons de protéines par SDS-PAGE (gel de polyacrylamide à 8% à 20% (p / v)) et continuez avec la coloration au zinc et à Coomassie. La procédure détaillée a été décrite dans la référence 8.
- Pour la coloration au zinc, incuber le gel dans une solution de ZnSO4 de 50 mM pendant 10 min à température ambiante, laver le gel avec de l’eau distillée et visualiser la fluorescence induite par le zinc sous irradiation UV (312 nm).
- Pour la coloration bleu Coomassie, incuber le gel dans un tampon de coloration Coomassie Blue [0,25 % (p/v) de Coomassie R-250, 10 % (v/v) d’acide acétique, 50 % (v/v) de méthanol, voir tableau des matières] pendant 1 h à température ambiante. Laver le gel avec de l’eau distillée deux fois pour éliminer le tampon de coloration résiduel et incuber le gel avec un tampon de déscoloration [10% (v / v) d’acide acétique, 30% (v / v) de méthanol] sur un agitateur à bascule (40 tr / min) à température ambiante pendant la nuit. Visualisez le gel entièrement coloré avec un appareil photo numérique ou un scanner.
Résultats
Les cellules Syn6803 et JSC-1 ont été cultivées dans des flacons coniques avec agitation constante en milieu B-HEPES à 30 °C, sous une lumière blanche LED (photons m-2s-1 de 50 μmol) dans une chambre de croissance remplie de 1% (v/v) de CO2. À la phase de croissance exponentielle (OD750 = ~0,5), les cellules ont été sous-cultivées en milieu frais avec une densité optique finale OD750 = ~0,2. Après avoir atteint la phase de croissance exponentielle tardive (OD750 = 0,6-0,8), les cultures ont été collectées et centrifugées (10 000 x g à température ambiante pendant 20 min). Le surnageant a été jeté et les granulés de cellules ont été stockés à -80 °C jusqu’à ce que l’étape suivante soit disponible.
Pour briser les cellules, les cellules ont d’abord été décongelées à température ambiante. Les cellules ont été perturbées par le battement de billes avec des billes de verre de 0,1 mm dans le tampon K-phosphate de 0,75 M. La lyse cellulaire complète montre le surnageant de couleur bleu-vert foncé avant centrifugation (Figure 1B). Après solubilisation par Triton X-100 et centrifugation pour éliminer les membranes insolubles et les débris cellulaires, le surnageant a été chargé sur le dessus de la solution de gradient de saccharose dans un tube de centrifugeuse de 40 mL (Figure 1C). Après 18 heures de centrifugation, le PBS intact s’est déplacé vers le centre du dégradé en tant que bande bleue claire pour Syn6803 et bande violette pour JSC-1. La différence de couleur résulte des différentes compositions de PBS dans Syn6803 et JSC-1. Le PBS de Syn6803 contient de la phycocyanine35, tandis que le PBS de JSC-1 contient de la phycocyanine et de la phycoérythrine7. Le résultat de la séparation du gradient de densité de saccharose du PBS isolé montre plusieurs fractions de phycobiliprotéines dissociées, et la fraction la plus faible représente le PBS intact (Figure 1D).
Les spectres d’absorption des différentes fractions de PBS isolées à partir de JSC-1 et Syn6803 sont comparés à la figure 2A. La procédure détaillée des spectres d’absorption a été décrite dans les articles7,8. Les spectres d’absorption du PBS dissocié et du PBS intact de JSC-1 et Syn6803 ont le même pic à 622 nm, correspondant à la phycocyanine. Et le pic d’absorption de la phycoérythrine à 571 nm se trouve à la fois dans le PBS dissocié et le PBS intact de JSC-1. L’allophycocyanine montre un pic mineur avec une épaule à 670 nm dans les fractions PBS intactes de JSC-1 et Syn6803. Les différences spectrales indiquent que le rapport bâtonnet (phycocyanine) /noyau (allophycocyanine) est plus élevé dans le PBS dissocié que dans la fraction PBS intacte, car les propriétés spectrales des phycobiliprotéines ont été déterminées précédemment5. Étant donné que le PBS dissocié et les fractions PBS intactes présentent des spectres d’absorption et des caractéristiques d’émission fluorescente similaires à température ambiante, la spectroscopie de fluorescence 77K a ensuite été utilisée pour analyser les différentes fractions isolées du gradient de saccharose. Les spectres d’émission fluorescente 77K du PBS dissocié et des fractions PBS intactes ont été excités de 580 nm. Les spectres d’émission du PBS dissocié ont un pic fort à ~650 nm dans Syn6803 et JSC-1, représentant l’émission de phycocyanine (Figure 2B). Les spectres d’émission fluorescente du PBS intact montrent deux pics maximaux d’émission fluorescente : le faible à 651 nm et le fort à 684 nm, révélant que l’énergie récoltée par la phycocyanine a été transférée efficacement à l’allophycocyanine et aux émetteurs terminaux (ApcD et ApcE) dans le noyau9 (Figure 2C). Ces caractéristiques démontrent que les fractions les plus faibles du gradient de saccharose contiennent du PBS intact.
Le PBS dissocié et le PBS intact ont été séparés par SDS-PAGE sur un gel à gradient linéaire de polyacrylamide SDS de 8 % à 20 % (p/v). Les α et β sous-unités de phycocyanine et d’allophycocyanine étaient visibles sur le gel sans coloration (figure 3A). Le gel a ensuite été coloré avec 10 mM de ZnSO4 pendant 10 min. Les phycobiliprotéines contenant des chromophores ont été observées par la coloration au zinc lors de l’irradiation UV8. Les sous-unités de phycobiliprotéines (14-21 kDa) sont fortement fluorescentes, et l’ApcE (flèche) a montré une faible fluorescence (Figure 3B). De plus, la coloration bleu de Coomassie montre la composition protéique différente entre les fractions PBS dissociées et les fractions PBS intactes (Figure 3C). Les fractions supérieures contiennent d’autres protéines hydrosolubles non PBS car plus de protéines sont colorées que dans les fractions PBS intactes. Le PBS intact dans Syn6803 montre une bande ApcE proéminente (flèche) dépourvue des fractions PBS dissociées (Figure 3C).
Le rapport volumique entre l’extrait de PBS et le gradient de saccharose est essentiel pour obtenir des bandes nettes dans le gradient de saccharose après ultracentrifugation. Le rapport suggéré entre les extraits de PBS solubilisés et la solution de gradient de saccharose est de 1:10. Sur la base de l’expérience antérieure, la réalisation du gradient de saccharose dans des tubes centrifuges de 40 mL montre une résolution plus élevée que le gradient de saccharose réalisé dans les tubes de 13 mL. Le gradient de saccharose discontinu se diffuse au fil du temps en raison des vibrations sur le banc. Par conséquent, le tube de centrifugeuse de 13 mL peut être un bon choix pour manipuler de nombreux échantillons simultanément. Pour démontrer cela, les gradients de saccharose dans des tubes centrifuges de 13 mL aux rapports 1:3 et 1:10 ont été préparés entre les extraits bruts de Syn6803 ou JSC-1 et la solution de gradient de saccharose (figure 4A). Après ultracentrifugation, le gradient de saccharose préparé au rapport 1:3 affiche des bandes plus larges que le gradient réalisé au rapport 1:10 (Figure 4B). Les fractions les plus basses de chaque gradient contiennent du PBS intact, confirmé par spectroscopie d’émission fluorescente 77K.

Figure 1 : Perturbation des cellules Syn6803 et JSC-1 et ultracentrifugation du gradient de saccharose. (A) Illustration schématique de la préparation du gradient de saccharose abandonné dans un tube de centrifugeuse de 40 mL. (B) Les flacons à bouchon vissé ont été remplis de 0,4 g de billes de verre et de 1 mL de suspension cellulaire de Syn6803 ou de JSC-1, puis les cellules ont été lysées par un batteur de billes. (C) Le surnageant de l’extrait solubilisé triton X-100 a été superposé au sommet d’un gradient de densité de saccharose. (D) Après centrifugation pendant 18 h, les fractions PBS ont été visualisées sous forme de bandes bleues claires dans le gradient dans Syn6803 et de bandes violettes dans JSC-1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
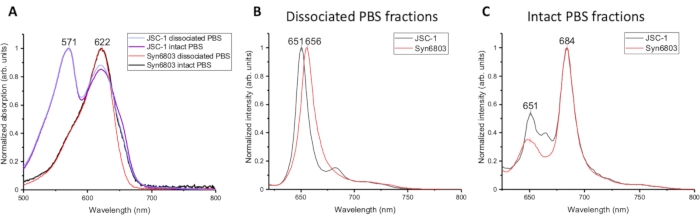
Figure 2 : Caractérisation spectroscopique de différentes fractions de gradients de saccharose. (A) Spectres d’absorption des fractions PBS dissociées et PBS intactes de JSC-1 et Syn6803. Les spectres d’émission de fluorescence ont été mesurés à 77 K en utilisant la longueur d’onde d’excitation à 580 nm pour (B) les fractions PBS dissociées et (C) les fractions PBS intactes de Syn6803 et JSC-1. Veuillez cliquer ici pour voir une version agrandie de cette figure.
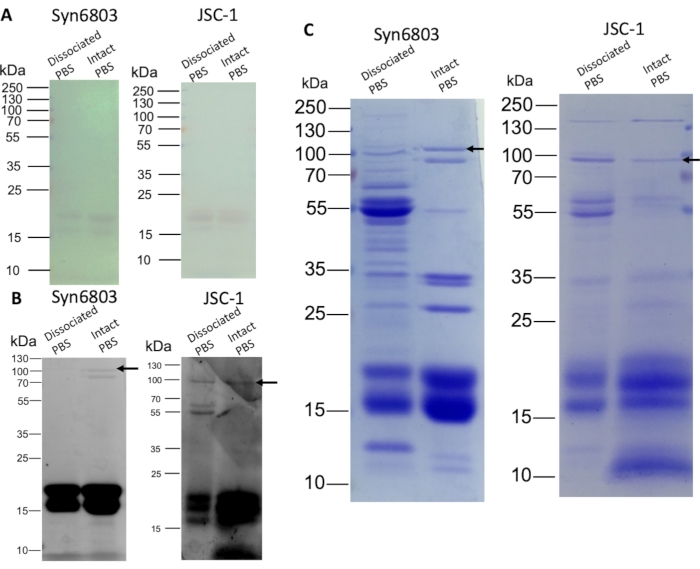
Figure 3 : Analyse SDS-PAGE du PBS isolé à partir de gradients de saccharose. Les fractions PBS dissociées et intactes ont été quantifiées (20 μg de protéines par voie) et chargées sur un gel de polyacrylamide à gradient de 8 % à 20 % (p/v). Après l’électrophorèse sur gel, le gel a été visualisé par coloration au zinc et coloration au bleu de Coomassie, par la suite. (A) La couleur des phycobiliprotéines est visible sur le gel sans coloration. (B) Le gel teinté de zinc montre la fluorescence des phycobiliprotéines. (C) Le gel coloré avec Coomassie Blue montre des phycobiliprotéines et d’autres protéines. Les flèches indiquent les positions de l’ApcE. Veuillez cliquer ici pour voir une version agrandie de cette figure.
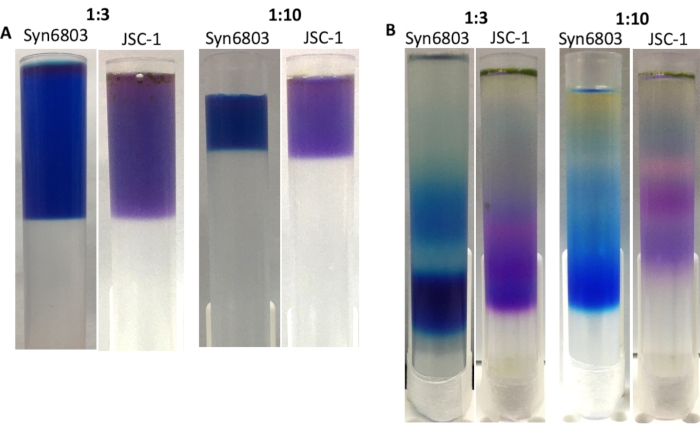
Figure 4 : Gradient de saccharose réalisé dans des tubes centrifuges de 13 mL. Les rapports entre l’extrait brut et la solution de gradient de saccharose sont marqués en haut des images. (A) Le surnageant des extraits solubilisés de Triton X-100 de Syn6803 et JSC-1 a été superposé sur des gradients de densité de saccharose avec des rapports différents entre les extraits solubilisés et la solution de gradient de saccharose. (B) Après centrifugation pendant 18 h, les fractions PBS dans Syn6803 et JSC-1 ont été observées dans les gradients de saccharose. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Ce protocole décrit une méthode simple et standard pour isoler le PBS intact dans deux types de cyanobactéries, le modèle unicellulaire Syn6803 et le non-modèle filamenteux JSC-1. Les étapes critiques du protocole sont l’homogénéisation cellulaire et l’ultracentrifugation sur un gradient de densité discontinu de saccharose. Généralement, la perturbation des cellules filamenteuses est plus compliquée que les cellules unicellulaires. L’augmentation de la quantité de matière première (le poids humide de la pastille cellulaire) et la répétition des battements de billes ont été utiles pour augmenter le rendement en PBS des cellules cyanobactériennes filamenteuses. Pour la cyanobactérie filamenteuse, JSC-1, trois fois plus de cellules ont été utilisées que pour la cyanobactérie unicellulaire, Syn6803. De plus, pour briser complètement la cyanobactérie filamenteuse, il faut battre les perles plus de fois que les cyanobactéries unicellulaires pour observer la couleur bleu-violet foncé dans le tampon d’extraction.
Il n’est pas suggéré de dépasser 30 s pour la durée du battement des billes, car les échantillons sont chauffés pendant chaque cycle de battement des perles. Il est recommandé de refroidir les tubes à température ambiante sur un banc (ou au bain-marie) entre chaque cycle, car le PBS intact est facilement dissocié à basse température25. Par conséquent, il est suggéré d’effectuer toutes les procédures de ce protocole à température ambiante. De nombreux articles de recherche ont décrit différentes méthodes de perturbation cellulaire, y compris un homogénéisateur à haute pression (Français-Press) ou un sonicator6,8,20. Un homogénéisateur de broyeur à billes est suggéré parce qu’il est moins cher, plus sûr, plus facile à manipuler, plus rapide, plus accessible et plus efficace dans le traitement de plusieurs échantillons simultanément.
Les phycobilisomes présentent trois formes différentes, hémidiscoïdales, en forme de faisceau et en forme de tige5. Les phycobilisomes intacts isolés dans la figure 2 appartiennent à la forme hémidiscoïdale telle que discutée dans les publications précédentes7,13,36. La fraction supérieure qui représente le PBS dissocié, cependant, peut également contenir du PBS en forme de tige. Syn6803 et JSC-1 codent un linker rod-core spécifique CpcL, ce qui suggère la présence de PBS en forme de tige en plus du PBS hémidiscoïdal PBS6,37. Le PBS en forme de tige a été directement identifié dans Syn6803 mais pas dans JSC-17,13,37. D’autre part, JSC-1 remodèle son PBS en effectuant une acclimatation chromatique de type III en lumière verte/rouge et une photoacclimation en lumière rouge/rouge lointain6,7. Toutes ces diversités indiquent qu’il peut y avoir d’autres types de PBS dans les gradients de saccharose, en plus de la fraction pbS hémidiscoïdale intacte la plus basse. Par exemple, deux types de PBS sont présents en même temps lorsque Synechococcus sp. PCC 7335 et JSC-1 s’acclimatent à la lumière rouge lointaine8,13. Il est suggéré que la personne qui isole le PBS d’une souche cyanobactérienne non caractérisée devrait être plus prudente dans l’analyse de chaque fraction du gradient de saccharose afin d’identifier tout type possible de PBS.
Dans l’ensemble, ce protocole fournit une méthode peu coûteuse, simple et rapide pour la perturbation cellulaire. Il a également été démontré que cette méthode est fiable pour isoler le PBS de différentes cyanobactéries avec différents types de cellules et compositions de PBS.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt concurrent.
Remerciements
Les auteurs remercient Technology Commons, College of Life Science, National Taiwan University pour l’utilisation pratique de l’ultracentrifugeuse. Les souches cyanobactériennes Synechocystis sp. PCC 6803 et Leptolyngbya sp. JSC-1 ont été offertes par le Dr Chu, Hsiu-An à l’Academia Sinica, Taiwan, et le Dr Donald A. Bryant à la Pennsylvania State University, USA, respectivement. Ce travail a été financé par le ministère de la Science et de la Technologie (Taïwan) (109-2636-B-002-013- et 110-2628-B-002-065-) et le ministère de l’Éducation (Taïwan) Yushan Young Scholar Program (109V1102 et 110V1102).
matériels
| Name | Company | Catalog Number | Comments |
| 0.1 mm glass beads | BioSpec | 11079101 | for PBS extraction |
| 13 mL centrifugation tube | Hitachi | 13PA | ultracentrifugation |
| 40 mL centrifugation tube | Hitachi | 40PA | ultracentrifugation |
| Acetic acid | Merck | 8.1875.2500 | for Coomassie Blue staining |
| B-HEPES medium | A modified cyanobacterial medium from BG-11 medium | ||
| Brilliant Blue R-250 | Sigma | B-0149 | for Coomassie Blue staining |
| Bromophenol blue | Wako pure chemical industries | 2-291 | protein loading buffer |
| Electronic balance | Radwag | WLC 2/A2/C/2 | for the wet weight measurement of cell pellets |
| Fluorescence spectrophotometer | Hitachi | F-7000 | Spectrophotometer |
| Glycerol | BioShop | Gly001.500 | protein loading buffer |
| High-Speed refrigerated centrifuge | Hitachi | CR22N | for buffer exchange |
| Leptolyngbya sp. JSC-1 | from Dr. Donald A. Bryant at Pennsylvania State University, USA. | ||
| Low temperature measurement accessory | Hitachi | 5J0-0112 | The accessory includes a transparent Dewar container for 77K fluorescence spectra |
| Methanol | Merck | 1.07018,2511 | for Coomassie Blue staining |
| Microcentrifuge | Thermo Fisher | Pico 21 | for PBS extraction |
| Mini-Beadbeater-16 | BioSpec | Model 607 | for PBS extraction |
| Potassium phosphate dibasic | PanReac AppliChem | 121512.121 | for PBS extraction |
| Potassium phosphate monobasic | PanReac AppliChem | 141509.121 | for PBS extraction |
| Screw cap vial | BioSpec | 10832 | for PBS extraction |
| SmartView Pro Imager | Major Science | UVCI-2300 | for Znic staining signal detection |
| Sodium dodecyl sulfate | Zymeset | BSD101 | protein loading buffer |
| Sucrose | Zymeset | BSU101 | for PBS isolation |
| Synechocystis sp. PCC 6803 | glucose-tolerant strain from Dr. Chu, Hsiu-An at Academia Sinica, Taiwan | ||
| Tris | BioShop | TRS 011.1 | protein loading buffer |
| Triton X-100 | BioShop | TRX 506.500 | for PBS extraction |
| Ultra 10 K membrane centrifugal filter | Millipore | UFC901024 | for buffer exchange |
| Ultra 3 K membrane centrifugal filter | Millipore | UFC500324 | for buffer exchange |
| Ultracentrifuge | Hitachi | CP80WX | ultracentrifugation |
| UV/Vis spectrophotometer | Agilent | Cary 60 | Spectrophotometer |
| Zinc sulfate | PanReac AppliChem | 131787.121 | for Znic staining |
| β-Mercaptoethanol | BioBasic | MB0338 | protein loading buffer |
Références
- Bryant, D. A., Guglielmi, G., de Marsac, N. T., Castets, A. M., Cohen-Bazire, G. The structure of cyanobacterial phycobilisomes: A model. Archives of Microbiology. 123 (2), 113-127 (1979).
- Glazer, A. N. Phycobilisomes: Structure and dynamics. Annual Review of Microbiology. 36, 173-198 (1982).
- Glazer, A. N. Light harvesting by phycobilisomes. Annual Review of Biophysics and Biophysical Chemistry. 14 (1), 47-77 (1985).
- Liu, H., et al. Phycobilisomes supply excitations to both photosystems in a megacomplex in cyanobacteria. Science. 342 (6162), 1104 (2013).
- Bryant, D. A., Canniffe, D. P. How nature designs light-harvesting antenna systems: Design principles and functional realization in chlorophototrophic prokaryotes. Journal of Physics B: Atomic, Molecular and Optical Physics. 51 (3), 033001 (2018).
- Hirose, Y., et al. Diverse chromatic acclimation processes regulating phycoerythrocyanin and rod-shaped phycobilisome in cyanobacteria. Molecular Plant. 12 (5), 715-725 (2019).
- Gan, F., et al. Extensive remodeling of a cyanobacterial photosynthetic apparatus in far-red light. Science. 345 (6202), 1312-1317 (2014).
- Ho, M. Y., Gan, F., Shen, G., Bryant, D. A. Far-red light photoacclimation (FaRLiP) in Synechococcus sp. PCC 7335. II. Characterization of phycobiliproteins produced during acclimation to far-red light. Photosynthesis Research. 131 (2), 187-202 (2017).
- Ho, M. Y., et al. Extensive remodeling of the photosynthetic apparatus alters energy transfer among photosynthetic complexes when cyanobacteria acclimate to far-red light. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1861 (4), 148064 (2020).
- Sanfilippo, J. E., Garczarek, L., Partensky, F., Kehoe, D. M. Chromatic Acclimation in Cyanobacteria: A diverse and widespread process for optimizing photosynthesis. Annual Review of Microbiology. 73, 407-433 (2019).
- Grossman, A. R., Schaefer, M. R., Chiang, G. G., Collier, J. L. The phycobilisome, a light-harvesting complex responsive to environmental conditions. Microbiological Reviews. 57 (3), 725-749 (1993).
- Bryant, D. A., Glazer, A. N., Eiserling, F. A. Characterization and structural properties of the major biliproteins of Anabaena sp. Archives of Microbiology. 110 (1), 61-75 (1976).
- Soulier, N., Laremore, T. N., Bryant, D. A. Characterization of cyanobacterial allophycocyanins absorbing far-red light. Photosynthesis Research. 145 (3), 189-207 (2020).
- Guglielmi, G., Cohen-Bazire, G., Bryant, D. A. The structure of Gloeobacter violaceus and its phycobilisomes. Archives of Microbiology. 129 (3), 181-189 (1981).
- Zhang, J., et al. Structure of phycobilisome from the red alga Griffithsia pacifica. Nature. 551 (7678), 57-63 (2017).
- Li, Y., et al. Characterization of red-shifted phycobilisomes isolated from the chlorophyll f-containing cyanobacterium Halomicronema hongdechloris. Biochimica et Biophysica Acta. 1857 (1), 107-114 (2016).
- Herrera-Salgado, P., Leyva-Castillo, L. E., Rios-Castro, E., Gomez-Lojero, C. Complementary chromatic and far-red photoacclimations in Synechococcus ATCC 29403 (PCC 7335). I: The phycobilisomes, a proteomic approach. Photosynthesis Research. 138 (1), 39-56 (2018).
- Yamanaka, G., Glazer, A. N., Williams, R. C. Cyanobacterial phycobilisomes. Characterization of the phycobilisomes of Synechococcus sp. 6301. Journal of Biological Chemistry. 253 (22), 8303-8310 (1978).
- Gantt, E., Lipschultz, C. A., Grabowski, J., Zimmerman, B. K. Phycobilisomes from blue-green and red algae: Isolation criteria and dissociation characteristics. Plant Physiology. 63 (4), 615-620 (1979).
- Patel, A., Mishra, S., Pawar, R., Ghosh, P. K. Purification and characterization of C-Phycocyanin from cyanobacterial species of marine and freshwater habitat. Protein Expression and Purification. 40 (2), 248-255 (2005).
- Zolla, L., Bianchetti, M. High-performance liquid chromatography coupled on-line with electrospray ionization mass spectrometry for the simultaneous separation and identification of the Synechocystis PCC 6803 phycobilisome proteins. Journal of Chromatography A. 912 (2), 269-279 (2001).
- Soni, B., Kalavadia, B., Trivedi, U., Madamwar, D. Extraction, purification and characterization of phycocyanin from Oscillatoria quadripunctulata-Isolated from the rocky shores of Bet-Dwarka, Gujarat, India. Process Biochemistry. 41 (9), 2017-2023 (2006).
- Williams, J. G. K. . Methods in Enzymology. , 766-778 (1988).
- Brown Igor, I., et al. Polyphasic characterization of a thermotolerant siderophilic filamentous cyanobacterium that produces intracellular iron deposits. Applied and Environmental Microbiology. 76 (19), 6664-6672 (2010).
- Wang, L., et al. Isolation, purification and properties of an R-phycocyanin from the phycobilisomes of a marine red macroalga Polysiphonia urceolata. PLoS One. 9 (2), 87833 (2014).
- Berkelman, T. R., Lagarias, J. C. Visualization of bilin-linked peptides and proteins in polyacrylamide gels. Analytical Biochemistry. 156 (1), 194-201 (1986).
- Rigbi, M., Rosinski, J., Siegelman, H. W., Sutherland, J. C. Cyanobacterial phycobilisomes: Selective dissociation monitored by fluorescence and circular dichroism. Proceedings of the National Academy of Sciences. 77 (4), 1961-1965 (1980).
- Dubbs, J. M., Bryant, D. A. Molecular cloning and transcriptional analysis of the cpeBA operon of the cyanobacterium Pseudanabaena species PCC 7409. Molecular Microbiology. 5 (12), 3073-3085 (1991).
- Stevenson, K., McVey, A. F., Clark, I. B. N., Swain, P. S., Pilizota, T. General calibration of microbial growth in microplate readers. Scientific Reports. 6 (1), 38828 (2016).
- Zhang, S., Shen, G., Li, Z., Golbeck, J. H., Bryant, D. A. Vipp1 is essential for the biogenesis of Photosystem I but not thylakoid membranes in Synechococcus sp. PCC 7002. Journal Biological Chemistry. 289 (23), 15904-15914 (2014).
- Zhang, S., Bryant, D. A. Biochemical validation of the glyoxylate cycle in the cyanobacterium Chlorogloeopsis fritschii Strain PCC 9212. Journal Biological Chemistry. 290 (22), 14019-14030 (2015).
- Huang, J. Y., et al. Mutations of cytochrome b559 and Psbj on and near the QC site in photosystem II influence the regulation of short-term light response and photosynthetic growth of the cyanobacterium Synechocystis sp. PCC 6803. Biochemistry. 55 (15), 2214-2226 (2016).
- Li, Y., Lin, Y., Loughlin, P., Chen, M. Optimization and effects of different culture conditions on growth of Halomicronema hongdechloris - A filamentous cyanobacterium containing chlorophyll f. Frontiers in Plant Science. 5, 67 (2014).
- Bennett, A., Bogorad, L. Complementary chromatic adaptation in a filamentous blue-green alga. Journal of Cell Biology. 58 (2), 419-435 (1973).
- Su, X., Fraenkel, P. G., Bogorad, L. Excitation energy transfer from phycocyanin to chlorophyll in an apcA-defective mutant of Synechocystis sp. PCC 6803. Journal of Biological Chemistry. 267 (32), 22944-22950 (1992).
- Arteni, A. A., Ajlani, G., Boekema, E. J. Structural organisation of phycobilisomes from Synechocystis sp. strain PCC6803 and their interaction with the membrane. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1787 (4), 272-279 (2009).
- Kondo, K., Ochiai, Y., Katayama, M., Ikeuchi, M. The Membrane-associated CpcG2-phycobilisome in Synechocystis: A new photosystem I antenna. Plant Physiology. 144 (2), 1200-1210 (2007).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon