Method Article
Kardiyak İskemi / Reperfüzyonu In Vitro Taklit Etmek için Bir Hücre Ko-Kültür Modelinin Geliştirilmesi
Bu Makalede
Özet
Uzamsal mesafe, ayrı endotel ve kardiyomiyosit hücre katmanlarının bir ko-kültür modelinde hipoksi / reoksijenasyon hasarının değerlendirilmesinde anahtar bir parametredir, bu da ilk kez, kardiyomiyosit korumasında endotel hücrelerinin rolünü test etmek için uygun bir in vitro model sağlamak için ko-kültür uzamsal ortamının optimize edilmesinin gerekli olduğunu düşündürmektedir.
Özet
İskemik kalp hastalığı dünya çapında önde gelen ölüm ve sakatlık nedenidir. Reperfüzyon iskeminin ötesinde ek yaralanmalara neden olur. Endotel hücreleri (ECs), kardiyomiyositleri (CM'ler) hücre-hücre etkileşimleri yoluyla reperfüzyon hasarından koruyabilir. Ko-kültürler, hücre-hücre etkileşimlerinin rolünü araştırmaya yardımcı olabilir. Karışık bir ko-kültür en basit yaklaşımdır, ancak izole tedaviler ve tek hücre tiplerinin aşağı akış analizleri mümkün olmadığından sınırlıdır. ECs'nin CM hücre hasarını doza bağımlı olarak zayıflatıp zayıflatamayacağını ve bu korumanın iki hücre hattı arasındaki temas mesafesini değiştirerek daha da optimize edilip edilemeyeceğini araştırmak için, hücreler arası katman mesafelerinde 0.5'te değişen üç tip hücre kültürü ekini test etmek için Fare Primer Koroner Arter Endotel Hücreleri ve Yetişkin Fare Kardiyomiyositlerini kullandık. Sırasıyla 1,0 ve 2,0 mm. Sadece CM'lerde, laktat dehidrogenaz (LDH) salınımı ile değerlendirilen hücresel hasar, hipoksi sırasında ve mesafe 0.5 ve 1.0 mm'ye kıyasla 2.0 mm olduğunda reoksijenasyon sonrasında önemli ölçüde artmıştır. ECS ve CM'ler neredeyse doğrudan temas halinde olduğunda (0.5 mm), hipoksi sonrası CM'lerin reoksijenasyon hasarında sadece hafif bir zayıflama vardı. 2.0 mm mesafe ile ECs, hem hipoksi hem de hipoksi / reoksijenasyon sırasında CM yaralanmasını zayıflattı, bu da EC'lerin CM'lerle çapraz konuşması için yeterli kültür mesafesinin gerekli olduğunu gösterdi, böylece salgılanan sinyal molekülleri dolaşabilir ve koruyucu yolları tamamen uyarabilir. Bulgularımız, ilk kez, EC / CM ortak kültür mekansal ortamının optimize edilmesinin, EC'lerin simüle iskemi / reperfüzyon hasarına karşı CM korumasındaki rolünü test etmek için uygun bir in vitro model sağlamak için gerekli olduğunu göstermektedir. Bu raporun amacı, araştırmacıların bu önemli modeli kendi avantajlarına kullanmaları için adım adım bir yaklaşım sağlamaktır.
Giriş
İskemik kalp hastalığı dünya çapında önde gelen ölüm ve sakatlık nedenidir 1,2. Bununla birlikte, reperfüzyonun tedavi sürecinin kendisi, miyokard iskemisi / reperfüzyon (IR) hasarı olarak bilinen kardiyomiyosit ölümüne neden olabilir, bunun için hala etkili bir ilaç yoktur3. Endotel hücrelerinin (ECs), kardiyomiyositleri (CM'ler) parakrin sinyallerin salgılanması ve hücreden hücreye etkileşimler yoluyla koruduğu öne sürülmüştür4.
Hücre ko-kültürü modelleri, otokrin ve / veya parakrin hücre-hücre etkileşimlerinin hücre fonksiyonu ve farklılaşması üzerindeki rolünü araştırmak için yaygın olarak kullanılmıştır. Ko-kültür modelleri arasında, karışık ko-kültür, iki farklı hücre tipinin, istenen hücre oranında tek bir kültür bölmesinde doğrudan temas halinde olduğu en basitolanıdır 5. Bununla birlikte, hücre tipleri arasındaki ayrı tedaviler ve tek bir hücre tipinin aşağı akış analizi, karışık popülasyon göz önüne alındığında kolayca mümkün değildir.
Önceki çalışmalar, hipoksik ve iskemik hakaretlerin, laktat dehidrogenaz (LDH) salınımı ile ölçülen hücre zarının bütünlüğünde önemli hasara neden olduğunu göstermiştir. Bu yaralanma reoksijenasyon üzerine kötüleşirve reperfüzyon hasarı 6,7,8'i taklit eder. Mevcut protokolün amacı, EC'lerin varlığının, hipoksi ve reoksijenasyonun (HR) neden olduğu CM'lerin hücre zarı sızıntısını doza bağımlı olarak azaltabileceği ve EC'lerin koruyucu etkisinin iki hücre hattı arasındaki temas mesafesinin değiştirilmesiyle optimize edilebileceği hipotezlerini test etmekti. Bu nedenle, üç tip hücre kültürü inserti ve Fare Primer Koroner Arter Endotel Hücreleri ve Yetişkin Fare Kardiyomiyositleri kullandık. Corning, Merck Millipore ve Greiner Bio-One markalı kesici uçlar, sırasıyla 0,5, 1,0 ve 2,0 mm'lik hücreler arası hat mesafelerine sahip üç farklı hücre kültürü çapraz konuşma koşulu oluşturmamızı sağladı. Her durumda kesici uç başına 100.000 ECs kaplandı.
Ek olarak, ko-kültürdeki EC'lerin yoğunluğunun bu modelde İK hasarının zayıflamasına katkıda bulunup bulunmadığını belirlemek için, CM'ler tarafından EC konsantrasyonu ve LDH salınımı arasındaki doz-yanıt ilişkisini inceledik. ECs, 2.0 mm'lik kesici uçta kesici uç başına sırasıyla 25.000, 50.000 ve 100.000 olarak kaplandı.
Bu rapor, araştırmacıların bu önemli modeli kendi avantajlarına kullanmaları için adım adım bir yaklaşım sunmaktadır.
Protokol
1. Deneysel hazırlama/kaplama
- CM'leri ve EC'leri üreticinin talimatlarına göre koruyun.
- Satıcılardan geldiklerinde her iki hücre hattını da çözün. Taze maddelerle yıkandıktan sonra T25 şişelerde plaka. Her hücre kültürü ortamının, hücrelerin satın alındığı aynı satıcılardan satın alınması önerilir. Ertesi gün, hücreleri medya ile yenileyin ve birleştiğinde kullanın.
- Hücre kültürü inkübatörünü %21 O2, %5 CO2, %74N2 ile 37 °C'de tutun ve nemlendirilmiş halde tutun.
NOT: Bu protokolde kullanılan Fare Primer Koroner Arter Endotel Hücreleri, C57BL/6 farelerin koroner arterlerinden izole edilir ve Yetişkin Fare Kardiyomiyositleri yetişkin C57BL/6J fare kalplerinden izole edilir ve ticari olarak elde edilir (bkz.
- Steril koşullar altında plaka CM'leri 24 delikli plakaların dibine (alt tabaka) yerleştirin. 24 saat sonra, plaka EC'leri ko-kültür kuyusunun ekine (veya üst kısmına) sokar. EC kaplamadan 24 saat sonra, EC uçlarını CM plaka tabanlarına yerleştirerek ko-kültür periyoduna başlayın. Kullanmadan önce hücrelerin en az 12-24 saat boyunca birlikte kültürlenmesine izin verin. Bu adımlar aşağıda ayrıntılı olarak açıklanmıştır.
- Bir ışık mikroskobu altında CM hücre hattı akıcılığını tahmin edin. Kültür şişelerinde hücreler% 90 -% 100 oranında akıtılmış gibi göründüğünde, deneysel kaplamaya devam edin.
- Ortamları birleşik hücre kültürleri içeren şişelerden çıkarın ve T25 şişeleri için 3-5 mL Tripsin/Etilendiamintetraasetik asit (EDTA) ile tripsinize edin. Şişeyi nazikçe çalkalayın, 2-5 dakika boyunca 37 ° C'de inkübe edin ve ardından enzimatik ilerlemeyi bir ışık mikroskobu altında değerlendirin. Hücreler yuvarlanmaya başladığında, hücreleri yüzeyden ayırmak için bir hücre kazıyıcı kullanın.
- Ayrılmadan sonra, tripsin / hücre çözeltisini T25 şişeleri için 10 mL ortam içeren 50 mL'lik bir tüpe ekleyerek tripsin çözeltisini etkisiz hale getirin. Yumuşak bir hücre peleti elde etmek için hücre süspansiyonunu 120 x g'de 2 dakika boyunca santrifüj yapın. Süpernatantı çıkarın ve peleti 5 mL ortamda yeniden askıya alın.
- Hücre sayımı yapmak ve hücre canlılığını doğrulamak için, 10 μL yeniden askıya alınmış hücre ve 10 μL tripan mavi boyadan oluşan bir aliquot karıştırın. Bir hücre sayacı kullanarak canlı hücreleri sayın. İstenilen tohumlama yoğunluklarını elde etmek için hücreleri taze normal ortamlarla seyreltin. Hacimler, istenen tohum yoğunluğuna ve stok çözeltilerinin hücre konsantrasyonuna bağlı olarak hesaplanır. Tüm kaplamalar steril koşullar altında yapılmalıdır.
- Hücre dışı matris ile önceden kaplanmış 24 delikli bir plakanın dibine kuyu başına 300.000 tohumlama yoğunluğunda plaka CM'leri. Hücrelerigece boyunca% 21 O2 ve% 5 CO2 ile 37 ° C'de tutun.
- 24 saat sonra, plaka uçlara kesici uç başına 100.000 optimum kaplama yoğunluğunda (kültür alanı 33,6mm2'dir) plakalanır (Şekil 1). 24 saatlik EC kaplamasından sonra, EC uçlarını CM kuyucuklarının içine yerleştirin ve ko-kültürü başlatın. Deneyleri yapmadan önce hücrelerin 12-24 saat boyunca birlikte kültürlenmesine izin verin.
- Deneyler gerçekleştirildiğinde, hem CM'lerin hem de EC'lerin %80-%90 akıcılığa ulaştığından emin olun.
2. İskemi / reperfüzyon hasarını simüle etmek için hipoksi / reoksijenasyon In Vitro
NOT: Aşağıdaki adımların açıklandığı gibi gerçekleştirilmesi gerekir, arada duraklamayın.
- Hipoksik ortamı, 50 mL'lik bir konik tüpe ~ 25 mL ortam dökerek hazırlayın. Üstünü silikon bir membranla hava ile kapatın ve bir delik açmak için sterilize edilmiş bir pipet kullanın. Başka bir delik oluşturun, bu sefer pipeti ortama yaklaşık 2/3 batırılmış halde bırakın.
- Ortamı hipoksik gazla (%0,0125 O2, %5 CO 2, %94,99 N2) 5 dakika boyunca 30 L/dak akış hızında yıkayın. Bu, hipoksi başladığında ortamda çözünenO2'yi en aza indirir (adım 2.5).
- Ekli hücreler içeren 24 delikli plakaların veya kültür eklerinin ortamını atın ve 100 μL/kuyucuk dolusu %10 Fosfat Tamponlu Tuzlu Su (PBS) ile çok nazikçe yıkayın. Daha sonra, taze hazırlanmış hipoksik ortamın 500 μL'sini plakaların veya eklerin her bir oluğuna ekleyin.
NOT: Ortamdaki hipoksi, hücreler ve medya için gerçek hipoksi adım 2.5'te başlamadan önce bu adımda mümkün olduğunca kısa bir süre kesintiye uğrar.- Normoksik kontrol grubunda, orijinal ortamı glikoz ve serum içeren taze normal ortamlarla değiştirin.
- Hipoksi odasını, odanın içine steril suyla dolu bir Petri kabı yerleştirerek nemlendirin. Daha sonra, hipoksik grupları içeren plakaları odaya yerleştirin.
- Hipoksi odacığını hipoksik gazla (%0.0125 O 2, %5 CO 2, %94.99 N2) 5 dakika boyunca 30 L/dk'lık bir akışla yıkayın. Odayı 24 saat boyunca 37 °C inkübatöre yerleştirin.
- Hipoksiden sonra, normal koşullar altında CM'leri ve EC'leri yetiştirin. Bunu yapmak için, plakaların/kesici uçların eski ortamını atın, normal ortamla değiştirin (glikoz ve serum içeren; her kuyucuk / ekin 500 μL'si) ve reperfüzyonu taklit etmek için 2 saat boyunca normal kültür koşulları altında (%21 O 2,% 5 CO2,% 74 N2, 37 ° C) inkübatörde saklayın.
- Ortam değişiminin herhangi bir etkisini kontrol etmek için, hipoksik ortam değiştirilirken aynı zamanda normoksik hücrelerin ortamını değiştirin.
NOT: Şekil 2 , bu protokole şematik bir genel bakış sağlar.
3. Uç nokta değerlendirmesi
- Hücre kültürü ortamını 24 delikli plakadan 96 delikli bir plakaya aktarın. 24 delikli plakanın her bir kuyucuğundan 200 μL ortam kullanın ve buna göre 96 delikli plakanın dört kuyucuğuna eşit olarak dağıtın. Normoksiye karşı hipoksiye karşı HR için her biri bir plaka kullanın.
- Hücresel yaralanma derecesini, örneğin, üreticinin talimatlarını izleyerek bir sitotoksisite tahlil kiti kullanarak LDH için absorbansı ölçerek belirleyin. Tahlil protokolünde belirtildiği gibi tahlili 96 kuyucuklu bir plakada gerçekleştirin.
4. İstatistik
- Parametrik verileri ortalama/standart sapma olarak ve parametrik olmayan verileri medyan/çeyrekler arası aralıklı kutu grafikleri olarak görüntüleyin. Tip-1 hata olasılığını azaltmak için kabul edilebilir post-hoc testlerle yeterli parametrik ve parametrik olmayan çoklu karşılaştırma testleri yapılmalıdır. Anlamlılık tipik olarak 0,05 alfaya (iki kuyruklu) ayarlanır.
- Mevcut çalışmada yapılan tüm deneyler için, bir deneyde en az üç iyi replikasyon gerçekleştirin. İstatistiksel analiz için kullanılan her deneyin üç ila altı tekrarı vardı.
Sonuçlar
Bu deneyde kullanılan üç kesici uç türü (A, B, C) 0,4 μm'lik aynı gözenek boyutuna sahiptir. Aralarındaki tek fark, iki ortak kültürlü hücre katmanı arasındaki mesafelerin sırasıyla 0,5, 1,0 ve 2,0 mm olmasını sağlayan (Şekil 3) ve farklı satıcılardan (ayrıntılar için bkz.
IR hasarını simüle etmek için HR'ye maruz kalan iki hücre hattının ayrı katmanlarıyla in vitro bir ko-kültür modeli oluşturmak için, ECS ile birlikte kültürlenmiş veya ECs olmadan birlikte kültürlenmiş CM'lerin hücre zarı bütünlüğünü inceledik. CM tabakasının üzerine çeşitli mesafelere yerleştirilebilen EC'ler için ayrı bir kesici uç kullanmak, hücre tabakası mesafesinin CM'lerdeki membran hasarının ciddiyeti üzerindeki diferansiyel etkilerini de değerlendirmemizi sağladı. Ayrı bir deney setinde, EC'lerin yoğunluğunu ve dolayısıyla EC'lerin CM'lere oranını değiştirdik. Ek olarak, simüle edilmiş iskemiyi simüle edilmiş IR hasarından ayırt etmek için, deneyler 1) normoksi, 2) sadece hipoksi ve 3) HR koşulları altında gerçekleştirildi. Bu model için 24 saat hipoksi, ardından 2 saat reoksijenasyon kullandık.
Değişken mesafeler
Hücre katmanları arasında 0,5 mm mesafe (Insert A)
CM'ler tek başına kültürlendiğinde, hipoksi, önceki çalışmalarımızla tutarlı olarak, normoksiye kıyasla önemli ölçüde artmış bir LDH salınımına yol açmıştır (Şekil 4A)6. Bununla birlikte, LDH, sadece hipoksi grubuna kıyasla 2 saatlik reoksijenasyon üzerine sadece hafif bir şekilde artmıştır. ECS ve CM'ler 0.5 mm'lik bir mesafede birlikte kültürlendiğinde, hipoksi ile LDH salınımındaki artış, ECs'nin herhangi bir koruyucu etki göstermediğini gösteren azalmamıştır (yalnızca hipoksi koşulları altında tek başına CM'lerle karşılaştırıldığında). Bununla birlikte, EC'ler İK sırasında CM'ler üzerinde hafif ama önemli bir koruma uygulamıştır.
Hücre katmanları arasında 1,0 mm mesafe (Insert B)
Aynı deney, iki hücre katmanı arasındaki mesafenin 1.0 mm'ye çıkarılması dışında yukarıdaki gibi gerçekleştirildi (Şekil 4B). LDH salınımının CM'lerde de anlamlı derecede arttığını bulduk, sadece hipoksi ile. Bununla birlikte, 0.5 mm'lik kesici uçtan farklı olarak, yalnızca CM'lerdeki LDH artışı, HR tarafından yalnızca hipoksi üzerinde güçlendirilmiştir. Dahası, bu potansiyel, yalnızca CM'ler grubuna kıyasla reoksijenasyon sırasında EC'lerin varlığı ile daha fazla inhibe edildi ve neredeyse ortadan kaldırıldı.
Hücre katmanları arasında 2,0 mm mesafe (Insert C)
İki hücre çizgisi arasında 2.0 mm'lik bir mesafe yaratan ko-kültür ekleri kullanıldığında (Şekil 4C), ayrıca CM'ler tarafından LDH salınımının önemli bir artışını bulduk - sadece hipoksi sırasında, 0.5 mm ve 1.0 mm deneylerinde olduğu gibi. Bununla birlikte, ilginç bir şekilde, reoksijenasyon yoluyla LDH salınımındaki ek artış, 1.0 mm'lik deneylerden daha belirgindi. Bu artışların her ikisi de, ortadan kaldırılmamış olsa da, EC'lerin varlığı ile zayıflatılmıştır, bu da 0.5 veya 1.0 mm'lik kesici uçların kullanılmasından farklı olarak, ECs'nin CM'leri hem hipoksi hem de İK koşulları altında yaralanmalardan önemli ölçüde koruduğunu göstermektedir.
Değişken EC yoğunlukları
Farklı bir deney setinde, 2,0 mm'lik kesici uçlarda kaplanan EC'lerin konsantrasyonu, kesici uç başına sırasıyla 25.000, 50.000 ve 100.000 hücreye titre edildi. LDH salınımı 24 saat hipoksi ve ardından 2 saat reoksijenasyondan sonra ölçüldü. Sonuçlarımız, ko-kültürde artan EC yoğunluğunun, HR'nin neden olduğu LDH salınımının doza bağımlı bir zayıflamasına yol açtığını göstermiştir (Şekil 5); normoksik koşullar altında böyle bir etki görülmedi.
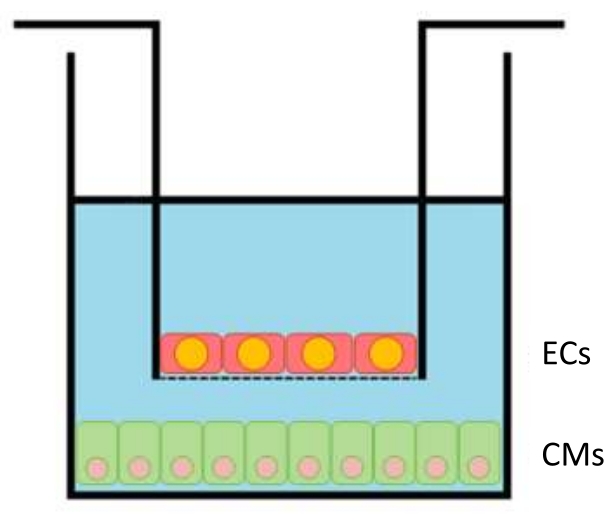
Resim 1: Kuyunun içindeki ekleme şeması. EC'li kesici uçlar (kesici uç başına 100.000 hücreye kadar), altlarında CM'ler (kuyu başına 300.000) bulunan 24 delikli plakalara aktarılır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 2: Deneysel tasarım. Hücreler normal oksijen koşulları altında (% 21O2) kültürlenir ve daha sonra iki gruba ayrılır: normoksik bir kontrol grubu normal koşullar altında 24 saat daha kültürlenmeye devam ederken, hipoksi grubu 24 saat boyunca bir hipoksi odasında sadece% 0.01O2 ile kültürlenecek ve glikoz olmayacaktır. Bu 24 saatlik müdahalelerden sonra, her iki hücre grubu da medya ile yenilenir ve sonunda LDH analizi gibi son nokta testlerini yapmadan önce, 2 saat daha, reoksijenasyon aşaması olan 21% O2 ortamında sürekli olarak kültürlenir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
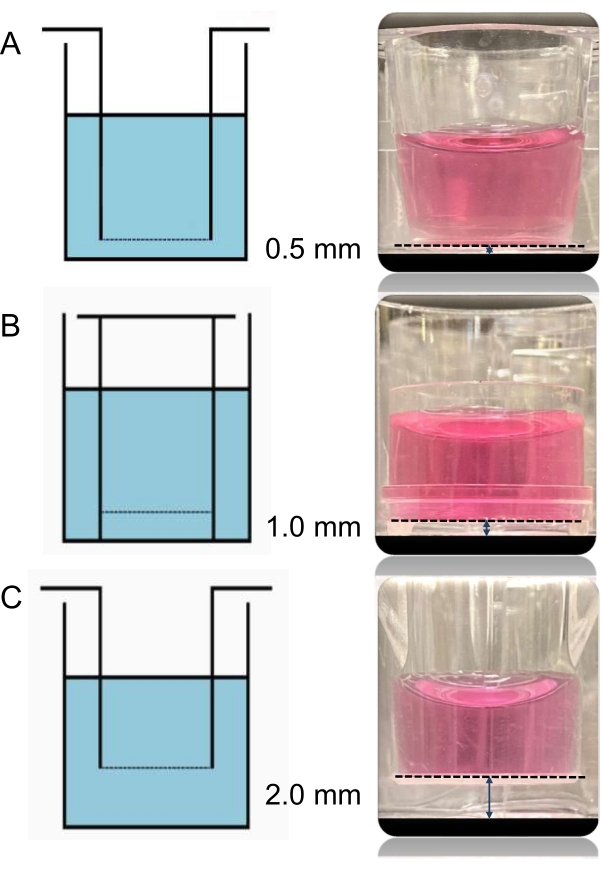
Şekil 3: Üç farklı kesici ucun görüntüleri ve şemaları. Ekteki endotel hücreleri ile kuyunun altındaki kardiyomiyositler arasındaki mesafe, farklı ekler kullanılarak değiştirilebilir. Burada kullanılan üç kesici uç türü de 0,4 μm'lik aynı gözenek boyutuna sahiptir. Aralarındaki tek fark, iki ortak kültürlü hücre katmanı arasındaki mesafelerin sırasıyla 0,5 (A), 1,0 (B) ve 2,0 mm (C) olmasını sağlayan eklemeden tabana yüksekliktir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
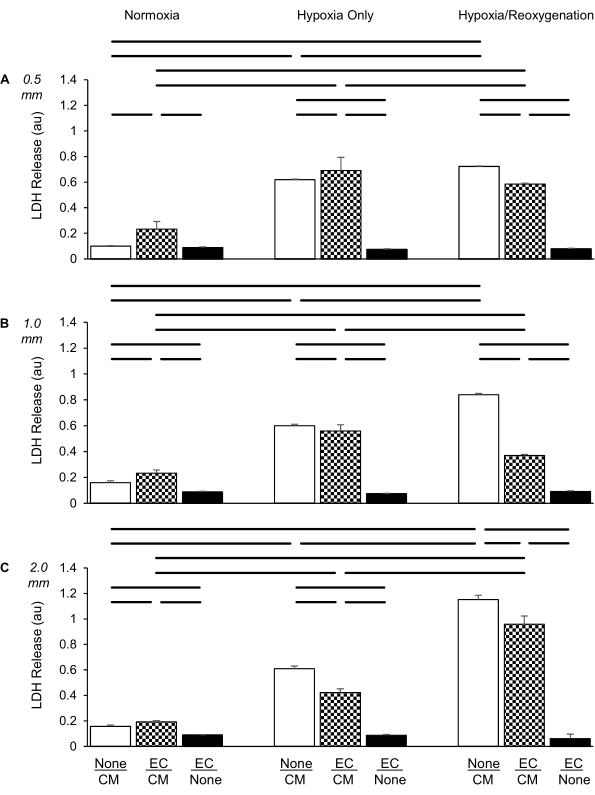
Şekil 4: Laktat dehidrojenazın (LDH; absorbans ünitelerinde [au]) normoksik (solda), sadece hipoksi (ortada) ve hipoksi/reoksijenasyon koşullarının (sağda) tek başına kardiyomiyositler (CM; beyaz), tek başına endotel hücreleri (EC; siyah) ve CM'nin EC ile ko-kültürlerinin (kontrol paterni) altında salınımını değerlendirmede üç tip kültür ekinin karşılaştırılması. (A) 0.5 mm mesafe, (B) 1.0 mm mesafe, (C) İki farklı hücre katmanı arasında 2,0 mm mesafe. EC'ler, ekleme başına 100.000 hücre yoğunluğunda, CM'ler kuyu başına 300.000 hücre yoğunluğunda kaplandı. Veriler standart sapma ± ortalamadır, grup başına n = 4'tür. İstatistikler: ANOVA ve ardından Student-Newman-Keuls post-hoc testi. P< karşılaştırılan her çift arasında yatay çubuklarla gösterilen 0,05 (iki kuyruklu). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
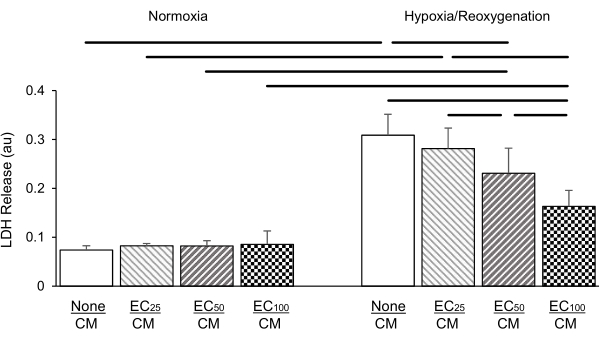
Şekil 5: Laktat dehidrogenaz (LDH; absorbans ünitelerinde [au]) salınımı ile kanıtlandığı üzere, ko-kültürlü endotel hücrelerinin konsantrasyonu (EC; 25: Insert başına 25.000 hücre; 50: Insert başına 50.000 hücre; ekleme başına 100: 100.000 hücre) doza bağlı olarak kardiyomiyositlerin (CM) hipoksi / reoksijenasyon hasarına karşı korunmasını (sağda) normoksik koşullara (solda) kıyasla etkilemiştir. EC'lerin normoksik koşullar altında LDH salınımı üzerinde hiçbir etkisi olmamıştır. Veriler standart sapma ± ortalamadır, grup başına n = 4'tür. İstatistikler: ANOVA ve ardından Student-Newman-Keuls post-hoc testi. P< karşılaştırılan her çift arasında yatay çubuklarla gösterilen 0,05 (iki kuyruklu). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Protokoldeki kritik adımlar
Kardiyoproteksiyonun hücresel mekanizmalarını incelemek için hücre ko-kültürü modelleri kullanılmıştır. Bu nedenle, aralarında anlamlı bir mesafe olan iki ayrı katmanın nasıl oluşturulacağı, uygun bir ortak kültür modelinin geliştirilmesi için çok önemlidir. Simüle edilmiş IR, yani HR, yaralanma çalışmasındaki bir zorluk, sadece iskeminin (hipoksi) kendisinin değil, aynı zamanda reperfüzyonun (reoksijenasyon) hücresel işlev bozukluğunu şiddetlendirmesidir. Bu nedenle, gerçekçi bir modelin, örneğin, tek başına hipoksi yerine hipoksi sonrası reoksijenasyon yoluyla yeterince artmış yaralanma göstererek, ancak yine de hücre koruyucu ilaçlarla veya bizim durumumuzda ECs'nin varlığı gibi stratejilerle yaralanmanın azaltılmasına izin vererek bu özellikleri yansıtması gerekir. İlginç bir şekilde, iki hücre katmanı arasındaki mesafe, uygun bir ortak kültür modelinin geliştirilmesinde önemli bir rol oynamaktadır. EC'ler ve CM'ler arasındaki 1.0 mm'lik ve 2.0 mm'lik bir mesafenin beklenen İK yaralanma tepkisine izin verdiğini, ancak daha da önemlisi, sadece 2.0 mm'nin hem hipoksik hem de İK koşulları altında EC'lerin varlığı ile hücresel yaralanma koruması için tutarlı bir şekilde olumlu bir sonuç verdiğini gösterebildik.
Yöntemin değiştirilmesi ve sorun giderme
Ko-kültür modellerinde hücre-hücre etkileşimleri, farklı ko-kültürlü popülasyonların sayısı, hücre tiplerinin benzerlik derecesi, aralarındaki fiziksel ayrılık derecesi, popülasyon yerel ortamları arasındaki fark, kültürlerin hacmi ve ko-kültürün zamanlama değerlendirmesi gibi çoklu değişkenlerden etkilenir 9,10,11,12 . Bu faktörler arasında dengeler vardır. Bu etkileşimler, protokol ve kurulum tarafından belirlenen ortamdan güçlü bir şekilde etkilenir. Tekrarlanabilir, ölçülebilir ve karşılaştırılabilir deneysel modeller geliştirmek çok önemlidir. Yaklaşımımız, üç farklı hücre kültürü eki hariç, iki ortak kültürlü hücre hattının aynı oranını, hücre kültürü ortamının ve tahlil reaktiflerinin aynı hacimlerini vb. kullanarak, doğru sayıda hücreyi kaplayarak farklı zamanlarda yapılan farklı deneylerden elde edilen verilerin tutarlılığını bozabilecek değişkenlerin sayısını kontrol etmek ve sınırlamaktı.
Yöntemin sınırlamaları
Modelimiz, muhtemelen kardiyovasküler sistemde EC'lerin her yerde bulunmasından dolayı ECs ve CM'lerle iyi çalışır. Potansiyel ilgi alanına sahip diğer hücre hattı tiplerinin CM'ler, nöronlar veya in vitro olarak incelenecek diğer ilgi çekici hücrelerle ne kadar iyi etkileşime girdiği, farklı hücre hatlarının ortak kültür ortamında farklı şekilde etkileşime girebileceği için henüz değerlendirilmemiştir. Birlikte kültürlenmiş hücre popülasyonları arasındaki bir fark, ekolojik ilişkileri olabilir, örneğin doğal rakipler veya işbirlikçiler iseler. Ayrıca, diğer tüm in vitro hücre modellerinde olduğu gibi, deneyde üretilen hücresel hasar, in vivo yaralanmanın gerçek patofizyolojik durumunu temsil etmeyebilir. Ayrıca, EC'ler ile CM'ler arasındaki 0,5, 1,0 ve 2,0 mm'lik test edilmiş mesafelerin aralıklarını in vivo olarak yeniden üretmediğini kabul ediyoruz; verilen in vitro model için; Bununla birlikte, sonuçlarımız, bu teknikten yararlanmak isteyen bilim adamları tarafından incelenecek iki hücre katmanı arasındaki optimal mesafenin etkilerini açıklamaktadır.
Yöntemin mevcut/alternatif yöntemler açısından önemi
Mevcut / alternatif ortak kültür yöntemleri, hücre hatlarının doğrudan karıştırılmasını veya transwell plakalarının13, mikroakışkan platformlar14 veya transwell plakalarının en ucuz ve en kolay mevcut olduğu üç boyutlu iskeleler15 gibi bir ayırma derecesi ile ayrı bir ortam yaratmayı içerir. Doğal sınırlamalara rağmen, ko-kültürler ilaç araştırması için oldukça önemlidir, çünkü daha temsili bir in vivo benzeri doku modeli sağlarlar ve yüksek verimli testlere ve hücre-hücre etkileşimleri üzerindeki ilaç etkilerinin derinlemesine izlenmesine izin verirler16. Modelimiz, iki farklı hücre tipinin eksiksiz ve kontrolsüz bir karışımı yerine, ECs ve CM'ler arasındaki iyi tanımlanmış uzamsal mesafeler kullanılarak doğru bir şekilde kalibre edildi. Dahası, bu model ayrı tedavilere izin verir ve in vivo'dan bahsetmek yerine, karışık bir ortak kültürde elde edilmesi imkansız olan bireysel hücre tiplerini analiz eder. IR hasarı ayrı İK süreçlerini içerdiğinden, bu model iskemi / hipoksi ile reperfüzyon / reoksijenasyon hasarının hücresel mekanizmalarını ayrı ayrı incelemek için çok uygundur. Verilerimiz, simüle edilmiş IR yaralanma çalışmalarında kullanılmak üzere oldukça değerli ve verimli bir hücre ko-kültürü modeli olabileceğini düşündürmektedir. Gözlemlerimiz, EC'lerin bu özel ko-kültür modelinde CM'lerle çapraz konuşması için optimal bir uzamsal mesafenin, bizim durumumuzda 2.0 mm'nin gerekli olduğunu açıkça göstermektedir, böylece EC'ler tarafından potansiyel olarak salgılanan sinyal molekülleri, CM'lerin yalnızca hipoksi ve / veya HR tarafından yaralanmaya karşı yasadışı korunmasına karşı etkili bir şekilde dolaşabilir.
Yöntemlerin belirli araştırma alanlarındaki önemi ve potansiyel uygulamaları
Modelimiz, İK yaralanmasına karşı koruyucu önlemlerin araştırılmasını geliştirmek için fare koroner arter EC'lerini fare CM'leri ile birleştirmenin önemini göstermektedir; Ortak kültürlerin mekansal uzaklığının değişmesinin, EC'lerin İK'nın neden olduğu CM yaralanması üzerindeki koruyucu etkisini etkileyen mekansal koşulları daha iyi anlamanın etkili bir yolunu gösterdiğini; ve EC'lerin yoğunluğunun veya EC-CM oranının, İK yaralanmasına karşı koruma kapsamı ile pozitif olarak ilişkili olduğunu.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma kısmen ABD Gazi İşleri Bakanlığı Biyomedikal Laboratuvar Ar-Ge Servisi (I01 BX003482) ve M.L.R.'ye kurumsal fonlar tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Adult Mouse Cardiomyocytes (CMs) | Celprogen Inc | 11041-14 | Isolated from adult C57BL/6J mouse cardiac tissue |
| Automated Cell Counter Countess II | Invitrogen | A27977 | Cell counting for calculating cell numbers |
| Bio-Safety Cabinet | Nuaire | NU425400 | Cell culture sterile hood |
| Cell Culture Freezing Medium | Cell Biologics Inc | 6916 | Used for cell freezing for long term cell line storage |
| Cell Culture Incubator | Nuaire | Nu-5500 | To provide normal cell living condition (21%O2, 5%CO2, 74%N2, 37°C, humidified) |
| Cell Culture Incubator Gas Tank | A-L Compressed Gases | UN1013 | Gas needed for cell culture incubator |
| Cell Culture Inserts A (0.5 mm) | Corning Inc | 353095 | Used for EC-CM co-culture |
| Cell Culture Inserts B (1.0 mm) | Millicell Millipore | PIHP01250 | Used for EC-CM co-culture |
| Cell Culture Inserts C (2.0 mm) | Greiner Bio-One | 662640 | Used for EC-CM co-culture |
| Centrifuge | Anstel Enterprises Inc | 4235 | For cell culture plating and passaging |
| CMs Cell Culture Flasks T25 | Celprogen Inc | E11041-14 | Used for CMs regular culture, coated by manufacturer |
| CMs Cell Culture Medium Complete | Celprogen Inc | M11041-14S | CMs culture complete medium |
| CMs Cell Culture Medium Complete Phenol free | Celprogen Inc | M11041-14PN | CMs culture medium without phenol red used during LDH measurement |
| CMs Cell Culture Plates 96 well | Celprogen Inc | E11041-14-96well | Used for experiments of LDH measurement, coated by manufacturer |
| CMs Hypoxia Cell Culture Medium | Celprogen Inc | M11041-14GFPN | CMs cell culture under hypoxic condition (glucose- and serum-free) |
| Countess cell counting chamber slides | Invitrogen | C10283 | Counting slides used for cell counter |
| Cyquant LDH Cytotoxicity Kit | Thermo Scientific | C20301 | LDH measurement kit |
| ECs Cell Culture Flasks T25 | Fisher Scientific | FB012935 | Used for ECs regular culture |
| ECs Cell Culture Medium Complete | Cell Biologics Inc | M1168 | ECs culture complete medium |
| ECs Cell Culture Medium Complete Phenol free | Cell Biologics Inc | M1168PF | ECs culture medium without phenol red used during LDH measurement |
| ECs Cell Culture Plates 96 well | Fisher Scientific (Costar) | 3370 | Used for experiments of LDH measurement |
| ECs Culture Gelatin-Based Coating Solution | Cell Biologics Inc | 6950 | Used for coating flasks and plates for ECs |
| ECs Hypoxia Cell Culture Medium | Cell Biologics Inc | GPF1168 | ECs cell culture under hypoxic condition (glucose- and serum-free) |
| Fetal Bovine Serum (FBS) | Fisher Scientific | MT35011CV | FBS-HI USDA-approved for cell culture and maintenance |
| Hypoxia Chamber | StemCell Technologies | 27310 | To create a hypoxic condition with 0.01%O2 environment |
| Hypoxia Chamber Flow Meter | StemCell Technologies | 27311 | To connect with hypoxic gas tank for a consistent gas flow speed |
| Hypoxic Gas Tank (0.01%O2 Cylinder) | A-L Compressed Gases | UN1956 | Used to flush hypoxic medium and chamber (0.01%O2/5%CO2/94.99N2) |
| Microscope | Nikon | TMS | To observe cell condition |
| Mouse Primary Coronary Artery Endothelial Cells (ECs) | Cell Biologics Inc | C57-6093 | Isolated from coronary artery of C57BL/6 mice |
| NUNC 15ML CONICL Tubes | Fisher Scientific | 12565269 | For cell culture process, experiments, solution preparation etc. |
| NUNC 50ML CONICL Tubes | Fisher Scientific | 12565271 | For cell culture process, experiments, solution preparation etc. |
| Phosphate Buffered Saline (PBS) | Sigma-Aldrich | D8662 | Used for cell washing during culture or experiments |
| Plate Reader | BioTek Instrument | 11120533 | Colorimetric or fluorometric plate reading |
| Reaction 96 Well Palte (clear no lid) | Fisher Scientific | 12565226 | Used for LDH measurement plate reading |
| Trypsin/EDTA for CMs | Celprogen Inc | T1509-014 | 1 x sterile filtered and tissue culture tested |
| Trypsin/EDTA for ECs | Cell Biologics Inc | 6914/0619 | 0.25%, cell cuture-tested |
Referanslar
- Hausenloy, D. J., et al. Ischaemic conditioning and targeting reperfusion injury: a 30 year voyage of discovery. Basic Research in Cardiology. 111 (6), 70 (2016).
- Hausenloy, D. J., Yellon, D. M. Myocardial ischemia-reperfusion injury: a neglected therapeutic target. The Journal of Clinical Investigation. 123 (1), 92-100 (2013).
- Gottlieb, R. A. Cell death pathways in acute ischemia/reperfusion injury. Journal of Cardiovascular Pharmacology and Therapeutics. 16 (3-4), 233-238 (2011).
- Colliva, A., Braga, L., Giacca, M., Zacchigna, S. Endothelial cell-cardiomyocyte crosstalk in heart development and disease. The Journal of Physiology. 598 (14), 2923-2939 (2020).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology Journal. 8 (4), 395-396 (2013).
- Salzman, M. M., Bartos, J. A., Yannopoulos, D., Riess, M. L. Poloxamer 188 protects isolated adult mouse cardiomyocytes from reoxygenation injury. Pharmacology Research & Perspectives. 8 (6), 00639 (2020).
- Kalogeris, T., Baines, C. P., Krenz, M., Korthuis, R. J. Cell biology of ischemia/reperfusion injury. International Review of Cell and Molecular Biology. 298, 229-317 (2012).
- Martindale, J. J., Metzger, J. M. Uncoupling of increased cellular oxidative stress and myocardial ischemia reperfusion injury by directed sarcolemma stabilization. Journal of Molecular and Cellular Cardiology. 67, 26-37 (2014).
- vander Meer, A. D., Orlova, V. V., ten Dijke, P., vanden Berg, A., Mummery, C. L. Three-dimensional co-cultures of human endothelial cells and embryonic stem cell-derived pericytes inside a microfluidic device. Lab on a Chip. 13, 3562-3568 (2013).
- Bidarra, S. J., et al. Phenotypic and proliferative modulation of human mesenchymal stem cells via crosstalk with endothelial cells. Stem Cell Research. 7, 186-197 (2011).
- Campbell, J. J., Davidenko, N., Caffarel, M. M., Cameron, R. E., Watson, C. J. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PloS One. 6, 25661 (2011).
- Mehes, E., Mones, E., Nemeth, V., Vicsek, T. Collective motion of cells mediates segregation and pattern formation in co-cultures. PloS One. 7, 31711 (2012).
- Miki, Y., et al. The advantages of co-culture over mono cell culture in simulating in vivo environment. The Journal of Steroid Biochemistry and Molecular Biology. 131 (3-5), 68-75 (2012).
- Moraes, C., Mehta, G., Lesher-Perez, S. C., Takayama, S. Organs-on-a-chip: a focus on compartmentalized microdevices. Annals of Biomedical Engineering. 40 (6), 1211-1227 (2012).
- Campbell, J., Davidenko, N., Caffarel, M., Cameron, R., Watson, C. A multifunctional 3D co-culture system for studies of mammary tissue morphogenesis and stem cell biology. PLoS One. 6, 25661 (2011).
- Wu, M. H., Huang, S. B., Lee, G. B. Microfluidic cell culture systems for drug research. Lab on a Chip. 10, 939-956 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır